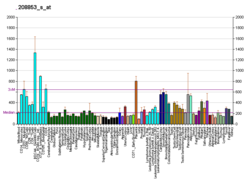
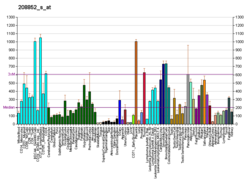
Кальнексин
| Canx | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | Canx , CNX, IP90, P90, CalNexin | |||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Омим : 114217 ; MGI : 88261 ; Гомологен : 1324 ; GeneCards : Canx ; OMA : Canx - ортологи | |||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Викидид | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
Кальнексин ( CNX ) представляет собой 67 кДа интегральный белок (который по -разному появляется в виде полосы 90 кДа, 80 кДа или 75 кДа на вестерн -блоттинге в зависимости от источника антитела) эндоплазматического ретикулума (ER). Он состоит из большого (50 кДа) N -концевого кальция -связывания домена ) . , одной трансмембранной спирали и короткой (90 остатков , кислый цитоплазматический хвост [ 5 ] У людей кальнексин кодируется геном Canx . [ 6 ]
Функция
[ редактировать ]Кальнексин является шапероном , характеризующимся путем оказания помощи складыванию белков и контроля качества, гарантируя, что только правильно сложенные и собранные белки продолжаются вдоль секреторного пути . В частности, он действует, чтобы сохранить развернутые или незамеченные N-связанные гликопротеины в ER. [ 7 ]
Кальнексин связывает только те N - гликопротеины , которые имеют олигосахариды GLCNAC2MAN9GLC1 . [ 8 ] Эти моноглакозилированные олигосахариды являются результатом обрезки двух остатков глюкозы последовательным действием двух глюкозидаз , I и II. Глюкозидаза II также может удалить третий и последний остаток глюкозы. Если гликопротеин не сложен должным образом, фермент, называемый UGGT (для UDP-глюкозы: гликопротеин глюкозилтрансфераза) добавит остаток глюкозы обратно на олигосахарид, тем самым регенерируя способность гликопротеина связывать с кальнексином. [ 9 ] Неправильно развернутая гликопротеиновая цепь, таким образом, ловит в ER и экспрессию EDEM/HTM1P [ 10 ] [ 11 ] [ 12 ] который в конечном итоге представляет собой неэффективный гликопротеин деградации , удаляя один из девяти девять остатков. Мульноза лектин YOS-9 (OS-9 у людей) отмечает и сортирует неправильно свернутые гликопротеины для деградации. YOS-9 распознает остатки маннозы, подвергшиеся воздействию после удаления α-маннозидазы внешней маннозы неправильно свернутых гликопротеинов. [ 13 ]
Кальнексин ассоциируется с ферментом складного белка ERP57 [ 14 ] Чтобы катализировать гликопротеиновое, специфическое образование дисульфидной связи, а также функционирует в качестве шаперона для складывания α-цепи класса I MHC в мембране ER. Поскольку недавно синтезированные цепи MHC класса I α α α входят в эндоплазматический ретикулум, кальнексин связывается с ними, сохраняя их в частично сложенном состоянии. [ 15 ]
После того, как β2-микроглобулин связывается с комплексом пептидного нагрузки класса I MHC (PLC), кальретикулин и ERP57 охватывают работу по шаперонированию белка класса I MHC, в то время как тапасин связывает комплекс с транспортером, связанным с антигеном (TAP). Полем Эта ассоциация готовит MHC класса I для связывания антигена для представления на клеточной поверхности.
Длительная связь кальнексина с неправильно свернутым мутантом PMP22, как известно, вызывает заболевание Charcot-Marie-Tooth [ 16 ] Приводит к секвестрации, деградации и неспособности PMP22 двигать на клеточную поверхность Шванна для миелинизации . После повторных раундов связывания кальнексина мутант PMP22 модифицируется убиквитином для деградации протеасомой , а также гольджи для ER -пути, чтобы вернуть любой неправильно свернутый PMP22, который сбежал от ER к аппарату Гольджи. [ 17 ]
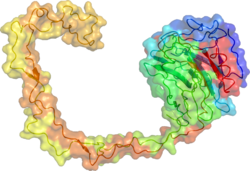
Рентгеновская кристаллическая структура кальнексина выявила глобулярный домен лектина и длинную гидрофобную руку. [ 18 ]
Кофакторы
[ редактировать ]АТФ и ионы кальция являются кофакторами, участвующими в связывании субстрата для кальнексина. [ 19 ]
Ссылки
[ редактировать ]- ^ Подпрыгнуть до: а беременный в ENSG00000127022 GRCH38: Ensembl Release 89: ENSG00000283777, ENSG00000127022 - ENSEMBL , май 2017
- ^ Подпрыгнуть до: а беременный в GRCM38: Ensembl Release 89: ENSMUSG00000020368 - ENSEMBL , май 2017 г.
- ^ «Человеческая PubMed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ «Мышь Pubmed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ Wada I, Rindress D, Cameron PH, Ou WJ, Doherty JJ 2nd, Louvard D, Bell AW, Dignard D, Thomas Dy, Bergeron JJ (1991). «SSR альфа и связанный с ними кальнексин являются основными белками, связывающими кальция мембраны эндоплазматической ретикулумы» . J Biol Chem . 226 (29): 19599–610. doi : 10.1016/s0021-9258 (18) 55036-5 . PMID 1918067 .
- ^ Paskevicius T, Farraj RA, Michaelak M, Agellon LB (2023). Lim D (ред.). «Кальнексин, больше, чем просто молекулярный шаперон » Ячейки 12 (3): 403. doi : 10.3390/ cells12030403 9913998PMC PMID PMID Статья № 403.
- ^ OU WJ, Cameron PH, Thomas Dy, Bergeron JJ (1993). «Ассоциация складных промежуточных соединений гликопротеинов». Природа . 364 (644): 771–6. doi : 10.1038/364771A0 . PMID 8102790 . S2CID 4340769 .
- ^ Хаммонд С., Браакман I, Хелениус А. (1984). «Роль N-связанного олигосахаридного распознавания, обрезки глюкозы и кальнексина в складывании гликопротеинов и контроле качества» . Proc Natl Acad Sci USA . 91 (3): 913–7. doi : 10.1073/pnas.91.3.913 . PMC 521423 . PMID 8302866 .
- ^ Gañán S, Cazzulo JJ, Parodi AJ (1991). «Основная доля N-гликопротеинов временно глюкозилирована в эндоплазматической ретикулуме». Биохимия . 30 (12): 3098–104. doi : 10.1021/bi00226a017 . PMID 1826090 .
- ^ Джейкоб К.А., Бодмер Д., Спириг У, Бэттиг П., Марсиль А., Диньард Д., Бержерон Дж.Дж., Томас Да, Эби М. (2001). «HTM1P, манносидазоподобный белок, участвует в деградации гликопротеина у дрожжей» . Embo Rep . 2 (5): 423–30. doi : 10.1093/embo-reports/kve089 . PMC 1083883 . PMID 11375935 .
- ^ Hosokawa N, Wada I, Haswaga K, Yrihuzi T, Tremblay LO, Herscovics A, Nagata K (2001). «Новая эр-альфа-маннозидазоподобная белковая acceletes, связанная с ER-ассоциированной деградацией » Embo Rep 2 (5): 415–2 Doi : 10.1093/ em-reports/ kve0 1083879PMC PMID 11375934 .
- ^ Ли А.Х., Ивакоши Н.Н., Глимчер Л.Х. (2003). «XBP-1 регулирует подмножество генов шаперона эндоплазматического ретикулума в разворачиваемом белковом ответе» . Мол -клеточная биол . 23 (21): 5448–59. doi : 10.1128/mcb.23.21.7448-7459.2003 . PMC 207643 . PMID 14559994 .
- ^ Quan EM, Kamiya D, Denic V, Weibezahn J, Kato K, Weissman JS (2008). «Определение сигнала разрушения гликана для деградации эндоплазматической ретикулумы» . Моллют . 32 (6): 870–7. doi : 10.1016/j.molcel.2008.11.017 . PMC 2873636 . PMID 19111666 .
- ^ Zapun A, Darby NJ, Tessier DC, Michalak M, Bergeron JJ, Thomas Dy (1998). «Увеличенный катализ рибонуклеазы B складывается путем взаимодействия кальнексина или кальретикулина с ERP57» . J Biol Chem . 273 (211): 6009–12. doi : 10.1074/jbc.273.11.6009 . PMID 9497314 .
- ^ Bergeron JJ, Brenner MB, Thomas Dy, Williams DB (1994). «Кальнексин: мембранный шаперон эндоплазматической ретикулумы». Тенденции Biochem Sci . 19 (3): 124–8. doi : 10.1016/0968-0004 (94) 90205-4 . PMID 8203019 .
- ^ Диксон К.М., Бержерон Дж.Дж., Шамс И., Колби Дж., Нгуен Д.Т., Шевет Е., Томас Да, Снайпс Г.Дж. (2002). «Ассоциация кальнексина с мутантным периферическим миелиновым белком-22 ex vivo: основа для« усиления функции » . Proc Natl Acad Sci USA . 99 (15): 9852–7. Bibcode : 2002pnas ... 99.9852d . doi : 10.1073/pnas.152621799 . PMC 125041 . PMID 12119418 .
- ^ Хара Т., Хашимото Ю., Акузава Т., Хирай Р., Кобаяши Х., Сато К (2014). «RER1 и кальнексин регулируют задержку эндоплазматического ретикулума мутанта периферического белка миелина, который вызывает болезнь чарко-мари-зуба типа 1А» . SCI Rep . 4 : 1–11. Bibcode : 2014natsr ... 4E6992H . doi : 10.1038/srep06992 . PMC 4227013 . PMID 25385046 .
- ^ Schrag JD, Bergeron JJ, Li Y, Borisova S, Hahn M, Thomas Dy, Cygler M (2001). «Структура кальнексина, эр -шаперон, участвующий в контроле качества складывания белка» . Моллют . 8 (3): 633–44. doi : 10.1016/s1097-2765 (01) 00318-5 . PMID 11583625 .
- ^ OU WJ, Bergeron JJ, Li Y, Kang Cy, Thomas Dy (1995). «Конформационные изменения, индуцированные в эндоплазматическом ретикулуме света кальнексина с помощью Mg-ATP и Ca2+» . J Biol Chem . 270 (30): 18051–9. doi : 10.1074/jbc.270.30.18051 . PMID 7629114 .
Внешние ссылки
[ редактировать ]- Кальнексин в Национальной библиотеке медицинской библиотеки США медицинские заголовки (Mesh)
Дальнейшее чтение
[ редактировать ]- Benyair R, Ron E, LederkRemer GZ (2011). Контроль качества белка, удержание и деградация в эндоплазматической ретикулуме . Международный обзор клеточной и молекулярной биологии. Тол. 292. С. 197–280. doi : 10.1016/b978-0-12-386033-0.00005-0 . ISBN 9780123860330 Полем PMID 22078962 .
- Del Bem Le (февраль 2011 г.). «Эволюционная история генов кальрекулина и кальнексина в зеленых растениях». Genetica . 139 (2): 225–9. doi : 10.1007/s10709-010-9544-y . PMID 21222018 . S2CID 9228786 .
- Kleizen B, Braakman I (август 2004 г.). «Складывание белка и контроль качества в эндоплазматической ретикулуме». Современное мнение в клеточной биологии . 16 (4): 343–9. doi : 10.1016/j.ceb.2004.06.012 . HDL : 1874/5106 . PMID 15261665 .
- Расмуссен Х.Х., Ван Дамм Дж., Пуйп М., Гессер Б., Селис Дж., Вандекеркхоув Дж. (Декабрь 1992). «Микроязывания из 145 белков, зарегистрированных в двумерной базе данных гелевых белков нормальных эпидермальных кератиноцитов человека». Электрофорез . 13 (12): 960–9. doi : 10.1002/elps.115013011199 . PMID 1286667 . S2CID 41855774 .
- Galvin K, Krishna S, Ponchel F, Frohlich M, Cummings DE, Carlson R, Wands JR, Esselbacher KJ, Pillai S, Ozturk M (сентябрь 1992). «Основной гистосовместимость комплексного антиген-связывающего белка P88 является продуктом гена кальнексина» . Труды Национальной академии наук Соединенных Штатов Америки . 89 (18): 8452–6. Bibcode : 1992pnas ... 89.8452G . doi : 10.1073/pnas.89.18.8452 . PMC 49938 . PMID 1326756 .
- Пинд С., Риордан младший, Уильямс Д.Б. (апрель 1994 г.). «Участие эндоплазматического ретикулума шаперона кальнексина (p88, IP90) в биогенезе регулятора трансмембранного проводимости муковисцидоза» . Журнал биологической химии . 269 (17): 12784–8. doi : 10.1016/s0021-9258 (18) 99944-8 . PMID 7513695 .
- Honoré B, Rasmussen HH, Celis A, Leffers H, Madsen P, Celis JE (1992). «Молекулярные шапероны HSP28, GRP78, эндоплазмин и кальнексин демонстрируют поразительно разные уровни в покоящихся кератиноцитах по сравнению с их пролиферирующими нормальными и трансформированными аналогами: клонирование кДНК и экспрессия кальнексина». Электрофорез . 15 (3–4): 482–90. doi : 10.1002/elps.1150150166 . PMID 8055875 . S2CID 22393279 .
- Tjoelker LW, Seyfried CE, Eddy RL, Byers MG, показывает TB, Calderon J, Schreiber RB, Grey PW (март 1994 г.). «Клонирование кДНК кальнексина человека, мыши и крысы: идентификация потенциальных мотивов связывания кальция и локализации генов с хромосомой человека 5». Биохимия . 33 (11): 3229–36. doi : 10.1021/bi00177a013 . PMID 8136357 .
- Lenter M, Vestweber D (апрель 1994 г.). «Интегранные цепочки бета 1 и Alpha 6 связываются с кальнексином шаперона перед сборкой интегрина» . Журнал биологической химии . 269 (16): 12263–8. doi : 10.1016/s0021-9258 (17) 32710-2 . PMID 8163531 .
- Раджагопалан С., Сюй Ю., Бреннер М.Б. (январь 1994). «Удержание незаменимых компонентов интегральных мембранных белков кальнексином». Наука . 263 (5145): 387–90. Bibcode : 1994sci ... 263..387r . doi : 10.1126/science.8278814 . PMID 8278814 .
- Дэвид V, Хохстенбах Ф., Раджагопалан С., Бреннер М.Б. (май 1993). «Взаимодействие с вновь синтезированными и удерживаемыми белками в эндоплазматической ретикулуме предполагает функцию шаперона для интегральной мембранной белки человека IP90 (кальнексин)» . Журнал биологической химии . 268 (13): 9585–92. doi : 10.1016/s0021-9258 (18) 98391-2 . PMID 8486646 .
- Белловино Д., Моримото Т., Тоскетти Ф., Гаетани С. (Январь 1996). «Ретинол -связывающий белок и транстиретин секретируются как комплекс, образованный в эндоплазматическом ретикулуме в клетках гепатокарциномы HEPG2» . Экспериментальные исследования клеток . 222 (1): 77–83. doi : 10.1006/excr.1996.0010 . PMID 8549676 .
- Otteken A, Moss B (январь 1996 г.). «Кальрекулин взаимодействует с вновь синтезированным гликопротеином вируса иммунодефицита человека типа 1, что предполагает функцию шаперона, аналогичную функции кальнексина» . Журнал биологической химии . 271 (1): 97–103. doi : 10.1074/jbc.271.1.97 . PMID 8550632 .
- Devergne O, Hummel M, Koeppen H, Le Beau MM, Nathanson EC, Kieff E, Birkenbach M (февраль 1996 г.). «Новый белок, связанный с интерлейкином-12 P40, индуцированный латентной вирусной инфекцией Эпштейна-Барра в B-лимфоцитах» . Журнал вирусологии . 70 (2): 1143–53. doi : 10.1128/JVI.70.2.1143-1153.1996 . PMC 189923 . PMID 8551575 .
- Andersson B, Wendland MA, Ricafrente JY, Liu W, Gibbs RA (апрель 1996 г.). «Метод" двойного адаптера "для улучшения строительства библиотеки ружья». Аналитическая биохимия . 236 (1): 107–13. doi : 10.1006/abio.1996.0138 . PMID 8619474 .
- Van Leeuwen JE, Kearse KP (апрель 1996 г.). «Кальнексин ассоциируется исключительно с отдельными альфа -белками Delta и T -клеточным рецептором антигена (TCR), содержащими не полностью обрезанные гликаны, которые не собираются в комплексы TCR -мультисубунита» . Журнал биологической химии . 271 (16): 9660–5. doi : 10.1074/jbc.271.16.9660 . PMID 8621641 .
- Оливер Д.Д., Хреско Р.К., Муклер М., Хай С (июнь 1996 г.). «Переносчик глюкозы 1 глюкозы взаимодействует с кальнексином и кальретикулином» . Журнал биологической химии . 271 (23): 13691–6. doi : 10.1074/jbc.271.23.13691 . PMID 8662691 .
- Li Y, Bergeron JJ, Luo L, Ou WJ, Thomas Dy, Kang Cy (сентябрь 1996). «Влияние неэффективного расщепления сигнальной последовательности ВИЧ-1 GP 120 на его связь с кальнексином, складыванием и внутриклеточным транспортом» . Труды Национальной академии наук Соединенных Штатов Америки . 93 (18): 9606–11. Bibcode : 1996pnas ... 93,9606L . doi : 10.1073/pnas.93.18.9606 . PMC 38475 . PMID 8790377 .
- Thrombetta ES, Simons JF, Helenius A (ноябрь 1996 г.). «Эндоплазматическая ретикулума глюкозидаза II состоит из каталитической субъединицы, консервативной от дрожжей до млекопитающих, и жестко связанную некаталитическую субъединицу HDEL-содержащей» . Журнал биологической химии . 271 (44): 27509–16. doi : 10.1074/jbc.271.44.27509 . PMID 8910335 .
- Тату У, Хелениус А (февраль 1997 г.). «Взаимодействие между вновь синтезированными гликопротеинами, кальнексином и сетью резидентных шаперонов в эндоплазматической ретикулуме» . Журнал клеточной биологии . 136 (3): 555–65. doi : 10.1083/jcb.136.3.555 . PMC 2134297 . PMID 9024687 .
- Wiest DL, Bhandoola A, Punt J, Kreibich G, McKean D, Singer A (март 1997 г.). «Неполное удержание эндоплазматического ретикулума (ER) в незрелых тимоцитах, что выявлено в результате поверхностной экспрессии молекулярных шаперонов« резидента ER-резидента » . Труды Национальной академии наук Соединенных Штатов Америки . 94 (5): 1884–9. Bibcode : 1997pnas ... 94.1884W . doi : 10.1073/pnas.94.5.1884 . PMC 20012 . PMID 9050874 .
- Yu W, Andersson B, Worley KC, Muzny DM, Ding Y, Liu W, Ricafrente JY, Wendland MA, Lennon G, Gibbs RA (апрель 1997). «Крупномасштабное секвенирование кДНК конкатенации» . Исследование генома . 7 (4): 353–8. doi : 10.1101/gr.7.4.353 . PMC 139146 . PMID 9110174 .