Открытие и разработка нуклеозидных и нуклеотидных ингибиторов обратной транскриптазы.
Открытие и разработка нуклеозидных и нуклеотидных ингибиторов обратной транскриптазы (НИОТ и НИОТ) началось в 1980-х годах, когда СПИДа эпидемия поразила западные общества. НИОТ ингибируют обратную транскриптазу (ОТ), фермент , который контролирует репликацию генетического материала вируса иммунодефицита человека ( ВИЧ ). Первым НИОТ был зидовудин , одобренный Управлением по контролю за продуктами и лекарствами США (FDA) в 1987 году, что стало первым шагом на пути к лечению ВИЧ. За ним последовали шесть агентов НИОТ и один НИОТ. НИОТ и НИОТ являются аналогами эндогенных 2'-дезоксинуклеозида и нуклеотида. , устойчивые к лекарствам, Вирусы являются неизбежным следствием длительного воздействия на ВИЧ-1 препаратов против ВИЧ.
История
[ редактировать ]Летом 1981 года впервые было сообщено о синдроме приобретенного иммунодефицита (СПИД). [ 1 ] Два года спустя была выявлена этиологическая связь со СПИДом — вирусом иммунодефицита человека (ВИЧ). [ 2 ] [ 3 ] С момента выявления ВИЧ разработка эффективных антиретровирусных препаратов и научные достижения в исследованиях ВИЧ были огромными. [ 3 ] [ 4 ] Антиретровирусные препараты для лечения ВИЧ-инфекции относятся к шести категориям: нуклеозидные и нуклеотидные ингибиторы обратной транскриптазы, ненуклеозидные ингибиторы обратной транскриптазы , ингибиторы протеазы , ингибиторы проникновения, ингибиторы корецепторов и ингибиторы интегразы. [ 4 ] Обратная транскриптаза ВИЧ-1 стала основной основой для разработки лекарств против ВИЧ. [ 5 ] Первым нуклеозидным ингибитором обратной транскриптазы, обладающим активностью против ВИЧ in vitro, был зидовудин. [ 6 ] С тех пор как зидовудин был одобрен в 1987 году, FDA одобрило шесть нуклеозидов и один нуклеотидный ингибитор обратной транскриптазы (НИОТ). [ 6 ] К НИОТ, одобренным FDA, относятся зидовудин, диданозин , залцитабин , ставудин , ламивудин , абакавир и эмтрицитабин , а единственным одобренным нуклеотидным ингибитором обратной транскриптазы (NtRTI) является тенофовир (см. таблицу 4). [ 4 ] [ 6 ]
Фермент обратной транскриптазы ВИЧ-1
[ редактировать ]Функция
[ редактировать ]
Большинство стандартных медикаментозных методов лечения ВИЧ основаны на ингибировании фермента обратной транскриптазы (RT), фермента, который необходим вирусу ВИЧ-1 и другим ретровирусам для завершения их жизненного цикла. [ 5 ] Фермент RT выполняет две ключевые функции. Во-первых, он контролирует репликацию генетического материала вируса посредством своей полимеразной активности. Он превращает вирусную одноцепочечную РНК в способную к интеграции двухцепочечную ДНК . Впоследствии сгенерированная ДНК транслоцируется в ядро -хозяина клетки , где она интегрируется в ее геном с помощью ретровирусной интегразы. Другая роль RT заключается в его активности рибонуклеазы H , которая разрушает РНК только тогда, когда она находится в гетеродуплексе с ДНК. [ 7 ] [ 8 ]
Структура
[ редактировать ]RT ВИЧ-1 представляет собой асимметричный гетеродимер длиной 1000 аминокислот , состоящий из двух субъединиц . Более крупная субъединица, p66, имеет длину 560 аминокислот и проявляет всю ферментативную активность RT. [ 8 ] Меньшая субъединица, называемая p51, имеет длину 440 аминокислот и считается, что она стабилизирует гетеродимер, но также может принимать участие в связывании праймера тРНК . Субъединица p66 имеет два активных центра: полимеразу и рибонуклеазу H. Полимераза имеет четыре субдомена, которые получили названия «пальцы», «большой палец», «соединение» и «ладонь», поскольку ее сравнивают с правой рукой. [ 7 ] [ 8 ] [ 9 ]
Механизм действия
[ редактировать ]Активация нуклеозидных и нуклеотидных ингибиторов обратной транскриптазы в первую очередь зависит от проникновения в клетку путем пассивной диффузии или транспорта, опосредованного переносчиком . НИОТ обладают высокой гидрофильностью и ограниченной проницаемостью мембран, поэтому этот этап очень важен. НИОТ являются аналогами эндогенных 2'-дезоксинуклеозида и нуклеотида. Они неактивны в своих родительских формах и требуют последовательного фосфорилирования . [ 6 ]
Нуклеозиды должны быть трифосфорилированы, а нуклеотиды, имеющие одну фосфонированную группу, — дифосфорилированы. [ 10 ] Этот поэтапный процесс активации происходит внутри клетки и опосредуется скоординированной серией ферментов. [ 11 ] Первая и часто лимитирующая скорость стадия фосфорилирования (для аналогов нуклеозидов) чаще всего катализируется дезоксинуклеозидкиназами. Присоединение второй фосфатной группы к аналогам нуклеозидмонофосфата осуществляется нуклеозидмонофосфаткиназами (NMP-киназами). Различные ферменты способны катализировать заключительную стадию фосфорилирования НИОТ, включая нуклеозиддифосфаткиназу (NDP-киназу), фосфоглицераткиназу , пируваткиназу и креатинкиназу , что приводит к образованию соответствующих противовирусно активных трифосфата . аналогов [ 6 ] В своих соответствующих трифосфатных формах НИОТ и единственный доступный НИОТ конкурируют с соответствующим эндогенным дезоксинуклеотидтрифосфатом (дНТФ) за включение в зарождающуюся цепь ДНК (см. рисунок 1). [ 6 ] В отличие от субстрата dNTP, у НИОТ отсутствует 3´-гидроксильная группа в дезоксирибозном фрагменте. После включения в цепь ДНК отсутствие 3´-гидроксильной группы, которая обычно образует 5´-3´- фосфоэфирную связь со следующей нуклеиновой кислотой , блокирует дальнейшее расширение ДНК за счет RT, и они действуют как цепь. терминаторы. [ 10 ] [ 12 ]
Открытие и развитие
[ редактировать ]Первый шаг к лечению ВИЧ-зидовудином
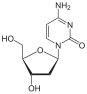
[ редактировать ]В 1964 году зидовудин (АЗТ) был синтезирован Хорвицем в Мичиганском онкологическом фонде. 3'-гидроксильная группа в дезоксирибозном кольце тимидина заменяется азидогруппой, что дает нам зидовудин. [ 13 ] Отсутствие 3'-гидроксильной группы, которая обеспечивает точку присоединения следующего нуклеотида в растущей цепи ДНК во время обратной транскрипции, делает ее облигатным терминатором цепи. Зидуводин используется вместо тимидина и является чрезвычайно мощным ингибитором репликации ВИЧ . [ 14 ] Это соединение было получено в 1964 году как потенциальное противораковое средство, но оказалось, что оно неэффективно. [ 15 ] В 1974 году сообщалось, что зидовудин обладает активностью против ретровирусов, и впоследствии он был повторно проверен как противовирусное средство, когда в середине 1980-х годов западные общества поразила эпидемия СПИДа. [ 13 ] [ 15 ] Однако зидовудин относительно токсичен , поскольку он превращается в трифосфат клеточными ферментами и, следовательно, активируется в неинфицированных клетках. [ 14 ]
Дальнейшая разработка аналогов нуклеозидов.
[ редактировать ]Дидезоксинуклеозиды
[ редактировать ]| Дидезоксиаденозин | Диданозин | |
|---|---|---|
| Химическая
структура |

|

|
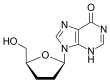
Дидезоксинуклеозиды являются аналогами нуклеозидов, у которых в сахарном кольце отсутствуют как 2´-, так и 3´-гидроксильные группы. [ 9 ] Через три года после синтеза зидовудина Джером Хорвиц и его коллеги в Чикаго получили еще один дидезоксинуклеозид, ныне известный как залцитабин (ddC). [ 16 ] Зальцитабин представляет собой синтетический аналог пиримидинового нуклеозида, структурно родственный дезоксицитидину , в котором 3'-гидроксильная группа рибозного сахарного фрагмента замещена водородом. [ 17 ] Зальцитабин был одобрен FDA для лечения ВИЧ-1 в июне 1992 года. [ 3 ] [ 18 ]
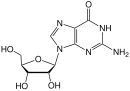
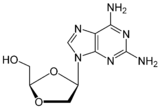
2',3'-дидезоксиинозин или диданозин превращается в дидезоксиаденозин in vivo. Его развитие имеет давнюю историю. [ 19 ] В 1964 году был синтезирован дидезоксиаденозин, соответствующий аденозиновый аналог залцитабина. Дидеоксиаденозин вызывал повреждение почек , поэтому диданозин был получен из дидезоксиаденозина путем ферментативного окисления (см. таблицу 1). Было обнаружено, что он активен против ВИЧ, не вызывая повреждения почек. [ 16 ] Диданозин был одобрен FDA для лечения ВИЧ-1 в октябре 1991 года. [ 18 ] Зальцитабин и диданозин являются облигатными терминаторами цепи, которые были разработаны для лечения ВИЧ. К сожалению, оба препарата не обладают избирательностью и поэтому вызывают побочные эффекты . [ 14 ]
| Зальцитабин | Ламивудин | |
|---|---|---|
| Химическая
структура |
|

|
Дальнейшая модификация дидезоксикаркаса привела к созданию 2´,3´-дидегидро-3´-дезокситимидина (ставудин, d4T). Было показано, что активность ставудина аналогична активности зидовудина, хотя характер их фосфорилирования различается; тот
сродство зидовудина к тимидинкиназы (ферменту, ответственному за первое фосфорилирование) аналогично сродству тимидина , тогда как сродство
для ставудина в 700 раз слабее. [ 9 ]
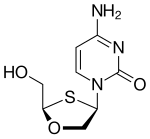
2',3'-дидезокси-3'-тиацитидин (ламивудин, 3TC) был открыт Бернаром Белло . История
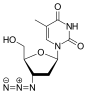
История ламивудина началась в середине 1970-х годов, когда Бернар Белло исследовал производные сахара . Ламивудин был разработан как серный аналог залцитабина (см. таблицу 2). [ 16 ] Первоначально он был синтезирован в виде рацемической смеси (BCH-189), и анализ показал, что как положительные, так и отрицательные энантиомеры BCH-189 (2',3'-дидезокси-3'-тиацитидин) обладали активностью in vitro против ВИЧ. Ламивудин представляет собой отрицательный энантиомер и аналог пиримидинового нуклеозида. 3'-углерод рибозного кольца 2'-дезоксицитидина был заменен атомом серы, поскольку он обладал большей активностью против ВИЧ и менее токсичен, чем положительный энантиомер. [ 16 ] [ 20 ] [ 21 ]
Следующим на очереди был 2',3'-дидезокси-5-фтор-3'-тиацитидин (Эмтрицитабин, FTC), который структурный гомолог ламивудина. Структурное отличие заключается в 5-фтормодификации основной части ламивудина. Он во многом подобен ламивудину и активен как против ВИЧ-1, так и против вируса гепатита B ( HBV ). [ 21 ] [ 22 ]
Карбоциклический нуклеозид
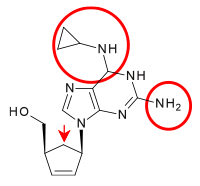
[ редактировать ]Карбоциклические аналоги дидезоксиаденозина исследовали на предмет их активности против ВИЧ. Сначала наблюдалась минимальная активность. Было получено и исследовано множество аналогов нуклеозидов, но только один обладал значительной активностью и удовлетворял требованиям для клинического использования. Это был 2´,3´-дидегидроаналог дидезоксиаденозина. Введение циклопропильной группы в 6-аминоазот аденинового кольца и, таким образом , увеличивало липофильность улучшало проникновение в мозг. Полученное соединение известно как абакавир (см. таблицу 3). [ 16 ] Абакавир был одобрен FDA для использования в терапии инфекций ВИЧ-1 в декабре 1998 года. [ 20 ]
Этот препарат является единственным одобренным антиретровирусным препаратом, активным in vivo как аналог гуанозина . Сначала он монофосфорилируется аденозинфосфотрансферазой, а затем монофосфат превращается в карбовир-3'-монофосфат. Впоследствии он полностью фосфорилируется, и карбовир включается RT в цепь ДНК и действует как терминатор цепи. Карбовир — родственный аналог гуанозина, который имел плохую биодоступность при пероральном приеме и поэтому был исключен из клинических исследований. [ 19 ]
| Дидезоксиаденозин | Диданозин | Абакавир | |
|---|---|---|---|
| Химическая структура | 
|

|
|
Ациклический нуклеотид – единственный одобренный NtRTI
[ редактировать ]Аналоги нуклеотидов требуют только двух стадий фосфорилирования, тогда как аналоги нуклеозидов требуют трех стадий. Снижение потребности в фосфорилировании может обеспечить более быстрое и полное превращение лекарств в их активные метаболиты. Такие соображения привели к разработке аналогов фосфонатных нуклеотидов, таких как тенофовир. Тенофовира дизопроксила фумарат (Тенофовир DF) является пролекарством тенофовира. Тенофовир – ациклическое производное аденозина. Ациклическая природа соединения и его фосфонатная часть являются уникальными структурными особенностями среди одобренных НИОТ. [ 21 ] Тенофовир DF ферментативно гидролизуется до тенофовира, который проявляет активность против ВИЧ. [ 23 ] [ 24 ] Он был разработан путем синтеза и противовирусной активности широкого спектра 2,3-дигидроксипропиладенина. [ 24 ] Тенофовир DF был первым нуклеотидным ингибитором обратной транскриптазы, одобренным FDA для лечения инфекции ВИЧ-1 в октябре 2001 года. [ 18 ] [ 23 ]
почему таблица съедает заголовок следующего раздела, если здесь ничего не написано?
Сопротивление
[ редактировать ]В настоящее время появление лекарственно-устойчивых вирусов является неизбежным следствием длительного воздействия на ВИЧ-1 антиретровирусной терапии. Лекарственная устойчивость представляет собой серьезную клиническую проблему при лечении вирусной инфекции и особенно сложную проблему при лечении ВИЧ. [ 25 ] Мутации резистентности известны для всех одобренных НИОТ. [ 26 ]
Известны два основных механизма, вызывающих лекарственную устойчивость к НИОТ: вмешательство в процесс включения НИОТ и удаление включенных НИОТ. [ 26 ] [ 27 ] Взаимодействие с включенными НИОТ связано с мутацией в субдомене p66 RT. [ 27 ] Мутация вызывает стерические препятствия , которые могут исключить включение некоторых лекарств, например ламивудина, во время обратной транскрипции. В случае удаления включенных НИОТ устойчивые ферменты легко принимают ингибитор в качестве субстрата для включения в цепь ДНК. [ 27 ] Впоследствии фермент RT может удалить включенные НИОТ, обратив стадию полимеризации . Для реакции вырезания требуется донор пирофосфата, который RT присоединяется к НИОТ на конце 3'-праймера, вырезая его из ДНК праймера. [ 27 ] Чтобы добиться эффективного ингибирования репликации ВИЧ-1 у пациентов, а также задержать или предотвратить появление устойчивых к лекарствам вирусов, используются комбинации лекарств. ВААРТ , также известная как высокоактивная антиретровирусная терапия, состоит из комбинаций противовирусных препаратов, включающих НИОТ, НИОТ, ненуклеозидные ингибиторы обратной транскриптазы и ингибиторы протеазы. [ 28 ]
Текущий статус
[ редактировать ]В настоящее время существует несколько НИОТ, находящихся на различных стадиях клинической и доклинической разработки. Основными причинами продолжения поиска новых НИОТ против ВИЧ-1 являются снижение токсичности, повышение эффективности против устойчивых вирусов и упрощение лечения ВИЧ-1. [ 6 ] [ 26 ] [ 29 ]
Априцитабин (АТС)
[ редактировать ]Априцитабин является аналогом дезоксицитидина. Он структурно связан с ламивудином, в котором положения кислорода и серы практически поменяны местами. [ 21 ] Несмотря на то, что априцитабин немного менее эффективен in vitro по сравнению с некоторыми другими НИОТ, он сохраняет свою активность против широкого спектра вариантов ВИЧ-1 с мутациями устойчивости к НИОТ. Априцитабин находится на заключительной стадии клинической разработки для лечения пациентов, ранее принимавших НИОТ. [ 6 ]
Элвуцитабин (L-d4FC)
[ редактировать ]Элвуцитабин представляет собой аналог дезоксицитидина, обладающий активностью в отношении ВИЧ, устойчивый к нескольким другим аналогам нуклеозидов, включая зидовудин и ламивудин. [ 22 ] Частично это связано с высокими внутриклеточными уровнями его трифосфатного метаболита , достигаемого в клетках. [ 6 ] Клинические испытания элвуцитабина приостановлены, поскольку он показал подавление функции костного мозга у некоторых пациентов, при этом количество клеток CD4+ падает уже через два дня после начала приема. [ 22 ] [ 29 ]
Амдоксовир (ДАПД)
[ редактировать ]Амдоксовир представляет собой пролекарство, аналог гуанозина НИОТ, которое имеет хорошую биодоступность. [ 6 ] [ 22 ] [ 29 ] Он дезаминируется внутриклеточно аденозиндезаминазой до диоксолангуанина (DXG). DXG-трифосфат, активная форма препарата, обладает большей активностью, чем DAPD-трифосфат. [ 22 ] Амдоксовир в настоящее время проходит II фазу клинических испытаний. [ 24 ] [ 29 ]
Расивирус (RCV)
[ редактировать ]Рацивир представляет собой рацемическую смесь двух β-энантиомеров эмтрицитабина (FTC), (-)-FTC и (+)-FTC. Рацивир обладает превосходной биодоступностью при пероральном приеме и имеет то преимущество, что его нужно принимать только один раз в день. Рацивир можно рассматривать как комбинацию двух НИОТ, и он продемонстрировал многообещающую противовирусную активность при использовании в комбинации. Рацивир в настоящее время проходит II фазу клинических испытаний. [ 6 ] [ 22 ] [ 29 ]
В разработке находится еще несколько НИОТ. Либо спонсоры подали заявку на исследовательское новое лекарство (IND), либо заявка была одобрена FDA, либо лекарства находятся на разных стадиях клинических испытаний. Некоторые из НИОТ, находящихся в стадии разработки, обладают различными привлекательными фармакологическими свойствами, которые могут сделать их желательными для лечения пациентов, нуждающихся в новых препаратах. [ 6 ] [ 22 ] [ 29 ]
См. также
[ редактировать ]- Антиретровирусный препарат
- Открытие и разработка антагонистов рецептора CCR5
- Открытие и разработка ненуклеозидных ингибиторов обратной транскриптазы
- Открытие и разработка ингибиторов протеазы ВИЧ.
- Открытие и разработка антагонистов рецептора CCR5
- исследования ВИЧ/СПИДа
- Ингибитор обратной транскриптазы
- Ингибитор протеазы
- Ингибитор входа
Ссылки
[ редактировать ]- ^ Мерсон, доктор медицины; Майкл, Х. (2006), «Пандемия ВИЧ-СПИДа в 25 лет — глобальный ответ», The New England Journal of Medicine , 354 (23): 2414–2417, doi : 10.1056/NEJMp068074 , PMID 16760441 , S2CID 2579436
- ^ Фаузи, А.С. (1999), «Аспекты эпидемии СПИДа в 21 веке», Медицинский журнал Новой Англии , 351 (14): 1046–1050, doi : 10.1056/NEJM199909303411406 , PMID 10502595
- ^ Jump up to: а б с Фаучи, А.С. (2003), «ВИЧ и СПИД: 20 лет науки» , Nature Medicine , 9 (7): 839–843, doi : 10.1038/nm0703-839 , PMID 12835701 , S2CID 5472960 , ПроКвест 223114463
- ^ Jump up to: а б с Де-Клерк, Э. (2009), «Препараты против ВИЧ: 25 соединений, одобренных в течение 25 лет после открытия ВИЧ», Международный журнал антимикробных агентов , 33 (4): 307–320, doi : 10.1016/j. ijantimicag.2008.10.010 , PMID 19108994
- ^ Jump up to: а б Бойер, Польша; Гроб, Дж. М.; Делвикс_Франкенберри, Калифорния; Хьюз, Ш.; Джерен, А.; Николенко Г.Н.; Патак, В.К. (2008), «Мутации субдомена соединения обратной транскриптазы ВИЧ-1 уменьшают деградацию матричной РНК и усиливают удаление AZT», Proceedings of the National Academy of Sciences of the United States of America , 105 (31): 10943–10948, Bibcode : 2008PNAS..10510943D , doi : 10.1073/pnas.0804660105 , PMC 2491488 , PMID 18667707
- ^ Jump up to: а б с д и ж г час я дж к л Джихлар, Т.; Рэй, А.С. (2010), «Нуклеозидные и нуклеотидные ингибиторы обратной транскриптазы ВИЧ: 25 лет после зидовудина», Antiviral Research , 85 (1): 39–58, doi : 10.1016/j.antiviral.2009.09.014 , PMID 19887088
- ^ Jump up to: а б Хершорн, А.; Хизи (2008), «Ретровирусные обратные транскриптазы (кроме обратных транскриптаз ВИЧ-1 и вируса мышиного лейкоза): сравнение их молекулярных и биохимических свойств», Virus Research , 134 (1–2): 203–220, doi : 10.1016. /j.virusres.2007.12.008 , PMID 18291546
- ^ Jump up to: а б с Гиридхар, Р.; Праджапати, генеральный директор; Рамаджаям, Р.; Ядав, М.Р. (2009), «Поиск мощных низкомолекулярных ННИОТ: обзор», Bioorganic & Medicinal Chemistry , 17 (16): 5744–5762, doi : 10.1016/j.bmc.2009.06.060 , PMID 19632850
- ^ Jump up to: а б с Андерсон, К.С. (2007), «Обратная транскрипция пандемии ВИЧ-1», The FASEB Journal , 21 (14): 3795–3808, doi : 10.1096/fj.07-8697rev , PMID 17639073 , S2CID 24960391
- ^ Jump up to: а б Гольдшмидт, В.; Марке, Р. (2004), «Разблокировка праймера обратной транскриптазой ВИЧ-1 и устойчивость к нуклеозидным ингибиторам RT», Международный журнал биохимии и клеточной биологии , 36 (9): 1687–1705, doi : 10.1016/j.biocel .2004.02.028 , PMID 15183338
- ^ Какуда, Теннесси (2010), «Фармакология нуклеозидов и нуклеотидов, индуцированная ингибитором обратной транскриптазы митохондриальной токсичности», Clinical Therapeutics , 22 (6): 2717–2747, doi : 10.1016/S0149-2918(00)90004-3 , PMID 10929917
- ^ Хершорн, А.; Хизи, А. (2010), «Ретровирусные обратные транскриптазы», Cellular and Molecular Life Sciences , 67 (16): 2717–2747, doi : 10.1007/s00018-010-0346-2 , PMC 11115783 , PMID 20358252 , S2CID 6954555
- ^ Jump up to: а б Снидер, В. (1996), Прототипы наркотиков и их использование , John Wileys & sons, стр. 448–450, ISBN. 978-0-471-94847-6
- ^ Jump up to: а б с Смит, Дж.; Уильям, Хиуэл (1998), «Введение Смита и Уильямса в принципы разработки и действия лекарств» (3-е изд.), Академические издательства Харвуда, стр. 247–250, 486–490, ISBN. 978-90-5702-037-7
- ^ Jump up to: а б Сондерс, Дж. (2000), Лучшие наркотики: основные синтетические пути , стр. 71–75.
- ^ Jump up to: а б с д и Снидер, В. (2005), История открытия лекарств , Wiley, стр. 250–268, ISBN. 978-0-471-89979-2
- ^ Георгиев В.С. (2009), Национальный институт аллергии и инфекционных заболеваний НИЗ , вып. 2, стр. 417–426, doi : 10.1007/978-1-60327-297 (неактивно 31 января 2024 г.), ISBN 978-1-60327-296-4
{{citation}}: CS1 maint: DOI неактивен по состоянию на январь 2024 г. ( ссылка ) - ^ Jump up to: а б с Де-Клерк, Э. (2009), «Препараты против ВИЧ: 25 соединений, одобренных в течение 25 лет после открытия ВИЧ», Международный журнал антимикробных агентов , 33 (4): 307–320, doi : 10.1016/j. ijantimicag.2008.10.010 , PMID 19108994
- ^ Jump up to: а б Брантон, Л.; Лазо, Дж.; Паркер, К. (2006), «Фармакологические основы терапии» Гудмана и Гилмана, одиннадцатое издание , McGraw-Hill, стр. 1280–1292, ISBN. 978-0-07-142280-2
- ^ Jump up to: а б Огден, Колорадо; Скоурон, Г. (2006), Ингибиторы обратной транскриптазы в терапии ВИЧ/СПИДа , Humana press Inc, стр. 33–63, ISBN 978-1-58829-649-8
- ^ Jump up to: а б с д ЛаФемина, Р.Л. (2009), Стратегии противовирусных исследований при разработке противовирусных препаратов , AMS press, стр. 51–70.
- ^ Jump up to: а б с д и ж г Отто, MJ (2003), «Новые нуклеозидные ингибиторы обратной транскриптазы для лечения ВИЧ-инфекций», Current Opinion in Pharmacology , 9 (7): 839–843, doi : 10.1016/j.coph.2004.06.001 , PMID 15351346
- ^ Jump up to: а б Фунг, Х.Б.; Пьяченти, Ф.Дж.; Стоун, Е.А. (2002), «Тенофовир дизопроксил фумарат: нуклеотидный ингибитор обратной транскриптазы для лечения ВИЧ-инфекции», Clinical Therapeutics , 24 (10): 1515–1548, doi : 10.1016/S0149-2918(02)80058-3 , ПМИД 12462284
- ^ Jump up to: а б с Нгуен-Ба, Н.; Рандо, РФ (2000), «Разработка новых аналогов нуклеозидов для использования против лекарственно-устойчивых штаммов ВИЧ-1», Drug Discovery Today , 5 (10): 465–476, doi : 10.1016/s1359-6446(00)01558- 0 , ПМИД 11018598
- ^ Арнольд, Э.; Даса, К.; Хьюгеск, Ш.; Левиб, П.Дж. (2005), «Кристаллография и разработка препаратов против СПИДа: конформационная гибкость и позиционная адаптируемость важны при разработке ненуклеозидных ингибиторов обратной транскриптазы ВИЧ-1» (PDF) , «Прогресс в биофизике и молекулярной биологии» , 88 (2): 209–231, doi : 10.1016/j.pbiomolbio.2004.07.001 , PMID 15572156 , заархивировано из оригинала (PDF) 30 января 2006 г. , получено 3 ноября 2010 г.
- ^ Jump up to: а б с Делвикс-Франкенберри, Калифорния; Николенко Г.Н.; Патакар, В.К. (2010), «Связь» между лекарственной устойчивостью ВИЧ и РНКазой H», Viruses , 2 (7): 1476–1503, doi : 10.3390/v2071476 , PMC 2982141 , PMID 21088701
- ^ Jump up to: а б с д Кирби, Калифорния; Маршан, Б.; Михаилидис, Э.; Сарафианос, СГ; Сингх, К. (2010), «Структурные аспекты лекарственной устойчивости и ингибирование обратной транскриптазы ВИЧ-1», Viruses , 2 (2): 606–638, doi : 10.3390/v2020606 , PMC 2850067 , PMID 20376302
- ^ Боулинг, TL; Гу, З.; Л'Эрё, Л.; Мейс, Дж. М.; Нгуен-Ба, Н.; Рандо, РФ; Вайнберг, Массачусетс (1999), «Механизм действия и активность in vitro аналогов нуклеозидов 1',3'-диоксоланилпурина против чувствительных и устойчивых к лекарствам вариантов вируса иммунодефицита человека типа 1», Антимикробные агенты и химиотерапия , 43 (10): 2376 –2382, doi : 10.1128/AAC.43.10.2376 , PMC 89486 , PMID 10508010
- ^ Jump up to: а б с д и ж Агравала, РК; Кришнан, ПН; Раман, С.; Равичандран, С.; Вирасами, Р. (2008), «Обзор ингибиторов обратной транскриптазы ВИЧ-1» (PDF) , Digest Journal of Nanomaterials and Biostructures , 3 (4): 171–187, заархивировано из оригинала (PDF) в 2011–2007 гг. -20