Зукапсаицин
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Циванекс |
| Другие имена | Цивамид; ( Z )-Капсаицин; цис -капсаицин |
| Маршруты администрация | Актуальный |
| код АТС | |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| КЭБ | |
| ХЭМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.164.527 |
| Химические и физические данные | |
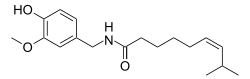
| Формула | C18H27NOC18H27NO3 |
| Молярная масса | 305.418 g·mol −1 |
| 3D model ( JSmol ) | |
Зукапсаицин ( Циванекс ) – препарат, используемый для лечения остеоартрита коленного сустава и других нейропатических болей . Зукапсаицин является членом фенолов и членом метоксибензолов. [ 1 ] Это модулятор члена 1 подсемейства катионных каналов временного рецепторного потенциала ( TRPV-1 ), также известного как ваниллоидный или капсаициновый рецептор 1, который уменьшает боль и улучшает суставные функции. [ 2 ] [ ненадежный медицинский источник? ] [ 3 ] Это цис изомер капсаицина . - Цивамид , производимый Winston Pharmaceuticals, выпускается в формах для перорального, назального и местного применения (пластырь и крем). [ 4 ] [ 5 ]
Зукапсаицин был протестирован для лечения различных состояний, связанных с постоянной нервной болью. Сюда входят инфекции простого герпеса ; кластерные головные боли и мигрень ; и остеоартрит коленного сустава . [ 6 ] Он был одобрен Министерством здравоохранения Канады в 2010 году как крем для местного применения, продаваемый под торговой маркой Zuacta, но в настоящее время не одобрен FDA. [ 2 ] Он имеет температуру плавления 71,5–74,5 ° C. [ 2 ]
Фармакология
[ редактировать ]Зукапсаицин оказывает антиноцицептивное действие, действуя как агонист TRPV1. TRPV1 играют важную физиологическую роль в передаче химических, механических и термических раздражителей, а также в передаче боли и участвуют в модуляции и восприятии боли. Они в основном распределены в сенсорных нервных волокнах C, а также в волокнах Aẟ для передачи сенсорной информации, связанной с воспалительной и нейропатической болью, и активация этих каналов высвобождает соматостатин, пептид, связанный с геном кальцитонина (CGRP) и другие нейропептиды (нейрокинин А, кассинин), приводящее к нейрогенному воспалению [A19720]. Сообщается также, что зукапсаицин влияет на пептидергические афферентные нейроны посредством механизма десенсибилизации, снижая уровни ганглиев дорсальных корешков и пептида, связанного с геном кальцитонина седалищного нерва (CGRP), и вещества P (SP) [L877]. [ 2 ]
Фармакодинамика
[ редактировать ]Зукапсаицин оказывает антиноцицептивное действие, действуя как агонист TRPV1. TRPV1 играют важную физиологическую роль в передаче химических, механических и термических раздражителей, а также в передаче боли и участвуют в модуляции и восприятии боли. Они в основном распределены в сенсорных нервных волокнах C, а также в волокнах Aẟ для передачи сенсорной информации, связанной с воспалительной и нейропатической болью, и активация этих каналов высвобождает соматостатин, пептид, связанный с геном кальцитонина (CGRP) и другие нейропептиды (нейрокинин А, кассинин), приводит к нейрогенному воспалению. [ 5 ] Сообщается также, что зукапсаицин влияет на пептидергические афферентные нейроны посредством механизма десенсибилизации, снижая уровни ганглиев дорсальных корешков и пептида, связанного с геном кальцитонина седалищного нерва (CGRP) и вещества P (SP). [ 2 ]
Механизм действия
[ редактировать ]Зукапсаицин возбуждает и снижает чувствительность С-волокон через агонист TRPV1 на ноцицептивных нейронах. Он связывается с внутриклеточными участками и первоначально стимулирует каналы, вызывая ощущение жжения. [ 3 ] Механизм фармакологического действия зукапсаицина до конца не изучен. Предполагается, что это соединение, как и его транс-изомер, является агонистом ваниллоидного рецептора VR1 (TRPV1) и блокатором нейрональных кальциевых каналов. [ 7 ] [ 8 ] Капсаицин способен возбуждать и снижать чувствительность С-волокон. Таким образом, он способен не только вызывать боль, но и проявлять обезболивающие свойства. Первоначально он стимулирует TRPV1, который отвечает за ощущение жжения. За этим эффектом следует длительное рефрактерное состояние – «десенситизация», во время которого ранее возбужденные сенсорные нейроны перестают реагировать на капсаицин и другие раздражители. Показано, что десенсибилизация и тахифилаксия каналов TRPV1 способствуют облегчению боли, вызванной капсаицином. [ 9 ] Десенсибилизация TRPV1 представляет собой основной механизм его ингибирующей функции.
Описаны три различных пути десенсибилизации, индуцированной капсаицином: i) активация кальциневрина, что приводит к дефосфорилированию TRPV1; ii) активация фосфолипазы C с последующим гидролизом фосфатидилинозитол-4,5-бифосфата (весьма спорно) и iii) активация кальций-зависимых изоформ протеинкиназы C и последующее фосфорилирование каналов. [ 10 ] [ 11 ] Десенсибилизация включает как тахифилаксию (краткосрочную десенсибилизацию), так и длительную, стойкую десенсибилизацию. [ 12 ] [ 13 ] [ 14 ] Предполагается, что снижение активности проальгетических веществ (таких как SP) и повышение активности анальгезирующих пептидов участвуют в десенсибилизации. [ 15 ] Истощение резервов SP делает нейроны десенсибилизированными и рефрактерными. Эти механизмы десенсибилизации до конца не изучены. Считается, что кратковременная десенсибилизация связана со способностью капсаицина блокировать внутриаксональный транспорт NGF, SP и соматостатина. [ 16 ]
Десенсибилизация – явление обратимое. Он начинается через несколько часов после применения капсаицина и может продолжаться даже несколько недель. [ 15 ] Обратимая десенсибилизация оказалась полезной при лечении боли, тогда как локальная абляция сенсорных нервов, передающих болевые стимулы, является многообещающим подходом («молекулярный скальпель») для достижения постоянного облегчения боли у пациентов, страдающих от болей, вызванных раком кости или ВИЧ-инфекцией. индуцированные нейропатии. [ 12 ] [ 13 ] Десенсибилизация и истощение проноцицептивных нейротрансмиттеров вызывают химическую денервацию с потерей функции, что клинически используется при остеоартрите, диабетической нейропатии, псориазе и других. [ 17 ] [ 18 ] [ 19 ] В ганглиях дорсальных корешков и седалищном нерве зукапсаицин снижает уровни SP и CGRP, указывая на то, что он влияет на пептидергические афферентные нейроны посредством механизма десенсибилизации. [ 20 ] [41]. При местном применении предполагаемой мишенью зукапсаицина являются нейроны, иннервирующие местную область применения. Эти нейроны передают боль в ЦНС.
Фармакокинетика
[ редактировать ]Поглощение
[ редактировать ]Зукапсаицин обладает низкой системной абсорбцией и локализуется в области применения. В исследованиях на животных системная абсорбция составила 0,075%. [ 21 ] [ ненадежный медицинский источник? ] [ 22 ] [ 23 ]
Метаболизм
[ редактировать ]Исследования in vitro продемонстрировали ингибирующее действие от слабого до умеренного на различные ферменты цитохрома P450, хотя и не являются клинически значимыми из-за низкой системной абсорбции. [ 22 ]
Путь устранения
[ редактировать ]В исследованиях на крысах зукапсаицин и его метаболиты медленно выводятся с мочой и калом (до 2/3), с минимальным выведением через выдох после кожного введения. [ 21 ] [ 22 ]
Период полураспада
[ редактировать ]У крыс период полувыведения зукапсаицина и его метаболитов составляет примерно 7–11 часов. [ 21 ] [ 22 ]
Токсичность
[ редактировать ]Наиболее распространенными побочными эффектами были реакции в месте нанесения, такие как кратковременное жжение и ощущение тепла. Другими побочными эффектами, наблюдавшимися в клинических исследованиях, были раздражение глаз, артралгия, обострение остеоартрита, ощущение жжения, головная боль, кашель и чихание. Пероральная LD50 у мышей составляет >87,5 мг/кг у самцов и <60 мг/кг у самок. Пероральная LD50 у крыс составляет >90 мг/кг у самцов и >60 мг/кг у самок. [ 21 ]
Химические и физические свойства
[ редактировать ]Вычисляемые свойства
[ редактировать ]| Имя свойства | Стоимость недвижимости [ 24 ] |
|---|---|
| Молекулярный вес | 305.418 g/mol |
| XLogP3-AA | 3.6 |
| Количество доноров водородной связи | 2 |
| Количество акцепторов водородной связи | 3 |
| Вращающееся количество облигаций | 9 |
| Точная масса | 305.199 g/mol |
| Моноизотопная масса | 305.199 g/mol |
| Топологическая полярная поверхность | 58,6 А^2 |
| Количество тяжелых атомов | 22 |
| Официальное обвинение | 0 |
| Сложность | 341 |
| Количество атомов изотопа | 0 |
| Определенное количество стереоцентров атома | 0 |
| Неопределенное количество стереоцентров атома | 0 |
| Определенное количество стереоцентров связи | 1 |
| Неопределенное количество стереоцентров связи | 0 |
| Количество единиц ковалентной связи | 1 |
| Соединение канонизировано | Да |
Ссылки
[ редактировать ]- ^ «цукапсаицин (CHEBI:135952)» . Химические соединения биологического интереса (ХЭБИ) . ЭМБЛ-ЭБИ . Проверено 25 июня 2019 г.
- ^ Jump up to: а б с д и «Зукапсаицин» . Наркобанк . Проверено 25 июня 2019 г.
- ^ Jump up to: а б Студер М., Макнотон, Пенсильвания (октябрь 2010 г.). «Модуляция одноканальных свойств TRPV1 путем фосфорилирования» . Журнал физиологии . 588 (Часть 19): 3743–56. дои : 10.1113/jphysicalol.2010.190611 . ПМЦ 2998224 . ПМИД 20693293 .
- ^ «Цивамид» . Уинстон Фармасьютикалс. Архивировано из оригинала 25 апреля 2012 года . Проверено 16 ноября 2011 г.
- ^ Jump up to: а б Салат К., Якубовская А., Кулиг К. (октябрь 2014 г.). «Зукапсаицин для лечения нейропатической боли». Экспертное мнение об исследуемых препаратах . 23 (10): 1433–40. дои : 10.1517/13543784.2014.956079 . ПМИД 25171227 . S2CID 2969900 .
- ^ Информация о цукапсайцине из Национальной медицинской библиотеки http://druginfo.nlm.nih.gov/drugportal.
- ^ Беван С.Дж., Дочерти Р.Дж. (1993). «Клеточные механизмы действия капсаицина». В Вуде Дж. (ред.). Капсаицин в изучении боли . Лондон, Англия: Академическая пресса. стр. 27–44.
- ^ Ананд П., Блей К. (октябрь 2011 г.). «Местный капсаицин для снятия боли: терапевтический потенциал и механизмы действия нового 8% пластыря с капсаицином с высокой концентрацией» . Британский журнал анестезии . 107 (4): 490–502. дои : 10.1093/bja/aer260 . ПМК 3169333 . ПМИД 21852280 .
- ^ Сен-Пьер М., Ри П.В., Циммерманн К. (июнь 2009 г.). «Дифференциальное влияние блокады каналов TRPV на полимодальную активацию кожных ноцицепторов крыс in vitro». Экспериментальное исследование мозга . 196 (1): 31–44. дои : 10.1007/s00221-009-1808-3 . ПМИД 19404626 . S2CID 25823889 .
- ^ Стаки С.Л., Дубин А.Е., Джеске Н.А. и др. Роль временных рецепторных потенциальных каналов при боли. Brain Res Ред. 2009;60(1):2-23
- ^ Нилиус Б., Овсяник Г. (2013). «Потенциальное семейство ионных каналов переходных рецепторов». Энциклопедия боли . Том. 12. Шпрингер Берлин Гейдельберг. п. 4037. дои : 10.1007/978-3-642-28753-4_202324 . ISBN 978-3-642-28752-7 . ПМК 3129667 . ПМИД 21401968 .
{{cite encyclopedia}}:|journal=игнорируется ( помогите ) - ^ Jump up to: а б Салласи А., Шета М. (сентябрь 2012 г.). «Нацеливание на TRPV1 для облегчения боли: пределы, проигравшие и лавры». Экспертное заключение об исследуемых препаратах . 21 (9): 1351–69. дои : 10.1517/13543784.2012.704021 . ПМИД 22780443 . S2CID 32934502 .
- ^ Jump up to: а б Тревисани М (26 июля 2010 г.). «Нацеливание на TRPV1: проблемы и проблемы в лечении боли» (PDF) . Открытый журнал открытия лекарств . 2 (3): 37–49. doi : 10.2174/1877381801002030037 (неактивен 6 марта 2024 г.). ISSN 1877-3818 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на март 2024 г. ( ссылка ) - ^ Хайраткар-Джоши Н., Салласи А (январь 2009 г.). «Антагонисты TRPV1: проблемы таргетного терапевтического воздействия». Тенденции молекулярной медицины . 15 (1): 14–22. doi : 10.1016/j.molmed.2008.11.004 . ПМИД 19097938 .
- ^ Jump up to: а б Бредерсон Дж.Д., Ким П.Р., Салласи А. Нацеливание на каналы TRP для облегчения боли. Eur J Pharmacol 2013;716:61-76
- ^ Папойу А.Д., Йосипович Г (июнь 2010 г.). «Капсаицин для местного применения. Огонь «горячего» лекарства разгорается вновь» . Экспертное заключение по фармакотерапии . 11 (8): 1359–71. дои : 10.1517/14656566.2010.481670 . ПМИД 20446852 .
- ^ Палаццо Э, Луонго Л, де Новеллис В, Беррино Л, Росси Ф, Майоне С (октябрь 2010 г.). «Движение к супраспинальным рецепторам TRPV1 для облегчения хронической боли» . Молекулярная боль . 6 : 1744-8069–6–66. дои : 10.1186/1744-8069-6-66 . ПМЦ 2959024 . ПМИД 20937102 .
- ^ Ламберт Д.Г. (февраль 2009 г.). «Антагонисты рецепторов капсаицина: новое многообещающее дополнение к клинике боли» . Британский журнал анестезии . 102 (2): 153–5. дои : 10.1093/bja/aen354 . ПМИД 19151045 .
- ^ Ламберт Г.А., Дэвис Дж.Б., Эпплби Дж.М., Чиж Б.А., Хоскин К.Л., Загами А.С. (октябрь 2009 г.). «Влияние антагониста рецептора TRPV1 SB-705498 на тригеминоваскулярную сенсибилизацию и нейротрансмиссию». Архив фармакологии Наунина-Шмидеберга . 380 (4): 311–25. дои : 10.1007/s00210-009-0437-5 . ПМИД 19690836 . S2CID 11113986 .
- ^ Хольцер П. (март 1988 г.). «Локальные эффекторные функции чувствительных к капсаицину сенсорных нервных окончаний: участие тахикининов, пептида, связанного с геном кальцитонина, и других нейропептидов». Нейронаука . 24 (3): 739–68. дои : 10.1016/0306-4522(88)90064-4 . ПМИД 3288903 . S2CID 35325223 .
- ^ Jump up to: а б с д «Монография о продукте ZUACTA (крем зукапсаицин)» (PDF) . Санофи Канада.
- ^ Jump up to: а б с д WO 2011100668 , Бернштейн Дж.Е., «Способ и композиции цивамида для лечения заболеваний кишечника», опубликовано в 2011 г.
- ^ Шнитцер Т.Дж., Пеллетье Дж.П., Хазелвуд Д.М., Эллисон В.Т., Эрвин Дж.Е., Гордон Р.Д. и др. (март 2012 г.). «Крем Цивамид 0,075% у пациентов с остеоартритом коленного сустава: 12-недельное рандомизированное контролируемое клиническое исследование с долгосрочным продлением» . Журнал ревматологии . 39 (3): 610–20. дои : 10.3899/jrheum.110192 . ПМИД 22089461 .
- ^ «Зукапсаицин. Вычисленные свойства» . ПабХим . Национальная медицинская библиотека США . Проверено 23 августа 2019 г.