Окись

Оксид содержащее ( / ˈ ɒ k s aɪ d / ) — химическое соединение, хотя бы один кислорода атом и еще один элемент. [1] в его химической формуле . «Оксид» сам по себе представляет собой дианион (анион с чистым зарядом –2) кислорода, O 2– ион с кислородом в степени окисления -2. Большая часть земной коры состоит из оксидов. Даже материалы, считающиеся чистыми элементами, часто образуют оксидное покрытие. Например, алюминиевая фольга покрывается тонкой оболочкой. Al 2 O 3 (называемый пассивирующим слоем ), защищающий фольгу от дальнейшего окисления . [2]
Стехиометрия [ править ]
Оксиды чрезвычайно разнообразны с точки зрения стехиометрии (измеримой связи между реагентами и химическими уравнениями уравнения или реакции), а также с точки зрения структуры каждой стехиометрии. Большинство элементов образуют оксиды более чем одной стехиометрии. Хорошо известным примером являются окись углерода и двуокись углерода . [2] Это касается бинарных оксидов, то есть соединений, содержащих только оксид и другой элемент. Гораздо более распространены, чем бинарные оксиды, оксиды более сложной стехиометрии. Такая сложность может возникнуть при введении других катионов (положительно заряженного иона, т.е. такого, который будет притягиваться к катоду при электролизе) или других анионов (отрицательно заряженного иона). Силикат железа Fe 2 SiO 4 , минерал фаялит , является одним из многих примеров тройного оксида. Для многих оксидов металлов также существуют возможности полиморфизма и нестехиометрии. [3] Например, коммерчески важные диоксиды титана существуют в трех различных структурах. Многие оксиды металлов существуют в различных нестехиометрических состояниях. Многие молекулярные оксиды также существуют с различными лигандами. [4]
Для простоты большая часть этой статьи посвящена бинарным оксидам.
Формирование [ править ]
Оксиды связаны со всеми элементами, кроме некоторых благородных газов. Пути образования этого разнообразного семейства соединений соответственно многочисленны.
Оксиды металлов [ править ]
Многие оксиды металлов возникают в результате разложения соединений других металлов, например карбонатов, гидроксидов и нитратов. При производстве оксида кальция карбонат кальция (известняк) при нагревании разлагается, выделяя углекислый газ: [2]
Реакция элементов с кислородом воздуха является ключевым этапом коррозии, особенно актуальной для коммерческого использования железа. Почти все элементы при нагревании в атмосфере кислорода образуют оксиды. Например, цинковый порошок сгорает на воздухе с образованием оксида цинка: [5]
Производство металлов из руд часто предполагает получение оксидов путем обжига (нагревания) сульфидных минералов металлов на воздухе. Таким образом, MoS 2 ( молибденит ) превращается в триоксид молибдена , предшественник практически всех соединений молибдена: [6]
Благородные металлы (такие как золото и платина ) ценятся, потому что они устойчивы к прямому химическому соединению с кислородом. [2]
Оксиды неметаллов [ править ]
Важными и распространенными оксидами неметаллов являются диоксид углерода и окись углерода . Эти виды образуются при полном или частичном окислении углерода или углеводородов. При недостатке кислорода монооксид образуется: [2]
При избытке кислорода продуктом является диоксид, путь протекает при посредничестве оксида углерода:
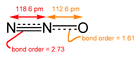
Элементарный азот ( N 2 ) трудно перевести в оксиды, но при сгорании аммиака образуется оксид азота, который далее реагирует с кислородом:
Эти реакции практикуются при производстве азотной кислоты , товарного химического продукта. [7]
Химическим веществом, производимым в крупнейших промышленных масштабах, является серная кислота . Его получают окислением серы до диоксида серы , который отдельно окисляется до триоксида серы : [8]
Наконец, триоксид превращается в серную кислоту в результате реакции гидратации :
Структура [ править ]
Оксиды имеют разнообразную структуру: от отдельных молекул до полимерных и кристаллических структур. В стандартных условиях оксиды могут варьироваться от твердых веществ до газов. Твердые оксиды металлов в обычных условиях обычно имеют полимерную структуру. [9]
Молекулярные оксиды [ править ]
- Некоторые важные газообразные оксиды
- Углекислый газ является основным продуктом сгорания ископаемого топлива.
- Оксид углерода является продуктом неполного сгорания топлива на основе углерода и предшественником многих полезных химических веществ.
- Диоксид азота является проблематичным загрязнителем двигателей внутреннего сгорания.
- Диоксид серы , основной оксид серы , выбрасывается вулканами.
- Закись азота («веселящий газ») — мощный парниковый газ, вырабатываемый почвенными бактериями.
Хотя большинство оксидов металлов представляют собой кристаллические твердые вещества, многие оксиды неметаллов представляют собой молекулы. Примерами молекулярных оксидов являются диоксид углерода и окись углерода . Все простые оксиды азота молекулярны, например NO, N 2 O, NO 2 и N 2 O 4 . Пятиокись фосфора — более сложный молекулярный оксид с обманчивым названием, настоящая формула — P 4 O 10 . Тетроксиды встречаются редко, наиболее распространенными примерами являются четырехокись рутения , четырехокись осмия и четырехокись ксенона . [2]
Реакция [ править ]
Сокращение [ править ]
Восстановление оксидов металлов до металлов широко практикуется при производстве некоторых металлов. Многие оксиды металлов превращаются в металлы просто при нагревании (см. Термическое разложение ). Например, оксид серебра разлагается при 200 °С: [10]
Однако чаще всего оксиды металлов восстанавливают химическим реагентом. Распространенным и дешевым восстановителем является углерод в виде кокса . Наиболее ярким примером является выплавка железной руды . Здесь задействовано множество реакций, но упрощенное уравнение обычно изображается так: [2]
Некоторые оксиды металлов растворяются в присутствии восстановителей, к которым могут относиться органические соединения. Восстановительное растворение оксидов железа является неотъемлемой частью геохимических явлений, таких как круговорот железа . [11]
Гидролиз и растворение [ править ]
Поскольку связи МО обычно прочные, оксиды металлов обычно нерастворимы в растворителях, хотя они могут подвергаться воздействию водных кислот и оснований. [2]
Растворение оксидов часто дает оксианионы . Добавление водной основы в P 4 O 10 дает различные фосфаты . Добавление водной основы в МоО 3 дает полиоксометаллаты . Оксикатионы встречаются реже, некоторые примеры - нитрозоний ( НЕТ + ), ванадил ( VO 2+ ) и уранил ( УО 2+ 2 ). Конечно, известно множество соединений, содержащих как оксиды, так и другие группы. В органической химии к ним относятся кетоны и многие родственные карбонильные соединения. Для переходных металлов многие оксокомплексы известны , а также оксигалогениды . [2]
Номенклатура и формулы [ править ]
Химические формулы оксидов химических элементов в их высшей степени окисления предсказуемы и выводятся из числа валентных электронов этого элемента. Даже химическая формула O 4 , тетракислорода , предсказуема как элемент 16 группы . Единственным исключением является медь , для которой оксид с наивысшей степенью окисления имеет оксид меди(II) , а не оксид меди(I) . Другим исключением является фторид , который существует не как можно было бы ожидать, как F 2 O 7 , а как OF 2 . [12]
См. также [ править ]
- Другие ионы кислорода озонид , О - 3 , супероксид , О - 2 , перекись , O 2− 2 и диоксигенил , О + 2 .
- субоксид
- Окохали
- оксианион
- Сложный оксид
- в разделе «Категория: Оксиды» . Список оксидов см.
- Соль
- Мокрые электроны
Ссылки [ править ]
- ^ Хейн, Моррис; Арена, Сьюзен (2006). Основы студенческой химии (12-е изд.). Уайли. ISBN 978-0-471-74153-4 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я Гринвуд, штат Нью-Йорк; и Эрншоу, А. (1997). Химия элементов (2-е изд.), Оксфорд: Баттерворт-Хайнеманн. ISBN 0-7506-3365-4 .
- ^ CNR Рао, Б. Раво (1995). Оксиды переходных металлов . Нью-Йорк: ВЧ. ISBN 1-56081-647-3 .
- ^ Роски, Герберт В.; Хайдук, Ионел; Хосман, Нараян С. (2003). «Металлоорганические оксиды основной группы и переходных элементов, сокращающие неорганические твердые вещества до мелких молекулярных фрагментов». хим. Преподобный . 103 (7): 2579–2596. дои : 10.1021/cr020376q . ПМИД 12848580 .
- ^ Граф, Гюнтер Г. (2000). «Цинк». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a28_509 . ISBN 3-527-30673-0 .
- ^ Роджер Ф. Себеник; и др. (2005). «Молибден и соединения молибдена». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a16_655 . ISBN 978-3527306732 .
- ^ Тиман, Майкл; Шайблер, Эрих; Виганд, Карл Вильгельм (2000). «Азотная кислота, азотистая кислота и оксиды азота». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a17_293 . ISBN 978-3527306732 .
- ^ Мюллер, Герман (2000). «Серная кислота и триоксид серы». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a25_635 . ISBN 3527306730 .
- ^ П.А. Кокс (2010). Оксиды переходных металлов. Введение в их электронную структуру и свойства . Издательство Оксфордского университета. ISBN 978-0-19-958894-7 .
- ^ «оксид серебра» .
- ^ Корнелл, РМ; Швертманн, У. (2003). Оксиды железа: структура, свойства, реакции, возникновение и использование, второе издание . п. 323. дои : 10.1002/3527602097 . ISBN 978-3-527-30274-1 .
- ^ Шульц, Эмерик (2005). «Полное использование потенциала таблицы Менделеева посредством распознавания образов». Дж. Хим. Образование . 82 (11): 1649. Бибкод : 2005ЖЧЭд..82.1649С . дои : 10.1021/ed082p1649 .