Переходный металл
| Часть серии о |
| Периодическая таблица |
|---|
В химии переходный металл (или переходный элемент ) — химический элемент в d-блоке таблицы Менделеева (группы с 3 по 12), хотя элементы 12 группы (и реже группы 3 ) иногда исключаются. Элементы лантаноидов f - и актинидов ( блок ) называются внутренними переходными металлами и иногда также считаются переходными металлами.
Поскольку это металлы, они блестящие и обладают хорошей электро- и теплопроводностью. Большинство из них (за исключением групп 11 и 12) тверды и прочны, имеют высокие температуры плавления и кипения. Они образуют соединения в любой из двух или более различных степеней окисления и связываются с различными лигандами, образуя координационные комплексы , которые часто окрашены. Они образуют множество полезных сплавов и часто используются в качестве катализаторов в элементарной форме или в таких соединениях, как координационные комплексы и оксиды . являются сильно парамагнитными из-за неспаренных d-электронов Большинство из них, как и многие их соединения, . Все элементы, которые являются ферромагнитными при комнатной температуре, являются переходными металлами ( железо , кобальт и никель ) или внутренними переходными металлами ( гадолиний ).
Английский химик Чарльз Ругли Бери (1890–1968) впервые использовал слово «переход» в этом контексте в 1921 году, когда он имел в виду переходный ряд элементов при изменении внутреннего слоя электронов (например, n = 3 в 4-м ряду периодической таблицы) из стабильной группы из 8 в одну из 18 или из 18 в 32. [1] [2] [3] Эти элементы теперь известны как d-блок.

Определение и классификация
2011 года ИЮПАК В Принципах химической номенклатуры «переходный металл» описывается как любой элемент в группах с 3 по 12 таблицы Менделеева . [4] Это в точности соответствует элементам d-блока , и многие учёные используют это определение. [5] [6] На практике f-блока ряды лантаноидов и актинидов называются «внутренними переходными металлами». 2005 года Красная книга допускает исключение элементов группы 12, но не Принципы 2011 года . [7]
ИЮПАК Золотая книга [8] определяет переходный металл как « элемент , атом которого имеет частично заполненную подоболочку d или который может давать катионы с неполной подоболочкой d», но это определение взято из старого издания Красной книги и является больше не присутствует в текущем издании. [7]
В d-блоке атомы элементов имеют от нуля до десяти d-электронов.
| Группа | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
|---|---|---|---|---|---|---|---|---|---|---|
| Период 4 | 21 СБН | 22 Ти | 2323В | 24 Кр | 25 млн. | 26 февраля | 27 Ко | 28 Ни | 29 меди | 30 Зн |
| 5 | 3939 лет | 40 Зр | 41 НБ | 42 мес. | 43 Тк | 44 Ру | 45 резус | 46 ПД | 47 Аг | 48 компакт-дисков |
| 6 | 71 Лу | 72 гф | 73 Та | 74 Вт | 75 Ре | 76 Ос | 77 ИК | 78 баллов | 79 Ау | 80 рт. ст. |
| 7 | 103 лр | 104 РФ | 105 Дб | 106 Сг | 107 бат.ч. | 108 Гс | 109 тонн | 110 Дс | 111 рг | 112 Сп |
Опубликованные тексты и таблицы Менделеева показывают различия в отношении более тяжелых членов группы 3 . [9] Общее расположение лантана и актиния в этих позициях не подтверждается физическими, химическими и электронными доказательствами . [10] [11] [12] которые в подавляющем большинстве предпочитают помещать лютеций и лоуренсий . в эти места [13] [14] Некоторые авторы предпочитают оставлять пробелы под иттрием пустыми в качестве третьего варианта, но существует путаница в отношении того, подразумевает ли этот формат, что группа 3 содержит только скандий и иттрий, или она также содержит все лантаноиды и актиниды; [15] [16] [17] [18] [19] кроме того, он создает f-блок шириной 15 элементов, тогда как квантовая механика требует, чтобы f-блок имел ширину только 14 элементов. [15] Форма с лютецием и лоуренсием в группе 3 подтверждается отчетом ИЮПАК 1988 года по физическим, химическим и электронным основаниям. [20] и снова предварительным отчетом IUPAC 2021 года, поскольку это единственная форма, которая позволяет одновременно (1) сохранять последовательность возрастающих атомных номеров, (2) f-блок шириной из 14 элементов и (3) избегать разделения в блоке Д. [15] В современной литературе все еще можно найти аргументацию, защищающую форму с лантаном и актинием в группе 3, но многие авторы считают ее логически непоследовательной (особым предметом разногласий является различное обращение с актинием и торием , которые оба могут использовать 5f как валентная орбиталь , но не имеют занятости 5f в качестве одиночных атомов); [14] [21] [22] большинство исследователей, рассматривающих проблему, согласны с обновленной формой с лютецием и лоуренцием. [14]
Элементы 12-й группы цинк , кадмий и ртуть иногда исключаются из числа переходных металлов. [1] Это потому, что они имеют электронную конфигурацию [ ]d 10 с 2 , где оболочка d завершена, [23] и они все еще имеют полную d-оболочку во всех известных степенях окисления . Поэтому элементы группы 12 Zn, Cd и Hg при определенных критериях могут быть классифицированы в этом случае как постпереходные металлы . Однако часто бывает удобно включить эти элементы в обсуждение переходных элементов. Например, при обсуждении энергии стабилизации кристаллического поля переходных элементов первого ряда удобно также включать элементы кальций и цинк, поскольку оба Ca 2+
и цинк 2+
имеют нулевое значение, с которым можно сравнивать значение для других ионов переходных металлов. Другой пример имеет место в Ирвинга – Вильямса ряду констант устойчивости комплексов . Более того, Zn, Cd и Hg могут использовать свои d-орбитали для связывания, даже если они не известны в состояниях окисления, которые формально потребовали бы разрыва d-подоболочки, что отличает их от элементов p-блока. [24] [25] [26]
Недавний (хотя и оспариваемый и до сих пор не воспроизведенный независимо) синтез фторида ртути(IV) ( HgF
4 ) был воспринят некоторыми как подтверждение мнения о том, что элементы группы 12 следует считать переходными металлами. [27] но некоторые авторы до сих пор считают это соединение исключительным. [28] Ожидается, что коперниций сможет использовать свои d-электроны в химических целях, поскольку его 6d -оболочка дестабилизирована сильными релятивистскими эффектами из-за его очень высокого атомного номера, и поэтому ожидается, что он будет иметь поведение, подобное переходному металлу, и демонстрировать более высокие степени окисления, чем +2 (которые точно не известны для более легких элементов 12-й группы). Даже в голых обозначениях Cn 2+ по прогнозам будет 6d 8 7 с 2 , в отличие от ртути 2+ это 5д 10 6 с 0 .
Хотя мейтнерий , дармштадтий и рентгений находятся внутри d-блока и, как ожидается, будут вести себя как переходные металлы, аналогичные своим более легким родственникам иридию , платине и золоту , это еще не подтверждено экспериментально. ведет ли коперниций больше сходство с ртутью или имеет свойства, более схожие со свойствами благородного газа радона Неясно, . Относительная инертность Cn может быть обусловлена релятивистски расширенной энергетической щелью 7s–7p 1/2 , которая уже намечена в щели 6s–6p 1/2 для Hg, ослабляя металлические связи и вызывая ее хорошо известные низкие температуры плавления и кипения.
Переходные металлы с более низкими или более высокими номерами групп описываются как «ранние» или «поздние» соответственно. При описании в двухсторонней схеме классификации ранние переходные металлы находятся на левой стороне d-блока от группы 3 до группы 7. Поздние переходные металлы находятся на правой стороне d-блока от группы 8 до 11 ( или 12, если они считаются переходными металлами). В альтернативной трехсторонней схеме группы 3, 4 и 5 классифицируются как ранние переходные металлы, 6, 7 и 8 классифицируются как средние переходные металлы, а 9, 10 и 11 (а иногда и группа 12) классифицируются как металлы среднего уровня. как поздние переходные металлы.
Тяжелые элементы группы 2 кальций , стронций и барий участвуют d-орбитальные связи не имеют заполненных d-орбиталей в виде отдельных атомов, но, как известно, в некоторых соединениях , и по этой причине их называют «почетными» переходными металлами. [29] Вероятно, то же самое относится и к радию . [30]
Элементы f-блока La–Yb и Ac–No обладают химической активностью (n-1)d-оболочки, но, что важно, также обладают химической активностью (n-2)f-оболочки, отсутствующей у элементов d-блока. Следовательно, их часто рассматривают отдельно как внутренние переходные элементы.
Электронная конфигурация
Общая электронная конфигурация атомов d-блока: [благородный газ]( n - 1)d 0–10 н с 0–2 nнапример 0–1 . Здесь «[благородный газ]» — это электронная конфигурация последнего благородного газа, предшествующего рассматриваемому атому, а n — высшее главное квантовое число занятой орбитали в этом атоме. Например, Ti ( Z = 22) находится в периоде 4, так что n = 4, первые 18 электронов имеют ту же конфигурацию Ar в конце периода 3, а общая конфигурация равна [Ar]3d. 2 4 с 2 . Переходные металлы периодов 6 и 7 также добавляют ядро ( n - 2)f. 14 электроны, которые не включены в таблицы ниже. P-орбитали почти никогда не заполнены свободными атомами (единственным исключением является лоуренсий из-за релятивистских эффектов, которые становятся важными при таких высоких Z ), но они могут способствовать образованию химических связей в соединениях переходных металлов.
Правило Маделунга предсказывает, что внутренняя d-орбиталь заполняется после орбитали валентной оболочки . Типичная электронная структура атомов переходных металлов тогда записывается как [благородный газ] n s 2 ( п - 1)д м . Это правило приблизительное, но справедливо для большинства переходных металлов. Даже если это не соответствует нейтральному основному состоянию, оно точно описывает низколежащее возбужденное состояние.
Подоболочка d является предпоследней подоболочкой и обозначается как ( n − 1)d подоболочка. Число s-электронов в самой внешней s-подоболочке обычно составляет один или два, за исключением палладия (Pd), где в этой s-подоболочке нет электронов в основном состоянии. Подоболочка s в валентной оболочке представлена как подоболочка n s, например 4s. В периодической таблице переходные металлы представлены в десяти группах (от 3 до 12).
Элементы группы 3 имеют n s 2 ( п - 1)д 1 конфигурация, кроме лоуренсиума (Lr): это 7s 2 7р 1 Конфигурация в исключительных случаях вообще не заполняет 6d-орбитали. Первая переходная серия присутствует в 4-м периоде и начинается после Са ( Z = 20) группы 2 с конфигурацией [Ar]4s. 2 , или скандий (Sc), первый элемент группы 3 с атомным номером Z = 21 и конфигурацией [Ar]4s. 2 3d 1 , в зависимости от используемого определения. По мере движения слева направо электроны добавляются в одну и ту же подоболочку d, пока она не завершится. Поскольку добавленные электроны заполняют ( n − 1)d-орбитали, свойства элементов d-блока существенно отличаются от свойств элементов s- и p-блока, у которых заполнение происходит либо по s, либо по p-орбиталям валентной оболочки.Электронная конфигурация отдельных элементов, присутствующих во всех сериях d-блоков, приведена ниже: [31]
| Группа | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
|---|---|---|---|---|---|---|---|---|---|---|
| Атомный номер | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Элемент | наук | Из | V | Кр | Мин. | Фе | Ко | В | С | Зн |
| Электрон конфигурация | 3d 1 4 с 2 | 3d 2 4 с 2 | 3d 3 4 с 2 | 3d 5 4 с 1 | 3d 5 4 с 2 | 3d 6 4 с 2 | 3d 7 4 с 2 | 3d 8 4 с 2 | 3d 10 4 с 1 | 3d 10 4 с 2 |
| Атомный номер | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 |
|---|---|---|---|---|---|---|---|---|---|---|
| Элемент | И | Зр | Нб | Мо | Тс | Ру | резус | ПД | В | компакт-диск |
| Электрон конфигурация | 4д 1 5 с 2 | 4д 2 5 с 2 | 4д 4 5 с 1 | 4д 5 5 с 1 | 4д 5 5 с 2 | 4д 7 5 с 1 | 4д 8 5 с 1 | 4д 10 5 с 0 | 4д 10 5 с 1 | 4д 10 5 с 2 |
| Атомный номер | 71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 |
|---|---|---|---|---|---|---|---|---|---|---|
| Элемент | Лу | хф | Облицовка | В | Ре | Ты | И | Пт | В | ртуть |
| Электрон конфигурация | 5д 1 6 с 2 | 5д 2 6 с 2 | 5д 3 6 с 2 | 5д 4 6 с 2 | 5д 5 6 с 2 | 5д 6 6 с 2 | 5д 7 6 с 2 | 5д 9 6 с 1 | 5д 10 6 с 1 | 5д 10 6 с 2 |
| Атомный номер | 103 | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 |
|---|---|---|---|---|---|---|---|---|---|---|
| Элемент | лр | РФ | ДБ | Сг | Бх | Хс | гора | Дс | Рг | Сп |
| Электрон конфигурация | 7 с 2 7р 1 | 6д 2 7 с 2 | 6д 3 7 с 2 | 6д 4 7 с 2 | 6д 5 7 с 2 | 6д 6 7 с 2 | 6д 7 7 с 2 | 6д 8 7 с 2 | 6д 9 7 с 2 | 6д 10 7 с 2 |
Внимательный взгляд на электронную конфигурацию элементов показывает, что из правила Маделунга существуют определенные исключения . Для примера Cr правило предсказывает конфигурацию 3d 4 4 с 2 , но наблюдаемые атомные спектры показывают, что реальное основное состояние — это 3d 5 4 с 1 . Чтобы объяснить такие исключения, необходимо учитывать влияние увеличения заряда ядра на орбитальные энергии, а также электрон-электронные взаимодействия, включая как кулоновское отталкивание , так и обменную энергию . [31] Исключения в любом случае не очень важны для химии, поскольку разница в энергии между ними и ожидаемой конфигурацией всегда весьма мала. [32]
( n - 1) d-орбитали, участвующие в переходных металлах, очень важны, поскольку они влияют на такие свойства, как магнитный характер, переменные степени окисления, образование окрашенных соединений и т. д. Валентные s- и p-орбитали ( ns и n p) имеют очень небольшой вклад в этом отношении, поскольку они почти не меняются при движении слева направо в переходном ряду.В переходных металлах наблюдается большее горизонтальное сходство свойств элементов в периоде по сравнению с периодами, в которых d-орбитали не участвуют. Это связано с тем, что в переходной серии электронная конфигурация валентной оболочки элементов не меняется. Однако есть и некоторые сходства между группами.
Характерные свойства
Переходные элементы обладают рядом свойств, которых нет у других элементов, что является результатом частично заполненной оболочки d. К ним относятся
- образование соединений, цвет которых обусловлен электронными переходами d–d.
- образование соединений во многих степенях окисления из-за относительно небольшой энергетической разницы между различными возможными степенями окисления [33]
- образование многих парамагнитных соединений из-за наличия неспаренных d-электронов. Некоторые соединения элементов основной группы также являются парамагнитными (например, оксид азота , кислород ).
Большинство переходных металлов могут быть связаны с различными лигандами , что позволяет образовывать самые разнообразные комплексы переходных металлов. [34]
Цветные соединения

3 )
2 (красный); К
2 Кр
22О
7 (оранжевый); К
2 КрО
4 (желтый); NiCl
2 (бирюзовый); CuSO
4 (синий); КМнО
4 (фиолетовый).
Цвет соединений металлов переходного ряда обычно обусловлен электронными переходами двух основных типов.
- с переносом заряда переходы . Электрон может перепрыгнуть с преимущественно лигандной орбитали на преимущественно металлическую орбиталь, вызывая переход с переносом заряда от лиганда к металлу (LMCT). Наиболее легко это может произойти, когда металл находится в высокой степени окисления. Например, окраска ионов хромата , дихромата и перманганата обусловлена переходами LMCT. Другой пример: йодид ртути HgI 2 имеет красный цвет из-за перехода LMCT.
Переход с переносом заряда металл-лиганд (MLCT) будет наиболее вероятен, когда металл находится в низкой степени окисления и лиганд легко восстанавливается.
Обычно переходы с переносом заряда приводят к более интенсивным цветам, чем переходы d – d.
- d–d переходы. Электрон перепрыгивает с одной d-орбитали на другую. В комплексах переходных металлов не все d-орбитали имеют одинаковую энергию. Характер расщепления d-орбиталей можно рассчитать с помощью теории кристаллического поля . Степень расщепления зависит от конкретного металла, степени его окисления и природы лигандов. Реальные уровни энергии показаны на диаграммах Танабе-Сугано .
В центросимметричных комплексах, таких как октаэдрические, переходы d–d запрещены правилом Лапорта и происходят только из-за вибронной связи , при которой молекулярное колебание происходит вместе с переходом ad–d. Тетраэдрические комплексы имеют несколько более интенсивный цвет, поскольку смешивание d- и p-орбиталей возможно при отсутствии центра симметрии, поэтому переходы не являются чистыми d – d-переходами. Молярная поглощательная способность (ε) полос, обусловленных d–d-переходами, относительно невелика, примерно в диапазоне 5–500 М. −1 см −1 (где M = моль дм −3 ). [35] Некоторые d–d-переходы запрещены по спину . Пример встречается в октаэдрических высокоспиновых комплексах марганца (II).где есть реклама 5 конфигурация, в которой все пять электронов имеют параллельные спины; окраска таких комплексов значительно слабее, чем у комплексов со спин-разрешенными переходами. Многие соединения марганца(II) кажутся почти бесцветными. Спектр [ Mn(H
2О )
6 ] 2+
показывает максимальную молярную поглощающую способность около 0,04 М. −1 см −1 в видимом спектре .
Стадии окисления
Характерной чертой переходных металлов является то, что они проявляют две или более степени окисления , обычно отличающиеся на одну. Например, соединения ванадия известны во всех степенях окисления от -1, например [V (CO)
6 ] −
и +5, например VO 3−
4 .
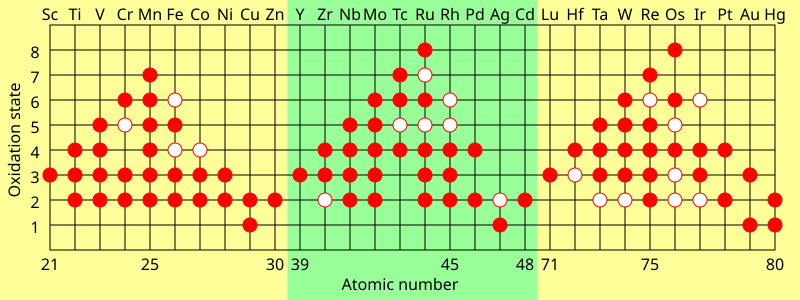
Элементы основной группы в группах с 13 по 18 также имеют несколько степеней окисления. «Общие» степени окисления этих элементов обычно различаются на две, а не на одну. Например, существуют соединения галлия в степенях окисления +1 и +3, в которых имеется один атом галлия. Соединения Ga(II) имеют неспаренный электрон, ведут себя как свободные радикалы и обычно быстро разрушаются, но известны некоторые стабильные радикалы Ga(II). [36] Галлий также имеет формальную степень окисления +2 в димерных соединениях, таких как [Ga
2 кл.
6 ] 2−
, которые содержат связь Ga-Ga, образованную неспаренным электроном на каждом атоме Ga. [37] Таким образом, основное различие в степенях окисления между переходными элементами и другими элементами заключается в том, что известны состояния окисления, в которых имеется один атом элемента и один или несколько неспаренных электронов.
Максимальная степень окисления у переходных металлов первого ряда равна числу валентных электронов от титана (+4) до марганца (+7), но уменьшается у более поздних элементов. Во втором ряду максимум приходится на рутений (+8), а в третьем ряду максимум приходится на иридий (+9). В таких соединениях, как [MnO
4 ] −
и ОсО
4 , элементы достигают стабильной конфигурации за счет ковалентной связи .
Наименьшие степени окисления проявляются у карбонильных комплексов металлов, таких как Cr (CO)
6 (нулевая степень окисления) и [Fe(CO)
4 ] 2−
(степень окисления -2), при которой правило 18 электронов соблюдается . Эти комплексы также ковалентны.
Ионные соединения в основном образуются со степенями окисления +2 и +3. В водном растворе ионы гидратируются (обычно) шестью молекулами воды, расположенными октаэдрически.
Магнетизм
Соединения переходных металлов являются парамагнитными , если у них есть один или несколько неспаренных d-электронов. [38] В октаэдрических комплексах с четырьмя и семью d-электронами как высокоспиновые , так и низкоспиновые возможны состояния. Тетраэдрические комплексы переходных металлов, такие как [FeCl
4 ] 2−
имеют высокий спин, потому что расщепление кристаллического поля мало, так что энергия, которую можно получить за счет нахождения электронов на орбиталях с более низкой энергией, всегда меньше, чем энергия, необходимая для объединения спинов в пары. Некоторые соединения диамагнитны . К ним относятся октаэдрические, низкоспиновые, d 6 и плоско-квадратный d 8 комплексы. В этих случаях расщепление кристаллического поля таково, что все электроны образуют пары.
Ферромагнетизм возникает, когда отдельные атомы являются парамагнитными, а векторы спина ориентированы параллельно друг другу в кристаллическом материале. Металлическое железо и сплав алнико являются примерами ферромагнитных материалов, содержащих переходные металлы. Антиферромагнетизм — еще один пример магнитного свойства, возникающего в результате особого расположения отдельных спинов в твердом состоянии.
Каталитические свойства
Переходные металлы и их соединения известны своей гомогенной и гетерогенной каталитической активностью. Эта активность объясняется их способностью принимать несколько степеней окисления и образовывать комплексы. Оксид ванадия (V) (в контактном процессе ), мелкодисперсное железо (в процессе Габера ) и никель (в каталитическом гидрировании ) являются лишь некоторыми примерами. Катализаторы на твердой поверхности ( катализаторы на основе наноматериалов ) предусматривают образование связей между молекулами реагентов и атомами поверхности катализатора (переходные металлы первого ряда используют для связи 3d и 4s электроны). Это приводит к увеличению концентрации реагентов на поверхности катализатора, а также к ослаблению связей в реагирующих молекулах (снижается энергия активации). Кроме того, поскольку ионы переходных металлов могут менять свою степень окисления, они становятся более эффективными катализаторами .
Интересный тип катализа возникает, когда продукты реакции катализируют реакцию, производя больше катализатора ( автокатализ ). Одним из примеров является реакция щавелевой кислоты с подкисленным перманганатом калия (или манганатом (VII)). [39] Однажды немного Мн 2+ получен, он может реагировать с MnO 4 − образуя Mn 3+ . Затем он реагирует с C 2 O 4 − ионы, образующие Mn 2+ снова.
Физические свойства
Как следует из названия, все переходные металлы являются металлами и, следовательно, являются проводниками электричества.
В целом переходные металлы обладают высокой плотностью и высокими температурами плавления и кипения . Эти свойства обусловлены металлической связью делокализованными d-электронами, что приводит к сплочению , которое увеличивается с увеличением количества общих электронов. Однако металлы группы 12 имеют гораздо более низкие температуры плавления и кипения, поскольку их полные подоболочки d предотвращают образование d – d-связей, что снова имеет тенденцию отличать их от общепринятых переходных металлов. Ртуть имеет температуру плавления -38,83 ° C (-37,89 ° F) и при комнатной температуре является жидкостью.
См. также
- Внутренний переходный элемент — имя, присвоенное любому члену f-блока.
- Элемент основной группы , элемент, отличный от переходного металла.
- Теория поля лигандов - развитие теории кристаллического поля с учетом ковалентности.
- Теория кристаллического поля - модель, описывающая нарушение вырождений электронных орбитальных состояний.
- Постпереходный металл , металлический элемент справа от переходных металлов в таблице Менделеева.
Ссылки
- ^ Jump up to: а б Дженсен, Уильям Б. (2003). «Место цинка, кадмия и ртути в периодической таблице» (PDF) . Журнал химического образования . 80 (8): 952–961. Бибкод : 2003JChEd..80..952J . дои : 10.1021/ed080p952 .
- ^ Бери, ЧР (1921). «Теория Ленгмюра о расположении электронов в атомах и молекулах» . Дж. Ам. хим. Соц . 43 (7): 1602–1609. дои : 10.1021/ja01440a023 .
- ^ Бери, Чарльз Рагели . Encyclepedia.com Полный словарь научной биографии (2008).
- ^ Ли, Дж.Дж., изд. (2011). Принципы химической номенклатуры (PDF) . Королевское химическое общество. п. 9. ISBN 978-1-84973-007-5 .
- ^ Петруччи, Ральф Х.; Харвуд, Уильям С.; Херринг, Ф. Джеффри (2002). Общая химия: принципы и современные приложения (8-е изд.). Река Аппер-Седл, Нью-Джерси: Прентис-Холл. стр. 341–342 . ISBN 978-0-13-014329-7 . LCCN 2001032331 . OCLC 46872308 .
- ^ Хаускрофт, CE и Шарп, AG (2005) Неорганическая химия , 2-е изд., Pearson Prentice-Hall, стр. 20–21.
- ^ Jump up to: а б Коннелли, штат Нью-Йорк; Дамхус, Т.; Хартсхорн, РМ; Хаттон, AT, ред. (2005). Номенклатура неорганической химии (PDF) . РСК – ИЮПАК . ISBN 0-85404-438-8 .
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Переходной элемент ». дои : 10.1351/goldbook.T06456
- ^ Шерри, Эрик Р. (2020). Таблица Менделеева: ее история и значение . Нью-Йорк, штат Нью-Йорк. ISBN 978-0-19-091436-3 . OCLC 1096234740 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Л.Д. Ландау , Е.М. Лифшиц (1958). Квантовая механика: нерелятивистская теория . Том. 3 (1-е изд.). Пергамон Пресс . стр. 256–7.
- ^ Виттиг, Йорг (1973). «Переменная давления в физике твердого тела: как насчет сверхпроводников 4f-диапазона?». В HJ Queisser (ред.). Проблема Festkörper: пленарные лекции на отделениях физики полупроводников, физики поверхности, физики низких температур, высоких полимеров, термодинамики и статистической механики Немецкого физического общества, Мюнстер, 19–24 марта 1973 г. Достижения физики твердого тела. Том. 13. Берлин, Гейдельберг: Шпрингер. стр. 375–396. дои : 10.1007/BFb0108579 . ISBN 978-3-528-08019-8 .
- ^ Матиас, BT (1969). «Систематика сверхпроводимости». В Уоллесе, PR (ред.). Сверхпроводимость . Том. 1. Гордон и Брич. стр. 225–294. ISBN 9780677138107 .
- ^ Уильям Б. Дженсен (1982). «Положения лантана (актиния) и лютеция (лоуренция) в периодической таблице». Дж. Хим. Образование . 59 (8): 634–636. Бибкод : 1982JChEd..59..634J . дои : 10.1021/ed059p634 .
- ^ Jump up to: а б с Дженсен, Уильям Б. (2015). «Положения лантана (актиния) и лютеция (лоуренция) в периодической таблице: обновление» . Основы химии . 17 : 23–31. дои : 10.1007/s10698-015-9216-1 . S2CID 98624395 . Архивировано из оригинала 30 января 2021 года . Проверено 28 января 2021 г.
- ^ Jump up to: а б с Шерри, Эрик (18 января 2021 г.). «Предварительный отчет о дискуссиях по группе 3 периодической таблицы» (PDF) . Химия Интернэшнл . 43 (1): 31–34. дои : 10.1515/ci-2021-0115 . S2CID 231694898 . Архивировано (PDF) из оригинала 13 апреля 2021 года . Проверено 9 апреля 2021 г.
- ^ Тиссен, П.; Биннеманс, К. (2011). «Размещение редких земель в таблице Менделеева: исторический анализ». В Гшнейднере, К.А. младшем; Бюнцли, JCG; Вечарский, Бюнцли (ред.). Справочник по физике и химии редких земель . Том. 41. Амстердам: Эльзевир. стр. 1–94. дои : 10.1016/B978-0-444-53590-0.00001-7 . ISBN 978-0-444-53590-0 .
- ^ Барбер, Роберт С.; Карол, Пол Дж; Накахара, Хиромичи; Вардачи, Эмануэле; Фогт, Эрих В. (2011). «Открытие элементов с атомными номерами больше или равными 113 (Технический отчет ИЮПАК)» . Чистое приложение. Хим . 83 (7): 1485. doi : 10.1351/PAC-REP-10-05-01 .
- ^ Карол, Пол Дж.; Барбер, Роберт С.; Шерилл, Брэдли М.; Вардачи, Эмануэле; Ямазаки, Тосимицу (22 декабря 2015 г.). «Открытие элементов с атомными номерами Z = 113, 115 и 117 (Технический отчет ИЮПАК)» . Чистое приложение. Хим . 88 (1–2): 139–153. дои : 10.1515/pac-2015-0502 .
- ^ Пюиккё, Пекка (2019). «Очерк периодических таблиц» (PDF) . Чистая и прикладная химия . 91 (12): 1959–1967. дои : 10.1515/pac-2019-0801 . S2CID 203944816 . Проверено 27 ноября 2022 г.
- ^ Флак, Э. (1988). «Новые обозначения в таблице Менделеева» (PDF) . Чистое приложение. хим. 60 (3): 431–436. дои : 10.1351/pac198860030431 . S2CID 96704008 . Архивировано (PDF) из оригинала 25 марта 2012 года . Проверено 24 марта 2012 г.
- ^ Шерри, Эрик (2009). «Какие элементы относятся к группе 3?» . Журнал химического образования . 86 (10): 1188. Бибкод : 2009ЖЧЭд..86.1188С . дои : 10.1021/ed086p1188 . Проверено 1 января 2023 г.
- ^ Чеми, Александр Т.; Альбрехт-Шмитт, Томас Э. (2019). «Эволюция таблицы Менделеева посредством синтеза новых элементов». Радиохимика Акта . 107 (9–11): 771–801. дои : 10.1515/ract-2018-3082 . S2CID 104470619 .
- ^ Коттон, Ф. Альберт; Уилкинсон, Г.; Мурильо, Калифорния (1999). Продвинутая неорганическая химия (6-е изд.). Нью-Йорк: Уайли, ISBN 978-0-471-19957-1 .
- ^ Тосселл, Дж. А. (1 ноября 1977 г.). «Теоретические исследования энергий связи валентных орбиталей в твердом сульфиде цинка, оксиде цинка и фториде цинка». Неорганическая химия . 16 (11): 2944–2949. дои : 10.1021/ic50177a056 .
- ^ Фарберович О.В.; Курганский С.И.; Домашевская, Е.П. (1980). «Проблемы метода ОПВ. II. Расчет зонной структуры ZnS и CdS». Физический статус Solidi B. 97 (2): 631–640. Бибкод : 1980ПССБР..97..631Ф . дои : 10.1002/pssb.2220970230 .
- ^ Сингх, Прабхакар П. (1994). «Релятивистские эффекты в ртути: атом, кластеры и объем». Физический обзор B . 49 (7): 4954–4958. Бибкод : 1994PhRvB..49.4954S . дои : 10.1103/PhysRevB.49.4954 . ПМИД 10011429 .
- ^ Ван, Сюэфан; Эндрюс, Лестер; Ридель, Себастьян; Каупп, Мартин (2007). «Ртуть — переходный металл: первое экспериментальное свидетельство существования HgF 4 ». Энджью. хим. Межд. Эд . 46 (44): 8371–8375. дои : 10.1002/anie.200703710 . ПМИД 17899620 .
- ^ Дженсен, Уильям Б. (2008). «Является ли Меркурий теперь переходным элементом?» . Дж. Хим. Образование . 85 (9): 1182–1183. Бибкод : 2008JChEd..85.1182J . дои : 10.1021/ed085p1182 .
- ^ Фернандес, Израиль; Хольцманн, Николь; Френкинг, Гернот (2020). «Валентные орбитали щелочноземельных атомов» . Химия: Европейский журнал . 26 (62): 14194–14210. дои : 10.1002/chem.202002986 . ПМК 7702052 . PMID 32666598 . S2CID 220529532 .
- ^ Пюиккё, Пекка; Дескло, Жан-Поль (1979). «Относительность и периодическая система элементов». Отчеты о химических исследованиях . 12 (8): 276–281. дои : 10.1021/ar50140a002 .
- ^ Jump up to: а б Мисслер Г.Л. и Тарр Д.А. (1999) Неорганическая химия , 2-е изд., Prentice-Hall, стр. 38-39 ISBN 978-0-13-841891-5
- ^ Йоргенсен, Кристиан (1973). «Слабая связь между электронной конфигурацией и химическим поведением тяжелых элементов (трансуранов)». Angewandte Chemie, международное издание . 12 (1): 12–19. дои : 10.1002/anie.197300121 .
- ^ Мацумото, Пол С. (2005). «Тенденции в энергии ионизации элементов переходных металлов». Журнал химического образования . 82 (11): 1660. Бибкод : 2005ЖЧЭд..82.1660М . дои : 10.1021/ed082p1660 .
- ^ Хоган, К. Майкл (2010). «Хэви-метал» в Энциклопедии Земли . Национальный совет по науке и окружающей среде. Э. Моноссон и К. Кливленд (ред.), Вашингтон, округ Колумбия.
- ^ Оргель, Л.Е. (1966). Введение в химию переходных металлов, теория поля лигандов (2-е изд.). Лондон: Метуэн.
- ^ Протченко Андрей Владимирович; Данге, Дипак; Хармер, Джеффри Р.; Тан, Кристина Ю.; Шварц, Эндрю Д.; Келли, Майкл Дж.; Филлипс, Николас; Тирфоин, Реми; Бирджкумар, Кришна Хасомал; Джонс, Кэмерон; Кальцояннис, Николас; Маунтфорд, Филип; Олдридж, Саймон (16 февраля 2014 г.). «Стабильные радикалы GaX 2 , InX 2 и TlX 2 ». Природная химия . 6 (4): 315–319. Бибкод : 2014НатЧ...6..315П . дои : 10.1038/nchem.1870 . ПМИД 24651198 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 . п. 240
- ^ Фиггис, Б.Н.; Льюис, Дж. (1960). Льюис, Дж.; Уилкинс, Р.Г. (ред.). Магнитохимия сложных соединений . Современная координационная химия. Нью-Йорк: Wiley Interscience. стр. 400–454.
- ^ Ковач К.А., Гроф П., Бурай Л., Ридель М. (2004). «Пересмотр механизма перманганатно-оксалатной реакции». Дж. Физ. хим. А. 108 (50): 11026–11031. Бибкод : 2004JPCA..10811026K . дои : 10.1021/jp047061u .