Жирная кислота
| Виды жиров в продуктах питания |
|---|
| Компоненты |
| Промышленные жиры |
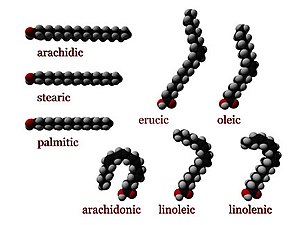
В химии , особенно в биохимии , жирная кислота представляет собой карбоновую кислоту с алифатической цепью, которая может быть насыщенной или ненасыщенной . Большинство встречающихся в природе жирных кислот имеют неразветвленную цепь из четного числа атомов углерода, от 4 до 28. [1] Жирные кислоты являются основным компонентом липидов (до 70% по массе) у некоторых видов, таких как микроводоросли. [2] но у некоторых других организмов они не встречаются в отдельной форме, а существуют в виде трех основных классов сложных эфиров : триглицеридов , фосфолипидов и эфиров холестерина . В любой из этих форм жирные кислоты являются одновременно важными пищевыми источниками топлива для животных и важными структурными компонентами клеток .
История
[ редактировать ]Понятие жирных кислот ( acid gras ) было введено в 1813 году Мишелем Эженом Шеврёлем . [3] [4] [5] хотя первоначально он использовал несколько вариантов терминов: graisse acid и acide huileux («кислотный жир» и «маслянистая кислота»). [6]
Виды жирных кислот
[ редактировать ]
Жирные кислоты классифицируются по-разному: по длине, по насыщенности и ненасыщенности, по четному и нечетному содержанию углерода, а также по линейному и разветвленному.
Длина жирных кислот
[ редактировать ]- Короткоцепочечные жирные кислоты (КЦЖК) представляют собой жирные кислоты с алифатическими хвостами из пяти или менее атомов углерода (например, масляная кислота ). [7]
- Жирные кислоты со средней длиной цепи (MCFA) представляют собой жирные кислоты с алифатическими хвостами от 6 до 12. [8] атомы углерода, которые могут образовывать триглицериды со средней длиной цепи .
- Длинноцепочечные жирные кислоты (ДЦЖК) представляют собой жирные кислоты с алифатическими хвостами, состоящими из 13–21 атома углерода. [9]
- Жирные кислоты с очень длинной цепью (VLCFA) представляют собой жирные кислоты с алифатическими хвостами, состоящими из 22 или более атомов углерода.
Насыщенные жирные кислоты
[ редактировать ]Насыщенные жирные кислоты не имеют двойных связей C=C. Они имеют формулу CH 3 (CH 2 ) n COOH, для разных n . Важная насыщенная жирная кислота — стеариновая кислота ( n = 16), которая при нейтрализации гидроксидом натрия представляет собой наиболее распространенную форму мыла .

| Общее имя | Химическая структура | С : Д [а] |
|---|---|---|
| Каприловая кислота | СН3 ( СН2 ) 66СООН | 8:0 |
| Каприновая кислота | СН3 ( СН2 ) 88СООН | 10:0 |
| Лауриновая кислота | СН 3 (СН 2 ) 10 СООН | 12:0 |
| Миристиновая кислота | СН 3 (СН 2 ) 12 СООН | 14:0 |
| Пальмитиновая кислота | СН 3 (СН 2 ) 14 СООН | 16:0 |
| Стеариновая кислота | СН3 ( СН2 ) 1616СООН | 18:0 |
| Арахиновая кислота | СН 3 (СН 2 ) 18 СООН | 20:0 |
| Бегеновая кислота | СН 3 (СН 2 ) 20 СООН | 22:0 |
| Лигноцериновая кислота | СН 3 (СН 2 ) 22 СООН | 24:0 |
| Церотовая кислота | СН 3 (СН 2 ) 24 СООН | 26:0 |
Ненасыщенные жирные кислоты
[ редактировать ]Ненасыщенные жирные кислоты имеют одну или несколько двойных связей C=C . Двойные связи C=C могут давать как цис- , так и транс- изомеры.
- цис
- Цис - конфигурация означает, что два атома водорода, прилегающие к двойной связи, располагаются на одной стороне цепи. Жесткость двойной связи замораживает ее конформацию, а в случае цис- изомера вызывает изгиб цепи и ограничивает конформационную свободу жирной кислоты. Чем больше двойных связей имеет цепь в цис- конфигурации, тем меньшей гибкостью она обладает. Когда цепь имеет много цис- связей, она становится весьма изогнутой в наиболее доступных конформациях. Например, олеиновая кислота с одной двойной связью имеет «излом», тогда как линолевая кислота с двумя двойными связями имеет более выраженный изгиб. α-линоленовая кислота с тремя двойными связями предпочитает крючковидную форму. Результатом этого является то, что в ограниченных средах, например, когда жирные кислоты являются частью фосфолипида в липидном бислое или триглицеридов в липидных каплях, цис-связи ограничивают способность жирных кислот плотно упаковываться и, следовательно, могут влиять на плавление. температура мембраны или жира. Однако цис-ненасыщенные жирные кислоты повышают текучесть клеточных мембран, тогда как трансненасыщенные жирные кислоты этого не делают.
- транс
- Транс - конфигурация, напротив, означает, что два соседних атома водорода лежат на противоположных сторонах цепи. В результате они не вызывают сильного изгиба цепи, а их форма аналогична прямым насыщенным жирным кислотам.
В большинстве встречающихся в природе ненасыщенных жирных кислот каждая двойная связь имеет три ( n-3 ), шесть ( n-6 ) или девять ( n-9 ) атомов углерода после нее, и все двойные связи имеют цис-конфигурацию. Большинство жирных кислот в транс -конфигурации ( трансжиры ) не встречаются в природе и являются результатом переработки человеком (например, гидрогенизации ). Некоторые трансжирные кислоты также встречаются в природе в молоке и мясе жвачных животных (например, крупного рогатого скота и овец). Они производятся путем ферментации в рубце этих животных. Они также обнаружены в молочных продуктах из молока жвачных животных, а также могут быть обнаружены в грудном молоке женщин, которые получили их из своего рациона.
Геометрические различия между различными типами ненасыщенных жирных кислот, а также между насыщенными и ненасыщенными жирными кислотами играют важную роль в биологических процессах и в построении биологических структур (например, клеточных мембран).
| Общее имя | Химическая структура | Д х [б] | С : Д [а] | ИЮПАК [10] | п - х [с] |
|---|---|---|---|---|---|
| Миристолеиновая кислота | СН 3 (СН 2 ) 3 СН=СН (СН 2 ) 7 СООН | цис -D 9 | 14:1 | 14:1(9) | п -5 |
| Пальмитолеиновая кислота | СН 3 (СН 2 ) 5 СН=СН (СН 2 ) 7 СООН | цис -D 9 | 16:1 | 16:1(9) | п -7 |
| Сапиеновая кислота | СН 3 (СН 2 ) 8 СН=СН (СН 2 ) 4 СООН | цис -D 6 | 16:1 | 16:1(6) | п -10 |
| Олеиновая кислота | СН 3 (СН 2 ) 7 СН=СН (СН 2 ) 7 СООН | цис -D 9 | 18:1 | 18:1(9) | п -9 |
| Элаидиновая кислота | СН 3 (СН 2 ) 7 СН=СН (СН 2 ) 7 СООН | транс -Д 9 | 18:1 | 18:1(9т) | п -9 |
| Вакценовая кислота | СН 3 (СН 2 ) 5 СН=СН (СН 2 ) 9 СООН | транс -Д 11 | 18:1 | 18:1(11т) | п -7 |
| Линолевая кислота | СН 3 (СН 2 ) 4 СН=СН СН 2 СН=СН (СН 2 ) 7 СООН | цис , цис -Δ 9 , Д 12 | 18:2 | 18:2(9,12) | п -6 |
| Линоэлаидиновая кислота | СН 3 (СН 2 ) 4 СН=СН СН 2 СН=СН (СН 2 ) 7 СООН | транс , транс -Δ 9 , Д 12 | 18:2 | 18:2(9т,12т) | п -6 |
| α-линоленовая кислота | СН 3 СН 2 СН=СН СН 2 СН=СН СН 2 СН=СН (СН 2 ) 7 СООН | цис , цис , цис -Δ 9 , Д 12 , Д 15 | 18:3 | 18:3(9,12,15) | п -3 |
| Арахидоновая кислота | СН 3 (СН 2 ) 4 СН=СН СН 2 СН=СН СН 2 СН=СН СН 2 СН=СН (СН 2 ) 3 СООН НИСТ | цис , цис , цис , цис -Δ 5 Д 8 , Д 11 , Д 14 | 20:4 | 20:4(5,8,11,14) | п -6 |
| Эйкозапентаеновая кислота | СН 3 СН 2 СН=СН СН 2 СН=СН СН 2 СН=СН СН 2 СН=СН СН 2 СН=СН (СН 2 ) 3 СООН | цис , цис , цис , цис , цис -Δ 5 , Д 8 , Д 11 , Д 14 , Д 17 | 20:5 | 20:5(5,8,11,14,17) | п -3 |
| Эруковая кислота | СН 3 (СН 2 ) 7 СН=СН (СН 2 ) 11 СООН | цис -D 13 | 22:1 | 22:1(13) | п -9 |
| Докозагексаеновая кислота | СН 3 СН 2 СН=СН СН 2 СН=СН СН 2 СН= 2 СН СН 2 СН=СН СН СН =СН СН 2 СН =СН (СН 2 ) 2 СООН | цис , цис , цис , цис , цис , цис -Δ 4 , Д 7 , Д 10 , Д 13 , Д 16 , Д 19 | 22:6 | 22:6(4,7,10,13,16,19) | п -3 |
Четно- и нечетноцепочечные жирные кислоты
[ редактировать ]Большинство жирных кислот имеют четную цепь, например стеариновая (C18) и олеиновая (C18), что означает, что они состоят из четного числа атомов углерода. Некоторые жирные кислоты имеют нечетное число атомов углерода; их называют жирными кислотами с нечетной цепью (OCFA). Наиболее распространенными OCFA являются насыщенные производные C15 и C17, пентадекановая кислота и гептадекановая кислота соответственно, которые содержатся в молочных продуктах. [11] [12] На молекулярном уровне OCFA биосинтезируются и метаболизируются несколько иначе, чем их родственники с четными цепями.
Ветвление
[ редактировать ]Наиболее распространенные жирные кислоты представляют собой соединения с прямой цепью , без дополнительных атомов углерода, связанных в качестве боковых групп с основной углеводородной цепью. Жирные кислоты с разветвленной цепью содержат одну или несколько метильных групп, связанных с углеводородной цепью.
Номенклатура
[ редактировать ]Нумерация атомов углерода
[ редактировать ]
Большинство встречающихся в природе жирных кислот имеют неразветвленную цепь атомов углерода с карбоксильной группой (–COOH) на одном конце и метильной группой (–CH3) на другом конце.
Положение каждого атома углерода в основной цепи жирной кислоты обычно указывается путем отсчета от 1 на конце -COOH. Число углерода x часто обозначается сокращением C- x (или иногда C x ), где x = 1, 2, 3 и т. д. Это схема нумерации, рекомендованная IUPAC .
Другое соглашение использует буквы греческого алфавита последовательно, начиная с первого атома углерода после карбоксильной группы. Таким образом, углерод α ( альфа ) — это C-2, углерод β ( бета ) — это C-3 и так далее.
Хотя жирные кислоты могут иметь разную длину, согласно этому второму соглашению последний углерод в цепи всегда обозначается как ω ( омега ), что является последней буквой греческого алфавита. Третье соглашение о нумерации считает атомы углерода с этого конца, используя метки «ω», «ω-1», «ω-2». Альтернативно, метка «ω- x » пишется как «n- x », где «n» означает количество атомов углерода в цепи. [д]
В любой схеме нумерации положение двойной связи в цепи жирной кислоты всегда указывается путем указания метки углерода, ближайшего к карбоксильному концу. [д] Таким образом, в 18-углеродной жирной кислоте двойная связь между C-12 (или ω-6) и C-13 (или ω-5) находится «в» положении C-12 или ω-6. Название кислоты по ИЮПАК, такое как «октадек-12-еновая кислота» (или более произносимый вариант «12-октадекановая кислота»), всегда основано на нумерации «C».
Обозначение ∆ х , у ,... традиционно используется для обозначения жирной кислоты с двойными связями в положениях x , y ,.... (Заглавная греческая буква «Δ» ( дельта ) соответствует римской «D», обозначающей двойную связь). Так, например, 20-углеродная арахидоновая кислота представляет собой Δ 5,8,11,14 Это означает, что он имеет двойные связи между атомами углерода 5 и 6, 8 и 9, 11 и 12, а также 14 и 15.
В контексте рациона человека и жирового обмена ненасыщенные жирные кислоты часто классифицируются по положению двойной связи, ближайшей к ω-углероду (только), даже в случае множественных двойных связей, таких как незаменимые жирные кислоты . Таким образом, линолевая кислота (18 атомов углерода, Δ 9,12 ), γ-линоленовая кислота ( 18-углерод, Δ 6,9,12 ) и арахидоновая кислота (20-углеродная, Δ 5,8,11,14 ) все классифицируются как жирные кислоты «ω-6»; это означает, что их формула заканчивается на –CH=CH– CH.
2 – СН
2 – СН
2 – СН
2 – СН
3 .
Жирные кислоты с нечетным числом атомов углерода называются жирными кислотами с нечетной цепью , тогда как остальные являются жирными кислотами с четной цепью. Это различие имеет отношение к глюконеогенезу .
Название жирных кислот
[ редактировать ]В следующей таблице описаны наиболее распространенные системы наименования жирных кислот.
| Номенклатура | Примеры | Объяснение |
|---|---|---|
| Тривиальный | Пальмитолеиновая кислота | Тривиальные имена (или нарицательные имена ) — это несистематические исторические имена, которые являются наиболее частой системой именования, используемой в литературе. Большинство распространенных жирных кислот помимо систематических названий имеют тривиальные названия (см. ниже). Эти имена часто не соответствуют какому-либо шаблону, но они кратки и часто недвусмысленны. |
| Систематический | цис-9-октадек-9-еновая кислота (9 Z )-октадек-9-еновая кислота | Систематические названия (или ИЮПАК названия ) происходят из стандартных Правил ИЮПАК по номенклатуре органической химии , опубликованных в 1979 году. [13] наряду с рекомендацией, опубликованной специально для липидов в 1977 году. [14] Нумерация атомов углерода начинается с карбоксильного конца основной цепи молекулы. Двойные связи обозначаются цис- / транс - нотацией или E- / Z -нотацией, где это необходимо. Эта номенклатура обычно более многословна, чем обычная номенклатура, но имеет то преимущество, что она более технически понятна и наглядна. |
| Д х | цис -D 9 , цис -D 12 октадекадиеновая кислота | В Д х (или дельта -х ) В номенклатуре каждая двойная связь обозначается Δ. х , где двойная связь начинается с x- й связи углерод-углерод, считая от карбоксильного конца основной цепи молекулы. Каждой двойной связи предшествует цис- или транс -префикс, указывающий конфигурацию молекулы вокруг связи. Например, линолевая кислота обозначается « цис -Δ 9 , цис -D 12 октадекадиеновая кислота». Эта номенклатура имеет то преимущество, что она менее многословна, чем систематическая номенклатура, но не является более технически ясной или описательной. [ нужна ссылка ] |
| п - х (или ω− x ) | п -3 (или ω−3 ) | n - x ( n минус x ; также ω- x или omega- x ) Номенклатура дает названия отдельным соединениям и классифицирует их по вероятным биосинтетическим свойствам у животных. Двойная связь расположена на х. й связь углерод-углерод, считая от метильного конца основной цепи молекулы. Например, α-линоленовая кислота классифицируется как жирная кислота n -3 или омега-3 , и поэтому она, вероятно, имеет общий путь биосинтеза с другими соединениями этого типа. Обозначения ω− x , omega- x или «omega» широко распространены в популярной литературе по питанию, но IUPAC отказался от них в пользу обозначения n — x в технических документах. [13] Наиболее часто исследуемыми путями биосинтеза жирных кислот являются n -3 и n -6 . |
| Липидные числа | 18:3 18:3н3 18:3, цис , цис , цис -Δ 9 , Д 12 , Д 15 18:3(9,12,15) | Липидные числа принимают вид C : D , [а] где C — количество атомов углерода в жирной кислоте, а D — количество двойных связей в жирной кислоте. Если D больше единицы, предполагается, что двойные связи прерваны CH. 2 единицы , т. е . с интервалом в 3 атома углерода вдоль цепи. Например, α-линоленовая кислота представляет собой жирную кислоту с соотношением 18:3, и ее три двойные связи расположены в положениях Δ. 9 , Д 12 , и ∆ 15 . Это обозначение может быть неоднозначным, поскольку некоторые разные жирные кислоты могут иметь одинаковые номера C : D . Следовательно, когда существует неоднозначность, это обозначение обычно сочетается либо с Δ х или n - x термин. [13] Например, хотя соотношение α-линоленовой кислоты и γ-линоленовой кислоты составляет 18:3, их можно однозначно описать как жирные кислоты 18:3n3 и 18:3n6 соответственно. С той же целью ИЮПАК рекомендует использовать список позиций двойных связей в круглых скобках, добавляемый к обозначению C:D. [10] Например, рекомендованные ИЮПАК обозначения для α- и γ-линоленовой кислоты составляют 18:3(9,12,15) и 18:3(6,9,12) соответственно. |
Свободные жирные кислоты
[ редактировать ]Циркулируя эфира в плазме (жирные кислоты плазмы), а не в виде своего , жирные кислоты известны как неэстерифицированные жирные кислоты (НЭЖК) или свободные жирные кислоты (СЖК). СЖК всегда связаны с транспортным белком , таким как альбумин . [15]
СЖК также образуются из триглицеридов пищевых масел и жиров путем гидролиза, что приводит к характерному прогорклому запаху. [16] Аналогичный процесс происходит в биодизеле с риском коррозии деталей.
Производство
[ редактировать ]Промышленный
[ редактировать ]Жирные кислоты обычно производятся в промышленности путем гидролиза триглицеридов Олеохимикаты с удалением глицерина (см. ) . Фосфолипиды представляют собой еще один источник. Некоторые жирные кислоты получают синтетическим путем гидрокарбоксилирования алкенов. [17]
Животные
[ редактировать ]У животных жирные кислоты образуются из углеводов преимущественно в печени , жировой ткани и молочных железах в период лактации. [18]
Углеводы превращаются в пируват путем гликолиза , что является первым важным шагом в превращении углеводов в жирные кислоты. [18] Затем пируват декарбоксилируется с образованием ацетил-КоА в митохондриях . Однако этот ацетил-КоА необходимо транспортировать в цитозоль , где происходит синтез жирных кислот. Это не может произойти напрямую. Чтобы получить цитозольный ацетил-КоА, цитрат (полученный конденсацией ацетил-КоА с оксалоацетатом ) удаляется из цикла лимонной кислоты и переносится через внутреннюю митохондриальную мембрану в цитозоль. [18] Там он расщепляется АТФ-цитратлиазой на ацетил-КоА и оксалоацетат. Оксалоацетат возвращается в митохондрии в виде малата . [19] Цитозольный ацетил-КоА карбоксилируется ацетил-КоА-карбоксилазой с образованием малонил-КоА , что является первой стадией синтеза жирных кислот. [19] [20]
Затем малонил-КоА участвует в повторяющейся серии реакций, которые удлиняют растущую цепь жирной кислоты на два атома углерода за раз. Таким образом, почти все природные жирные кислоты имеют четное число атомов углерода. Когда синтез завершен, свободные жирные кислоты почти всегда соединяются с глицерином (три жирные кислоты на одну молекулу глицерина) с образованием триглицеридов , основной формы хранения жирных кислот и, следовательно, энергии у животных. Однако жирные кислоты также являются важными компонентами фосфолипидов , которые образуют фосфолипидные бислои , из которых построены все мембраны клетки ( клеточная стенка и мембраны, окружающие все органеллы внутри клетки, такие как ядро , митохондрии , эндоплазматическая сеть и аппарат Гольджи ). [18]
«Некомбинированные жирные кислоты» или «свободные жирные кислоты», обнаруженные в кровообращении животных, образуются в результате распада (или липолиза ) накопленных триглицеридов. [18] [21] Поскольку они нерастворимы в воде, эти жирные кислоты транспортируются в связанном виде с альбумином плазмы . Уровни «свободных жирных кислот» в крови ограничены наличием мест связывания альбумина. Их могут забирать из крови все клетки, имеющие митохондрии (за исключением клеток центральной нервной системы ). Жирные кислоты могут расщепляться только в митохондриях путем бета-окисления с последующим сжиганием в цикле лимонной кислоты до CO 2 и воды. Клетки центральной нервной системы, хотя и обладают митохондриями, не могут забирать свободные жирные кислоты из крови, поскольку гематоэнцефалический барьер непроницаем для большинства свободных жирных кислот. [ нужна ссылка ] за исключением жирных кислот с короткой цепью и жирных кислот со средней длиной цепи . [22] [23] Эти клетки должны производить свои собственные жирные кислоты из углеводов, как описано выше, чтобы производить и поддерживать фосфолипиды своих клеточных мембран и органелл. [18]
Различия между видами животных
[ редактировать ]Исследования клеточных мембран млекопитающих обнаружили , и рептилий что клеточные мембраны млекопитающих состоят из более высокой доли полиненасыщенных жирных кислот ( DHA , жирные кислоты омега-3 ), чем у рептилий . [24] Исследования состава жирных кислот птиц выявили аналогичные пропорции с млекопитающими, но с содержанием жирных кислот омега-3 на 1/3 меньше по сравнению с омега-6 для данного размера тела. [25] Такой состав жирных кислот приводит к созданию более жидкой клеточной мембраны, но при этом проницаемой для различных ионов ( ЧАС + & Уже + ), в результате чего содержание клеточных мембран становится более дорогостоящим. Утверждается, что эти затраты на техническое обслуживание являются одной из ключевых причин высокой скорости метаболизма и сопутствующей теплокровности млекопитающих и птиц. [24] Однако полиненасыщение клеточных мембран может также возникать в ответ на хронические низкие температуры. У рыб все более холодная среда приводит к увеличению содержания в клеточных мембранах как мононенасыщенных, так и полиненасыщенных жирных кислот, что позволяет поддерживать большую текучесть (и функциональность) мембран при более низких температурах . [26] [27]
Жирные кислоты в пищевых жирах
[ редактировать ]В следующей таблице представлен состав жирных кислот, витамина Е и холестерина некоторых распространенных пищевых жиров. [28] [29]
| Насыщенный | Мононенасыщенные | Полиненасыщенные | Холестерин | Витамин Е | |
|---|---|---|---|---|---|
| г/100г | г/100г | г/100г | мг/100 г | мг/100 г | |
| Животные жиры | |||||
| Утиный жир [30] | 33.2 | 49.3 | 12.9 | 100 | 2.70 |
| Сало [30] | 40.8 | 43.8 | 9.6 | 93 | 0.60 |
| сальный [30] | 49.8 | 41.8 | 4.0 | 109 | 2.70 |
| Масло | 54.0 | 19.8 | 2.6 | 230 | 2.00 |
| Растительные жиры | |||||
| Кокосовое масло | 85.2 | 6.6 | 1.7 | 0 | .66 |
| Какао-масло | 60.0 | 32.9 | 3.0 | 0 | 1.8 |
| Пальмоядровое масло | 81.5 | 11.4 | 1.6 | 0 | 3.80 |
| Пальмовое масло | 45.3 | 41.6 | 8.3 | 0 | 33.12 |
| Хлопковое масло | 25.5 | 21.3 | 48.1 | 0 | 42.77 |
| Масло зародышей пшеницы | 18.8 | 15.9 | 60.7 | 0 | 136.65 |
| Соевое масло | 14.5 | 23.2 | 56.5 | 0 | 16.29 |
| Оливковое масло | 14.0 | 69.7 | 11.2 | 0 | 5.10 |
| Кукурузное масло | 12.7 | 24.7 | 57.8 | 0 | 17.24 |
| Подсолнечное масло | 11.9 | 20.2 | 63.0 | 0 | 49.00 |
| Сафлоровое масло | 10.2 | 12.6 | 72.1 | 0 | 40.68 |
| Конопляное масло | 10 | 15 | 75 | 0 | 12.34 |
| Масло канолы/рапсовое | 5.3 | 64.3 | 24.8 | 0 | 22.21 |
Реакции жирных кислот
[ редактировать ]Жирные кислоты вступают в реакции, как и другие карбоновые кислоты, т.е. подвергаются этерификации и кислотно-основным реакциям.
Кислотность
[ редактировать ]Жирные кислоты не демонстрируют больших различий в своей кислотности, на что указывает их pKa значение . соответствующее нонановая кислота Например, имеет ap K a 4,96, что лишь немного слабее, чем у уксусной кислоты (4,76). По мере увеличения длины цепи растворимость жирных кислот в воде снижается, так что жирные кислоты с более длинной цепью оказывают минимальное влияние на pH водного раствора. При нейтральном pH жирные кислоты существуют в форме сопряженных оснований, например, олеата и т. д.
Растворы жирных кислот в этаноле можно титровать раствором гидроксида натрия , используя фенолфталеин в качестве индикатора. Этот анализ используется для определения содержания свободных жирных кислот в жирах; т.е. доля гидролизованных триглицеридов .
Нейтрализация жирных кислот, одна из форм омыления (приготовление мыла), является широко практикуемым способом получения металлического мыла . [31]
Гидрирование и закалка
[ редактировать ]Гидрирование ненасыщенных жирных кислот широко практикуется. Типичные условия включают давление H 2 2,0–3,0 МПа , температуру 150 °C и никель на кремнеземе в качестве катализатора. Эта обработка дает насыщенные жирные кислоты. Степень гидрирования обозначается йодным числом . Гидрогенизированные жирные кислоты менее склонны к прогорканию . Поскольку насыщенные жирные кислоты имеют более высокую температуру плавления , чем ненасыщенные предшественники, этот процесс называется отверждением. Соответствующая технология используется для переработки растительных масел в маргарин . Гидрирование триглицеридов (по сравнению с жирными кислотами) выгодно, поскольку карбоновые кислоты разлагают никелевые катализаторы, образуя никелевые мыла. В ходе частичного гидрирования ненасыщенные жирные кислоты могут изомеризоваться из цис-конфигурации в транс -конфигурацию. [17]
Более интенсивное гидрирование, т.е. использование более высокого давления H 2 и более высоких температур, превращает жирные кислоты в жирные спирты . Однако жирные спирты легче получить из эфиров жирных кислот .
В реакции Варрентраппа некоторые ненасыщенные жирные кислоты расщепляются в расплавленной щелочи, и эта реакция когда-то имела отношение к выяснению структуры.
Автоокисление и прогоркание
[ редактировать ]Ненасыщенные жирные кислоты и их эфиры подвергаются автоокислению , которое включает замену связи CH на связь CO. Процесс требует кислорода (воздуха) и ускоряется наличием следов металлов, которые служат катализаторами. Дважды ненасыщенные жирные кислоты особенно склонны к этой реакции. Растительные масла в небольшой степени противостоят этому процессу, поскольку содержат антиоксиданты, такие как токоферол . Жиры и масла часто обрабатывают хелатирующими агентами, такими как лимонная кислота, для удаления металлических катализаторов.
Озонолиз
[ редактировать ]Ненасыщенные жирные кислоты подвержены разложению под действием озона. Эту реакцию практикуют при производстве азелаиновой кислоты ((CH 2 ) 7 (CO 2 H) 2 ) из олеиновой кислоты . [17]
Тираж
[ редактировать ]Пищеварение и всасывание
[ редактировать ]Жирные кислоты с короткой и средней длиной цепи всасываются непосредственно в кровь через капилляры кишечника и проходят через воротную вену, как и другие всасываемые питательные вещества. Однако длинноцепочечные жирные кислоты не попадают непосредственно в капилляры кишечника. Вместо этого они впитываются жировыми стенками ворсинок кишечника и снова собираются в триглицериды . Триглицериды покрыты холестерином и белком (белковая оболочка) в соединение, называемое хиломикроном .
Изнутри клетки хиломикрон попадает в лимфатический капилляр, называемый млечным , который сливается с более крупными лимфатическими сосудами. Он транспортируется через лимфатическую систему и грудной проток к сердцу (где артерии и вены крупнее). Грудной проток выводит хиломикроны в кровоток через левую подключичную вену . На этом этапе хиломикроны могут транспортировать триглицериды в ткани, где они хранятся или метаболизируются для получения энергии.
Метаболизм
[ редактировать ]Жирные кислоты расщепляются до CO 2 внутриклеточными митохондриями и воды посредством бета-окисления и цикла лимонной кислоты . На заключительном этапе ( окислительное фосфорилирование ) реакции с кислородом выделяют много энергии, захватываемой в виде большого количества АТФ . Многие типы клеток могут использовать для этой цели либо глюкозу , либо жирные кислоты, но жирные кислоты выделяют больше энергии на грамм. Жирные кислоты (поступающие либо с пищей, либо с использованием триглицеридов, хранящихся в жировых тканях) распределяются по клеткам и служат топливом для мышечных сокращений и общего метаболизма.
Незаменимые жирные кислоты
[ редактировать ]Жирные кислоты, которые необходимы для хорошего здоровья, но не могут быть получены в достаточном количестве из других субстратов и поэтому должны поступать из пищи, называются незаменимыми жирными кислотами. Существует две серии незаменимых жирных кислот: одна имеет двойную связь на расстоянии трех атомов углерода от метильного конца; другой имеет двойную связь в шести атомах углерода от метильного конца. У людей отсутствует способность вводить двойные связи в жирных кислотах за пределами атомов углерода 9 и 10, если считать со стороны карбоновой кислоты. [32] Двумя незаменимыми жирными кислотами являются линолевая кислота (LA) и альфа-линоленовая кислота (ALA). Эти жирные кислоты широко распространены в растительных маслах. Человеческий организм имеет ограниченную способность превращать АЛК в длинноцепочечные жирные кислоты омега-3 — эйкозапентаеновую кислоту (ЭПК) и докозагексаеновую кислоту (ДГК), которые также можно получить из рыбы. омега-3 и омега-6 Жирные кислоты являются биосинтетическим предшественником эндоканнабиноидов, обладающих антиноцицептивными , анксиолитическими и нейрогенными свойствами. [33]
Распределение
[ редактировать ]Жирные кислоты крови принимают различные формы на разных этапах кровообращения. Они всасываются через кишечник в виде хиломикронов , но также существуют в виде липопротеинов очень низкой плотности (ЛПОНП) и липопротеинов низкой плотности (ЛПНП) после обработки в печени. Кроме того, при высвобождении из адипоцитов жирные кислоты существуют в крови в виде свободных жирных кислот .
Предполагается, что смесь жирных кислот, выделяемых кожей млекопитающих, вместе с молочной и пировиноградной кислотами , специфична и позволяет животным с острым обонянием различать особей. [34]
Кожа
[ редактировать ]– Роговой слой самый внешний слой эпидермиса – состоит из терминально дифференцированных и энуклеированных корнеоцитов внутри липидного матрикса. [35] Вместе с холестерином и церамидами свободные жирные кислоты образуют водонепроницаемый барьер, предотвращающий потерю воды с испарением . [35] Обычно эпидермальный липидный матрикс состоит из эквимолярной смеси церамидов (около 50% по массе), холестерина (25%) и свободных жирных кислот (15%). [35] Насыщенные жирные кислоты длиной 16 и 18 атомов углерода являются доминирующими типами в эпидермисе. [35] [36] при этом также присутствуют ненасыщенные жирные кислоты и насыщенные жирные кислоты различной длины. [35] [36] Относительное содержание различных жирных кислот в эпидермисе зависит от участка тела, который покрывает кожа. [36] Существуют также характерные изменения жирных кислот эпидермиса, которые возникают при псориазе , атопическом дерматите и других воспалительных состояниях . [35] [36]
Анализ
[ редактировать ]Химический анализ жирных кислот в липидах обычно начинается со стадии переэтерификации , которая расщепляет их исходные эфиры (триглицериды, воски, фосфолипиды и т. д.) и превращает их в метиловые эфиры, которые затем разделяются газовой хроматографией. [37] или анализируется с помощью газовой хроматографии и спектроскопии среднего инфракрасного диапазона .
Разделение ненасыщенных изомеров возможно с помощью тонкослойной хроматографии, дополненной ионами серебра . [38] Другие методы разделения включают высокоэффективную жидкостную хроматографию (с короткими колонками, заполненными силикагелем со связанными группами фенилсульфоновой кислоты, атомы водорода которых заменены на ионы серебра). Роль серебра заключается в его способности образовывать комплексы с ненасыщенными соединениями.
Промышленное использование
[ редактировать ]Жирные кислоты в основном используются при производстве мыла , как в косметических целях, так и, в случае металлического мыла , в качестве смазочных материалов. Жирные кислоты также превращаются через свои метиловые эфиры в жирные спирты и жирные амины , которые являются предшественниками поверхностно-активных веществ, моющих средств и смазочных материалов. [17] Другие применения включают их использование в качестве эмульгаторов , текстурирующих агентов, смачивающих агентов, пеногасителей или стабилизирующих агентов. [39]
Эфиры жирных кислот с более простыми спиртами (такими как метил-, этил-, н-пропил-, изопропил- и бутиловые эфиры) используются в качестве смягчающих средств в косметике и других продуктах личной гигиены, а также в качестве синтетических смазок. Эфиры жирных кислот с более сложными спиртами, такими как сорбит , этиленгликоль , диэтиленгликоль и полиэтиленгликоль , употребляются в пищу, используются для ухода за собой и очистки воды, а также используются в качестве синтетических смазок или жидкостей для металлообработки.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с «C:D» — числовой символ: общее количество атомов углерода (C) жирной кислоты и количество двойных ( ненасыщенных ) связей (D) в ней; если D > 1, предполагается, что двойные связи разделены одним или несколькими метиленовыми мостиками .
- ^ Каждая двойная связь в жирной кислоте обозначается Δx, где двойная связь расположена на x-й связи углерод-углерод, считая от конца карбоновой кислоты.
- ^ В номенклатуре n минус x (также ω-x или омега-x) двойная связь жирной кислоты расположена на x-й связи углерод-углерод, считая от концевого метильного углерода (обозначаемого как n или ω) в сторону карбонильного углерода. .
- ^ Jump up to: а б с Распространенной ошибкой является утверждение, что последний углерод — это «ω-1».
Другая распространенная ошибка — утверждать, что позиция связи в омега-нотации — это номер атома углерода, ближайшего к КОНЦУ.
В случае двойных облигаций эти две ошибки компенсируют друг друга; так что жирная кислота «ω-3» действительно имеет двойную связь между 3-м и 4-м атомами углерода с конца, считая метил за 1.
Однако для замен и других целей они этого не делают: гидроксил «в ω-3» находится на углероде 15 (4-й с конца), а не 16. См., например, эту статью. дои : 10.1016/0005-2760(75)90089-2
Также обратите внимание, что «-» в записи омеги является знаком минус, а «ω-3» в принципе следует читать «омега минус три». Однако очень часто (особенно в ненаучной литературе) его пишут «ω-3» (через дефис/тире) и читают как «омега-три». См., например, Карен Дули (2008), Омега-3 жирные кислоты и диабет .
- ^ Мосс, врач общей практики; Смит, PAS; Тавернье, Д. (1997). «Сборник химической терминологии ИЮПАК» . Чистая и прикладная химия . 67 (8–9). Международный союз чистой и прикладной химии: 1307–1375. дои : 10.1351/pac199567081307 . S2CID 95004254 . Проверено 31 октября 2007 г.
- ^ Чен, Линь (2012). «Производство биодизеля из масла водорослей с высоким содержанием свободных жирных кислот путем двухэтапной каталитической конверсии». Биоресурсные технологии . 111 : 208–214. doi : 10.1016/j.biortech.2012.02.033 . ПМИД 22401712 .
- ^ Шеврёль, Мэн (1813 г.). «О некоторых жирных веществах и особенно о их соединениях со щелочами» . Анналы химии . 88 . Париж: Х. Перронно: 225–261 – через Галлику.
- ^ Шеврёль, Мэн (1823 г.). Химические исследования жировых веществ животного происхождения . Париж: Левро - через Интернет-архив.
- ^ Лере, Клод (11 ноября 2017 г.). «Хронологическая история липидоведения» . Киберлипидный центр . Архивировано из оригинала 6 октября 2017 г.
- ^ Ментен П., изд. (2013). Химический словарь: этимологический и исторический подход . Брюссель: Де Бек.
- ^ Сифуэнтес, Алехандро, изд. (18 марта 2013 г.). «Микробные метаболиты в кишечнике человека». Фудомика: передовая масс-спектрометрия в современной пищевой науке и питании . Джон Уайли и сыновья, 2013. ISBN. 978-1-118-16945-2 .
- ^ Рот, Карл С. (19 декабря 2013 г.). «Дефицит ацил-КоА-дегидрогеназы средней цепи» . Медскейп .
- ^ Берманн, К.; Елинек, Дж.; Райнекер, Т.; Хауеншильд, А.; Бём, Г.; Клёр, Х.-У. (2003). «Краткосрочное воздействие пищевых среднецепочечных жирных кислот и n -3 длинноцепочечных полиненасыщенных жирных кислот на жировой обмен у здоровых добровольцев» . Липиды в здоровье и болезни . 2:10 . дои : 10.1186/1476-511X-2-10 . ПМЦ 317357 . ПМИД 14622442 .
- ^ Jump up to: а б «Номенклатура липидов ИЮПАК: Приложение А: названия и символы высших жирных кислот» . www.sbcs.qmul.ac.uk.
- ^ Пфайффер, Мария; Яудсус, Анке (2016). «Пентадекановая и гептадекановая кислоты: многогранные жирные кислоты с нечетной цепью» . Достижения в области питания . 7 (4): 730–734. дои : 10.3945/ан.115.011387 . ПМЦ 4942867 . ПМИД 27422507 .
- ^ Смит, С. (1994). «Синтаза жирных кислот животных: один ген, один полипептид, семь ферментов» . Журнал ФАСЭБ . 8 (15): 1248–1259. дои : 10.1096/fasebj.8.15.8001737 . ПМИД 8001737 . S2CID 22853095 .
- ^ Jump up to: а б с Ригоди, Дж.; Клесни, СП (1979). Номенклатура органической химии . Пергамон . ISBN 978-0-08-022369-8 . OCLC 5008199 .
- ^ «Номенклатура липидов. Рекомендации, 1976 г.» . Европейский журнал биохимии . 79 (1): 11–21. 1977. doi : 10.1111/j.1432-1033.1977.tb11778.x .
- ^ Иллюстрированный медицинский словарь Дорланда . Эльзевир .
- ^ Мариод, Абдалбасит; Омер, Нуха; Ал, Эль Мугдад; Мохтар, Мохаммед (9 сентября 2014 г.). «Химические реакции, происходящие во время жарки во фритюре, и продукты из нее: обзор» . Суданский университет науки и технологий SUST Журнал естественных и медицинских наук . Дополнительный выпуск: 1–17.
- ^ Jump up to: а б с д Аннекен, Дэвид Дж.; Оба, Сабина; Кристоф, Ральф; Фиг, Джордж; Штайнбернер, Удо; Вестфехтель, Альфред (2006). «Жирные кислоты». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a10_245.pub2 . ISBN 978-3527306732 .
- ^ Jump up to: а б с д и ж Страйер, Люберт (1995). «Обмен жирных кислот». Биохимия (4-е изд.). Нью-Йорк: WH Freeman and Company. стр. 603–628. ISBN 978-0-7167-2009-6 .
- ^ Jump up to: а б Ферре, П.; Фуфель, Ф. (2007). «Фактор транскрипции SREBP-1c и липидный гомеостаз: клиническая перспектива» . Гормональные исследования . 68 (2): 72–82. дои : 10.1159/000100426 . ПМИД 17344645 .
этот процесс графически представлен на стр. 73.
- ^ Воэт, Дональд; Воэт, Джудит Г.; Пратт, Шарлотта В. (2006). Основы биохимии (2-е изд.). Джон Уайли и сыновья. стр. 547, 556 . ISBN 978-0-471-21495-3 .
- ^ Зехнер, Р.; Штраус, Дж. Г.; Хеммерле, Г.; Ласс, А.; Циммерманн, Р. (2005). «Липолиз: путь в разработке». Курс. Мнение. Липидол . 16 (3): 333–340. дои : 10.1097/01.мол.0000169354.20395.1c . ПМИД 15891395 . S2CID 35349649 .
- ^ Цудзи А (2005). «Малогомолекулярный перенос лекарств через гематоэнцефалический барьер через транспортные системы, опосредованные переносчиками» . НейроРкс . 2 (1): 54–62. дои : 10.1602/neurorx.2.1.54 . ПМК 539320 . ПМИД 15717057 .
Поглощение вальпроевой кислоты снижалось в присутствии жирных кислот со средней длиной цепи, таких как гексаноат, октаноат и деканоат, но не пропионата или бутирата, что указывает на то, что вальпроевая кислота попадает в мозг через систему транспорта жирных кислот со средней длиной цепи. , а не жирные кислоты с короткой цепью. ... На основании этих сообщений считается, что вальпроевая кислота транспортируется в двух направлениях между кровью и мозгом через ГЭБ с помощью двух различных механизмов: переносчиков, чувствительных к монокарбоновой кислоте, и переносчиков, чувствительных к среднецепочечным жирным кислотам, для оттока и поглощения соответственно.
- ^ Виджей Н., Моррис М.Э. (2014). «Роль переносчиков монокарбоксилатов в доставке лекарств в мозг» . Курс. Фарм. Дес . 20 (10): 1487–98. дои : 10.2174/13816128113199990462 . ПМК 4084603 . ПМИД 23789956 .
Известно, что переносчики монокарбоксилатов (MCT) опосредуют транспорт короткоцепочечных монокарбоксилатов, таких как лактат, пируват и бутират. ... MCT1 и MCT4 также связаны с транспортом короткоцепочечных жирных кислот, таких как ацетат и формиат, которые затем метаболизируются в астроцитах [78].
- ^ Jump up to: а б Халберт А.Дж., Эльзе П.Л. (август 1999 г.). «Мембраны как возможные водители ритма обмена веществ». Журнал теоретической биологии . 199 (3): 257–74. Бибкод : 1999JThBi.199..257H . дои : 10.1006/jtbi.1999.0955 . ПМИД 10433891 .
- ^ Халберт А.Дж., Фолкс С., Баттемер В.А., Эльс П.Л. (ноябрь 2002 г.). «Ацильный состав мышечных мембран варьируется в зависимости от размера тела птиц». Журнал экспериментальной биологии . 205 (Часть 22): 3561–9. дои : 10.1242/jeb.205.22.3561 . ПМИД 12364409 .
- ^ Халберт А.Дж. (июль 2003 г.). «Жизнь, смерть и бислои мембран» . Журнал экспериментальной биологии . 206 (Часть 14): 2303–11. дои : 10.1242/jeb.00399 . ПМИД 12796449 .
- ^ Рейнард Р.С., Коссинс А.Р. (май 1991 г.). «Гомеовязкая адаптация и термокомпенсация натриевого насоса эритроцитов форели». Американский журнал физиологии . 260 (5, часть 2): R916–24. дои : 10.1152/ajpregu.1991.260.5.R916 . ПМИД 2035703 . S2CID 24441498 .
- ^ Макканн; Уиддоусон; Агентство по пищевым стандартам (1991). «Жиры и масла». Состав продуктов питания . Королевское химическое общество.
- ^ Алтарь, Тед. «Больше, чем вы хотели знать о жирах и маслах» . Сандэнс Натуральные продукты. Архивировано из оригинала 5 декабря 2010 г. Проверено 31 августа 2006 г.
- ^ Jump up to: а б с «Национальная база данных по питательным веществам Министерства сельского хозяйства США для стандартных справок» . Министерство сельского хозяйства США. Архивировано из оригинала 3 марта 2015 г. Проверено 17 февраля 2010 г.
- ^ Шуман, Клаус; Зикманн, Курт (2000). «Мыло». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a24_247 . ISBN 978-3527306732 .
- ^ Болсовер, Стивен Р.; и др. (15 февраля 2004 г.). Клеточная биология: краткий курс . Джон Уайли и сыновья. стр. 42 и далее. ISBN 978-0-471-46159-3 .
- ^ Рамсден, Кристофер Э.; Самора, Дейзи; Макрияннис, Александрос ; Вуд, ДжодиЭнн Т.; Манн, Дж. Дуглас; Фаурот, Кетура Р.; Макинтош, Бет А.; Майчрзак-Хонг, Шэрон Ф.; Гросс, Джеклин Р. (август 2015 г.). «Вызванные диетой изменения в эндоканнабиноидах, производных n-3 и n-6, и уменьшение головной боли и психологического стресса» . Журнал боли . 16 (8): 707–716. дои : 10.1016/j.jpain.2015.04.007 . ISSN 1526-5900 . ПМЦ 4522350 . ПМИД 25958314 .
- ^ «Электронный нос создан для обнаружения паров кожи» . Наука Дейли . 21 июля 2009 года . Проверено 18 мая 2010 г.
- ^ Jump up to: а б с д и ж Нокс, Софи; О'Бойл, Ниам М. (2021). «Липиды кожи в здоровье и заболеваниях: обзор» . Химия и физика липидов . 236 : 105055. doi : 10.1016/j.chemphyslip.2021.105055 . ISSN 0009-3084 . ПМИД 33561467 . S2CID 231864420 .
- ^ Jump up to: а б с д Мерлеев Александр Александрович; Ле, Стефани Т.; Алексанян, Клэр; и др. (22 августа 2022 г.). «Биогеографические и специфические для заболевания изменения в составе эпидермальных липидов и одноклеточный анализ акральных кератиноцитов» . JCI-инсайт . 7 (16): e159762. doi : 10.1172/jci.insight.159762 . ISSN 2379-3708 . ПМЦ 9462509 . ПМИД 35900871 .
- ^ Айспуруа-Олайсола О, Ормазабаль М, Вальехо А, Оливарес М, Наварро П, Эчебарриа Н и др. (январь 2015 г.). «Оптимизация сверхкритической жидкостной последовательной экстракции жирных кислот и полифенолов из отходов винограда Vitis vinifera». Журнал пищевой науки . 80 (1): Е101-7. дои : 10.1111/1750-3841.12715 . ПМИД 25471637 .
- ^ Брейер, Б.; Штулфаут, Т.; Фок, HP (1987). «Разделение жирных кислот или метиловых эфиров, включая позиционные и геометрические изомеры, методом тонкослойной хроматографии с аргентированием оксида алюминия». Журнал хроматографической науки . 25 (7): 302–6. дои : 10.1093/chromsci/25.7.302 . ПМИД 3611285 .
- ^ «Жирные кислоты: строительные блоки для промышленности» (PDF) . www.aciscience.org . Американский институт очистки. Архивировано (PDF) из оригинала 23 апреля 2018 г. Проверено 22 апреля 2018 г.