Тиол

В органической тиол θ ( / ˈ l aɪ ɒ / ; химии [1] от древнегреческого θεῖον (theion) « сера ». [2] ), или тиоловое производное , представляет собой любое сероорганическое соединение формы R-SH , где R представляет собой алкил или другой органический заместитель . -SH Функциональная группа сама по себе называется либо тиоловой группой , либо сульфгидрильной группой , либо сульфанильной группой . Тиолы являются серным аналогом спиртов (т.е. сера заменяет кислород в гидроксиле ( −OH ) группа спирта), а слово представляет собой смесь слов « тио- » и «спирт».
Многие тиолы имеют резкий запах, напоминающий запах чеснока или тухлых яиц. Тиолы используются в качестве одорантов для обнаружения природного газа (который в чистом виде не имеет запаха), а «запах природного газа» обусловлен запахом тиола, используемого в качестве одоранта. Тиолы иногда называют меркаптанами ( / m ər ˈ k æ p t æ n / ) [3] или меркаптосоединения , [4] [5] [6] термин, введенный в 1832 году Уильямом Кристофером Зейзе и происходящий от латинского mercurio captāns («улавливающий ртуть»). [7] потому что тиолатная группа ( РС − ) очень прочно связывается с соединениями ртути . [8]
Структура и связь
[ редактировать ]Тиолы, имеющие структуру R-SH, в которой алкильная группа (R) присоединена к сульфгидрильной группе (SH), называются алкантиолами или алкилтиолами . [9] Тиолы и спирты имеют сходную связь. Поскольку атомы серы больше атомов кислорода, длины связей C-S — обычно около 180 пикометров — примерно на 40 пикометров длиннее, чем типичные связи C-O. Углы C-S-H приближаются к 90 °, тогда как угол для группы C-O-H более тупой. В твердых телах и жидкостях водородные связи между отдельными тиоловыми группами слабы, причем основной силой сцепления являются ван-дер-ваальсовые взаимодействия между высокополяризуемыми центрами двухвалентной серы.
Связь S-H намного слабее, чем связь OH, что отражается в соответствующих энергиях диссоциации связей (BDE). Для CH 3 S-H БДЭ составляет 366 кДж/моль (87 ккал/моль), а для CH 3 O-H БДЭ составляет 440 кДж/моль (110 ккал/моль). [10]
Связь S-H умеренно полярна из-за небольшой разницы в электроотрицательности серы и водорода. Напротив, связи OH в гидроксильных группах более полярны. Тиолы имеют меньший дипольный момент по сравнению с соответствующими спиртами.
Номенклатура
[ редактировать ]Существует несколько способов названия алкилтиолов:
- суффикс -тиол К названию алкана добавляется . Этот метод почти идентичен названию спирта и используется ИЮПАК , например, CH 3 SH будет метантиолом .
- Слово меркаптан заменяет спирт в названии эквивалентного спиртового соединения. Пример: CH 3 SH будет метилмеркаптаном, так же как CH 3 OH называется метиловым спиртом.
- Термин сульфгидрил- или меркапто- используется в качестве префикса, например меркаптопурин .
Физические свойства
[ редактировать ]Запах
[ редактировать ]Многие тиолы имеют сильный запах, напоминающий запах чеснока . Запахи тиолов, особенно низкомолекулярных, часто бывают сильными и отталкивающими. Спрей скунсов состоит в основном из низкомолекулярных тиолов и их производных. [11] [12] [13] [14] [15] Эти соединения обнаруживаются человеческим носом в концентрациях всего 10 частей на миллиард. [16] Человеческий пот содержит ( R )/( S )-3-метил-3-меркапто-1-ол (MSH), содержание которого определяется в концентрации 2 части на миллиард и имеет фруктовый луковый запах. (Метилтио)метантиол (MeSCH 2 SH; MTMT) представляет собой летучий тиол с сильным запахом, который также обнаруживается на уровне частей на миллиард и обнаруживается в моче самцов мышей . Лоуренс К. Кац и его коллеги показали, что MTMT действует как семиохимическое вещество , активируя определенные обонятельные сенсорные нейроны мышей и привлекая самок мышей . [17] Было показано, что медь необходима специфическому обонятельному рецептору мыши, MOR244-3, который очень чувствителен к MTMT, а также к различным другим тиолам и родственным соединениям. [18] обонятельный рецептор человека, OR2T11 Идентифицирован , который в присутствии меди очень чувствителен к одорантам газа (см. ниже), этантиолу и т -бутилмеркаптану, а также к другим низкомолекулярным тиолам, включая аллилмеркаптан, обнаруженный в организме человека. чесночное дыхание и сильно пахнущий циклический сульфид тиетан . [19]
Тиолы также ответственны за класс винных дефектов , вызванных непреднамеренной реакцией между серой и дрожжами и «вонючим» запахом пива, подвергшегося воздействию ультрафиолета.
Не все тиолы имеют неприятный запах. Например, фуран-2-илметантиол придает аромат жареного кофе , тогда как меркаптан грейпфрута , монотерпеноидный тиол, отвечает за характерный аромат грейпфрута . Эффект последнего соединения присутствует только при низких концентрациях. Чистый меркаптан имеет неприятный запах.
В Соединенных Штатах дистрибьюторы природного газа были вынуждены добавлять тиолы, первоначально этантиол , в природный газ (который, естественно, не имеет запаха) после смертельного взрыва в Нью-Лондонской школе в Нью-Лондоне, штат Техас , в 1937 году. это событие. Большинство используемых в настоящее время одорантов газа содержат смеси меркаптанов и сульфидов, при этом т -бутилмеркаптан является основным компонентом запаха в природном газе и этантиолом в сжиженном нефтяном газе (СНГ, пропан). [20] В ситуациях, когда тиолы используются в коммерческой промышленности, например, в цистернах для сжиженного нефтяного газа и системах погрузки-разгрузки, окислительный катализатор для уничтожения запаха используется . Катализатор окисления на основе меди нейтрализует летучие тиолы и превращает их в инертные продукты.
Точки кипения и растворимость
[ редактировать ]Тиолы слабо связаны водородными связями как с молекулами воды, так и между собой. Следовательно, они имеют более низкие температуры кипения и менее растворимы в воде и других полярных растворителях, чем спирты с аналогичной молекулярной массой. По этой же причине тиолы и соответствующие изомеры их сульфидных функциональных групп имеют сходные характеристики растворимости и температуры кипения, тогда как этого нельзя сказать о спиртах и соответствующих им изомерных простых эфирах.
Склеивание
[ редактировать ]Связь S-H в тиолах слаба по сравнению со связью O-H в спиртах. Для CH 3 X−H энтальпии связи составляют 365,07 ± 2,1 ккал/моль для X = S и 440,2 ± 3,0 ккал/моль для X = O. [21] Отделение атома водорода от тиола дает тиильный радикал с формулой RS • , где R = алкил или арил.
Характеристика
[ редактировать ]Летучие тиолы легко и почти безошибочно обнаруживаются по характерному запаху. Полезны анализаторы серы для газовых хроматографов . Спектроскопическими индикаторами являются D 2 O -обменный сигнал SH в 1 Спектр ЯМР Н ( 33 S является ЯМР -активным, но сигналы для двухвалентной серы очень широки и малополезны. [22] ). Полоса ν SH появляется вблизи 2400 см-1. −1 в ИК спектре . [4] В реакции нитропруссида свободные тиоловые группы реагируют с нитропруссидом натрия и гидроксидом аммония , образуя красный цвет.
Подготовка
[ редактировать ]В промышленности метантиол получают реакцией сероводорода с метанолом . Этот метод используется для промышленного синтеза метантиола :
- CH 3 OH + H 2 S → CH 3 SH + H 2 O
Такие реакции проводятся в присутствии кислотных катализаторов. Другой основной путь получения тиолов включает присоединение сероводорода к алкенам . Такие реакции обычно проводятся в присутствии кислотного катализатора или УФ-света. галогенидов с использованием подходящего органического галогенида и гидросульфида натрия. Также использовалось замещение [23]
Другой метод предполагает алкилирование гидросульфида натрия .
- RX + NaSH → RSH + NaX (X = Cl, Br, I)
Этот метод используется для производства тиогликолевой кислоты из хлоруксусной кислоты .
Лабораторные методы
[ редактировать ]В целом в типичном лабораторном масштабе прямая реакция галогеналкана с гидросульфидом натрия неэффективна из-за конкурирующего образования сульфидов. Вместо этого алкилгалогениды превращаются в тиолы посредством S -алкилирования тиомочевины . Этот многостадийный однореакторный процесс протекает через посредство изотиурониевой соли , которая гидролизуется на отдельной стадии: [24] [25]
- CH 3 CH 2 Br + SC(NH 2 ) 2 → [CH 3 CH 2 SC(NH 2 ) 2 ]Br
- [CH 3 CH 2 SC(NH 2 ) 2 ]Br + NaOH → CH 3 CH 2 SH + OC(NH 2 ) 2 + NaBr
Путь тиомочевины хорошо работает с первичными галогенидами, особенно с активированными. Вторичные и третичные тиолы получить труднее. Вторичные тиолы можно получить из кетона через соответствующие дитиокетали . [26] Родственный двухстадийный процесс включает алкилирование тиосульфата с образованием тиосульфоната (« соль Бунте ») с последующим гидролизом. Метод иллюстрируется одним синтезом тиогликолевой кислоты :
- ClCH 2 CO 2 H + Na 2 S 2 O 3 → Na[O 3 S 2 CH 2 CO 2 H] + NaCl
- Na[O 3 S 2 CH 2 CO 2 H] + H 2 O → HSCH 2 CO 2 H + NaHSO 4
Литийорганические соединения и реактивы Гриньяра реагируют с серой с образованием тиолатов, которые легко гидролизуются: [27]
- РЛи + С → РСЛи
- RSLi + HCl → RSH + LiCl
Фенолы можно превратить в тиофенолы путем перегруппировки их O -арилдиалкилтиокарбаматов. [28]
Тиолы получают восстановительным деалкилированием сульфидов, особенно бензильных производных и тиоацеталей. [29]
Тиофенолы получают путем S -арилирования или замены уходящей группы диазония сульфгидрильным анионом (SH − ): [30] [31]
- АрН +
2 + Ш − → АрШ + Н 2
Реакции
[ редактировать ]Подобно химии спиртов, тиолы образуют сульфиды , тиоацетали и тиоэфиры , которые аналогичны простым эфирам , ацеталям и сложным эфирам соответственно. Тиолы и спирты также сильно различаются по своей реакционной способности: тиолы легче окисляются, чем спирты. Тиолаты являются более сильными нуклеофилами, чем соответствующие алкоксиды .
S -Алкилирование
[ редактировать ]Тиолы, или, точнее, сопряженные с ними основания, легко алкилируются с образованием сульфидов:
- RSH + R’Br + B → RSR’ + [HB]Br (B = основание)
Кислотность
[ редактировать ]Тиолы легко депротонируются. [32] По сравнению со спиртами тиолы более кислые. Сопряженное основание тиола называется тиолатом . Бутантиол имеет P K a 10,5 против 15 у бутанола. Тиофенол имеет p K a 6 по сравнению с 10 для фенола . Сильнокислым тиолом является пентафтортиофенол (C 6 F 5 SH) с ap K a 2,68. Так, тиолаты можно получить из тиолов обработкой гидроксидами щелочных металлов.

Редокс
[ редактировать ]Тиолы, особенно в присутствии основания, легко окисляются такими реагентами, как бром и йод, с образованием органического дисульфида (R-S-S-R).
- 2 R−SH + Br 2 → R−S−S−R + 2 HBr
Окисление более мощными реагентами, такими как гипохлорит натрия или перекись водорода, также может давать сульфоновые кислоты (RSO 3 H).
- R−SH + 3 H 2 O 2 → RSO 3 H + 3 H 2 O
Окисление может осуществляться также кислородом в присутствии катализаторов: [33]
- 2 Р–Ш + 1 ⁄ 2 О 2 → RS−SR + Н 2 О
Тиолы участвуют в тиол-дисульфидном обмене:
- RS-SR + 2 R'SH → 2 RSH + R'S-SR'
Эта реакция важна в природе.
Комплексообразование ионов металлов
[ редактировать ]С ионами металлов тиолаты ведут себя как лиганды, образуя тиолатные комплексы переходных металлов . Термин «меркаптан» происходит от латинского mercurium captans (улавливающий ртуть). [7] потому что тиолатная группа очень прочно связана с соединениями ртути . Согласно теории «жесткая/мягкая кислота/основание» (HSAB) , сера является относительно мягким (поляризующимся) атомом. Это объясняет склонность тиолов связываться с мягкими элементами и ионами, такими как ртуть, свинец или кадмий. Стабильность тиолатов металлов аналогична стабильности соответствующих сульфидных минералов.
Тиоксантогенаты
[ редактировать ]Тиолаты реагируют с сероуглеродом с образованием тиоксантогената ( RSCS −
2 ).
Тиильные радикалы
[ редактировать ]Свободные радикалы, производные меркаптанов, называемые тиильными радикалами , обычно используются для объяснения реакций в органической химии и биохимии . У них есть формула RS • где R представляет собой органический заместитель, такой как алкил или арил . [6] Они возникают или могут генерироваться разными путями, но основным методом является абстракция атома водорода от тиолов. Другой метод включает гомолиз органических дисульфидов. [34] В биологии тиильные радикалы ответственны за образование дезоксирибонуклеиновых кислот, строительных блоков ДНК . Это превращение катализируется рибонуклеотидредуктазой (см. рисунок). [35] Тиильные промежуточные соединения также производятся путем окисления глутатиона , антиоксиданта в биологии. Тиильные радикалы (сероцентрированные) могут превращаться в углеродцентрированные радикалы посредством водорода обмена атомов равновесия . Образование углеродцентрированных радикалов может привести к повреждению белка за счет образования связей C -C или фрагментации основной цепи. [36]
Из-за слабости связи S-H тиолы могут действовать как поглотители свободных радикалов . [37]
Биологическое значение
[ редактировать ]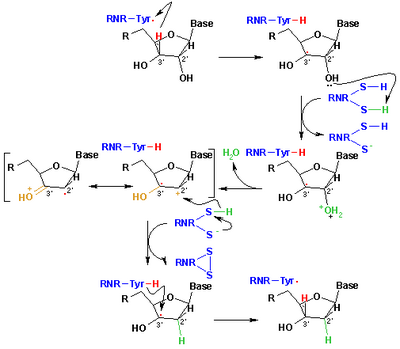
Цистеин и цистин
[ редактировать ]Как функциональная группа аминокислоты цистеина , тиоловая группа играет очень важную роль в биологии. Когда тиоловые группы двух остатков цистеина (как в мономерах или составляющих единицах) приближаются друг к другу в ходе сворачивания белка , реакция окисления может привести к образованию цистиновой единицы с дисульфидной связью (-S-S-). белка, Дисульфидные связи могут вносить вклад в третичную структуру если цистеины являются частью одной и той же пептидной цепи, или вносить вклад в четвертичную структуру многозвенных белков, образуя довольно прочные ковалентные связи между различными пептидными цепями. Физическое проявление цистеин-цистинового равновесия обеспечивают технологии выпрямления волос . [38]
Сульфгидрильные группы в активном центре фермента также могут образовывать нековалентные связи фермента с субстратом , способствуя ковалентной каталитической активности в каталитических триадах . Остатки цистеина в активном центре являются функциональной единицей цистеиновых протеаз каталитических триад . Остатки цистеина также могут реагировать с ионами тяжелых металлов (Zn 2+ , компакт-диск 2+ , Пб 2+ , ртуть 2+ , Аг + ) из-за высокого сродства между мягким сульфидом и мягким металлом (см. твердые и мягкие кислоты и основания ). Это может деформировать и инактивировать белок и является одним из механизмов отравления тяжелыми металлами .
Препараты, содержащие тиоловую группу 6-меркаптопурин (противораковые) Каптоприл (антигипертензивное) D-пеницилламин (противоартритный) Натрия ауротиолат (противоартритное) [39]
Кофакторы
[ редактировать ]Многие кофакторы (небелковые вспомогательные молекулы) содержат тиолы. Биосинтез и деградация жирных кислот и родственных длинноцепочечных углеводородов проводятся на каркасе, который закрепляет растущую цепь с помощью тиоэфира, полученного из тиолового коэнзима А. Биосинтез коферментом метана М , основного углеводорода на Земле, происходит в результате реакции, опосредованной , 2-меркаптоэтилсульфоновой кислотой. Тиолаты, сопряженные основания, полученные из тиолов, образуют прочные комплексы со многими ионами металлов, особенно с теми, которые относятся к мягким. Стабильность тиолатов металлов аналогична стабильности соответствующих сульфидных минералов.
В скунсах
[ редактировать ]Защитный спрей скунсов состоит в основном из низкомолекулярных тиолов и их производных с неприятным запахом, что защищает скунса от хищников. Совы способны охотиться на скунсов, так как у них отсутствует обоняние. [40]
Примеры тиолов
[ редактировать ]- Метантиол – CH 3 SH [метилмеркаптан]
- Этантиол – C 2 H 5 SH [этилмеркаптан]
- 1-Пропантиол – C 3 H 7 SH [ н -пропилмеркаптан]
- 2-Пропантиол – CH 3 CH(SH)CH 3 [2C3 меркаптан]
- Аллилмеркаптан – CH 2 =CHCH 2 SH [2-пропентиол]
- Бутантиол – C 4 H 9 SH [ н -бутилмеркаптан]
- трет -Бутилмеркаптан – (CH 3 ) 3 CSH [ т -бутилмеркаптан]
- Пентантиолы – C 5 H 11 SH [пентилмеркаптан]
- Тиофенол – C 6 H 5 SH
- Димеркаптоянтарная кислота
- Тиоуксусная кислота
- Коэнзим А
- Глутатион
- Металлотионеин
- Цистеин
- 2-меркаптоэтанол
- Дитиотреитол / дитиоэритрит ( эпимерная пара)
- 2-меркаптоиндол
- Грейпфрутовый меркаптан
- Фуран-2-илметантиол
- 3-Меркаптоппропан-1,2-диол
- 3-Меркапто-1-пропансульфоновая кислота
- 1-гексадекантиол
- Пентахлорбензолтиол
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Справочник по словарю : тиол. Архивировано 11 апреля 2013 г. в Wayback Machine.
- ^ θεῖον. Архивировано 10 мая 2017 г. в Wayback Machine , Генри Джордж Лидделл, Роберт Скотт, Греко-английский лексикон.
- ^ Справочный словарь : меркаптан. Архивировано 13 ноября 2012 г. в Wayback Machine.
- ^ Перейти обратно: а б Патай, Саул, изд. (1974). Химия тиоловой группы. Часть 1 . Лондон: Уайли. дои : 10.1002/9780470771310 . ISBN 9780470771310 .
- ^ Патай, Саул, изд. (1974). Химия тиоловой группы. Часть 2 . Лондон: Уайли. дои : 10.1002/9780470771327 . ISBN 9780470771327 .
- ^ Перейти обратно: а б Р. Дж. Кремлин (1996). Введение в сероорганическую химию . Чичестер: Джон Уайли и сыновья. ISBN 978-0-471-95512-2 .
- ^ Перейти обратно: а б Оксфордские американские словари ( Mac OS X Leopard ).
- ^ См.:
- Зейзе, Уильям Кристофер (1834). «Меркаптан, с замечаниями о некоторых других новых продуктах солей этилгидросульфата, а также тяжелого винного масла посредством сероводорода». Труды Датского королевского общества наук . 4-я серия (на датском языке). 6 :1–70. На стр. 13 придумано слово «меркаптан».
- Немецкий перевод: Цейзе, туалет (1834 г.). «Меркаптан» вместе с комментариями о некоторых новых продуктах воздействия сероводорода на соли этилсульфата ((C 2 H 5 ) HSO 4 ) и тяжелого винного масла (смесь диэтилсульфита, диэтилсульфита и полимеризованного этилена) ]. Анналы физики и химии . 2-я серия (на немецком языке). 31 (24): 369–431. Из стр. 378: «...вещество, [которое] поглощается ртутью, я называю « меркаптум (от : тело » (вещество) [которое] было поглощено ртутью)… )
- Немецкий перевод перепечатан в: Цейзе, туалет (1834 г.). «Меркаптан, а также замечания о некоторых других новых продуктах действия серно-винных солей, а также тяжелого винного масла на сульфурит» . Журнал практической химии . 1 (1): 257–268, 345–356, 396–413, 457–475. дои : 10.1002/prac.18340010154 .
- Краткое изложение: Цейзе, WC (1834 г.). «Ueber das Mercaptan» [О меркаптане]. Аннален дер Аптека . 11 (1): 1–10. дои : 10.1002/jlac.18340110102 . Архивировано из оригинала 20 марта 2015 г.
- Зейзе, Уильям Кристофер (1834). «Sur le mercaptan; avec des Observations sur d’autres produits resultant de l’action des sulfovinates ainsi que de l’huile de vin, sur des sulfores metalliques» [О меркаптане; с наблюдениями за другими продуктами, образующимися в результате действия сульфовинатов [обычно этилгидросульфата], а также винного масла [смесь диэтилсульфата и полимеров этилена] на сульфиды металлов]. Annales de Chimie et de Physique . 56 : 87–97. Архивировано из оригинала 20 марта 2015 г. «Меркаптан» (этилтиол) был открыт в 1834 году датским профессором химии Уильямом Кристофером Зейзе (1789–1847). Он назвал его «меркаптан», сокращение от «corpus mercurio captans» (вещество, улавливающее ртуть) [с. 88], поскольку он бурно реагировал с оксидом ртути(II) («деутоксид ртути») [с. 92].
- Статья в Annales de Chimie et de Physique (1834 г.) была переведена с немецкой статьи: Цейзе, туалет (1834 г.). «Меркаптан вместе с замечаниями о некоторых новых продуктах действия сульфертов на соли винной серной кислоты и на винное масло» . Анналы физики и химии . 107 (27): 369–431. Бибкод : 1834АнП...107..369З . дои : 10.1002/andp.18341072402 . Архивировано из оригинала 20 марта 2015 г.
- ^ «Алкантиолы» . Королевское химическое общество . Проверено 4 сентября 2019 г.
- ^ Лиде, Дэвид Р., изд. (2006). Справочник CRC по химии и физике (87-е изд.). Бока-Ратон, Флорида: CRC Press . ISBN 0-8493-0487-3 .
- ^ Андерсен К.К.; Бернштейн Д.Т. (1978). «Некоторые химические составляющие запаха полосатого скунса ( Mephitis mephitis )». Журнал химической экологии . 1 (4): 493–499. дои : 10.1007/BF00988589 . S2CID 9451251 .
- ^ Андерсен К.К., Бернштейн Д.Т.; Бернштейн (1978). «1-Бутантиол и полосатый скунс». Журнал химического образования . 55 (3): 159–160. Бибкод : 1978JChEd..55..159A . дои : 10.1021/ed055p159 .
- ^ Андерсен К.К.; Бернштейн Д.Т.; Карет Р.Л.; Романчик Л.Дж.-младший (1982). «Химические составляющие защитного секрета полосатого скунса ( Mephitis mephitis )». Тетраэдр . 38 (13): 1965–1970. дои : 10.1016/0040-4020(82)80046-X .
- ^ Вуд ВФ; Соллерс Б.Г.; Драгу Г.А.; Драгу Дж.В. (2002). «Летучие компоненты защитного спрея от скунса с капюшоном, Mephitis macroura ». Журнал химической экологии . 28 (9): 1865–70. дои : 10.1023/A:1020573404341 . ПМИД 12449512 . S2CID 19217201 .
- ^ Уильям Ф. Вуд. «Химия спрея Skunk» . Кафедра химии Государственного университета имени Гумбольдта . Архивировано из оригинала 8 октября 2010 года . Проверено 2 января 2008 г.
- ^ Олдрич, ТБ (1896 г.). «Химическое исследование секрета анальных желез Mephitis mephitiga (обыкновенного скунса) с замечаниями о физиологических свойствах этого секрета» . Дж. Эксп. Мед . 1 (2): 323–340. дои : 10.1084/jem.1.2.323 . ПМК 2117909 . ПМИД 19866801 .
- ^ Лин, Дайю; Чжан, Шаочжун; Блок, Эрик; Кац, Лоуренс К. (2005). «Кодирование социальных сигналов в главной обонятельной луковице мыши». Природа . 434 (7032): 470–477. Бибкод : 2005Natur.434..470L . дои : 10.1038/nature03414 . ПМИД 15724148 . S2CID 162036 .
- ^ Дуань, Сюйфан; Блок, Эрик; Ли, Чжэнь; Коннелли, Тимоти; Чжан, Цзянь; Хуан, Чжиминь; Су, Сюбо; Пан, Йи; и др. (2012). «Решающая роль меди в обнаружении одорантов, координирующих металлы» . Учеб. Натл. акад. наук. США . 109 (9): 3492–3497. Бибкод : 2012PNAS..109.3492D . дои : 10.1073/pnas.1111297109 . ПМК 3295281 . ПМИД 22328155 .
- ^ «Медный ключ к нашей чувствительности к неприятному запаху тухлых яиц» . chemistryworld.com . Архивировано из оригинала 10 мая 2017 года . Проверено 3 мая 2018 г.
- ^ Робертс, Дж. С., изд. (1997). Энциклопедия химической технологии Кирка-Отмера . Вайнхайм: Wiley-VCH. [ нужна страница ]
- ^ Луо, Ю.-Р.; Ченг, Ж.-П. (2017). «Энергии диссоциации связей». В JR Rumble (ред.). Справочник по химии и физике . ЦРК Пресс.
- ^ Мэн, Паскаль П. «Ссылки на ЯМР серы-33» . www.pascal-man.com . Архивировано из оригинала 23 августа 2017 года . Проверено 3 мая 2018 г.
- ^ Джон С. Робертс, «Тиолы», в Энциклопедии химической технологии Кирка-Отмера , 1997, Wiley-VCH, Вайнхайм. два : 10.1002/0471238961.2008091518150205.a01
- ^ Специале, AJ (1963). «Этандитиол» . Органические синтезы ; Сборник томов , т. 4, с. 401 ..
- ^ Уркарт, Г.Г.; Гейтс, JW младший; Коннор, Ральф (1941). « Н -Додецил Меркаптан». Орг. Синтез . 21:36 . дои : 10.15227/orgsyn.021.0036 .
- ^ С.Р. Уилсон, Г.М. Георгиадис (1990). «Мекаптаны из тиокеталей: циклододецилмеркаптан» . Органические синтезы ; Сборник томов , т. 7, с. 124 ..
- ^ Э. Джонс и И. М. Муди (1990). «2-Тиофентиол» . Органические синтезы ; Сборник томов , т. 6, с. 979 ..
- ^ Мелвин С. Ньюман и Фредерик В. Хетцель (1990). «Тиофенолы из фенолов: 2-нафталинтиол» . Органические синтезы ; Сборник томов , т. 6, с. 824 ..
- ^ Элиэль, Эрнест Л.; Линч, Джозеф Э.; Куме, Фумитака; Фрай, Стивен В. (1993). «Хиральный 1,3-оксатиан из (+)-пулегона: гексагидро-4,4,7-триметил- 4H -1,3-бензоксатиин» . Органические синтезы ; Сборник томов , т. 8, с. 302 .
- ^ Казем-Ростами, Масуд; Хазаи, Ардешир; Мусави-Заре, Ахмад; Баят, Мохаммед; Саедния, Шахназ (2012). «Новый однореакторный синтез тиофенолов из родственных триазенов в мягких условиях». Синлетт . 23 (13): 1893–1896. дои : 10.1055/s-0032-1316557 . S2CID 196805424 .
- ^ Лейкарт, Рудольф (1890). «Новый метод получения ароматических меркаптанов» . Журнал практической химии . 2-я серия (на немецком языке). 41 : 179–224. дои : 10.1002/prac.18900410114 .
- ^ МЕ Алонсо; Х. Арагона (1978). «Синтез сульфидов при получении несимметричных диалкилдисульфидов: втор-бутилизопропилдисульфид». Орг. Синтез . 58 : 147. дои : 10.15227/orgsyn.058.0147 .
- ^ Ахмадуллина, А.Г.; Кижаев Б.В.; Нургалиева, ГМ; Хрущева И.К.; Шабаева А.С.; и др. (1993). «Гетерогенно-каталитическая демеркаптизация легкого углеводородного сырья» . Химия и технология топлив и масел . 29 (3): 108–109. дои : 10.1007/bf00728009 . S2CID 97292021 . Архивировано из оригинала 15 августа 2011 г.
- ^ Рой, Катрин-Мария (2005). «Тиолы и органические сульфиды». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a26_767 . ISBN 978-3527306732 .
- ^ Стуббе, Джоанн; Ночера, Дэниел Г.; Да, Кирилл С.; Чанг, Мишель Сай (2003). «Радикальная инициация рибонуклеотидредуктазы класса I: перенос электронов с протонами на большие расстояния?». хим. Преподобный . 103 (6): 2167–2202. дои : 10.1021/cr020421u . ПМИД 12797828 .
- ^ Хофстеттер, Дастин; Наузер, Томас; Коппенол, Виллем Х. (2010). «Равновесия водородного обмена в глутатионовых радикалах: константы скорости» . Хим. рез . 23 (10): 1596–1600. дои : 10.1021/tx100185k . ПМЦ 2956374 . ПМИД 20882988 .
- ^ Кох, Кэмерон Дж.; Парламент, Мэтью Б.; Браун, Дж. Мартин; Уртасун, Рауль К. (2010). «Химические модификаторы радиационной реакции». Учебник Лейбеля и Филлипса по радиационной онкологии . Эльзевир. стр. 55–68. дои : 10.1016/b978-1-4160-5897-7.00004-4 . ISBN 978-1-4160-5897-7 .
Сульфгидрилы являются поглотителями свободных радикалов, защищая от химического повреждения, вызванного ионизирующим излучением или алкилирующими агентами.
- ^ Рис, Урри; и др. (2011). Кэмпбелл Биология (Девятое изд.). Нью-Йорк: Пирсон Бенджамин Каммингс. стр. 65 , 83.
- ^ Малле, Э (2007). «Миелопероксидаза: цель для разработки новых лекарств?» . Британский журнал фармакологии . 152 (6): 838–854. дои : 10.1038/sj.bjp.0707358 . ПМК 2078229 . ПМИД 17592500 .
- ^ «Понимание сов – The Owls Trust» . theowlstrust.org . Архивировано из оригинала 5 февраля 2018 года . Проверено 3 мая 2018 г.
Внешние ссылки
[ редактировать ]- Меркаптаны (или тиолы) в Периодической таблице видео (Ноттингемский университет)
- Применение, свойства и синтез ω-функционализированных н-алкантиолов и дисульфидов – строительных блоков самоорганизующихся монослоев, авторы Д. Витт, Р. Клайн, П. Барски, Б. А. Гжибовский из Северо-Западного университета.
- Меркаптан , Электронная энциклопедия Колумбии.
- Что такое Меркаптан? , компанией Columbia Gas из Пенсильвании и Мэриленда.
- Какое химическое вещество хуже всего пахнет? Архивировано 6 июня 2011 г. в Wayback Machine компанией About Chemistry.