Рентгеновская кристаллография

Рентгеновская кристаллография -это экспериментальная наука о определении атомной и молекулярной структуры кристалла , в которой кристаллическая структура вызывает пучок падающих рентгеновских лучей для дифракции в определенных направлениях. Измеряя углы и интенсивность рентгеновской дифракции , кристаллограф может произвести трехмерную картину плотности электронов в кристалле и положениях атомов, а также их химические связи , кристаллографическое расстройство и другую информацию Полем
Рентгеновская кристаллография была фундаментальной в разработке многих научных областей. В первые десятилетия использования этот метод определил размер атомов, длины и типов химических связей, а также различия в атомном масштабе между различными материалами, особенно минералами и сплавами . Метод также выявил структуру и функцию многих биологических молекул, включая витамины , лекарства, белки и нуклеиновые кислоты, такие как ДНК . Рентгеновская кристаллография по-прежнему является основным методом для характеристики атомной структуры материалов и в дифференцирующих материалах, которые кажутся одинаковыми в других экспериментах. Рентгеновские кристаллические структуры также могут помочь объяснить необычные электронные или упругие свойства материала, пролить свет на химические взаимодействия и процессы или служить основой для проектирования фармацевтических препаратов против заболеваний .
Современная работа включает в себя ряд шагов, которые важны. Предварительные шаги включают подготовку образцов хорошего качества, тщательную запись дифрагированной интенсивности и обработку данных для удаления артефактов. Разнообразие различных методов затем используется для получения оценки атомной структуры, которая в целом называется прямыми методами. С начальной оценкой дальнейшие вычислительные методы, такие как те, которые включают различные карты, используются для завершения структуры. Последний шаг-это числовое уточнение атомных позиций по сравнению с экспериментальными данными, которые иногда помогают в расчетах ab-initio . Почти во всех случаях новые структуры депонируются в базах данных, доступных для международного сообщества.
История
[ редактировать ]Кристаллы, хотя и долго восхищались их регулярностью и симметрией, не были исследованы с научной точки зрения до 17 -го века. Йоханнес Кеплер предположил в своей работе Страна Сеонив Сексингула (новогодний дар гексагонального снега) (1611), что гексагональная симметрия кристаллов снежинки была вызвана регулярной упаковкой сферических частиц воды. [ 1 ] Датский ученый Николас Стено (1669 г.) пионеровал экспериментальные исследования кристаллической симметрии. Стено показал, что углы между лицами одинаковы во всех образцах конкретного типа кристалла. [ 2 ] Рене Just Haüy (1784) обнаружил, что каждое лицо кристалла может быть описана простыми узорами блоков одинаковой формы и размера. Следовательно, Уильям Хэллоус Миллер в 1839 году смог дать каждому лицу уникальный ярлык из трех небольших целых чисел, индексов Миллера , которые остаются используемыми для определения кристаллических грани. Исследование Haüy привело к идее, что кристаллы представляют собой регулярную трехмерную массив ( решетчатая решетка Bravais ) атомов и молекул ; Один единичная ячейка повторяется на неопределенный срок вдоль трех основных направлений. В 19 -м веке был разработан полный каталог возможных симметрий кристалла . [ 3 ] Огюст Браве , [ 4 ] Evgraf Fedorov , [ 5 ] Артур Шонфис [ 6 ] и (запоздало) Уильям Барлоу (1894). Барлоу предложил несколько кристаллических структур в 1880-х годах, которые были подтверждены позже рентгеновской кристаллографией; [ 7 ] Тем не менее, доступные данные были слишком дефицитны в 1880 -х годах, чтобы принять его модели как окончательные.

Вильгельм Ронген обнаружил рентген в 1895 году. [ 8 ] Физики не были уверены в природе рентгеновских лучей, но подозревали, что они были волнами электромагнитного излучения . Теория Максвелла электромагнитного излучения была хорошо принята, и эксперименты Чарльза Гловера Баркла показали, что рентгеновские снимки демонстрируют явления, связанные с электромагнитными волнами, включая поперечную поляризацию и спектральные линии, сродни теми, которые наблюдаются в видимых длин волн. Баркла создала рентгеновские нотации для острых спектральных линий, отметив в 1909 году две отдельные энергии, сначала назвав их «а» и «b», а затем предполагая, что до «А» могут быть строки, он начал начало нумерации алфавита с "К." [ 9 ] [ 10 ] Эксперименты с одним щелчком в лаборатории Арнольда Соммерфельда предположили, что рентгеновские лучи имели длину волны около 1 Ангстром . [ 11 ] Рентген-это не только волны, но также обладают свойствами частиц, заставляющие Соммерфельда монать название Bresstrahlung для непрерывных спектров, когда они образовались, когда электроны бомбардировали материал. [ 10 ] Альберт Эйнштейн представил концепцию фотона в 1905 году, [ 12 ] но это не было широко принято до 1922 года, [ 13 ] [ 14 ] Когда Артур Комптон подтвердил это рассеянием рентгеновских лучей от электронов. [ 15 ] Подобные частицам свойства рентгеновских лучей, такие как их ионизация газов, побудили Уильяма Генри Брэгга в 1907 году утверждать, что рентгеновские снимки не были электромагнитным излучением. [ 16 ] [ 17 ] [ 18 ] [ 19 ] Взгляд Брэгга оказался непопулярным, и наблюдение рентгеновской дифракции Максом фон Лауэ в 1912 году [ 20 ] Подтверждено, что рентгеновские лучи являются формой электромагнитного излучения.

Идея о том, что кристаллы можно использовать в качестве дифракционной решетки для рентгеновских снимков, возникла в 1912 году в разговоре Пола Питера Эвальда и Макса фон Лауэ в английском саду в Мюнхене. Эвальд предложил резонаторную модель кристаллов для своего тезиса, но эта модель не могла быть подтверждена с использованием видимого света , поскольку длина волны была намного больше, чем расстояние между резонаторами. Фон Ла понял, что необходимо электромагнитное излучение более короткой длины волны, и предположил, что рентгеновские снимки могут иметь длину волны, сравнимую с расстоянием единичных клеток в кристаллах. Фон Лауэ работал с двумя техническими специалистами, Уолтером Фридрихом и его помощником Пола Ножпинга, чтобы пролить балку рентгеновских снимков через кристалл сульфата меди и записать его дифракцию на фотографической пластине . После разработки на пластине было показано большое количество четко определенных пятен, расположенных в схеме пересекающих кругов вокруг пятна, полученного центральным лучом. Результаты были представлены баварской академии наук и гуманитарных наук В июне 1912 года как «знаки помех в рентген» (явления интерференции в рентгеновских снимках). [ 20 ] [ 21 ] Фон Ла разработал закон, который соединяет углы рассеяния и размер и ориентацию разделов единичной ячейки в кристалле, за которые он был удостоен Нобелевской премии по физике в 1914 году. [ 22 ]

После новаторского исследования фон Лай, поле развивалось быстро, особенно у физика Уильяма Лоуренса Брэгга и его отца Уильяма Генри Брэгга . В 1912–1913 годах младший Брэгг разработал закон Брэгга , который соединяет рассеяние с равномерно разнесенными плоскостями в кристалле. [ 8 ] [ 23 ] [ 24 ] [ 25 ] Брэгги, отец и сын, поделились Нобелевской премией 1915 года по физике за их работу в кристаллографии. Самые ранние структуры были в целом просты; Поскольку вычислительные и экспериментальные методы улучшились в течение следующих десятилетий, стало возможным вывести надежные атомные позиции для более сложных расположений атомов.
Самыми ранними структурами были простые неорганические кристаллы и минералы, но даже они выявили фундаментальные законы физики и химии. Первая структура атомного разрешения, которая была «решена» (т. Е. Определено) в 1914 году была структура столовой соли . [ 26 ] [ 27 ] [ 28 ] Распределение электронов в структуре соли таблицы показало, что кристаллы не обязательно состоят из ковалентно связанных молекул и доказали существование ионных соединений . [ 29 ] Структура алмаза была решена в том же году, [ 30 ] [ 31 ] доказывая тетраэдрическое расположение его химических связей и показывает, что длина отдельной связи C - C составляла около 1,52 анги. Другие ранние структуры включали медь, [ 32 ] Флуорид кальция (CAF 2 , также известный как флуорит ), кальцит (како 3 ) и пирит (FES 2 ) [ 33 ] в 1914 году; Spinel (Mgal 2 O 4 ) в 1915 году; [ 34 ] [ 35 ] Рутиловые ; и анатазные формы диоксида титана (TIO 2 ) в 1916 году [ 36 ] пирохруит (Mn (OH) 2 ) и, по расширению, Brucite (Mg (OH) 2 ) в 1919 году. [ 37 ] [ 38 ] Также в 1919 году нитрат натрия (Nano 3 ) и цезий -дихлорид (CSICL 2 ) определяли Ральфом Уолтером Грейстоном Виккоффа , а в 1920 году была определена структура вюрцита (шестиугольный ZnS). [ 39 ]
Структура графита была решена в 1916 году [ 40 ] связанным методом порошковой дифракции , [ 41 ] который был разработан Питером Дебай и Полом Шеррером и независимо, Альбертом Халлом в 1917 году. [ 42 ] Структура графита была определена из однокристаллической дифракции в 1924 году двумя группами независимо. [ 43 ] [ 44 ] Халл также использовал метод порошка для определения структур различных металлов, таких как железо [ 45 ] и магний. [ 46 ]
Вклад в разные области
[ редактировать ]Химия
[ редактировать ]Рентгеновская кристаллография привела к лучшему пониманию химических связей и нековалентных взаимодействий . Первоначальные исследования выявили типичные радиусы атомов и подтвердили многие теоретические модели химической связи, такие как тетраэдрическая связь углерода в алмазной структуре, [ 30 ] Октаэдрическая связь металлов, наблюдаемой в гексахлороплатинате аммония (IV), [ 47 ] и резонанс, наблюдаемый в плоской карбонатной группе [ 33 ] и в ароматических молекулах. [ 48 ] Кэтлин Лонсдейл 1928 года Структура гексаметилбензола [ 49 ] установил гексагональную симметрию бензола и показала четкую разницу в длине связи между алифатическими связями C - C и ароматическими связями C - C; Этот вывод привел к идее резонанса между химическими связями, что имело глубокие последствия для развития химии. [ 50 ] Ее выводы были ожидаются Уильямом Генри Брэггом , который опубликовал модели нафталина и антрацен в 1921 году на основе других молекул, ранней формы молекулярной замены . [ 48 ] [ 51 ]
Первая структура органического соединения, гексаметилентетрамина , была решена в 1923 году. [ 52 ] длинноцепочечной кислоты За этим быстро последовали несколько исследований различных жирных кислот , которые являются важным компонентом биологических мембран . [ 53 ] [ 54 ] [ 55 ] [ 56 ] [ 57 ] [ 58 ] [ 59 ] [ 60 ] [ 61 ] В 1930-х годах стали решать структуры гораздо более крупных молекул с двумерной сложностью. Значительным продвижением была структура фталоцианина , [ 62 ] Большая плоская молекула, которая тесно связана с молекулами порфирина, важными для биологии, такой как гем , коррин и хлорофилл .
В 1920 -х годах Виктор Мориц Голдшмидт и позже Линус Полинг разработали правила устранения химически маловероятных структур и для определения относительных размеров атомов. Эти правила привели к структуре Brookite (1928) и пониманию относительной стабильности рутиловых , брукских и анатазных форм диоксида титана .
Расстояние между двумя связанными атомами является чувствительной мерой прочности связи и ее порядок связи ; Таким образом, рентгеновские кристаллографические исследования привели к открытию еще более экзотических типов связи в неорганической химии , таких как двойные связи металла, металлические металлические связи, [ 63 ] [ 64 ] [ 65 ] металлические четырехкратные связи, [ 66 ] [ 67 ] [ 68 ] и три центра, двухэлектронные связи. [ 69 ] Рентгеновская кристаллография-или, строго говоря, эксперимент с неэластичным рассеянием компона -также предоставил доказательства частично ковалентного характера водородных связей . [ 70 ] В области органометаллической химии рентгеновская структура ферроцена инициировала научные исследования сэндвич-соединений , [ 71 ] [ 72 ] в то время как соль Зейз стимулировал исследования в области «спины» и комплексов металлов. [ 73 ] [ 74 ] [ 75 ] [ 76 ] Наконец, рентгеновская кристаллография сыграла новаторскую роль в развитии супрамолекулярной химии , особенно в прояснении структур короночных эфиров и принципах химии хозяина и госпитала . [ Цитация необходима ]
Материаловая и минералогия
[ редактировать ]
Применение рентгеновской кристаллографии к минералогии началось со структуры граната , которая была определена в 1924 году Менцером. Систематическое рентгеновское кристаллографическое исследование силикатов было проведено в 1920-х годах. Это исследование показало, что, по мере изменения отношения Si / O , кристаллы силиката демонстрируют значительные изменения в их атомной композиции. Махацчки расширил эти идеи до минералов, в которых алюминиевые заменители атомов кремния силикатов. Первое применение рентгеновской кристаллографии к металлургии также произошло в середине 1920-х годов. [ 78 ] [ 79 ] [ 80 ] [ 81 ] [ 82 ] [ 83 ] В частности, структура Linus Pauling сплава Mg 2 SN [ 84 ] привел к его теории стабильности и структуры сложных ионных кристаллов. [ 85 ] Многие сложные неорганические и органометаллические системы были проанализированы с использованием однокристаллических методов, таких как фуллерены , металлопорфирины и другие сложные соединения. Однокристаллическая дифракция также используется в фармацевтической промышленности . Кембриджская структурная база данных содержит более 1 000 000 структур по состоянию на июнь 2019 года; Большинство из этих структур были определены с помощью рентгеновской кристаллографии. [ 86 ]
On October 17, 2012, the Curiosity rover on the planet Mars at "Rocknest" performed the first X-ray diffraction analysis of Martian soil. The results from the rover's CheMin analyzer revealed the presence of several minerals, including feldspar, pyroxenes and olivine, and suggested that the Martian soil in the sample was similar to the "weathered basaltic soils" of Hawaiian volcanoes.[77]
Biological macromolecular crystallography
[edit]X-ray crystallography of biological molecules took off with Dorothy Crowfoot Hodgkin, who solved the structures of cholesterol (1937), penicillin (1946) and vitamin B12 (1956), for which she was awarded the Nobel Prize in Chemistry in 1964. In 1969, she succeeded in solving the structure of insulin, on which she worked for over thirty years.[87]

Crystal structures of proteins (which are irregular and hundreds of times larger than cholesterol) began to be solved in the late 1950s, beginning with the structure of sperm whale myoglobin by Sir John Cowdery Kendrew,[88] for which he shared the Nobel Prize in Chemistry with Max Perutz in 1962.[89] Since that success, over 130,000 X-ray crystal structures of proteins, nucleic acids and other biological molecules have been determined.[90] The nearest competing method in number of structures analyzed is nuclear magnetic resonance (NMR) spectroscopy, which has resolved less than one tenth as many.[91] Crystallography can solve structures of arbitrarily large molecules, whereas solution-state NMR is restricted to relatively small ones (less than 70 kDa). X-ray crystallography is used routinely to determine how a pharmaceutical drug interacts with its protein target and what changes might improve it.[92] However, intrinsic membrane proteins remain challenging to crystallize because they require detergents or other denaturants to solubilize them in isolation, and such detergents often interfere with crystallization. Membrane proteins are a large component of the genome, and include many proteins of great physiological importance, such as ion channels and receptors.[93][94] Helium cryogenics are used to prevent radiation damage in protein crystals.[95]
Methods
[edit]Overview
[edit]
Two limiting cases of X-ray crystallography—"small-molecule" (which includes continuous inorganic solids) and "macromolecular" crystallography—are often used. Small-molecule crystallography typically involves crystals with fewer than 100 atoms in their asymmetric unit; such crystal structures are usually so well resolved that the atoms can be discerned as isolated "blobs" of electron density. In contrast, macromolecular crystallography often involves tens of thousands of atoms in the unit cell. Such crystal structures are generally less well-resolved; the atoms and chemical bonds appear as tubes of electron density, rather than as isolated atoms. In general, small molecules are also easier to crystallize than macromolecules; however, X-ray crystallography has proven possible even for viruses and proteins with hundreds of thousands of atoms, through improved crystallographic imaging and technology.[96]
The technique of single-crystal X-ray crystallography has three basic steps. The first—and often most difficult—step is to obtain an adequate crystal of the material under study. The crystal should be sufficiently large (typically larger than 0.1 mm in all dimensions), pure in composition and regular in structure, with no significant internal imperfections such as cracks or twinning.[citation needed]
In the second step, the crystal is placed in an intense beam of X-rays, usually of a single wavelength (monochromatic X-rays), producing the regular pattern of reflections. The angles and intensities of diffracted X-rays are measured, with each compound having a unique diffraction pattern.[97] As the crystal is gradually rotated, previous reflections disappear and new ones appear; the intensity of every spot is recorded at every orientation of the crystal. Multiple data sets may have to be collected, with each set covering slightly more than half a full rotation of the crystal and typically containing tens of thousands of reflections.[citation needed]
In the third step, these data are combined computationally with complementary chemical information to produce and refine a model of the arrangement of atoms within the crystal. The final, refined model of the atomic arrangement—now called a crystal structure—is usually stored in a public database.[citation needed]
Crystallization
[edit]
Although crystallography can be used to characterize the disorder in an impure or irregular crystal, crystallography generally requires a pure crystal of high regularity to solve the structure of a complicated arrangement of atoms. Pure, regular crystals can sometimes be obtained from natural or synthetic materials, such as samples of metals, minerals or other macroscopic materials. The regularity of such crystals can sometimes be improved with macromolecular crystal annealing[98][99][100] and other methods. However, in many cases, obtaining a diffraction-quality crystal is the chief barrier to solving its atomic-resolution structure.[101]
Small-molecule and macromolecular crystallography differ in the range of possible techniques used to produce diffraction-quality crystals. Small molecules generally have few degrees of conformational freedom, and may be crystallized by a wide range of methods, such as chemical vapor deposition and recrystallization. By contrast, macromolecules generally have many degrees of freedom and their crystallization must be carried out so as to maintain a stable structure. For example, proteins and larger RNA molecules cannot be crystallized if their tertiary structure has been unfolded; therefore, the range of crystallization conditions is restricted to solution conditions in which such molecules remain folded.[citation needed]
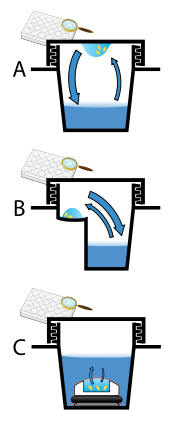
Protein crystals are almost always grown in solution. The most common approach is to lower the solubility of its component molecules very gradually; if this is done too quickly, the molecules will precipitate from solution, forming a useless dust or amorphous gel on the bottom of the container. Crystal growth in solution is characterized by two steps: nucleation of a microscopic crystallite (possibly having only 100 molecules), followed by growth of that crystallite, ideally to a diffraction-quality crystal.[102][103] The solution conditions that favor the first step (nucleation) are not always the same conditions that favor the second step (subsequent growth). The solution conditions should disfavor the first step (nucleation) but favor the second (growth), so that only one large crystal forms per droplet. If nucleation is favored too much, a shower of small crystallites will form in the droplet, rather than one large crystal; if favored too little, no crystal will form whatsoever. Other approaches involve crystallizing proteins under oil, where aqueous protein solutions are dispensed under liquid oil, and water evaporates through the layer of oil. Different oils have different evaporation permeabilities, therefore yielding changes in concentration rates from different percipient/protein mixture.[104]
It is difficult to predict good conditions for nucleation or growth of well-ordered crystals.[105] In practice, favorable conditions are identified by screening; a very large batch of the molecules is prepared, and a wide variety of crystallization solutions are tested.[106] Hundreds, even thousands, of solution conditions are generally tried before finding the successful one. The various conditions can use one or more physical mechanisms to lower the solubility of the molecule; for example, some may change the pH, some contain salts of the Hofmeister series or chemicals that lower the dielectric constant of the solution, and still others contain large polymers such as polyethylene glycol that drive the molecule out of solution by entropic effects. It is also common to try several temperatures for encouraging crystallization, or to gradually lower the temperature so that the solution becomes supersaturated. These methods require large amounts of the target molecule, as they use high concentration of the molecule(s) to be crystallized. Due to the difficulty in obtaining such large quantities (milligrams) of crystallization-grade protein, robots have been developed that are capable of accurately dispensing crystallization trial drops that are in the order of 100 nanoliters in volume. This means that 10-fold less protein is used per experiment when compared to crystallization trials set up by hand (in the order of 1 microliter).[107]
Several factors are known to inhibit crystallization. The growing crystals are generally held at a constant temperature and protected from shocks or vibrations that might disturb their crystallization. Impurities in the molecules or in the crystallization solutions are often inimical to crystallization. Conformational flexibility in the molecule also tends to make crystallization less likely, due to entropy. Molecules that tend to self-assemble into regular helices are often unwilling to assemble into crystals.[citation needed] Crystals can be marred by twinning, which can occur when a unit cell can pack equally favorably in multiple orientations; although recent advances in computational methods may allow solving the structure of some twinned crystals. Having failed to crystallize a target molecule, a crystallographer may try again with a slightly modified version of the molecule; even small changes in molecular properties can lead to large differences in crystallization behavior.[citation needed]
Data collection
[edit]Mounting the crystal
[edit]The crystal is mounted for measurements so that it may be held in the X-ray beam and rotated. There are several methods of mounting. In the past, crystals were loaded into glass capillaries with the crystallization solution (the mother liquor). Crystals of small molecules are typically attached with oil or glue to a glass fiber or a loop, which is made of nylon or plastic and attached to a solid rod. Protein crystals are scooped up by a loop, then flash-frozen with liquid nitrogen.[108] This freezing reduces the radiation damage of the X-rays, as well as thermal motion (the Debye-Waller effect). However, untreated protein crystals often crack if flash-frozen; therefore, they are generally pre-soaked in a cryoprotectant solution before freezing.[109] This pre-soak may itself cause the crystal to crack, ruining it for crystallography. Generally, successful cryo-conditions are identified by trial and error.[citation needed]
The capillary or loop is mounted on a goniometer, which allows it to be positioned accurately within the X-ray beam and rotated. Since both the crystal and the beam are often very small, the crystal must be centered within the beam to within ~25 micrometers accuracy, which is aided by a camera focused on the crystal. The most common type of goniometer is the "kappa goniometer", which offers three angles of rotation: the ω angle, which rotates about an axis perpendicular to the beam; the κ angle, about an axis at ~50° to the ω axis; and, finally, the φ angle about the loop/capillary axis. When the κ angle is zero, the ω and φ axes are aligned. The κ rotation allows for convenient mounting of the crystal, since the arm in which the crystal is mounted may be swung out towards the crystallographer. The oscillations carried out during data collection (mentioned below) involve the ω axis only. An older type of goniometer is the four-circle goniometer, and its relatives such as the six-circle goniometer.[citation needed]
Recording the reflections
[edit]
The relative intensities of the reflections provides information to determine the arrangement of molecules within the crystal in atomic detail. The intensities of these reflections may be recorded with photographic film, an area detector (such as a pixel detector) or with a charge-coupled device (CCD) image sensor. The peaks at small angles correspond to low-resolution data, whereas those at high angles represent high-resolution data; thus, an upper limit on the eventual resolution of the structure can be determined from the first few images. Some measures of diffraction quality can be determined at this point, such as the mosaicity of the crystal and its overall disorder, as observed in the peak widths. Some pathologies of the crystal that would render it unfit for solving the structure can also be diagnosed quickly at this point.[citation needed]
One set of spots is insufficient to reconstruct the whole crystal; it represents only a small slice of the full three dimensional set. To collect all the necessary information, the crystal must be rotated step-by-step through 180°, with an image recorded at every step; actually, slightly more than 180° is required to cover reciprocal space, due to the curvature of the Ewald sphere. However, if the crystal has a higher symmetry, a smaller angular range such as 90° or 45° may be recorded. The rotation axis should be changed at least once, to avoid developing a "blind spot" in reciprocal space close to the rotation axis. It is customary to rock the crystal slightly (by 0.5–2°) to catch a broader region of reciprocal space.[citation needed]
Multiple data sets may be necessary for certain phasing methods. For example, multi-wavelength anomalous dispersion phasing requires that the scattering be recorded at least three (and usually four, for redundancy) wavelengths of the incoming X-ray radiation. A single crystal may degrade too much during the collection of one data set, owing to radiation damage; in such cases, data sets on multiple crystals must be taken.[110]
Crystal symmetry, unit cell, and image scaling
[edit]The recorded series of two-dimensional diffraction patterns, each corresponding to a different crystal orientation, is converted into a three-dimensional set. Data processing begins with indexing the reflections. This means identifying the dimensions of the unit cell and which image peak corresponds to which position in reciprocal space. A byproduct of indexing is to determine the symmetry of the crystal, i.e., its space group. Some space groups can be eliminated from the beginning. For example, reflection symmetries cannot be observed in chiral molecules; thus, only 65 space groups of 230 possible are allowed for protein molecules which are almost always chiral. Indexing is generally accomplished using an autoindexing routine.[111] Having assigned symmetry, the data is then integrated. This converts the hundreds of images containing the thousands of reflections into a single file, consisting of (at the very least) records of the Miller index of each reflection, and an intensity for each reflection (at this state the file often also includes error estimates and measures of partiality (what part of a given reflection was recorded on that image)).
A full data set may consist of hundreds of separate images taken at different orientations of the crystal. These have to be merged and scaled usingpeaks appear in two or more images (merging) and scaling so there is a consistent intensity scale. Optimizing the intensity scale is critical because the relative intensity of the peaks is the key information from which the structure is determined. The repetitive technique of crystallographic data collection and the often high symmetry of crystalline materials cause the diffractometer to record many symmetry-equivalent reflections multiple times. This allows calculating the symmetry-related R-factor, a reliability index based upon how similar are the measured intensities of symmetry-equivalent reflections,[clarification needed] thus assessing the quality of the data.
Initial phasing
[edit]The intensity of each diffraction 'spot' is proportional to the modulus squared of the structure factor. The structure factor is a complex number containing information relating to both the amplitude and phase of a wave. In order to obtain an interpretable electron density map, both amplitude and phase must be known (an electron density map allows a crystallographer to build a starting model of the molecule). The phase cannot be directly recorded during a diffraction experiment: this is known as the phase problem. Initial phase estimates can be obtained in a variety of ways:
- Ab initio phasing or direct methods – This is usually the method of choice for small molecules (<1000 non-hydrogen atoms), and has been used successfully to solve the phase problems for small proteins. If the resolution of the data is better than 1.4 Å (140 pm), direct methods can be used to obtain phase information, by exploiting known phase relationships between certain groups of reflections.[112][113]
- Molecular replacement – if a related structure is known, it can be used as a search model in molecular replacement to determine the orientation and position of the molecules within the unit cell. The phases obtained this way can be used to generate electron density maps.[114]
- Anomalous X-ray scattering (MAD or SAD phasing) – the X-ray wavelength may be scanned past an absorption edge[ А ] атома, который меняет рассеяние известным образом. Записывая полные наборы отражений на трех разных длин волн (далеко внизу, далеко выше и в середине края поглощения), можно решить для подструктуры аномально дифракционных атомов и, следовательно, структуры всей молекулы. Наиболее популярный метод включения атомов аномального рассеяния в белки-экспрессировать белок в метиониновом ауксотрофе (хозяин, неспособный синтезировать метионин) в средах, богатой селено-метионином, который содержит атомы селена . Многоволновая аномальная дисперсионная (MAD) эксперимент может проводиться вокруг края поглощения, что должно дать положение любых остатков метионина в белке, обеспечивая начальные фазы. [ 115 ]
- Методы тяжелого атома ( множественная изоморфная замена )-Если электронные атомы металлов могут быть введены в кристалл, прямые методы или методы пространства Паттерсона можно использовать для определения их местоположения и для получения начальных фаз. Такие тяжелые атомы могут быть введены либо путем замачивания кристалла в тяжелом атомсодержащем растворе, либо путем совместной кристаллизации (выращивание кристаллов в присутствии тяжелого атома). Как и в многоволновой аномальной дисперсионной фазировании, изменения в амплитудах рассеяния могут быть интерпретированы с учетом этапов. Хотя это исходный метод, с помощью которого были решены кристаллические структуры белка, он в значительной степени был заменен многоволновой аномальной дисперсионной фазированием с селенометионином. [ 114 ]
Строительство модели и уточнение фазы
[ редактировать ]

Получив начальные фазы, может быть построена начальная модель. Атомные позиции в модели и их соответствующие факторы дебай -бультера (или B -факторы, учитывая тепловое движение атома), могут быть уточнены, чтобы соответствовать наблюдаемым дифракционным данным, в идеале, давая лучший набор фаз. Затем новая модель может быть подходящей для новой карты плотности электронов, и проводятся последовательные раунды уточнения. Этот итеративный процесс продолжается до тех пор, пока корреляция между дифракционными данными и моделью не станет максимизирована. Соглашение измеряется с помощью R -фактора , определяемого как
где F является фактором структуры . Аналогичный критерий качества R свободен , который рассчитывается по подмножеству (~ 10%) отражений, которые не были включены в утончение структуры. Оба R -фактора зависят от разрешения данных. Как правило, R Free должен быть приблизительно разрешением у ангстремов, разделенных на 10; Таким образом, набор данных с разрешением 2 Å должен дать окончательный r свободный ~ 0,2. Химические связи, такие как стереохимия, водородная связь и распределение длины связей и углов, являются дополнительными показателями качества модели. В итеративном построении модели это часто встречается с смещением фазы или смещением модели: поскольку фазовые оценки поступают из модели, каждый раунд рассчитанной карты имеет тенденцию показывать плотность, везде, где модель имеет плотность, независимо от того, действительно ли существует плотность. Эта проблема может быть смягчена с помощью максимального уровня веса и проверки с использованием карт опускания . [ 118 ]
Возможно, невозможно наблюдать каждый атом в асимметричной единице. Во многих случаях кристаллографическое расстройство смазывает карту электронов. Слабо рассеяние атомов, таких как водород, обычно невидимы. Также возможно, чтобы один атом появлялся несколько раз на карте электронной плотности, например, если белковая боковая ущерб имеет множественные (<4) разрешенные конформации. В других случаях кристаллограф может обнаружить, что ковалентная структура, выведенная для молекулы, была неверной или измененной. Например, белки могут быть расщеплены или подвергаться посттрансляционным модификациям, которые не были обнаружены до кристаллизации.
Расстройство
[ редактировать ]Общая проблема в уточнении кристаллических структур является результатом кристаллографического расстройства. Расстройство может принимать разные формы, но в целом включает в себя сосуществование двух или более видов или конформаций. Неспособность распознать расстройство приводит к ошибочной интерпретации. Подводные камни от неправильного моделирования расстройства иллюстрируются дисконтированной гипотезой изомеризма растяжения связи . [ 119 ] Расстройство моделируется относительно относительной популяции компонентов, часто только два и их идентичности. В структурах крупных молекул и ионов растворитель и противоионы часто беспорядочны.
Применяемый анализ вычислительных данных
[ редактировать ]Использование вычислительных методов для анализа данных дифракционных дифракционных данных порошка теперь обобщено. Обычно он сравнивает экспериментальные данные с моделируемой дифрактограммой структуры модели, принимая во внимание инструментальные параметры и уточняет структурные или микроструктурные параметры модели с использованием наименьших квадратов алгоритма минимизации . Наиболее доступные инструменты, позволяющие идентификацию фазы и уточнение структурной, основаны на методе Rietveld , [ 120 ] [ 121 ] Некоторые из них являются открытыми и свободным программным обеспечением, таким как FullProf Suite, [ 122 ] [ 123 ] Jana2006, [ 124 ] МОД, [ 125 ] [ 126 ] [ 127 ] В Rietz, [ 128 ] GSA, [ 129 ] и т. д., в то время как другие доступны по коммерческим лицензиям, таким как Diffrac.suite topas, [ 130 ] Соответствовать!, [ 131 ] и т. д . Более поздние инструменты позволяют уточнить как структурные, так и микроструктурные данные, такие как программа неисправностей, включенная в набор FullProf, [ 132 ] что позволяет уточнить структуры с плоскими дефектами (например, разломы с укладками, Twinnings, Intergrowsthats).
Осаждение структуры
[ редактировать ]После того, как модель структуры молекулы была завершена, ее часто осаждается в кристаллографической базе данных, такой как структурная база данных Кембриджа (для малых молекул), база данных неорганической кристаллической структуры (ICSD) (для неорганических соединений) или банк данных белка (банк данных белка (ICSD). для белка, а иногда и нуклеиновых кислот). Многие структуры, полученные в частных коммерческих предприятиях для кристаллизации лекарственных белков, не осаждаются в общественных кристаллографических базах данных.
Вклад женщин в рентгеновскую кристаллографию
[ редактировать ]Ряд женщин были пионерами в рентгеновской кристаллографии в то время, когда они были исключены из большинства других ветвей физической науки. [ 133 ]
Кэтлин Лонсдейл была студентом -исследователем Уильяма Генри Брэгга , у которого было 11 студентов -исследователей в общей сложности 18. Она известна как своей экспериментальной, так и теоретической работой. Лонсдейл присоединился к своей исследовательской группе по кристаллографии в Королевском учреждении в Лондоне в 1923 году, и после женитьбы и рождения и рождения вернулся на работу с Брэггом в качестве исследователя. Она подтвердила структуру бензольного кольца, проведя исследования алмаза, была одной из первых двух женщин, которые были избраны в Королевское общество в 1945 году, и в 1949 году была назначена первая женщина -пребывание по химии и глава департамента. Кристаллография в университетском колледже Лондон . [ 134 ] Лонсдейл всегда выступал за более широкое участие женщин в науке и сказал в 1970 году: «Любая страна, которая хочет в полной мере использовать всех своих потенциальных ученых и технологов, может сделать это, но она не должна ожидать, что женщины так просто получат, как он получает Мужчины . Полем [ 135 ] В течение этого периода Лонсдейл начал сотрудничество с Уильямом Т. Астбери в комплекте из 230 таблиц космической группы, который был опубликован в 1924 году и стал важным инструментом для кристаллографов.

В 1932 году Дороти Ходжкин присоединилась к лаборатории физика Джона Десмонда Бернала, который был бывшим студентом Брэгга в Кембридже, Великобритания. Она и Бернал сделали первые рентгеновские фотографии кристаллических белков. Ходжкин также сыграл роль в основе Международного союза кристаллографии . В 1964 году она была удостоена Нобелевской премии по химии за свою работу с использованием рентгеновских методов для изучения структур пенициллина, инсулина и витамина B12. Ее работа по пенициллину началась в 1942 году во время войны и на витамине В12 в 1948 году. Хотя ее группа медленно росла, их преобладающая была сосредоточена на рентгеновском анализе натуральных продуктов. Она единственная британская женщина, которая когда -либо получила Нобелевскую премию по предмету науки.

Розалинда Франклин сделала рентгеновскую фотографию ДНК-волокна, которая оказалась ключом к Джеймсу Уотсону и открытию Фрэнсиса Крика двойной спирали, за которую они оба получили Нобелевскую премию за физиологию или медицину в 1962 году. Уотсон раскрыл в своем автобиографическом счете обнаружения структуры ДНК, двойной спираль , [ 136 ] что он использовал рентгеновскую фотографию Франклина без ее разрешения. Франклин умер от рака в возрасте 30 лет, прежде чем Уотсон получил Нобелевскую премию. Франклин также провел важные структурные исследования углерода в угле и графите, а также вирусов растений и животных.
Изабелла Карле из Военно -морской исследовательской лаборатории Соединенных Штатов разработала экспериментальный подход к математической теории кристаллографии. Ее работа улучшила скорость и точность химического и биомедицинского анализа. Тем не менее, только ее муж Джером поделился Нобелевской премией 1985 года по химии с Гербертом Хауптманом, «за выдающиеся достижения в разработке прямых методов определения кристаллических структур». Другие призовые тела сами по себе осыпали Изабеллу.
Женщины написали много учебников и исследовательских работ в области рентгеновской кристаллографии. В течение многих лет Лонсдейл отредактировал международные таблицы для кристаллографии , которая предоставляет информацию о кристаллических решетках, симметрии и космических группах, а также математические, физические и химические данные о структурах. Ольга Кеннард из Кембриджского университета , основанная и управляла Кембриджским кристаллографическим центром обработки данных , международно признанным источником структурных данных о мелких молекулах с 1965 по 1997 год. Дженни Пикворт Глюзер , британский ученый, соавторский анализ кристаллической структуры: праймер. В [ 137 ] Впервые опубликовано в 1971 году и по состоянию на 2010 год в своем третьем издании. Элеонора Додсон , биолог, родившийся в Австралии, который начал с работы в качестве техника Дороти Ходжкин, была главным зачинщиком CCP4 , совместным вычислительным проектом, который в настоящее время имеет более 250 программных инструментов с кристаллографом белка по всему миру.
Нобелевские призы, включающие рентгеновскую кристаллографию
[ редактировать ]| Год | Лауреат | Приз | Обоснование |
|---|---|---|---|
| 1914 | Макс фон Лауэ | Физика | «За его открытие дифракции рентгеновских лучей кристаллами» [ 138 ] |
| 1915 | Уильям Генри Брэгг | Физика | «За их услуги при анализе кристаллической структуры с помощью рентгеновских снимков» [ 139 ] |
| Уильям Лоуренс Брэгг | |||
| 1962 | Макс Ф. Перутц | Химия | «Для их исследований структур шаровых белков » [ 140 ] |
| Джон С. Держи | |||
| 1962 | Джеймс Дьюи Уотсон | Лекарство | «Для их открытий, касающихся молекулярной структуры нуклеиновых кислот и его значения для переноса информации в живом материале» [ 141 ] |
| Фрэнсис Гарри Комптон Крик | |||
| Морис Хью Фредерик Уилкинс | |||
| 1964 | Дороти Ходжкин | Химия | «Для ее определений с помощью рентгеновских методов структур важных биохимических веществ» [ 142 ] |
| 1972 | Стэнфорд Мур | Химия | «За их вклад в понимание связи между химической структурой и каталитической активностью активного центра молекулы рибонуклеазы » [ 143 ] |
| Уильям Х. Стейн | |||
| 1976 | Уильям Н. Липскомб | Химия | «Для его исследований по структуре боранов , освещающих проблемы химической связи» [ 144 ] |
| 1985 | Джером Карл | Химия | «За их выдающиеся достижения в разработке прямых методов определения кристаллических структур» [ 145 ] |
| Герберт А. Хауптман | |||
| 1988 | Иоганн Дейзенхофер | Химия | «Для их определения трехмерной структуры фотосинтетического реакционного центра » [ 146 ] |
| Хартмут Мишель | Химия | ||
| Роберт Хубер | Химия | ||
| 1997 | Джон Э. Уокер | Химия | «За их выяснение ферментативного механизма, лежащего в основе синтеза аденозин -трифосфата (АТФ)» [ 147 ] |
| 2003 | Родерик Маккиннон | Химия | «Для открытий, касающихся каналов в клеточных мембранах [...] для структурных и механистических исследований ионных каналов » [ 148 ] |
| Питер добавил | «Для открытий, касающихся каналов в клеточных мембранах [...] для обнаружения водных каналов » [ 148 ] | ||
| 2006 | Роджер Д. Корнберг | Химия | «Для его исследований молекулярной основы эукариотической транскрипции » [ 149 ] |
| 2009 | Есть Э. Йонат | Химия | «Для исследований структуры и функции рибосомы » [ 150 ] |
| Томас А. Стейц | |||
| Венкатраман Рамакришнан | |||
| 2012 | Брайан Кобилка | Химия | «Для исследований рецепторов, связанных с G-белком » [ 151 ] |
Смотрите также
[ редактировать ]- Beevers - Lipson Strip
- Брэгг Дифракция
- Кристаллографическая база данных
- Кристаллографические группы
- Карта плотности разницы
- Дифракция электронов
- Энергетическая дисперсионная рентгеновская дифракция
- Параметр Flack
- Дифракция пастбищного заболевания
- Хендерсон лимит
- Международный год кристаллографии
- Формализм плотности мультипольной плотности
- Нейтронная дифракция
- Порошковая дифракция
- Птихография
- Уравнение Шеррера
- Небольшое угловое рентгеновское рассеяние (SAXS)
- Определение структуры
- Ультрастадовый рентген
- Широкологическое рентгеновское рассеяние (воски)
- Рентгеновская дифракция
Примечания
[ редактировать ]- ^ Край поглощения первоначально известен по рентгеновской спектроскопии поглощения . Видеть «Рентгеновский аномальный рассеяние» . skuld.bmsc.washington.edu . Для руководства по аномальному рассеянию.
Ссылки
[ редактировать ]- ^ Kepler J (1611). Strena seu de Nive Sexangula . Frankfurt: G. Tampach. ISBN 3-321-00021-0 Полем Архивировано из оригинала 2011-09-19 . Получено 2008-08-25 .
- ^ Стено Н (1669). Твердый содержит естественное содержание диссертации . Флоренция.
- ^ Хессель JF (1831). Кристаллометрия или кристаллономия и кристаллография . Лейпциг.
- ^ Bravais A (1850). «Мемуары о системах, сформированных распределенными точками, регулируемыми на плоскости или в пространстве». Журнал Ecole Polytechnique . 19 : 1.
- ^ Shafranovskii II, Belov NV (1962). Пол Эвальд (ред.). "Es Fedorov" (PDF) . 50 лет рентгеновской дифракции . Springer: 351. ISBN 90-277-9029-9 Полем Архивировано (PDF) из оригинала 2007-09-28 . Получено 2007-09-25 .
- ^ Schönflies A (1891). Кристаллические системы и кристаллическая структура . Лейпциг.
- ^ Барлоу W (1883). «Вероятная природа внутренней симметрии кристаллов» . Природа . 29 (738): 186. Bibcode : 1883nater..29..186b . doi : 10.1038/029186a0 . Архивировано из оригинала 2020-03-29 . Получено 2019-09-10 . Смотрите также Барлоу W (1883). «Вероятная природа внутренней симметрии кристаллов» . Природа . 29 (739): 205. Bibcode : 1883nater..29..205b . doi : 10.1038/029205A0 . SOHNCKE L (1884). «Вероятная природа внутренней симметрии кристаллов» . Природа . 29 (747): 383. Bibcode : 18844natur..29..383s . doi : 10.1038/029383a0 . S2CID 4072817 . Архивировано из оригинала 2020-03-29 . Получено 2019-09-10 . Барлоу Вм (1884). «Вероятная природа внутренней симметрии кристаллов» . Природа . 29 (748): 404. Bibcode : 18844natur..29..404b . doi : 10.1038/029404b0 . S2CID 4016086 . Архивировано из оригинала 2020-03-29 . Получено 2019-09-10 .
- ^ Jump up to: а беременный Stoddart C (1 марта 2022 г.). «Структурная биология: как белки получили свой крупный план» . Познаваемый журнал . doi : 10.1146/Познание-022822-1 . Архивировано из оригинала 7 апреля 2022 года . Получено 25 марта 2022 года .
- ^ Баркла, Чарльз Г. (1911). «XXXIX. Спектры флуоресцентных излучений Röntgen». Философский журнал. Серия 6. 22 (129): 396–412. doi: 10.1080/14786440908637137.
- ^ Jump up to: а беременный Майкл Экерт, Спорное открытие: начало дифракции рентгеновских лучей в кристаллах в 1912 году и его последствий, январь 2011 года, Acta Crystallographica. Раздел A, Основы кристаллографии 68 (1): 30–39 Эта статья Laue Centennial также была опубликована в Zeitschrift für Kristallographie [Eckert (2012). З. Кристаллог. 227, 27–35].
- ^ Нисио, Сигеко. «Формирование квантовой теории Соммерфельда 1916 года». (1974) JSHS, № 12. Стр .39-78.
- ^ Эйнштейн А (1905). «О эвристической точке зрения, относящейся к производству и трансформации света» [эвристическая модель создания и трансформации света]. Анналы физики (на немецком языке). 17 (6): 132. Bibcode : 1905anp ... 322..132e . Doi : 10.1002/andp.19053220607 . Полем Для английского перевода доступен в Wikisource .
- ^ Сравните: Эйнштейн А (1909). «О развитии наших взглядов на природу и конституцию радиации» [развитие наших взглядов на состав и сущность радиации]. Физический журнал (на немецком языке). 10 : 817 . Для английского перевода доступен в Wikisource .
- ^ Пайс А (1982). Тонкий - Господь: наука и жизнь Альберта Эйнштейна . Издательство Оксфордского университета . ISBN 0-19-853907-X .
- ^ Комптон А (1923). «Квантовая теория рассеяния рентгеновских лучей по световым элементам» (PDF) . Физический Преподобный 21 (5): 483. Bibcode : 1923phrv ... 21..483c . doi : 10.1103/physrev.21.483 . Архивировано (PDF) из оригинала 2020-08-10 . Получено 2019-09-15 .
- ^ Брэгг В.П. (1907). «Природа лучей Röntgen». Сделки Королевского общества науки Австралии . 31 : 94.
- ^ Брэгг В.П. (1908). «Природа γ- и рентген» . Природа . 77 (1995): 270. Bibcode : 1908natur..77..270b . doi : 10.1038/077270a0 . S2CID 4020075 . Архивировано из оригинала 2020-03-29 . Получено 2019-09-10 . Смотрите также Брэгг В.П. (1908). «Природа γ и рентген» . Природа . 78 (2021): 271. Bibcode : 1908natur..78..271b . doi : 10.1038/078271a0 . S2CID 4039315 . Архивировано из оригинала 2021-03-27 . Получено 2020-06-03 . Брэгг В.П. (1908). «Природа γ и рентген». Природа . 78 (2022): 293. Bibcode : 1908natur..78..293b . doi : 10.1038/078293d0 . S2CID 3993814 . Брэгг В.П. (1908). «Природа рентгеновских снимков» . Природа . 78 (2035): 665. Bibcode : 1908natur..78r.665b . doi : 10.1038/078665b0 . S2CID 4024851 . Архивировано из оригинала 2021-03-27 . Получено 2020-08-27 .
- ^ Брэгг В.Х. (1910). «Последствия корпускулярной гипотезы γ- и рентгеновских лучей и диапазона β-лучей» . Фил. Маг 20 (117): 385. doi : 10.1080/14786441008636917 . Архивировано из оригинала 2020-03-29 . Получено 2019-09-10 .
- ^ Брэгг В.П. (1912). «О прямой или косвенной природе ионизации рентгеновскими снимками». Фил. Маг 23 (136): 647. doi : 10.1080/14786440408637253 .
- ^ Jump up to: а беременный в Фридрих В., Поиск П, Лау М. (1912). «Симптомы интерференции в рентгеновских снимках» (PDF) . Отчеты о встречах математического физического класса Королевской баварской академии наук в Мюнхене [ явления помех в рентген ]. 1912 : 303. Архивированный (PDF) из оригинала на 2024-05-21 . Получено 2024-07-14 .
- ^ фон Лау М (1914). «Что касается обнаружения рентгеновских помех» (PDF) . Нобелевские лекции, физика . 1901–1921. Архивировано (PDF) из оригинала 2010-12-07 . Получено 2009-02-18 .
- ^ Дана Эс, Форд мы (1932). Учебник минералогии (четвертое изд.). Нью -Йорк: Джон Уайли и сыновья. п. 28
- ^ Брэгг WL (1912). «Зеркальная рефлексия рентгеновских снимков» . Природа . 90 (2250): 410. Bibcode : 1912natur..90..410B . doi : 10.1038/090410b0 . S2CID 3952319 . Архивировано из оригинала 2020-03-29 . Получено 2019-09-10 .
- ^ Брэгг WL (1913). «Дифракция коротких электромагнитных волн кристаллом». Труды Кембриджского философского общества . 17 : 43.
- ^ Брэгг WL (1914). «Отражение X -Rays». Ежегодник радиоактивности и электроники . 11 : 350.
- ^ Брэгг WL (1913). «Структура некоторых кристаллов, как указано их дифракцией рентгеновских лучей» . Прокурор R. Soc. Лонд A89 (610): 248–277. Bibcode : 1913rspsa..89..248b . doi : 10.1098/rspa.1913.0083 . JSTOR 93488 .
- ^ Брэгг В.Л., Джеймс Р.В., Босанка Ч.Х. (1921). «Интенсивность рефлексии рентгеновских лучей с помощью скальной соли» . Фил. Маг 41 (243): 309. DOI : 10.1080/14786442108636225 . Архивировано из оригинала 2020-03-29 . Получено 2019-09-10 .
- ^ Брэгг В.Л., Джеймс Р.В., Босанка Ч.Х. (1921). «Интенсивность рефлексии рентгеновских лучей с помощью каменной соли. Часть II» . Фил. Маг 42 (247): 1. doi : 10.1080/14786442108633730 . Архивировано из оригинала 2020-03-29 . Получено 2019-09-10 .
- ^ Брэгг В.Л., Джеймс Р.В., Босанка Ч.Х. (1922). «Распределение электронов вокруг ядра в атомах натрия и хлора» . Фил. Маг 44 (261): 433. doi : 10.1080/14786440908565188 . Архивировано из оригинала 2020-03-29 . Получено 2019-09-10 .
- ^ Jump up to: а беременный Bragg WH, Bragg WL (1913). «Структура алмаза» . Природа . 91 (2283): 557. Bibcode : 1913natur..91..557b . doi : 10.1038/091557a0 . S2CID 3987932 . Архивировано из оригинала 2021-03-26 . Получено 2020-08-27 .
- ^ Bragg WH, Bragg WL (1913). «Структура алмаза» . Прокурор R. Soc. Лонд A89 (610): 277. Bibcode : 1913rspsa..89..277b . doi : 10.1098/rspa.1913.0084 .
- ^ Брэгг WL (1914). «Кристаллическая структура меди» . Фил. Маг 28 (165): 355. DOI : 10.1080/14786440908635219 . Архивировано из оригинала 2020-03-29 . Получено 2019-09-10 .
- ^ Jump up to: а беременный Брэгг WL (1914). «Анализ кристаллов с помощью рентгеновского спектрометра» . Прокурор R. Soc. Лонд A89 (613): 468. Bibcode : 1914rspsa..89..468b . doi : 10.1098/rspa.1914.0015 .
- ^ Брэгг В.П. (1915). «Структура группировки шпинели кристаллов» . Фил. Маг 30 (176): 305. doi : 10.1080/14786440808635400 . Архивировано из оригинала 2020-03-29 . Получено 2019-09-10 .
- ^ Нишикава С. (1915). «Структура некоторых кристаллов шпинельной группы». Прокурор Токио математика. Физический Соц 8 : 199.
- ^ Vegard L (1916). «Результаты кристаллического анализа» . Фил. Маг 32 (187): 65. DOI : 10.1080/14786441608635544 . Архивировано из оригинала 2020-03-29 . Получено 2019-09-10 .
- ^ Аминофф Г. (1919). «Кристаллическая структура пирохруита» . Стокгольм Геол. Форен. Форх . 41 : 407. DOI : 10.1080/11035891909447000 . Архивировано из оригинала 2020-03-29 . Получено 2019-09-10 .
- ^ Аминофф Г. (1921). «О структуре гидроксида магния». З. Кристаллог . 56 : 505.
- ^ Брэгг WL (1920). «Кристаллическая структура оксида цинка» . Фил. Маг 39 (234): 647. doi : 10.1080/14786440608636079 . Архивировано из оригинала 2021-10-25 . Получено 2020-06-03 .
- ^ Debije P , Scherrer P (1916). «Вмешательство на случайно ориентированные частицы в x -ray i». Физический журнал . 17 : 277.
- ^ Фридрих В. (1913). «Новое появление помех в x -rays». Физический журнал . 14 : 317.
- ^ Халл AW (1917). «Новый метод анализа рентгеновских кристаллов». Физический Преподобный 10 (6): 661. Bibcode : 1917phrv ... 10..661H . doi : 10.1103/physrev.10.661 .
- ^ Бернал Д.Д. (1924). «Структура графита». Прокурор R. Soc. Лонд A106 (740): 749–773. JSTOR 94336 .
- ^ Хассел О, Мак (1924). «О кристаллической структуре графита». Журнал физики . 25 (1): 317. Bibcode : 1924zphy ... 25..317H . Doi : 10.1007/bf01327534 . S2CID 121157442 .
- ^ Халл AW (1917). «Кристаллическая структура железа». Физический Преподобный 9 (1): 84. Bibcode : 1917 Phrv .... 9 ... 83. Полем doi : 10.1103/physrev.9.83 .
- ^ Халл AW (июль 1917 г.). «Кристаллическая структура магния» . Труды Национальной академии наук Соединенных Штатов Америки . 3 (7): 470–473. Bibcode : 1917pnas .... 3..470h . doi : 10.1073/pnas.3.7.470 . PMC 1091290 . PMID 16576242 .
- ^ Wyckoff RW, Posnjak E (1921). «Кристаллическая структура хлороплатината аммония» . J. Am. Химический Соц 43 (11): 2292. doi : 10.1021/ja01444a002 . Архивировано из оригинала 2021-04-13 . Получено 2020-06-03 .
- ^ Jump up to: а беременный Брэгг В.П. (1921). «Структура органических кристаллов» . Прокурор R. Soc. Лонд 34 (1): 33. Bibcode : 1921ppsl ... 34 ... 33b . doi : 10.1088/1478-7814/34/1/306 . S2CID 4098112 . Архивировано из оригинала 2021-04-13 . Получено 2020-08-27 .
- ^ Лонсдейл К (1928). «Структура бензольного кольца» . Природа . 122 (3082): 810. Bibcode : 1928natur.122..810L . doi : 10.1038/122810C0 . S2CID 4105837 .
- ^ Полинг Л. (1960). Природа химической связи (3 -е изд.). Итака, Нью -Йорк: издательство Корнелльского университета . ISBN 0-8014-0333-2 .
- ^ Брэгг В.П. (1922). «Кристаллическая структура антрацен» . Прокурор R. Soc. Лонд 35 (1): 167. Bibcode : 1922ppsl ... 35..167b . doi : 10.1088/1478-7814/35/1/320 . Архивировано из оригинала 2021-04-13 . Получено 2020-08-27 .
- ^ Дикинсон Р.Г., Рэймонд А.Л. (1923). «Кристаллическая структура гексаметилен-тетрамина» (PDF) . J. Am. Химический Соц 45 : 22. doi : 10.1021/ja01654a003 . Архивировано (PDF) из оригинала 2020-08-11 . Получено 2019-09-10 .
- ^ Мюллер А (1923). «Рентгеновское исследование жирных кислот». Журнал химического общества . 123 : 2043. DOI : 10.1039/CT9232302043 .
- ^ Saville WB, Shearer G (1925). «Рентгеновское исследование насыщенных алифатических кетонов». Журнал химического общества . 127 : 591. DOI : 10.1039/CT9252700591 .
- ^ Брэгг В.П. (1925). «Исследование тонких пленок с помощью рентгеновских снимков» . Природа . 115 (2886): 266. Bibcode : 1925natur.115..266b . doi : 10.1038/115266a0 .
- ^ Де Брогли М. , Триллат Дж.Дж. (1925). «О физической интерпретации x спектры жирных кислот». Еженедельные сообщения о сессиях Академии наук . 180 : 1485.
- ^ Триллат JJ (1926). «X -Rays и органические соединения с цепью. Спектрографические исследования потеют их структуры и ориентации». Анналы физики . 10 (6): 5. Bibcode : 1926anph ... 10 .... 5t . Doi : 10.1051/anphys/192610060005 .
- ^ Caspari WA (1928). «Кристаллография алифатических дикарбоновых кислот». Журнал химического общества . ? : 3235. DOI : 10.1039/JR9280003235 .
- ^ Мюллер А (1928). «Рентгеновское исследование длинных цепных соединений (п. Углеводородов)» . Прокурор R. Soc. Лонд 120 (785): 437. Bibcode : 1928rspsa.120..437m . doi : 10.1098/rspa.1928.0158 .
- ^ Piper SH (1929). «Некоторые примеры информации, доступной из длинных пространств жирных кислот». Труды общества Фарадея . 25 : 348. DOI : 10.1039/TF9292500348 .
- ^ Мюллер А (1929). «Связь между зигзагообразной структурой углеводородной цепи и чередованием в свойствах нечетных и даже пронумерованных цепных соединений» . Прокурор R. Soc. Лонд 124 (794): 317. Bibcode : 1929rspsa.124..317m . doi : 10.1098/rspa.1929.0117 .
- ^ Робертсон Дж. М. (1936). «Рентгеновское исследование фталоцианинов, часть II». Журнал Химического общества : 1195. DOI : 10.1039/JR9360001195 .
- ^ Пауэлл Х.М., Эвенс Р.В. (1939). «Кристаллическая структура железного эннекарбонила». J. Chem. Соц : 286. doi : 10.1039/jr9390000286 .
- ^ Бертран Дж. «Связанный металлический полинуклеарный комплексный анион в CSRECL 4 ». J. Am. Химический Соц 85 (9): 1349. DOI : 10.1021/ja00892a029 .
- ^ Робинсон В.Т., Фергюссон Дж., Пенфолд Б.Р. (1963). «Конфигурация аниона в CSRECL 4 ». Труды Химического общества Лондона : 116.
- ^ Cotton FA , Curtis NF, Harris CB, Johnson BF, Lippard SJ, Mague JT и др. (Сентябрь 1964). «Мононуклеарная и полинуклеарная химия Rhenium (III): его выраженная гомофильность». Наука . 145 (3638): 1305–1307. Bibcode : 1964sci ... 145.1305c . doi : 10.1126/science.145.3638.1305 . PMID 17802015 . S2CID 29700317 .
- ^ Коттон Ф.А. , Харрис К.Б. (1965). «Кристаллическая и молекулярная структура дигидрата дипотассий -октахлорхената (III)». Неорганическая химия . 4 (3): 330. DOI : 10.1021/IC50025A015 .
- ^ Хлопок Ф.А. (1965). "Металлическая металлическая связь в [re 2 x 8 ] 2− Ионы и другие кластеры атома металлов ». Неорганическая химия . 4 (3): 334. DOI : 10.1021/IC50025A016 .
- ^ Eberhardt WH, Crawford Jr W, Lipscomb WN (1954). «Структура валентности гидридов бора». J. Chem. Физический 22 (6): 989. Bibcode : 1954jchph..22..989e . doi : 10.1063/1.1740320 .
- ^ Martin TW, Derewenda ZS (май 1999). «Имя Бонда - Бонга». Природа структурная биология . 6 (5): 403–406. doi : 10.1038/8195 . PMID 10331860 . S2CID 27195273 .
- ^ Dunitz JD, Orgel LE, Rich A (1956). «Кристаллическая структура ферроцена» . Acta Crystallographica . 9 (4): 373. Bibcode : 1956accry ... 9..373d . doi : 10.1107/s0365110x56001091 .
- ^ Seiler P, Dunitz JD (1979). «Новая интерпретация неупорядоченной кристаллической структуры ферроцена». Acta Crystallographica b . 35 (5): 1068. Bibcode : 1979ccrb..35.1068s . doi : 10.1107/s0567740879005598 .
- ^ Wunderlich JA, Mellor DP (1954). «Примечание о кристаллической структуре соли Зейз» . Acta Crystallographica . 7 (1): 130. Bibcode : 1954accry ... 7..130W . doi : 10.1107/s0365110x5400028x .
- ^ Jarvis JA, Kilbourn BT, Owston PG (1970). «Повторное определение кристаллической и молекулярной структуры соли Зейз, KPTCL 3 .C 2 H 4 .H 2 O. Коррекция». Acta Crystallographica b . 26 (6): 876. Bibcode : 1970accrb..26..876j . doi : 10.1107/s056774087000328x .
- ^ Jarvis JA, Kilbourn BT, Owston PG (1971). «Повторное определение кристаллической и молекулярной структуры соли Зейз, KPTCL 3 .C 2 H 4 .H 2 O» . Acta Crystallographica b . 27 (2): 366. Bibcode : 1971accrb..27..366j . doi : 10.1107/s0567740871002231 .
- ^ Love RA, Koetzle TF, Williams GJ, Andrews LC, Bau R (1975). «Нейтронный дифракционный исследование структуры соли Зейз, KPTCL 3 (C 2 H 4 ) .h 2 O». Неорганическая химия . 14 (11): 2653. DOI : 10.1021/IC50153A012 .
- ^ Jump up to: а беременный Браун Д (30 октября 2012 г.). «Первые исследования почвы НАСА Ровера помогают марсианским минералам отпечатков пальцев» . НАСА . Архивировано с оригинала 3 июня 2016 года . Получено 31 октября 2012 года .
- ^ Westgren A, Phragmén G (1925). «Анализ рентгеновских сплавов сплавов Cu-ZN, AG-ZN и Au-ZN». Фил. Маг 50 : 311. DOI : 10.1080/14786442508634742 .
- ^ Брэдли А.Дж., Тевлис Дж (1926). «Структура γ-браса» . Прокурор R. Soc. Лонд 112 (762): 678. Bibcode : 1926rspsa.112..678b . doi : 10.1098/rspa.1926.0134 .
- ^ Хьюм-Рутери В. (1926). «Исследования о природе, свойствах и условиях формирования интерметаллических соединений (с особым ссылкой на определенные соединения олова)». Журнал Института металлов . 35 : 295.
- ^ Брэдли А.Дж., Грегори Ч. (1927). «Структура некоторых тройных сплавов» . Природа . 120 (3027): 678. Bibcode : 1927natur.120..678. Полем doi : 10.1038/120678a0 .
- ^ Западный Грен А (1932). «О химии сплавов». Прикладная химия . 45 (2): 33. Bibcode : 1932angch .. 45 ... 33W . Doi : 10.1002/Прилагается .
- ^ Бернал Д.Д. (1935). «Электронная теория металлов». Годовые отчеты о прогрессе химии . 32 : 181. doi : 10.1039/ar9353200181 .
- ^ Полинг Л (1923). «Кристаллическая структура магния Stannide». J. Am. Химический Соц 45 (12): 2777. doi : 10.1021/ja01665a001 .
- ^ Полинг Л (1929). «Принципы, определяющие структуру сложных ионных кристаллов». J. Am. Химический Соц 51 (4): 1010. DOI : 10.1021/JA01379A006 .
- ^ «Кембриджская структурная база данных | CCDC» . www.ccdc.cam.ac.uk. Архивировано из оригинала на 2024-05-07 . Получено 2024-05-07 .
- ^ Ходжкин, округ Колумбия (1935). «Рентгеновские монокристаллические фотографии инсулина» . Природа . 135 (3415): 591. Bibcode : 1935nater.135..591c . doi : 10.1038/135591a0 . S2CID 4121225 .
- ^ Kendrew JC , Bodo G, Dintzis HM, Parrish RG, Wyckoff H, Phillips DC (март 1958 г.). «Трехмерная модель молекулы миоглобина, полученная с помощью рентгеновского анализа». Природа . 181 (4610): 662–666. Bibcode : 1958natur.181..662K . doi : 10.1038/181662a0 . PMID 13517261 . S2CID 4162786 .
- ^ «Нобелевская премия по химии 1962» . www.nobelprize.org . Архивировано из оригинала 2018-01-31 . Получено 2018-01-31 .
- ^ «Таблица записей в PDB, расположенная экспериментальным методом» . Архивировано из оригинала 2017-07-11 . Получено 2017-07-24 .
- ^ «Статистика PDB» . RCSB Белковой банк данных. Архивировано из оригинала на 2009-09-05 . Получено 2010-02-09 .
- ^ Scapin G (2006). «Структурная биология и открытие лекарств». Текущий фармацевтический дизайн . 12 (17): 2087–2097. doi : 10.2174/138161206777585201 . PMID 16796557 .
- ^ Lundstrom K (ноябрь 2006 г.). «Структурная геномика для мембранных белков» . Клеточные и молекулярные науки о жизни . 63 (22): 2597–2607. doi : 10.1007/s00018-006-6252-y . PMC 11136435 . PMID 17013556 . S2CID 13432321 .
- ^ Lundstrom K (август 2004 г.). «Структурная геномика на мембранных белках: мини -обзор». Комбинаторная химия и высокая пропускная способность . 7 (5): 431–439. doi : 10.2174/1386207043328634 . PMID 15320710 .
- ^ Chinte U, Shah B, Chen YS, Pinkerton AA, Schall CA, Hanson BL (апрель 2007 г.). «Криогенное (<20 К) гелий охлаждение смягчает радиационное повреждение кристаллов белка». Acta Crystallographica. Раздел D, биологическая кристаллография . 63 (Pt 4): 486–492. Bibcode : 2007accrd..63..486c . doi : 10.1107/s0907444907005264 . PMID 17372353 .
- ^ Джонс Н (январь 2014 г.). «Кристаллография: атомные секреты» . Природа . 505 (7485): 602–603. Bibcode : 2014natur.505..602j . doi : 10.1038/505602a . PMID 24476871 .
- ^ «Морфология рентгеновский анализ | ИМР -тестовые лаборатории» . www.imrtest.com . Получено 2018-04-30 . [ Постоянная мертвая ссылка ]
- ^ Harp JM, Timm DE, Bunick GJ (июль 1998 г.). «Макромолекулярное кристаллическое отжиг: преодоление повышенной мозаичности, связанной с криокристаллографией». Acta Crystallographica. Раздел D, биологическая кристаллография . 54 (Pt 4): 622–628. Bibcode : 1998ccrd..54..622H . doi : 10.1107/s0907444997019008 . PMID 9761858 .
- ^ Harp JM, Hanson BL, Timm DE, Bunick GJ (июль 1999 г.). «Макромолекулярный кристаллический отжиг: оценка методов и переменных». Acta Crystallographica. Раздел D, биологическая кристаллография . 55 (Pt 7): 1329–1334. Bibcode : 1999ccrd..55.1329h . doi : 10.1107/s0907444999005442 . PMID 10393299 .
- ^ Hanson BL, Harp JM, Bunick GJ (2003). «Хорошо хрустящий кристалл белка: отжигание макромолекулярных кристаллов». Макромолекулярная кристаллография, часть c . Методы в фермере. Тол. 368. С. 217–35. doi : 10.1016/s0076-6879 (03) 68012-2 . ISBN 978-0-12-182271-2 Полем PMID 14674276 .
- ^ Geerlof A, Brown J, Coutard B, Egloff MP, Enguita FJ, Fogg MJ, et al. (Октябрь 2006 г.). «Влияние характеристики белка в структурной протеомике» . Acta Crystallographica. Раздел D, биологическая кристаллография . 62 (Pt 10): 1125–1136. Bibcode : 2006ccrd..62.1125g . doi : 10.1107/s0907444906030307 . PMC 7161605 . PMID 17001090 .
- ^ Чернов А.А. (апрель 2003 г.). «Протеиновые кристаллы и их рост». Журнал структурной биологии . 142 (1): 3–21. doi : 10.1016/s1047-8477 (03) 00034-0 . PMID 12718915 .
- ^ Bergfors T (2016). «Учебное пособие по кристаллизации белка» . Архивировано с оригинала 2019-12-25 . Получено 2020-01-17 .
- ^ Chayen N (1997). «Ограничения кристаллизации под маслом» . Клетка . 5 (10): 1269–1274. doi : 10.1016/s0969-2126 (97) 00279-7 . PMID 9351804 .
- ^ Рупп Б., Ван Дж (ноябрь 2004 г.). «Прогнозирующие модели для кристаллизации белка». Методы 34 (3): 390–407. doi : 10.1016/j.ymeth.2004.03.031 . PMID 15325656 .
- ^ Chayen NE (июль 2005 г.). «Методы разделения нуклеации и роста кристаллизации белка» . Прогресс в биофизике и молекулярной биологии . 88 (3): 329–337. doi : 10.1016/j.pbiomolbio.2004.07.007 . PMID 15652248 .
- ^ Stock D, Perisic O, Löwe J (июль 2005 г.). «Роботизированная кристаллизация белка нанолитрового белка в лаборатории MRC молекулярной биологии» . Прогресс в биофизике и молекулярной биологии . 88 (3): 311–327. doi : 10.1016/j.pbiomolbio.2004.07.009 . PMID 15652247 .
- ^ Джерузалми Д. (2006). «Первый анализ макромолекулярных кристаллов: биохимия и рентгеновская дифракция». Макромолекулярная кристаллография протоколов, том 2 . Методы в молекулярной биологии. Тол. 364. С. 43–62. doi : 10.1385/1-59745-266-1: 43 . ISBN 1-59745-266-1 Полем PMID 17172760 .
- ^ Helliwell Jr (июнь 2005 г.). «Протеиновое кристаллическое совершенство и его применение» . Acta Crystallographica. Раздел D, биологическая кристаллография . 61 (Pt 6): 793–798. Bibcode : 2005ccrd..61..793h . doi : 10.1107/s0907444905001368 . PMID 15930642 .
- ^ Равелли Р.Б., Гарман Эф (октябрь 2006 г.). «Радиационное повреждение при макромолекулярной криокристаллографии». Современное мнение в структурной биологии . 16 (5): 624–629. doi : 10.1016/j.sbi.2006.08.001 . PMID 16938450 .
- ^ Пауэлл Хр (октябрь 1999). «Алгоритм аутоиндексирования Россмана Фурье в MOSFLM» . Acta Crystallographica. Раздел D, биологическая кристаллография . 55 (Pt 10): 1690–1695. Bibcode : 1999ccrd..55.1690p . doi : 10.1107/s0907444999009506 . PMID 10531518 .
- ^ Hauptman H (октябрь 1997 г.). «Методы фазирования кристаллографии белка». Современное мнение в структурной биологии . 7 (5): 672–680. doi : 10.1016/s0959-440x (97) 80077-2 . PMID 9345626 .
- ^ Usón I, Sheldrick GM (октябрь 1999 г.). «Достижения в прямых методах кристаллографии белка» . Современное мнение в структурной биологии . 9 (5): 643–648. doi : 10.1016/s0959-440x (99) 00020-2 . PMID 10508770 .
- ^ Jump up to: а беременный Тейлор Г (ноябрь 2003 г.). «Проблема фазы» . Acta Crystallographica. Раздел D, биологическая кристаллография . 59 (Pt 11): 1881–1890. Bibcode : 2003ccrd..59.1881t . doi : 10.1107/s0907444903017815 . PMID 14573942 .
- ^ Ealick SE (октябрь 2000 г.). «Достижения в множественной длине волны аномальной дифракционной кристаллографии» . Современное мнение о химической биологии . 4 (5): 495–499. doi : 10.1016/s1367-5931 (00) 00122-8 . PMID 11006535 .
- ^ Из PDB -файла 2nrl, остатки 17–32.
- ^ «Гарман Лаборатория: взаимосвязь специфичности лизосомальных ферментов - протеопедия, жизнь в 3D» . Proteopedia.org . Архивировано из оригинала 2018-11-28 . Получено 2018-11-28 .
- ^ Лэмб, Ал; Каппок, TJ; Silvaggi, NR (апрель 2015 г.). «Вы потеряны без карты: навигация по морю белковых структур» . Biochimica et Biophysica Acta (BBA) - белки и протеомика . 1854 (4): 258–68. doi : 10.1016/j.bbapap.2014.12.021 . PMC 5051661 . PMID 25554228 .
- ^ Паркин Г. (1993). «Связанный изомеризм в комплексах переходных металлов: переоценка кристаллографических данных». Химический Преподобный 93 (3): 887–911. doi : 10.1021/cr00019a003 .
- ^ Rietveld HM (1969-06-02). «Метод уточнения профиля для ядерных и магнитных структур» . Журнал прикладной кристаллографии . 2 (2): 65–71. Bibcode : 1969japcr ... 2 ... 65r . doi : 10.1107/s0021889869006558 .
- ^ Молодой Р.А. (1993). Метод Rietveld . [Честер, Англия]: Международный союз кристаллограммы. ISBN 0198555776 Полем OCLC 26299196 .
- ^ "IUCR" . www.iucr.org . Архивировано с оригинала 2019-04-06 . Получено 2019-04-06 .
- ^ "FullProf" . www.ill.eu. Архивировано из оригинала 2019-04-02 . Получено 2019-04-06 .
- ^ Petříček V, DuШек M, Палатин Л. (2014-01-01). «Кристаллографическая вычислительная система Jana2006: общие функции». Журнал кристаллографии - кристаллические материалы . 229 (5): 345–352. Doi : 10.1515/Zkri-2014-1737 . ISSN 2196-7105 . S2CID 101692863 .
- ^ Lutterotti L (февраль 2010 г.). «Общее подгонка шаблона для определения комбинированного размера - деформация - стр. - текстура в тонкой пленке». Ядерные инструменты и методы в области физики исследования B: BEAM Взаимодействие с материалами и атомами . 268 (3–4): 334–340. Bibcode : 2010nimpb.268..334L . doi : 10.1016/j.nimb.2009.09.053 . ISSN 0168-583X .
- ^ Lutterotti L, Bortolotti M, Ischia G, Lonardelli I, Wenk HR (2007), «Текстура Rietveld из дифракционных изображений», Десятая европейская конференция по порошковым дифракциям , издатель науки Oldenbourg, с. 125–130, doi : 10.1524/978348692540-020 , ISBN 9783486992540
- ^ Lutterotti L, Matthies S, Wenk HR, Schultz AS, Richardson Jr JW (1997-01-15). «Комбинированный анализ текстуры и структуры деформированного известняка из нетроновых спектров по времени полета». Журнал прикладной физики . 81 (2): 594–600. Bibcode : 1997Jap .... 81..594L . doi : 10.1063/1,364220 . ISSN 0021-8979 .
- ^ «Распределительные файлы для пакета Rietan-FP-envus» . fujioizumi.verse.jp . Архивировано с оригинала 2019-08-10 . Получено 2019-04-06 .
- ^ Toby BH, Von Drilee RB (2013-03-14). «GSAS-II: Бытие современного программного пакета с открытым исходным кодом с открытым исходным кодом». Журнал прикладной кристаллографии . 46 (2): 544–549. Bibcode : 2013japcr..46..544t . doi : 10.1107/s0021889813003531 . ISSN 0021-8898 .
- ^ "Diffrac.Suite Topas - рентгенография, рентгеновская дифракция" . Bruker.com . Архивировано из оригинала 2019-04-02 . Получено 2019-04-06 .
- ^ «Соответствие! - фазовая идентификация из порошковой дифракции» . www.crystalimpact.com . Архивировано из оригинала 2019-04-02 . Получено 2019-04-06 .
- ^ Casas-Cabanas M, Reynaud M, Rikarte J, Horbach P, Rodríguez-Carvajal J (2016-12-01). «Недостатки: программа для уточнения структур с расширенными дефектами». Журнал прикладной кристаллографии . 49 (6): 2259–2269. BIBCODE : 2016JAPCR..49.2259C . doi : 10.1107/s1600576716014473 . ISSN 1600-5767 .
- ^ Кар, Барт (2015). «Более широкое воздействие женщин на кристаллографию» . Кристаллический рост и дизайн . 15 (10): 4715–4730. doi : 10.1021/acs.cgd.5b00457 . ISSN 1528-7483 .
- ^ Ферри, Джорджина (2014). «История: женщины в кристаллографии» . Природа . 505 (7485): 609–611. Bibcode : 2014natur.505..609f . doi : 10.1038/505609a . ISSN 1476-4687 . PMID 24482834 .
- ^ Sanz-Aparicio, Julia (2015). «Взгляд на женское наследие кристаллографии | Арбор» . Беседка 191 (772): A216. Doi : 10.3989/arbor.2015.772n2002 . HDL : 10261/130728 . Арчндд из оригинала 2015-09-07.
- ^ Уотсон, Джеймс Д. (2000), Обнаружение двойной спирали , лаборатория Cold Spring Harbor, ISBN 978-0-87969-622-1 , OCLC 48554849
- ^ Глускер, Дженни Пикворт; TrueBlood, Kenneth N; Международный союз кристаллографии (2020). Анализ кристаллической структуры: праймер . ISBN 978-0-19-191790-5 Полем OCLC 1241842166 .
- ^ «Нобелевская премия по физике 1914» . Нобелевский фонд. Архивировано из оригинала 2008-09-15 . Получено 2008-10-09 .
- ^ «Нобелевская премия по физике 1915» . Нобелевский фонд. Архивировано из оригинала 2008-10-19 . Получено 2008-10-09 .
- ^ «Нобелевская премия по химии 1962» . Nobelprize.org. Архивировано из оригинала 2008-09-24 . Получено 2008-10-06 .
- ^ «Нобелевская премия по физиологии или медицине 1962» . Нобелевский фонд. Архивировано из оригинала 2018-12-26 . Получено 2007-07-28 .
- ^ «Нобелевская премия по химии 1964» . Nobelprize.org. Архивировано из оригинала 2008-10-15 . Получено 2008-10-06 .
- ^ «Нобелевская премия по химии 1972 года» . Nobelprize.org. Архивировано из оригинала 2008-10-11 . Получено 2008-10-06 .
- ^ «Нобелевская премия по химии 1976 года» . Nobelprize.org. Архивировано из оригинала 2008-12-25 . Получено 2008-10-06 .
- ^ «Нобелевская премия по химии 1985» . Nobelprize.org. Архивировано из оригинала 2008-12-25 . Получено 2008-10-06 .
- ^ «Нобелевская премия по химии 1988» . Nobelprize.org. Архивировано из оригинала 2008-12-25 . Получено 2008-10-06 .
- ^ «Нобелевская премия по химии 1997 года» . Nobelprize.org. Архивировано из оригинала 2008-10-21 . Получено 2008-10-06 .
- ^ Jump up to: а беременный «Нобелевская премия по химии 2003 года» . Nobelprize.org. Архивировано из оригинала 2008-09-29 . Получено 2008-10-06 .
- ^ «Нобелевская премия по химии 2006 года» . Nobelprize.org. Архивировано из оригинала 2008-10-17 . Получено 2008-10-06 .
- ^ «Нобелевская премия по химии 2009» . Nobelprize.org. Архивировано из оригинала на 2009-10-10 . Получено 2009-10-07 .
- ^ «Нобелевская премия по химии 2012» . Nobelprize.org. Архивировано из оригинала 2012-10-13 . Получено 2012-10-13 .
Дальнейшее чтение
[ редактировать ]Международные таблицы кристаллографии
[ редактировать ]- Hahn T, ed. (2002). Международные таблицы для кристаллографии. Том A, симметрия космической группы (5-е изд.). Дордрехт: академические издатели Kluwer , для Международного союза кристаллографии . ISBN 0-7923-6590-9 .
- Россманн М.Г., Арнольд Э, ред. (2001). Международные таблицы для кристаллографии. Объем F, кристаллография биологических молекул . Дордрехт: академические издатели Kluwer, для Международного союза кристаллографии. ISBN 0-7923-6857-6 .
- Hahn T, ed. (1996). Международные таблицы для кристаллографии. Краткое учебное издание тома A, симметрия космической группы (4-е изд.). Дордрехт: академические издатели Kluwer, для Международного союза кристаллографии. ISBN 0-7923-4252-6 .
Связанные коллекции статей
[ редактировать ]- Carter Jr CW, Sweet RM, Eds. (1997). Макромолекулярная кристаллография, часть A (методы в фермере, т. 276) . Сан -Диего: академическая пресса. ISBN 0-12-182177-3 .
- Carter Jr CW, Sweet RM, Eds. (1997). Макромолекулярная кристаллография, часть B (методы в фермере, т. 277) . Сан -Диего: академическая пресса. ISBN 0-12-182178-1 .
- Ducruix A, Giegé R, Eds. (1999). Кристаллизация нуклеиновых кислот и белков: практический подход (2 -е изд.). Оксфорд: издательство Оксфордского университета. ISBN 0-19-963678-8 .
Учебники
[ редактировать ]- Биркхольц М., Фатистер П.Ф., Гензель С. (2005). «Глава 1: Принципы рентгеновской дифракции» . Тонкопленка с помощью рентгеновского рассеяния . Вейнхайм: Wiley-VCH. ISBN 978-3-527-31052-4 - через ResearchGate.
- Благодарность D (2002). Схема кристаллографии для биологов . Оксфорд: издательство Оксфордского университета. ISBN 0-19-851051-9 .
- Бернс Г., Глейзер А.М. (1990). Космические группы для ученых и инженеров (2 -е изд.). Бостон: Academic Press, Inc. ISBN 0-12-145761-3 .
- Clegg W (1998). Определение кристаллической структуры (Оксфордский химический праймер) . Оксфорд: издательство Оксфордского университета. ISBN 0-19-855901-1 .
- Cullity BD (1978). Элементы рентгеновской дифракции (2-е изд.). Рединг, Массачусетс: издательская компания Аддисон-Уэсли. ISBN 0-534-55396-6 .
- Дрент Дж (1999). Принципы белковой рентгеновской кристаллографии . Нью-Йорк: Springer-Verlag. ISBN 0-387-98587-5 .
- Гиковаццо С. (1992). Основы кристаллографии . Оксфорд: издательство Оксфордского университета. ISBN 0-19-855578-4 .
- Glusker JP, Lewis M, Rossi M (1994). Анализ кристаллической структуры для химиков и биологов . Нью -Йорк: VCH Publishers. ISBN 0-471-18543-4 .
- Масса В. (2004). Определение кристаллической структуры . Берлин: Спрингер. ISBN 3-540-20644-2 .
- Макферсон А. (1999). Кристаллизация биологических макромолекул . Cold Spring Harbour, NY: Laboratory Press Cold Spring Harbour. ISBN 0-87969-617-6 .
- Макферсон А. (2003). Введение в макромолекулярную кристаллографию . Джон Уайли и сыновья. ISBN 0-471-25122-4 .
- Макри Де (1993). Практическая кристаллография белка . Сан -Диего: академическая пресса. ISBN 0-12-486050-8 .
- О'Киф М., Хайд Б.Г. (1996). Кристаллические структуры; И. Паттерны и симметрия . Вашингтон, округ Колумбия: Минералогическое общество Америки, серия монографий. ISBN 0-939950-40-5 .
- Родс Г. (2000). Кристаллография сделана кристально чистой (PDF) . Сан -Диего: академическая пресса. ISBN 0-12-587072-8 Полем Архивировано (PDF) из оригинала на 2021-10-08 . Получено 2007-09-16 -через UW-Eau Claire, Chem 406, осень 2005 года.
- Рупп Б. (2009). Биомолекулярная кристаллография: принципы, практика и применение к структурной биологии . Нью -Йорк: Гарлендская наука. ISBN 978-0-8153-4081-2 .
- Уоррен Бэй (1969). Рентгеновская дифракция . Нью -Йорк: Dover Publications. ISBN 0-486-66317-5 .
- Захариасен В.Х. (1945). Теория рентгеновской дифракции в кристаллах . Нью -Йорк: Dover Publications. LCCN 67026967 .
Применяемый анализ вычислительных данных
[ редактировать ]- Молодой РА, изд. (1993). Метод Rietveld . Оксфорд: издательство Оксфордского университета и Международный союз кристаллографии. ISBN 0-19-855577-6 .
Исторический
[ редактировать ]- Bijvoet MJ , Burgers WG, Hägg G, Eds. (1969). Ранние документы о дифракции рентгеновских лучей кристаллами . Тол. I. Utrecht: опубликовано для Международного союза кристаллографии A. oostek's Uitgeversmaatschappij nv
- Bijvoet JM, Burgers WG, Hägg G, Eds. (1972). Ранние документы о дифракции рентгеновских лучей кристаллами . Полный. II Utrecht: опубликовано для Международного союза кристаллографии A. oostek's Uitgeversmaatschappij nv
- Bragg WL, Phillips DC, Lipson H (1992). Разработка рентгеновского анализа . Нью -Йорк: Дувер. ISBN 0-486-67316-2 .
- Ewald PP , et al., Eds. (1962). Пятьдесят лет рентгеновской дифракции . Утрехт: опубликовано для Международного союза кристаллографии A. oostek's Uitgeversmaatschappij nv doi : 10.1007/978-1-4615-9961-6 . ISBN 978-1-4615-9963-0 .
- Эвальд Пп (ред.). «50 лет рентгеновской дифракции» . Международный союз кристаллографии. Архивировано из оригинала 2008-03-23 . Получено 2006-12-11 .
Перепечатано в формате PDF для Конгресса IUCR XVIII, Глазго, Шотландия
- Фридрих В. (1922). «История поиска X -Rays» . Естественные науки . 10 (16): 363. Код BIB : 1922NW ..... 10..363f . Doi : 10.1007/bf01565289 . S2CID 28141506 . Архивировано из оригинала 2020-03-29 . Получено 2019-12-03 .
- Лонсдейл К (1949). Кристаллы и рентген . Нью -Йорк: Д. Ван Ностранд.
Внешние ссылки
[ редактировать ]Учебные пособия
[ редактировать ]- Изучение кристаллографии
- Простое, не техническое введение
- Коллекция кристаллографии , видео сериалы из Королевского института
- «Кристализация малых молекул» ( PDF ) на Иллинойса Института технологий веб -сайте
- Международный союз кристаллографии
- Кристаллография 101
- Учебник интерактивного структуры , демонстрируя свойства дифракционной картины 2D -кристалла.
- Книга изображений преобразований Фурье , иллюстрируя взаимосвязь между кристаллом и дифракционной паттерной в 2D.
- Заметки лекций о рентгеновской кристаллографии и определении структуры
- Онлайн-лекция о современных методах рассеяния рентгеновских лучей для анализа наноразмерных материалов Ричарда Дж. Матии
- Интерактивная кристаллография сроки архивирована 2021-06-30 на машине Wayback от Королевского института
Основные базы данных
[ редактировать ]- Кристаллография открытая база данных (COD)
- Банк данных белка ( PDB )
- Дата банка нуклеиновой кислоты (NDB)
- Кембриджская структурная база данных ( CSD )
- База данных неорганической кристаллической структуры ( ICSD )
- База данных кристаллизации биологической макромолекулы (BMCD)
Производные базы данных
[ редактировать ]- Pdbsum
- Протеопедия - совместная, 3D -энциклопедия белков и других молекул
- RNabase
- База данных HIC-UP лигандов PDB Архивирована 2020-08-08 на машине Wayback
- Структурная классификация базы данных белков
- Классификация структуры белка CATH
- Список трансмембранных белков с известной трехмерной структурой архивировал 2011-04-11 на машине Wayback
- Ориентации белков в базе данных мембран
Структурная проверка
[ редактировать ]- Molprobity Structural Validation Suite
- Проза-вае
- NQ-Flipper (проверьте неблагоприятные ротамеры остатков ASN и GLN)
- DALI Server (идентифицирует белки, сходные с данным белком)



