Актинин
Актинин - это микрофиламентальный белок. Функциональный белок представляет собой антипараллельный димер , который сшивает тонкие филаменты в соседних саркомерах и, следовательно, координирует сокращения между саркомерами по горизонтальной оси. Альфа-актинин является частью суперсемейства спектрина . Эта суперсемейство состоит из спектрина, дистрофина и их гомологичных и изоформ. В некошечных клетках это обнаруживается актиновыми филаментами и в сайтах адгезии [ 1 ] . Расположение, подобная решетке, обеспечивает стабильность для мышечного сократительного аппарата. [ 1 ] В частности, это помогает связывать актиновые филаменты с клеточной мембраной. [ 2 ] На каждом конце стержня есть сайт связывания и с пучками актиновых филаментов. [ 1 ]
Несчастные альфа-актинины, кодируемые ACTN1 и ACTN4 , широко выражены. Экспрессия ACTN2 обнаруживается как в сердечной , так и в скелетной мышце, тогда как ACTN3 ограничен последним. Оба конца стержневого димера альфа-актинина содержат актин-связывающие домены. Шесть различных белков продуцируются из четырех альфа-актининовых генов, кодирующих. [ 1 ]
Эволюция
[ редактировать ]Существует мнение, что существует общий альфа-актинин, подобный предку, когда рассматривает особенности альфа-актинина и спектрина. [ 3 ] Изучение последовательностей спектрина предоставляет доказательства двухэтапной модели, описывающей эволюцию суперсемейства спектрина. Глядя на своего общего предка, альфа-актинин и спектр имеют четыре гомологичных повторения. [ 3 ] Дублирование генов привело к появлению стабильной линии, которая привела к современным альфа-актининовым генам. Одновременно другой дублированный ген приобрел дополнительные повторения через серию неравных событий пересечения. Это сделало предок субъединицы спектрина, который является антипараллельным гомодимером, который может сшивать актиновые филаменты. [ 3 ] Альфа-актинин 1 (ACTN1) был обнаружен сорок лет назад из-за того, что он присутствовал в стыди мышечной сократительной аппараты в больших количествах. [ 4 ] Альфа-актинин-1 необходим для прикрепления актина миофиламентов к Z-линесу в клетках скелетных мышц , [ 5 ] и к плотным телам в клетках гладких мышц . [ 6 ] Альфа-актинин 2 (ACTN2) в основном обнаруживается в волокнах сердца и окислительных мышц. Некоторые из Actn2 видны в мозге. Альфа-актинин 3 (ACTN3) обычно обнаруживается в мышечных волокнах типа II, обычно известных как быстрости мышечные волокна. [ 4 ]
Структура
[ редактировать ]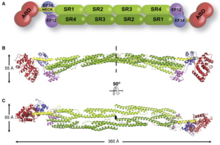
У него есть N-конце, который есть у всех членов суперсемейства. Это состоит из двух последовательных гомологии кальпонина (CH), где повторяются спектр сразу после него. Это позволяет определить длину и гибкость актин -связывающего белка. Поперечные связи актин-филаментов включают альфа-актинин, который представляет собой функциональный антипараллельный димер. [ 1 ] Он состоит из домена связывания актина (ABD), соединенного с четырьмя повторяющимися спектрином, образующими центральный стержень через гибкую область шеи. Эти повторения - 122 аминокислотных повторения. [ 8 ] Затем следует домен C-концевой кальмодулин (CAM), который содержат два мотива связывания кальция EF-руки. [ 8 ] [ 1 ] Это образует сайт связывания на каждом конце белка, что приводит к молекуле в форме стержня и с пучками актиновых филаментов. [ 1 ] Внешний вид в форме стержня обусловлен тем, что область SR имеет цилиндрическую форму. [ 7 ] На каждом конце есть функциональный домен (ABD и CAM). [ 1 ] Связывание кальция присутствует только в ACTN1 и ACTN4, в то время как ACTN2 и ACTN3 потеряли способность связывать кальций. [ 9 ]
Актин связывающий домен
[ редактировать ]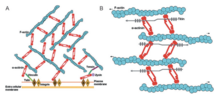
Альфа-актинин и актин являются высококонсервативными белками, а альфа-актинин наиболее консервативный во всем домене во всем семействе белков. Это связано с ABD, который связывается с доменами CH типа 1 и типа 2 (CH1 и CH2). Домен CH1-CH2 имеет гидрофильную стабилизирующую часть и гидрофобную часть. Ядро каждого домена CH имеет четыре спирали (A, C, E и G). Спирали C и G параллельны друг другу, и N-концевая спираль A и E окружает их. У людей кристаллические структуры ABD определяли из альфа-актинина 1,3 и 4. [ 1 ] ABD образует закрытую конформацию. ЯМР показал, что есть три основных ABD. Три сайта представляют собой N-концевой спираль A CH1, C-концевой спираль G-спирали CH1 и междоменным линкером, граничащим с N-концевым сегментом домена CH2. [ 1 ] Они имеют высокую близость к актиновым филаментам. Тем не менее, они должны работать вместе, чтобы иметь высшее сродство, поскольку CH2 не может связывать актиновые филаменты. С учетом сказанного, актин-связывающий домен расположен в N-концевой области молекулы альфа-актинина. [ 8 ]
Метаболизм
[ редактировать ]Альфа-актинин 3 (ACTN3) имеет недостаток около шестнадцати процентов людей, и он играет значительную роль в мышечном метаболизме. [ 10 ] Этот недостаток связан с преждевременным полиморфизмом стоп -кодона (R577X). [ 11 ] Ген R577X был выше у спортсменов на выносливость, чем у спортсменов Sprint. [ 12 ] Среди четырех альфа-актининов млекопитающих Actn3 выделяется как наиболее высокоспециализированные, в основном экспрессируемые в быстрых гликолитических волокнах в скелетных мышцах. [ 11 ] У людей, у которых есть ACTN3, ученые наблюдали лучшие результаты в спринте и силовой эффективности у спортсменов и населения в целом. [ 10 ] Несмотря на то, что это было обнаружено, недавний положительный отбор, по -видимому, повлиял на нулевый генотип XX, возможно, благодаря его появляющейся роли в регуляции мышечного метаболизма, как предполагается имеющимися доказательствами. [ 10 ] Отсутствие ACTN3 приводит к более окислительным путям энергии, используемой, поскольку активность гликогена фосфорилазы снижается. Это отсутствие ACTN3 не приводит к ясной причине мышечной болезни [ 10 ] Но было замечено изменение мышечной функции. [ 12 ]
Рак
[ редактировать ]Альфа-актинин 4 (ACTN4) экспрессируется в нешехочных клетках. Это важно, так как это связь между двумя компонентами опухоли. ACTN4 направляет связь между актиновым цитоскелетом в клетке и интегринами, которые непосредственно взаимодействуют со стромальной ECM. Кроме того, это может почувствовать и реагировать на применяемую внешнюю силу. [ 9 ] Этот процесс имеет решающее значение для образования и продолжения рака молочной железы, колоректального, яичника и рака поджелудочной железы. Объяснение о том, почему ACTN4 вносит свой вклад в образование рака, до сих пор неизвестно. В клетках рака меланомы ACTN4 играет роль в клеточной морфологии. Он изменяет клетку из более мезенхимальной клетки в клетку типа амеоида путем уменьшения центра фокальной адгезии. [ 9 ] Изменения в месте очаговой адгезии важны, поскольку места фокальной адгезии имеют решающее значение для сборки создания актин -стрессовых волокон и миграционного поведения клеток. [ 9 ] Переход от клетки мезенхимального типа на клетку типа амеоида обеспечивает более высокую скорость инвазии через коллаген. В клетках мезенхимального типа они зависят от фокальной точки адгезии и интегрина. Это допускает их вторжение через коллаген. В клетках типа амебоида отсутствует стрессовые волокна и используют высокопоседренное сокращение миозина II, которое позволяет ему вторгаться в механизм блеббинга. [ 9 ] Этот процесс - то, на что ученые смотрят дальше, так как это может прояснить значительный рост инвазии и наблюдается метастазирование, когда они перемещаются по плотной строме опухолей. [ 9 ] Мутации в ACTN4 заболевания почек могут вызвать фокальный сегментарный гломерулосклероз (FSGS). [ 13 ]
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k Sjöblom B, Salmazo A, Djinović-Carugo K (сентябрь 2008 г.). «Альфа-актининовая структура и регуляция» . Клеточные и молекулярные науки о жизни . 65 (17): 2688–2701. doi : 10.1007/s00018-008-8080-8 . PMC 11131806 . PMID 18488141 . S2CID 26321210 .
- ^ Broderick MJ, Winder SJ (январь 2005 г.). «Спектрин, альфа-актинин и дистрофин» . Достижения в химии белка . Волокнистые белки: спиральными катушками, коллагеном и эластомерами. 70 Академическая пресса: 203–246. doi : 10.1016/s0065-3233 (05) 70007-3 . ISBN 9780120342709 Полем PMID 15837517 . Получено 2023-11-06 .
- ^ Jump up to: а беременный в Viel A (ноябрь 1999 г.). «Структуры альфа-актинина и спектрина: разворачивающаяся семейная история». Письма Febs . 460 (3): 391–394. doi : 10.1016/s0014-5793 (99) 01372-1 . PMID 10556504 . S2CID 20832269 .
- ^ Jump up to: а беременный HSU KS, Kao HY (2013). «Альфа-актинин 4 и онкогенез рака молочной железы» . Витамины и гормоны . 93 : 323–351. doi : 10.1016/b978-0-12-416673-8.00005-8 . ISBN 9780124166738 Полем PMC 4143506 . PMID 23810014 .
- ^ Обзор Ganong по медицинской физиологии, 24 -е издание . Ланге (Тата МакГроу Хилл). 2012. С. 100
- ^ Габелла Г (6 декабря 2012 г.). «Структура гладких мышц» . В Szekeres L, Papp JG (Eds.). Фармакология гладких мышц . Springer Science & Business Media. С. 17–18. ISBN 978-3-642-78920-5 .
- ^ Jump up to: а беременный Рибейро Е., Финоссис Н., Гислени А., Салмазо А., Конарев П.В., Костан Дж. И др. (Декабрь 2014). «Структура и регуляция α-актинина мышц человека » Ячейка 159 (6): 1447–1 Doi : 10.1016/ j.cell.2014.10.0 PMC 4259493 PMID 2543700
- ^ Jump up to: а беременный в Бланшар А., Оханян В., Кричли Д. (август 1989 г.). «Структура и функция альфа-актинина». Журнал исследований мышц и подвижности клеток . 10 (4): 280–289. doi : 10.1007/bf01758424 . PMID 2671039 . S2CID 22230767 .
- ^ Jump up to: а беременный в дюймовый и фон Томас Д.Г., Робинсон Д.Н. (ноябрь 2017 г.). «Пятый смысл: механическая регуляция альфа-актинина-4 и его актуальность для метастазирования рака» . Семинары в биологии клеток и развития . Механосилирование: от молекул до тканей. 71 : 68–74. doi : 10.1016/j.semcdb.2017.05.024 . PMC 5659936 . PMID 28579451 .
- ^ Jump up to: а беременный в дюймовый Berman Y, North KN (август 2010 г.). «Ген для скорости: появляющаяся роль альфа-актинина-3 в мышечном метаболизме». Физиология . 25 (4): 250–259. doi : 10.1152/physiol.00008.2010 . PMID 20699471 .
- ^ Jump up to: а беременный Макартур Д.Г., Северный Кн (июль 2004 г.). «Ген для скорости? Эволюция и функция альфа-актинина-3». Биологии . 26 (7): 786–795. doi : 10.1002/bies.20061 . PMID 15221860 . S2CID 19761762 .
- ^ Jump up to: а беременный Lee FX, Howeling PJ, North KN, Quinlan KG (апрель 2016 г.). «Как дефицит дефицита α-актинина-актинина-3 изменяет функцию мышц? Мехасттическое понимание ACTN3,« ген для скорости » Biochimica et Biophysica Acta (BB) - исследования молекулярных клеток 1863 (4): 686–6 Doi : 10.1016/ j.bmcr.2016.01.0 26802899PMID
- ^ Полу К.Р., Поллак М.Р. (25 февраля 2009 г.). «Фокальный сегментальный гломерулосклероз» . В Lifton RP, Somlo S, Giebisch GH, Seldin DW (ред.). Генетические заболевания почки . Академическая пресса. С. 117–118. ISBN 978-0-08-092427-4 .
Внешние ссылки
[ редактировать ]- Актинин в Национальной библиотеке медицинской библиотеки США медицинские заголовки (сетка)