Химическая биология
Химическая биология — научная дисциплина, занимающая промежуточное положение между химией и биологией . Дисциплина включает в себя применение химических методов, анализа и часто небольших молекул, полученных с помощью синтетической химии , для изучения биологических систем и манипулирования ими. [ 1 ] часто путают с Хотя химическую биологию биохимией , которая изучает химию биомолекул и регуляцию биохимических путей внутри и между клетками, химическая биология по-прежнему отличается тем, что фокусируется на применении химических инструментов для решения биологических вопросов. [ 2 ]
История
[ редактировать ]Хотя это считается относительно новой научной областью, [ 2 ] термин «химическая биология» используется с начала 20 века. [ 3 ] и имеет корни в научных открытиях начала 19 века. Термин «химическая биология» восходит к раннему появлению в книге Алонзо Э. Тейлора «О ферментации», опубликованной в 1907 году. [ 4 ] и впоследствии был использован в статье Джона Б. Литса 1930 года под названием «Харвианская речь о рождении химической биологии». [ 5 ] Однако неясно, когда этот термин был впервые использован. [ 3 ]
Фридрихом Вёлером в 1828 году Синтез мочевины является ранним примером применения синтетической химии для развития биологии. [ 6 ] Оно показало, что биологические соединения могут быть синтезированы с использованием неорганических исходных материалов, и ослабило прежнее представление о витализме , или что для производства органических соединений необходим «живой» источник. [ 7 ] [ 8 ] Работу Вёлера часто считают важной для развития органической химии и синтеза природных продуктов , которые играют большую роль в современной химической биологии. [ 9 ]
Работа Фридриха Мишера в конце 19 века по исследованию клеточного содержимого лейкоцитов человека привела к открытию «нуклеина», который позже будет переименован в ДНК. [ 6 ] После выделения нуклеина из ядра лейкоцитов посредством расщепления протеазой Мишер использовал химические методы, такие как элементный анализ и тесты на растворимость, чтобы определить состав нуклеина. [ 10 ] Эта работа заложила основу для открытия Уотсоном и Криком структуры двойной спирали ДНК. [ 10 ] [ 11 ]
Растущий интерес к химической биологии привел к созданию множества журналов, посвященных этой области. Nature Chemical Biology , созданный в 2005 году, [ 12 ] и ACS Chemical Biology , созданная в 2006 году, [ 13 ] — два самых известных журнала в этой области с импакт-фактором 14,8. [ 14 ] и 4.0 [ 15 ] соответственно.
Нобелевские лауреаты по химической биологии
[ редактировать ]| Лауреат | Год | Дисциплина | Вклад |
|---|---|---|---|
| Пол Берг | 1980 | Химия | Рекомбинантная ДНК [ 16 ] |
| Уолтер Гилберт | 1980 | Химия | Секвенирование генома [ 16 ] |
| Кэри Маллис | 1993 | Химия | Полимеразная цепная реакция [ 17 ] |
| Майкл Смит | 1993 | Химия | Сайт-направленный мутагенез [ 17 ] |
| Венкатраман Рамакришнан | 2009 | Химия | Выяснение рибосомы структуры и функции [ 18 ] |
| Роберт Дж. Лефковиц | 2012 | Химия | Рецепторы, связанные с G-белком [ 19 ] |
| Фрэнсис Х. Арнольд | 2018 | Химия | ферментов Развитие путем направленной эволюции [ 20 ] |
| Эммануэль Шарпантье | 2020 | Химия | CRISPR/Cas9 Генетические ножницы [ 21 ] |
| Барри Шарплесс | 2022 | Химия | Нажмите химия [ 22 ] |
| Кэролайн Бертоцци | 2022 | Химия | Применение клик-химии в живых организмах [ 22 ] |
Области исследований
[ редактировать ]Гликобиология
[ редактировать ]
Гликобиология – это изучение структуры и функций углеводов . [ 23 ] В то время как ДНК , РНК и белки кодируются на генетическом уровне, углеводы не кодируются непосредственно геномом и поэтому требуют различных инструментов для их изучения. [ 24 ] Применяя химические принципы к гликобиологии, можно разработать новые методы анализа и синтеза углеводов. [ 25 ] Например, клетки можно снабдить синтетическими вариантами натуральных сахаров, чтобы проверить их функцию. Исследовательская группа Кэролайн Бертоцци разработала методы сайт-специфического взаимодействия молекул на поверхности клеток с помощью синтетических сахаров. [ 26 ]
Комбинаторная химия
[ редактировать ]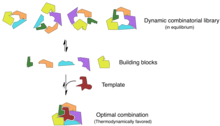
Комбинаторная химия предполагает одновременный синтез большого количества родственных соединений для высокопроизводительного анализа. [ 27 ] Химические биологи могут использовать принципы комбинаторной химии для синтеза активных лекарственных соединений и повышения эффективности скрининга. [ 28 ] Аналогично, эти принципы можно использовать в областях сельского хозяйства и пищевых исследований, в частности, при синтезе ненатуральных продуктов и создании новых ингибиторов ферментов. [ 29 ]
Синтез пептидов
[ редактировать ]
Химический синтез белков является ценным инструментом в химической биологии, поскольку он позволяет вводить неприродные аминокислоты, а также включать специфические остатки « посттрансляционных модификаций », таких как фосфорилирование , гликозилирование , ацетилирование и даже убиквитинирование . [ 30 ] Эти свойства ценны для биологов-химиков, поскольку неприродные аминокислоты можно использовать для исследования и изменения функциональности белков, в то время как широко известно, что посттрансляционные модификации регулируют структуру и активность белков. [ 31 ] Хотя для достижения этих целей были разработаны строго биологические методы, химический синтез пептидов часто имеет более низкий технический и практический барьер для получения небольших количеств желаемого белка. [ 32 ]
Чтобы создать полипептидные цепи размером с белок из небольших пептидных фрагментов, полученных в результате синтеза, биологи-химики могут использовать процесс нативного химического лигирования . [ 33 ] Нативное химическое лигирование включает соединение С-концевого тиоэфира и N-концевого остатка цистеина, что в конечном итоге приводит к образованию «нативной» амидной связи. [ 34 ] Другие стратегии, которые использовались для лигирования пептидных фрагментов с использованием химии переноса ацила, впервые введенной с помощью нативного химического лигирования, включают лигирование экспрессированных белков , [ 35 ] методы сульфуризации/десульфурации, [ 36 ] и использование съемных тиоловых вспомогательных веществ. [ 37 ]
Методы обогащения для протеомики
[ редактировать ]Химические биологи работают над улучшением протеомики посредством разработки стратегий обогащения, меток химического сродства и новых зондов. Образцы для протеомики часто содержат множество пептидных последовательностей, и интересующая последовательность может быть широко представлена или иметь низкое содержание, что создает барьер для их обнаружения. Методы химической биологии могут уменьшить сложность образцов за счет селективного обогащения с использованием аффинной хроматографии . Это предполагает нацеливание на пептид с отличительной особенностью, такой как биотиновая метка или посттрансляционная модификация . [ 38 ] Были разработаны методы, включающие использование антител, лектинов для захвата гликопротеинов и иммобилизованных ионов металлов для захвата фосфорилированных пептидов и ферментных субстратов для захвата отдельных ферментов.
Ферментные зонды
[ редактировать ]Для исследования ферментативной активности в отличие от общего белка были разработаны реагенты на основе активности для маркировки ферментативно активной формы белков (см. Протеомика, основанная на активности ). Например, ингибиторы серингидролазы и цистеинпротеазы были преобразованы в ингибиторы суицида . [ 39 ] Эта стратегия расширяет возможности выборочного анализа компонентов с низкой численностью посредством прямого нацеливания. [ 40 ] Активность фермента также можно контролировать по преобразованному субстрату. [ 41 ] Идентификация ферментных субстратов представляет собой сложную задачу в протеомике и жизненно важна для понимания путей передачи сигнала в клетках. Разработанный метод использует «чувствительные к аналогам» киназы для маркировки субстратов с использованием неприродного аналога АТФ, что облегчает визуализацию и идентификацию с помощью уникальной ручки. [ 42 ]
Использование биологии
[ редактировать ]Многие исследовательские программы также сосредоточены на использовании природных биомолекул для выполнения биологических задач или для поддержки нового химического метода. В этом отношении исследователи химической биологии показали, что ДНК может служить шаблоном для синтетической химии, самосборочные белки могут служить структурным каркасом для новых материалов, а РНК может эволюционировать in vitro для выполнения новой каталитической функции. Кроме того, гетеробифункциональные (двусторонние) синтетические небольшие молекулы, такие как димеризаторы или PROTAC, объединяют два белка внутри клеток, что может синтетически вызывать новые важные биологические функции, такие как целенаправленная деградация белков. [ 43 ]
Направленная эволюция
[ редактировать ]Основной целью белковой инженерии является создание новых пептидов или белков с желаемой структурой и химической активностью. [ 44 ] Поскольку наши знания о взаимосвязи между первичной последовательностью, структурой и функцией белков ограничены, рациональный дизайн новых белков с инженерной активностью является чрезвычайно сложной задачей. [ 45 ] При направленной эволюции повторяющиеся циклы генетического разнообразия с последующим процессом скрининга или отбора могут использоваться для имитации естественного отбора в лаборатории для создания новых белков с желаемой активностью. [ 46 ]
Существует несколько методов создания больших библиотек вариантов последовательностей. Среди наиболее широко используемых — воздействие ДНК на УФ-излучения или химических мутагенов , подверженная ошибкам ПЦР , вырожденные кодоны или рекомбинация . [ 47 ] [ 48 ] После создания большой библиотеки вариантов используются методы отбора или скрининга для поиска мутантов с желаемым признаком. Общие методы отбора/проверки включают FACS , [ 49 ] мРНК-дисплей , [ 50 ] фаговый дисплей и in vitro компартментализация . [ 51 ] Как только полезные варианты найдены, их последовательность ДНК амплифицируется и подвергается дальнейшим раундам диверсификации и отбора.
Разработка методов направленной эволюции была отмечена в 2018 году вручением Нобелевской премии по химии Фрэнсис Арнольд за эволюцию ферментов, а также Джорджу Смиту и Грегори Уинтеру за фаговый дисплей. [ 52 ]
Биоортогональные реакции
[ редактировать ]Успешное мечение интересующей молекулы требует специфической функционализации этой молекулы для хемоспецифической реакции с оптическим зондом. Чтобы эксперимент по маркировке считался надежным, эта функционализация должна минимально возмущать систему. К сожалению, эти требования часто трудно удовлетворить. Многие реакции, обычно доступные химикам-органикам в лаборатории, недоступны в живых системах. [ 53 ] Реакции, чувствительные к воде и окислительно-восстановительному потенциалу, не будут протекать, реагенты, склонные к нуклеофильной атаке, не будут обладать хемоспецифичностью, а любые реакции с большими кинетическими барьерами не смогут найти достаточно энергии в относительно низкотемпературной среде живой клетки. [ 54 ] Таким образом, химики недавно разработали группу биоортогональной химии , которая действует хемоспецифично, несмотря на среду отвлекающих реактивных материалов in vivo .
Соединение зонда с интересующей молекулой должно происходить в течение достаточно короткого периода времени; [ 55 ] следовательно, кинетика реакции сочетания должна быть весьма благоприятной. Клик-химия хорошо подходит для заполнения этой ниши, поскольку реакции щелчков быстрые, спонтанные, избирательные и высокопродуктивные. К сожалению, самая известная «щелчковая реакция» — циклоприсоединение [3+2] между азидом и ациклическим алкином — катализируется медью, что представляет собой серьезную проблему для использования in vivo из-за токсичности меди. Чтобы обойти необходимость в катализаторе, лаборатория Кэролин Р. Бертоцци ввела в алкиновые разновидности природную деформацию, используя циклический алкин. В частности, циклооктин с особенной энергией реагирует с азидомолекулами.
Открытие биомолекул посредством метагеномики
[ редактировать ]Достижения в области современных технологий секвенирования в конце 1990-х годов позволили ученым исследовать ДНК сообществ организмов в их естественной среде обитания («эДНК»), без культивирования отдельных видов в лаборатории. Этот метагеномный подход позволил ученым изучить широкий выбор организмов, которые ранее не были охарактеризованы, отчасти из-за некомпетентных условий роста. Источниками эДНК являются почвы , океаны, недра , горячие источники , гидротермальные жерла , полярные ледяные шапки , гиперсоленая среда обитания и среда с экстремальным pH. [ 56 ] Из многих применений метагеномики такие исследователи, как Джо Хандельсман , Джон Кларди и Роберт М. Гудман , исследовали метагеномные подходы к открытию биологически активных молекул, таких как антибиотики . [ 57 ]

Стратегии функционального скрининга или скрининга гомологии использовались для идентификации генов, которые продуцируют небольшие биоактивные молекулы. Функциональные метагеномные исследования предназначены для поиска конкретных фенотипов , связанных с молекулами с определенными характеристиками. С другой стороны, метагеномные исследования гомологии предназначены для изучения генов с целью выявления консервативных последовательностей , которые ранее были связаны с экспрессией биологически активных молекул. [ 58 ]
Функциональные метагеномные исследования позволяют открывать новые гены, кодирующие биологически активные молекулы. Эти анализы включают в себя анализы с наложением верхнего агара, при которых антибиотики создают зоны ингибирования роста тестовых микробов, и анализы pH, которые могут проверять изменение pH из-за вновь синтезированных молекул с использованием индикатора pH на чашке с агаром . [ 59 ] Скрининг экспрессии генов, индуцированный субстратом (SIGEX), метод скрининга экспрессии генов, индуцируемой химическими соединениями, также использовался для поиска генов со специфическими функциями. [ 59 ] Метагеномные исследования, основанные на гомологии, привели к быстрому открытию генов, которые имеют гомологичные последовательности с ранее известными генами, ответственными за биосинтез биологически активных молекул. Как только гены будут секвенированы, ученые смогут одновременно сравнивать тысячи бактериальных геномов. [ 58 ] Преимущество перед функциональными метагеномными анализами заключается в том, что метагеномные исследования гомологии не требуют, чтобы система организма-хозяина экспрессировала метагеномы, поэтому этот метод потенциально может сэкономить время, затрачиваемое на анализ нефункциональных геномов. Это также привело к открытию нескольких новых белков и малых молекул. [ 60 ] Кроме того, исследование in silico , проведенное Глобальным метагеномным исследованием океана, выявило 20 новых лантибиотических циклаз. [ 61 ]
Киназы
[ редактировать ]Посттрансляционная модификация белков с фосфатными группами киназами является ключевым регуляторным этапом во всех биологических системах. События фосфорилирования, либо фосфорилирование протеинкиназами, либо дефосфорилирование фосфатазами , приводят к активации или дезактивации белка. Эти события оказывают влияние на регуляцию физиологических путей, что делает способность анализировать и изучать эти пути неотъемлемой частью понимания деталей клеточных процессов. Существует ряд проблем, а именно огромный размер фосфопротеома, мимолетный характер событий фосфорилирования и связанные с этим физические ограничения классических биологических и биохимических методов, которые ограничивают развитие знаний в этой области. [ 62 ]
Благодаря использованию низкомолекулярных модуляторов протеинкиназ биологи-химики лучше поняли эффекты фосфорилирования белков. Например, неселективные и селективные ингибиторы киназ, такие как класс соединений пиридинилимидазола. [ 63 ] являются мощными ингибиторами, полезными для разделения сигнальных путей MAP-киназы . Эти соединения пиридинилимидазола действуют, воздействуя на карман связывания АТФ . Хотя этот подход, как и родственные подходы, [ 64 ] [ 65 ] с небольшими модификациями доказали свою эффективность в ряде случаев, этим соединениям не хватает адекватной специфичности для более общего применения. Другой класс соединений, ингибиторы, основанные на механизме, сочетает в себе знания об ферментологии киназы с ранее использовавшимися мотивами ингибирования. Например, «аналог бисубстрата» ингибирует действие киназы путем связывания как консервативного кармана связывания АТФ, так и сайта узнавания белка/пептида на специфической киназы. [ 66 ] Исследовательские группы также использовали аналоги АТФ в качестве химических зондов для изучения киназ и идентификации их субстратов. [ 67 ] [ 68 ] [ 69 ]
Разработка новых химических способов включения фосфомиметических аминокислот в белки дала важное понимание эффектов процессов фосфорилирования. События фосфорилирования обычно изучаются путем мутации идентифицированного сайта фосфорилирования ( серина , треонина или тирозина ) на аминокислоту, такую как аланин , которая не может быть фосфорилирована. Однако эти методы имеют ограничения, и биологи-химики разработали улучшенные способы исследования фосфорилирования белков. Встраивая фосфосерин, фосфотреонин или аналогичные имитаторы фосфоната в нативные белки, исследователи могут проводить исследования in vivo для изучения эффектов фосфорилирования, увеличивая время, в течение которого происходит событие фосфорилирования, и одновременно сводя к минимуму зачастую неблагоприятные эффекты мутаций. . Лигирование экспрессированных белков оказалось успешным методом синтетического получения белков, которые содержат фосформиметические молекулы на обоих концах. [ 70 ] Кроме того, исследователи использовали мутагенез неприродных аминокислот в целевых участках пептидной последовательности. [ 71 ] [ 72 ]
Достижения химической биологии также улучшили классические методы визуализации действия киназы. Например, разработка пептидных биосенсоров — пептидов, содержащих встроенные флуорофоры, улучшила временное разрешение анализов связывания in vitro. [ 73 ] Одним из наиболее полезных методов изучения действия киназы является резонансный перенос энергии флуоресценции (FRET) . Чтобы использовать FRET для исследований фосфорилирования, флуоресцентные белки соединяют как с доменом, связывающим фосфоаминокислоты, так и с пептидом, который может фосфорилироваться. При фосфорилировании или дефосфорилировании пептида-субстрата происходит конформационное изменение, приводящее к изменению флуоресценции. [ 74 ] FRET также использовался в тандеме с флуоресцентной микроскопией с возможностью получения изображений на протяжении всего срока службы (FLIM). [ 75 ] или флуоресцентно-конъюгированные антитела и проточная цитометрия [ 76 ] для получения количественных результатов с превосходным временным и пространственным разрешением.
Биологическая флуоресценция
[ редактировать ]Химические биологи часто изучают функции биологических макромолекул с использованием методов флуоресценции . Преимущество флуоресценции перед другими методами заключается в ее высокой чувствительности, неинвазивности, безопасном обнаружении и способности модулировать сигнал флуоресценции. В последние годы открытие и другими зеленого флуоресцентного белка (GFP) Роджером Ю. Цзянем , гибридных систем и квантовых точек позволило более точно оценить местоположение и функцию белка. [ 77 ] Используются три основных типа флуорофоров: небольшие органические красители, зеленые флуоресцентные белки и квантовые точки . Небольшие органические красители обычно имеют массу менее 1 кДа и модифицированы для повышения фотостабильности и яркости, а также уменьшения самозатухания. Квантовые точки имеют очень острые длины волн, высокую молярную поглощающую способность и квантовый выход. Как органические красители, так и квантовые красители не способны распознавать интересующий белок без помощи антител, поэтому для них необходимо использовать иммуномечение . Флуоресцентные белки генетически закодированы и могут быть слиты с интересующим вас белком. Другой метод генетического мечения - это тетрацистеиновая бимышьяковая система, которая требует модификации целевой последовательности, включающей четыре цистеина, которые связывают проницаемые через мембраны молекулы бимышьяка, зеленый и красный красители «FlAsH» и «ReAsH» с пикомолярным сродством. И флуоресцентные белки, и бимышьяковый тетрацистеин могут экспрессироваться в живых клетках, но имеют серьезные ограничения при эктопической экспрессии и могут вызывать потерю функции.
Флуоресцентные методы использовались для оценки ряда динамики белков, включая, среди прочего, отслеживание белков, конформационные изменения, межбелковые взаимодействия, синтез и обмен белков, а также активность ферментов. Тремя общими подходами к измерению перераспределения и диффузии белковой сети являются методы отслеживания одиночных частиц, корреляционная спектроскопия и методы фотомаркирования. При отслеживании одной частицы отдельная молекула должна быть одновременно яркой и достаточно редкой, чтобы ее можно было отслеживать от одного видео к другому. Корреляционная спектроскопия анализирует флуктуации интенсивности, возникающие в результате миграции флуоресцентных объектов в небольшой объем в фокусе лазера и из него. При фотомаркировании флуоресцентный белок можно потушить в субклеточной области с использованием интенсивного локального освещения, и судьбу меченой молекулы можно непосредственно визуализировать. Мишале и его коллеги использовали квантовые точки для отслеживания одиночных частиц с помощью квантовых точек биотина в клетках HeLa. [ 78 ] Один из лучших способов обнаружить конформационные изменения в белках — пометить интересующий белок двумя флуорофорами, расположенными в непосредственной близости. FRET будет реагировать на внутренние конформационные изменения, возникающие в результате переориентации одного флуорофора относительно другого. Можно также использовать флуоресценцию для визуализации активности ферментов, обычно с использованием протеомики на основе подавленной активности (qABP). Ковалентное связывание qABP с активным сайтом целевого фермента предоставит прямые доказательства того, несет ли фермент ответственность за сигнал при высвобождении тушителя и возобновлении флуоресценции. [ 79 ]
Образование в области химической биологии
[ редактировать ]Бакалавриат
[ редактировать ]Несмотря на рост биологических исследований на химических факультетах, попыток интегрировать химическую биологию в учебные программы бакалавриата не хватает. [ 80 ] Например, хотя Американское химическое общество (ACS) требует, чтобы базовые курсы бакалавриата химии включали биохимию, никаких других курсов химии, связанных с биологией, не требуется. [ 81 ]
Хотя курс химической биологии часто не требуется для получения степени бакалавра химии, многие университеты теперь предоставляют своим студентам вводные курсы химической биологии. Например, Университет Британской Колумбии предлагает четвертый год обучения по синтетической химической биологии. [ 82 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Шрайбер С.Л. (июль 2005 г.). «Маленькие молекулы: недостающее звено в центральной догме». Химическая биология природы . 1 (2): 64–66. дои : 10.1038/nchembio0705-64 . ПМИД 16407997 . S2CID 14399359 .
- ^ Jump up to: а б Миллер А., Таннер Дж. (2008). Основы химической биологии: структура и динамика биологических макромолекул . Англия: John Wiley & Sons, Ltd., стр. vi – x. ISBN 978-0-470-84530-1 .
- ^ Jump up to: а б Хриковини М., Ямпилек Дж. (февраль 2023 г.). «Химия навстречу биологии» . Международный журнал молекулярных наук . 24 (4): 3998. doi : 10.3390/ijms24043998 . ПМК 9960482 . ПМИД 36835407 .
- ^ Тейлор А.Э. (1907). О брожении . 8. Том. 1. Университетское издательство.
- ^ Литес Дж. Б. (октябрь 1930 г.). «Гарвейская речь о РОЖДЕНИИ ХИМИЧЕСКОЙ БИОЛОГИИ» . Британский медицинский журнал . 2 (3642): 671–676. дои : 10.1136/bmj.2.3642.671 . ПМЦ 2451377 . ПМИД 20775787 .
- ^ Jump up to: а б Моррисон К.Л., Вайс Г.А. (январь 2006 г.). «Истоки химической биологии». Химическая биология природы . 2 (1): 3–6. дои : 10.1038/nchembio0106-3 . ПМИД 16408079 . S2CID 8427286 .
- ^ Рамберг П.Дж. (ноябрь 2000 г.). «Смерть витализма и рождение органической химии: синтез мочевины Велера и дисциплинарная идентичность органической химии». Амбикс . 47 (3): 170–195. дои : 10.1179/amb.2000.47.3.170 . ПМИД 11640223 . S2CID 44613876 .
- ^ Кинне-Сафран Э., Кинне Р.К. (1999). «Витализм и синтез мочевины. От Фридриха Велера до Ганса А. Кребса». Американский журнал нефрологии . 19 (2): 290–4. дои : 10.1159/000013463 . ПМИД 10213830 . S2CID 71727190 .
- ^ Хун Дж (август 2014 г.). «Синтез натуральных продуктов на стыке химии и биологии» . Химия . 20 (33): 10204–10212. дои : 10.1002/chem.201402804 . ПМК 4167019 . ПМИД 25043880 .
- ^ Jump up to: а б Дам Р. (январь 2008 г.). «Открытие ДНК: Фридрих Мишер и первые годы исследований нуклеиновых кислот». Генетика человека . 122 (6): 565–581. дои : 10.1007/s00439-007-0433-0 . ПМИД 17901982 . S2CID 915930 .
- ^ Дам Р. (февраль 2005 г.). «Фридрих Мишер и открытие ДНК». Биология развития . 278 (2): 274–288. дои : 10.1016/j.ydbio.2004.11.028 . ПМИД 15680349 .
- ^ «Каталог LC — Информация о товаре (Полная запись)» . каталог.loc.gov . Проверено 6 ноября 2023 г.
- ^ «Каталог LC — Информация о товаре (Полная запись)» . каталог.loc.gov . Проверено 6 ноября 2023 г.
- ^ «Метрики журнала | Природная химическая биология» . www.nature.com . Проверено 6 ноября 2023 г.
- ^ «О журнале» . Публикации АКС . Проверено 5 ноября 2023 г.
- ^ Jump up to: а б «Нобелевская премия по химии 1980 года» . NobelPrize.org . Проверено 6 ноября 2023 г.
- ^ Jump up to: а б «Нобелевская премия по химии 1993 года» . NobelPrize.org . Проверено 6 ноября 2023 г.
- ^ «Нобелевская премия по химии 2009» . NobelPrize.org . Проверено 6 ноября 2023 г.
- ^ «Нобелевская премия по химии 2012» . NobelPrize.org . Проверено 6 ноября 2023 г.
- ^ «Нобелевская премия по химии 2018» . NobelPrize.org . Проверено 6 ноября 2023 г.
- ^ «Нобелевская премия по химии 2020» . NobelPrize.org . Проверено 6 ноября 2023 г.
- ^ Jump up to: а б «Нобелевская премия по химии 2022» . NobelPrize.org . Проверено 6 ноября 2023 г.
- ^ Двек Р.А. (март 1996 г.). «Гликобиология: к пониманию функции сахаров». Химические обзоры . 96 (2): 683–720. дои : 10.1021/cr940283b . ПМИД 11848770 .
- ^ Спрингер С.А., Ганье П. (март 2016 г.). «Гликомика: раскрытие динамической экологии и эволюции молекул сахара» . Журнал протеомики . 135 : 90–100. дои : 10.1016/j.jprot.2015.11.022 . ПМЦ 4762723 . ПМИД 26626628 .
- ^ Ву CY, Вонг CH (июнь 2011 г.). «Химия и гликобиология». Химические коммуникации . 47 (22): 6201–6207. дои : 10.1039/c0cc04359a . ПМИД 21503322 .
- ^ «Группа Бертоцци» . Группа Бертоцци . Проверено 4 декабря 2023 г.
- ^ Лю Р., Ли Х, Лам К.С. (июнь 2017 г.). «Комбинаторная химия в открытии лекарств» . Современное мнение в области химической биологии . 38 : 117–126. дои : 10.1016/j.cbpa.2017.03.017 . ПМЦ 5645069 . ПМИД 28494316 .
- ^ Кеннеди Дж.П., Уильямс Л., Бриджес Т.М., Дэниелс Р.Н., Уивер Д., Линдсли К.В. (1 мая 2008 г.). «Применение комбинаторной химии для открытия современных лекарств». Журнал комбинаторной химии . 10 (3): 345–354. дои : 10.1021/cc700187t . ПМИД 18220367 .
- ^ Вонг Д., Робертсон Дж. (декабрь 2004 г.). «Применение комбинаторной химии и биологии к исследованиям пищевых продуктов». Журнал сельскохозяйственной и пищевой химии . 52 (24): 7187–7198. дои : 10.1021/jf040140i . ПМИД 15563194 .
- ^ Рамази С., Захири Дж. (апрель 2021 г.). «Посттрансляционные модификации белков: ресурсы, инструменты и методы прогнозирования» . База данных . 2021 . дои : 10.1093/база данных/baab012 . ПМК 8040245 . ПМИД 33826699 .
- ^ Адхикари А., Бхаттараи Б.Р., Арьял А., Тапа Н., Кс П., Адхикари А. и др. (ноябрь 2021 г.). «Перепрограммирование натуральных белков с использованием неприродных аминокислот» . РСК Прогресс . 11 (60): 38126–38145. Бибкод : 2021RSCAd..1138126A . дои : 10.1039/D1RA07028B . ПМК 9044140 . ПМИД 35498070 .
- ^ Чандруду С., Симерска П., Тот I (апрель 2013 г.). «Химические методы получения пептидов и белков» . Молекулы . 18 (4): 4373–4388. дои : 10.3390/molecules18044373 . ПМК 6270108 . ПМИД 23584057 .
- ^ Цистрон П.А., Бёрд М.Дж., Флад Д.Т., Сильвестри А.П., Хинтцен Дж.К., Томпсон Д.А., Доусон П.Е. (март 2019 г.). «Нативное химическое лигирование пептидов и белков» . Современные протоколы химической биологии . 11 (1): е61. дои : 10.1002/cpch.61 . ПМК 6384150 . ПМИД 30645048 .
- ^ Hermanson GT (январь 2013 г.). «Глава 3 - Реакции биоконъюгации». В Hermanson GT (ред.). Методы биоконъюгата (Третье изд.). Бостон: Академическая пресса. стр. 229–258. дои : 10.1016/b978-0-12-382239-0.00003-0 . ISBN 978-0-12-382239-0 .
- ^ Мьюир Т.В., Сонди Д., Коул П.А. (июнь 1998 г.). «Экспрессированное лигирование белков: общий метод белковой инженерии» . Труды Национальной академии наук Соединенных Штатов Америки . 95 (12): 6705–6710. Бибкод : 1998PNAS...95.6705M . дои : 10.1073/pnas.95.12.6705 . ПМК 22605 . ПМИД 9618476 .
- ^ Джин К., Ли Т., Чоу ХИ, Лю Х., Ли Икс (ноябрь 2017 г.). «Десульфуризация PB: эффективный метод химического синтеза белков и дейтерирования в зависимости от места». Ангеванде Хеми . 56 (46): 14607–14611. дои : 10.1002/anie.201709097 . ПМИД 28971554 .
- ^ Нильссон Б.Л., Зёлльнер М.Б., Райнс Р.Т. (1 июня 2005 г.). «Химический синтез белков» . Ежегодный обзор биофизики и биомолекулярной структуры . 34 (1): 91–118. doi : 10.1146/annurev.biophys.34.040204.144700 . ПМЦ 2845543 . ПМИД 15869385 .
- ^ Чжао Ю, Дженсен О.Н. (октябрь 2009 г.). «Протеомика, специфичная для модификаций: стратегии характеристики посттрансляционных модификаций с использованием методов обогащения» . Протеомика . 9 (20): 4632–4641. дои : 10.1002/pmic.200900398 . ПМЦ 2892724 . ПМИД 19743430 .
- ^ Лопес-Отин С, общий СМ (июль 2002 г.). «Деградомика протеаз: новый вызов протеомике». Обзоры природы. Молекулярно-клеточная биология . 3 (7): 509–519. дои : 10.1038/nrm858 . ПМИД 12094217 . S2CID 7586786 .
- ^ Адам Г.К., Краватт Б.Ф., Соренсен Э.Дж. (январь 2001 г.). «Профилирование специфической реактивности протеома с помощью зондов, основанных на ненаправленной активности» . Химия и биология . 8 (1): 81–95. дои : 10.1016/S1074-5521(00)90060-7 . ПМИД 11182321 .
- ^ Туречек Ф. (январь 2002 г.). «Масс-спектрометрия в сочетании с аффинным захватом-высвобождением и аффинными метками с изотопным кодированием для количественного анализа белков». Журнал масс-спектрометрии . 37 (1): 1–14. Бибкод : 2002JMSp...37....1T . дои : 10.1002/jms.275 . ПМИД 11813306 .
- ^ Блетроу Дж., Чжан С., Шокат К.М., Вайс Э.Л. (май 2004 г.). «Разработка и использование аналогово-чувствительных протеинкиназ». Современные протоколы молекулярной биологии . Глава 18: Раздел 18.11. дои : 10.1002/0471142727.mb1811s66 . ПМИД 18265343 . S2CID 25869680 .
- ^ Чермакова К., Ходжес ХК (август 2018 г.). «Лекарства нового поколения и зонды для биологии хроматина: от целенаправленной деградации белка к фазовому разделению» . Молекулы . 23 (8): 1958. doi : 10.3390/molecules23081958 . ПМК 6102721 . ПМИД 30082609 .
- ^ Дханжал Дж.К., Малик В., Радхакришнан Н., Сигар М., Кумари А., Сундар Д. (январь 2019 г.). «Подходы вычислительной белковой инженерии для эффективного проектирования новых молекул» . Ранганатан С., Грибсков М., Накаи К., Шенбах С. (ред.). Энциклопедия биоинформатики и вычислительной биологии . Оксфорд: Академическая пресса. стр. 631–643. дои : 10.1016/b978-0-12-809633-8.20150-7 . ISBN 978-0-12-811432-2 . S2CID 196001607 . Проверено 6 декабря 2023 г.
- ^ Кульман Б., Брэдли П. (ноябрь 2019 г.). «Достижения в области прогнозирования и проектирования структуры белков» . Обзоры природы. Молекулярно-клеточная биология . 20 (11): 681–697. дои : 10.1038/s41580-019-0163-x . ПМК 7032036 . ПМИД 31417196 .
- ^ Йекель С., Каст П., Хилверт Д. (2008). «Дизайн белка путем направленной эволюции». Ежегодный обзор биофизики . 37 : 153–173. doi : 10.1146/annurev.biophys.37.032807.125832 . ПМИД 18573077 .
- ^ Тейлор С.В., Уолтер К.У., Каст П., Хилверт Д. (сентябрь 2001 г.). «Поиск пространства последовательностей белковых катализаторов» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (19): 10596–10601. Бибкод : 2001PNAS...9810596T . дои : 10.1073/pnas.191159298 . ПМЦ 58511 . ПМИД 11535813 .
- ^ Битткер Дж.А., Ле Б.В., Лю Дж.М., Лю Д.Р. (май 2004 г.). «Направленная эволюция белковых ферментов с помощью негомологичной случайной рекомбинации» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (18): 7011–7016. Бибкод : 2004PNAS..101.7011B . дои : 10.1073/pnas.0402202101 . ПМК 406457 . ПМИД 15118093 .
- ^ Ахарони А., Гриффитс А.Д., Тауфик Д.С. (апрель 2005 г.). «Высокопроизводительный скрининг и отбор генов, кодирующих ферменты». Современное мнение в области химической биологии . 9 (2): 210–216. дои : 10.1016/j.cbpa.2005.02.002 . ПМИД 15811807 .
- ^ Уилсон Д.С., Киф А.Д., Шостак Дж.В. (март 2001 г.). «Использование мРНК-дисплея для выбора высокоаффинных белок-связывающих пептидов» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (7): 3750–3755. Бибкод : 2001PNAS...98.3750W . дои : 10.1073/pnas.061028198 . ПМК 31124 . ПМИД 11274392 .
- ^ Тауфик Д.С., Гриффитс А.Д. (июль 1998 г.). «Искусственные клеточные отсеки для молекулярной эволюции». Природная биотехнология . 16 (7): 652–656. дои : 10.1038/nbt0798-652 . ПМИД 9661199 . S2CID 25527137 .
- ^ «Нобелевская премия по химии 2018» . NobelPrize.org . Проверено 3 октября 2018 г.
- ^ Йонссон А.Л., Робертс М.А., Киаппес Дж.Л., Скотт К.А. (октябрь 2017 г.). «Необходимая химия для биохимиков» . Очерки по биохимии . 61 (4): 401–427. дои : 10.1042/EBC20160094 . ПМЦ 5869253 . ПМИД 28951470 .
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). «Катализ и использование энергии клетками» . Молекулярная биология клетки (4-е изд.). Гирляндная наука . Проверено 6 декабря 2023 г.
- ^ Чен К., Чен Икс (2010). «Проектирование и разработка зондов молекулярной визуализации» . Актуальные темы медицинской химии . 10 (12): 1227–1236. дои : 10.2174/156802610791384225 . ПМЦ 3632640 . ПМИД 20388106 .
- ^ Келлер М., Зенглер К. (февраль 2004 г.). «Использование микробного разнообразия». Обзоры природы. Микробиология . 2 (2): 141–150. дои : 10.1038/nrmicro819 . ПМИД 15040261 . S2CID 11512358 .
- ^ Хэндельсман Дж., Рондон М.Р., Брэди С.Ф., Кларди Дж., Гудман Р.М. (октябрь 1998 г.). «Молекулярно-биологический доступ к химии неизвестных почвенных микробов: новый рубеж для натуральных продуктов» . Химия и биология . 5 (10): 245–249 Р. дои : 10.1016/S1074-5521(98)90108-9 . ПМИД 9818143 .
- ^ Jump up to: а б Баник Джей Джей, Брэди С.Ф. (октябрь 2010 г.). «Недавнее применение метагеномных подходов к открытию противомикробных препаратов и других биологически активных малых молекул» . Современное мнение в микробиологии . 13 (5): 603–609. дои : 10.1016/j.mib.2010.08.012 . ПМК 3111150 . ПМИД 20884282 .
- ^ Jump up to: а б Дэниел Р. (июнь 2005 г.). «Метагеномика почвы». Обзоры природы. Микробиология . 3 (6): 470–478. дои : 10.1038/nrmicro1160 . ПМИД 15931165 . S2CID 32604394 .
- ^ Бантернгсук Б., Канократана П., Тонгарам Т., Танапонгпипат С., Уенгветванит Т., Рахдавонг С. и др. (2010). «Идентификация и характеристика липолитических ферментов из метагенома торфяно-болотной лесной почвы» . Бионауки, биотехнологии и биохимия . 74 (9): 1848–1854. дои : 10.1271/bbb.100249 . ПМИД 20834152 .
- ^ Ли Б., Шер Д., Келли Л., Ши Ю., Хуан К., Кнерр П.Дж. и др. (июнь 2010 г.). «Каталитическая беспорядочность в биосинтезе вторичных метаболитов циклических пептидов у планктонных морских цианобактерий» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (23): 10430–10435. Бибкод : 2010PNAS..10710430L . дои : 10.1073/pnas.0913677107 . ПМК 2890784 . ПМИД 20479271 .
- ^ Таррант МК, Коул П.А. (2009). «Химическая биология фосфорилирования белков» . Ежегодный обзор биохимии . 78 : 797–825. doi : 10.1146/annurev.biochem.78.070907.103047 . ПМК 3074175 . ПМИД 19489734 .
- ^ Уилсон К.П., Маккаффри П.Г., Сяо К., Пажанисами С., Галулло В., Бемис Г.В. и др. (июнь 1997 г.). «Структурные основы специфичности пиридинилимидазольных ингибиторов киназы p38 MAP» . Химия и биология . 4 (6): 423–431. дои : 10.1016/S1074-5521(97)90194-0 . ПМИД 9224565 .
- ^ Паргеллис С., Тонг Л., Черчилль Л., Сирилло П.Ф., Гилмор Т., Грэм А.Г. и др. (апрель 2002 г.). «Ингибирование киназы p38 MAP с использованием нового аллостерического сайта связывания». Структурная биология природы . 9 (4): 268–272. дои : 10.1038/nsb770 . ПМИД 11896401 . S2CID 22680843 .
- ^ Шиндлер Т., Борнманн В., Пеллисена П., Миллер В.Т., Кларксон Б., Куриян Дж. (сентябрь 2000 г.). «Структурный механизм ингибирования STI-571 тирозинкиназы Абельсона». Наука . 289 (5486): 1938–1942. Бибкод : 2000Sci...289.1938S . дои : 10.1126/science.289.5486.1938 . ПМИД 10988075 . S2CID 957274 .
- ^ Паранг К., Тилль Дж.Х., Аблооглу А.Дж., Кохански Р.А., Хаббард С.Р., Коул П.А. (январь 2001 г.). «Механизм создания ингибитора протеинкиназы». Структурная биология природы . 8 (1): 37–41. дои : 10.1038/83028 . ПМИД 11135668 . S2CID 12994600 .
- ^ Фуда А.Е., Пфлум МК (август 2015 г.). «Проницаемый в клетку аналог АТФ для киназно-катализируемого биотинилирования» . Ангеванде Хеми . 54 (33): 9618–9621. дои : 10.1002/anie.201503041 . ПМЦ 4551444 . ПМИД 26119262 .
- ^ Сеневиратне С., Эмбогама Д.М., Энтони Т.А., Фуда А.Е., Пфлум М.К. (январь 2016 г.). «Общность биотинилирования, катализируемого киназой» . Биоорганическая и медицинская химия . 24 (1): 12–19. дои : 10.1016/j.bmc.2015.11.029 . ПМЦ 4921744 . ПМИД 26672511 .
- ^ Энтони Т.М., Дедигама-Арахчиге П.М., Эмбогама Д.М., Фанер Т.Р., Фуда А.Е., Пфлум М.К. (2015). «Аналоги АТФ в исследованиях протеинкиназ». В Kraatz HB, Санела М. (ред.). Киномика: подходы и приложения . стр. 137–68. дои : 10.1002/9783527683031.ch6 . ISBN 978-3-527-68303-1 .
- ^ Мьюир Т.В., Сонди Д., Коул П.А. (июнь 1998 г.). «Экспрессированное лигирование белков: общий метод белковой инженерии» . Труды Национальной академии наук Соединенных Штатов Америки . 95 (12): 6705–6710. Бибкод : 1998PNAS...95.6705M . дои : 10.1073/pnas.95.12.6705 . ПМК 22605 . ПМИД 9618476 .
- ^ Норен С.Дж., Энтони-Кэхилл С.Дж., Гриффит М.К., Шульц П.Г. (апрель 1989 г.). «Общий метод сайт-специфического включения неприродных аминокислот в белки». Наука . 244 (4901): 182–188. Бибкод : 1989Sci...244..182N . дои : 10.1126/science.2649980 . ПМИД 2649980 .
- ^ Ван Л., Се Дж., Шульц П.Г. (2006). «Расширение генетического кода». Ежегодный обзор биофизики и биомолекулярной структуры . 35 : 225–249. doi : 10.1146/annurev.biophys.35.101105.121507 . ПМИД 16689635 .
- ^ Шарма В., Ван К., Лоуренс Д.С. (январь 2008 г.). «Пептидные флуоресцентные сенсоры протеинкиназной активности: конструкция и применение» . Biochimica et Biophysical Acta (BBA) - Белки и протеомика . 1784 (1): 94–99. дои : 10.1016/j.bbapap.2007.07.016 . ПМЦ 2684651 . ПМИД 17881302 .
- ^ Скрипка JD, Чжан Дж, Цянь Р.Ю., Ньютон AC (июнь 2003 г.). «Генетически закодированный флуоресцентный репортер обнаруживает колебательное фосфорилирование протеинкиназой C» . Журнал клеточной биологии . 161 (5): 899–909. дои : 10.1083/jcb.200302125 . ПМК 2172956 . ПМИД 12782683 .
- ^ Вервир П.Дж., Воутерс Ф.С., Рейнольдс А.Р., Бастианс П.И. (ноябрь 2000 г.). «Количественная визуализация распространения сигнала латерального рецептора ErbB1 в плазматической мембране». Наука . 290 (5496): 1567–1570. Бибкод : 2000Sci...290.1567V . дои : 10.1126/science.290.5496.1567 . ПМИД 11090353 .
- ^ Мюллер С., Демотц С., Буллиард С., Валитутти С. (июнь 1999 г.). «Кинетика и степень активации протеинтирозинкиназы в отдельных Т-клетках при антигенной стимуляции» . Иммунология . 97 (2): 287–293. дои : 10.1046/j.1365-2567.1999.00767.x . ПМК 2326824 . ПМИД 10447744 .
- ^ Гипманс Б.Н., Адамс С.Р., Эллисман М.Х., Цянь Р.Ю. (апрель 2006 г.). «Набор флуоресцентных инструментов для оценки местоположения и функции белка». Наука . 312 (5771): 217–224. Бибкод : 2006Sci...312..217G . дои : 10.1126/science.1124618 . ПМИД 16614209 . S2CID 1288600 .
- ^ Мишале X, Пино Ф.Ф., Бентолила Л.А., Цай Дж.М., Дуз С., Ли Дж.Дж. и др. (январь 2005 г.). «Квантовые точки для живых клеток, визуализация in vivo и диагностика» . Наука . 307 (5709): 538–544. Бибкод : 2005Sci...307..538M . дои : 10.1126/science.1104274 . ПМК 1201471 . ПМИД 15681376 .
- ^ Тераи Т., Нагано Т. (октябрь 2008 г.). «Флуоресцентные зонды для биовизуализации». Современное мнение в области химической биологии . 12 (5): 515–521. дои : 10.1016/j.cbpa.2008.08.007 . ПМИД 18771748 .
- ^ Бегли Т.П. (октябрь 2005 г.). «Химическая биология: образовательная задача для химических факультетов». Химическая биология природы . 1 (5): 236–238. дои : 10.1038/nchembio1005-236 . ПМИД 16408045 . S2CID 30591672 .
- ^ «Курсовая работа» . Американское химическое общество . Проверено 2 декабря 2023 г.
- ^ «Химия 461: Синтетическая химическая биология | Химия UBC» . www.chem.ubc.ca. Проверено 2 декабря 2023 г.
Дальнейшее чтение
[ редактировать ]- Дертингер С.К.В., Чиу Д.Т., Чон Н.Л., генеральный менеджер Уайтсайдс (2001). «Генерация градиентов сложной формы с использованием микрофлюидных сетей». Аналитическая химия . 73 (6): 1240–1246. дои : 10.1021/ac001132d .
- Грайф Д., Побигайло Н., Фраге Б., Беккер А., Регтмайер Дж., Ансельметти Д. (сентябрь 2010 г.). «Динамика белков с пространственным и временным разрешением в отдельных бактериальных клетках, наблюдаемая на чипе». Журнал биотехнологии . 149 (4): 280–288. doi : 10.1016/j.jbiotec.2010.06.003 . ПМИД 20599571 .
- Ли Л, Исмагилов Р.Ф. (2010). «Кристаллизация белков с использованием микрофлюидных технологий на основе клапанов, капель и SlipChip». Ежегодный обзор биофизики . 39 : 139–158. doi : 10.1146/annurev.biophys.050708.133630 . ПМИД 20192773 .
- Луккетта Э.М., Ли Дж.Х., Фу Л.А., Патель Н.Х., Исмагилов Р.Ф. (апрель 2005 г.). «Динамика сети формирования эмбрионального паттерна дрозофилы, возмущенная в пространстве и времени с помощью микрофлюидики» . Природа . 434 (7037): 1134–1138. Бибкод : 2005Natur.434.1134L . дои : 10.1038/nature03509 . ПМК 2656922 . ПМИД 15858575 .
- Мелин Дж., Quake SR (2007). «Крупномасштабная интеграция микрофлюидности: эволюция правил проектирования биологической автоматизации». Ежегодный обзор биофизики и биомолекулярной структуры . 36 : 213–231. doi : 10.1146/annurev.biophys.36.040306.132646 . ПМИД 17269901 .
- Шен Ф., Ду В., Кройц Дж.Э., Фок А., Исмагилов Р.Ф. (октябрь 2010 г.). «Цифровая ПЦР на SlipChip» . Лаборатория на чипе . 10 (20): 2666–2672. дои : 10.1039/c004521g . ПМК 2948063 . ПМИД 20596567 .
- Сонг Х, Чен Д.Л., Исмагилов Р.Ф. (ноябрь 2006 г.). «Реакции в каплях в микрофлюидных каналах» . Ангеванде Хеми . 45 (44): 7336–7356. дои : 10.1002/anie.200601554 . ПМК 1766322 . ПМИД 17086584 .
- Спиллер Д.Г., Вуд К.Д., Рэнд Д.А., Уайт М.Р. (июнь 2010 г.). «Измерение динамики отдельных клеток». Природа . 465 (7299): 736–745. Бибкод : 2010Natur.465..736S . дои : 10.1038/nature09232 . ПМИД 20535203 . S2CID 4426105 .
- Тайс Дж.Д., Сонг Х., Лион А.Д., Исмагилов Р.Ф. (2003). «Образование капель и смешивание в многофазной микрофлюидике при низких значениях чисел Рейнольдса и капиллярных чисел». Ленгмюр . 19 (22): 9127–9133. дои : 10.1021/la030090w .
- Винсент М.Э., Лю В., Хейни Э.Б., Исмагилов Р.Ф. (март 2010 г.). «Микрофлюидное стохастическое удержание улучшает анализ редких клеток за счет изоляции клеток и создания среды высокой плотности для контроля диффузных сигналов» . Обзоры химического общества . 39 (3): 974–984. дои : 10.1039/b917851a . ПМЦ 2829723 . ПМИД 20179819 .
- Вейбель Д.Б., генеральный директор Whitesides (декабрь 2006 г.). «Применение микрофлюидики в химической биологии». Современное мнение в области химической биологии . 10 (6): 584–591. дои : 10.1016/j.cbpa.2006.10.016 . ПМИД 17056296 .
- Генеральный директор Уайтсайдса (июль 2006 г.). «Истоки и будущее микрофлюидики». Природа . 442 (7101): 368–373. Бибкод : 2006Natur.442..368W . дои : 10.1038/nature05058 . ПМИД 16871203 . S2CID 205210989 .
- Молодой EW, Beebe DJ (март 2010 г.). «Основы микрофлюидной культуры клеток в контролируемой микросреде» . Обзоры химического общества . 39 (3): 1036–1048. дои : 10.1039/b909900j . ПМК 2967183 . ПМИД 20179823 .
Журналы
[ редактировать ]- ACS Chemical Biology – новый журнал по химической биологии Американского химического общества.
- Биоорганическая и медицинская химия - Журнал исследований на стыке химии и биологии «Тетраэдр»
- ChemBioChem - Европейский журнал химической биологии
- Химическая биология – точка доступа к новостям и исследованиям в области химической биологии со всего RSC Publishing.
- Клеточная химическая биология – междисциплинарный журнал, публикующий статьи, представляющие исключительный интерес во всех областях, находящихся на стыке химии и биологии. chembiol.com
- Журнал химической биологии - новый журнал, публикующий новые работы и обзоры на стыке биологии и физических наук, публикуемый Springer. связь
- Журнал интерфейса Королевского общества - междисциплинарное издание, продвигающее исследования на стыке физических наук и наук о жизни.
- Molecular BioSystems - журнал по химической биологии, в котором особое внимание уделяется взаимодействию химии с омическими науками и системной биологией.
- Nature Chemical Biology – ежемесячный междисциплинарный журнал, предоставляющий международный форум для своевременной публикации важных новых исследований на стыке химии и биологии.
- Энциклопедию химической биологии Wiley Ссылка на
