Ингибитор фермента
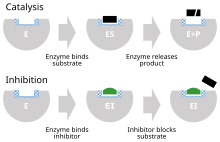
Ингибитор фермента - это молекула , которая связывается с ферментом и блокирует его активность . Ферменты - это белки , которые ускоряют химические реакции, необходимые для жизни , в которых молекулы субстрата превращаются в продукты . [ 1 ] Фермент облегчает специфическую химическую реакцию, связывая субстрат с его активным сайтом , специализированной областью на ферменте, которая ускоряет наиболее сложную стадию реакции .
Ингибитор фермента останавливает («ингибирует») этот процесс, либо связываясь с активным сайтом фермента (таким образом, предотвращая связывание самого субстрата), либо путем связывания с другим сайтом на ферменте, так что катализ фермента реакции блокируется. Ингибиторы фермента могут связывать обратимо или необратимо связывать. Необратимые ингибиторы образуют химическую связь с ферментом, так что фермент ингибируется до тех пор, пока химическая связь не будет нарушена. Напротив, обратимые ингибиторы связываются нековалентно и могут спонтанно покинуть фермент, позволяя ферменту возобновить свою функцию. Обратимые ингибиторы продуцируют различные типы ингибирования в зависимости от того, связываются ли они с ферментом, комплексом фермента-субстрата или обоих.
Ингибиторы фермента играют важную роль во всех клетках, поскольку они, как правило, специфичны для одного фермента каждый и служат для контроля активности этого фермента. Например, ферменты в метаболическом пути могут ингибироваться молекулами, продуцируемыми позже на пути, что ограничивает производство молекул, которые больше не нужны. Этот тип отрицательной обратной связи является важным способом поддерживать баланс в ячейке . [ 2 ] Ингибиторы ферментов также контролируют необходимые ферменты, такие как протеазы или нуклеазы , которые, если ее не контролировать, могут повредить клетку. Многие яды , продуцируемые животными или растениями, являются ингибиторами ферментов, которые блокируют активность важных ферментов в добыче или хищниках .
Многие молекулы лекарственного средства представляют собой ингибиторы фермента, которые ингибируют аберрантный человеческий фермент или фермент, критический для выживания патогена, такого как вирус , бактерия или паразит . Примеры включают метотрексат (используемый при химиотерапии и при лечении ревматического артрита ) и ингибиторы протеазы, используемые для лечения ВИЧ/СПИДа . Поскольку ингибиторы антипатогена обычно нацелены только на один фермент, такие препараты очень специфичны и, как правило, вызывают мало побочных эффектов у людей, при условии, что нет аналогичного у людей фермента. (Это часто бывает так, поскольку такие патогенные микроорганизмы и люди . генетически далеки ) Ингибиторы лекарственного фермента часто имеют низкие константы диссоциации , что означает, что только минутное количество ингибитора необходимо для ингибирования фермента. Низкая концентрация ингибитора фермента снижает риск повреждения печени и почек и других побочных реакций лекарственного средства у людей. Следовательно, открытие и уточнение ингибиторов ферментов является активной областью исследований в области биохимии и фармакологии .
Структурные классы
[ редактировать ]Ингибиторы ферментов представляют собой химически разнообразный набор веществ, которые варьируются в размерах от органических малых молекул до макромолекулярных белков .
Маленькие ингибиторы молекул включают необходимые первичные метаболиты , которые ингибируют восходящие ферменты, которые продуцируют эти метаболиты. Это обеспечивает отрицательную петлю обратной связи, которая предотвращает производство метаболитов и, таким образом, поддерживает клеточный гомеостаз (устойчивые внутренние условия). [ 3 ] [ 2 ] Ингибиторы малых молекул фермента также включают вторичные метаболиты , которые не являются важными для организма, который их производит, но обеспечивает организм с эволюционным преимуществом, поскольку они могут использоваться для отталкивания хищников или конкурирующих организмов или неподвижных добычи. [ 4 ] Кроме того, многие препараты являются ингибиторами малых молекул фермента, которые нацелены на любые ферменты, модифицирующие заболевание у пациента [ 1 ] : 5 или ферменты в патогенных микроорганизмах, которые необходимы для роста и воспроизведения патогена. [ 5 ]
В дополнение к мелким молекулам некоторые белки действуют как ингибиторы фермента. Наиболее заметным примером являются серпины ( сертификация гибиторов ) , . хищничества которые продуцируются животными для защиты от неуместной активации фермента и растениями для предотвращения [ 6 ] Другим классом ингибиторных белков являются ингибиторы рибонуклеазы , которые связываются с рибонуклеазами в одном из самых плотных белковых взаимодействий . [ 7 ] Особым случаем ингибиторов белкового фермента являются зимогены , которые содержат аутоингибирующий N-концевой пептид, который связывается с активным сайтом фермента, который внутримолекулярно блокирует свою активность как защитный механизм против неконтролируемого катализатора. N -концевой пептид расщепляется (разделение) от предшественника зимогенового фермента другим ферментом для выделения активного фермента. [ 8 ]
Сайт связывания ингибиторов на ферментах чаще всего является тем же сайтом, который связывает субстрат фермента. Эти активные ингибиторы сайта известны как ортостерические («обычные» ориентационные ингибиторы. [ 9 ] Механизм ортостерического ингибирования заключается в том, чтобы просто предотвратить связывание субстрата с ферментом посредством прямой конкуренции, которая, в свою очередь, предотвращает катализацию превращения субстратов в продукты. Альтернативно, ингибитор может связываться с сайтом, удаленным от активного сайта фермента. Они известны как аллостерические («альтернативные» ингибиторы ориентации). [ 9 ] Механизмы аллостерического ингибирования варьируются и включают изменение конформации (формы) фермента, чтобы он больше не мог связывать субстрат ( кинетически неразличимо от конкурентного ортостерического ингибирования) [ 10 ] Или альтернативно стабилизируют связывание субстрата с ферментом, но заблокируйте фермент в конформации, которая больше не является каталитически активной. [ 11 ]
Обратимые ингибиторы
[ редактировать ]Обратимые ингибиторы присоединяются к ферментам с нековалентными взаимодействиями, такими как водородные связи , гидрофобные взаимодействия и ионные связи . [ 12 ] Многочисленные слабые связи между ингибитором и активным сайтом фермента объединяются для продуцирования сильного и специфического связывания.
В отличие от необратимых ингибиторов, обратимые ингибиторы, как правило, не подвергаются химическим реакциям, когда связаны с ферментом и могут быть легко удалены путем разбавления или диализа . Специальным случаем являются ковалентные обратимые ингибиторы , которые образуют химическую связь с ферментом, но связь может быть расщеплена, поэтому ингибирование полностью обратимо. [ 13 ]
Обратимые ингибиторы, как правило, классифицируются на четыре типа, введенные Cleland в 1963 году. [ 14 ] Они классифицируются в соответствии с влиянием ингибитора на V MAX (максимальная скорость реакции, катализируемую ферментом) и K M (концентрация субстрата, приводящая к половине максимальной активности фермента), поскольку концентрация субстрата фермента варьируется. [ 15 ] [ 16 ]
Конкурентоспособный
[ редактировать ]При конкурентном торможении субстрат и ингибитор не могут одновременно связываться с ферментом. [ 17 ] : 134 Обычно это происходит из -за того, что ингибитор, имеющий аффинность к активному сайту фермента, где подложка также связывает; Подложка и ингибитор конкурируют за доступ к активному сайту фермента. Этот тип ингибирования может быть преодолен с помощью достаточно высоких концентраций субстрата ( v max остается постоянным), то есть, выходя из ингибитора. [ 17 ] : 134–135 Тем не менее, кажущееся K M будет увеличиваться, поскольку он получает более высокую концентрацию субстрата, чтобы достичь точки K M , или половину V MAX . Конкурентные ингибиторы часто похожи по структуре с реальным субстратом (см., Например, рисунок «метотрексат против фолата» в разделе «препараты» ). [ 17 ] : 134
Неконкурентоспособность
[ редактировать ]В неконкурентоспособном ингибировании ингибитор связывается только с ферментом-субстратным комплексом. [ 17 ] : 139 Этот тип ингибирования приводит к снижению V Max (максимальная скорость снижается в результате удаления активированного комплекса) и K M для уменьшения (из -за лучшей эффективности связывания в результате принципа Le Chatelier и эффективного устранения комплекса ES, таким образом, снижает, таким образом, снижается K M, который указывает на более высокую аффинность связывания). [ 18 ] Неудовлетворительное торможение встречается редко. [ 17 ] : 139 [ 19 ]
Неконкурентный
[ редактировать ]При неконкурентном ингибировании связывание ингибитора с ферментом снижает его активность , но не влияет на связывание субстрата. [ 16 ] Этот тип ингибитора связывается с одинаковой аффинностью со свободным ферментом в отношении комплекса фермента-субстрата. Это можно считать, что обладает способностью конкурентных и неконкуренторов, но без предпочтения ни одного типа. В результате степень ингибирования зависит только от концентрации ингибитора. V MAX будет уменьшаться из -за неспособности реакции продолжаться как эффективно, но K M будет оставаться таким же, как фактическое связывание субстрата, по определению, все равно будет работать должным образом. [ 20 ]
Смешанный
[ редактировать ]В смешанном ингибировании ингибитор может связываться с ферментом, независимо от того, уже связан субстрат. Следовательно, смешанное ингибирование представляет собой комбинацию конкурентного и неконкурентного ингибирования. [ 16 ] Кроме того, сродство ингибитора к свободному ферменту и комплексу фермента-субстрата может отличаться. [ 17 ] : 136–139 Увеличивая концентрации субстрата [S], этот тип ингибирования может быть уменьшен (из -за конкурентного вклада), но не полностью преодоленен (из -за неконкурентного компонента). [ 21 ] : 381–382 Хотя ингибиторы смешанного типа могут связываться в активном сайте, этот тип ингибирования обычно возникает в результате аллостерического эффекта, когда ингибитор связывается с другим сайтом на ферменте. Связывание ингибитора с этим аллостерическим сайтом изменяет конформацию (то есть третичную структуру или трехмерную форму) фермента, так что аффинность субстрата к активному сайту снижается. [ 22 ]
Эти четыре типа ингибирования также можно различить путем влияния увеличения концентрации субстрата на степень ингибирования, вызванное данным количеством ингибитора. Для конкурентного ингибирования степень ингибирования снижается путем увеличения [s], для неконкурентного ингибирования степень ингибирования не изменяется, и для неконкурентного (также называемого антиконъективным) ингибированием степень ингибирования увеличивается с [s]. [ 23 ]
Количественное описание
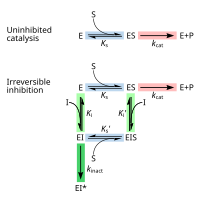
[ редактировать ]ингибитора Обратимое ингибирование может быть описано количественно с точки зрения связывания с ферментом и комплексом фермента-субстрата, а также его воздействия на кинетические константы фермента. [ 24 ] : 6 В классической схеме Михаэлиса-Мюмонена (показана в схеме «механизм механизма ингибирования») фермент (E) связывается с его субстратом (ов), образуя фермент-субстратный комплекс. После катализа этот комплекс разрывается, чтобы высвободить продукт P и бесплатный фермент. [ 24 ] : 55 Ингибитор (I) может связываться с E или ES с константами диссоциации K I или K I ', соответственно. [ 24 ] : 87
- Конкурентные ингибиторы могут связываться с E, но не с ES. Конкурентное ингибирование увеличивает K M (т. Е. Ингибитор мешает связыванию субстрата), но не влияет на V MAX (ингибитор не запускает катализ в ES, поскольку он не может связываться с ES). [ 24 ] : 102
- Неудовлетворительные ингибиторы связываются с ES. Неуверенное ингибирование уменьшает как K M, так и V Max . Ингибитор влияет на связывание субстрата за счет увеличения аффинности фермента к субстрату (снижение K M ), а также задерживая катализ (уменьшает V MAX ). [ 24 ] : 106
- Неконкурентные ингибиторы имеют идентичное сродство к E и ES ( K I = K I '). Неконкурентное ингибирование не изменяет k m (то есть оно не влияет на связывание субстрата), но уменьшает V max (т.е., ингибитор связывающий катализ). [ 24 ] : 97
- Ингибиторы смешанного типа связываются как с E, так и с ES, но их аффинность к этим двум формам фермента различна ( K I ≠ K I '). Таким образом, ингибиторы смешанного типа влияют на связывание субстрата (увеличение или уменьшение k m ) и катализ корзины в комплексе ES (снижение V max ). [ 25 ] : 63–64
Когда фермент имеет несколько субстратов, ингибиторы могут демонстрировать различные типы ингибирования в зависимости от того, какая субстрат рассматривается. Это является результатом активного сайта, содержащего два различных сайта связывания в активном сайте, по одному для каждого субстрата. Например, ингибитор может конкурировать с субстратом A для первого сайта связывания, но быть неконкурентным ингибитором в отношении субстрата B во втором сайте связывания. [ 26 ]
Традиционно обратимые ингибиторы ферментов были классифицированы как конкурентоспособные, неконкурентоспособные или неконкурентные в соответствии с их влиянием на K M и V Max . [ 14 ] Эти три типа ингибирования возникают соответственно из -за связывания ингибитора только с ферментом E в отсутствие субстрата S, с эс комплексом фермента -субстрата, или к обоим. Разделение этих классов возникает из -за проблемы в их выводе и приводит к необходимости использовать две разные константы связывания для одного события привязки. [ 27 ] Кроме того, предполагается, что связывание ингибитора с ферментом приводит к 100% ингибированию и не учитывает возможность частичного ингибирования. [ 27 ] Общая форма ингибирующего термина также скрывает взаимосвязь между связыванием ингибитора с ферментом и его взаимосвязи с любым другим термином связывания, будь то уравнение Михаэлиса -Менден или кривой дозы отклика, связанной с связыванием рецептора лиганда. Чтобы продемонстрировать отношения, можно сделать следующую перестройку: [ 28 ]
Эта перестройка демонстрирует, что, аналогично уравнению Михаэлис -Ментена, максимальная скорость реакции зависит от доли популяции фермента, взаимодействующей с его субстратом.
доля ферментной популяции, связанной с субстратом
доля ферментной популяции, связанной с ингибитором
Эффект ингибитора является результатом процента популяции фермента, взаимодействующей с ингибитором. Единственная проблема с этим уравнением в ее нынешней форме заключается в том, что оно предполагает абсолютное ингибирование фермента с связыванием ингибитора, когда на самом деле может быть широкий диапазон эффектов от 100% ингибирования подложки до ингибирования. Чтобы учесть это, уравнение может быть легко модифицировано, чтобы обеспечить различные степени ингибирования, включив в него Delta V. максимальный термин [ 29 ] : 361
или
Этот термин может затем определить остаточную ферментативную активность, присутствующую, когда ингибитор взаимодействует с отдельными ферментами в популяции. Однако включение этого термина имеет дополнительное значение, позволяющее разрешить возможность активации, если вторичный V -максимальный член оказывается выше, чем начальный термин. Чтобы объяснить, возможно, активацию, а затем можно переписать замену ингибитора «I» на термин модификатора (стимулятор или ингибитор), обозначенной здесь как «x». [ 28 ] : Уравнение 13
связанными с максимальной скоростью уравнения Михаэлиса -Ментена, она подчеркивает потенциальные проблемы с термином, используемым для описания эффектов, связанных с K M. Хотя эта терминология приводит к упрощенному способу справиться с кинетическими эффектами , K относящийся M, к аффинности фермента к субстрату, должен в большинстве случаев связан с потенциальными изменениями в сайте связывания фермента, что непосредственно приводит к взаимодействию ингибитора фермента. Поскольку такой термин, аналогичный термину Delta v Max, предложенный выше для модуляции V Max, должен быть подходящим в большинстве ситуаций: [ 28 ] : Уравнение 14
Константы диссоциации
[ редактировать ]![2D графики концентрации 1/[s] (ось x) и 1/v (ось Y), демонстрирующие, что при изменении концентрации ингибитора конкурентные линии ингибитора пересекаются в одной точке на оси y, неконкурентные ингибиторы пересекаются При оси x, а смешанные ингибиторы пересекают точку, которая не находится ни на оси.](http://upload.wikimedia.org/wikipedia/commons/thumb/b/ba/Inhibition_diagrams-1-.png/220px-Inhibition_diagrams-1-.png)
Ингибитор фермента характеризуется его постоянной диссоциацией k I , концентрацией, при которой половина ингибитора занимает фермент. В неконкурентном ингибировании ингибитор также может связываться с ферментом-субстратным комплексом, а наличие связанного субстрата может изменить аффинность ингибитора к ферменту, что приводит к второй постоянной диссоциации K I '. Следовательно, k i и k i 'являются константами диссоциации ингибитора для фермента и комплекса фермента-субстрата соответственно. [ 30 ] : Глоссарий Константа ингибитора фермента K I может быть измерена непосредственно различными методами; Одним особенно точным методом является калориметрия изотермического титрования , в которой ингибитор титруется в раствор фермента, и измеряется высвобождение или поглощение тепла. [ 31 ] Тем не менее, другая постоянная диссоциации k i 'трудно измерить напрямую, поскольку комплекс фермента-субстрата является коротким и подвергается химической реакции, чтобы сформировать продукт. Следовательно, k i 'обычно измеряется косвенно, наблюдая за активностью фермента в различных концентрациях субстрата и ингибиторов и подготовив данные через нелинейную регрессию [ 32 ] в модифицированное уравнение Михаэлиса -Менден . [ 21 ]
где модифицирующие факторы α и α 'определяются концентрацией ингибитора и двумя его константами диссоциации
Таким образом, в присутствии ингибитора эффективным k m и v max фермента становятся (α/α ') k m и (1/α') v max соответственно. Тем не менее, модифицированное уравнение Михаэлиса-Ментена предполагает, что связывание ингибитора с ферментом достигло равновесия, что может быть очень медленным процессом для ингибиторов с субнаномолярными константами диссоциации. В этих случаях ингибирование становится эффективно необратимым, следовательно, более практично обрабатывать такие жесткие ингибиторы как необратимые (см. Ниже ).
Эффекты различных типов обратимых ингибиторов фермента на ферментативную активность могут быть визуализированы с использованием графических представлений об уравнении Михаэлиса-Менден, таких как Lineweaver-Burk , Eadie-Hofstee или участки Hanes-Woolf . [ 17 ] : 140–144 Иллюстрация представлена тремя участками Lineweaver -Burk, изображенной на рисунке LineWeaver -Burk . На верхней диаграмме линии конкурентного ингибирования пересекаются по оси y , иллюстрируя, что такие ингибиторы не влияют на V Max . На нижней диаграмме неконкурентные линии ингибирования пересекаются на оси x что эти ингибиторы не влияют на K M. , показывая , Однако, поскольку может быть трудно оценить k i и k i 'точно с таких сюжетов, [ 33 ] Желательно оценить эти константы, используя более надежные методы нелинейной регрессии. [ 33 ]
Особые случаи
[ редактировать ]Частично конкурентоспособно
[ редактировать ]Механизм частично конкурентного ингибирования аналогичен механизму неконкурентного, за исключением того, что комплекс EIS обладает каталитической активностью, которая может быть ниже или даже выше (частично конкурентная активация), чем в комплексе фермента-substrate (ES). Это ингибирование обычно отображает более низкий V -макс , но нетронутое K M. значение [ 18 ]
Субстрат или продукт
[ редактировать ]Подложка или ингибирование продукта - это то, где подложка или продукт ферментов также действуют как ингибитор. Это ингибирование может следовать за конкурентоспособными, неконкурентоспособными или смешанными узорами. При ингибировании субстрата наблюдается прогрессивное снижение активности при высоких концентрациях субстрата, потенциально из фермента, имеющего два конкурирующих субстрат-связывающих сайта. При низкой субстрате участок с высокой аффинностью занят, а нормальная кинетика соблюдается. Однако при более высоких концентрациях второй ингибирующий сайт становится занятым, ингибируя фермент. [ 34 ] Ингибирование продукта (либо собственный продукт фермента, либо продукт для фермента ниже по течению в его метаболическом пути) часто является регуляторной особенностью в метаболизме и может быть формой негативной обратной связи . [ 2 ]
Медленная
[ редактировать ]Медленное ингибирование возникает, когда начальный комплекс ферментации-ингибитора подвергается конформационной изомеризме (изменение формы) на второй более плотно удерживаемый комплекс, EI*, но общий процесс ингибирования обратимо. Это проявляется как медленно увеличивающее ингибирование ферментов. В этих условиях традиционная кинетика Михаэлиса -Ментена придает ложную ценность для K I , что зависит от времени. Истинное значение K I может быть получено посредством более сложного анализа констант скорости ON ( K ON ) и OFF ( k OFF ) для ассоциации ингибиторов с кинетикой, аналогичной необратимым ингибированию . [ 17 ] : 168
Аналоги с мульти-субстратом
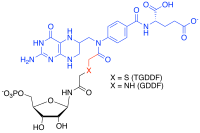
[ редактировать ]Аналоговые ингибиторы с несколькими субстратами представляют собой селективные ингибиторы с высокой аффинностью, которые могут быть подготовлены к ферментам, которые катализируют реакции с более чем одним субстратом, захватывая энергию связывания каждого из этих субстрата в одну молекулу. [ 35 ] [ 36 ] Например, в формального переноса реакциях пуринового биосинтеза мультизабстратный ингибитор аддукта (MAI) с глицинамидной рибонуклеотидной ( TFAS GAR , мощный ) производить тиоглицинамид рибонуклеотид дидеазафолат (TGDDF), [ 37 ] или ферментативно от натурального субстрата GAR, чтобы получить GDDF. [ 38 ] Здесь субнаномолярная постоянная диссоциации (KD) TGDDF была больше, чем предсказанная, предположительно, из -за энтропийных преимуществ, полученных и/или положительных взаимодействий, полученных через атомы, связывающие компоненты. Также наблюдалось, что MAIS продуцируется в клетках реакциями Pro-Srugs, таких как изониазид [ 39 ] или лиганды ингибитора ферментов (например, PTC124 ) [ 40 ] с клеточными кофакторами, такими как никотинамид -аденин -динуклеотид (NADH) и аденозин трифосфат (АТФ) соответственно. [ 41 ]
Примеры
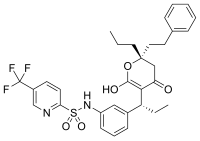
[ редактировать ]Поскольку ферменты эволюционировали для тесного связывания своих субстратов, и большинство обратимых ингибиторов связываются в активном сайте ферментов, неудивительно, что некоторые из этих ингибиторов поразительно схожи по структуре с субстратами своих мишеней. Ингибиторы дигидрофолатредуктазы (DHFR) являются заметными примерами. [ 42 ] Другими примерами этих имиталов субстрата являются ингибиторы протеазы , терапевтически эффективный класс антиретровирусных препаратов, используемых для лечения ВИЧ/СПИДа . [ 43 ] [ 44 ] Структура ритонавира , пептидомиметического (пептидного имитируемого) ингибитора протеазы, содержащего три пептидных связей , как показано на «конкурентном ингибировании» на рисунке выше. Поскольку этот препарат напоминает пептид, который является субстратом ВИЧ -протеазы, он конкурирует с субстратом в активном сайте фермента. [ 45 ]
Ингибиторы фермента часто предназначены для имитации переходного состояния или промежуточного соединения реакции, катализируемой ферментами. [ 46 ] Это гарантирует, что ингибитор использует переходное состояние, стабилизирующее эффект фермента, что приводит к лучшему сродству связывания (нижний K I ), чем конструкции на основе субстрата. Примером такого переходного ингибитора является противовирусный препарат осельтамивир ; Этот препарат имитирует плоскую природу иона оксония кольца в реакции вирусного фермента нейрораминидазы . [ 47 ]
Однако не все ингибиторы основаны на структурах субстратов. Например, структура другого ингибитора протеазы ВИЧ типанавира не основана на пептиде и не имеет очевидного структурного сходства с белковым субстратом. Эти непептидные ингибиторы могут быть более стабильными, чем ингибиторы, содержащие пептидные связи, потому что они не будут субстратами для пептидаз и с меньшей вероятностью будут деградированы. [ 48 ]
В дизайне лекарств важно учитывать концентрации субстратов, на которые подвергаются целевые ферменты. Например, некоторые ингибиторы протеинкиназы имеют химические структуры, которые похожи на АТФ, один из субстратов этих ферментов. [ 49 ] Тем не менее, лекарства, которые являются простыми конкурентными ингибиторами, должны будут конкурировать с высокими концентрациями АТФ в клетке. Протеинкиназы также могут быть ингибированы конкуренцией в сайтах связывания, где киназы взаимодействуют с их субстратными белками, и большинство белков присутствуют внутри клеток в концентрациях, намного ниже, чем концентрация АТФ. Как следствие, если два ингибитора протеинкиназы оба связываются в активном сайте с аналогичной аффинностью, но только один должен конкурировать с АТФ, то конкурентный ингибитор в сайте связывающего белка будет более эффективно ингибировать фермент. [ 50 ]
Необратимые ингибиторы
[ редактировать ]Типы
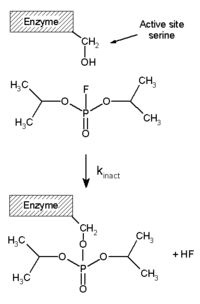
[ редактировать ]Необратимые ингибиторы ковалентно связываются с ферментом, и, следовательно, этот тип ингибирования не может быть легко изменен. [ 51 ] Необратимые ингибиторы часто содержат реактивные функциональные группы, такие как азотные горчики , альдегиды , галоалканы , алкены , акцепторы Майкла , фенилсульфонаты или флуорофосфонаты . [ 52 ] Эти электрофильные группы реагируют с аминокислотными боковыми цепями с образованием ковалентных аддуктов . [ 51 ] Модифицированные остатки - это те с боковыми цепями, содержащими нуклеофилы, такие как гидроксильные или сульфгидрильные группы; К ним относятся аминокислоты серина (которые реагируют с DFP , см. Диаграмму «DFP реакции»), а также цистеин , треонин или тирозин . [ 53 ]
Необратимое ингибирование отличается от необратимой инактивации фермента. [ 54 ] Необратимые ингибиторы, как правило, специфичны для одного класса фермента и не инактивируют все белки; Они не функционируют, разрушая структуру белка , а специально изменяя активное место их цели. Например, крайности рН или температуры обычно вызывают денатурацию всей структуры белка, но это неспецифический эффект. Аналогичным образом, некоторые неспецифические химические обработки разрушают структуру белка: например, нагрев в концентрированной соляной кислоте будет гидролизировать пептидные связи, скрепляющие белки, высвобождая свободные аминокислоты. [ 55 ]
Необратимые ингибиторы демонстрируют зависящее от времени ингибирование, и, следовательно, их эффективность не может характеризоваться значением IC 50 . Это связано с тем, что количество активного фермента в заданной концентрации необратимого ингибитора будет различаться в зависимости от того, как долго инкубируется инкубируемой инкубированием с ферментом. Вместо этого k obs /[ i ], используются значения [ 56 ] где k Obs -это наблюдаемый псевдо-первой скорость инактивации (полученная путем построения журнала % активности % в зависимости от времени), а [ i ] является концентрацией ингибитора. Параметр k obs /[ i ] действителен до тех пор, пока ингибитор не насыщает связывание ферментом (в этом случае k obs = k inact ), где k inact является скоростью инактивации.
Измерение
[ редактировать ]Необратимые ингибиторы сначала образуют обратимый нековалентный комплекс с ферментом (EI или ESI). Впоследствии между ферментом и ингибитором возникает химическая реакция для получения ковалентно модифицированного «тупикового комплекса» EI* (необратимый ковалентный комплекс). Скорость, с которой сформируется EI*, называется скоростью инактивации или K inact . [ 13 ] Поскольку формирование EI может конкурировать с ES, связывание необратимых ингибиторов может быть предотвращено конкуренцией либо с подложкой, либо с вторым обратимым ингибитором. Этот эффект защиты является хорошим доказательством конкретной реакции необратимого ингибитора с активным сайтом.
Стадии связывания и инактивации этой реакции исследуются путем инкубации фермента с ингибитором и анализа объема активности, оставшейся с течением времени. Активность будет снижена в зависимости от времени, обычно после экспоненциального распада . Подходящее эти данные к уравнению скорости дает скорость инактивации при этой концентрации ингибитора. Это делается в нескольких различных концентрациях ингибитора. Если реверсивный комплекс EI задействован, скорость инактивации будет насыщенной, и подготовить эту кривую даст K inact и k i . [ 57 ]
Другим методом, который широко используется в этих анализах, является масс -спектрометрия . Здесь точное измерение массы немодифицированного нативного фермента и инактивированного фермента дает увеличение массы, вызванную реакцией с ингибитором, и показывает стехиометрию реакции. [ 58 ] Обычно это делается с использованием масс-спектрометра MALDI-TOF . [ 59 ] В дополнительной технике пептидная массовая снятия пальцев включает переваривание нативного и модифицированного белка с помощью протеазы, такой как трипсин . Это приведет к набору пептидов , которые можно проанализировать с использованием масс -спектрометра. Пептид, который изменяется в массе после реакции с ингибитором, будет тем, который содержит сайт модификации. [ 60 ]
Медленное связывание
[ редактировать ]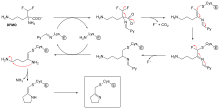
Не все необратимые ингибиторы образуют ковалентные аддукты с их ферментными мишенями. Некоторые обратимые ингибиторы так тесно связываются с их целевым ферментом, что они по сути необратимы. Эти жесткие ингибиторы могут показывать кинетику, аналогичную ковалентным необратимым ингибиторам. В этих случаях некоторые из этих ингибиторов быстро связываются с ферментом в комплексе EI с низким аффинтностью, а затем подвергается более медленной перестройке с очень плотно связанным комплексом EI* (см. «Необратимая механизм ингибирования»). Это кинетическое поведение называется медленным связыванием. [ 62 ] Эта медленная перестройка после связывания часто включает в себя конформационное изменение , поскольку фермент «зажимает» вокруг молекулы ингибитора. Примеры медленных ингибиторов включают некоторые важные лекарства, такие как метотрексат , [ 63 ] аллопуринол , [ 64 ] и активированная форма ацикловира . [ 65 ]
Некоторые примеры
[ редактировать ]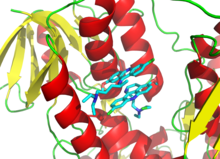
Диизопропилфлюрофосфат (DFP) является примером необратимого ингибитора протеазы (см. Диаграмму «реакция DFP»). Фермент гидролизует фосфорс -флуориную связь, но остаток фосфата остается связанным с серином в активном участке , деактивируя ее. [ 67 ] Аналогичным образом, DFP также реагирует с активным сайтом ацетилхолинэстеразы в синапсах нейронов и, следовательно, является мощным нейротоксином со смертельной дозой менее 100 мг. [ 68 ]
Ингибирование самоубийств является необычным типом необратимого ингибирования, когда фермент превращает ингибитор в реактивную форму в его активном сайте. [ 69 ] Примером является ингибитор биосинтеза полиаминов , α-дифторметилорнитин (DFMO), который является аналогом аминокислотного орнитина и используется для лечения африканского трипаносомоза (спящая болезнь). Орнитин декарбоксилаза может катализировать декарбоксилирование DFMO вместо орнитина (см. Диаграмму «Механизм ингибитора DFMO»). Однако за этой реакцией декарбоксилирования следует элиминация атома фтора, который превращает это каталитическое промежуточное соединение в конъюгированный имин , очень электрофильный вид. Эта реактивная форма DFMO затем реагирует с остатком цистеина или лизина в активном сайте, чтобы необратимо инактивировать фермент. [ 61 ]
Поскольку необратимое ингибирование часто включает в себя начальное образование нековалентного комплекса ингибитора фермента (EI), [ 13 ] Иногда ингибитор может связываться с ферментом более чем одним способом. Например, на рисунке, показывающей трипанотионерекредуктазу из простейшего паразита человека трипаносомы Cruzi , две молекулы ингибитора, называемого хинакриновым горчицей, связаны в его активном сайте. Верхняя молекула обратимо связана, но нижняя нижняя связана ковалентно, поскольку она реагировала с аминокислотным остатком через свою азотную горчичную группу. [ 70 ]
Приложения
[ редактировать ]Ингибиторы ферментов обнаружены в природе [ 71 ] а также производится искусственно в лаборатории. [ 72 ] Природные ингибиторы фермента регулируют многие метаболические процессы и имеют важное значение для жизни. [ 3 ] [ 1 ] Кроме того, естественные яды часто являются ингибиторами ферментов, которые развивались для использования в качестве токсичных агентов против хищников, добычи и конкурирующих организмов. [ 4 ] Эти естественные токсины включают некоторые из самых ядовитых веществ, известных. [ 73 ] Искусственные ингибиторы часто используются в качестве лекарств, но также могут быть инсектицидами, такими как малатион , гербициды, такие как глифосат , [ 74 ] или дезинфицирующие средства, такие как триклозан . Другие ингибиторы искусственного фермента блокируют ацетилхолинэстеразу , фермент, который разрушает ацетилхолин и используется в качестве нервных агентов в химической войне . [ 75 ]
Метаболическая регуляция
[ редактировать ]Ингибирование ферментов является общей особенностью контроля метаболического пути в клетках. [ 3 ] Метаболический поток пути, через путь часто регулируется метаболитами действующими как ингибиторы и усилители для ферментов в том же пути. Гликолитический путь является классическим примером. [ 76 ] Этот катаболический путь потребляет глюкозу и производит АТФ , NADH и пируват . Ключевым этапом регуляции гликолиза является ранняя реакция в пути, катализируемой фосфофруктокиназой -1 (PFK1). Когда уровни АТФ повышаются, АТФ связывает аллостерический сайт в PFK1, чтобы уменьшить скорость реакции фермента; Гликолиз ингибируется, а производство АТФ падает. Этот контроль отрицательной обратной связи помогает поддерживать постоянную концентрацию АТФ в ячейке. Тем не менее, метаболические пути не только регулируются через ингибирование, поскольку активация ферментов одинаково важна. Что касается PFK1, то фруктоза 2,6-бисфосфат и ADP являются примерами метаболитов, которые являются аллостерическими активаторами. [ 77 ]
Физиологическое ингибирование ферментов также может быть продуцировано специфическими ингибиторами белка. Этот механизм возникает в поджелудочной железе , которая синтезирует многие ферменты предшественника пищеварения, известные как зимогены . Многие из них активируются протеазой трипсина , поэтому важно ингибировать активность трипсина в поджелудочной железе, чтобы предотвратить переваривание органа. Одним из способов контроля активности трипсина является производство специфического и мощного белка ингибитора трипсина в поджелудочной железе. Этот ингибитор жестко связывается с трипсином, предотвращая активность трипсина, которая в противном случае наносит ущерб органу. [ 78 ] Хотя ингибитор трипсина является белком, он позволяет избежать гидролизированного в качестве субстрата протеазой, исключая воду из активного участка трипсина и дестабилизируя переходное состояние. [ 79 ] Другие примеры белков ингибитора физиологических ферментов включают ингибитор Barstar бактериальной рибонуклеазы . [ 80 ]
Естественные яды
[ редактировать ]
Животные и растения эволюционировали для синтеза огромного спектра ядовитых продуктов, включая вторичные метаболиты , [ 81 ] Пептиды и белки [ 82 ] Это может действовать как ингибиторы. Природные токсины, как правило, являются небольшими органическими молекулами и настолько разнообразны, что, вероятно, существуют естественные ингибиторы для большинства метаболических процессов. [ 83 ] Метаболические процессы, нацеленные на естественные яму, охватывают нечто большее, чем ферменты в метаболических путях, а также могут включать ингибирование функций рецептора, канала и структурных белков в клетке. Например, паклитаксел (таксол), органическая молекула, обнаруженная в тихоокеанском тихоокеанском дереве , плотно связывается с тубулина димерами и ингибирует их сборку в микротрубочки в цитоскелете . [ 84 ]
Многие естественные яды действуют как нейротоксины , которые могут вызвать паралич, приводящий к смерти и функции защиты от хищников или при охоте и захвате добычи. Некоторые из этих естественных ингибиторов, [ 85 ] Несмотря на их токсичные атрибуты, ценны для терапевтического использования в более низких дозах. [ 86 ] Примером нейротоксина являются гликоалкалоиды , от видов растений в семействе Solanaceae (включает картофель , томат и баклажан ), которые являются ингибиторами ацетилхолинэстеразы . Ингибирование этого фермента вызывает неконтролируемое увеличение нейротрансмиттера ацетилхолина, мышечного паралича и затем смерти. Нейротоксичность также может возникнуть в результате ингибирования рецепторов; Например, атропин из смертельного паслена ( Atropa belladonna ), который функционирует как конкурентный антагонист мускариновых рецепторов ацетилхолина . [ 87 ]
Хотя многие естественные токсины являются вторичными метаболитами, эти яды также включают пептиды и белки. Примером токсичного пептида является альфа-аманитин , который встречается у родственников гриба смерти . Это мощный ингибитор фермента, в этом случае предотвращает РНК -полимеразы II . транзирирующую ДНК фермент [ 88 ] токсина водорослей Микроцистин также является пептидом и является ингибитором белковых фосфатаз . [ 89 ] Этот токсин может загрязнять водоснабжения после цветения водорослей и является известным канцерогеном, который также может вызвать острое кровоизлияние в печени и смерть в более высоких дозах. [ 90 ]
Белки также могут быть натуральными ядами или антинутриентами , такими как ингибиторы трипсина (обсуждаемые в разделе «Метаболическая регуляция» выше), которые встречаются в некоторых бобовых . [ 91 ] Менее распространенный класс токсинов - это токсичные ферменты: они действуют как необратимые ингибиторы их целевых ферментов и работают, химически модифицируя их субстратные ферменты. Примером является рицин , чрезвычайно мощный белковый токсин, обнаруженный в бобах касторового масла . [ 92 ] Этот фермент представляет собой гликозидазу , которая инактивирует рибосомы. [ 93 ] Поскольку рицин является каталитическим необратимым ингибитором, это позволяет только одной молекуле рицина убить клетку. [ 94 ]
Наркотики
[ редактировать ]

Наиболее распространенным применением ингибиторов ферментов являются лекарства для лечения заболеваний. Многие из этих ингибиторов нацелены на человеческий фермент и стремятся исправить патологическое состояние. Например, аспирин является широко используемым препаратом, который действует как ингибитор самоубийств фермента циклооксигеназы . [ 95 ] Это ингибирование, в свою очередь, подавляет выработку прохвалистых простагландинов , и, следовательно, аспирин может использоваться для снижения боли, лихорадки и воспаления. [ 95 ]
По состоянию на 2017 год, [update] По оценкам, 29% утвержденных препаратов являются ингибиторами ферментов [ 96 ] из которых около одной пятой являются ингибиторы киназы . [ 96 ] Примечательным классом мишеней для препаратов киназы является рецепторные тирозинкиназы , которые являются важными ферментами, которые регулируют рост клеток ; Их чрезмерная активация может привести к раку. Следовательно, ингибиторы киназы, такие как иматиниб, часто используются для лечения злокачественных новообразований. [ 97 ] Янус киназы являются еще одним заметным примером лекарственных ферментных мишеней. Ингибиторы янус -киназ блокируют выработку воспалительных цитокинов , и, следовательно, эти ингибиторы используются для лечения различных воспалительных заболеваний , включая артрит , астму и болезнь Крона . [ 98 ]
Пример структурного сходства некоторых ингибиторов с субстратами ферментов, на которые они нацелены, наблюдается на рисунке, сравнивающей метотрексат лекарственного средства с фолиевой кислотой . Фолиевая кислота является окисленной формой субстрата дигидрофолатной редуктазы , фермента, который мощно ингибируется метотрексатом. Метотрексат блокирует действие дигидрофолатредуктазы и, таким образом, останавливает тимидина . биосинтез [ 42 ] Этот блок нуклеотидного биосинтеза является избирательно токсичным для быстро растущих клеток, поэтому метотрексат часто используется при химиотерапии рака. [ 99 ]
Общим лечением эректильной дисфункции является силденафил (виагра). [ 100 ] Это соединение является мощным ингибитором CGMP -специфической фосфодиэстеразы типа 5 , фермента, который разлагает циклический монофосфат сигнальной молекулы . [ 101 ] Эта сигнальная молекула запускает релаксацию гладких мышц и обеспечивает кровоток в кавернозум корпуса , что вызывает эрекцию. Поскольку препарат уменьшает активность фермента, который останавливает сигнал, он делает этот сигнал в течение более длительного периода времени.
Антибиотики
[ редактировать ]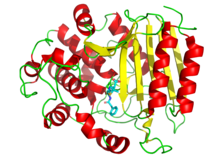
Препараты также используются для ингибирования ферментов, необходимых для выживания патогенов. Например, бактерии окружены толстой клеточной стенкой из чистоподобного полимера, называемого пептидогликаном . Многие антибиотики , такие как пенициллин и ванкомицин, ингибируют ферменты, которые продуцируют, а затем сшивают цепи этого полимера вместе. [ 102 ] [ 103 ] Это заставляет клеточную стенку потерять силу, а бактерии лопались. На рисунке показана молекула пенициллина (показана в форме шариков и палки), связанная с ее мишенью, транспептидаза из бактерий Streptomyces R61 (белок показан как диаграмма ленты ).
антибиотиков Дизайн препарата облегчается, когда фермент, который необходим для выживания патогена, отсутствует или очень отличается у людей. [ 104 ] Люди не делают пептидогликан, поэтому антибиотики, которые ингибируют этот процесс, избирательно токсичны для бактерий. [ 105 ] Селективная токсичность также продуцируется при антибиотиках путем использования различий в структуре рибосом в бактериях, [ 106 ] или как они делают жирные кислоты . [ 107 ]
Антивирусные изделия
[ редактировать ]Препараты, которые ингибируют ферменты, необходимые для репликации вирусов, эффективны при лечении вирусных инфекций. [ 108 ] Противовирусные препараты включают ингибиторы протеазы, используемые для лечения ВИЧ/СПИДа [ 109 ] и гепатит С , [ 110 ] ингибиторы обратной транскриптазы, нацеленные на ВИЧ/СПИД [ 111 ] ингибиторы нейрораминидазы, нацеленные на грипп , [ 112 ] и ингибиторы терминазы, нацеленные на цитомегаловирус человека . [ 113 ]
Пестициды
[ редактировать ]Многие пестициды являются ингибиторами ферментов. [ 114 ] Ацетилхолинэстераза (ACHE) - это фермент, обнаруженный у животных, от насекомых до людей. Очень важно функционировать нервные клетки через его механизм разбивания нейротрансмиттера ацетилхолина на его составляющие, ацетат и холин . [ 115 ] Это несколько необычно среди нейротрансмиттеров, так как большинство, включая серотонин , дофамин и норэпинефрин , поглощаются из синаптической расщелины , а не расщепления. Большое количество ингибиторов болей используется как в медицине, так и в сельском хозяйстве. [ 116 ] Обратимые конкурентные ингибиторы, такие как edrophonium , physostigmine и neostigmine , используются при лечении миастении гравис [ 117 ] и в анестезии, чтобы обратить вспять мышечную блокаду. [ 118 ] Пестициды карбамата также являются примерами обратимых ингибиторов ACHE. Органофосфатные пестициды , такие как малатион , паратион и хлорпирифос необратимо ингибируют ацетилхолинэстеразу. [ 119 ]
Гербициды
[ редактировать ]гербицида Глифосат является ингибитором 3-фосфосикированной 1-карбоксивинилтрансферазы , [ 120 ] Другие гербициды, такие как сульфониллуреаса, ингибируют фермент ацетолактат -синтазу . [ 121 ] Оба фермента необходимы для растений, чтобы сделать аминокислоты с разветвленной цепью . Многие другие ферменты ингибируются гербицидами, включая ферменты, необходимые для биосинтеза липидов и каротиноидов , а также процессы фотосинтеза и окислительного фосфорилирования . [ 122 ]
Открытие и дизайн
[ редактировать ]
Новые лекарства - это продукты длительного процесса разработки лекарств , первым этапом которого часто является открытие нового ингибитора фермента. [ 123 ] Существует два принципиальных подхода к обнаружению этих ингибиторов. [ 124 ]
Первым общим методом является рациональный дизайн лекарств, основанный на имитировании переходного состояния химической реакции, катализируемой ферментом. [ 125 ] Проектный ингибитор часто напоминает субстрат, за исключением того, что часть субстрата, которая подвергается химической реакции, заменяется химически стабильной функциональной группой , которая напоминает переходное состояние. Поскольку фермент развивался для стабилизации переходного состояния, аналоги переходного состояния обычно обладают более высоким сродством к ферменту по сравнению с субстратом и, следовательно, являются эффективными ингибиторами. [ 46 ]
Вторым способом обнаружения новых ингибиторов ферментов является высокопроизводительный скрининг крупных библиотек структурно разнообразных соединений для идентификации молекул HIT, которые связываются с ферментом. Этот метод был расширен, чтобы включить виртуальный скрининг баз данных разнообразных молекул с использованием компьютеров, [ 126 ] [ 127 ] которые затем сопровождаются экспериментальным подтверждением связывания виртуальных скрининговых ударов. [ 128 ] Дополнительные подходы, которые могут обеспечить новые начальные точки для ингибиторов, включают открытие свинца на основе фрагментов [ 129 ] и ДНК, закодированные химические библиотеки (DEL). [ 130 ]
Удар из любого из вышеперечисленных подходов могут быть оптимизированы в борьбу с высокой аффинностью, которые эффективно ингибируют фермент. [ 131 ] Компьютерные методы для прогнозирования ориентации связывания и аффинности ингибитора для фермента, такого как молекулярная стыковка [ 132 ] и молекулярная механика может использоваться, чтобы помочь в процессе оптимизации. [ 133 ] Новые ингибиторы используются для получения кристаллографических структур фермента в комплексе ингибитора/фермента, чтобы показать, как молекула связывается с активным сайтом, позволяя вносить изменения с ингибитором для оптимизации связы Полем [ 1 ] : 66 Этот тест и улучшение цикла повторяется до тех пор, пока не будет произведен достаточно мощный ингибитор.
Смотрите также
[ редактировать ]- Протеомика на основе активности -ветвь протеомики , которая использует ингибиторы ковалентных ферментов в качестве репортеров для мониторинга активности ферментов.
- Антиметаболит - ингибитор фермента, который используется для вмешательства в рост и деление клеток
- Аналог переходного состояния - тип ингибитора фермента, который имитирует переходное состояние химической реакции, катализируемой ферментом
Ссылки
[ редактировать ]- ^ Jump up to: а беременный в дюймовый Copeland RA (март 2013 г.). «Почему ферменты как лекарственные мишени? Фермент необходимы для жизни». Оценка ингибиторов ферментов при обнаружении лекарств: руководство для химиков лекарственных средств и фармакологов (второе изд.). John Wiley & Sons, Inc. с. 1–23. doi : 10.1002/9781118540398.CH1 . ISBN 978-1-118-48813-3 .
- ^ Jump up to: а беременный в Sauro HM (февраль 2017 г.). «Контроль и регуляция путей посредством отрицательной обратной связи» . Журнал Королевского общества, интерфейс . 14 (127): 1–13. doi : 10.1098/rsif.2016.0848 . PMC 5332569 . PMID 28202588 .
- ^ Jump up to: а беременный в Plaxton WC (2004). «Принципы метаболического контроля» . В Starey KB (ред.). Функциональный метаболизм: регуляция и адаптация . Хобокен, Нью -Джерси: Джон Вили и сыновья. С. 1–24 (12). ISBN 978-0-471-67557-0 Полем Архивировано из оригинала 28 марта 2023 года . Получено 14 апреля 2022 года .
- ^ Jump up to: а беременный Haefner B (июнь 2003 г.). «Препараты из глубины: морские натуральные продукты в качестве кандидатов в наркотики». Drug Discovery сегодня . 8 (12): 536–44. doi : 10.1016/s1359-6446 (03) 02713-2 . PMID 12821301 .
- ^ Gualerzi Co, Brandi L, Fabbretti A, Pon CL (2013). Антибиотики: мишени, механизмы и устойчивость . Хобокен: Джон Уайли и сыновья. ISBN 978-3-527-65970-8 .
- ^ Sanrattana W, Maas C, De Maat S (2019). «Серпины-ловушка к лечению» . Границы в медицине . 6 : 25. doi : 10.3389/fmed.2019.00025 . PMC 6379291 . PMID 30809526 .
- ^ Shapiro R, Vallee BL (февраль 1991 г.). «Взаимодействие человеческой плацентарной рибонуклеазы с ингибитором плаценты рибонуклеазы». Биохимия . 30 (8): 2246–2255. doi : 10.1021/bi00222a030 . PMID 1998683 .
- ^ Бун Л., Угарте-Берзал Е., Вандурен Дж., Опденаккер Г. (апрель 2020 г.). «Протеазовая пропептидная структура, механизмы активации и функции». Критические обзоры биохимии и молекулярной биологии . 55 (2): 111–165. doi : 10.1080/10409238.2020.1742090 . PMID 32290726 . S2CID 215772580 .
- ^ Jump up to: а беременный Rydzewski RM (2010). «Глава 7.2.1: конкуренция и аллостера» . Открытие лекарств в реальном мире: руководство химика по биотехнологическим и фармацевтическим исследованиям (1 -е изд.). Амстердам: Elsevier. С. 281–285. ISBN 978-0-08-091488-6 Полем Архивировано из оригинала 28 марта 2023 года . Получено 20 июля 2022 года .
- ^ Jakubík J, Randáková A, El-Fakahany EE, Doležal V (2019). «Анализ равновесного связывания ортостерического индикатора и двух аллостерических модуляторов» . Plos один . 14 (3): E0214255. BIBCODE : 2019PLOSO..1414255J . doi : 10.1371/journal.pone.0214255 . PMC 6436737 . PMID 30917186 .
- ^ Патрик Г.Л. (2013). «Глава 7: Ферменты как лекарственные цели» . Введение в лекарственную химию (пятое изд.). Оксфорд, Великобритания: издательство Оксфордского университета. п. 90. ISBN 978-0-19-969739-7 Полем Архивировано из оригинала 20 июля 2022 года . Получено 20 июля 2022 года .
- ^ Kuriyan J, Konforti B, Wemmer D (2012). «Молекулярное распознавание: термодинамика связывания» . Молекулы жизни: физические и химические принципы (первое изд.). Бока -Ратон, Флорида: Гарлендская наука. С. 531–580. ISBN 978-1-135-08892-7 Полем Архивировано из оригинала 7 июня 2022 года . Получено 7 июня 2022 года .
- ^ Jump up to: а беременный в Tuley A, Fast W (июнь 2018 г.). «Таксономия ковалентных ингибиторов» . Биохимия . 57 (24): 3326–3337. doi : 10.1021/acs.biochem.8b00315 . PMC 6016374 . PMID 29689165 .
- ^ Jump up to: а беременный Cleland WW (февраль 1963 г.). «Кинетика реакций, катализируемых ферментами, с двумя или более субстратами или продуктами. II. Ингибирование: номенклатура и теория». Biochimica et Biophysica Acta (BBA) - Специализированный раздел на фермеры . 67 : 173–187. doi : 10.1016/0926-6569 (63) 90226-8 . PMID 14021668 .
- ^ Berg J, Tymoczko J, Stryer L (2002). Биохимия . WH Freeman and Company. ISBN 978-0-7167-4955-4 Полем Архивировано с оригинала 26 сентября 2009 года . Получено 31 августа 2017 года .
- ^ Jump up to: а беременный в «Типы запрета» . NIH Center по трансляционной терапии. Архивировано из оригинала 8 сентября 2011 года . Получено 2 апреля 2012 года .
- ^ Jump up to: а беременный в дюймовый и фон глин час Корниш-Боуден А (2012). Основы кинетики фермента (4 -е изд.). Вейнхайм: Wiley-VCH. ISBN 978-3-527-66549-5 .
- ^ Jump up to: а беременный Segel IH (1993). Кинетика фермента: поведение и анализ быстрого равновесия и стационарных ферментных систем (новое изд.). Wiley-Interscience. ISBN 978-0-471-30309-1 .
- ^ Палмер Т., Боннер П.Л. (2007). «Ингибирование фермента». Ферменты: биохимия, биотехнология, клиническая химия (2 -е изд.). Woodhead Publishing. С. 126–152 (135). doi : 10.1533/9780857099921.2.126 . ISBN 978-1-904275-27-5 .
- ^ Delaune KP, Alsayouri K (сентябрь 2021 г.). «Физиология: неконкурентный ингибитор» . Statpearls . Остров сокровищ (Флорида): Statpearls Publishing. п. 31424826. PMID 31424826 . Архивировано из оригинала 28 ноября 2021 года . Получено 3 апреля 2022 года .
- ^ Jump up to: а беременный Voet D, Voet JG, Pratt CW (2016). «Глава 12: Кинетика фермента, ингибирование и контроль». Основы биохимии: жизнь на молекулярном уровне (пятое изд.). Хобокен, Нью -Джерси: Уайли. С. 361–401. ISBN 978-1-118-91840-1 .
- ^ Buker SM, Boriack-Sjodin PA, Copeland RA (июнь 2019 г.). «Взаимодействие ферментации-ингибитор и простой, быстрый метод для определения модальности ингибирования» . SLAS Discovery: продвижение наук о Life Sciences R & D. 24 (5): 515–522 (516). doi : 10.1177/24725555219829898 . PMID 30811960 . S2CID 73480979 .
В некоторых случаях ингибитор может связываться с отдельным сайтом на ферменте, который находится в аллостерической связи с субстратом -связывающим карманом. Во многих случаях аллостерические, субстратные конкурентные соединения приводят к конформационным изменениям в ферменте, которые изменяют способность фермента связывать субстрат.
- ^ Лейдлер К.Дж. (1978). Физическая химия с биологическим применением . Бенджамин/Каммингс. п. 437. ISBN 978-0-8053-5680-9 .
- ^ Jump up to: а беременный в дюймовый и фон Биссвангер Х (2017). Кинетика фермента: принципы и методы (3 -е изд.). Ньюарк: Джон Уайли и сыновья, включенные. ISBN 978-3-527-80647-8 .
- ^ Marangoni AG (2003). «Обратимое ингибирование ферментов». Кинетика фермента: современный подход . Хобокен, Нью-Джерси: Wiley-Interscience. С. 61–69. ISBN 978-0-471-15985-8 .
- ^ Segel IH (1993). Кинетика фермента: поведение и анализ быстрого равновесия и стационарных ферментных систем (новое изд.). Wiley -Interscience. ISBN 978-0-471-30309-1 .
- ^ Jump up to: а беременный Уолш Р., Мартин Е., Дарвеш С. (декабрь 2011 г.). «Ограничения обычных классификаций ингибиторов». Интегративная биология . 3 (12): 1197–1201. doi : 10.1039/c1ib00053e . PMID 22038120 .
- ^ Jump up to: а беременный в Уолш Р., Мартин Е., Дарвеш С (май 2007 г.). «Универсальное уравнение для описания обратимого ингибирования ферментов и кинетики активации: моделирование бета-галактозидазы и бутирилхолинэстеразы». Biochimica et Biophysica Acta (BBA) - Общие субъекты . 1770 (5): 733–746. doi : 10.1016/j.bbagen.2007.01.001 . PMID 17307293 .
- ^ Уолш Р (май 2012 г.). «Альтернативные перспективы кинетического моделирования фермента». Лекарственная химия и дизайн лекарств. (16). Intech: 357–372.
- ^ Стрелоу Дж., Деве В., Айверсен П.В., Брукс П.Б., Радинг Дж.А., МакГи Дж. И др. (Октябрь 2012 г.). «Механизм действий анализа на ферменты» . В Markossian S, Grossman A, Brimacombe K, et al. (ред.). Руководство по анализу . Eli Lilly & Company и Национальный центр по продвижению трансляционных наук. PMID 22553872 . Архивировано из оригинала 15 июня 2022 года . Получено 9 апреля 2022 года .
- ^ Holdgate GA (июль 2001 г.). «Создание прохладных лекарств горячими: изотермическая титровая калориметрия как инструмент для изучения энергетики связывания». Биотехники . 31 (1): 164–6, 168, 170 Passim. PMID 11464510 .
- ^ Leatherbarrow RJ (декабрь 1990 г.). «Использование линейной и нелинейной регрессии в соответствии с биохимическими данными». Тенденции в биохимических науках . 15 (12): 455–458. doi : 10.1016/0968-0004 (90) 90295-м . PMID 2077683 .
- ^ Jump up to: а беременный Tseng SJ, HSU JP (август 1990 г.). «Сравнение процедур оценки параметров для модели Михаэлиса-Мюмонена». Журнал теоретической биологии . 145 (4): 457–464. BIBCODE : 1990JTHBI.145..457T . doi : 10.1016/s0022-5193 (05) 80481-3 . PMID 2246896 .
- ^ Dixon M, Webb EC, Thorne CJ, Tipton KF (1979). Ферменты (3 -е изд.). Лондон: Лонгман. п. 126. ISBN 978-0-470-20745-1 .
- ^ Радзицка А., Вольфенден Р. (1995). «Переходное состояние и аналоговые ингибиторы мультисабстрата». Кинетика фермента и механизм Часть D: разработки в динамике ферментов . Методы в фермере. Тол. 249. С. 284–312. doi : 10.1016/0076-6879 (95) 49039-6 . ISBN 9780121821500 Полем PMID 7791615 .
- ^ Schiffer CF, Burke JF, Besarab A, Lasker N, Simenhoff ML (январь 1977 г.). «Фракция клиренса амилазы/креатинина у пациентов с хроническим гемодиализом». Анналы внутренней медицины . 86 (1): 65–66. doi : 10.7326/0003-4819-86-1-65 . PMID 319722 .
- ^ Инглзе Дж., Блатчли Р.А., Бенкович С.Дж. (май 1989). «Мультисабстратный ингибитор аддукта пуринового биосинтетического фермента с константой диссоциации пикомолярной диссоциации». Журнал лекарственной химии . 32 (5): 937–940. doi : 10.1021/jm00125a002 . PMID 2709379 .
- ^ Инглзе Дж., Бенкович С.Дж. (1991). «Ингибиторы аддукта мультисабстрата глицинамидной рибонуклеотид -трансформулазы: синтетический и генерируемый фермент». Тетраэдр . 47 (14–15): 2351–2364. doi : 10.1016/s0040-4020 (01) 81773-7 .
- ^ Розварски Д.А., Грант Г.А., Студенты Д.Х., Джаббс В.Р., Сакшеттини Дж.С. (январь 1998 г.). «Модификация NADH иссониазидной цели (INHA) из Mycobacterium tuberculosis» Наука . 279 (5347): 98–1 Bibcode : 1998 Scci ... 279 ... 98r Doi : 10.1126/ science.279.5347.98 9417034PMID
- ^ Auld DS, Lovell S, Thorne N, Lea WA, Maloney DJ, Shen M, et al. (Март 2010 г.). «Молекулярная основа для связывания с высокой аффинностью и стабилизации люциферазы светлячка с помощью PTC124» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (11): 4878–4883. Bibcode : 2010pnas..107.4878a . doi : 10.1073/pnas.0909141107 . PMC 2841876 . PMID 20194791 .
- ^ Le Calvez PB, Scott CJ, Migaud Me (декабрь 2009 г.). «Ингибиторы аддукта мультисстрата: дизайн лекарств и биологические инструменты». Журнал ингибирования ферментов и лекарственной химии . 24 (6): 1291–318. doi : 10.3109/14756360902843809 . PMID 19912064 . S2CID 21808708 .
- ^ Jump up to: а беременный Avendano C, Menendez JC (июнь 2015 г.). «Глава 2.5: Ингибиторы дигидрофолатной редуктазы». Медицинская химия противоопухолевых лекарств . Elsevier. С. 54–58. ISBN 978-0-444-62667-7 .
- ^ HSU JT, Wang HC, Chen GW, Shih SR (2006). «Обнаружение антивирусного препарата, нацеленное на вирусные протеазы». Текущий фармацевтический дизайн . 12 (11): 1301–1314. doi : 10.2174/138161206776361110 . PMID 16611117 .
- ^ Agbowuro AA, Huston WM, Gamble AB, Tyndall JD (июль 2018 г.). «Протеазы и ингибиторы протеазы при инфекционных заболеваниях». Обзоры лекарственных исследований . 38 (4): 1295–1331. doi : 10.1002/med.21475 . PMID 29149530 . S2CID 25269012 .
- ^ Qiu X, Liu ZP (2011). «Недавние события пептидомиметических ингибиторов протеазы ВИЧ-1». Текущая лекарственная химия . 18 (29): 4513–37. doi : 10.2174/092986711797287566 . PMID 21864279 .
- ^ Jump up to: а беременный Schramm VL (ноябрь 2018). «Ферментативные переходные состояния и дизайн лекарств» . Химические обзоры . 118 (22): 11194–11258. doi : 10.1021/acs.chemrev.8b00369 . PMC 6615489 . PMID 30335982 .
- ^ Lew W, Chen X, Kim Cu (июнь 2000 г.). «Открытие и развитие GS 4104 (Oseltamivir): перорально активного ингибитора нейраминидазы гриппа». Текущая лекарственная химия . 7 (6): 663–672. doi : 10.2174/0929867003374886 . PMID 10702632 .
- ^ Fischer PM (октябрь 2003 г.). «Дизайн, синтез и применение стереохимических и направленных пептидных изомеров: критический обзор». Текущая белковая и пептидная наука . 4 (5): 339–356. doi : 10.2174/138920303033487054 . PMID 14529528 .
- ^ Брин Я, Солнер М.Б. (январь 2015 г.). «Маленькая молекула субстрата -фосфорилирования ингибиторов протеинкиназ: подходы и проблемы» . ACS Химическая биология . 10 (1): 175–89. doi : 10.1021/cb5008376 . PMC 4301090 . PMID 25494294 .
- ^ Bogoyevitch MA, Barr Rk, Ketterman AJ (декабрь 2005 г.). «Пептидные ингибиторы протеинкиназ-распаки, характеристики и использования». Biochimica et Biophysica Acta (BBA) - белки и протеомика . 1754 (1–2): 79–99. doi : 10.1016/j.bbapap.2005.07.025 . PMID 16182621 .
- ^ Jump up to: а беременный Патрик Г.Л. (2017). «Ферменты как лекарственные цели» . Введение в лекарственную химию (шестое изд.). Оксфорд, Великобритания: издательство Оксфордского университета. п. 95. ISBN 978-0-19-874969-1 Полем Архивировано из оригинала 28 марта 2023 года . Получено 3 июня 2022 года .
- ^ Gehringer M, Laufer SA (июнь 2019 г.). «Появляющиеся и вновь появляющиеся боеголовки для целевых ковалентных ингибиторов: применение в лекарственной химии и химической биологии». Журнал лекарственной химии . 62 (12): 5673–5724. doi : 10.1021/acs.jmedchem.8b01153 . PMID 30565923 . S2CID 56480231 .
- ^ Lundblad RL (2004). Химические реагенты для модификации белка (3 -е изд.). CRC Press. ISBN 978-0-8493-1983-9 .
- ^ Полакович М., Врабель П., Балеш В. (январь 1998 г.). «Подходы к улучшению идентификации механизмов инактивации фермента». Прогресс в биотехнологии . 15 Elsevier: 77–82. doi : 10.1016/s0921-0423 (98) 80013-0 . ISBN 978-0-444-82970-2 Полем
Инактивация фермента обычно объясняется как химический процесс, включающий несколько явлений, таких как агрегация, диссоциация в субъединицы или денатурацию (конформационные изменения), которые возникают одновременно во время инактивации специфического фермента.
- ^ Прайс Н., Хеймс Б., Риквуд Д. (1996). Белки Labfax . Bios Scientific Publishers. ISBN 978-0-12-564710-6 .
- ^ Adam GC, Cravatt BF, Sorensen EJ (январь 2001 г.). «Профилирование специфической реакционной способности протеома не направленными зондами на основе активности» . Химия и биология . 8 (1): 81–95. doi : 10.1016/s1074-5521 (00) 90060-7 . PMID 11182321 .
- ^ Maurer T, Fung HL (2000). «Сравнение методов анализа кинетических данных из инактивации на основе механизма: применение к синтазе оксида азота» . AAPS Pharmsci . 2 (1): 68–77. doi : 10.1208/ps020108 . PMC 2751003 . PMID 11741224 .
- ^ Loo Ja, Dejohn de, Du P, Stevenson Ti, Ogorzalek Loo RR (июль 1999 г.). «Применение масс -спектрометрии для идентификации и характеристики цели». Обзоры лекарственных исследований . 19 (4): 307–319. doi : 10.1002/(SICI) 1098-1128 (199907) 19: 4 <307 :: AID-MED4> 3.0.CO; 2-2 . PMID 10398927 . S2CID 11766917 .
- ^ Пурич Д.Л. (2010). «Необратимое ингибирование ферментов агентами маркировки аффинности» . Кинетика фермента: катализ и контроль: ссылка на теорию и методы наилучшей практики . Сан -Диего, Калифорния: Elsevier Academic. п. 542. ISBN 978-0-12-380925-4 Полем Архивировано из оригинала 20 июля 2022 года . Получено 20 июля 2022 года .
- ^ Sibille E, Bana E, Chaouni W, Deederich M, Bagrel D, Chaimbault P (ноябрь 2012 г.). «Разработка матричной лазерной десорбционной/ионизационной спектрометрической скринингового теста на основе обратимых и необратимых ингибиторов фосфатаз CDC25». Аналитическая биохимия . 430 (1): 83–91. doi : 10.1016/j.ab.2012.08.006 . PMID 22902804 .
- ^ Jump up to: а беременный Пулин Р., Лу Л., Акерманн Б., Бей П., Пегг А.Е. (январь 1992). «Механизм необратимой инактивации орнитин-декарбоксилазы мыши с помощью альфа-дифторметилорнитин. Характеристика последовательностей на сайтах связывания ингибитора и кофермента» . Журнал биологической химии . 267 (1): 150–158. doi : 10.1016/s0021-9258 (18) 48472-4 . PMID 1730582 .
- ^ Sheedlacsek SE, Daggleby RG (1995). «[6] Кинетика медленных и жестких связывающих ингибиторов». Кинетика медленных и жестких ингибиторов . Методы в фермере. Тол. 249. С. 144–80. doi : 10.1016/0076-6879 (95) 49034-5 . ISBN 978-0-12-182150-0 Полем PMID 7791610 .
- ^ Стоун С.Р., Моррисон Дж.Ф. (февраль 1986 г.). «Механизм ингибирования дигидрофолатных редуктаз из источников бактерий и позвоночных различными классами аналогов фолата». Biochimica et Biophysica Acta (BBA) - структура белка и молекулярная ферма . 869 (3): 275–285. doi : 10.1016/0167-4838 (86) 90067-1 . PMID 3511964 .
- ^ Pick FM, McGartoll MA, Bray RC (январь 1971 г.). «Реакция формальдегида и метанола с ксантиноксидазой» . Европейский журнал биохимии . 18 (1): 65–72. doi : 10.1111/j.1432-1033.1971.tb01215.x . PMID 4322209 .
- ^ Рирдон JE (ноябрь 1989 г.). «Взаимодействие герпес простого вируса типа 1 и ДНК-полимеразы человека с 2'-дезоксигуанозином 5'-трифосфата . Журнал биологической химии . 264 (32): 19039–19044. doi : 10.1016/s0021-9258 (19) 47263-3 . PMID 2553730 .
- ^ PDB : 1GXF ; Saravanamuthu A, Vickers TJ, Bond CS, Peterson MR, Hunter WN, Fairlamb AH (июль 2004 г.). «Два взаимодействующих сайта связывания для производных хинакринов в активном месте трипанотионерекредуктазы: шаблон для дизайна лекарственного средства» . Журнал биологической химии . 279 (28): 29493–500. doi : 10.1074/jbc.m403187200 . PMC 3491871 . PMID 15102853 .
- ^ Cohen JA, Oosterbaan RA, Berends F (1967). «[81] Соединения органофосфора» . Структура фермента . Методы в фермере. Тол. 11. С. 686–702. doi : 10.1016/s0076-6879 (67) 11085-9 . ISBN 978-0-12-181860-9 Полем Архивировано из оригинала 28 февраля 2018 года.
- ^ Бреннер Г.М. (2000). Фармакология (1 -е изд.). Филадельфия, Пенсильвания: WB Saunders. ISBN 978-0-7216-7757-6 .
- ^ Уолш КТ (1984). «Субительные субстраты, инактиваторы, основанные на механизме: последние разработки». Ежегодный обзор биохимии . 53 : 493–535. doi : 10.1146/annurev.bi.53.070184.002425 . PMID 6433782 .
- ^ Saravanamuthu A, Vickers TJ, Bond CS, Peterson MR, Hunter WN, Fairlamb AH (июль 2004 г.). «Два взаимодействующих сайта связывания для производных хинакринов в активном месте трипанотионерекредуктазы: шаблон для дизайна лекарств» . Журнал биологической химии . 279 (28): 29493–29500. doi : 10.1074/jbc.m403187200 . PMC 3491871 . PMID 15102853 .
- ^ Pereira DM, Andrade C, Valentão P, Andrade PB (октябрь 2017 г.). «Натуральные продукты как ингибиторы фермента». (PDF) . Натуральные продукты, нацеленные на клинически значимые ферменты (первое изд.). Wiley-VCH Verlag GmbH & Co. KGAA. ISBN 978-3-527-34205-1 Полем Архивировано (PDF) из оригинала 5 декабря 2022 года . Получено 3 апреля 2022 года .
- ^ Хиратаке Дж. (2005). «Ингибиторы ферментов как химические инструменты для изучения ферментного катализа: рациональный дизайн, синтез и применение». Химическая запись . 5 (4). Нью -Йорк, Нью -Йорк: 209–28. doi : 10.1002/tcr.20045 . PMID 16041744 .
- ^ Страница C, Питчфорд S (2021). «Яды, токсины, яды и травы» . Фармакология Дейла конденсированная электронная книга (третье изд.). Филадельфия, Пенсильвания: Elsevier Health Sciences. С. 153–155. ISBN 978-0-7020-7819-4 Полем Архивировано из оригинала 25 апреля 2013 года . Получено 3 июня 2022 года .
- ^ Стенерсен Дж. (2004). «Глава 5: специфические ингибиторы фермента» . Химические пестициды Режим действия и токсикология . Boca Raton: CRC Press. С. 73–114. ISBN 978-0-203-64683-0 Полем Архивировано из оригинала 28 марта 2023 года . Получено 14 апреля 2022 года .
- ^ Greathouse B, Zahra F, Brady MF (сентябрь 2021 г.). «Ингибиторы ацетилхолинэстеразы токсичности» . Statpearls [Интернет] . Остров сокровищ (Флорида): Statpearls Publishing. PMID 30571049 . Архивировано из оригинала 17 января 2023 года . Получено 14 апреля 2022 года .
- ^ Orencio-Trejo M, Utrilla J, Fernández-Sandoval MT, Huerta-Baristain G, Gosset G, Martinez A (2010). «Инженерная метаболизм Escherichia coli» . В Cordes M, Wittmann C, Krull R (Eds.). Biosystems Engineering II: Связывание клеточных сетей и биопроцессов . Берлин: Springer Science & Business Media. С. 77–78. ISBN 978-3-642-13865-2 .
- ^ Окар Д.А., Ланге А.Дж. (1999). «Фруктоза-2,6-бисфосфат и контроль углевода метаболизма у эукариот». Биофофакторы . 10 (1): 1–14. doi : 10.1002/biof.5520100101 . PMID 10475585 . S2CID 24586866 .
- ^ Прайс Н.К., Стивенс Л. (1999). Основы фермеры: клеточная и молекулярная биология каталитических белков (3 -е изд.). Издательство Оксфордского университета. ISBN 978-0-19-850229-6 .
- ^ Smyth TP (август 2004 г.). «Варианты субстрата в сравнении с аналогами переходного состояния как нековалентные обратимые ингибиторы фермента» . Биоорганическая и лекарственная химия . 12 (15): 4081–4088. doi : 10.1016/j.bmc.2004.05.041 . PMID 15246086 . Архивировано из оригинала 28 марта 2023 года . Получено 14 апреля 2022 года .
- ^ Хартли RW (ноябрь 1989). «Barnase и Barstar: два маленьких белка, чтобы сложить и сочетаться». Тенденции в биохимических науках . 14 (11): 450–454. doi : 10.1016/0968-0004 (89) 90104-7 . PMID 2696173 .
- ^ Махешвари В.Л. (2022). Натуральные продукты как ингибиторы ферментов . Сингапур: Спрингер. ISBN 978-981-19-0932-0 .
- ^ Бирк Y (2003). Ингибиторы протеазы растений: значимость в питании, защите растений, профилактике рака и генетической инженерии . Берлин: Спрингер. ISBN 978-3-540-00118-8 .
- ^ Tan G, Gyllenhaal C, Soejarto DD (март 2006 г.). «Биоразнообразие как источник противоопухолевых лекарств». Современные цели наркотиков . 7 (3): 265–277. doi : 10.2174/138945006776054942 . PMID 16515527 .
- ^ Abal M, Andreu JM, Barasoain I (июнь 2003 г.). «Таксаны: микротрубочки и центросома, и клеточный цикл, зависящие от механизмов действия». Современные раковые препараты . 3 (3): 193–203. doi : 10.2174/1568009033481967 . PMID 12769688 .
- ^ Хостеттманн К., Борлоз А., Урбейн А., Марстон А. (2006). «Ингибиторы натурального продукта ацетилхолинэстеразы». Текущая органическая химия . 10 (8): 825–847. doi : 10.2174/138527206776894410 .
- ^ Knight R, Khondoker M, Magill N, Stewart R, Landau S (2018). «Систематический обзор и мета-анализ эффективности ингибиторов ацетилхолинэстеразы и мемантина при лечении когнитивных симптомов деменции» . Деменция и гериатрические когнитивные расстройства . 45 (3–4): 131–151. doi : 10.1159/000486546 . PMID 29734182 . S2CID 13701908 .
- ^ Defrartes LJ, Hoehns JD, Sakornbut EL, Glascock DG, Tew AR (январь 2005 г.). «Антимускариновая интоксикация в результате проглатывания семян лунного цвета». Анналы фармакотерапии . 39 (1): 173–176. doi : 10.1345/aph.1d536 . PMID 15572604 . S2CID 36465515 .
- ^ Веттер Дж (январь 1998 г.). «Токсины фаллоидов аманитов» Токсичный 36 (1): 13–24. Bibcode : 1998txcn ... 13V два 10.1016/S0041-0101(97)00074-3: 9604278PMID
- ^ Holmes CF, Maynes JT, Perreault KR, Dawson JF, James MN (ноябрь 2002 г.). «Молекулярная фермерская ферма, лежащая в основе регуляции белковой фосфатазы-1 природными токсинами». Текущая лекарственная химия . 9 (22): 1981–1989. doi : 10.2174/0929867023368827 . PMID 12369866 .
- ^ Бишофф К (октябрь 2001 г.). «Токсикология микроцистина-LR: возникновение, токсикокинетика, токсикодинамика, диагностика и лечение». Ветеринарная и человеческая токсикология . 43 (5): 294–297. PMID 11577938 .
- ^ Savage GP, Morrison SC (2003). «Ингибиторы трипсина». В Caballero B (ред.). Энциклопедия пищевых наук и питания (второе изд.). Академическая пресса. С. 5878–5884. doi : 10.1016/b0-12-227055-x/00934-2 . ISBN 978-0-12-227055-0 .
- ^ Полито Л., Бортолотти М., Баттелли М.Г., Калафато Г., Болоннесси А (июнь 2019 г.). «Рицин: древняя история для вечного токсина растения» . Токсины . 11 (6): 324. doi : 10.3390/toxins11060324 . PMC 6628454 . PMID 31174319 .
- ^ Sowa-Rogozińska N, Sominka H, Nowakowska-Gołcka J, Sandvig K, Slomińska-Wojewódzka M (июнь 2019 г.). «Внутрицеллура транспорт и цитотоксичность белкового токсина» . Токсины . 11 (6): 350. doi : 10.3390/toxins11060350 . PMC 6628406 . PMID 31216687 .
- ^ Хартли М.Р., Лорд Дж. М. (сентябрь 2004 г.). «Цитотоксические рибосомы инактивирующие лектины из растений». Biochimica et Biophysica Acta (BBA) - белки и протеомика . 1701 (1–2): 1–14. doi : 10.1016/j.bbapap.2004.06.004 . PMID 15450171 .
- ^ Jump up to: а беременный Finkel R, Cubeddu LX, Clark MA (2009). «Глава 41: Противоинфимационные препараты» . Фармакология (4 -е изд.). Филадельфия: Липпинкотт Уильямс и Уилкинс. С. 499–518 (502). ISBN 978-0-7817-7155-9 Полем Архивировано из оригинала 28 марта 2023 года . Получено 14 апреля 2022 года .
- ^ Jump up to: а беременный Сантос Р., Урсу О., Голтон А., Бенто А.П., Донади Р.С., Болоня К.Г. и др. (Январь 2017). «Комплексная карта молекулярных лекарственных целей» . Природные обзоры. Открытие наркотиков . 16 (1): 19–34 (рис. 1C). doi : 10.1038/nrd.2016.230 . PMC 6314433 . PMID 27910877 .
Figure 1C: Clinical success of privileged protein family classes (% approved drugs targeting each target class): Reductase 7.62, Kinase 5.94, Protease 3.35, Hydrolase 2.76, NPTase 2.09, Transferase 1.92, Lyase 1.59, Isomerase 1.51, Phosphodiesterase 1.50, Cytochrome p450 0.84 , Эпигенетический ластик 0,33, общие ферментные мишени одобренных лекарств = 29,45%
- ^ Каннайян Р., Махадеван Д. (декабрь 2018 г.). «Комплексный обзор ингибиторов протеинкиназы для терапии рака» . Экспертный обзор противоопухолевой терапии . 18 (12): 1249–1270. doi : 10.1080/14737140.2018.1527688 . PMC 6322661 . PMID 30259761 .
- ^ McLornan DP, Pope JE, Gotlib J, Harrison CN (август 2021 г.). «Текущий и будущий статус ингибиторов JAK». Лансет . 398 (10302): 803–816. doi : 10.1016/s0140-6736 (21) 00438-4 . PMID 34454676 . S2CID 237311419 .
- ^ McGuire JJ (2003). «Противоопухолевые антиполаты: текущий статус и будущие направления». Текущий фармацевтический дизайн . 9 (31): 2593–2613. doi : 10.2174/1381612033453712 . PMID 14529544 .
- ^ Гольдштейн I, Бернетт А.Л., Розен Р.К., Парк П.В., Стехер В.Дж. (январь 2019). «Случайная история силденафила: неожиданная пероральная терапия для эректильной дисфункции». Отзывы о сексуальной медицине . 7 (1): 115–128. doi : 10.1016/j.sxmr.2018.06.005 . PMID 30301707 . S2CID 52945888 .
- ^ Maggi M, Philippi S, Rabbit F, Magini A, Forti G (август 2000 г.). «Эректильная дисфункция: от биохимической фармакологии до достижений в области медикаментозной терапии » Европейский журнал эндокринологии 143 (2): 143–1 Doi : 10.1530/ eje.0.1 10913932PMID
- ^ Кокрейн С.А., Лоханс КТ (май 2020). «Разбивая клеточную стенку: стратегии антибиотикового открытия, нацеленного на бактериальные транспептидазы» . Европейский журнал по лекарственной химии . 194 : 112262. DOI : 10.1016/j.ejmech.2020.112262 . PMID 32248005 . S2CID 214809706 . Архивировано из оригинала 28 марта 2023 года . Получено 20 июля 2022 года .
- ^ Buynak JD (сентябрь 2007 г.). «Резка и сшивание: сшивание пептидогликана в сборке бактериальной клеточной стенки». ACS Химическая биология . 2 (9): 602–5. doi : 10.1021/cb700182u . PMID 17894443 .
- ^ Далхофф А (февраль 2021 г.). «Селективная токсичность антибактериальных агентов-сил-действительную концепцию или мы упускаем шансы и игнорируем риски?» Полем Инфекция . 49 (1): 29–56. doi : 10.1007/s15010-020-01536-y . PMC 7851017 . PMID 33367978 .
- ^ Мобли Х (13 марта 2006 г.). «Как антибиотики убивают бактериальные клетки, но не клетки человека?» Полем Scientific American . 294 (6): 98. PMID 16711368 . Архивировано из оригинала 9 апреля 2022 года . Получено 9 апреля 2022 года .
- ^ Zhang L, He J, Bai L, Ruan S, Yang T, Luo Y (июль 2021 г.). «Рибосома, нацеленные на антибактериальные агенты: достижения, проблемы и возможности». Обзоры лекарственных исследований . 41 (4): 1855–1889. doi : 10.1002/med.21780 . PMID 33501747 . S2CID 231761270 .
- ^ Yao J, Rock Co (ноябрь 2017 г.). «Метаболизм бактериальных жирных кислот при современном антибиотическом открытии» . Biochimica et Biophysica Acta (BBA) - Молекулярная и клеточная биология липидов . 1862 (11): 1300–1309. doi : 10.1016/j.bbalip.2016.09.014 . PMC 5364071 . PMID 27668701 .
- ^ Li G, Jing X, Pan, Zhang P, de Clercq E (2021). «Антивирусная классификация». В Бэмфорде Д., Цукерман М.А. (ред.). Энциклопедия вирусологии . Тол. 5 (4 -е изд.). Амстердам: академическая пресса. С. 129–130. doi : 10.1016/b978-0-12-814515-9.00126-0 . ISBN 978-0-12-814516-6 Полем OCLC 1240584737 .
- ^ Вошавар С. (2019). «Ингибиторы протеазы для лечения ВИЧ/СПИДа: последние достижения и будущие проблемы». Текущие темы в лекарственной химии . 19 (18): 1571–1598. doi : 10.2174/1568026619666190619115243 . PMID 31237209 . S2CID 195356119 .
- ^ De Leuw P, Stephan C (апрель 2018 г.). «Терапия ингибиторами протеазы при инфекции вируса гепатита С». Экспертное мнение о фармакотерапии . 19 (6): 577–587. doi : 10.1080/14656566.2018.1454428 . PMID 29595065 . S2CID 4489039 .
- ^ G, Wang Y, от Clercq E. «Утвержденный ВИЧ является измененным транскрибингом ингибиторов . Фармацевтические минуты SICICA B 12 (4): 1567–1590. два 10.1016/j.apsb.2021.11.009: 9279714PMC 35847492PMID
- ^ Губарева Л., Мохан Т (январь 2022 г.). «Антивирус, нацеленные на нейрораминидазу» . Перспективы Cold Spring Harbor в медицине . 12 (1): A038455. doi : 10.1101/cshperspect.a038455 . PMC 8725622 . PMID 32152244 . S2CID 212651676 .
- ^ Джентри Б.Г., Богнер Э, Драч Дж.С. (январь 2019 г.). «Нацеливание на терминазу: важный шаг вперед в лечении и профилактике инфекций цитомегаловируса человека». Антивирусные исследования . 161 : 116–124. doi : 10.1016/j.antiviral.2018.11.005 . PMID 30472161 . S2CID 53763831 .
- ^ Kuhr RJ, Dorough HW (1976). Инсектициды карбамата: химия, биохимия и токсикология . Кливленд: CRC Press. ISBN 978-0-87819-052-2 .
- ^ Камень TW (октябрь 2020 г.). CNS Нейротрансмиттеры и нейромодуляторы: ацетилхолин (1 -е изд.). Boca Raton: CRC Press. ISBN 978-1-00-009898-3 .
- ^ Гупта Р.К. (2006). «Классификация и использование органофосфатов и карбаматов» . В Gupta RC (ред.). Токсикология органических и карбаматных соединений . Амстердам: Elsevier Academic Press. С. 5–24. ISBN 978-0-08-054310-9 Полем Архивировано из оригинала 21 июля 2022 года . Получено 21 июля 2022 года .
- ^ Farmakidis C, Pasnoor M, Dimachkie MM, Barohn RJ (май 2018). «Лечение миастении Гэджис» . Неврологические клиники . 36 (2): 311–337. doi : 10.1016/j.ncl.2018.01.011 . PMC 6690491 . PMID 29655452 .
- ^ Butterworth JF, IV, Mackey DC, Wasnick JD, Eds. (2013). «Глава 12. Ингибиторы холинэстеразы и другие фармакологические антагонисты к нервно -мышечным блокирующим агентам». Клиническая анестезиология Morgan & Mikhail (5 -е изд.). МакГроу Хилл. Архивировано из оригинала 30 июня 2022 года . Получено 9 апреля 2022 года .
- ^ Thapa S, Lv M, Xu H (2017). «Ацетилхолинэстераза: первичная мишень для лекарств и инсектицидов». Мини -обзоры по лекарственной химии . 17 (17): 1665–1676. doi : 10.2174/1389557517666170120153930 . PMID 28117022 .
- ^ Tan S, Evans R, Singh B (март 2006 г.). «Гербицидные ингибиторы биосинтеза аминокислот и урожая, устойчивых к гербицидам». Аминокислоты . 30 (2): 195–204. doi : 10.1007/s00726-005-0254-1 . PMID 16547651 . S2CID 2358278 .
- ^ Хирай К, Учида А., Оно Р. (2012). «Основные синтетические маршруты для современных классов гербицидов и агрохимических характеристик» . В Böger P, Wakabayashi K, Hirai K (Eds.). Гербицидные занятия в разработке . Springer Science & Business Media. С. 179–195. doi : 10.1007/978-3-642-59416-8_10 . ISBN 978-3-642-59416-8 Полем Архивировано из оригинала 27 июня 2022 года . Получено 27 июня 2022 года .
Глава 10.2.1: ингибиторы ацетолактат -сальфонилуреа ацетолактат
- ^ Герцог SO (июль 1990 г.). «Обзор гербицидных механизмов действия» . Перспективы здоровья окружающей среды . 87 : 263–271. doi : 10.2307/3431034 . JSTOR 3431034 . PMC 1567841 . PMID 1980104 .
- ^ Гангули А.К., Аллури С.С. (12 сентября 2021 г.). «Глава 2: Ингибиторы фермента». Медицинская химия: посмотрите, как обнаруживаются лекарства . Бока Ратон, Флорида: CRC Press. С. 29–68. ISBN 978-1-00-043721-8 .
- ^ Руфер А.С. (апрель 2021 г.). «Открытие наркотиков для ферментов» . Drug Discovery сегодня . 26 (4): 875–886. doi : 10.1016/j.drudis.2021.01.006 . PMID 33454380 . S2CID 231633284 .
- ^ Линдквист Р.Н. (октябрь 2013 г.). «Дизайн ингибиторов фермента: аналоги переходного состояния». В Ariëns EJ (ed.). Дизайн лекарственного средства: лекарственная химия: серия монографий . Тол. 5. Elsevier. С. 24–80.
- ^ Scapin G (2006). «Структурная биология и открытие лекарств». Текущий фармацевтический дизайн . 12 (17): 2087–2097. doi : 10.2174/138161206777585201 . PMID 16796557 .
- ^ Gohlke H, Klebe G (август 2002 г.). «Подходы к описанию и прогнозированию аффинности связывания лигандов из малых молекул с макромолекулярными рецепторами». Angewandte Chemie . 41 (15): 2644–2676. doi : 10.1002/1521-3773 (20020802) 41:15 <2644 :: Aid-Anie2644> 3.0.co; 2-O . PMID 12203463 .
- ^ Коппиц М., Эйс К (июнь 2006 г.). «Автоматизированная лекарственная химия». Drug Discovery сегодня . 11 (11–12): 561–568. doi : 10.1016/j.drudis.2006.04.005 . PMID 16713909 .
- ^ Ciulli A, Abell C (декабрь 2007 г.). «Подходы на основе фрагментов к ингибированию ферментов» . Текущее мнение о биотехнологии . 18 (6): 489–96. doi : 10.1016/j.copbio.2007.09.003 . PMC 4441723 . PMID 17959370 .
- ^ Satz AL, Kuai L, Peng X (май 2021 г.). «Выборы и скрининги кодируемых ДНК химических библиотек против ферментов и клеточных мишеней» . Биоорганические и лекарственные химические письма . 39 : 127851. DOI : 10.1016/j.bmcl.2021.127851 . PMID 33631371 . S2CID 232059044 .
- ^ Perez O, Pena J, Fernandez-Vega V, Scampavia L, Spicer T (2019). «Глава 4: высокая пропускная способность». Открытие наркотиков и развитие . Бока Ратон, Флорида: CRC Press. С. 47–69. ISBN 978-1-315-11347-0 .
- ^ Скарпино А., Ференси Г.Г., Кесер Г.М. (2020). «Ковалентная стыковка при обнаружении наркотиков: объем и ограничения». Текущий фармацевтический дизайн . 26 (44): 5684–5699. doi : 10.2174/1381612824999201105164942 . PMID 33155894 . S2CID 226271153 .
- ^ Elsässer B, Goettig P (март 2021 г.). «Механизмы протеолитических ферментов и их ингибирование в исследованиях QM/MM» . Международный журнал молекулярных наук . 22 (6): 3232. DOI : 10.3390/IJMS22063232 . PMC 8004986 . PMID 33810118 .
Внешние ссылки
[ редактировать ]- "Бренда" . Архивировано из оригинала 1 апреля 2022 года. База данных ферментов, предоставляющих списки известных ингибиторов для каждой записи
- «Pubchem» . Национальный центр информации о биотехнологии . Национальная библиотека медицины. База данных лекарств и ингибиторов ферментов
- «Символизм и терминология в кинетике фермента» . Архивировано из оригинала 20 июня 2006 года. Рекомендации Комитета по номенклатуре Международного союза биохимии (NC-IUB) по терминологии ингибирования ферментов
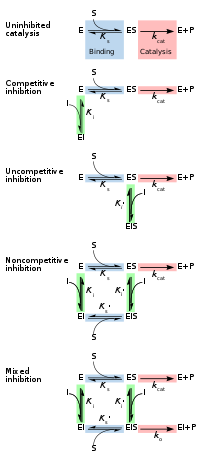
![{\ displayStyle {\ begin {Aligned} {\ cfrac {v _ {\ max}} {1+{\ cfrac {\ ce {[i]}} {k_ {i}}}} & = {v _ {\ max }} \ left ({\ cfrac {k_ {i}} {k_ {i}+[{\ ce {i}}]}} \ right) && {\ tex }} {K_ {i}}} = 1 \\ & = {v _ {\ max}} \ Leal / ] = 0 {\ text {to numerator}} \\ & = {v _ {\ max}} \ left (1-{\ cfrac {[{\ ce {i}}]} {k_ {i}+[{\ ce {i}}]}} \ right) && {\ text {aymorify}} {\ cfrac {k_ {i}+[{\ ce {i}}]} {k_ {i}+[{\ ce {i }}]}} = 1 \\ & = v _ {\ max} -v _ {\ max} {\ cfrac {\ ce {[i]}} {k_ {i}+[{\ ce {i}}]}}}}}}}}}}}}}}}}}}} } && {\ text {Multiply Out by}} v _ {\ max} \ end {Aligned}}}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/37eda4dec307f8acfca89b2d8f4811474ea764ec)
![{\ displayStyle {\ cfrac {\ wome {s]}} {[{\ что {s}]+k_ {m}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb08dd139085a394e6e7370f47ebfa255f1ad685)
![{\ displayStyle {\ cfrac {\ wome {[i]}} {[{\ wome {i}}]+k_ {i}}}}}}}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9ed50a1f7a5f2c52f406b52263916ab48b268e07)
![{\displaystyle V_{\max }-\Delta V_{\max }{\cfrac {\ce {[I]}}{[{\ce {I}}]+K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7dff424ec79284c3a1cea14f0f82b0eaace53c69)
![{\displaystyle V_{\max 1}-(V_{\max 1}-V_{\max 2}){\cfrac {\ce {[I]}}{[{\ce {I}}]+K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f3874623edd9524ba2741fe448927bf5cf0ab257)
![{\ displaysyle v _ _ {\ max 1} -(v _ {\ max 1} -v _ {\ max 2}) {\ cfrac {\ ce {[x]} {{\ ce {x}}]] +k_ {{{{{{{{{{x}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/306d44733a89308883053e3b8372a8cf9ce0239b)
![{\ DisplayStyle K_ {M1}-(k_ {m1} -K_ {m2}) {\ cfrac {\ ce {[x]}} {[{\ ce {x}}]+k_ {x}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb4e0de216e1e625bb803ee725bf85c9989a15f5)
![{\displaystyle V={\frac {V_{max}[S]}{\alpha K_{m}+\alpha ^{\prime }[S]}}={\frac {(1/\alpha ^{\prime })V_{max}[S]}{(\alpha /\alpha ^{\prime })K_{m}+[S]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a8f0a9dda1d308de7f090f99c2833f944f11a09)
![{\ displaystyle \ alpha = 1+{\ frac {[i]} {k_ {i}}}}}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/57fcf54938a9784f9313437681b220079ff43ee5)
![{\ displaystyle \ alpha ^{\ prime} = 1+{\ frac {[i]} {k_ {i} ^{\ prime}}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/65bf16742482cae7b0743781f47c327ddcf537e3)