Радон
| Радон | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | / ˈreɪdɒn eɪdɒn/ | ||||||||||||||||||||||||||||||||
| Появление | бесцветный газ | ||||||||||||||||||||||||||||||||
| Массовое число | [222] | ||||||||||||||||||||||||||||||||
| Радон в таблице Менделеева | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Атомный номер ( Z ) | 86 | ||||||||||||||||||||||||||||||||
| Группа | группа 18 (благородные газы) | ||||||||||||||||||||||||||||||||
| Период | период 6 | ||||||||||||||||||||||||||||||||
| Блокировать | p-блок | ||||||||||||||||||||||||||||||||
| Электронная конфигурация | [ Автомобиль ] 4f 14 5д 10 6 с 2 6р 6 | ||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 32, 18, 8 | ||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||
| Phase at STP | gas | ||||||||||||||||||||||||||||||||
| Melting point | 202 K (−71 °C, −96 °F) | ||||||||||||||||||||||||||||||||
| Boiling point | 211.5 K (−61.7 °C, −79.1 °F) | ||||||||||||||||||||||||||||||||
| Density (at STP) | 9.73 g/L | ||||||||||||||||||||||||||||||||
| when liquid (at b.p.) | 4.4 g/cm3 | ||||||||||||||||||||||||||||||||
| Critical point | 377 K, 6.28 MPa[1] | ||||||||||||||||||||||||||||||||
| Heat of fusion | 3.247 kJ/mol | ||||||||||||||||||||||||||||||||
| Heat of vaporization | 18.10 kJ/mol | ||||||||||||||||||||||||||||||||
| Molar heat capacity | 5R/2 = 20.786 J/(mol·K) | ||||||||||||||||||||||||||||||||
Vapor pressure
| |||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||
| Oxidation states | 0, +2, +6 | ||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 2.2 | ||||||||||||||||||||||||||||||||
| Ionization energies |
| ||||||||||||||||||||||||||||||||
| Covalent radius | 150 pm | ||||||||||||||||||||||||||||||||
| Van der Waals radius | 220 pm | ||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||
| Natural occurrence | from decay | ||||||||||||||||||||||||||||||||
| Crystal structure | face-centered cubic (fcc) (predicted) | ||||||||||||||||||||||||||||||||
| Thermal conductivity | 3.61×10−3 W/(m⋅K) | ||||||||||||||||||||||||||||||||
| Magnetic ordering | non-magnetic | ||||||||||||||||||||||||||||||||
| CAS Number | 10043-92-2 | ||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||
| Discovery | Ernest Rutherford and Robert B. Owens (1899) | ||||||||||||||||||||||||||||||||
| First isolation | William Ramsay and Robert Whytlaw-Gray (1910) | ||||||||||||||||||||||||||||||||
| Isotopes of radon | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
Радон — химический элемент ; он имеет символ Rn и атомный номер 86. Это радиоактивный благородный газ , бесцветный и не имеющий запаха. Из трех встречающихся в природе изотопов радона только радон-222 имеет достаточно длительный период полураспада (3,825 дня), чтобы его можно было высвободить из почвы и горных пород, где он образуется. Изотопы радона являются непосредственными продуктами распада радия изотопов . Нестабильность радона-222, его наиболее стабильного изотопа, делает радон одним из самых редких элементов. Радон будет присутствовать на Земле еще несколько миллиардов лет, несмотря на его короткий период полураспада, поскольку он постоянно образуется на ступенях цепочки распада урана-238 и тория -232 , каждый из которых является чрезвычайно опасным. Обильный радиоактивный нуклид с периодом полураспада в несколько миллиардов лет. Распад радона приводит к образованию многих других короткоживущих нуклидов , известных как «дочери радона», заканчивающихся стабильными изотопами свинца . [3] Радон-222 встречается в значительных количествах как один из этапов нормальной цепи радиоактивного распада урана-238, также известного как урановый ряд , который медленно распадается на различные радиоактивные нуклиды и в конечном итоге распадается на свинец-206 , который стабилен. Радон-220 встречается в незначительных количествах как промежуточный этап в цепочке распада тория-232, также известного как ряд тория , который в конечном итоге распадается на свинец-208 стабильный .
Under standard conditions, radon is gaseous and can be easily inhaled, posing a health hazard. However, the primary danger comes not from radon itself, but from its decay products, known as radon daughters. These decay products, often existing as single atoms or ions, can attach themselves to airborne dust particles. Although radon is a noble gas and does not adhere to lung tissue, meaning it is often exhaled before decaying, the radon daughters attached to dust are more likely to stick to the lungs. This increases the risk of harm, as the radon daughters can cause damage to lung tissue.[4] Radon and its daughters are, taken together, often the single largest contributor to an individual's background radiation dose, but due to local differences in geology,[5] the level of exposure to radon gas differs from place to place. A common source is uranium-containing minerals in the ground, and therefore it accumulates in subterranean areas such as basements. Radon can also occur in some ground water like spring waters and hot springs.[6] Radon trapped in permafrost may be released by climate change induced thawing of permafrosts.[7] It is possible to test for radon in buildings, and to use techniques such as sub-slab depressurization for mitigation.[8][9]
Epidemiological studies have shown a clear link between breathing high concentrations of radon and incidence of lung cancer. Radon is a contaminant that affects indoor air quality worldwide. According to the United States Environmental Protection Agency (EPA), radon is the second most frequent cause of lung cancer, after cigarette smoking, causing 21,000 lung cancer deaths per year in the United States. About 2,900 of these deaths occur among people who have never smoked. While radon is the second most frequent cause of lung cancer, it is the number one cause among non-smokers, according to EPA policy-oriented estimates.[10] Significant uncertainties exist for the health effects of low-dose exposures.[11]
Characteristics
[edit]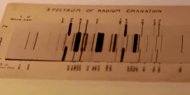
Physical properties
[edit]Radon is a colorless, odorless, and tasteless[12] gas and therefore is not detectable by human senses alone. At standard temperature and pressure, it forms a monatomic gas with a density of 9.73 kg/m3, about 8 times the density of the Earth's atmosphere at sea level, 1.217 kg/m3.[13] It is one of the densest gases at room temperature (a few are denser, e.g. CF3(CF2)2CF3 and WF6) and is the densest of the noble gases. Although colorless at standard temperature and pressure, when cooled below its freezing point of 202 K (−71 °C; −96 °F), it emits a brilliant radioluminescence that turns from yellow to orange-red as the temperature lowers.[14] Upon condensation, it glows because of the intense radiation it produces.[15] It is sparingly soluble in water, but more soluble than lighter noble gases. It is appreciably more soluble in organic liquids than in water. Its solubility equation is as follows,[16][17][18]
where is the molar fraction of radon, is the absolute temperature, and and are solvent constants.
Chemical properties
[edit]Radon is a member of the zero-valence elements that are called noble gases, and is chemically not very reactive. The 3.8-day half-life of radon-222 makes it useful in physical sciences as a natural tracer. Because radon is a gas at standard conditions, unlike its decay-chain parents, it can readily be extracted from them for research.[19]
It is inert to most common chemical reactions, such as combustion, because the outer valence shell contains eight electrons. This produces a stable, minimum energy configuration in which the outer electrons are tightly bound.[20] Its first ionization energy—the minimum energy required to extract one electron from it—is 1037 kJ/mol.[21] In accordance with periodic trends, radon has a lower electronegativity than the element one period before it, xenon, and is therefore more reactive. Early studies concluded that the stability of radon hydrate should be of the same order as that of the hydrates of chlorine (Cl
2) or sulfur dioxide (SO
2), and significantly higher than the stability of the hydrate of hydrogen sulfide (H
2S).[22]
Because of its cost and radioactivity, experimental chemical research is seldom performed with radon, and as a result there are very few reported compounds of radon, all either fluorides or oxides. Radon can be oxidized by powerful oxidizing agents such as fluorine, thus forming radon difluoride (RnF
2).[23][24] It decomposes back to its elements at a temperature of above 523 K (250 °C; 482 °F), and is reduced by water to radon gas and hydrogen fluoride: it may also be reduced back to its elements by hydrogen gas.[25] It has a low volatility and was thought to be RnF
2. Because of the short half-life of radon and the radioactivity of its compounds, it has not been possible to study the compound in any detail. Theoretical studies on this molecule predict that it should have a Rn–F bond distance of 2.08 ångströms (Å), and that the compound is thermodynamically more stable and less volatile than its lighter counterpart xenon difluoride (XeF
2).[26] The octahedral molecule RnF
6 was predicted to have an even lower enthalpy of formation than the difluoride.[27] The [RnF]+ ion is believed to form by the following reaction:[28]
- Rn (g) + 2 [O
2]+
[SbF
6]−
(s) → [RnF]+
[Sb
2F
11]−
(s) + 2 O
2 (g)
For this reason, antimony pentafluoride together with chlorine trifluoride and N
2F
2Sb
2F
11 have been considered for radon gas removal in uranium mines due to the formation of radon–fluorine compounds.[19] Radon compounds can be formed by the decay of radium in radium halides, a reaction that has been used to reduce the amount of radon that escapes from targets during irradiation.[25] Additionally, salts of the [RnF]+ cation with the anions SbF−
6, TaF−
6, and BiF−
6 are known.[25] Radon is also oxidised by dioxygen difluoride to RnF
2 at 173 K (−100 °C; −148 °F).[25]
Radon oxides are among the few other reported compounds of radon;[29] only the trioxide (RnO
3) has been confirmed.[30] The higher fluorides RnF
4 and RnF
6 have been claimed[30] and are calculated to be stable,[31] but their identification is unclear.[30] They may have been observed in experiments where unknown radon-containing products distilled together with xenon hexafluoride: these may have been RnF
4, RnF
6, or both.[25] Trace-scale heating of radon with xenon, fluorine, bromine pentafluoride, and either sodium fluoride or nickel fluoride was claimed to produce a higher fluoride as well which hydrolysed to form RnO
3. While it has been suggested that these claims were really due to radon precipitating out as the solid complex [RnF]+
2[NiF6]2−, the fact that radon coprecipitates from aqueous solution with CsXeO
3F has been taken as confirmation that RnO
3 was formed, which has been supported by further studies of the hydrolysed solution. That [RnO3F]− did not form in other experiments may have been due to the high concentration of fluoride used. Electromigration studies also suggest the presence of cationic [HRnO3]+ and anionic [HRnO4]− forms of radon in weakly acidic aqueous solution (pH > 5), the procedure having previously been validated by examination of the homologous xenon trioxide.[30]
The decay technique has also been used. Avrorin et al. reported in 1982 that 212Fr compounds cocrystallised with their caesium analogues appeared to retain chemically bound radon after electron capture; analogies with xenon suggested the formation of RnO3, but this could not be confirmed.[32]
It is likely that the difficulty in identifying higher fluorides of radon stems from radon being kinetically hindered from being oxidised beyond the divalent state because of the strong ionicity of radon difluoride (RnF
2) and the high positive charge on radon in RnF+; spatial separation of RnF
2 molecules may be necessary to clearly identify higher fluorides of radon, of which RnF
4 is expected to be more stable than RnF
6 due to spin–orbit splitting of the 6p shell of radon (RnIV would have a closed-shell 6s2
6p2
1/2 configuration). Therefore, while RnF
4 should have a similar stability to xenon tetrafluoride (XeF
4), RnF
6 would likely be much less stable than xenon hexafluoride (XeF
6): radon hexafluoride would also probably be a regular octahedral molecule, unlike the distorted octahedral structure of XeF
6, because of the inert pair effect.[33][34] Because radon is quite electropositive for a noble gas, it is possible that radon fluorides actually take on highly fluorine-bridged structures and are not volatile.[34] Extrapolation down the noble gas group would suggest also the possible existence of RnO, RnO2, and RnOF4, as well as the first chemically stable noble gas chlorides RnCl2 and RnCl4, but none of these have yet been found.[25]
Radon carbonyl (RnCO) has been predicted to be stable and to have a linear molecular geometry.[35] The molecules Rn
2 and RnXe were found to be significantly stabilized by spin-orbit coupling.[36] Radon caged inside a fullerene has been proposed as a drug for tumors.[37][38] Despite the existence of Xe(VIII), no Rn(VIII) compounds have been claimed to exist; RnF
8 should be highly unstable chemically (XeF8 is thermodynamically unstable). It is predicted that the most stable Rn(VIII) compound would be barium perradonate (Ba2RnO6), analogous to barium perxenate.[31] The instability of Rn(VIII) is due to the relativistic stabilization of the 6s shell, also known as the inert pair effect.[31]
Radon reacts with the liquid halogen fluorides ClF, ClF
3, ClF
5, BrF
3, BrF
5, and IF
7 to form RnF
2. In halogen fluoride solution, radon is nonvolatile and exists as the RnF+ and Rn2+ cations; addition of fluoride anions results in the formation of the complexes RnF−
3 and RnF2−
4, paralleling the chemistry of beryllium(II) and aluminium(III).[25] The standard electrode potential of the Rn2+/Rn couple has been estimated as +2.0 V,[39] although there is no evidence for the formation of stable radon ions or compounds in aqueous solution.[25]
Isotopes
[edit]Radon has no stable isotopes. Thirty-nine radioactive isotopes have been characterized, with mass numbers ranging from 193 to 231.[40][41] Six of them, from 217 to 222 inclusive, occur naturally. The most stable isotope is 222Rn (half-life 3.82 days), which is a decay product of 226Ra, the latter being itself a decay product of 238U.[42] A trace amount of the (highly unstable) isotope 218Rn (half-life about 35 milliseconds) is also among the daughters of 222Rn. The isotope 216Rn would be produced by the double beta decay of natural 216Po; while energetically possible, this process has however never been seen.[43]
Three other radon isotopes have a half-life of over an hour: 211Rn (about 15 hours), 210Rn (2.4 hours) and 224Rn (about 1.8 hours). However, none of these three occur naturally. 220Rn, also called thoron, is a natural decay product of the most stable thorium isotope (232Th). It has a half-life of 55.6 seconds and also emits alpha radiation. Similarly, 219Rn is derived from the most stable isotope of actinium (227Ac)—named "actinon"—and is an alpha emitter with a half-life of 3.96 seconds.[40] No radon isotopes occur significantly in the neptunium (237Np) decay series, though trace amounts of the isotopes 221Rn (26 minutes) and 217Rn (0.5 millisecond) are produced in minor branches.
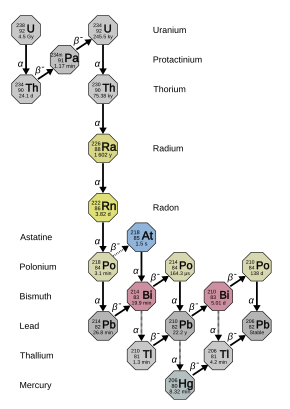
Daughters
[edit]222Rn belongs to the radium and uranium-238 decay chain, and has a half-life of 3.8235 days. Its first four products (excluding marginal decay schemes) are very short-lived, meaning that the corresponding disintegrations are indicative of the initial radon distribution. Its decay goes through the following sequence:[40]
- 222Rn, 3.82 days, alpha decaying to...
- 218Po, 3.10 minutes, alpha decaying to...
- 214Pb, 26.8 minutes, beta decaying to...
- 214Bi, 19.9 minutes, beta decaying to...
- 214Po, 0.1643 ms, alpha decaying to...
- 210Pb, which has a much longer half-life of 22.3 years, beta decaying to...
- 210Bi, 5.013 days, beta decaying to...
- 210Po, 138.376 days, alpha decaying to...
- 206Pb, stable.
The radon equilibrium factor[44] is the ratio between the activity of all short-period radon progenies (which are responsible for most of radon's biological effects), and the activity that would be at equilibrium with the radon parent.
If a closed volume is constantly supplied with radon, the concentration of short-lived isotopes will increase until an equilibrium is reached where the overall decay rate of the decay products equals that of the radon itself. The equilibrium factor is 1 when both activities are equal, meaning that the decay products have stayed close to the radon parent long enough for the equilibrium to be reached, within a couple of hours. Under these conditions, each additional pCi/L of radon will increase exposure by 0.01 working level (WL, a measure of radioactivity commonly used in mining). These conditions are not always met; in many homes, the equilibrium factor is typically 40%; that is, there will be 0.004 WL of daughters for each pCi/L of radon in the air.[45] 210Pb takes much longer (decades) to come in equilibrium with radon, but, if the environment permits accumulation of dust over extended periods of time, 210Pb and its decay products may contribute to overall radiation levels as well.
Because of their electrostatic charge, radon progenies adhere to surfaces or dust particles, whereas gaseous radon does not. Attachment removes them from the air, usually causing the equilibrium factor in the atmosphere to be less than 1. The equilibrium factor is also lowered by air circulation or air filtration devices, and is increased by airborne dust particles, including cigarette smoke. The equilibrium factor found in epidemiological studies is 0.4.[46]
History and etymology
[edit]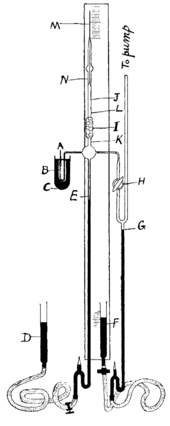
Radon was discovered in 1899 by Ernest Rutherford and Robert B. Owens at McGill University in Montreal.[47] It was the fifth radioactive element to be discovered, after uranium, thorium, radium, and polonium.[48][49][50][51] In 1899, Pierre and Marie Curie observed that the gas emitted by radium remained radioactive for a month.[52] Later that year, Rutherford and Owens noticed variations when trying to measure radiation from thorium oxide.[47] Rutherford noticed that the compounds of thorium continuously emit a radioactive gas that remains radioactive for several minutes, and called this gas "emanation" (from Latin: emanare, to flow out, and emanatio, expiration),[53] and later "thorium emanation" ("Th Em"). In 1900, Friedrich Ernst Dorn reported some experiments in which he noticed that radium compounds emanate a radioactive gas he named "radium emanation" ("Ra Em").[54][55] In 1901, Rutherford and Harriet Brooks demonstrated that the emanations are radioactive, but credited the Curies for the discovery of the element.[56] In 1903, similar emanations were observed from actinium by André-Louis Debierne,[57][58] and were called "actinium emanation" ("Ac Em").
Several shortened names were soon suggested for the three emanations: exradio, exthorio, and exactinio in 1904;[59] radon (Ro), thoron (To), and akton or acton (Ao) in 1918;[60] radeon, thoreon, and actineon in 1919,[61] and eventually radon, thoron, and actinon in 1920.[62] (The name radon is not related to that of the Austrian mathematician Johann Radon.) The likeness of the spectra of these three gases with those of argon, krypton, and xenon, and their observed chemical inertia led Sir William Ramsay to suggest in 1904 that the "emanations" might contain a new element of the noble-gas family.[59]
In 1909, Ramsay and Robert Whytlaw-Gray isolated radon and determined its melting temperature and approximate density. In 1910, they determined that it was the heaviest known gas.[63] They wrote that "L'expression l'émanation du radium est fort incommode" ("the expression 'radium emanation' is very awkward") and suggested the new name niton (Nt) (from Latin: nitens, shining) to emphasize the radioluminescence property,[64] and in 1912 it was accepted by the International Commission for Atomic Weights. In 1923, the International Committee for Chemical Elements and International Union of Pure and Applied Chemistry (IUPAC) chose the name of the most stable isotope, radon, as the name of the element. The isotopes thoron and actinon were later renamed 220Rn and 219Rn. This has caused some confusion in the literature regarding the element's discovery as while Dorn had discovered radon the isotope, he was not the first to discover radon the element.[65]
As late as the 1960s, the element was also referred to simply as emanation.[66] The first synthesized compound of radon, radon fluoride, was obtained in 1962.[67] Even today, the word radon may refer to either the element or its isotope 222Rn, with thoron remaining in use as a short name for 220Rn to stem this ambiguity. The name actinon for 219Rn is rarely encountered today, probably due to the short half-life of that isotope.[65]
The danger of high exposure to radon in mines, where exposures can reach 1,000,000 Bq/m3, has long been known. In 1530, Paracelsus described a wasting disease of miners, the mala metallorum, and Georg Agricola recommended ventilation in mines to avoid this mountain sickness (Bergsucht).[68][69] In 1879, this condition was identified as lung cancer by Harting and Hesse in their investigation of miners from Schneeberg, Germany. The first major studies with radon and health occurred in the context of uranium mining in the Joachimsthal region of Bohemia.[70] In the US, studies and mitigation only followed decades of health effects on uranium miners of the Southwestern US employed during the early Cold War; standards were not implemented until 1971.[71]
In the early 20th century in the US, gold contaminated with the radon daughter 210Pb entered the jewelry industry. This was from gold brachytherapy seeds that had held 222Rn, which were melted down after the radon had decayed.[72][73]
The presence of radon in indoor air was documented as early as 1950. Beginning in the 1970s, research was initiated to address sources of indoor radon, determinants of concentration, health effects, and mitigation approaches. In the US, the problem of indoor radon received widespread publicity and intensified investigation after a widely publicized incident in 1984. During routine monitoring at a Pennsylvania nuclear power plant, a worker was found to be contaminated with radioactivity. A high concentration of radon in his home was subsequently identified as responsible.[74]
Occurrence
[edit]Concentration units
[edit]
All discussions of radon concentrations in the environment refer to 222Rn. While the average rate of production of 220Rn (from the thorium decay series) is about the same as that of 222Rn, the amount of 220Rn in the environment is much less than that of 222Rn because of the short half-life of 220Rn (55 seconds, versus 3.8 days respectively).[3]
Radon concentration in the atmosphere is usually measured in becquerel per cubic meter (Bq/m3), the SI derived unit. Another unit of measurement common in the US is picocuries per liter (pCi/L); 1 pCi/L = 37 Bq/m3.[45] Typical domestic exposures average about 48 Bq/m3 indoors, though this varies widely, and 15 Bq/m3 outdoors.[76]
In the mining industry, the exposure is traditionally measured in working level (WL), and the cumulative exposure in working level month (WLM); 1 WL equals any combination of short-lived 222Rn daughters (218Po, 214Pb, 214Bi, and 214Po) in 1 liter of air that releases 1.3 × 105 MeV of potential alpha energy;[45] 1 WL is equivalent to 2.08 × 10−5 joules per cubic meter of air (J/m3).[3] The SI unit of cumulative exposure is expressed in joule-hours per cubic meter (J·h/m3). One WLM is equivalent to 3.6 × 10−3 J·h/m3. An exposure to 1 WL for 1 working-month (170 hours) equals 1 WLM cumulative exposure. A cumulative exposure of 1 WLM is roughly equivalent to living one year in an atmosphere with a radon concentration of 230 Bq/m3.[77]
222Rn decays to 210Pb and other radioisotopes. The levels of 210Pb can be measured. The rate of deposition of this radioisotope is weather-dependent.
Radon concentrations found in natural environments are much too low to be detected by chemical means. A 1,000 Bq/m3 (relatively high) concentration corresponds to 0.17 picogram per cubic meter (pg/m3). The average concentration of radon in the atmosphere is about 6×10−18 molar percent, or about 150 atoms in each milliliter of air.[78] The radon activity of the entire Earth's atmosphere originates from only a few tens of grams of radon, consistently replaced by decay of larger amounts of radium, thorium, and uranium.[79]
Natural
[edit]
Radon is produced by the radioactive decay of radium-226, which is found in uranium ores, phosphate rock, shales, igneous and metamorphic rocks such as granite, gneiss, and schist, and to a lesser degree, in common rocks such as limestone.[5][80] Every square mile of surface soil, to a depth of 6 inches (2.6 km2 to a depth of 15 cm), contains about 1 gram of radium, which releases radon in small amounts to the atmosphere.[3] It is estimated that 2.4 billion curies (90 EBq) of radon are released from soil annually worldwide.[81] This is equivalent to some 15.3 kilograms (34 lb).
Radon concentration can differ widely from place to place. In the open air, it ranges from 1 to 100 Bq/m3, even less (0.1 Bq/m3) above the ocean. In caves or ventilated mines, or poorly ventilated houses, its concentration climbs to 20–2,000 Bq/m3.[82]
Radon concentration can be much higher in mining contexts. Ventilation regulations instruct to maintain radon concentration in uranium mines under the "working level", with 95th percentile levels ranging up to nearly 3 WL (546 pCi 222Rn per liter of air; 20.2 kBq/m3, measured from 1976 to 1985).[3]The concentration in the air at the (unventilated) Gastein Healing Gallery averages 43 kBq/m3 (1.2 nCi/L) with maximal value of 160 kBq/m3 (4.3 nCi/L).[83]
Radon mostly appears with the radium/uranium series (decay chain) (222Rn), and marginally with the thorium series (220Rn). The element emanates naturally from the ground, and some building materials, all over the world, wherever traces of uranium or thorium are found, and particularly in regions with soils containing granite or shale, which have a higher concentration of uranium. Not all granitic regions are prone to high emissions of radon. Being a rare gas, it usually migrates freely through faults and fragmented soils, and may accumulate in caves or water. Owing to its very short half-life (four days for 222Rn), radon concentration decreases very quickly when the distance from the production area increases. Radon concentration varies greatly with season and atmospheric conditions. For instance, it has been shown to accumulate in the air if there is a meteorological inversion and little wind.[84]
High concentrations of radon can be found in some spring waters and hot springs.[85] The towns of Boulder, Montana; Misasa; Bad Kreuznach, Germany; and the country of Japan have radium-rich springs that emit radon. To be classified as a radon mineral water, radon concentration must be above 2 nCi/L (74 kBq/m3).[86] The activity of radon mineral water reaches 2 MBq/m3 in Merano and 4 MBq/m3 in Lurisia (Italy).[83]
Natural radon concentrations in the Earth's atmosphere are so low that radon-rich water in contact with the atmosphere will continually lose radon by volatilization. Hence, ground water has a higher concentration of 222Rn than surface water, because radon is continuously produced by radioactive decay of 226Ra present in rocks. Likewise, the saturated zone of a soil frequently has a higher radon content than the unsaturated zone because of diffusional losses to the atmosphere.[87][88]
In 1971, Apollo 15 passed 110 km (68 mi) above the Aristarchus plateau on the Moon, and detected a significant rise in alpha particles thought to be caused by the decay of 222Rn. The presence of 222Rn has been inferred later from data obtained from the Lunar Prospector alpha particle spectrometer.[89]
Radon is found in some petroleum. Because radon has a similar pressure and temperature curve to propane, and oil refineries separate petrochemicals based on their boiling points, the piping carrying freshly separated propane in oil refineries can become contaminated because of decaying radon and its products.[90]
Residues from the petroleum and natural gas industry often contain radium and its daughters. The sulfate scale from an oil well can be radium rich, while the water, oil, and gas from a well often contains radon. Radon decays to form solid radioisotopes that form coatings on the inside of pipework.[90]
Accumulation in buildings
[edit]The examples and perspective in this section may not represent a worldwide view of the subject. (September 2021) |
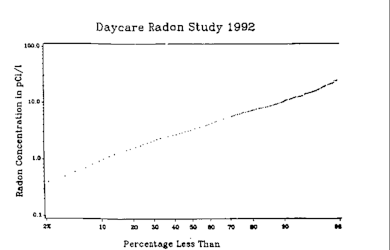

High concentrations of radon in homes were discovered by chance in 1985 after the stringent radiation testing conducted at the new Limerick Generating Station nuclear power plant revealed that Stanley Watras, a construction engineer at the plant, was contaminated by radioactive substances even though the reactor had never been fueled.[91] Typical domestic exposures are of approximately 100 Bq/m3 (2.7 pCi/L) indoors. Some level of radon will be found in all buildings. Radon mostly enters a building directly from the soil through the lowest level in the building that is in contact with the ground. High levels of radon in the water supply can also increase indoor radon air levels. Typical entry points of radon into buildings are cracks in solid foundations and walls, construction joints, gaps in suspended floors and around service pipes, cavities inside walls, and the water supply.[12] Radon concentrations in the same place may differ by double/half over one hour. Also, the concentration in one room of a building may be significantly different from the concentration in an adjoining room.[3] The soil characteristics of the dwellings are the most important source of radon for the ground floor and higher concentration of indoor radon observed on lower floors. Most of the high radon concentrations have been reported from places near fault zones; hence the existence of a relation between the exhalation rate from faults and indoor radon concentrations is obvious.[citation needed]
The distribution of radon concentrations will generally differ from room to room, and the readings are averaged according to regulatory protocols. Indoor radon concentration is usually assumed to follow a log-normal distribution on a given territory.[92] Thus, the geometric mean is generally used for estimating the "average" radon concentration in an area.[93]
The mean concentration ranges from less than 10 Bq/m3 to over 100 Bq/m3 in some European countries.[94]
Some of the highest radon hazard in the US is found in Iowa and in the Appalachian Mountain areas in southeastern Pennsylvania.[95] Iowa has the highest average radon concentrations in the US due to significant glaciation that ground the granitic rocks from the Canadian Shield and deposited it as soils making up the rich Iowa farmland.[96] Many cities within the state, such as Iowa City, have passed requirements for radon-resistant construction in new homes. The second highest readings in Ireland were found in office buildings in the Irish town of Mallow, County Cork, prompting local fears regarding lung cancer.[97]
In a few places, uranium tailings have been used for landfills and were subsequently built upon, resulting in possible increased exposure to radon.[3]
Since radon is a colorless, odorless gas, the only way to know how much is present in the air or water is to perform tests. In the US, radon test kits are available to the public at retail stores, such as hardware stores, for home use, and testing is available through licensed professionals, who are often home inspectors. Efforts to reduce indoor radon levels are called radon mitigation. In the US, the EPA recommends all houses be tested for radon. In the UK under the Housing Health & Safety Rating System (HHSRS) property owners have an obligation to evaluate potential risks and hazards to health and safety in a residential property.[98]
Industrial production
[edit]Radon is obtained as a by-product of uraniferous ores processing after transferring into 1% solutions of hydrochloric or hydrobromic acids. The gas mixture extracted from the solutions contains H
2, O
2, He, Rn, CO
2, H
2O and hydrocarbons. The mixture is purified by passing it over copper at 993 K (720 °C; 1,328 °F) to remove the H
2 and the O
2, and then KOH and P
2O
5 are used to remove the acids and moisture by sorption. Radon is condensed by liquid nitrogen and purified from residue gases by sublimation.[99]
Radon commercialization is regulated, but it is available in small quantities for the calibration of 222Rn measurement systems, at a price, in 2008, of almost US$6,000 (equivalent to $8,491 in 2023) per milliliter of radium solution (which only contains about 15 picograms of actual radon at any given moment).[100]Radon is produced by a solution of radium-226 (half-life of 1,600 years). Radium-226 decays by alpha-particle emission, producing radon that collects over samples of radium-226 at a rate of about 1 mm3/day per gram of radium; equilibrium is quickly achieved and radon is produced in a steady flow, with an activity equal to that of the radium (50 Bq). Gaseous 222Rn (half-life of about four days) escapes from the capsule through diffusion.[101]
Concentration scale
[edit]| Bq/m3 | pCi/L | Occurrence example |
|---|---|---|
| 1 | ~0.027 | Radon concentration at the shores of large oceans is typically 1 Bq/m3. Radon trace concentration above oceans or in Antarctica can be lower than 0.1 Bq/m3. |
| 10 | 0.27 | Mean continental concentration in the open air: 10 to 30 Bq/m3. Based on a series of surveys, the global mean indoor radon concentration is estimated to be 39 Bq/m3. |
| 100 | 2.7 | Typical indoor domestic exposure. Most countries have adopted a radon concentration of 200–400 Bq/m3 for indoor air as an Action or Reference Level. If testing shows levels less than 4 picocuries radon per liter of air (150 Bq/m3), then no action is necessary. A cumulated exposure of 230 Bq/m3 of radon gas concentration during a period of 1 year corresponds to 1 WLM. |
| 1,000 | 27 | Very high radon concentrations (>1000 Bq/m3) have been found in houses built on soils with a high uranium content and/or high permeability of the ground. If levels are 20 picocuries radon per liter of air (800 Bq/m3) or higher, the home owner should consider some type of procedure to decrease indoor radon levels. Allowable concentrations in uranium mines are approximately 1,220 Bq/m3 (33 pCi/L)[102] |
| 10,000 | 270 | The concentration in the air at the (unventilated) Gastein Healing Gallery averages 43 kBq/m3 (about 1.2 nCi/L) with maximal value of 160 kBq/m3 (about 4.3 nCi/L).[83] |
| 100,000 | ~2700 | About 100,000 Bq/m3 (2.7 nCi/L) was measured in Stanley Watras's basement.[103][104] |
| 1,000,000 | 27000 | Concentrations reaching 1,000,000 Bq/m3 can be found in unventilated uranium mines. |
| ~5.54 × 1019 | ~1.5 × 1018 | Theoretical upper limit: Radon gas (222Rn) at 100% concentration (1 atmosphere, 0 °C); 1.538×105 curies/gram;[105] 5.54×1019 Bq/m3. |
Applications
[edit]Медицинский
[ редактировать ]начала 20-го века Одной из форм шарлатанства было лечение болезней в радиотории . [106] Это была небольшая герметичная комната, в которой пациенты подвергались воздействию радона из-за его «лечебного эффекта». Канцерогенная природа радона вследствие его ионизирующего излучения стала очевидна позднее. Радиоактивность радона, повреждающая молекулы, использовалась для уничтожения раковых клеток. [107] но это не увеличивает здоровье здоровых клеток. [ нужна ссылка ] Ионизирующее излучение вызывает образование свободных радикалов , что приводит к повреждению клеток , вызывая рост заболеваемости, включая рак .
Было высказано предположение, что воздействие радона смягчает аутоиммунные заболевания, такие как артрит, посредством процесса, известного как радиационный гормезис . [108] [109] В результате в конце 20-го и начале 21-го веков в Басине, штат Монтана , были созданы «рудники здоровья», привлекавшие людей, ищущих облегчения от таких проблем со здоровьем, как артрит, за счет ограниченного воздействия радиоактивной шахтной воды и радона. Такая практика не рекомендуется из-за хорошо задокументированных пагубных последствий высоких доз радиации на организм. [110]
Радиоактивные водяные ванны применялись с 1906 года в Яхимове (Чехия), но еще до открытия радона они использовались в Бад-Гаштайне (Австрия). Богатые радием источники также используются в традиционных японских онсэнах в Мисасе , префектура Тоттори . Питьевая терапия применяется в Бад-Брамбахе , Германия, и в начале 20-го века воду из источников, содержащую радон, разливали в бутылки и продавали (к тому времени, когда она попала к потребителям, в этой воде почти не было радона из-за короткого содержания радона) -жизнь). [111] Ингаляционная терапия проводится в Гаштайнер-Хайльстоллене , Австрия; Сверадув-Здруй , Чернява-Здруй , Ковары , Лендек-Здруй , Польша; Харгита Бай , Румыния; и Боулдер, Монтана . В США и Европе есть несколько «радоновых спа», где люди сидят в течение нескольких минут или часов в атмосфере с высоким содержанием радона, например, в Бад-Шмидеберге , Германия. [109] [112]
Радон производился в промышленных масштабах для использования в лучевой терапии, но по большей части был заменен радионуклидами, полученными в ускорителях частиц и ядерных реакторах . Радон использовался в имплантируемых семенах, сделанных из золота или стекла, которые в основном использовались для лечения рака, известного как брахитерапия .Золотые семена были изготовлены путем заполнения длинной трубки радоном, накачиваемым из источника радия, а затем трубка была разделена на короткие секции путем обжатия и разрезания. Слой золота удерживает радон внутри и отфильтровывает альфа- и бета-излучение, позволяя при этом гамма-лучам уйти (которые убивают больные ткани). Активность может варьироваться от 0,05 до 5 милликюри на семя (от 2 до 200 МБк). [107] Гамма-лучи производятся радоном и первыми короткоживущими элементами его цепи распада ( 218 Po, 214 Пб, 214 С, 214 Po).
После 11 периодов полураспада (42 дня) радиоактивность радона достигает 1/2048 от исходного уровня. На этом этапе преобладающая остаточная активность затравки обусловлена продуктами распада радона. 210 Pb, период полураспада которого (22,3 года) в 2000 раз больше, чем у радона и его потомков. 210 Би и 210 Po.
Научный
[ редактировать ]Выделение радона из почвы варьируется в зависимости от типа почвы и содержания урана на поверхности, поэтому концентрации радона на открытом воздухе можно использовать для отслеживания воздушных масс в ограниченной степени . Этот факт был использован некоторыми учеными-атмосферниками ( Радоновый шторм ). Из-за быстрой потери радона в воздухе и сравнительно быстрого распада радон используется в гидрологических исследованиях, изучающих взаимодействие между грунтовыми водами и ручьями . Любая значительная концентрация радона в ручье является хорошим индикатором локального поступления подземных вод.
Концентрация радона в почве использовалась экспериментальным способом для картирования погребенных близко расположенных геологических разломов, поскольку концентрации радона обычно выше над разломами. [113] Точно так же он нашел ограниченное применение при поиске геотермических градиентов . [114]
Некоторые исследователи исследовали изменения концентрации радона в грунтовых водах для прогнозирования землетрясений . [115] [116] [117] Повышение уровня радона отмечалось еще до Ташкентской катастрофы 1966 г. [118] и 1994 Миндоро [117] землетрясения. Период полураспада радона составляет примерно 3,8 дня, а это означает, что его можно обнаружить только вскоре после того, как он образовался в цепочке радиоактивного распада. По этой причине была выдвинута гипотеза, что увеличение концентрации радона происходит из-за образования новых подземных трещин, которые позволят увеличить циркуляцию грунтовых вод, вымывая радон. Небезосновательно можно предположить, что образование новых трещин предшествует сильным землетрясениям. В 1970-х и 1980-х годах научные измерения выбросов радона вблизи разломов показали, что землетрясения часто происходили без сигнала радона, а радон часто обнаруживался без последующего землетрясения. Затем многие отвергли его как ненадежный индикатор. [119] исследовало его как возможного предшественника По состоянию на 2009 год НАСА . [120]
Радон является известным загрязнителем, выбрасываемым геотермальными электростанциями , поскольку он присутствует в материале, выкачиваемом из глубоких подземных зон. Он быстро рассеивается, и в различных исследованиях не было выявлено никакой радиологической опасности. Кроме того, типичные системы повторно закачивают материал глубоко под землю, а не выбрасывают его на поверхность, поэтому его воздействие на окружающую среду минимально. [121] Однако то же самое можно сказать и о тривиальных выбросах действующих атомных электростанций . [ нужна ссылка ]
В 1940-х и 1950-х годах радон использовался для промышленной рентгенографии . [122] [123] Другие источники рентгеновского излучения, которые стали доступны после Второй мировой войны, быстро заменили радон для этого применения, поскольку они были дешевле и имели меньшую опасность альфа-излучения .
Риски для здоровья
[ редактировать ]В шахтах
[ редактировать ]Продукты распада радона-222 классифицированы Международным агентством по изучению рака как канцерогенные для человека. [124] и как газ, который можно вдыхать, рак легких вызывает особую озабоченность у людей, подвергающихся воздействию повышенного уровня радона в течение длительного времени. В 1940-е и 1950-е годы, когда стандарты безопасности, требующие дорогостоящей вентиляции в шахтах, не были широко внедрены, [125] Воздействие радона было связано с раком легких среди некурящих шахтеров урана и других твердых пород на территории нынешней Чешской Республики, а затем и среди горняков на юго-западе США. [126] [127] [128] и Южная Австралия . [129] Несмотря на то, что об этих опасностях было известно еще в начале 1950-х годов, [130] этот профессиональный риск оставался плохо управляемым на многих шахтах до 1970-х годов. В этот период несколько предпринимателей открыли для широкой публики бывшие урановые рудники в США и рекламировали предполагаемую пользу для здоровья от дыхания радоном под землей. Заявленные преимущества для здоровья включали облегчение боли, проблем с носовыми пазухами, астмы и артрита. [131] [132] но они оказались ложными [ нужна ссылка ] и правительство запретило такую рекламу в 1975 году. [133]
С тех пор вентиляция и другие меры использовались для снижения уровня радона в наиболее пострадавших шахтах, которые продолжают работать. В последние годы среднегодовое воздействие на шахтеров урана упало до уровней, аналогичных концентрациям, вдыхаемым в некоторых домах. Это снизило риск профессионального рака, вызванного радоном, хотя проблемы со здоровьем могут сохраняться как у тех, кто в настоящее время работает на пострадавших шахтах, так и у тех, кто работал там в прошлом. [134] Поскольку относительный риск для майнеров снизился, уменьшилась и способность выявлять избыточные риски среди этого населения. [135]
Источником радона также могут быть остатки переработки урановой руды. Радон, образующийся из-за высокого содержания радия в открытых отвалах и хвостохранилищах, может легко выбрасываться в атмосферу и поражать людей, живущих поблизости. [136]
Помимо рака легких, исследователи предположили, что из-за воздействия радона может повыситься риск развития лейкемии . Эмпирическая поддержка исследований среди населения в целом противоречива, а исследование шахтеров урана выявило корреляцию между воздействием радона и хроническим лимфоцитарным лейкозом . [137]
Шахтеры (а также рабочие по переработке и транспортировке руды), которые работали в урановой промышленности США в период с 1940-х по 1971 год, могут иметь право на компенсацию в соответствии с Законом о компенсации за радиационное воздействие (RECA). Выжившие родственники также могут подать заявление в случае смерти бывшего работавшего лица.
Не только урановые рудники страдают от повышенного уровня радона. Особенно страдают угольные шахты, поскольку уголь может содержать больше урана и тория, чем коммерчески действующие урановые рудники.
Воздействие на внутреннем уровне
[ редактировать ]Длительное воздействие более высоких концентраций радона связано с увеличением заболеваемости раком легких. [84] С 1999 года во всем мире проводятся исследования методов оценки концентрации радона. Только в Соединенных Штатах средний показатель составил не менее 40 Бк/м. 3 . Штек и др. провел исследование различий между радоном внутри и снаружи помещений в Айове и Миннесоте. Более высокая радиация была обнаружена в населенном регионе, а не в незаселенных регионах Центральной Америки в целом. В некоторых округах на северо-западе Айовы и юго-западе Миннесоты концентрации радона на открытом воздухе превышают средние по стране концентрации радона в помещениях. [84] Несмотря на более высокий средний показатель, показатели Миннесоты и Айовы были исключительно близкими, независимо от расстояния. Точные исследования воздействия радона необходимы для дальнейшего понимания проблем, которые воздействие радона может иметь для общества. Текущие исследования подтверждают связь между воздействием радона и плохими последствиями для здоровья (т.е. повышенным риском рака легких), но дальнейшие исследования могут поддержать более строгие ограничения на радон как внутри, так и за пределами жилых домов. [84]
Воздействие радона (в основном дочерних элементов радона) было связано с раком легких в многочисленных исследованиях «случай-контроль», проведенных в США, Европе и Китае. Ежегодно в США происходит около 21 000 смертей (0,0063% населения в 333 миллиона человек) из-за рака легких, вызванного радоном. [10] [138] В Словении, стране с высокой концентрацией радона, ежегодно от радона умирают около 120 человек (0,0057% населения в 2,11 миллиона человек). [139] [140] Одно из наиболее полных исследований радона, проведенное в США эпидемиологом Р. Уильямом Филдом и его коллегами, выявило увеличение риска рака легких на 50% даже при длительном воздействии при уровне действия EPA 4 пКи/л. Объединенные анализы Северной Америки и Европы еще раз подтверждают эти выводы. [141] Однако дискуссия об противоположных результатах все еще продолжается. [142] [143] [144] особенно ретроспективное исследование риска рака легких в 2008 году, которое показало существенное снижение заболеваемости раком при концентрациях радона от 50 до 123 Бк/м. 3 . [145]
Большинство моделей воздействия радона в жилых помещениях основаны на исследованиях шахтеров, и более желательны прямые оценки рисков, которым подвергаются домовладельцы. [134] Из-за трудностей измерения риска, связанного с радоном по сравнению с курением, в моделях его воздействия часто использовались именно они.
Агентство по охране окружающей среды считает радон второй по значимости причиной рака легких и ведущей экологической причиной смертности от рака, причем первой из них является курение . [146] Другие пришли к аналогичным выводам в отношении Соединенного Королевства. [134] и Франция. [147] Воздействие радона в домах и офисах может быть вызвано некоторыми подземными горными породами, а также некоторыми строительными материалами (например, некоторыми гранитами). Наибольший риск воздействия радона возникает в зданиях, которые герметичны, недостаточно вентилируются, имеют негерметичность фундамента, пропускающую воздух из грунта в подвалы и жилые помещения.
Торон ( 220 Rn) измерялся в сравнительно высоких концентрациях в зданиях с земляной архитектурой, таких как традиционные фахверковые дома и современные дома с глиняной отделкой стен. Из-за короткого периода полураспада торон в качестве источника встречается только вблизи земляных поверхностей, тогда как его потомство можно обнаружить в воздухе помещений таких зданий. Таким образом, радиационное облучение происходит в любом месте внутри таких домов. Исследование обнаружило, что в различных жилищах с земляной архитектурой в Германии годовые дозы внутреннего облучения из-за вдыхания торона и его потомков достигают нескольких миллизивертов . [148]
Действие и эталонный уровень
[ редактировать ]ВОЗ представила в 2009 г. рекомендуемый референтный уровень (национальный референтный уровень) 100 Бк/м. 3 , по радону в жилых домах. В рекомендации также говорится, что там, где это невозможно, 300 Бк/м2. 3 должен быть выбран как самый высокий уровень. Национальный эталонный уровень не должен быть пределом, а должен представлять собой максимально допустимую среднегодовую концентрацию радона в жилом помещении. [149]
Допустимая концентрация радона в доме варьируется в зависимости от организации, выполняющей рекомендации, например, Агентство по охране окружающей среды рекомендует принимать меры при концентрациях всего 74 Бк/м. 3 (2 пКи/л), [76] а Европейский Союз рекомендует принять меры, когда концентрация достигает 400 Бк/м. 3 (11 пКи/л) для старых домов и 200 Бк/м 3 (5 пКи/л) для новых. [150] 8 июля 2010 года Агентство по охране здоровья Великобритании выпустило новую рекомендацию, устанавливающую «целевой уровень» в 100 Бк/м. 3 сохраняя при этом «Уровень действия» 200 Бк/м. 3 . [151] Аналогичные уровни (как в Великобритании) публикуются Норвежским управлением по радиационной и ядерной безопасности (DSA). [152] при этом максимальный лимит для школ, детских садов и новых жилых домов установлен на уровне 200 Бк/м. 3 , где 100 Бк/м 3 устанавливается как уровень действия. [153] Во всех новых домах следует принимать профилактические меры против накопления радона.
Вдыхание и курение
[ редактировать ]Результаты эпидемиологических исследований показывают, что риск рака легких увеличивается при воздействии радона в жилых помещениях. Хорошо известным примером источника ошибки является курение, основной фактор риска рака легких. По оценкам, в США курение сигарет является причиной от 80% до 90% всех случаев рака легких. [154]
По данным EPA, риск рака легких для курильщиков значителен из-за синергетического воздействия радона и курения. В этой группе населения около 62 человек из 1000 умрут от рака легких по сравнению с 7 людьми из 1000 среди людей, которые никогда не курили. [10] Не исключено, что риск некурящих в первую очередь следует объяснять действием радона.
Радон, как и другие известные или предполагаемые внешние факторы риска рака легких, представляет угрозу для курильщиков и бывших курильщиков. Это было продемонстрировано европейским объединенным исследованием. [155] Комментарий [155] В объединенном исследовании говорилось: «Неуместно говорить просто о риске, связанном с радоном в домах. Риск связан с курением, усугубляемым синергическим эффектом радона на курильщиков. быть незначительным».
Согласно европейскому объединенному исследованию, существует разница в риске гистологических подтипов рака легких и воздействия радона. Мелкоклеточная карцинома легких , которая имеет высокую корреляцию с курением, имеет более высокий риск после воздействия радона. Для других гистологических подтипов, таких как аденокарцинома , тип, который в первую очередь поражает некурящих, риск воздействия радона оказывается ниже. [155] [156]
Исследование лучевой после мастэктомии терапии показывает, что необходимо разработать простые модели, которые ранее использовались для оценки комбинированных и отдельных рисков от радиации и курения. [157] Это также подтверждается новым обсуждением метода расчета, линейной беспороговой модели , которая обычно используется. [158]
Исследование 2001 года, в котором приняли участие 436 некурящих с раком легких и контрольная группа из 1649 некурящих без рака легких, показало, что воздействие радона увеличивает риск рака легких у некурящих. Группа, которая подвергалась воздействию табачного дыма дома, имела гораздо более высокий риск, в то время как у тех, кто не подвергался пассивному курению, не было выявлено какого-либо повышенного риска с увеличением воздействия радона. [159]
Проглатывание
[ редактировать ]Эффекты радона при попадании в организм неизвестны, хотя исследования показали, что его биологический период полураспада колеблется от 30 до 70 минут, при этом 90% выводится за 100 минут. США В 1999 году Национальный исследовательский совет исследовал проблему радона в питьевой воде. Риск, связанный с проглатыванием, считался практически незначительным. [160] Вода из подземных источников может содержать значительное количество радона в зависимости от условий окружающей породы и почвы, тогда как вода из поверхностных источников обычно этого не делает. [161]
Воздействие радона на океан
[ редактировать ]Основная важность понимания 222 Поток Rn из океана означает, что увеличение использования радона также циркулирует и увеличивается в атмосфере. Концентрации на поверхности океана обмениваются внутри атмосферы, вызывая 222 Рн увеличить за счет интерфейса воздух-море. [162] Хотя протестированные районы были очень мелководными, дополнительные измерения в самых разных прибрежных режимах должны помочь определить природу 222 - заметил Рн. [162] Радон не только попадает в организм с питьевой водой, но и выделяется из воды при повышении температуры, понижении давления и при аэрации воды. Оптимальные условия для выделения и воздействия радона создавались во время принятия душа. Вода с концентрацией радона 10 4 пКи/л может увеличить концентрацию радона в воздухе внутри помещений на 1 пКи/л при нормальных условиях. [80]
Тестирование и смягчение последствий
[ редактировать ]

Существуют относительно простые тесты на радон. В некоторых странах эти тесты методично проводятся в районах известных систематических опасностей. Устройства обнаружения радона имеются в продаже. Цифровые детекторы радона обеспечивают постоянные измерения, выдавая на цифровой дисплей как ежедневные, еженедельные, краткосрочные, так и долгосрочные средние значения. Устройства для кратковременного тестирования радона, используемые для целей первоначального скрининга, недороги, а в некоторых случаях бесплатны. Существуют важные протоколы проведения краткосрочных тестов на радон, и их необходимо строго соблюдать. В комплект входит коллектор, который пользователь подвешивает на самом нижнем жилом этаже дома на срок от двух до семи дней. Затем пользователь отправляет коллектор в лабораторию для анализа. Также доступны долгосрочные комплекты, рассчитанные на сбор средств на срок до одного года и более. Тестовый комплект для открытой местности может проверить выбросы радона с земли до начала строительства. [10] Концентрация радона может меняться ежедневно, и точные оценки воздействия радона требуют долгосрочных средних измерений радона в местах, где человек проводит значительное количество времени. [163]
Уровни радона колеблются естественным образом из-за таких факторов, как переменчивые погодные условия, поэтому первоначальный тест может не дать точной оценки среднего уровня радона в доме. Уровни радона максимальны в самое прохладное время дня, когда перепады давления самые большие. [80] Таким образом, высокий результат (более 4 пКи/л) оправдывает повторение теста, прежде чем предпринимать более дорогостоящие проекты по снижению выбросов. Измерения между 4 и 10 пКи/л требуют проведения долгосрочного теста на радон. Измерения выше 10 пКи/л требуют только проведения еще одного краткосрочного теста, чтобы меры по снижению выбросов не были неоправданно отложены. Покупателям недвижимости рекомендуется отложить или отказаться от покупки, если продавцу не удалось снизить уровень радона до 4 пКи/л или ниже. [10]
Поскольку период полураспада радона составляет всего 3,8 дня, удаление или изоляция источника значительно снизит опасность в течение нескольких недель. Другой метод снижения уровня радона — изменить вентиляцию здания. Как правило, концентрация радона в помещении увеличивается по мере снижения интенсивности вентиляции. [3] В хорошо вентилируемом месте концентрация радона имеет тенденцию соответствовать значениям на открытом воздухе (обычно 10 Бк/м2). 3 , в диапазоне от 1 до 100 Бк/м 3 ). [10]
Четыре основных способа уменьшения количества радона, накапливающегося в доме: [10] [164]
- Разгерметизация подплиты (подсос грунта) за счет увеличения вентиляции под полом;
- Улучшение вентиляции дома и недопущение переноса радона из подвала в жилые помещения;
- Установка радоновой системы отстойников в подвале;
- Установка системы принудительной вентиляции или системы принудительной приточной вентиляции.
По данным Агентства по охране окружающей среды, [10] метод снижения радона «...в основном используется система вентиляционных труб и вентилятор, который вытягивает радон из-под дома и выбрасывает его наружу», что также называется разгерметизацией подплиты, активной разгерметизацией грунта или всасыванием грунта. . Обычно уровень радона в помещениях можно уменьшить за счет разгерметизации подпанелей и выведения такого насыщенного радоном воздуха на улицу, вдали от окон и других проемов зданий. «[Агентство по охране окружающей среды] обычно рекомендует методы, предотвращающие попадание радона. Например, всасывание почвы предотвращает попадание радона в ваш дом, вытягивая радон из-под дома и выпуская его через трубу или трубы в воздух над домом. дома, где он быстро разбавляется» и «EPA не рекомендует использовать только герметизацию для снижения уровня радона, потому что само по себе герметизация не продемонстрировала значительного или постоянного снижения уровня радона». [165]
Системы вентиляции с положительным давлением можно комбинировать с теплообменником для рекуперации энергии в процессе обмена воздуха с наружным воздухом, и простое выведение воздуха из подвала наружу не обязательно является жизнеспособным решением, поскольку это может фактически привести к попаданию радона в жилище. Дома, построенные на подвале, могут извлечь выгоду из коллектора радона, установленного под «радоновым барьером» (листом пластика, закрывающим подвал). [10] [166] В отношении подвальных помещений Агентство по охране окружающей среды заявляет: «Эффективный метод снижения уровня радона в домах с подвальными помещениями включает в себя покрытие земляного пола пластиковым листом высокой плотности. Вентиляционная труба и вентилятор используются для вытягивания радона из-под листа и его вентиляции. Эта форма всасывания почвы называется подмембранным всасыванием, и при правильном применении она является наиболее эффективным способом снижения уровня радона в подвальных помещениях домов». [165]
См. также
[ редактировать ]- Международный радоновый проект
- клетка Лукаса
- Плеохроическое гало (также известное как Радиоореол)
- Закон о компенсации за радиационное воздействие
Ссылки
[ редактировать ]- ^ Хейнс, Уильям М., изд. (2011). Справочник CRC по химии и физике (92-е изд.). Бока-Ратон, Флорида: CRC Press . п. 4.122. ISBN 1-4398-5511-0 .
- ^ Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С.; Ауди, Г. (2021). «Оценка ядерных свойств NUBASE2020» (PDF) . Китайская физика C . 45 (3): 030001. doi : 10.1088/1674-1137/abddae .
- ^ Jump up to: а б с д и ж г час Токсикологический профиль радона. Архивировано 15 апреля 2016 г. в Wayback Machine , Агентство по регистрации токсичных веществ и заболеваний , Служба общественного здравоохранения США, в сотрудничестве с Агентством по охране окружающей среды США, декабрь 1990 г.
- ^ «Информационный бюллетень общественного здравоохранения о радоне — здравоохранение и социальные услуги» . Массачусетс.Гов. Архивировано из оригинала 21 ноября 2011 г. Проверено 4 декабря 2011 г.
- ^ Jump up to: а б Куски, Тимоти М. (2003). Геологические опасности: Справочник . Гринвуд Пресс. стр. 236–239. ISBN 9781573564694 .
- ^ «Факты о радоне» . Факты о. Архивировано из оригинала 22 февраля 2005 г. Проверено 7 сентября 2008 г.
- ^ Ламберинк, Лини (16 февраля 2022 г.). «Таяние вечной мерзлоты может подвергнуть северян воздействию канцерогенного газа, говорится в исследовании» . cbc.ca. Новости Си-Би-Си. Архивировано из оригинала 17 февраля 2022 года . Проверено 22 февраля 2024 г.
- ^ Баранюк, Крис (11 мая 2022 г.). «Гонка против радона» . Знающий журнал . Ежегодные обзоры. doi : 10.1146/knowable-051122-1 (неактивен 31 января 2024 г.) . Проверено 17 мая 2022 г.
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на январь 2024 г. ( ссылка ) - ^ Плохая читаемость
- ^ Jump up to: а б с д и ж г час я «Путеводитель по радону для граждан» . www.epa.gov . Агентство по охране окружающей среды США . 12 октября 2010 года . Проверено 29 января 2012 г.
- ^ Добжинский, Людвик; Форнальский, Кшиштоф В.; Рещинская, Иоанна (23 ноября 2017 г.). «Метаанализ тридцати двух исследований случай-контроль и двух экологических радоновых исследований рака легких» . Журнал радиационных исследований . 59 (2): 149–163. дои : 10.1093/jrr/rrx061 . ПМК 5950923 . ПМИД 29186473 .
- ^ Jump up to: а б «Путеводитель по радону для граждан: Руководство по защите себя и своей семьи от радона» . Epa.gov. 2016.
- ^ Уильямс, Дэвид Р. (19 апреля 2007 г.). «Информационный бюллетень о Земле» . НАСА . Проверено 26 июня 2008 г.
- ^ «Элемент Радон» . Это Элементаль . Джефферсонская лаборатория.
- ^ Томас, Йенс (2002). Благородные газы . Маршалл Кавендиш. п. 13. ISBN 978-0-7614-1462-9 .
- ^ Джеррард, W (1979). Серия данных о растворимости (PDF) (2-е изд.). Пергамон Пресс. стр. 264–271.
- ^ Баттино, Р. (1979). Серия данных о растворимости (PDF) (2-е изд.). Пергамон Пресс. стр. 227–234.
- ^ Сайто, М. (1999). « Определение растворимости радона в 1,2-диметилбензоле, 1,3-диметилбензоле, 1,4-диметилбензоле, 1,3,5-триметилбензоле, 1,2,4-триметилбензоле и 1-изопропил-4-метилбензоле » . Ниппон Кагаку Кайши (6): 363–368. дои : 10.1246/nikkashi.1999.363 .
- ^ Jump up to: а б Келлер, Корнелиус; Вольф, Уолтер; Шани, Джашовам. «Радионуклиды. 2. Радиоактивные элементы и искусственные радионуклиды». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.o22_o15 . ISBN 978-3527306732 .
- ^ Бадер, Ричард Ф.В. «Введение в электронную структуру атомов и молекул» . Университет Макмастера . Проверено 26 июня 2008 г.
- ^ Дэвид Р. Лиде (2003). «Раздел 10, Атомная, молекулярная и оптическая физика; Потенциалы ионизации атомов и атомарных ионов». Справочник CRC по химии и физике (84-е изд.). Бока-Ратон, Флорида: CRC Press.
- ^ Аврорин В.В.; Красикова, Р.Н.; Нефедов В.Д.; Торопова, М.А. (1982). «Химия радона». Российское химическое обозрение . 51 (1): 12. Бибкод : 1982RuCRv..51...12А . дои : 10.1070/RC1982v051n01ABEH002787 . S2CID 250906059 .
- ^ Штейн, Л. (1970). «Ионный раствор радона». Наука . 168 (3929): 362–4. Бибкод : 1970Sci...168..362S . дои : 10.1126/science.168.3929.362 . ПМИД 17809133 . S2CID 31959268 .
- ^ Питцер, Кеннет С. (1975). «Фториды радона и элемента 118» . Химические коммуникации . 44 (18): 760–761. дои : 10.1039/C3975000760b .
- ^ Jump up to: а б с д и ж г час Штейн, Лоуренс (1983). «Химия радона». Радиохимика Акта . 32 (1–3): 163–171. дои : 10.1524/ract.1983.32.13.163 . S2CID 100225806 .
- ^ Мэн-Шэн Ляо; Цянь-Эр Чжан (1998). «Химическая связь в XeF 2 , XeF 4 , KrF 2 , KrF 4 , RnF 2 , XeCl 2 и XeBr 2 : от газовой фазы к твердому состоянию». Журнал физической химии А. 102 (52): 10647. Бибкод : 1998JPCA..10210647L . дои : 10.1021/jp9825516 .
- ^ Филатов, Михаил; Кремер, Дитер (2003). «Связь в гексафториде радона: необычная релятивистская проблема?». Физическая химия Химическая физика . 5 (6): 1103. Бибкод : 2003PCCP....5.1103F . дои : 10.1039/b212460m .
- ^ Холлоуэй, Дж. (1986). «Фториды благородных газов». Журнал химии фтора . 33 (1–4): 149. Бибкод : 1986JFluC..33..149H . дои : 10.1016/S0022-1139(00)85275-6 .
- ^ Аврорин В.В.; Красикова, Р.Н.; Нефедов В.Д.; Торопова, М.А. (1982). «Химия радона». Российское химическое обозрение . 51 (1): 12. Бибкод : 1982RuCRv..51...12А . дои : 10.1070/RC1982v051n01ABEH002787 . S2CID 250906059 .
- ^ Jump up to: а б с д Сайкс, АГ (1998). «Последние достижения в химии благородных газов» . Достижения неорганической химии . Том. 46. Академическая пресса. стр. 91–93. ISBN 978-0120236466 . Проверено 2 ноября 2012 г.
- ^ Jump up to: а б с Тайер, Джон С. (2010). «Релятивистские эффекты и химия более тяжелых элементов основной группы». Релятивистские методы для химиков . Проблемы и достижения в области вычислительной химии и физики. Том. 10. с. 80. дои : 10.1007/978-1-4020-9975-5_2 . ISBN 978-1-4020-9974-8 .
- ^ Аврорин В.В.; Красикова, Р.Н.; Нефедов В.Д.; Торопова, М.А. (1982). «Химия радона». Российское химическое обозрение . 51 (1): 12–20. Бибкод : 1982RuCRv..51...12A . дои : 10.1070/RC1982v051n01ABEH002787 . S2CID 250906059 .
- ^ Либман, Джоэл Ф. (1975). «Концептуальные проблемы химии благородных газов и фтора, II: отсутствие тетрафторида радона». Неорг. Нукл. хим. Летт . 11 (10): 683–685. дои : 10.1016/0020-1650(75)80185-1 .
- ^ Jump up to: а б Зеппельт, Конрад (2015). «Молекулярные гексафториды». Химические обзоры . 115 (2): 1296–1306. дои : 10.1021/cr5001783 . ПМИД 25418862 .
- ^ Малли, Гульзари Л. (2002). «Прогноз существования карбонила радона: RnCO». Международный журнал квантовой химии . 90 (2): 611. дои : 10.1002/qua.963 .
- ^ Рунеберг, Нино; Пюиккё, Пекка (1998). «Релятивистские псевдопотенциальные расчеты на Xe 2 , RnXe и Rn 2 : ван-дер-ваальсовые свойства радона». Международный журнал квантовой химии . 66 (2): 131. doi : 10.1002/(SICI)1097-461X(1998)66:2<131::AID-QUA4>3.0.CO;2-W .
- ^ Браун, Малкольм В. (5 марта 1993 г.). «Химики нашли способ создать «невозможное» соединение» . Нью-Йорк Таймс . Проверено 30 января 2009 г.
- ^ Долг, М.; Кюхле, В.; Столл, Х.; Пройсс, Х.; Швердтфегер, П. (20 декабря 1991 г.). «Псевдопотенциалы Ab initio для Hg в Rn: II. Молекулярные расчеты гидридов Hg в At и фторидов Rn». Молекулярная физика . 74 (6): 1265–1285. Бибкод : 1991МолФ..74.1265Д . дои : 10.1080/00268979100102951 . ISSN 0026-8976 .
- ^ Братч, Стивен Г. (29 июля 1988 г.). «Стандартные электродные потенциалы и температурные коэффициенты в воде при 298,15 К». Журнал физических и химических справочных данных . 18 (1): 1–21. Бибкод : 1989JPCRD..18....1B . дои : 10.1063/1.555839 . S2CID 97185915 .
- ^ Jump up to: а б с Сонцогни, Алехандро. «Интерактивная карта нуклидов» . Национальный центр ядерных данных: Брукхейвенская национальная лаборатория. Архивировано из оригинала 21 июля 2011 г. Проверено 6 июня 2008 г.
- ^ Нейдерр, Д.; Ауди, Г.; Бек, Д.; Баум, К.; Бём, Ч.; Брайтенфельдт, М.; Чакирли, Р.Б.; Кастен, РФ; Джордж, С.; Херфурт, Ф.; Херлерт, А.; Келлербауэр, А.; Ковальска, М.; Ланни, Д.; Минайя-Рамирес, Э.; Наими, С.; Ной, Э.; Пенеску, Л.; Розенбуш, М.; Блэк, С.; Швейхард, Л.; Стора, Т. (19 марта 2009 г.). «Открытие 229 Rn и структура самых тяжелых изотопов Rn и Ra по результатам массовых измерений с помощью ловушки Пеннинга» (PDF) . Physical Review Letters . 102 (11): 112501–1–112501–5. Бибкод : 2009PhRvL.102k2501N . doi : 10.1103/PhysRevLett .102.112501 . ПМИД 19392194 .
- ^ «Основная схема распада уранового ряда» . Gulflink.osd.mil. Архивировано из оригинала 25 октября 2008 г. Проверено 12 сентября 2008 г.
- ^ Третьяк, В.И.; Здесенко, Ю.Г. (2002). «Таблицы данных двойного бета-распада — обновление». В. Данные Нукл. Таблицы данных . 80 (1): 83–116. Бибкод : 2002ADNDT..80...83T . дои : 10.1006/доп.2001.0873 .
- ^ «Зачем измерять RDP?» . Архивировано из оригинала 25 февраля 2015 г. Проверено 7 июля 2009 г.
- ^ Jump up to: а б с «Оценка Агентством по охране окружающей среды рисков, связанных с радоном в домах» (PDF) . Управление радиации и воздуха в помещениях, Агентство по охране окружающей среды США. Июнь 2003 г. Архивировано из оригинала (PDF) 27 февраля 2008 г.
- ^ Последствия воздействия радона на здоровье, Том 6 журнала BEIR (серия) . Издательство национальных академий. 1999. с. 179. ИСБН 978-0-309-05645-8 .
- ^ Jump up to: а б Резерфорд, Э.; Оуэнс, РБ (1899). «Торий и урановое излучение». Пер. Р. Сок. Может . 2 : 9–12. : «Излучение оксида тория не было постоянным, а изменялось самым причудливым образом», тогда как «Все соединения урана дают излучение, которое удивительно постоянно».
- ^ Партингтон-младший (1957). «Открытие радона» . Природа . 179 (4566): 912. Бибкод : 1957Natur.179..912P . дои : 10.1038/179912a0 . S2CID 4251991 .
- ^ «Хронология открытия элементов» . Компания «Нью-Йорк Таймс» . 2008. Архивировано из оригинала 8 февраля 2009 г. Проверено 28 февраля 2008 г.
- ^ Шюттманн, В. (1988). «История открытия радона». Isotopenpraxis Изотопы в исследованиях окружающей среды и здравоохранения (на немецком языке). 24 (4): 158. Бибкод : 1988IIEHS..24..158S . дои : 10.1080/10256018808623931 .
- ^ Бреннер, Дэвид Дж. (2000). «Резерфорд, Кюри и Радон». Медицинская физика . 27 (3): 618. Бибкод : 2000MedPh..27..618B . дои : 10.1118/1.598902 . ПМИД 10757614 .
- ^ Кюри, П.; Кюри, мадам Мария (1899). «О радиоактивности, вызываемой лучами Беккереля». Еженедельные отчеты сессий Академии наук (на французском языке). 129 :714–6.
- ^ Резерфорд, Э. (1900). «Радиоактивное вещество, выделяющееся из соединений тория» . Фил. Маг. 40 (296): 1–4. дои : 10.1080/14786440009463821 .
- ^ Дорн, Фридрих Эрнст (1900). «Об излучении радиоактивных веществ» (PDF) . Трактаты Общества естественных исследований Галле (на немецком языке). 22 . Штутгарт: 155.
- ^ Дорн, FE (1900). «Излучение радиоактивных веществ» (PDF) . Трактаты Общества естественных исследований Галле (на немецком языке). 23 :1–15.
- ^ Резерфорд, Э.; Брукс, ХТ (1901). «Новый газ из радия». Пер. Р. Сок. Может . 7 : 21–25.
- ^ Гизель, Фриц (1903). «О настуранном эманационном теле и о радие» . Химические отчеты (на немецком языке). 36 : 342. дои : 10.1002/cber.19030360177 .
- ^ Дебьерн, Андре-Луи (1903). «О наведенной радиоактивности, вызванной солями актиния» . Еженедельные отчеты сессий Академии наук (на французском языке). 136 :446.
- ^ Jump up to: а б Рамзи, сэр Уильям; Колли, Дж. Норман (1904). «Спектр эманации радия» . Труды Королевского общества . 73 (488–496): 470–476. дои : 10.1098/rspl.1904.0064 .
- ^ Шмидт, Курт (1918). «Периодическая система и генезис элементов» . Журнал неорганической и общей химии (на немецком языке). 103 :79–118. дои : 10.1002/zaac.19181030106 .
- ^ Перрен, Жан (1919). «Материя и свет. Очерк синтеза химической механики» . Анналы физики . IX (на французском языке). 11 :5–108. дои : 10.1051/anphys/191909110005 .
- ^ Адамс, Эллиот Куинси (1920). «Независимое происхождение актиния» . Журнал Американского химического общества . 42 (11): 2205. doi : 10.1021/ja01456a010 .
- ^ РВ Грей; У. Рамзи (1909). «Некоторые физические свойства эманации радия» . Дж. Хим. Соц. Пер. 1909 : 1073–1085. дои : 10.1039/CT9099501073 .
- ^ Рамзи, В.; Грей, Р.В. (1910). «Плотность эманации радия» . Еженедельные отчеты сессий Академии наук (на французском языке). 151 : 126–128.
- ^ Jump up to: а б Торнтон, Бретт Ф.; Бердетт, Шон К. (22 августа 2013 г.). «Вспоминая признание радона» . Природная химия . 5 (9): 804. Бибкод : 2013НатЧ...5..804Т . дои : 10.1038/nchem.1731 . ПМИД 23965684 .
- ^ Гросс, А.В. (1965). «Некоторые физические и химические свойства элемента 118 (Эка-Эм) и элемента 86 (Эм)». Журнал неорганической и ядерной химии . 27 (3): 509. doi : 10.1016/0022-1902(65)80255-X .
- ^ Филдс, Пол Р.; Штейн, Лоуренс; Зирин, Моше Х. (1962). «Радон Фторид». Дж. Ам. хим. Соц. 84 (21): 4164. doi : 10.1021/ja00880a048 .
- ^ Массе, Роланд (2002) Радон, исторические аспекты и восприятие риска . радон-франция.com.
- ^ Токсичность радона: кто находится в группе риска? , Агентство по регистрации токсичных веществ и заболеваний, 2000.
- ^ Проктор, Роберт Н. Нацистская война с раком . Издательство Принстонского университета, 2000 стр. 99. ISBN 0691070512 .
- ^ Эдельштейн, Майкл Р., Уильям Дж. Макофске. Смертельные дочери Радона: наука, экологическая политика и политика риска . Роуман и Литтлфилд, 1998, стр. 36–39. ISBN 0847683346 .
- ^ «Плакат, выпущенный Министерством здравоохранения Нью-Йорка (ок. 1981 г.)» . Ассоциированные университеты Ок-Риджа. 11 октября 2021 г. Проверено 11 октября 2021 г.
- ^ «Кольца и рак» . Время . 13 сентября 1968 г. Архивировано из оригинала 22 мая 2009 г. Проверено 5 мая 2009 г.
- ^ Самет, Дж. М. (1992). «Комнатный радон и рак легких. Оценка рисков» . Западный медицинский журнал . 156 (1): 25–9. ПМЦ 1003141 . ПМИД 1734594 .
- ^ Ямамото, М.; Сакагути, А.; Сасаки, К.; Хиросе, К.; Игараси, Ю.; Ким, К. (2006). «Радон». Журнал радиоактивности окружающей среды . 86 (1): 110–31. дои : 10.1016/j.jenvrad.2005.08.001 . ПМИД 16181712 .
- ^ Jump up to: а б «Радиационная защита: Радон» . Агентство по охране окружающей среды США . Ноябрь 2007 года . Проверено 17 апреля 2008 г.
- ^ Радон (Рн) . СЕА. 12 апреля 2005 г. (на французском языке)
- ^ «Данные об опасности для здоровья» (PDF) . Группа Линде . Архивировано из оригинала (PDF) 25 июня 2013 г.
- ^ «Ле Радон. Природный радиоактивный газ» (на французском языке). Архивировано из оригинала 13 января 2011 г. Проверено 7 июля 2009 г.
- ^ Jump up to: а б с Годиш, Тад (2001). Качество окружающей среды в помещении . ЦРК Пресс. ISBN 978-1-56670-402-1 .
- ^ Харли, Дж. Х. в Ричард Эдвард Стэнли; А. Алан Могисси (1975). Благородные газы . Агентство по охране окружающей среды США. п. 111.
- ^ Сперрин, Малькольм; Гиллмор, Гэвин; Денман, Тони (2001). «Вариации концентрации радона в скоплении пещер Мендип» . Экологический менеджмент и здоровье . 12 (5): 476. дои : 10.1108/09566160110404881 .
- ^ Jump up to: а б с Здроевич, Зигмунт; Стшельчик, Ядвига (Йоди) (2006). «Споры о лечении радоном, реакция на дозу» . Доза-реакция . 4 (2): 106–18. doi : 10.2203/dose-response.05-025.Zdrojewicz . ПМЦ 2477672 . ПМИД 18648641 .
- ^ Jump up to: а б с д Стек, диджей; Филд, RW; Линч, CF (1999). «Воздействие атмосферного радона» . Перспективы гигиены окружающей среды . 107 (2): 123–127. дои : 10.1289/ehp.99107123 . ПМК 1566320 . ПМИД 9924007 . S2CID 1767956 .
- ^ Филд, Р. Уильям. «Распространение радона и риск для здоровья» (PDF) . Департамент гигиены труда и окружающей среды, Университет Айовы. Архивировано из оригинала (PDF) 16 марта 2006 г. Проверено 2 февраля 2008 г.
- ^ «Клинические принципы курортологии и физической медицины» . Архивировано из оригинала 8 мая 2008 года . Проверено 7 июля 2009 г.
- ^ «Геология радона» . Геологическая служба США. Архивировано из оригинала 9 мая 2008 г. Проверено 28 июня 2008 г.
- ^ «Радон-222 как индикатор во взаимодействии грунтовых и поверхностных вод» (PDF) . Ланкастерский университет . Проверено 28 июня 2008 г.
- ^ Лоусон, С.; Фельдман, В.; Лоуренс, Д.; Мур, К.; Эльфик, Р.; Белиан, Р. (2005). «Недавнее выделение газа с поверхности Луны: спектрометр альфа-частиц Lunar Prospector» . Дж. Геофиз. Рез. 110 (E9): 1029. Бибкод : 2005JGRE..110.9009L . дои : 10.1029/2005JE002433 .
- ^ Jump up to: а б «Возможность повышенного уровня радиации в пропане» (PDF) . Национальный энергетический совет. Апрель 1994 года . Проверено 7 июля 2009 г.
- ^ Роуф, Сьюзен; Фуэнтес, Мануэль; Томас, Стефани (2007). Экодом: Руководство по проектированию . Эльзевир. п. 159. ИСБН 978-0-7506-6903-0 .
- ^ Многочисленные ссылки см., например, в «Анализ и моделирование распределения радона в помещениях с использованием теории экстремальных значений» или «Радон в помещениях в Венгрии» (логнормальный мистицизм) для обсуждения.
- ^ «Сбор данных и статистические расчеты» . Архивировано из оригинала 19 мая 2016 г. Проверено 7 июля 2009 г.
- ^ «Приложение E: Оценка источников и последствий радона в домах и на рабочих местах» (PDF) , Отчет Научного комитета Организации Объединенных Наций по действию атомной радиации (2006 г.) , том. 2, Организация Объединенных Наций, стр. 209–210, 2008 г. , получено 17 августа 2013 г.
- ^ Прайс, Филип Н.; Нерон, А.; Ревзан, К.; Апте, М.; Гельман А.; Боскардин, В. Джон. «Прогнозируемая средняя концентрация округа» . Национальная лаборатория Лоуренса Беркли. Архивировано из оригинала 31 декабря 2007 г. Проверено 12 февраля 2008 г.
- ^ Филд, Р. Уильям (2003). «Исследование радонового рака легких в Айове» . Департамент гигиены труда и окружающей среды, Университет Айовы.
- ^ «В офисе Мэллоу обнаружен рекордный уровень радона» . RTE.ie. 20 сентября 2007 г. Проверено 9 сентября 2018 г.
- ^ Физерстоун, Сара (10 марта 2021 г.). «Опасности радона — тест и руководство для арендодателей на 2021 год» . Проверено 16 мая 2021 г.
- ^ «Радон Производство» . Рн-радон.инфо. 24 июля 2007 г. Архивировано из оригинала 28 октября 2008 г. Проверено 30 января 2009 г.
- ^ «SRM 4972 – Эталон излучения радона-222» . Национальный институт стандартов и технологий . Проверено 26 июня 2008 г.
- ^ Колле, Р.; Р. Кишор (1997). «Обновленная информация о стандартном генераторе радона в воде NIST: его эффективность и долгосрочная стабильность» . Нукл. Инструмент. Методы Физ. Рез. А. 391 (3): 511–528. Бибкод : 1997NIMPA.391..511C . дои : 10.1016/S0168-9002(97)00572-X .
- ^ Закон о безопасности и гигиене труда в горнодобывающей промышленности – 30 CFR 57.0 . Правительство Соединенных Штатов. 1977. Архивировано из оригинала 5 августа 2014 г. Проверено 30 июля 2014 г.
- ^ Томас, Джон Дж.; Томас, Барбара Р.; Оверейндер, Хелен М. (27–30 сентября 1995 г.). Данные о концентрации радона в помещениях: его географическое и геологическое распределение на примере столичного округа штата Нью-Йорк (PDF) . Международный симпозиум по радону . Нэшвилл, Теннесси: Американская ассоциация ученых и технологов по радону . Проверено 28 ноября 2012 г.
- ^ Упфал, Марк Дж.; Джонсон, Кристина (2003). «Жилой Радон, 65» (PDF) . В Гринберге, Майкл И.; Гамильтон, Ричард Дж.; Филлипс, Скотт Д.; NN, Гейла Дж. (ред.). Профессиональная, промышленная и экологическая токсикология (2-е изд.). Сент-Луис, Миссури: Мосби. ISBN 9780323013406 . Архивировано из оригинала (PDF) 14 мая 2013 г. Проверено 28 ноября 2012 г.
- ^ Токсикологический профиль радона , Таблица 4-2 (Кейт С., Дойл Дж. Р., Харпер К. и др. Токсикологический профиль радона. Атланта (Джорджия): Агентство по регистрации токсичных веществ и заболеваний (США); 4 мая 2012 г. , ХИМИЧЕСКАЯ, ФИЗИЧЕСКАЯ И РАДИОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ.) Проверено 6 июня 2015 г.
- ^ Клиника, Том 34 . Гомеопатическая медицинская ассоциация Иллинойса. 1913 год . Проверено 30 июня 2011 г.
- ^ Jump up to: а б «Семена радона» . Проверено 5 мая 2009 г.
- ^ «Радоновые шахты: Боулдер и Бассейн, Монтана» . Придорожная Америка . Проверено 4 декабря 2007 г.
- ^ Jump up to: а б Неда, Т.; Сакач, А.; Мочи, И.; Косма, К. (2008). «Уровни концентрации радона в сухих выбросах CO 2 из Харгита-Бай, Румыния, используемых в лечебных целях». Журнал радиоаналитической и ядерной химии . 277 (3): 685. дои : 10.1007/s10967-007-7169-0 . S2CID 97610571 .
- ^ Салак, Кара; Нордеман, Лэндон (2004). «59631: Добыча чудес» . Нэшнл Географик . Архивировано из оригинала 24 января 2008 года . Проверено 26 июня 2008 г.
- ^ «Для этого здорового сияния пейте радиацию!» . Популярная наука . 18 августа 2004 г. Проверено 17 сентября 2022 г.
- ^ «Яхимов» . Петрос. Архивировано из оригинала 7 января 2002 года . Проверено 26 июня 2008 г.
- ^ Ришон, П.; Ю. Клингер; П. Таппонье; С.-Х. Ли; Дж. Ван дер Вёрд и Ф. Перье (2010). «Измерение потока радона через активные разломы: актуальность раскопок и возможность спутниковых сбросов» (PDF) . Радиат. Измер. 45 (2): 211–218. Бибкод : 2010РадМ...45..211Р . дои : 10.1016/j.radmeas.2010.01.019 . hdl : 10356/101845 . Архивировано из оригинала (PDF) 26 июня 2013 г. Проверено 20 августа 2011 г.
- ^ Семприни, Льюис; Крюгер, Пол (апрель 1980 г.). Радоновый трансектальный анализ в геотермальных резервуарах . Калифорнийское региональное собрание SPE, 9–11 апреля, Лос-Анджелес, Калифорния. дои : 10.2118/8890-MS . ISBN 978-1-55563-700-2 .
- ^ Игараси, Г.; Вакита, Х. (1995). «Геохимические и гидрологические наблюдения для прогноза землетрясений в Японии» . Журнал физики Земли . 43 (5): 585–598. дои : 10.4294/jpe1952.43.585 .
- ^ Вакита, Х., (1996). Химия землетрясений II, сборник статей, изд., Том. II, Лаборатория химии землетрясений, факультет естественных наук, Токийский университет, Япония.
- ^ Jump up to: а б Ришон, П.; Сабру, Ж.-К.; Хальбвакс, М.; Вандемельбрук, Дж.; Пуссельг, Н.; Таббаг, Дж.; Пунонгбаян, Р. (2003). «Радоновая аномалия в почве вулкана Таал, Филиппины: вероятный предвестник землетрясения М 7,1 Миндоро (1994 г.)». Письма о геофизических исследованиях . 30 (9): 34. Бибкод : 2003GeoRL..30.1481R . дои : 10.1029/2003GL016902 . S2CID 140597510 .
- ^ Котерн, К.Ричард; Смит, Джеймс Э., ред. (1987). Экологический радон . Исследования в области экологических наук. Том. 35. Нью-Йорк: Springer Science & Business Media. п. 53. ИСБН 978-0-306-42707-7 .
- ^ «Эксперт: Трудно предсказать землетрясения» . NPR.org . Проверено 5 мая 2009 г.
- ^ «Журнал EARTH: Прогноз землетрясения: ушло и снова» . 05.01.2012.
- ^ «Радон и радиоактивные материалы природного происхождения (НОРМ), связанные с геотермальными системами Хот-Рок» (PDF) . Правительство Южной Австралии — Primary Industries and Resources SA. Архивировано из оригинала (PDF) 2 апреля 2012 г. Проверено 16 июля 2013 г.
- ^ Доусон, JAT (1946). «Радон. Его свойства и подготовка к промышленной радиографии». Журнал научных инструментов . 23 (7): 138. Бибкод : 1946JScI...23..138D . дои : 10.1088/0950-7671/23/7/301 .
- ^ Моррисон, А. (1945). «Использование радона для промышленной радиографии». Канадский журнал исследований . 23е (6): 413–419. дои : 10.1139/cjr45f-044 . ПМИД 21010538 .
- ^ «Известные и вероятные канцерогены» . Американское онкологическое общество . Архивировано из оригинала 13 декабря 2003 г. Проверено 26 июня 2008 г.
- ^ Молд, Ричард Фрэнсис (1993). Век рентгеновских лучей и радиоактивности в медицине . ЦРК Пресс. ISBN 978-0-7503-0224-1 .
- ^ «Рак урановых шахтеров» . Время . 1960-12-26. ISSN 0040-781X . Архивировано из оригинала 15 января 2009 года . Проверено 26 июня 2008 г.
- ^ Тирмарш М.; Лорье Д.; Миттон Н.; Гелас Дж. М. «Риск рака легких, связанный с низким уровнем хронического воздействия радона: результаты исследования группы французских горнодобывающих компаний и Европейского проекта» (PDF) . Проверено 7 июля 2009 г.
- ^ Роско, Р.Дж.; Стинленд, К.; Гальперин, МЫ; Бомонт, Джей-Джей; Ваксвейлер, Р.Дж. (4 августа 1989 г.). «Смертность от рака легких среди некурящих шахтеров урана, подвергшихся воздействию радона». Журнал Американской медицинской ассоциации . 262 (5): 629–633. дои : 10.1001/jama.1989.03430050045024 . ПМИД 2746814 .
- ^ Вудворд, Алистер; Родер, Дэвид; МакМайкл, Энтони Дж.; Крауч, Филип; Милваганам, Арул (1 июля 1991 г.). «Облучение дочери радона на урановом руднике Радиум-Хилл и уровень рака легких среди бывших рабочих, 1952–87». Причины рака и борьба с ним . 2 (4): 213–220. дои : 10.1007/BF00052136 . JSTOR 3553403 . ПМИД 1873450 . S2CID 9664907 .
- ^ «Газ радон на урановых рудниках опасен для здоровья (1952 г.)» . Солт-Лейк-Трибьюн . 27 сентября 1952 г. с. 13 . Проверено 22 декабря 2015 г.
- ^ «Реклама о пользе для здоровья на шахтах по добыче радона (1953 г.)» . Грили Дейли Трибьюн . 27 марта 1953 г. с. 4 . Проверено 22 декабря 2015 г.
- ^ «Вырезка из газеты Montana Standard» . Газеты.com . Проверено 22 декабря 2015 г.
- ^ «Правительство запрещает рекламу шахты Боулдер о пользе радона для здоровья (1975)» . Газеты.com . Проверено 22 декабря 2015 г.
- ^ Jump up to: а б с Дарби, С.; Хилл, Д.; Долл, Р. (2005). «Радон: вероятный канцероген при любом воздействии» . Анналы онкологии . 12 (10): 1341–1351. дои : 10.1023/А:1012518223463 . ПМИД 11762803 .
- ^ «Отчет НКДАР ООН за 2006 год, том I» . Научный комитет Организации Объединенных Наций по действию атомной радиации. Отчет НКДАР ООН за 2006 год Генеральной Ассамблее с научными приложениями.
- ^ Шлегер, М.; Муртазаев, К.; Рахматулоев Б.; Зорий, П.; Хеуэль-Фабианек, Б. (2016). «Выбросы радона из уранового хвостохранилища Дигмай, Таджикистан» (PDF) . Радиация и ее применение . 1 : 222–228. дои : 10.21175/RadJ.2016.03.041 .
- ^ Рерича, В.; Кулич, М.; Рерича, Р.; Шор, ДЛ; Сэндлер, ДП (2007). «Заболеваемость лейкемией, лимфомой и множественной миеломой у чешских уранодобытчиков: когортное исследование» . Перспективы гигиены окружающей среды . 114 (6): 818–822. дои : 10.1289/ehp.8476 . ПМК 1480508 . ПМИД 16759978 .
- ^ «Краткие факты» . www.census.gov . Бюро переписи населения США . 01.07.2022 . Проверено 08 марта 2023 г.
- ^ «Драгоценный газ в Словении является причиной 120 смертей каждый год» . www.24ur.com (на словенском языке) . Проверено 2 ноября 2021 г.
- ^ «Население Словении, 1 января 2021» . www.stat.si. Статистическое управление Республики Словения (Источник: SURS). 01.01.2021. Архивировано из оригинала 11 января 2022 г. Проверено 08 марта 2023 г.
- ^ Снижение риска рака в окружающей среде – что мы можем сделать сейчас . Министерство здравоохранения и социальных служб США. Годовой отчет за 2008–2009 гг.
- ^ Форнальски, КВ; Адамс, Р.; Эллисон, В.; Коррис, Ле; Каттлер, Дж. М.; Дэйви, Ч.; Добжинский, Л.; Эспозито, виджей; Файнендеген, LE; Гомес, Л.С.; Льюис, П.; Ман, Дж.; Миллер, ML; Пеннингтон, Ч. В.; Сакс, Б.; Суто, С.; Валлийский, Дж.С. (2015). «Предположение о риске рака, вызванного радоном». Причины рака и борьба с ним . 10 (26): 1517–18. дои : 10.1007/s10552-015-0638-9 . ПМИД 26223888 . S2CID 15952263 .
- ^ Беккер, К. (2003). «Влияние на здоровье среды с высоким содержанием радона в Центральной Европе: еще одна проверка гипотезы LNT?» . Нелинейность в биологии, токсикологии и медицине . 1 (1): 3–35. дои : 10.1080/15401420390844447 . ПМК 2651614 . ПМИД 19330110 .
- ^ Коэн Б.Л. (1995). «Тестирование линейной беспороговой теории радиационного канцерогенеза для вдыхаемых продуктов распада радона» (PDF) . Физика здоровья . 68 (2): 157–74. дои : 10.1097/00004032-199502000-00002 . ПМИД 7814250 . S2CID 41388715 .
- ^ Томпсон, Ричард Э.; Нельсон, Дональд Ф.; Попкин, Джоэл Х.; Попкин, Зенаида (2008). «Исследование «случай-контроль» риска рака легких в результате воздействия радона в жилых помещениях в округе Вустер, штат Массачусетс». Физика здоровья . 94 (3): 228–41. дои : 10.1097/01.HP.0000288561.53790.5f . ПМИД 18301096 . S2CID 21134066 .
- ^ «Слайд-шоу: 10 вещей, которые, о которых вы никогда не знали, могут вызвать рак легких» . ВебМД . Проверено 05 декабря 2020 г.
- ^ Кателинуа О.; Рогель А.; Лорье Д.; Биллон, Соленн; Хемон, Денис; Верже, Пьер; Тирмарш, Марго (2006). «Рак легких, вызванный воздействием радона в помещениях во Франции: влияние моделей риска и анализ неопределенности» . Перспективы гигиены окружающей среды . 114 (9): 1361–1366. дои : 10.1289/ehp.9070 . ПМК 1570096 . ПМИД 16966089 .
- ^ Стефани Герл, Оливер Майзенберг, Питер Файстенауэр, Йохен Чирш: Измерения Торона и потомства Торона в немецких глиняных домах. Дозиметрия радиационной защиты 160, 2014, стр. 160-163.
- ^ Справочник ВОЗ по радону в помещениях . Всемирная организация здравоохранения.
- ^ «Уровни радона в жилищах: информационный бюллетень 4.6» (PDF) . Европейская информационная система по окружающей среде и здоровью. Декабрь 2009 года . Проверено 16 июля 2013 г.
- ^ «HPA выпускает новые рекомендации по радону» . Агентство по охране здоровья Великобритании . Июль 2010 г. Архивировано из оригинала 14 июля 2010 г. Проверено 13 августа 2010 г.
- ^ «Меры по снижению радона» . DSA (на норвежском языке) . Проверено 12 июля 2021 г.
- ^ «Стратегия снижения воздействия радона в Норвегии, 2010 г.» (PDF) . Архивировано из оригинала (PDF) 20 ноября 2021 года . Проверено 14 марта 2023 г.
- ^ «Каковы факторы риска рака легких?» . Центры по контролю и профилактике заболеваний . 18 сентября 2019 г. Проверено 3 мая 2020 г.
- ^ Jump up to: а б с Дарби, С.; Хилл, Д.; Аувинен, А.; Баррос-Диос, Ж.М.; Байссон, Х.; Бокиккио, Ф.; Део, Х.; Фальк, Р.; Форастьер, Ф.; Хакама, М.; Хейд, И.; Крайенброк, Л.; Кройцер, М.; Лагард, Ф.; Мякеляйнен, И.; Мюрхед, К.; Оберайнер, В.; Першаген, Г.; Руано-Равина, А.; Руостенойя, Э.; Росарио, А. Шаффрат; Тирмарш, М.; Томашек Л.; Уитли, Э.; Вихманн, Х.-Э.; Долл, Р. (2005). «Радон в домах и риск рака легких: совместный анализ отдельных данных 13 европейских исследований методом случай-контроль» . БМЖ . 330 (7485): 223. doi : 10.1136/bmj.38308.477650.63 . ПМК 546066 . ПМИД 15613366 .
- ^ Филд, Р. Уильям (4 декабря 2008 г.). «Президентская комиссия по раку, Факторы окружающей среды при раке: радон» (PDF) . Чарльстон, Южная Каролина: Американская ассоциация ученых и технологов по радону (AARST). Архивировано из оригинала (PDF) 29 августа 2013 г.
- ^ Кауфман, Эл; Джейкобсон, Дж. С.; Хершман, Д.Л.; Десаи, М.; Нойгут, А.И. (2008). «Влияние лучевой терапии рака молочной железы и курения сигарет на риск вторичного первичного рака легких» . Журнал клинической онкологии . 26 (3): 392–398. дои : 10.1200/JCO.2007.13.3033 . ПМИД 18202415 .
- ^ Дауэр, LT; Брукс, Алабама; Хоэл, генеральный директор; Морган, ВФ; Стрэм, Д.; Тран, П. (2010). «Обзор и оценка обновленных исследований последствий для здоровья, связанных с низкими дозами ионизирующего излучения». Радиационная защита Дозиметрия . 140 (2): 103–136. дои : 10.1093/rpd/ncq141 . ПМИД 20413418 .
- ^ Лагард, Ф.; Аксельссон, Г.; Дамбер, Л.; Мелландер, Х.; Нюберг, Ф.; Першаген, Г. (2001). «Жилой радон и рак легких среди никогда не куривших в Швеции» . Эпидемиология . 12 (4): 396–404. дои : 10.1097/00001648-200107000-00009 . JSTOR 3703373 . ПМИД 11416777 . S2CID 25719502 .
- ^ Оценка риска содержания радона в питьевой воде . Нап.еду (01.06.2003). Проверено 20 августа 2011 г.
- ^ «Основные сведения о радоне в питьевой воде» . Проверено 24 июля 2013 г.
- ^ Jump up to: а б Уилкенинг, Марвин Х.; Клементс, Уильям Э. (1975). «Радон 222 с поверхности океана» . Журнал геофизических исследований . 80 (27): 3828–3830. Бибкод : 1975JGR....80.3828W . дои : 10.1029/JC080i027p03828 .
- ^ Бэйс, Фред. «Ответ на вопрос № 10299 отправлен в программу «Спросите экспертов» » . Общество физики здоровья . Проверено 19 мая 2016 г.
- ^ Всемирная организация здравоохранения . «Радон и рак, информационный бюллетень 291» .
- ^ Jump up to: а б «Руководство для потребителей по снижению уровня радона: как отремонтировать свой дом» . Агентство по охране окружающей среды . Проверено 3 апреля 2010 г.
- ^ Создание радона: пошаговое руководство по строительству радоностойких домов . Издательство ДИАНА. п. 46. ИСБН 978-1-4289-0070-7 .
Внешние ссылки
[ редактировать ]- Радон в Агентстве по охране окружающей среды США
- Службы национальной радоновой программы , организованные Университетом штата Канзас
- Карты радона Великобритании
- Информация о радоне от Службы общественного здравоохранения Англии
- Радон в Периодической таблице видео (Ноттингемский университет)
- Радон и здоровье легких от Американской ассоциации легких
- Влияние радона на ваше здоровье – Ассоциация легких
- Геология радона , Джеймс К. Оттон, Линда К.С. Гундерсен и Р. Рэндалл Шуман.
- Руководство для покупателя и продавца жилья по радону Статья Международной ассоциации сертифицированных жилищных инспекторов ( InterNACHI )
- Токсикологический профиль радона , проект для общественного обсуждения, Агентство по регистрации токсичных веществ и заболеваний, сентябрь 2008 г.
- Последствия воздействия радона на здоровье : BEIR VI. Комитет по рискам воздействия радона для здоровья (BEIR VI), Национальный исследовательский совет, доступен онлайн.
- Доклад НКДАР ООН за 2000 год Генеральной Ассамблее с научными приложениями: Приложение B: Воздействие естественных источников радиации.
- Стоит ли измерять концентрацию радона в доме? , Филип Н. Прайс, Эндрю Гельман , в «Статистика: Путеводитель по неизведанному» , январь 2004 г.
- Радон в доме – невидимый убийца Насколько серьезным может быть высокий уровень радона в доме? Кевин Витали






