Масс-спектрометрия
Масс-спектрометрия ( МС используется для измерения отношения массы к заряду ионов ) — это аналитический метод, который . Результаты представлены в виде масс-спектра — графика зависимости интенсивности от отношения массы к заряду. Масс-спектрометрия используется во многих различных областях и применяется как к чистым образцам, так и к сложным смесям.
Масс-спектр — это тип графика ионного сигнала как функции отношения массы к заряду. Эти спектры используются для определения элементной или изотопной подписи образца, массы частиц и молекул , а также для выяснения химической идентичности или структуры молекул и других химических соединений .
В типичной процедуре МС образец, который может быть твердым, жидким или газообразным, ионизируется , например, бомбардируя его пучком электронов . Это может привести к тому, что некоторые молекулы образца распадутся на положительно заряженные фрагменты или просто станут положительно заряженными без фрагментации. Эти ионы (фрагменты) затем разделяются в соответствии с их отношением массы к заряду, например, путем их ускорения и воздействия на них электрического или магнитного поля: ионы с одинаковым соотношением массы к заряду будут подвергаться одинаковому отклонению. . [ 1 ] Ионы обнаруживаются с помощью механизма, способного обнаруживать заряженные частицы, такого как электронный умножитель . Результаты отображаются в виде спектров интенсивности сигнала обнаруженных ионов в зависимости от отношения массы к заряду. Атомы . или молекулы в образце можно идентифицировать путем сопоставления известных масс (например, всей молекулы) с идентифицированными массами или посредством характерного рисунка фрагментации
History of the mass spectrometer
[edit]
In 1886, Eugen Goldstein observed rays in gas discharges under low pressure that traveled away from the anode and through channels in a perforated cathode, opposite to the direction of negatively charged cathode rays (which travel from cathode to anode). Goldstein called these positively charged anode rays "Kanalstrahlen"; the standard translation of this term into English is "canal rays". Wilhelm Wien found that strong electric or magnetic fields deflected the canal rays and, in 1899, constructed a device with perpendicular electric and magnetic fields that separated the positive rays according to their charge-to-mass ratio (Q/m). Wien found that the charge-to-mass ratio depended on the nature of the gas in the discharge tube. English scientist J. J. Thomson later improved on the work of Wien by reducing the pressure to create the mass spectrograph.

The word spectrograph had become part of the international scientific vocabulary by 1884.[2][3] Early spectrometry devices that measured the mass-to-charge ratio of ions were called mass spectrographs which consisted of instruments that recorded a spectrum of mass values on a photographic plate.[4][5] A mass spectroscope is similar to a mass spectrograph except that the beam of ions is directed onto a phosphor screen.[6] A mass spectroscope configuration was used in early instruments when it was desired that the effects of adjustments be quickly observed. Once the instrument was properly adjusted, a photographic plate was inserted and exposed. The term mass spectroscope continued to be used even though the direct illumination of a phosphor screen was replaced by indirect measurements with an oscilloscope.[7] The use of the term mass spectroscopy is now discouraged due to the possibility of confusion with light spectroscopy.[1][8] Mass spectrometry is often abbreviated as mass-spec or simply as MS.[1]
Modern techniques of mass spectrometry were devised by Arthur Jeffrey Dempster and F.W. Aston in 1918 and 1919 respectively.
Sector mass spectrometers known as calutrons were developed by Ernest O. Lawrence and used for separating the isotopes of uranium during the Manhattan Project.[9] Calutron mass spectrometers were used for uranium enrichment at the Oak Ridge, Tennessee Y-12 plant established during World War II.
In 1989, half of the Nobel Prize in Physics was awarded to Hans Dehmelt and Wolfgang Paul for the development of the ion trap technique in the 1950s and 1960s.
In 2002, the Nobel Prize in Chemistry was awarded to John Bennett Fenn for the development of electrospray ionization (ESI) and Koichi Tanaka for the development of soft laser desorption (SLD) and their application to the ionization of biological macromolecules, especially proteins.[10]
Parts of a mass spectrometer
[edit]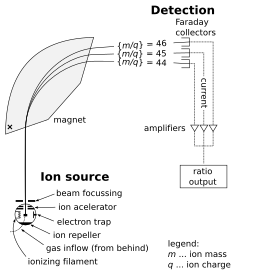
A mass spectrometer consists of three components: an ion source, a mass analyzer, and a detector. The ionizer converts a portion of the sample into ions. There is a wide variety of ionization techniques, depending on the phase (solid, liquid, gas) of the sample and the efficiency of various ionization mechanisms for the unknown species. An extraction system removes ions from the sample, which are then targeted through the mass analyzer and into the detector. The differences in masses of the fragments allows the mass analyzer to sort the ions by their mass-to-charge ratio. The detector measures the value of an indicator quantity and thus provides data for calculating the abundances of each ion present. Some detectors also give spatial information, e.g., a multichannel plate.
Theoretical example
[edit]The following describes the operation of a spectrometer mass analyzer, which is of the sector type. (Other analyzer types are treated below.) Consider a sample of sodium chloride (table salt). In the ion source, the sample is vaporized (turned into gas) and ionized (transformed into electrically charged particles) into sodium (Na+) and chloride (Cl−) ions. Sodium atoms and ions are monoisotopic, with a mass of about 23 daltons (symbol: Da or older symbol: u). Chloride atoms and ions come in two stable isotopes with masses of approximately 35 u (at a natural abundance of about 75 percent) and approximately 37 u (at a natural abundance of about 25 percent). The analyzer part of the spectrometer contains electric and magnetic fields, which exert forces on ions traveling through these fields. The speed of a charged particle may be increased or decreased while passing through the electric field, and its direction may be altered by the magnetic field. The magnitude of the deflection of the moving ion's trajectory depends on its mass-to-charge ratio. Lighter ions are deflected by the magnetic force to a greater degree than heavier ions (based on Newton's second law of motion, F = ma). The streams of magnetically sorted ions pass from the analyzer to the detector, which records the relative abundance of each ion type. This information is used to determine the chemical element composition of the original sample (i.e. that both sodium and chlorine are present in the sample) and the isotopic composition of its constituents (the ratio of 35Cl to 37Cl).
Creating ions
[edit]
The ion source is the part of the mass spectrometer that ionizes the material under analysis (the analyte). The ions are then transported by magnetic or electric fields to the mass analyzer.
Techniques for ionization have been key to determining what types of samples can be analyzed by mass spectrometry. Electron ionization and chemical ionization are used for gases and vapors. In chemical ionization sources, the analyte is ionized by chemical ion-molecule reactions during collisions in the source. Two techniques often used with liquid and solid biological samples include electrospray ionization (invented by John Fenn[11]) and matrix-assisted laser desorption/ionization (MALDI, initially developed as a similar technique "Soft Laser Desorption (SLD)" by K. Tanaka[12] for which a Nobel Prize was awarded and as MALDI by M. Karas and F. Hillenkamp[13]).
Hard ionization and soft ionization
[edit]
In mass spectrometry, ionization refers to the production of gas phase ions suitable for resolution in the mass analyser or mass filter. Ionization occurs in the ion source. There are several ion sources available; each has advantages and disadvantages for particular applications. For example, electron ionization (EI) gives a high degree of fragmentation, yielding highly detailed mass spectra which when skilfully analysed can provide important information for structural elucidation/characterisation and facilitate identification of unknown compounds by comparison to mass spectral libraries obtained under identical operating conditions. However, EI is not suitable for coupling to HPLC, i.e. LC-MS, since at atmospheric pressure, the filaments used to generate electrons burn out rapidly. Thus EI is coupled predominantly with GC, i.e. GC-MS, where the entire system is under high vacuum.
Hard ionization techniques are processes which impart high quantities of residual energy in the subject molecule invoking large degrees of fragmentation (i.e. the systematic rupturing of bonds acts to remove the excess energy, restoring stability to the resulting ion). Resultant ions tend to have m/z lower than the molecular ion (other than in the case of proton transfer and not including isotope peaks). The most common example of hard ionization is electron ionization (EI).
Soft ionization refers to the processes which impart little residual energy onto the subject molecule and as such result in little fragmentation. Examples include fast atom bombardment (FAB), chemical ionization (CI), atmospheric-pressure chemical ionization (APCI), atmospheric-pressure photoionization (APPI), electrospray ionization (ESI), desorption electrospray ionization (DESI), and matrix-assisted laser desorption/ionization (MALDI).
Inductively coupled plasma
[edit]
Inductively coupled plasma (ICP) sources are used primarily for cation analysis of a wide array of sample types. In this source, a plasma that is electrically neutral overall, but that has had a substantial fraction of its atoms ionized by high temperature, is used to atomize introduced sample molecules and to further strip the outer electrons from those atoms. The plasma is usually generated from argon gas, since the first ionization energy of argon atoms is higher than the first of any other elements except He, F and Ne, but lower than the second ionization energy of all except the most electropositive metals. The heating is achieved by a radio-frequency current passed through a coil surrounding the plasma.
Photoionization mass spectrometry
[edit]Photoionization can be used in experiments which seek to use mass spectrometry as a means of resolving chemical kinetics mechanisms and isomeric product branching.[14] In such instances a high energy photon, either X-ray or uv, is used to dissociate stable gaseous molecules in a carrier gas of He or Ar. In instances where a synchrotron light source is utilized, a tuneable photon energy can be utilized to acquire a photoionization efficiency curve which can be used in conjunction with the charge ratio m/z to fingerprint molecular and ionic species. More recently atmospheric pressure photoionization (APPI) has been developed to ionize molecules mostly as effluents of LC-MS systems.
Ambient ionization
[edit]Some applications for ambient ionization include environmental applications as well as clinical applications. In these techniques, ions form in an ion source outside the mass spectrometer. Sampling becomes easy as the samples don't need previous separation nor preparation. Some examples of ambient ionization techniques are Direct Analysis in Real Time (DART),DESI, SESI, LAESI, desorption atmospheric-pressure chemical ionization (DAPCI), and desorption atmospheric pressure photoionization DAPPI among others.
Other ionization techniques
[edit]Others include glow discharge, field desorption (FD), fast atom bombardment (FAB), thermospray, desorption/ionization on silicon (DIOS), atmospheric pressure chemical ionization (APCI), secondary ion mass spectrometry (SIMS), spark ionization and thermal ionization (TIMS).[15]
Mass selection
[edit]Mass analyzers separate the ions according to their mass-to-charge ratio. The following two laws govern the dynamics of charged particles in electric and magnetic fields in vacuum:
- (Newton's second law of motion in the non-relativistic case, i.e. valid only at ion velocity much lower than the speed of light).
Here F is the force applied to the ion, m is the mass of the ion, a is the acceleration, Q is the ion charge, E is the electric field, and v × B is the vector cross product of the ion velocity and the magnetic field
Equating the above expressions for the force applied to the ion yields:
This differential equation is the classic equation of motion for charged particles. Together with the particle's initial conditions, it completely determines the particle's motion in space and time in terms of m/Q. Thus mass spectrometers could be thought of as "mass-to-charge spectrometers". When presenting data, it is common to use the (officially) dimensionless m/z, where z is the number of elementary charges (e) on the ion (z=Q/e). This quantity, although it is informally called the mass-to-charge ratio, more accurately speaking represents the ratio of the mass number and the charge number, z.
There are many types of mass analyzers, using either static or dynamic fields, and magnetic or electric fields, but all operate according to the above differential equation. Each analyzer type has its strengths and weaknesses. Many mass spectrometers use two or more mass analyzers for tandem mass spectrometry (MS/MS). In addition to the more common mass analyzers listed below, there are others designed for special situations.
There are several important analyzer characteristics. The mass resolving power is the measure of the ability to distinguish two peaks of slightly different m/z. The mass accuracy is the ratio of the m/z measurement error to the true m/z. Mass accuracy is usually measured in ppm or milli mass units. The mass range is the range of m/z amenable to analysis by a given analyzer. The linear dynamic range is the range over which ion signal is linear with analyte concentration. Speed refers to the time frame of the experiment and ultimately is used to determine the number of spectra per unit time that can be generated.
Sector instruments
[edit]
A sector field mass analyzer uses a static electric and/or magnetic field to affect the path and/or velocity of the charged particles in some way. As shown above, sector instruments bend the trajectories of the ions as they pass through the mass analyzer, according to their mass-to-charge ratios, deflecting the more charged and faster-moving, lighter ions more. The analyzer can be used to select a narrow range of m/z or to scan through a range of m/z to catalog the ions present.[16]
Time-of-flight
[edit]The time-of-flight (TOF) analyzer uses an electric field to accelerate the ions through the same potential, and then measures the time they take to reach the detector. If the particles all have the same charge, their kinetic energies will be identical, and their velocities will depend only on their masses. For example, ions with a lower mass will travel faster, reaching the detector first.[17] Ions usually are moving prior to being accelerated by the electric field, this causes particles with the same m/z to arrive at different times at the detector. This difference in initial velocities is often not dependent on the mass of the ion, and will turn into a difference in the final velocity. This distribution in velocities broadens the peaks shown on the count vs m/z plot, but will generally not change the central location of the peaks, since the starting velocity of ions is generally centered at zero. To fix this problem, time-lag focusing/delayed extraction has been coupled with TOF-MS.[18]
Quadrupole mass filter
[edit]Quadrupole mass analyzers use oscillating electrical fields to selectively stabilize or destabilize the paths of ions passing through a radio frequency (RF) quadrupole field created between four parallel rods. Only the ions in a certain range of mass/charge ratio are passed through the system at any time, but changes to the potentials on the rods allow a wide range of m/z values to be swept rapidly, either continuously or in a succession of discrete hops. A quadrupole mass analyzer acts as a mass-selective filter and is closely related to the quadrupole ion trap, particularly the linear quadrupole ion trap except that it is designed to pass the untrapped ions rather than collect the trapped ones, and is for that reason referred to as a transmission quadrupole. A magnetically enhanced quadrupole mass analyzer includes the addition of a magnetic field, either applied axially or transversely. This novel type of instrument leads to an additional performance enhancement in terms of resolution and/or sensitivity depending upon the magnitude and orientation of the applied magnetic field.[19][20] A common variation of the transmission quadrupole is the triple quadrupole mass spectrometer. The "triple quad" has three consecutive quadrupole stages, the first acting as a mass filter to transmit a particular incoming ion to the second quadrupole, a collision chamber, wherein that ion can be broken into fragments. The third quadrupole also acts as a mass filter, to transmit a particular fragment ion to the detector. If a quadrupole is made to rapidly and repetitively cycle through a range of mass filter settings, full spectra can be reported. Likewise, a triple quad can be made to perform various scan types characteristic of tandem mass spectrometry.
Ion traps
[edit]Three-dimensional quadrupole ion trap
[edit]The quadrupole ion trap works on the same physical principles as the quadrupole mass analyzer, but the ions are trapped and sequentially ejected. Ions are trapped in a mainly quadrupole RF field, in a space defined by a ring electrode (usually connected to the main RF potential) between two endcap electrodes (typically connected to DC or auxiliary AC potentials). The sample is ionized either internally (e.g. with an electron or laser beam), or externally, in which case the ions are often introduced through an aperture in an endcap electrode.
There are many mass/charge separation and isolation methods but the most commonly used is the mass instability mode in which the RF potential is ramped so that the orbit of ions with a mass a > b are stable while ions with mass b become unstable and are ejected on the z-axis onto a detector. There are also non-destructive analysis methods.
Ions may also be ejected by the resonance excitation method, whereby a supplemental oscillatory excitation voltage is applied to the endcap electrodes, and the trapping voltage amplitude and/or excitation voltage frequency is varied to bring ions into a resonance condition in order of their mass/charge ratio.[21][22]
Cylindrical ion trap
[edit]The cylindrical ion trap mass spectrometer (CIT) is a derivative of the quadrupole ion trap where the electrodes are formed from flat rings rather than hyperbolic shaped electrodes. The architecture lends itself well to miniaturization because as the size of a trap is reduced, the shape of the electric field near the center of the trap, the region where the ions are trapped, forms a shape similar to that of a hyperbolic trap.
Linear quadrupole ion trap
[edit]A linear quadrupole ion trap is similar to a quadrupole ion trap, but it traps ions in a two dimensional quadrupole field, instead of a three-dimensional quadrupole field as in a 3D quadrupole ion trap. Thermo Fisher's LTQ ("linear trap quadrupole") is an example of the linear ion trap.[23]
A toroidal ion trap can be visualized as a linear quadrupole curved around and connected at the ends or as a cross-section of a 3D ion trap rotated on edge to form the toroid, donut-shaped trap. The trap can store large volumes of ions by distributing them throughout the ring-like trap structure. This toroidal shaped trap is a configuration that allows the increased miniaturization of an ion trap mass analyzer. Additionally, all ions are stored in the same trapping field and ejected together simplifying detection that can be complicated with array configurations due to variations in detector alignment and machining of the arrays.[24]
As with the toroidal trap, linear traps and 3D quadrupole ion traps are the most commonly miniaturized mass analyzers due to their high sensitivity, tolerance for mTorr pressure, and capabilities for single analyzer tandem mass spectrometry (e.g. product ion scans).[25]
Orbitrap
[edit]
Приборы с орбитальной ловушкой аналогичны масс-спектрометрам ионного циклотронного резонанса с Фурье-преобразованием (см. текст ниже). Ионы электростатически захватываются на орбите вокруг центрального электрода веретенообразной формы. Электрод удерживает ионы так, что они вращаются вокруг центрального электрода и колеблются вперед и назад вдоль длинной оси центрального электрода. Это колебание генерирует ток изображения в пластинах детектора, который регистрируется прибором. Частоты этих токов изображения зависят от отношения массы к заряду ионов. Масс-спектры получены путем преобразования Фурье токов записанного изображения.
Орбитальные ловушки обладают высокой точностью определения массы, высокой чувствительностью и хорошим динамическим диапазоном. [ 26 ]
Ионный циклотронный резонанс с преобразованием Фурье
[ редактировать ]
Масс-спектрометрия с преобразованием Фурье (FTMS), или, точнее, МС ионного циклотронного резонанса с преобразованием Фурье , измеряет массу путем обнаружения тока изображения , создаваемого циклотронным движением ионов в присутствии магнитного поля. Вместо измерения отклонения ионов с помощью такого детектора, как электронный умножитель , ионы вводятся в ловушку Пеннинга (статическую электрическую/магнитную ионную ловушку ), где они эффективно образуют часть цепи. Детекторы, расположенные в фиксированных положениях в пространстве, измеряют электрический сигнал ионов, которые проходят рядом с ними с течением времени, создавая периодический сигнал. Поскольку частота циклического движения иона определяется его отношением массы к заряду, ее можно выполнить деконволюцию , выполнив преобразование Фурье сигнала. FTMS Преимущество заключается в высокой чувствительности (поскольку каждый ион «подсчитывается» более одного раза) и гораздо более высоком разрешении и, следовательно, точности. [ 27 ] [ 28 ]
Ионный циклотронный резонанс (ИКР) — это более старый метод масс-анализа, аналогичный FTMS, за исключением того, что ионы обнаруживаются с помощью традиционного детектора. Ионы, попавшие в ловушку Пеннинга, возбуждаются радиочастотным электрическим полем до тех пор, пока не ударятся о стенку ловушки, где расположен детектор. Ионы различной массы разделяются в зависимости от времени воздействия.
Детекторы
[ редактировать ]
Последним элементом масс-спектрометра является детектор. Детектор регистрирует либо индуцированный заряд, либо ток, возникающий, когда ион проходит мимо поверхности или ударяется о нее. В сканирующем приборе сигнал, создаваемый детектором во время сканирования, в зависимости от того, где находится прибор при сканировании (при каком значении m/Q ), будет формировать масс-спектр , запись ионов в зависимости от m/Q .
тот или иной тип электронного умножителя Обычно используется другие детекторы, включая чашки Фарадея и детекторы ионов-фотонов , хотя также используются и . Поскольку количество ионов, покидающих масс-анализатор в конкретный момент, обычно весьма мало, для получения сигнала часто требуется значительное усиление. Микроканальные пластинчатые детекторы обычно используются в современных коммерческих приборах. [ 29 ] В FTMS и Orbitraps детектор состоит из пары металлических поверхностей в области масс-анализатора/ионной ловушки, мимо которых ионы проходят только во время колебаний. Постоянный ток не вырабатывается, в цепи между электродами создается только слабый переменный ток изображения. Также использовались другие индуктивные детекторы. [ 30 ]
Тандемная масс-спектрометрия
[ редактировать ]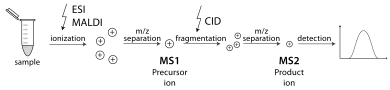
Тандемный масс-спектрометр — это прибор, способный выполнять несколько циклов масс-спектрометрии, обычно разделенных той или иной формой фрагментации молекул. Например, один масс-анализатор может выделить один пептид из многих, поступающих в масс-спектрометр. Затем ячейка столкновений стабилизирует ионы пептидов во время их столкновения с газом, вызывая их фрагментацию за счет диссоциации, вызванной столкновением (CID). Затем дополнительный масс-анализатор сортирует фрагменты, полученные из пептидов. Тандемную МС также можно проводить в одном масс-анализаторе с течением времени, например, в квадрупольной ионной ловушке . Существуют различные методы фрагментации молекул для тандемного МС, включая диссоциацию, индуцированную столкновениями (CID), диссоциацию с захватом электронов (ECD), диссоциацию с переносом электрона (ETD), инфракрасную многофотонную диссоциацию (IRMPD), инфракрасную радиационную диссоциацию черного тела (BIRD), электронную -отрывная диссоциация (EDD) и поверхностно-индуцированная диссоциация (SID). Важным применением тандемной масс-спектрометрии является идентификация белков. [ 31 ]
Тандемная масс-спектрометрия позволяет проводить различные экспериментальные последовательности. Многие коммерческие масс-спектрометры предназначены для ускорения выполнения таких рутинных последовательностей, как мониторинг выбранных реакций (SRM), сканирование ионов-предшественников, сканирование дочерних ионов и сканирование нейтральных потерь. [ 32 ]
- В SRM первый анализатор пропускает только одну массу, а второй анализатор отслеживает наличие нескольких определяемых пользователем фрагментных ионов в течение более длительного времени пребывания, чем можно было бы достичь при полном сканировании. Это повышает чувствительность.
- При сканировании дочерних ионов первый масс-анализатор фиксируется для выбора конкретного иона-предшественника («родительского»), а второй сканируется для поиска всех фрагментов («продуктов» или «дочерних ионов»), на которые он может быть фрагментирован. в камере столкновений.
- При сканировании ионов-предшественников второй масс-анализатор фиксируется для выбора определенного иона-фрагмента («дочернего»), а первый сканируется для поиска всех возможных ионов-предшественников, которые могли бы дать начало этому фрагменту.
- При сканировании нейтральных потерь два масс-анализатора сканируются параллельно, но разделены массой интересующей аналитика молекулярной субъединицы. Ионы обнаруживаются, если они теряют фиксированную массу во время фрагментации. Это можно использовать для поиска любого химического вещества, способного потерять определенную нейтральную группу, например, остаток сахара. Совместное сканирование нейтральных потерь и ионов-предшественников можно использовать для поиска химических веществ с определенными мотивами.
Другой тип тандемной масс-спектрометрии, используемый для радиоуглеродного датирования , - это масс-спектрометрия с ускорителем (AMS), в которой используются очень высокие напряжения, обычно в мегавольтном диапазоне, для ускорения отрицательных ионов в своего рода тандемный масс-спектрометр.
База METLIN данных метаболитов и химических веществ [ 33 ] [ 34 ] [ 35 ] [ 36 ] является крупнейшим хранилищем данных экспериментальной тандемной масс-спектрометрии, полученных из стандартов. Данные тандемной масс-спектрометрии по более чем 930 000 молекулярным стандартам (по состоянию на январь 2024 г.) [ 33 ] [ 36 ] предназначен для облегчения идентификации химических веществ в результате тандемных масс-спектрометрических экспериментов. [ 37 ] Помимо идентификации известных молекул, он также полезен для идентификации неизвестных с использованием поиска/анализа сходства. [ 38 ] Все данные тандемной масс-спектрометрии получены в результате экспериментального анализа стандартов при нескольких энергиях столкновения и в режимах как положительной, так и отрицательной ионизации. [ 33 ]
Распространенные конфигурации и методы масс-спектрометров
[ редактировать ]Когда на практике становится общепринятой конкретная комбинация источника, анализатора и детектора, составная аббревиатура для ее краткого обозначения может возникнуть . Одним из примеров является MALDI-TOF , который относится к комбинации матричного источника лазерной десорбции/ионизации с времяпролетным масс-анализатором. Другие примеры включают масс-спектрометрию с индуктивно связанной плазмой (ICP-MS) , масс-спектрометрию с ускорителем (AMS) , масс-спектрометрию с термической ионизацией (TIMS) и масс-спектрометрию с искровым источником (SSMS) .
В некоторых приложениях масс-спектрометрии появились названия, которые, хотя, строго говоря, кажутся относящимися к широкому применению, на практике вместо этого стали обозначать конкретную или ограниченное количество конфигураций приборов. Примером этого является масс-спектрометрия изотопного отношения (IRMS), которая на практике означает использование ограниченного числа секторных масс-анализаторов; это имя используется для обозначения как приложения, так и инструмента, используемого для приложения.
Методы разделения в сочетании с масс-спектрометрией
[ редактировать ]Важным улучшением возможностей масс-спектрометрии по разрешению и определению массы является ее использование в тандеме с хроматографическими и другими методами разделения.
Газовая хроматография
[ редактировать ]
Распространенной комбинацией является газовая хроматография-масс-спектрометрия (ГХ/МС или ГХ-МС). В этом методе газовый хроматограф используется для разделения различных соединений. Этот поток разделенных соединений подается в источник ионов — металлическую нить накала , к которой напряжение подается . Эта нить испускает электроны, которые ионизируют соединения. Затем ионы могут фрагментироваться дальше, создавая предсказуемые закономерности. Неповрежденные ионы и фрагменты попадают в анализатор масс-спектрометра и в конечном итоге обнаруживаются. [ 39 ] Однако высокие температуры (300°C), используемые в инжекционном порте (и печи) ГХ-МС, могут привести к термическому разложению введенных молекул, что приведет к измерению продуктов разложения вместо фактических интересующих молекул. [ 40 ]
Жидкостная хроматография
[ редактировать ]
Подобно газовой хроматографии-МС (ГХ-МС), жидкостная хроматография-масс-спектрометрия (ЖХ/МС или ЖХ-МС) разделяет соединения хроматографически перед их введением в источник ионов и масс-спектрометр. Он отличается от ГХ-МС тем, что подвижной фазой является жидкость, обычно смесь воды и органических растворителей , а не газа. Чаще всего ионизации электрораспылением в ЖХ-МС используется источник . Другими популярными и коммерчески доступными источниками ионов для ЖХ-МС являются химическая ионизация при атмосферном давлении и фотоионизация при атмосферном давлении . Есть также некоторые недавно разработанные методы ионизации, такие как лазерное распыление .
Капиллярный электрофорез-масс-спектрометрия
[ редактировать ]Капиллярный электрофорез-масс-спектрометрия (КЭ-МС) — это метод, который сочетает в себе процесс разделения жидкостей капиллярного электрофореза с масс-спектрометрией. [ 41 ] CE-MS обычно сочетается с ионизацией электрораспылением. [ 42 ]
Подвижность ионов
[ редактировать ]Спектрометрия ионной подвижности-масс-спектрометрия (IMS/MS или IMMS) — это метод, при котором ионы сначала разделяются за счет времени дрейфа через нейтральный газ под приложенным градиентом электрического потенциала перед введением в масс-спектрометр. [ 43 ] Время дрейфа является мерой сечения столкновения относительно заряда иона. Рабочий цикл IMS (время, в течение которого проводится эксперимент) длиннее, чем у большинства масс-спектрометрических методов, так что масс-спектрометр может отбирать пробы в ходе разделения IMS. Это позволяет получить данные о разделении IMS и отношении массы к заряду ионов аналогично ЖХ-МС . [ 44 ]
Рабочий цикл IMS короче по сравнению с жидкостной хроматографией или газовой хроматографией разделения, и поэтому его можно сочетать с такими методами, создавая тройные методы, такие как ЖХ/IMS/МС. [ 45 ]
Данные и анализ
[ редактировать ]
Представления данных
[ редактировать ]Масс-спектрометрия дает различные типы данных. Наиболее распространенным представлением данных является масс-спектр .
Определенные типы данных масс-спектрометрии лучше всего представить в виде масс-хроматограммы . Типы хроматограмм включают мониторинг выбранных ионов (SIM), общий ионный ток (TIC) и мониторинг выбранных реакций (SRM) и многие другие.
Другие типы данных масс-спектрометрии хорошо представлены в виде трехмерной контурной карты . В этой форме масса к заряду m/z откладывается по оси x , интенсивность — по оси y , а дополнительный экспериментальный параметр, такой как время, записывается по оси z .
Анализ данных
[ редактировать ]Анализ данных масс-спектрометрии зависит от типа эксперимента, в котором получены данные. Общее подразделение данных имеет основополагающее значение для понимания любых данных.
Многие масс-спектрометры работают либо в режиме отрицательных ионов , либо в режиме положительных ионов . Очень важно знать, заряжены ли наблюдаемые ионы отрицательно или положительно. Это часто важно для определения нейтральной массы, но также указывает на природу молекул.
Различные типы источников ионов приводят к получению разных массивов фрагментов из исходных молекул. Источник электронной ионизации производит множество фрагментов и в основном однозарядные (1-) радикалы (нечетное число электронов), тогда как источник электрораспыления обычно производит нерадикальные квазимолекулярные ионы, которые часто имеют многократный заряд. Тандемная масс-спектрометрия намеренно производит фрагментированные ионы после источника и может радикально изменить тип данных, получаемых в ходе эксперимента.
Знание происхождения образца может дать представление о составляющих молекул образца и их фрагментации. Образец, полученный в процессе синтеза/производства, вероятно, будет содержать примеси, химически связанные с целевым компонентом. Грубо приготовленный биологический образец, вероятно, будет содержать определенное количество соли, которая в некоторых анализах может образовывать аддукты с молекулами аналита.
Результаты также могут сильно зависеть от подготовки пробы и того, как она была проведена/введена. Важным примером является вопрос о том, какая матрица используется для нанесения MALDI, поскольку большая часть энергетики процесса десорбции/ионизации контролируется матрицей, а не мощностью лазера. Иногда в образцы добавляют натрий или другие вещества, переносящие ионы, для получения аддуктов, а не протонированных частиц.
Масс-спектрометрия позволяет измерять молярную массу, молекулярную структуру и чистоту образца. Каждый из этих вопросов требует отдельной экспериментальной процедуры; следовательно, адекватное определение цели эксперимента является предпосылкой для сбора правильных данных и их успешной интерпретации.
Интерпретация масс-спектров
[ редактировать ]
Поскольку точная структура или пептидная последовательность молекулы расшифровывается с помощью набора масс фрагментов, интерпретация масс-спектров требует совместного использования различных методов. Обычно первой стратегией идентификации неизвестного соединения является сравнение его экспериментального масс-спектра с библиотекой масс-спектров. Если в результате поиска совпадений не получено, то интерпретация вручную. [ 46 ] или интерпретацию масс-спектров с помощью программного обеспечения необходимо выполнить . Компьютерное моделирование процессов ионизации и фрагментации, происходящих в масс-спектрометре, является основным инструментом для определения структуры или пептидной последовательности молекулы. Априорная , структурная информация фрагментируется in silico и полученная картина сравнивается с наблюдаемым спектром. Такое моделирование часто поддерживается библиотекой фрагментации. [ 47 ] который содержит опубликованные схемы известных реакций разложения. Программное обеспечение, использующее эту идею, было разработано как для малых молекул, так и для белков .
Анализ масс-спектров также может проводиться по спектрам с точной массой . Значение отношения массы к заряду ( m/z ) только с целочисленной точностью может представлять огромное количество теоретически возможных ионных структур; однако более точные значения массы значительно уменьшают количество возможных молекулярных формул . Компьютерный алгоритм, называемый генератором формул, вычисляет все молекулярные формулы, которые теоретически соответствуют заданной массе с заданным допуском.
Недавний метод выяснения структуры в масс-спектрометрии, называемый дактилоскопией ионов-предшественников , идентифицирует отдельные фрагменты структурной информации путем проведения поиска тандемных спектров исследуемой молекулы по библиотеке спектров дочерних ионов структурно охарактеризованных ионов-предшественников. [ 48 ]
Приложения
[ редактировать ]
Масс-спектрометрия имеет как качественное , так и количественное применение. К ним относятся идентификация неизвестных соединений, определение изотопного состава элементов в молекуле и определение структуры соединения путем наблюдения за его фрагментацией. Другие области применения включают количественную оценку количества соединения в образце или изучение основ ионной химии газовой фазы (химии ионов и нейтральных веществ в вакууме). МС в настоящее время широко используется в аналитических лабораториях, изучающих физические, химические или биологические свойства самых разных соединений. Количественное определение может быть относительным (анализируется по отношению к эталонному образцу) или абсолютным (анализируется с использованием метода стандартной кривой). [ 49 ] [ 50 ]
Как аналитический метод он обладает явными преимуществами, такими как: Повышенная чувствительность по сравнению с большинством других аналитических методов, поскольку анализатор, как фильтр массового заряда, уменьшает фоновые помехи. Отличная специфичность благодаря характерным картинам фрагментации для идентификации неизвестных или подтверждения присутствия подозреваемых соединений. Информация о молекулярной массе. Информация об изотопном содержании элементов. Химические данные с временным разрешением.
Некоторыми недостатками метода является то, что он часто не позволяет различить оптические и геометрические изомеры, а также положения заместителей в о-, м- и р-положениях ароматического кольца. Кроме того, его возможности ограничены при идентификации углеводородов, которые производят аналогичные фрагментированные ионы.
Изотопное соотношение MS: датирование и отслеживание изотопов
[ редактировать ]
Масс-спектрометрия также используется для определения изотопного состава элементов в образце. Различия в массе изотопов элемента очень малы, а менее распространенные изотопы элемента обычно очень редки, поэтому требуется очень чувствительный прибор. Эти инструменты, иногда называемые масс-спектрометрами изотопного соотношения (ИК-МС), обычно используют один магнит для отклонения пучка ионизированных частиц к ряду чашек Фарадея , которые преобразуют удары частиц в электрический ток . Быстрый онлайн-анализ содержания дейтерия в воде можно выполнить с помощью проточной масс-спектрометрии послесвечения , FA-MS. Вероятно, наиболее чувствительным и точным масс-спектрометром для этой цели является ускорительный масс-спектрометр (АМС). Это связано с тем, что он обеспечивает максимальную чувствительность, позволяя измерять отдельные атомы и нуклиды с динамическим диапазоном ~ 10 15 относительно основного стабильного изотопа. [ 51 ] Изотопные отношения являются важными маркерами различных процессов. Некоторые соотношения изотопов используются для определения возраста материалов, например, при радиоуглеродном датировании . Мечение стабильными изотопами также используется для количественного определения белка. (см. характеристику белка ниже)
Масс-спектрометрия с мембранным введением: измерение газов в растворе
[ редактировать ]Масс-спектрометрия с мембранным введением сочетает соотношение изотопов MS с реакционной камерой/ячейкой, разделенной газопроницаемой мембраной. Этот метод позволяет изучать газы по мере их эволюции в растворе. Этот метод широко использовался для изучения производства кислорода Фотосистемой II . [ 52 ]
Анализ газовых примесей
[ редактировать ]В нескольких методах используются ионы, созданные в специальном источнике ионов, вводимые в расходомерную трубку или дрейфовую трубку: проточная трубка с выбранными ионами (SIFT-MS) и реакция переноса протона (PTR-MS) являются вариантами химической ионизации, предназначенными для газовых примесей анализа . воздуха, дыхания или свободного пространства жидкости с использованием четко определенного времени реакции, что позволяет рассчитывать концентрации аналита на основе известной кинетики реакции без необходимости использования внутреннего стандарта или калибровки.
Еще одним методом, применимым в области анализа газовых примесей, является вторичная ионизация электрораспылением (SESI-MS), которая является вариантом ионизации электрораспылением . SESI состоит из шлейфа электрораспыления чистого подкисленного растворителя, который взаимодействует с нейтральными парами. Молекулы пара ионизируются при атмосферном давлении, когда заряд передается от ионов, образующихся при электрораспылении, к молекулам. Одним из преимуществ этого подхода является то, что он совместим с большинством систем ESI-MS. [ 53 ] [ 54 ]
Анализ остаточных газов
[ редактировать ]
Анализатор остаточных газов (RGA) — это небольшой и обычно прочный масс-спектрометр , обычно предназначенный для управления технологическими процессами и мониторинга загрязнений в вакуумных системах . При построении квадрупольного масс-анализатора существует две реализации: либо открытый источник ионов (OIS), либо закрытый источник ионов (CIS). RGA можно найти в приложениях с высоким вакуумом, таких как исследовательские камеры, для изучения поверхности установки , ускорители , сканирующие микроскопы и т. д. RGA используются в большинстве случаев для контроля качества вакуума и легкого обнаружения мельчайших следов примесей в газе низкого давления. среда. Эти примеси можно измерить до Уровни Торра , обеспечивающие обнаруживаемость ниже ppm при отсутствии фоновых помех.
RGA также будут использоваться в качестве чувствительных на месте, детекторов утечек обычно с использованием гелия , изопропилового спирта или других индикаторных молекул. Когда вакуумные системы откачаны до уровня ниже Торр — проверка целостности вакуумных уплотнений и качества вакуума — утечки воздуха, виртуальные утечки и другие загрязнения на низких уровнях могут быть обнаружены до начала процесса.атомный зонд
[ редактировать ]Атомный зонд — это инструмент, который сочетает в себе времяпролетную масс-спектрометрию и полево-испарительную микроскопию для картирования местоположения отдельных атомов.
Фармакокинетика
[ редактировать ]Фармакокинетику часто изучают с помощью масс-спектрометрии из-за сложной природы матрицы (часто крови или мочи) и необходимости высокой чувствительности для наблюдения за низкими дозами и данными за длительный период времени. Наиболее распространенным прибором, используемым в этом приложении, является ЖХ-МС с тройным квадрупольным масс-спектрометром . Для большей специфичности обычно используется тандемная масс-спектрометрия. Стандартные кривые и внутренние стандарты обычно используются для количественного определения одного фармацевтического препарата в образцах. Образцы представляют разные моменты времени, когда фармацевтический препарат вводится, а затем метаболизируется или выводится из организма. Пустые образцы или пробы с t=0, взятые перед введением, важны для определения фона и обеспечения целостности данных в таких сложных матрицах образцов. Большое внимание уделяется линейности стандартной кривой; однако нередко используется аппроксимация кривой более сложными функциями, такими как квадратичные, поскольку отклик большинства масс-спектрометров менее чем линейный в больших диапазонах концентраций. [ 55 ] [ 56 ] [ 57 ]
В настоящее время существует значительный интерес к использованию масс-спектрометрии очень высокой чувствительности для исследований микродозирования , которые рассматриваются как многообещающая альтернатива экспериментам на животных .
Недавние исследования показывают, что вторичная ионизация электрораспылением (SESI) является мощным методом мониторинга кинетики лекарств с помощью анализа дыхания. [ 58 ] [ 59 ] Поскольку дыхание производится естественным путем, можно легко собрать несколько точек данных. Это позволяет значительно увеличить количество собираемых точек данных. [ 60 ] В исследованиях на животных этот подход SESI может снизить количество жертвоприношений животных. [ 59 ] У людей неинвазивный анализ дыхания SESI-MS может помочь изучить кинетику лекарств на индивидуальном уровне. [ 58 ] [ 61 ] [ 62 ]
Характеристика белка
[ редактировать ]Масс-спектрометрия — важный метод характеристики и секвенирования белков. Двумя основными методами ионизации целых белков являются ионизация электрораспылением (ESI) и лазерная десорбция/ионизация с помощью матрицы (MALDI). В соответствии с характеристиками и массовым диапазоном доступных масс-спектрометров для характеристики белков используются два подхода. В первом случае интактные белки ионизируются любым из двух описанных выше методов, а затем вводятся в масс-анализатор. Этот подход называется « сверху вниз стратегией анализа белков ». Однако подход «сверху вниз» в значительной степени ограничен исследованиями одного белка с низкой пропускной способностью. Во втором случае белки ферментативно расщепляются на более мелкие пептиды с использованием протеаз, таких как трипсин или пепсин , либо в растворе , либо в геле после электрофоретического разделения. Также используются другие протеолитические агенты. Коллекцию пептидных продуктов часто разделяют с помощью хроматографии перед введением в масс-анализатор. Когда для идентификации белка используется характерный образец пептидов, метод называется Массовый дактилоскопический анализ пептидов (PMF), если идентификация выполняется с использованием данных о последовательностях, определенных в тандемном МС- анализе, это называется секвенированием пептидов de novo . Эти процедуры анализа белков также называются подходом « снизу вверх » и также используются для анализа распределения и положения посттрансляционных модификаций, таких как фосфорилирование белков. [ 63 ] Третий подход также начинает использоваться, этот промежуточный подход «среднего вниз» включает анализ протеолитических пептидов, которые больше, чем типичный триптический пептид. [ 64 ]
Исследование космоса
[ редактировать ]
В качестве стандартного метода анализа масс-спектрометры достигли других планет и лун. Двое были доставлены на Марс по программе «Викинг» . В начале 2005 года миссия Кассини-Гюйгенс доставила специализированный прибор ГХ-МС на борт зонда Гюйгенс через атмосферу Титана , крупнейшего спутника планеты Сатурн . Этот прибор анализировал образцы атмосферы на траектории спуска и смог испарять и анализировать образцы замороженной, покрытой углеводородами поверхности Титана после приземления зонда. Эти измерения сравнивают содержание изотопов каждой частицы с естественным содержанием на Земле. [ 65 ] Также на борту космического корабля «Кассини-Гюйгенс» находился ионный и нейтральный масс-спектрометр, который проводил измерения состава атмосферы Титана, а также состава Энцелада шлейфов . Масс- спектрометр для анализа термических и выделяющихся газов был установлен на посадочном модуле Mars Phoenix, запущенном в 2007 году. [ 66 ]
Масс-спектрометры также широко используются в космических миссиях для измерения состава плазмы. Например, на космическом корабле Кассини был установлен плазменный спектрометр Кассини (CAPS). [ 67 ] который измерил массу ионов в магнитосфере Сатурна .
Монитор дыхательных газов
[ редактировать ]Масс-спектрометры использовались в больницах для анализа дыхательных газов примерно с 1975 года до конца века. Некоторые из них, вероятно, все еще используются, но в настоящее время ни один из них не производится. [ 68 ]
Находясь в основном в операционной , они были частью сложной системы, в которой пробы вдыхаемого газа пациентов, находящихся под анестезией, втягивались в прибор через клапанный механизм, предназначенный для последовательного подключения к масс-спектрометру до 32 помещений. Компьютер управлял всеми операциями системы. Данные, собранные с помощью масс-спектрометра, доставлялись в отдельные кабинеты для использования анестезиологом.
Уникальность этого магнитно-секторного масс-спектрометра, возможно, заключалась в том, что плоскость детекторов, каждый из которых специально расположен для сбора всех видов ионов, которые, как ожидается, будут находиться в образцах, позволяла прибору одновременно регистрировать все газы, вдыхаемые пациентом. . Хотя диапазон масс был ограничен чуть более 120 единиц , фрагментация некоторых более тяжелых молекул сводила на нет необходимость в более высоком пределе обнаружения. [ 69 ]
Препаративная масс-спектрометрия
[ редактировать ]Основная функция масс-спектрометрии — инструмент химического анализа, основанный на обнаружении и количественном определении ионов в соответствии с их отношением массы к заряду. Однако масс-спектрометрия также перспективна для синтеза материалов. [ 51 ] Мягкая посадка ионов характеризуется осаждением неповрежденных частиц на поверхности при низких кинетических энергиях, что исключает фрагментацию падающих частиц. [ 70 ] О методе мягкой посадки впервые было сообщено в 1977 году для реакции низкоэнергетических серосодержащих ионов на поверхности свинца. [ 71 ]
См. также
[ редактировать ]- Метод Дюма определения молекулярной массы
- Расширенный газовый анализ
- Гелиевый масс-спектрометр
- Изотопное разбавление
- MassBank (база данных) — японская спектральная база данных.
- Масс-спектрометрическая визуализация
- Программное обеспечение для масс-спектрометрии
- МасСпец Ручка
- Микроматрицы для масс-спектрометрии
- Наномасштабная масс-спектрометрия вторичных ионов
- Рефлектрон
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с Спаркман, О. Дэвид (2000). Справочник по столу масс-спектрометрии . Питтсбург: паб Global View. ISBN 978-0-9660813-2-9 .
- ^ " Определение спектрографа [ постоянная мертвая ссылка ] .» Мерриам Вебстер. По состоянию на 13 июня 2008 г.
- ^ Даунард К. (2004). Масс-спектрометрия — базовый курс . Королевское химическое общество. дои : 10.1039/9781847551306 . ISBN 978-0-85404-609-6 .
- ^ Сквайрс Дж. (1998). «Фрэнсис Астон и масс-спектрограф». Далтон Транзакции (23): 3893–3900. дои : 10.1039/a804629h .
- ^ Даунард К.М. (2007). «Исторический отчет: Фрэнсис Уильям Астон: человек, стоящий за масс-спектрографом». Европейский журнал масс-спектрометрии . 13 (3): 177–90. дои : 10.1255/ejms.878 . ПМИД 17881785 . S2CID 25747367 .
- ^ Томсон Джей-Джей (1913). Лучи положительного электричества и их применение в химическом анализе . Лондон: Longman's Green and Company.
- ^ Сири В. (1947). «Масс-спектроскоп для анализа в маломассовом диапазоне». Обзор научных инструментов . 18 (8): 540–545. Бибкод : 1947RScI...18..540S . дои : 10.1063/1.1740998 .
- ^ Прайс П (август 1991 г.). «Стандартные определения терминов, относящихся к масс-спектрометрии: отчет комитета по измерениям и стандартам Американского общества масс-спектрометрии». Журнал Американского общества масс-спектрометрии . 2 (4): 336–48. дои : 10.1016/1044-0305(91)80025-3 . ПМИД 24242353 . S2CID 20236081 .
- ^ Паркинс М.Е. (2005). «Урановая бомба, калютрон и проблема пространственного заряда». Физика сегодня . 58 (5): 45–51. Бибкод : 2005ФТ....58е..45П . CiteSeerX 10.1.1.579.4119 . дои : 10.1063/1.1995747 . ISSN 0031-9228 .
- ^ «Нобелевская премия по химии 2002 года: информация для общественности» . Нобелевский фонд. 9 октября 2002 года . Проверено 29 августа 2007 г.
- ^ Фенн Дж.Б., Манн М., Мэн К.К., Вонг С.Ф., Уайтхаус К.М. (октябрь 1989 г.). «Ионизация электрораспылением для масс-спектрометрии крупных биомолекул». Наука . 246 (4926): 64–71. Бибкод : 1989Sci...246...64F . CiteSeerX 10.1.1.522.9458 . дои : 10.1126/science.2675315 . ПМИД 2675315 .
- ^ Танака К., Ваки Х., Идо Ю., Акита С., Ёсида Й., Ёсида Т. (1988). «Анализ белков и полимеров до m/z 100 000 с помощью времяпролетной масс-спектрометрии с лазерной ионизацией». Масс-спектр быстрой коммуны . 2 (20): 151–3. Бибкод : 1988RCMS....2..151T . дои : 10.1002/rcm.1290020802 .
- ^ Карас М., Бахман Д., Бахр У., Хилленкамп Ф. (1987). «Матричная ультрафиолетовая лазерная десорбция нелетучих соединений». Int J Масс-спектральный ионный процесс . 78 : 53–68. Бибкод : 1987IJMSI..78...53K . дои : 10.1016/0168-1176(87)87041-6 .
- ^ Осборн Д.Л., Зоу П., Джонсен Х., Хайден К.С., Таатжес К.А., Князев В.Д., Норт С.В., Петерка Д.С., Ахмед М., Леоне С.Р. (октябрь 2008 г.). «Мультиплексный химико-кинетический фотоионизационный масс-спектрометр: новый подход к химической кинетике с разрешением изомеров» . Обзор научных инструментов (представленная рукопись). 79 (10): 104103–104103–10. Бибкод : 2008RScI...79j4103O . дои : 10.1063/1.3000004 . ПМИД 19044733 . S2CID 25452748 .
- ^ Брюинз, AP (1991). «Масс-спектрометрия с источниками ионов, работающими при атмосферном давлении». Обзоры масс-спектрометрии . 10 (1): 53–77. Бибкод : 1991MSRv...10...53B . дои : 10.1002/mas.1280100104 .
- ^ Коттрелл Дж.С., Грейтхед Р.Дж. (1986). «Расширение диапазона масс секторного масс-спектрометра». Обзоры масс-спектрометрии . 5 (3): 215–247. Бибкод : 1986MSRv....5..215C . дои : 10.1002/mas.1280050302 .
- ^ Если ионы не начинаются с одинаковой кинетической энергией, то некоторые ионы могут отставать от ионов с более высокой кинетической энергией, что снижает разрешение. Для решения этой проблемы обычно используются геометрии рефлектрона. Воллник, Х. (1993). «Времяпролетные масс-анализаторы». Обзоры масс-спектрометрии . 12 (2): 89–114. Бибкод : 1993MSRv...12...89W . дои : 10.1002/mas.1280120202 .
- ^ Гильхаус М (1998). «Принципы и приборы времяпролетной масс-спектрометрии» (PDF) . Журнал масс-спектрометрии . 30 (11): 1519–1532. дои : 10.1002/jms.1190301102 . S2CID 9444467 . Архивировано из оригинала (PDF) 6 февраля 2018 г. - через Google Scholar.
- ^ Сайед С.У., Махер С., Тейлор С. (декабрь 2013 г.). «Работа квадрупольного массового фильтра под воздействием магнитного поля». Журнал масс-спектрометрии . 48 (12): 1325–39. Бибкод : 2013JMSp...48.1325S . дои : 10.1002/jms.3293 . ПМИД 24338888 .
- ^ Махер С., Сайед С.Ю., Хьюз Д.М., Гибсон-младший, Тейлор С. (август 2013 г.). «Построение диаграммы стабильности квадрупольного масс-спектрометра с приложенным статическим поперечным магнитным полем». Журнал Американского общества масс-спектрометрии . 24 (8): 1307–14. Бибкод : 2013JASMS..24.1307M . дои : 10.1007/s13361-013-0654-5 . ПМИД 23720050 . S2CID 45734248 .
- ^ Пол В., Штайнведель Х. (1953). «Новый масс-спектрометр без магнитного поля» . Журнал естественных исследований А. 8 (7): 448–450. Стартовый код : 1953ЗНатА...8..448П . дои : 10.1515/zna-1953-0710 . S2CID 96549388 .
- ^ Мартовский РЭ (2000). «Масс-спектрометрия с квадрупольной ионной ловушкой: взгляд на рубеже веков». Международный журнал масс-спектрометрии . 200 (1–3): 285–312. Бибкод : 2000IJMSp.200..285M . дои : 10.1016/S1387-3806(00)00345-6 .
- ^ Шварц Дж.К., Сенко М.В., Сика Дж.Е. (июнь 2002 г.). «Двумерный масс-спектрометр с квадрупольной ионной ловушкой». Журнал Американского общества масс-спектрометрии . 13 (6): 659–69. дои : 10.1016/S1044-0305(02)00384-7 . ПМИД 12056566 . S2CID 26965687 .
- ^ Ламмерт С.А., Роквуд А.А., Ван М., Ли М.Л., Ли ЭД, Толли С.Э., Олифант Дж.Р., Джонс Дж.Л., Уэйт Р.В. (июль 2006 г.). «Миниатюрный масс-анализатор с тороидальной радиочастотной ионной ловушкой». Журнал Американского общества масс-спектрометрии . 17 (7): 916–922. дои : 10.1016/j.jasms.2006.02.009 . ПМИД 16697659 . S2CID 45444397 .
- ^ Снайдер Д.Т., Пуллиам С.Дж., Оуян З., Кукс Р.Г. (январь 2016 г.). «Миниатюрные и полевые масс-спектрометры: последние достижения» . Аналитическая химия . 88 (1): 2–29. дои : 10.1021/acs.analchem.5b03070 . ПМК 5364034 . ПМИД 26422665 .
- ^ Ху Кью, Нолл Р.Дж., Ли Х., Макаров А., Хардман М., Грэм Кукс Р. (апрель 2005 г.). «Орбитрап: новый масс-спектрометр». Журнал масс-спектрометрии . 40 (4): 430–43. Бибкод : 2005JMSp...40..430H . дои : 10.1002/jms.856 . ПМИД 15838939 .
- ^ Комисаров М.Б., Маршалл А.Г. (1974). «Спектроскопия ионного циклотронного резонанса с Фурье-преобразованием». Письма по химической физике . 25 (2): 282–283. Бибкод : 1974CPL....25..282C . дои : 10.1016/0009-2614(74)89137-2 .
- ^ Маршалл А.Г., Хендриксон К.Л., Джексон Г.С. (1998). «Масс-спектрометрия ионно-циклотронного резонанса с Фурье-преобразованием: учебник для начинающих». Обзоры масс-спектрометрии . 17 (1): 1–35. Бибкод : 1998MSRv...17....1M . doi : 10.1002/(SICI)1098-2787(1998)17:1<1::AID-MAS1>3.0.CO;2-K . ПМИД 9768511 .
- ^ Дюбуа Ф., Кнохенмус Р., Зеноби Р., Брюнель А., Депрун С., Ле Бейек И. (1999). «Сравнение ионно-фотонных и микроканальных пластинчатых детекторов». Быстрая связь в масс-спектрометрии . 13 (9): 786–791. Бибкод : 1999RCMS...13..786D . doi : 10.1002/(SICI)1097-0231(19990515)13:9<786::AID-RCM566>3.0.CO;2-3 .
- ^ Парк М.А., Каллахан Дж.Х., Вертес А. (1994). «Индуктивный детектор для времяпролетной масс-спектрометрии». Быстрая связь в масс-спектрометрии . 8 (4): 317–322. Бибкод : 1994RCMS....8..317P . дои : 10.1002/rcm.1290080407 .
- ^ Бойд, Роберт К. (1994). «Методы связанного сканирования для МС/МС с использованием тандемных приборов в космосе». Обзоры масс-спектрометрии . 13 (5–6): 359–410. Бибкод : 1994MSRv...13..359B . дои : 10.1002/mas.1280130502 .
- ^ Буш К.Л. «Глоссарий по масс-спектрометрии» (PDF) . Waters.com . Уотерс . Проверено 12 февраля 2024 г.
- ^ Перейти обратно: а б с Сюэ Дж., Гихас С., Бентон Х.П., Варт Б., Сиуздак Г. (октябрь 2020 г.). «МЕТЛИН МС» 2 обширный химический и биологический ресурс» . Nature Methods . 17 (10): 953–954. : 10.1038 /s41592-020-0942-5 . PMC 8802982. 32839599. PMID База данных молекулярных стандартов : . S2CID 221285246 doi
- ^ Смит К.А., О'Мэйл Дж., Вант Э.Дж., Цинь С., Траугер С.А., Брэндон Т.Р., Кастодио Д.Е., Абагян Р., Сиуздак Г. (декабрь 2005 г.). «МЕТЛИН: база данных масс-спектров метаболитов» . Терапевтический лекарственный мониторинг . 27 (6): 747–51. дои : 10.1097/01.ftd.0000179845.53213.39 . ПМИД 16404815 . S2CID 14774455 .
- ^ Гияс К, Монтенегро-Берк-младший, Доминго-Альменара Х, Палермо А, Варт Б, Герман Г, Кёлленспергер Г, Хуан Т, Уритбунтхай В, Айспорна А.Е., Волан Д.В., Спилкер М.Э., Бентон Х.П., Сюздак Г. (март 2018 г.). «МЕТЛИН: технологическая платформа для идентификации известных и неизвестных» . Аналитическая химия . 90 (5): 3156–3164. дои : 10.1021/acs.analchem.7b04424 . ПМЦ 5933435 . ПМИД 29381867 .
- ^ Перейти обратно: а б Хейм В., Айспорна А., Хоанг Л., Бентон Х.П., Сиуздак Г. (2023), Иванишевич Дж., Гиера М. (ред.), «Тандемная масс-спектрометрия METLIN и базы данных нейтральных потерь для идентификации микробных природных продуктов и других химических соединений» , Практическое руководство по применению метаболомики в здравоохранении и заболеваниях: от образцов к пониманию метаболизма , Cham: Springer International Publishing, стр. 105–124, doi : 10.1007/978-3-031-44256-8_5 , ISBN 978-3-031-44256-8 , получено 27 марта 2024 г.
- ^ Хоанг С., Уритбунтхай В., Хоанг Л., Биллингс Э.М., Айспорна А., Ниа Ф.А., Деркс Р.Дж., Уильямсон Дж.Р., Гиера М., Сиуздак Г. (26 марта 2024 г.). «Тандемная масс-спектрометрия на разных платформах» . Аналитическая химия . 96 (14): 5478–5488. дои : 10.1021/acs.analchem.3c05576 . ISSN 0003-2700 . ПМЦ 11007677 . ПМИД 38529642 .
- ^ Бентон Х.П., Вонг Д.М., Траугер С.А., Сиуздак Г. (август 2008 г.). «XCMS2: обработка данных тандемной масс-спектрометрии для идентификации метаболитов и структурной характеристики» . Аналитическая химия . 80 (16): 6382–9. дои : 10.1021/ac800795f . ПМК 2728033 . ПМИД 18627180 .
- ^ Айсман, Джорджия (2000). Газовая хроматография. В Р. А. Мейерсе (ред.), Энциклопедия аналитической химии: приложения, теория и приборы , стр. 10627. Чичестер: Wiley. ISBN 0-471-97670-9
- ^ Фанг М., Иванишевич Дж., Бентон Х.П., Джонсон CH, Патти Дж.Дж., Хоанг Л.Т., Уритбунтхай В., Курчи М.Э., Сюздак Г. (ноябрь 2015 г.). «Термическая деградация малых молекул: глобальное метаболомное исследование» . Аналитическая химия . 87 (21): 10935–41. дои : 10.1021/acs.analchem.5b03003 . ПМЦ 4633772 . ПМИД 26434689 .
- ^ Лу Дж.А., Удсет Х.Р., Смит Р.Д. (июнь 1989 г.). «Анализ пептидов и белков методами ионизации-масс-спектрометрии электрораспылением и масс-спектрометрии капиллярного электрофореза» . Аналитическая биохимия . 179 (2): 404–12. дои : 10.1016/0003-2697(89)90153-X . ПМИД 2774189 .
- ^ Максвелл Э.Дж., Чен Д.Д. (октябрь 2008 г.). «Двадцать лет разработки интерфейса для капиллярного электрофореза, ионизации электрораспылением и масс-спектрометрии». Аналитика Химика Акта . 627 (1): 25–33. Бибкод : 2008AcAC..627...25M . дои : 10.1016/j.aca.2008.06.034 . ПМИД 18790125 .
- ^ Вербек Г.Ф., Руотоло Б.Т., Сойер Х.А., Гиллиг К.Дж., Рассел Д.Х. (июнь 2002 г.). «Фундаментальное введение в масс-спектрометрию ионной подвижности применительно к анализу биомолекул» . Журнал биомолекулярных методов . 13 (2): 56–61. ПМК 2279851 . ПМИД 19498967 .
- ^ Мац Л.М., Эсбери Г.Р., Хилл Х.Х. (2002). «Двумерное разделение с ионизацией электрораспылением при атмосферном давлении, спектрометрия подвижности ионов высокого разрешения / квадрупольная масс-спектрометрия». Быстрая связь в масс-спектрометрии . 16 (7): 670–5. Бибкод : 2002RCMS...16..670M . дои : 10.1002/rcm.623 . ПМИД 11921245 .
- ^ Соуэлл Р.А., Кенигер С.Л., Валентайн С.Дж., Мун М.Х., Клеммер Д.Е. (сентябрь 2004 г.). «Nanoflow LC/IMS-MS и LC/IMS-CID/MS белковых смесей». Журнал Американского общества масс-спектрометрии . 15 (9): 1341–53. дои : 10.1016/j.jasms.2004.06.014 . ПМИД 15337515 . S2CID 11531292 .
- ^ Туречек Ф., Маклафферти Ф.В. (1993). Интерпретация масс-спектров . Саусалито: Университетские научные книги. ISBN 978-0-935702-25-5 .
- ^ Мистрик Р. «Новая концепция интерпретации масс-спектров, основанная на сочетании базы данных о механизмах фрагментации и компьютерной экспертной системы» . Highchem.com . Архивировано из оригинала 11 января 2012 года.
- ^ Шелдон М.Т., Мистрик Р., Кроли Т.Р. (март 2009 г.). «Определение ионной структуры в структурно родственных соединениях с использованием дактилоскопии ионов-предшественников» . Журнал Американского общества масс-спектрометрии . 20 (3): 370–6. дои : 10.1016/j.jasms.2008.10.017 . ПМИД 19041260 .
- ^ Метаболон (06.01.2022). «Решения по преодолению ограничений масс-спектрометрии» . Метаболон . Проверено 27 октября 2022 г.
- ^ Чжоу Б., Сяо Дж. Ф., Тули Л., Рессом Х.В. (2012). «Метаболомика на основе ЖХ-МС» . Мол. БиоСист . 8 (2): 470–481. дои : 10.1039/c1mb05350g . ISSN 1742-206X . ПМЦ 3699692 . ПМИД 22041788 .
- ^ Перейти обратно: а б Махер С., Джунджу Ф.П., Тейлор С. (2015). «100 лет масс-спектрометрии: перспективы и будущие тенденции». Преподобный Мод. Физ . 87 (1): 113–135. Бибкод : 2015РвМП...87..113М . дои : 10.1103/RevModPhys.87.113 .
- ^ Шевела Д., Мессингер Дж. (ноябрь 2013 г.). «Изучение окисления воды до молекулярного кислорода в фотосинтетических и искусственных системах методом мембранно-входной масс-спектрометрии с временным разрешением» . Границы в науке о растениях . 4 : 473. doi : 10.3389/fpls.2013.00473 . ПМЦ 3840314 . ПМИД 24324477 .
- ^ Ли Х, Хуан Л, Чжу Х, Чжоу Цз (февраль 2017 г.). «Прямой анализ дыхания человека с помощью вторичной масс-спектрометрии сверхвысокого разрешения с ионизацией наноэлектроспреем: важность высокого разрешения по массе и точности массы». Быстрая связь в масс-спектрометрии . 31 (3): 301–308. Бибкод : 2017RCMS...31..301L . дои : 10.1002/rcm.7794 . ПМИД 27859758 .
- ^ Барриос-Кольядо К., Видаль-де-Мигель Дж., Мартинес-Лозано Синуэс П. (февраль 2016 г.). «Численное моделирование и экспериментальное обоснование универсального вторичного источника ионизации электрораспылением для масс-спектрометрического анализа газов в режиме реального времени» . Датчики и исполнительные механизмы B: Химические вещества . 223 : 217–225. дои : 10.1016/j.snb.2015.09.073 . hdl : 20.500.11850/105470 .
- ^ Се Й., Корфмахер В.А. (июнь 2006 г.). «Повышение скорости и производительности при использовании систем ВЭЖХ-МС/МС для метаболизма лекарств и фармакокинетического скрининга». Современный метаболизм лекарств . 7 (5): 479–89. дои : 10.2174/138920006777697963 . ПМИД 16787157 . S2CID 13612670 .
- ^ Кови Т.Р., Ли ЭД, Хенион Дж.Д. (октябрь 1986 г.). «Высокоскоростная жидкостная хроматография/тандемная масс-спектрометрия для определения лекарственных средств в биологических образцах». Аналитическая химия . 58 (12): 2453–60. дои : 10.1021/ac00125a022 . ПМИД 3789400 .
- ^ Кови Т.Р., Кроутер Дж.Б., Дьюи Э.А., Хенион Дж.Д. (февраль 1985 г.). «Термоспрей-жидкостная хроматография/масс-спектрометрическое определение лекарственных средств и их метаболитов в биологических жидкостях». Аналитическая химия . 57 (2): 474–81. дои : 10.1021/ac50001a036 . ПМИД 3977076 .
- ^ Перейти обратно: а б Гамез Г., Чжу Л., Диско А., Чен Х., Азов В., Чингин К., Кремер Г., Зеноби Р. (май 2011 г.). «Мониторинг in vivo в режиме реального времени и фармакокинетика вальпроевой кислоты с помощью нового биомаркера в выдыхаемом воздухе» . Химические коммуникации . 47 (17): 4884–6. дои : 10.1039/c1cc10343a . ПМИД 21373707 .
- ^ Перейти обратно: а б Ли Х, Мартинес-Лозано Синуэс П., Даллманн Р., Бреги Л., Холлмен М., Пру С., Браун С.А., Детмар М., Колер М., Зеноби Р. (июнь 2015 г.). «Фармакокинетика лекарственного средства, определенная с помощью анализа дыхания мыши в реальном времени». Ангеванде Хеми . 54 (27): 7815–8. дои : 10.1002/anie.201503312 . hdl : 20.500.11850/102558 . ПМИД 26015026 .
- ^ Гаугг М.Т., Энглер А., Нуссбаумер-Окснер Й., Бреги Л., Штёберл А.С., Гейсл Т., Брудерер Т., Зеноби Р., Колер М., Мартинес-Лозано Синуэс П. (сентябрь 2017 г.). «Метаболические эффекты ингаляционного сальбутамола, определяемые анализом выдыхаемого воздуха» . Журнал исследований дыхания . 11 (4): 046004. Бибкод : 2017JBR....11d6004G . дои : 10.1088/1752-7163/aa7caa . hdl : 20.500.11850/220016 . ПМИД 28901297 .
- ^ Мартинес-Лозано Синуэс П., Колер М., Браун С.А., Зеноби Р., Даллманн Р. (февраль 2017 г.). «Измерение циркадных изменений метаболизма кетамина с помощью анализа дыхания в реальном времени» . Химические коммуникации . 53 (14): 2264–2267. дои : 10.1039/C6CC09061C . ПМИД 28150005 .
- ^ Техеро Риосерас А., Сингх К.Д., Новак Н., Гаугг М.Т., Брудерер Т., Зеноби Р., Синуес П.М. (июнь 2018 г.). «Мониторинг метаболитов трикарбоновой кислоты в выдыхаемом воздухе в режиме реального времени». Аналитическая химия . 90 (11): 6453–6460. дои : 10.1021/acs.analchem.7b04600 . ПМИД 29767961 .
- ^ Феррис С., Перкинс С., Браунридж П.Дж., Кэмпбелл А., Эйерс П.А., Джонс А.Р., Эйерс CE (сентябрь 2017 г.). «Оценка параметров для уверенной локализации сайта фосфорилирования с использованием трибридного масс-спектрометра Orbitrap Fusion» . Журнал исследований протеома . 16 (9): 3448–3459. doi : 10.1021/acs.jproteome.7b00337 . ПМИД 28741359 .
- ^ Хаит БТ (2011). «Масс-спектрометрия в постгеномную эпоху». Ежегодный обзор биохимии . 80 : 239–46. doi : 10.1146/annurev-biochem-110810-095744 . ПМИД 21675917 . S2CID 2676180 . – через Ежегодные обзоры (требуется подписка)
- ^ Петри С., Бёме Д.К. (2007). «Ионы в космосе». Обзоры масс-спектрометрии . 26 (2): 258–80. Бибкод : 2007MSRv...26..258P . дои : 10.1002/mas.20114 . ПМИД 17111346 .
- ^ Хоффман Дж. Х., Чейни Р. К., Хаммак Х. (октябрь 2008 г.). «Марсианская миссия «Феникс» — термический анализатор выделяющихся газов» . Журнал Американского общества масс-спектрометрии . 19 (10): 1377–83. дои : 10.1016/j.jasms.2008.07.015 . ПМИД 18715800 .
- ^ «Плазменный спектрометр Кассини» . Юго-Западный научно-исследовательский институт . Архивировано из оригинала 08.10.2018 . Проверено 4 января 2008 г.
- ^ Райкер Дж. Б., Хаберман Б. (1976). «Мониторинг выдыхаемых газов методом масс-спектрометрии в отделении интенсивной терапии респираторных заболеваний». Медицина критических состояний . 4 (5): 223–9. дои : 10.1097/00003246-197609000-00002 . ПМИД 975846 . S2CID 6334599 .
- ^ Готард Дж.В., Баст К.М., Брэнтвейт М.А., Дэвис Н.Дж., Денисон Д.М. (сентябрь 1980 г.). «Применение респираторной масс-спектрометрии в интенсивной терапии» . Анестезия . 35 (9): 890–5. дои : 10.1111/j.1365-2044.1980.tb03950.x . ПМИД 6778243 . S2CID 41696370 .
- ^ Вербек Г., Хоффманн В., Уолтон Б. (октябрь 2012 г.). «Препаративная масс-спектрометрия с мягкой посадкой». Аналитик . 137 (19): 4393–407. Бибкод : 2012Ана...137.4393В . дои : 10.1039/C2AN35550G . ПМИД 22900257 .
- ^ Франкетти В., Солка Б.Х., Байтингер В.Е., Эми Дж.В., Кукс Р.Г. (1977). «Мягкая посадка ионов как средство модификации поверхности». Масс-спектр. Ионная физика . 23 (1): 29–35. Бибкод : 1977IJMSI..23...29F . дои : 10.1016/0020-7381(77)80004-1 .
Библиография
[ редактировать ]- Туречек Ф., Маклафферти Ф.В. (1993). Интерпретация масс-спектров . Саусалито, Калифорния: Университетские научные книги. ISBN 978-0-935702-25-5 .
- де Хоффман Э., Строобант В. (2001). Масс-спектрометрия: принципы и приложения (2-е изд.). Джон Уайли и сыновья. ISBN 978-0-471-48566-7 .
- Даунард К. (2004). Масс-спектрометрия – базовый курс . Кембридж, Великобритания: Королевское химическое общество. ISBN 978-0-85404-609-6 .
- Сюздак Г (1996). Масс-спектрометрия для биотехнологии . Бостон: Академическая пресса. ISBN 978-0-12-647471-8 .
- Дасс С. (2001). Принципы и практика биологической масс-спектрометрии . Нью-Йорк: Джон Уайли. ISBN 978-0-471-33053-0 .
- Музикар П. и др. (2003). «Ускорительная масс-спектрометрия в геологических исследованиях». Бюллетень Геологического общества Америки . 115 : 643–654. Бибкод : 2003GSAB..115..643M . doi : 10.1130/0016-7606(2003)115<0643:AMSIGR>2.0.CO;2 . ISSN 0016-7606 . S2CID 55076131 .
- Махер С., Джунджу Ф.П., Тейлор С. (2015). «100 лет масс-спектрометрии: перспективы и будущие тенденции». Преподобный Мод. Физ . 87 (1): 113–135. Бибкод : 2015РвМП...87..113М . дои : 10.1103/RevModPhys.87.113 .
- Соботт Ф (2014). Биологическая масс-спектрометрия . Бока-Ратон: Crc Pr I Llc. ISBN 978-1-4398-9527-6 .
- Спаркман ОД (2006). Справочник по масс-спектрометрии . Питтсбург: паб Global View. ISBN 978-0-9660813-9-8 .
- Уотсон Дж. Т., Спаркман О. Д. (2007). Введение в масс-спектрометрию: инструменты, приложения и стратегии интерпретации данных (4-е изд.). Чичестер: Джон Уайли и сыновья. ISBN 978-0-470-51634-8 .
- Туниз С (1998). Ускорительная масс-спектрометрия: сверхчувствительный анализ для глобальной науки . Бока-Ратон: CRC Press. ISBN 978-0-8493-4538-8 .
- Кандия М., Урбан, Польша (июнь 2013 г.). «Достижения в области сверхчувствительной масс-спектрометрии органических молекул». Обзоры химического общества . 42 (12): 5299–322. дои : 10.1039/c3cs35389c . ПМИД 23471277 .
- Кальмс Дж (2011). Массовая характеристика: биография научного прибора (МС). Массачусетский технологический институт. hdl : 1721.1/68473 .
Внешние ссылки
[ редактировать ]- Масс-спектрометрия в Керли
- Интерактивное учебное пособие по масс-спектрам Национальная лаборатория сильных магнитных полей
- Моделирование масс-спектрометра Интерактивное приложение, имитирующее консоль масс-спектрометра.
- Инструмент моделирования масс-спектров в реальном времени для моделирования масс-спектров в браузере




