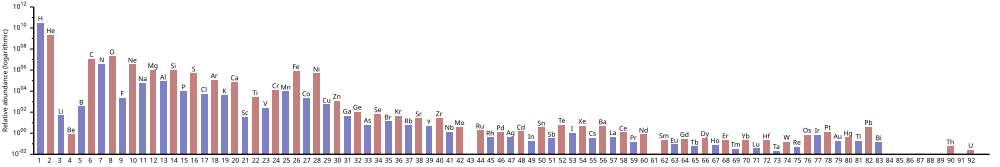
Содержание химических элементов
Распространенность химических элементов является мерой распространенности химических элементов по отношению ко всем другим элементам в данной среде. Изобилие измеряется одним из трех способов: по массовой доле (в коммерческом контексте часто называемой весовой долей ), по мольной доле (доля атомов при численном подсчете или иногда доля молекул в газах) или по объемной доле . Объемная доля является общепринятой мерой содержания в смешанных газах, таких как атмосферы планет, и по значению аналогична молекулярной мольной доле для газовых смесей при относительно низких плотностях и давлениях, а также для идеальных газовых смесей. Большинство значений численности в этой статье даны в виде массовых долей.
В изобилии химических элементов во Вселенной преобладают большие количества водорода и гелия, которые образовались во время Большого взрыва . Остальные элементы, составляющие лишь около 2% Вселенной, были в основном произведены сверхновыми . Элементы с четными атомными номерами обычно встречаются чаще, чем их соседи в таблице Менделеева , из-за благоприятной энергетики образования, известной как правило Оддо-Харкинса .
Обилие элементов на Солнце и внешних планетах аналогично таковому во Вселенной. Из-за солнечного нагрева элементы Земли и внутренних каменистых планет Солнечной системы подверглись дополнительному истощению летучих водорода, гелия, неона, азота и углерода (который улетучивается в виде метана). Кора, мантия и ядро Земли демонстрируют признаки химической сегрегации плюс некоторую секвестрацию по плотности. В земной коре встречаются более легкие силикаты алюминия, в мантии больше силикатов магния, а ядро составляют металлические железо и никель. Обилие элементов в специализированных средах, таких как атмосфера, океаны или человеческое тело, является прежде всего продуктом химического взаимодействия со средой, в которой они находятся.
Значения изобилия
[ редактировать ]Обилие каждого элемента выражается относительным числом. Астрономия использует логарифмическую шкалу изобилия. элемента X относительно Водорода, определяемого формулой для плотности числа ; в этом масштабе. [ 1 ] Другая шкала — массовая доля или, что то же самое, процент по массе. [ 2 ]
Например, содержание кислорода в чистой воде можно измерить двумя способами: массовая доля составляет около 89%, поскольку именно эту долю массы воды составляет кислород. Однако мольная доля составляет около 33%, поскольку только 1 атом из 3 в воде, H 2 O, является кислородом. В качестве другого примера, если посмотреть на содержание массовой доли водорода и гелия как во Вселенной в целом, так и в атмосферах планет -газовых гигантов, таких как Юпитер , то оно составляет 74% для водорода и 23–25% для гелия ; в то время как (атомная) мольная доля водорода в этих средах составляет 92%, а гелия - 8%. Изменение данной среды на внешнюю атмосферу Юпитера , где водород является двухатомным, а гелий - нет, изменяет молекулярную мольную долю (долю общего количества молекул газа), а также объемную долю атмосферы водорода примерно до 86%, а гелия до 13%. Под внешней атмосферой Юпитера объемные доли значительно отличаются от мольных из-за высоких температур (ионизация и диспропорционирование) и высокой плотности, где Закон идеального газа неприменим.
Вселенная
[ редактировать ]
| С | Элемент | Массовая доля (ppm) |
|---|---|---|
| 1 | Водород | 739,000 |
| 2 | Гелий | 240,000 |
| 8 | Кислород | 10,400 |
| 6 | Углерод | 4,600 |
| 10 | Неон | 1,340 |
| 26 | Железо | 1,090 |
| 7 | Азот | 960 |
| 14 | Кремний | 650 |
| 12 | Магний | 580 |
| 16 | сера | 440 |
| Общий | 999,060 |
В изобилии химических элементов во Вселенной преобладают большие количества водорода и гелия, которые образовались во время Большого взрыва . Остальные элементы, составляющие лишь около 2% Вселенной, были в основном произведены сверхновыми и некоторыми звездами-красными гигантами . Литий , бериллий и бор , несмотря на их низкий атомный номер, редки, потому что, хотя они и производятся в результате ядерного синтеза, они разрушаются в результате других реакций в звездах. [ 4 ] [ 5 ] Их естественное возникновение является результатом расщепления углерода, азота и кислорода космическими лучами в результате реакции ядерного деления. Элементы от углерода до железа относительно более распространены во Вселенной из-за легкости их получения в ходе нуклеосинтеза сверхновых . Элементы с более высокими атомными номерами, чем железо (элемент 26), становятся все более редкими во Вселенной, поскольку при своем производстве они все больше поглощают звездную энергию. Кроме того, элементы с четными атомными номерами обычно встречаются чаще, чем их соседи в таблице Менделеева , из-за благоприятной энергетики образования (см. Правило Оддо-Харкинса ), а среди самых легких нуклидов от гелия до серы наиболее распространены изотопы с равным числом протонов. и нейтроны.
Водород — самый распространенный элемент во Вселенной; гелий на втором месте. Все остальные встречаются на порядки реже. После этого ранг обилия перестает соответствовать атомному номеру . Кислород имеет ранг содержания 3, но атомный номер 8.

Известно 80 стабильных элементов, а 16 самых легких составляют 99,9% обычного вещества Вселенной. Эти же 16 элементов, от водорода до серы, попадают в начальную линейную часть Таблицы нуклидов (также называемой графиком Сегре ), графика зависимости числа протонов от нейтронов во всей материи, как обычной, так и экзотической, содержащей сотни стабильных изотопов и еще тысячи нестабильных. График Сегре изначально линеен, поскольку (кроме водорода) подавляющее большинство обычного вещества (99,4% в Солнечной системе) [ 6 ] ) содержит равное количество протонов и нейтронов (Z=N). Конечно, 74% обычной материи существует в виде мононуклонных протонов (водорода). Но когда нуклоны объединяются, образуя стабильные нуклиды, они объединяются в соотношении одна часть протона к одной части нейтрона в 99,4% обычной материи. Структурная основа равенства числа нуклонов в барионной материи — одна из самых простых и глубоких неразгаданных загадок атомного ядра.
Обилие легчайших элементов хорошо предсказывается стандартной космологической моделью , поскольку они в основном образовались вскоре (то есть в течение нескольких сотен секунд) после Большого взрыва в процессе, известном как нуклеосинтез Большого взрыва . Более тяжелые элементы в основном образовались гораздо позже, внутри звезд .
По оценкам, водород и гелий составляют примерно 74% и 24% всей барионной материи во Вселенной соответственно. Несмотря на то, что они составляют лишь очень небольшую часть Вселенной, оставшиеся «тяжелые элементы» могут сильно влиять на астрономические явления. Лишь около 2% (по массе) диска галактики Млечный Путь состоит из тяжелых элементов.
Эти другие элементы генерируются звездными процессами. [ 7 ] [ 8 ] [ 9 ] В астрономии «металл» — это любой элемент, кроме водорода и гелия. Это различие важно, поскольку водород и гелий — единственные элементы, которые образовались в значительных количествах во время Большого взрыва. , металличность галактики Таким образом или другого объекта является показателем звездной активности после Большого взрыва.
В общем, элементы вплоть до железа производятся большими звездами в процессе превращения в сверхновые или меньшими звездами в процессе умирания. Один тип железа, Железо-56 , особенно распространен, поскольку это наиболее стабильный нуклид (поскольку он имеет самую высокую энергию связи ядра на нуклон) и его можно легко получить из альфа-частиц (являющихся продуктом распада радиоактивного никеля) . -56 , в конечном итоге состоящие из 14 ядер гелия). Элементы тяжелее железа образуются в результате энергопоглощающих процессов в крупных звездах, и их содержание во Вселенной (и на Земле) обычно уменьшается с увеличением атомного номера.
В таблице показаны десять наиболее распространенных элементов в нашей галактике (по оценкам спектроскопически), измеряемые в частях на миллион по массе. [ 3 ] Близлежащие галактики, которые развивались по схожему пути, имеют соответствующее обогащение элементами тяжелее водорода и гелия. Более отдаленные галактики рассматриваются такими, какими они были в прошлом, поэтому содержание в них элементов кажется более близким к первичной смеси. Однако, поскольку физические законы и процессы, по-видимому, одинаковы во всей Вселенной, ожидается, что в этих галактиках также возникло одинаковое содержание элементов.
Как показано в таблице Менделеева , содержание элементов соответствует их происхождению. Очень распространенные водород и гелий являются продуктами Большого взрыва. Следующие три элемента таблицы Менделеева ( литий , бериллий и бор ) встречаются редко, несмотря на их низкий атомный номер. У них было мало времени для формирования в результате Большого взрыва. Они производятся в небольших количествах в результате ядерного синтеза в умирающих звездах или в результате распада более тяжелых элементов в межзвездной пыли, вызванного расщеплением космических лучей . В сверхновых они образуются в результате ядерного синтеза, но затем разрушаются в результате других реакций. [ 4 ]
Более тяжелые элементы, начиная с углерода , производятся в умирающих или сверхновых звездах путем накопления альфа-частиц (ядер гелия), что способствует поочередному увеличению содержания элементов с четными атомными номерами (они также более стабильны). Эффект того, что химические элементы с нечетными номерами обычно встречаются во Вселенной более редко, был эмпирически замечен в 1914 году и известен как правило Оддо-Харкинса .
Следующий график (примечание логарифмического масштаба) показывает содержание элементов в Солнечной системе .
| Нуклид | А | Массовая доля в частях на миллион | Атомная доля в частях на миллион |
|---|---|---|---|
| Водород-1 | 1 | 705,700 | 909,964 |
| Гелий-4 | 4 | 275,200 | 88,714 |
| Кислород-16 | 16 | 9,592 | 477 |
| Углерод-12 | 12 | 3,032 | 326 |
| Азот-14 | 14 | 1,105 | 102 |
| Неон-20 | 20 | 1,548 | 100 |
| Другие нуклиды: | 3,616 | 172 | |
| Кремний-28 | 28 | 653 | 30 |
| Магний-24 | 24 | 513 | 28 |
| Железо-56 | 56 | 1,169 | 27 |
| Сера-32 | 32 | 396 | 16 |
| Гелий-3 | 3 | 35 | 15 |
| Водород-2 | 2 | 23 | 15 |
| Неон-22 | 22 | 208 | 12 |
| Магний-26 | 26 | 79 | 4 |
| Углерод-13 | 13 | 37 | 4 |
| Магний-25 | 25 | 69 | 4 |
| Алюминий-27 | 27 | 58 | 3 |
| Аргон-36 | 36 | 77 | 3 |
| Кальций-40 | 40 | 60 | 2 |
| Натрий-23 | 23 | 33 | 2 |
| Железо-54 | 54 | 72 | 2 |
| Кремний-29 | 29 | 34 | 2 |
| Никель-58 | 58 | 49 | 1 |
| Кремний-30 | 30 | 23 | 1 |
| Железо-57 | 57 | 28 | 1 |
Связь с ядерной энергией связи
[ редактировать ]
Слабые корреляции наблюдались между оценками содержания элементов во Вселенной и кривой энергии связи ядра (также называемой энергией связи на нуклон ). Грубо говоря, относительная стабильность различных атомных нуклидов в условиях чрезвычайно энергетических условий нуклеосинтеза Большого взрыва (BBN) оказала сильное влияние на относительное содержание элементов, образовавшихся в результате Большого взрыва и в ходе развития Вселенной после него. [ 10 ]
См. статью о нуклеосинтезе , где объясняется, как определенные процессы ядерного синтеза в звездах (например, горение углерода и т. д.) создают элементы тяжелее водорода и гелия.
Еще одной наблюдаемой особенностью является неравномерное чередование относительного содержания и дефицита соседних атомных номеров в предполагаемых содержаниях химических элементов, в которых относительное содержание четных атомных номеров примерно на 2 порядка превышает относительное содержание нечетных атомных номеров ( Правило Оддо-Харкинса ). Подобное чередование четных и нечетных атомных номеров можно наблюдать на кривой энергии связи ядра в окрестности углерода и кислорода, но здесь слабая корреляция между относительным содержанием и энергией связи заканчивается. Например, энергия связи бериллия (четный атомный номер) меньше энергии связи бора (нечетный атомный номер), как показано на кривой энергии связи ядра. Кроме того, чередование энергии связи ядра между четными и нечетными атомными номерами разрешается выше кислорода, поскольку график неуклонно увеличивается до своего пика у железа. Полуэмпирическая формула массы (SEMF), также называемая формулой Вайцзеккера. или формула массы Бете-Вайцзеккера , дает теоретическое объяснение общей формы кривой энергии связи ядра. [ 11 ]
Солнце
[ редактировать ]Современная астрономия опирается на понимание обилия элементов на Солнце как часть космологических моделей. Значения численности получить трудно: даже фотосферная или наблюдательная численность зависит от моделей солнечной атмосферы и взаимодействия радиации. [ 1 ] Эти астрономические значения содержания представлены как логарифмы отношения к водороду. По этой шкале содержание водорода установлено на уровне 12. Фотосфера Солнца состоит в основном из водорода и гелия; содержание гелия колеблется примерно от 10,3 до 10,5 в зависимости от фазы солнечного цикла; [ 12 ] углерод 8,47, неон 8,29, кислород 7,69. [ 13 ] а железо оценивается в 7,62. [ 14 ]
Земля
[ редактировать ]
Земля разный образовалась из того же облака материи, из которого образовалось Солнце, но в ходе формирования и эволюции Солнечной системы планеты приобрели состав . В свою очередь, естественная история Земли привела к тому, что некоторые части этой планеты имели разную концентрацию элементов.
Масса Земли составляет примерно 5,97 × 10 24 кг. В основном по массе он состоит преимущественно из железа (32,1 %), кислорода (30,1 %), кремния (15,1 %), магния (13,9 %), серы (2,9 %), никеля (1,8 %), кальция (1,5 %). %) и алюминий (1,4%); остальные 1,2% состоят из следовых количеств других элементов. [ 15 ]
Основной состав Земли по элементарной массе примерно аналогичен общему составу Солнечной системы, с основным отличием в том, что на Земле отсутствует большое количество летучих элементов: водорода, гелия, неона и азота, а также углерод, который был потерян в виде летучих углеводородов.
Остальной элементный состав примерно типичен для «каменистых» внутренних планет, образовавшихся в термической зоне, где солнечное тепло выбрасывало в космос летучие соединения.
Земля сохраняет кислород как второй по величине компонент своей массы (и наибольшую атомную долю), главным образом за счет того, что этот элемент сохраняется в силикатных минералах , которые имеют очень высокую температуру плавления и низкое давление паров.
Корочка
[ редактировать ]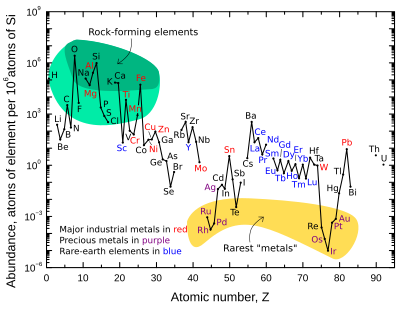
Массовое содержание девяти наиболее распространенных элементов в земной коре составляет примерно: кислород 46%, кремний 28%, алюминий 8,3%, железо 5,6%, кальций 4,2%, натрий 2,5%, магний 2,4%, калий 2,0% и титан 0,61%. Остальные элементы встречаются в количестве менее 0,15%. Полный список см. в разделе « Обилие элементов в земной коре» .
График справа иллюстрирует относительное атомное содержание химических элементов в верхней континентальной коре Земли — той части, которая относительно доступна для измерений и оценок.
Многие из элементов, показанных на графике, классифицированы по (частично перекрывающимся) категориям:
- породообразующие элементы (большие элементы - зеленое поле, второстепенные - светло-зеленое поле);
- редкоземельные элементы (лантаниды (La–Lu), Sc и Y; отмечены синим цветом);
- основные промышленные металлы (мировое производство >~3×10 7 кг/год; отмечено красным);
- драгоценные металлы (обозначены фиолетовым цветом);
- девять самых редких «металлов» — шесть элементов платиновой группы плюс Au , Re и Te (металлоид) — в желтом поле. Они редко встречаются в земной коре, поскольку растворимы в железе и поэтому сконцентрированы в ядре Земли. Теллур — единственный наиболее обедненный элемент в силикатной Земле по сравнению с космическим содержанием, поскольку он не только концентрировался в виде плотных халькогенидов в ядре, но и был сильно истощен в результате преаккреционной сортировки в туманности в виде летучего теллурида водорода . [ 17 ]
Есть два разрыва, где могут находиться нестабильные элементы технеций (атомный номер 43) и прометий (номер 61). Эти элементы окружены стабильными элементами, однако их наиболее стабильные изотопы имеют относительно короткий период полураспада (~ 4 миллиона лет и ~ 18 лет соответственно). Таким образом, они чрезвычайно редки, поскольку любые первичные количества этих элементов уже давно распались. Эти два элемента теперь производятся естественным путем только в результате спонтанного деления очень тяжелых радиоактивных элементов (таких как уран , торий или следовые количества плутония , которые существуют в урановых рудах) или в результате взаимодействия некоторых других элементов с космическими лучами . И технеций, и прометий были идентифицированы спектроскопически в атмосферах звезд, где они производятся в результате продолжающихся процессов нуклеосинтеза.
На графике содержания также есть разрывы там, где могли бы находиться шесть благородных газов , поскольку они химически не связаны в земной коре, и поэтому их содержание в земной коре четко не определено.
Восемь встречающихся в природе очень редких и высокорадиоактивных элементов ( полоний , астат , франций , радий , актиний , протактиний , нептуний и плутоний ) не включены, поскольку любой из этих элементов, присутствовавших при формировании Земли, распался много веков назад. , а их количество сегодня ничтожно и образуется только в результате радиоактивного распада урана и тория.
Кислород и кремний — наиболее распространенные элементы в земной коре. На Земле и на каменистых планетах в целом кремний и кислород встречаются гораздо чаще, чем их космическое изобилие. Причина в том, что они соединяются друг с другом, образуя силикатные минералы . [ 17 ] Другие космически распространенные элементы, такие как водород , углерод и азот, образуют летучие соединения, такие как аммиак и метан , которые легко испаряются в космос под воздействием тепла планетарного образования и/или солнечного света.
Редкоземельные элементы
[ редактировать ]Термин «редкие» земные элементы — историческое неверное название. Сохранение этого термина отражает скорее незнакомство, чем истинную редкость. Более распространенные редкоземельные элементы так же сконцентрированы в земной коре по сравнению с обычными промышленными металлами, такими как хром, никель, медь, цинк, молибден, олово, вольфрам или свинец. Два наименее распространенных стабильных редкоземельных элемента ( тулий и лютеций ) встречаются почти в 200 раз чаще, чем золото . Однако, в отличие от обычных цветных и драгоценных металлов, редкоземельные элементы имеют очень небольшую склонность к концентрации в пригодных для эксплуатации рудных месторождениях. Следовательно, большая часть мировых поставок редкоземельных элементов поступает лишь из нескольких источников. Более того, все редкоземельные металлы химически очень похожи друг на друга, и поэтому их довольно трудно разделить на чистые элементы.
Различия в содержаниях отдельных редкоземельных элементов в верхней континентальной коре Земли представляют собой суперпозицию двух эффектов: ядерного и геохимического. Во-первых, редкоземельные элементы с четными атомными номерами ( 58 Ce, 60 Nd, ...) имеют большее космическое и земное распространение, чем соседние редкоземельные элементы с нечетными атомными номерами ( 57 La, 59 Pr, ...). Во-вторых, более легкие редкоземельные элементы более несовместимы (поскольку они имеют больший ионный радиус) и, следовательно, сильнее концентрируются в континентальной коре, чем более тяжелые редкоземельные элементы. В большинстве месторождений редкоземельных руд первые четыре редкоземельных элемента — лантан , церий , празеодим и неодим — составляют от 80% до 99% общего количества редкоземельных металлов, которые можно найти в руде.
Мантия
[ редактировать ]Массовое содержание семи наиболее распространенных элементов в мантии Земли составляет примерно: кислорода 44,3%, магния 22,3%, кремния 21,3%, железа 6,32%, кальция 2,48%, алюминия 2,29%, никеля 0,19%. [ 18 ]
Основной
[ редактировать ]Считается, что из-за массовой сегрегации ядро Земли состоит в основном из железа (88,8%) с меньшим количеством никеля (5,8%), серы (4,5%) и менее 1% микроэлементов. [ 6 ]
Океан
[ редактировать ]Наиболее распространенными элементами в океане по массовым процентам являются кислород (85,84 %), водород (10,82 %), хлор (1,94 %), натрий (1,08 %), магний (0,13 %), сера (0,09 %), кальций (0,04%), калий (0,04%), бром (0,007%), углерод (0,003%) и бор (0,0004%).
Атмосфера
[ редактировать ]Порядок элементов по объемной доле (что примерно соответствует молекулярной мольной доле) в атмосфере : азот (78,1%), кислород (20,9%), [ 19 ] аргон (0,96%), за которым следуют (в неопределенном порядке) углерод и водород, поскольку водяной пар и углекислый газ, которые составляют большую часть этих двух элементов в воздухе, являются переменными компонентами. Сера, фосфор и все остальные элементы присутствуют в значительно меньших пропорциях.
Судя по графику кривой содержания, аргон, значимый, если не основной компонент атмосферы, вообще не появляется в земной коре. Это связано с тем, что атмосфера имеет гораздо меньшую массу, чем кора, поэтому аргон, остающийся в коре, мало влияет на ее массовую долю, в то время как в то же время накопление аргона в атмосфере стало достаточно большим, чтобы быть значительным.
Городские почвы
[ редактировать ]Полный список содержания элементов в городских почвах см. в разделе « Содержание элементов» (страница данных)#Urban Soils .
Человеческое тело
[ редактировать ]
По массе клетки человека на 65–90% состоят из воды (H 2 O), а значительная часть оставшейся части состоит из углеродсодержащих органических молекул. Таким образом, кислород составляет большую часть массы человеческого тела, за ним следует углерод. Почти 99% массы человеческого тела состоит из шести элементов: водорода (Н), углерода (С), азота (N), кислорода (О), кальция (Са) и фосфора (Р). Следующие 0,75% составляют следующие пять элементов: калий (K), сера (S), хлор (Cl), натрий (Na) и магний (Mg). Достоверно известно, что только 17 элементов необходимы для жизни человека, а еще один элемент (фтор) считается полезным для прочности зубной эмали. Еще несколько микроэлементов могут играть определенную роль в здоровье млекопитающих. Бор и кремний особенно необходимы растениям, но их роль в организме животных неясна. Элементы алюминий и кремний, хотя и очень распространены в земной коре, заметно редки в организме человека. [ 20 ]
Ниже представлена таблица Менделеева с указанием питательных элементов. [ 21 ]
| Основные элементы [ 22 ] [ 23 ] [ 24 ] [ 25 ] [ 26 ] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ЧАС | Он | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Что | Быть | Б | С | Н | ТО | Ф | Ne | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Уже | мг | Ал | И | П | С | кл. | С | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| К | Что | наук | Из | V | Кр | Мин. | Фе | Ко | В | С | Зн | Здесь | Ге | Как | Се | Бр | НОК | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| руб. | старший | И | Зр | Нб | Мо | Тс | Ру | резус | ПД | В | компакт-диск | В | Сн | Сб | я | Машина | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cs | Нет | * | Лу | хф | Облицовка | В | Ре | Ты | И | Пт | В | ртуть | Тл | Pb | С | Po | В | Рн | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Пт | Солнце | ** | лр | РФ | ДБ | Сг | Бх | Хс | гора | Дс | Рг | Сп | Нх | В | Мак | Лев | Ц | И | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| * | La | Этот | Пр | Нд | вечера | см | Евросоюз | Б-г | Тб | Те | К | Является | Тм | Ыб | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ** | И | че | Хорошо | В | Например | Мог | Являюсь | См | Бк | См. | Является | Фм | Мэриленд | Нет | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Легенда:
Количественные элементы
Основные микроэлементы
Существенность или функция у млекопитающих обсуждаются.
Нет доказательств биологического действия на млекопитающих, но он необходим для некоторых организмов.
(В случае с лантанидами определение незаменимого питательного вещества как незаменимого и незаменимого не вполне применимо из-за их чрезвычайного сходства. Известно, что стабильные ранние лантаноиды La-Nd стимулируют рост различных организмов, использующих лантаноиды, и Sm–Gd оказывает меньшее воздействие на некоторые такие организмы. Более поздние элементы ряда лантаноидов, по-видимому, не оказывают такого воздействия.) [ 27 ] |
См. также
[ редактировать ]- Обилие элементов (страница данных)
- Содержание элементов в земной коре
- Природное изобилие - изотопное изобилие
- Классификация Гольдшмидта - Геохимическая классификация
- Первичный нуклид - Нуклиды, существовавшие до образования Земли (обнаруженные на Земле).
- Радиационная левитация
- Список справочников по химическим элементам
Ссылки
[ редактировать ]Сноски
[ редактировать ]- ^ Перейти обратно: а б Асплунд, М.; Амарси, AM; Гревесс, Н. (01 сентября 2021 г.). «Химический состав Солнца: видение 2020 года» . Астрономия и астрофизика . 653 : А141. arXiv : 2105.01661 . дои : 10.1051/0004-6361/202140445 . ISSN 0004-6361 .
- ^ Химия (ИЮПАК), Международный союз теоретической и прикладной химии. «ИЮПАК – массовая фракция (М03722)» . goldbook.iupac.org . Проверено 29 мая 2024 г.
- ^ Перейти обратно: а б Кросвелл, Кен (февраль 1996 г.). Алхимия Небес . Якорь. ISBN 0-385-47214-5 . Архивировано из оригинала 13 мая 2011 г.
- ^ Перейти обратно: а б Ванджиони-Флам, Элизабет; Кассе, Мишель (2012). Злоба, Моник (ред.). Эволюция галактик: связь далекой Вселенной с местной летописью окаменелостей . Springer Science & Business Media . стр. 77–86. ISBN 978-9401142137 .
- ^ Тримбл, Вирджиния (1996). «Происхождение и эволюция химических элементов». В Малкане, Мэтью А.; Цукерман, Бен (ред.). Происхождение и эволюция Вселенной . Садбери, Массачусетс: Издательство Jones and Bartlett . п. 101. ИСБН 0-7637-0030-4 .
- ^ Перейти обратно: а б с Арнетт, Дэвид (1996). Сверхновые и нуклеосинтез (Первое изд.). Принстон, Нью-Джерси: Издательство Принстонского университета . п. 11. ISBN 0-691-01147-8 . OCLC 33162440 .
- ^ Зюсс, Ганс; Юри, Гарольд (1956). «Изобилие стихий». Обзоры современной физики . 28 (1): 53. Бибкод : 1956РвМП...28...53С . дои : 10.1103/RevModPhys.28.53 .
- ^ Кэмерон, AGW (1973). «Распространенность элементов в Солнечной системе». Обзоры космической науки . 15 (1): 121. Бибкод : 1973ССРв...15..121С . дои : 10.1007/BF00172440 . S2CID 120201972 .
- ^ Андерс, Э.; Эбихара, М. (1982). «Распространенность элементов Солнечной системы». Geochimica et Cosmochimica Acta . 46 (11): 2363. Бибкод : 1982GeCoA..46.2363A . дои : 10.1016/0016-7037(82)90208-3 .
- ^ Белл, Джерри А.; Редакционная/писательская группа GenChem (2005). «Глава 3: Происхождение атомов». Химия: проект Американского химического общества . Нью-Йорк [ua]: Фриман. стр. 191–193. ISBN 978-0-7167-3126-9 .
Корреляции между содержанием и энергией связи ядра [название подраздела]
- ^ Бэйли, Дэвид. «Полуэмпирическая формула ядерной массы» . PHY357: Струны и энергия связи . Университет Торонто . Архивировано из оригинала 24 июля 2011 г. Проверено 31 марта 2011 г.
- ^ Альтерман, Бенджамин Л.; Каспер, Джастин С.; Лимон, Роберт Дж.; Макинтош, Скотт В. (апрель 2021 г.). «Обилие гелия в солнечном ветре предвещает начало солнечного цикла». Солнечная физика . 296 (4): 67. arXiv : 2006.04669 . Бибкод : 2021SoPh..296...67A . дои : 10.1007/s11207-021-01801-9 . S2CID 233738140 .
- ^ Петроу, годовое общее собрание акционеров; Хоппе, Р.; Бергеманн, М.; Кальво, Ф. (2023). «Содержание кислорода на Солнце с использованием наблюдений SST/CRISP от центра до конечностей линии OI 7772 Å». Астрономия и астрофизика . 672 (4): Л6. arXiv : 2304.01048 . Бибкод : 2023A&A...672L...6P . дои : 10.1051/0004-6361/202346387 . S2CID 257912497 .
- ^ «Соотношение численности и галактическая химическая эволюция - Эндрю МакВильям» . ned.ipac.caltech.edu . Проверено 24 мая 2024 г.
- ^ Морган, JW; Андерс, Э. (1980). «Химический состав Земли, Венеры и Меркурия» . Труды Национальной академии наук . 77 (12): 6973–6977. Бибкод : 1980PNAS...77.6973M . дои : 10.1073/pnas.77.12.6973 . ПМК 350422 . ПМИД 16592930 .
- ^ Перейти обратно: а б Уильям Ф. Макдоно Состав Земли . Quake.mit.edu, заархивировано Internet Archive Wayback Machine.
- ^ Перейти обратно: а б с Андерсон, Дон Л.; «Химический состав мантии» в «Теории Земли» , стр. 147–175. ISBN 0865421234
- ^ Ван, Хайян С.; Лайнвивер, Чарльз Х.; Ирландия, Тревор Р. (01 января 2018 г.). «Содержание элементов (с неточностями) на самой похожей на Землю планете» . Икар . 299 : 460–474. дои : 10.1016/j.icarus.2017.08.024 . hdl : 1885/139094 . ISSN 0019-1035 . S2CID 119434532 .
- ^ Циммер, Карл (3 октября 2013 г.). «Кислород Земли: загадка, которую легко принять как должное» . Нью-Йорк Таймс . Архивировано из оригинала 3 октября 2013 года . Проверено 3 октября 2013 г.
- ^ Данные таблицы из Чанг, Раймонд (2007). Химия (Девятое изд.). МакГроу-Хилл . п. 52. ИСБН 978-0-07-110595-8 .
- ^ Нильсен, Форрест Х. (1998). «Ультраследовые минералы». У Мориса Э. Шилса; Джеймс А. Олсен; Моше Шайн; А. Кэтрин Росс (ред.). Современное питание в здоровье и болезни . Балтимор: Липпинкотт Уильямс и Уилкинс. стр. 283–303. hdl : 10113/46493 . ISBN 978-0683307696 .
- ^ Ультраследовые минералы. Авторы: Нильсен, Форрест Х. Министерство сельского хозяйства США, ARS Источник: Современное питание для здоровья и болезней / редакторы Морис Э. Шилс ... и др. Балтимор: Уильямс и Уилкинс, 1999 г., с. 283-303. Дата выпуска: 1999 г. URI: [1]
- ^ Шклярска Д., Ржимски П. (май 2019 г.). «Является ли литий микроэлементом? От биологической активности и эпидемиологического наблюдения к обогащению продуктов питания» . Биол Трейс Элем Рес . 189 (1): 18–27. дои : 10.1007/s12011-018-1455-2 . ПМК 6443601 . ПМИД 30066063 .
- ^ Эндерле Дж., Клинк У., Ди Джузеппе Р., Кох М., Зайдель У., Вебер К., Бирринджер М., Ратьен И., Римбах Г., Либ В. (август 2020 г.). «Уровни лития в плазме у населения в целом: перекрестный анализ метаболических и диетических корреляций» . Питательные вещества . 12 (8): 2489. дои : 10.3390/nu12082489 . ПМЦ 7468710 . ПМИД 32824874 .
- ^ Макколл А.С., Каммингс К.Ф., Бхаве Дж., Ванакор Р., Пейдж-Маккоу А., Хадсон Б.Г. (июнь 2014 г.). «Бром является важным микроэлементом для сборки каркасов коллагена IV в развитии и архитектуре тканей» . Клетка . 157 (6): 1380–92. дои : 10.1016/j.cell.2014.05.009 . ПМК 4144415 . ПМИД 24906154 .
- ^ Зородду, Мария-Антуанетта; Аасет, Ян; Криспони, Гвидо; Медичи, Серенелла; Паан, Максимилиан; Нурчи, Валерия Марина (2019). «Незаменимые для человека металлы: краткий обзор». Журнал неорганической биохимии . 195 : 120–129. дои : 10.1016/j.jinorgbio.2019.03.013 .
- ^ Дауманн, Лена Дж. (25 апреля 2019 г.). «Необходимое и повсеместное: появление металлобиохимии лантаноидов» . Angewandte Chemie, международное издание . дои : 10.1002/anie.201904090 . Проверено 15 июня 2019 г.
Примечания
[ редактировать ]Обозначения
[ редактировать ]- «Редкоземельные элементы — важнейшие ресурсы для высоких технологий | Информационный бюллетень Геологической службы США 087-02» . geopubs.wr.usgs.gov .
- «Представь Вселенную! Словарь» . 3 декабря 2003 г. Архивировано из оригинала 3 декабря 2003 г.
Внешние ссылки
[ редактировать ]- Список элементов в порядке распространенности в земной коре (с учетом только двадцати наиболее распространенных элементов)
- Космическое изобилие элементов и нуклеосинтез
- WebElements.com Списки содержания элементов во Вселенной, Солнце, метеоритах, Земле, океане, ручьях и т. д.