Распределение Максвелла – Больцмана
|
Функция плотности вероятности  | |||
|
Кумулятивная функция распределения  | |||
| Параметры | |||
|---|---|---|---|
| Поддерживать | |||
|
(где exp — показательная функция ) | |||
| CDF |
(где erf — функция ошибок ) | ||
| Иметь в виду | |||
| Режим | |||
| Дисперсия | |||
| асимметрия | |||
| Избыточный эксцесс | |||
| Энтропия | |||
В физике (в частности, в статистической механике ) распределение Максвелла-Больцмана , или распределение Максвелла (иан) — это особое распределение вероятностей, названное в честь Джеймса Клерка Максвелла и Людвига Больцмана .
Впервые он был определен и использован для описания скоростей частиц в идеализированных газах , где частицы свободно движутся внутри неподвижного контейнера, не взаимодействуя друг с другом, за исключением очень коротких столкновений , при которых они обмениваются энергией и импульсом друг с другом или со своей тепловой средой. Термин «частица» в этом контексте относится только к газообразным частицам ( атомам или молекулам ), и предполагается, что система частиц достигла термодинамического равновесия . [ 1 ] Энергии таких частиц соответствуют так называемой статистике Максвелла-Больцмана , а статистическое распределение скоростей получается путем приравнивания энергий частиц к кинетической энергии .
Математически распределение Максвелла-Больцмана представляет собой распределение хи с тремя степенями свободы (компонентами вектора скорости в евклидовом пространстве ) с параметром масштаба, измеряющим скорость в единицах, пропорциональных квадратному корню из (соотношение температуры и массы частицы). [ 2 ]
Распределение Максвелла-Больцмана является результатом кинетической теории газов , которая дает упрощенное объяснение многих фундаментальных свойств газа, включая давление и диффузию . [ 3 ] Распределение Максвелла-Больцмана в основном применимо к скоростям частиц в трех измерениях, но оказывается, что оно зависит только от скорости ( величины скорости) частиц. Распределение вероятностей скоростей частиц указывает, какие скорости более вероятны: случайно выбранная частица будет иметь скорость, случайно выбранную из распределения, и с большей вероятностью будет находиться в одном диапазоне скоростей, чем в другом. Кинетическая теория газов применима к классическому идеальному газу , который представляет собой идеализацию реальных газов. В реальных газах существуют различные эффекты (например, взаимодействия Ван-дер-Ваальса , вихревой поток, релятивистские пределы скорости и квантовые обменные взаимодействия ), которые могут сделать их распределение скоростей отличным от формы Максвелла-Больцмана. Однако разреженные газы при обычных температурах ведут себя очень близко к идеальному газу, и распределение скоростей Максвелла является отличным приближением для таких газов. Это справедливо и для идеальной плазмы , представляющей собой ионизированные газы достаточно малой плотности. [ 4 ]
Распределение было впервые получено Максвеллом в 1860 году на эвристических основаниях. [ 5 ] [ 6 ] Позже Больцман, в 1870-х годах, провел значительные исследования физической природы этого распределения. Распределение можно получить на том основании, что оно максимизирует энтропию системы. Список производных:
- Распределение вероятностей максимальной энтропии в фазовом пространстве с ограничением сохранения средней энергии
- Канонический ансамбль .
Функция распределения
[ редактировать ]Для системы, содержащей большое количество идентичных невзаимодействующих нерелятивистских классических частиц, находящихся в термодинамическом равновесии, доля частиц внутри бесконечно малого элемента трехмерного пространства скоростей d 3 v , с центром на векторе скорости величины , определяется где:
- m – масса частицы;
- k B – постоянная Больцмана ;
- Т – термодинамическая температура ;
- — функция распределения вероятностей, правильно нормированная так, что по всем скоростям равна единице.
Элемент пространства скоростей можно записать как , для скоростей в стандартной декартовой системе координат или как в стандартной сферической системе координат, где является элементом телесного угла и .
Функция распределения Максвелла для частиц, движущихся только в одном направлении, если это направление равно x , равна который можно получить путем интегрирования трехмерной формы, приведенной выше, по v y и v z .
Признавая симметрию , можно проинтегрировать по телесному углу и записать вероятностное распределение скоростей в виде функции [ 7 ]
Эта функция плотности вероятности дает вероятность на единицу скорости найти частицу со скоростью, близкой к v . Это уравнение представляет собой просто распределение Максвелла – Больцмана (приведенное в информационном окне) с параметром распределения Распределение Максвелла – Больцмана эквивалентно распределению хи с тремя степенями свободы и параметром масштаба.
Простейшее обыкновенное дифференциальное уравнение, которому удовлетворяет распределение:
или в безразмерном представлении: С помощью метода средних значений Дарвина-Фаулера распределение Максвелла-Больцмана получается как точный результат.

Релаксация к двумерному распределению Максвелла – Больцмана.
[ редактировать ]Для частиц, которые могут двигаться в плоскости, распределение скорости определяется выражением
Это распределение используется для описания систем, находящихся в равновесии. Однако большинство систем изначально не находятся в равновесном состоянии. Эволюция системы к равновесному состоянию определяется уравнением Больцмана . Уравнение предсказывает, что для короткодействующих взаимодействий равновесное распределение скоростей будет следовать распределению Максвелла – Больцмана. Справа показано моделирование молекулярной динамики (МД), в котором 900 частиц твердых сфер вынуждены двигаться по прямоугольнику. Они взаимодействуют посредством совершенно упругих столкновений . Система инициализируется вне равновесия, но распределение скоростей (синий цвет) быстро сходится к двумерному распределению Максвелла – Больцмана (оранжевый цвет).
Типичные скорости
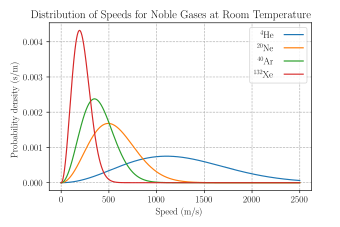
[ редактировать ]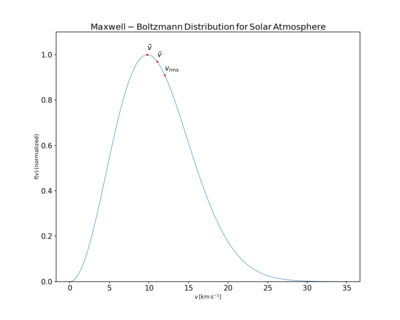
Средняя скорость , наиболее вероятная скорость ( режим ) v p и среднеквадратическая скорость можно получить из свойств распределения Максвелла.
Это хорошо работает для почти идеальных гелий одноатомных газов, таких как , но также и для молекулярных газов, таких как двухатомный кислород . Это связано с тем, что, несмотря на большую теплоемкость (большую внутреннюю энергию при той же температуре) из-за большего числа степеней свободы , их поступательная кинетическая энергия (и, следовательно, их скорость) не меняется. [ 8 ]
- Наиболее вероятная скорость vp — это скорость, которой с наибольшей вероятностью будет обладать любая молекула (той же массы m ) в системе, и она соответствует максимальному значению моде или f ( v ) . Чтобы его найти, вычислим производную установите его на ноль и найдите v : с решением: где:
- R — газовая постоянная ;
- M — молярная масса вещества, поэтому ее можно рассчитать как произведение массы на константу Авогадро NA m частицы :
Для двухатомного азота ( N 2 , основной компонент воздуха ) [ примечание 1 ] при комнатной температуре ( 300 К ) это дает
- Средняя скорость — это ожидаемое значение распределения скорости, устанавливающее :
- Средняя квадратичная скорость второго порядка – необработанный момент распределения скорости. «Среднеквадратическая скорость» - квадратный корень из среднеквадратичной скорости, соответствующей скорости частицы со средней кинетической энергией , устанавливая :
Таким образом, типичные скорости связаны следующим образом:
Среднеквадратическая скорость напрямую связана со скоростью звука c в газе соотношением где – показатель адиабаты , f – число степеней свободы отдельной молекулы газа. В приведенном выше примере двухатомный азот (приблизительно к воздуху ) при 300 К , [ примечание 2 ] и истинное значение для воздуха можно аппроксимировать, используя среднюю молярную массу воздуха ( 29 г/моль ), что дает 347 м/с при 300 К (поправки на переменную влажность составляют порядка 0,1–0,6%).
Средняя относительная скорость где трехмерное распределение скорости равно
Интеграл можно легко получить, перейдя к координатам и
Ограничения
[ редактировать ]Распределение Максвелла-Больцмана предполагает, что скорости отдельных частиц намного меньше скорости света, т.е. что . Для электронов температура электронов должна быть .
Вывод и связанные с ним распределения
[ редактировать ]Статистика Максвелла – Больцмана
[ редактировать ]Первоначальный вывод Джеймса Клерка Максвелла, сделанный в 1860 году , был аргументом, основанным на молекулярных столкновениях кинетической теории газов , а также на определенных симметриях в функции распределения по скорости; Максвелл также выдвинул один из первых аргументов в пользу того, что эти молекулярные столкновения влекут за собой тенденцию к равновесию. [ 5 ] [ 6 ] [ 9 ] По Максвеллу Людвиг Больцман в 1872 г. [ 10 ] также вывел распределение на механических основаниях и утверждал, что газы должны со временем стремиться к этому распределению из-за столкновений (см. H-теорему ). Позже он (1877 г.) [ 11 ] снова вывел распределение в рамках статистической термодинамики . Выводы в этом разделе аналогичны выводам Больцмана 1877 года, начиная с результата, известного как статистика Максвелла – Больцмана (из статистической термодинамики). Статистика Максвелла – Больцмана дает среднее количество частиц, находящихся в данном одночастичном микросостоянии . При определенных предположениях логарифм доли частиц в данном микросостоянии линейен по отношению энергии этого состояния к температуре системы: существуют константы и такой, что для всех , Предположения этого уравнения заключаются в том, что частицы не взаимодействуют и являются классическими; это означает, что состояние каждой частицы можно рассматривать независимо от состояний других частиц. Кроме того, предполагается, что частицы находятся в тепловом равновесии. [ 1 ] [ 12 ]
Это соотношение можно записать в виде уравнения, введя нормирующий множитель:
| ( 1 ) |
где:
- Ni — ожидаемое число частиц в одночастичном микросостоянии i ,
- N – общее количество частиц в системе,
- E i — энергия микросостояния i ,
- сумма по индексу j учитывает все микросостояния,
- T – равновесная температура системы,
- k B — постоянная Больцмана .
Знаменатель в уравнении 1 является нормирующим коэффициентом, так что отношения в сумме дают единицу — другими словами, это своего рода статистическая сумма (для одночастичной системы, а не обычная статистическая сумма всей системы).
Поскольку скорость и скорость связаны с энергией, уравнение ( 1 ) можно использовать для вывода взаимосвязи между температурой и скоростями частиц газа. Все, что нужно, — это обнаружить плотность микросостояний по энергии, которая определяется разделением импульсного пространства на области одинакового размера.
Распределение вектора импульса
[ редактировать ]Потенциальная энергия принимается равной нулю, так что вся энергия находится в форме кинетической энергии. Связь между кинетической энергией и импульсом для массивных нерелятивистских частиц имеет вид
| ( 2 ) |
где р 2 квадрат вектора импульса p = [ p x , p y , p z ] . Поэтому мы можем переписать уравнение ( 1 ) так:
| ( 3 ) |
где:
- Z — статистическая сумма , соответствующая знаменателю в уравнении 1 ;
- m – молекулярная масса газа;
- Т – термодинамическая температура;
- k B — постоянная Больцмана .
распределение N i : N пропорционально p функции плотности вероятности f Это для нахождения молекулы с этими значениями компонентов импульса, поэтому:
| ( 4 ) |
Нормализующую константу можно определить, если учесть, что вероятность того, что молекула будет иметь некоторый импульс, должна быть равна 1. Интегрирование экспоненты в уравнении 4 по всем p x , p y и p z дает коэффициент
Итак, нормированная функция распределения:
( 6 )
Распределение рассматривается как произведение трех независимых нормально распределенных переменных. , , и , с отклонением . Кроме того, можно видеть, что величина импульса будет распределяться как распределение Максвелла – Больцмана, причем . Распределение Максвелла – Больцмана для импульса (или, что равно, для скоростей) можно получить более фундаментально, используя H-теорему в состоянии равновесия в рамках кинетической теории газов .
Распределение энергии
[ редактировать ]Распределение энергии оказывается впечатляющим
| ( 7 ) |
где — бесконечно малый объем импульсов фазового пространства, соответствующий энергетическому интервалу dE . Используя сферическую симметрию дисперсионного уравнения энергии-импульса это можно выразить через dE как
| ( 8 ) |
Используя тогда ( 8 ) в ( 7 ) и выражая все через энергию E , получаем и наконец
( 9 )
Поскольку энергия пропорциональна сумме квадратов трех нормально распределенных компонентов импульса, это распределение энергии можно эквивалентно записать как гамма-распределение , используя параметр формы: и параметр масштаба,
Используя теорему о равнораспределении , учитывая, что энергия равномерно распределена между всеми тремя степенями свободы в равновесии, мы также можем разделить на набор распределений хи-квадрат , где энергия на степень свободы ε распределяется как распределение хи-квадрат с одной степенью свободы, [ 13 ]
В состоянии равновесия это распределение будет справедливым для любого числа степеней свободы. Например, если частицы представляют собой диполи жесткой массы с фиксированным дипольным моментом, они будут иметь три поступательные степени свободы и две дополнительные вращательные степени свободы. Энергия в каждой степени свободы будет описываться согласно вышеуказанному распределению хи-квадрат с одной степенью свободы, а полная энергия будет распределяться согласно распределению хи-квадрат с пятью степенями свободы. Это имеет значение в теории удельной теплоемкости газа.
Распределение вектора скорости
[ редактировать ]Учитывая, что плотность вероятности скорости f v пропорциональна функции плотности вероятности импульса по формуле
и используя p = m v, мы получаем
что представляет собой распределение скорости Максвелла – Больцмана. Вероятность найти частицу со скоростью в бесконечно малом элементе [ dv x , dv y , dv z ] относительно скорости v = [ v x , v y , v z ] равна
Как и импульс, это распределение рассматривается как произведение трех независимых нормально распределенных переменных. , , и , но с отклонением . Также можно видеть, что распределение скорости Максвелла – Больцмана для векторной скорости [ v x , v y , v z ] — произведение распределений для каждого из трех направлений: где распределение для одного направления равно
Каждая компонента вектора скорости имеет нормальное распределение со средним значением и стандартное отклонение , поэтому вектор имеет трехмерное нормальное распределение, особый вид многомерного нормального распределения со средним значением и ковариация , где — единичная матрица 3 × 3 .
Распределение по скорости
[ редактировать ]Распределение скорости Максвелла – Больцмана сразу следует из распределения вектора скорости, приведенного выше. Обратите внимание, что скорость и элемент объема в сферических координатах где и – сферические координатные углы вектора скорости. Интегрирование функции плотности вероятности скорости по телесным углам дает дополнительный коэффициент . Распределение скорости с заменой скорости на сумму квадратов компонент вектора:
В n -мерном пространстве
[ редактировать ]В n -мерном пространстве распределение Максвелла – Больцмана принимает вид:
Распределение скорости становится: где является нормирующей константой.
Полезен следующий интегральный результат: где это гамма-функция . Этот результат можно использовать для расчета моментов функции распределения скорости: что является самой средней скоростью
что дает среднеквадратическую скорость
Производная функции распределения скорости:
Это дает наиболее вероятную скорость ( режим )
См. также
[ редактировать ]- Квантовое уравнение Больцмана
- Статистика Максвелла – Больцмана
- Распределение Максвелла – Юттнера
- Распределение Больцмана
- Распределение Рэлея
- Кинетическая теория газов
Примечания
[ редактировать ]- ^ На расчет не влияет двухатомный азот. Несмотря на большую теплоемкость (большую внутреннюю энергию при той же температуре) двухатомных газов по сравнению с одноатомными газами из-за большего числа степеней свободы , по-прежнему является средней поступательной кинетической энергией . Двухатомность азота влияет только на значение молярной массы M = 28 г/моль . См., например, К. Пракашан, Инженерная физика (2001), 2.278 .
- ^ Азот при комнатной температуре считается «жестким» двухатомным газом с двумя вращательными степенями свободы в дополнение к трем поступательным, а колебательная степень свободы недоступна.
Ссылки
[ редактировать ]- ^ Jump up to: а б Мандл, Франц (2008). Статистическая физика . Манчестерская физика (2-е изд.). Чичестер: Джон Уайли и сыновья. ISBN 978-0471915331 .
- ^ Янг, Хью Д.; Фридман, Роджер А.; Форд, Альберт Льюис; Сирс, Фрэнсис Уэстон; Земански, Марк Уолдо. Университетская физика Сирса и Земанского: с современной физикой (12-е изд.). Сан-Франциско: Пирсон, Аддисон-Уэсли. ISBN 978-0-321-50130-1 .
- ^ Энциклопедия физики (2-е издание), Р.Г. Лернер , Г.Л. Тригг, издатели VHC, 1991, ISBN 3-527-26954-1 (издательская компания), ISBN 0-89573-752-3 (VHC Inc.)
- ^ Н. А. Кролл и А. В. Трайвелпис, Принципы физики плазмы, San Francisco Press, Inc., 1986, среди многих других текстов по основам физики плазмы.
- ^ Jump up to: а б Максвелл, Дж. К. (1860 г.): Иллюстрации динамической теории газов. Часть I. О движении и столкновениях идеально упругих сфер. Философский журнал и научный журнал Лондона, Эдинбурга и Дублина , 4-я серия, том 19, стр. 19–32. [1]
- ^ Jump up to: а б Максвелл, Дж. К. (1860 г.): Иллюстрации динамической теории газов. Часть II. О процессе диффузии двух и более видов движущихся частиц между собой. Философский журнал и научный журнал Лондона, Эдинбурга и Дублина , 4-я серия, том 20, стр. 21–37. [2]
- ^ Мюллер-Кирстен, HJW (2013). «2». Основы статистической физики (2-е изд.). Всемирная научная . ISBN 978-981-4449-53-3 . OCLC 822895930 .
- ^ Сервей, Раймонд А.; Фон, Джерри С. и Вуй, Крис (2011). Колледж физики, Том 1 (9-е изд.). Cengage Обучение. п. 352. ИСБН 9780840068484 .
- ^ Гиенис, Балаж (2017). «Максвелл и нормальное распределение: цветная история вероятности, независимости и тенденции к равновесию». Исследования по истории и философии современной физики . 57 : 53–65. arXiv : 1702.01411 . Бибкод : 2017ШПМП..57...53Г . дои : 10.1016/j.shpsb.2017.01.001 . S2CID 38272381 .
- ^ Больцманн, Л., «Дальнейшие исследования теплового баланса между молекулами газа». Труды Императорской академии наук в Вене, Classe Mathematical and Natural Sciences , 66 , 1872, стр. 275–370.
- ^ Больцманн, Л., «О связи между вторым законом механической теории тепла и расчетом вероятности или теоремами о тепловом равновесии». Отчеты о заседаниях Императорской Академии наук в Вене, Класс математических и естественных наук . Отдел II, 76 , 1877 г., стр. 373–435. в журнале «Научные том трактаты» , Перепечатано 05, в Wayback Machine.
- ^ Паркер, Сибил П. (1993). Энциклопедия физики МакГроу-Хилла (2-е изд.). МакГроу-Хилл. ISBN 978-0-07-051400-3 .
- ^ Лорандо, Норманд М. (2005). Статистическая термодинамика: основы и приложения . Издательство Кембриджского университета. п. 434 . ISBN 0-521-84635-8 .
Дальнейшее чтение
[ редактировать ]- Типлер, Пол Аллен; Моска, Джин (2008). Физика для ученых и инженеров: с современной физикой (6-е изд.). Нью-Йорк: WH Freeman. ISBN 978-0-7167-8964-2 .
- Шавит, Артур; Гутфингер, Хаим (2009). Термодинамика: от концепций к приложениям (2-е изд.). ЦРК Пресс. ISBN 978-1-4200-7368-3 . OCLC 244177312 .
- Айвз, Дэвид Дж. Г. (1971). Химическая термодинамика . Университетская химия. Макдональд Технический и научный. ISBN 0-356-03736-3 .
- Нэш, Леонард К. (1974). Элементы статистической термодинамики . Принципы химии (2-е изд.). Аддисон-Уэсли. ISBN 978-0-201-05229-9 .
- Уорд, Калифорния; Фанг, Г. (1999). «Выражение для прогнозирования потока испарения жидкости: подход статистической теории скорости». Физический обзор E . 59 (1): 429–440. дои : 10.1103/physreve.59.429 . ISSN 1063-651X .
- Рахими, П; Уорд, Калифорния (2005). «Кинетика испарения: подход статистической теории скорости». Международный журнал термодинамики . 8 (9): 1–14.
Внешние ссылки
[ редактировать ]- «Распределение скорости Максвелла» из демонстрационного проекта Wolfram в Mathworld














![{\displaystyle f(\mathbf {v})~d^{3}\mathbf {v} = {\biggl [}{\frac {m}{2\pi k_ {\text{B}}T}}{ \biggr ]}^{{3}/{2}}\,\exp \left(-{\frac {mv^{2}}{2k_{\text{B}}T}}\right)~d^ {3}\mathbf {v} ,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7d0b578ff89979fca8572da62ea179ae15023e89)








![{\displaystyle f(v)={\biggl [}{\frac {m}{2\pi k_ {\text{B}}T}}{\biggr ]}^{{3}/{2}}\ ,4\pi v^{2}\exp \left(-{\frac {mv^{2}}{2k_{\text{B}}T}}\right).}](https://wikimedia.org/api/rest_v1/media/math/render/svg/98bb4c223313a7732127081cb8420de14fee86dd)

![{\displaystyle {\begin{aligned}0&=k_ {\text{B}}Tvf'(v)+f(v)\left(mv^{2}-2k_{\text{B}}T\right) ,\\[4pt]f(1)&={\sqrt {\frac {2}{\pi }}}\,{\biggl [}{\frac {m}{k_{\text{B}}T }}{\biggr ]}^{3/2}\exp \left(-{\frac {m}{2k_{\text{B}}T}}\right);\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f09bc56bfb18cfe0569ef98c12df473e627f8fe8)
![{\displaystyle {\begin{aligned}0&=a^{2}xf'(x)+\left(x^{2}-2a^{2}\right)f(x),\\[4pt]f (1)&={\frac {1}{a^{3}}}{\sqrt {\frac {2}{\pi }}}\exp \left(-{\frac {1}{2a^{ 2}}}\вправо).\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c8f85d9d11f91bd03f3f946d088c429d58357e48)






![{\displaystyle {\frac {df(v)}{dv}}=-8\pi {\biggl [}{\frac {m}{2\pi k_ {\text{B}}T}}{\biggr ]}^{3/2}\,v\,\left[{\frac {mv^{2}}{2k_{\text{B}}T}}-1\right]\exp \left(-{ \frac {mv^{2}}{2k_{\text{B}}T}}\right)=0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f705b0159ece8500142ac11e1b1cee4d8fc6d443)




![{\displaystyle {\begin{aligned}\langle v\rangle &=\int _{0}^{\infty }v\,f(v)\,dv\\[1ex]&=4\pi \left[ {\frac {b}{\pi }}\right]^{3/2}\int _{0}^{\infty }v^{3}e^{-bv^{2}}dv=4\ pi \left[{\frac {b}{\pi }}\right]^{3/2}{\frac {1}{2b^{2}}}={\sqrt {\frac {4}{\ pi b}}}\\[1.4ex]&={\sqrt {\frac {8k_{\text{B}}T}{\pi m}}}={\sqrt {\frac {8RT}{\pi M}}}={\frac {2}{\sqrt {\pi }}}v_{\text{p}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4e1d266d125de547a3c03f1205cf63d612e458e2)


![{\displaystyle {\begin{aligned}v_{\mathrm {rms} }&={\sqrt {\langle v^{2}\rangle }}=\left[\int _{0}^{\infty }v ^{2}\,f(v)\,dv\right]^{1/2}\\[1ex]&=\left[4\pi \left({\frac {b}{\pi }}\ right)^{3/2}\int _{0}^{\infty }v^{4}e^{-bv^{2}}dv\right]^{1/2}\\[1ex]& =\left[4\pi \left({\frac {b}{\pi }}\right)^{3/2}{\frac {3}{8}}\left({\frac {\pi } {b^{5}}}\right)^{1/2}\right]^{1/2}={\sqrt {\frac {3}{2b}}}\\[1ex]&={\ sqrt {\frac {3k_{\text{B}}T}{m}}}={\sqrt {\frac {3RT}{M}}}={\sqrt {\frac {3}{2}}} v_{\text{p}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/953156e6ed42ee6fd33568ee4e1d776bca912d59)





![{\displaystyle {\begin{aligned}v_{\text{rel}}\equiv \langle |\mathbf {v} _{1}-\mathbf {v} _{2}|\rangle &=\int \! d^{3}\mathbf {v} _{1}\,d^{3}\mathbf {v} _{2}\left|\mathbf {v} _{1}-\mathbf {v} _{ 2}\right|f(\mathbf {v} _{1})f(\mathbf {v} _{2})\\[2pt]&={\frac {4}{\sqrt {\pi }} }{\sqrt {\frac {k_{\text{B}}T}{m}}}={\sqrt {2}}\langle v\rangle \end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d3581c8f4a6c03c7ffc0c2eb33cf1777e4a1bbd4)
![{\displaystyle f(\mathbf {v})\equiv \left[{\frac {2\pi k_ {\text{B}}T}{m}}\right]^{-3/2}\exp \ left(-{\frac {1}{2}}{\frac {m\mathbf {v} ^{2}}{k_{\text{B}}T}}\right).}](https://wikimedia.org/api/rest_v1/media/math/render/svg/df9a3c656dfebfee6fa77e16bef6f8d4b434973a)













![{\displaystyle \iiint _{-\infty }^{+\infty }\exp \left(- {\frac {p_{x}^{2}+p_{y}^{2}+p_{z}^ {2}}{2mk_{\text{B}}T}}\right)dp_{x}\,dp_{y}\,dp_{z}={\Bigl [}{\sqrt {\pi }}{ \sqrt {2mk_{\text{B}}T}}{\Bigr ]}^{3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5eddc1b73d3153825f1237bdae9a1d2d4231f968)
![{\displaystyle f_{\mathbf {p} }(p_{x},p_{y},p_{z})=\left[{\frac {1}{2\pi mk_{\text{B}}T }}\right]^{3/2}\exp \left(-{\frac {p_{x}^{2}+p_{y}^{2}+p_{z}^{2}}{2mk_ {\text{B}}T}}\вправо)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7aad48b8600ca1304f0f9d0779369975af58cbac)









![{\displaystyle {\begin{aligned}f_{E}(E)dE&=\left[{\frac {1}{2\pi mk_ {\text{B}}T}}\right]^{3/2 }\exp \left(-{\frac {E}{k_{\text{B}}T}}\right)4\pi m{\sqrt {2mE}}\ dE\\[1ex]&=2{ \sqrt {\frac {E}{\pi }}}\,\left[{\frac {1}{k_{\text{B}}T}}\right]^{3/2}\exp \left (-{\frac {E}{k_{\text{B}}T}}\right)\,dE\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bc92bf025227e24ed5d089a01540d65f69c7b584)
![{\displaystyle f_{E}(E)=2{\sqrt {\frac {E}{\pi }}}\,\left[{\frac {1}{k_{\text{B}}T}} \right]^{3/2}\exp \left(-{\frac {E}{k_{\text{B}}T}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d5bbfb57af3612e5585f95963f248fa6f0dea772)





![{\displaystyle f_{\mathbf {v} }(v_{x},v_{y},v_{z})={\biggl [}{\frac {m}{2\pi k_ {\text{B} }T}}{\biggr ]}^{3/2}\exp \left(-{\frac {m\left(v_{x}^{2}+v_{y}^{2}+v_{z }^{2}\right)}{2k_{\text{B}}T}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d07893f719551e500717b2f251c0d4ceafe49226)


















![{\displaystyle f(v)={\sqrt {\frac {2}{\pi }}}\,{\biggl [}{\frac {m}{k_{\text{B}}T}}{\ biggr ]}^{3/2}v^{2}\exp \left(-{\frac {mv^{2}}{2k_{\text{B}}T}}\right).}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a8998e2160261dfbd4c5637bdad7d55e31d759d4)
![{\displaystyle f(\mathbf {v})~d^{n}\mathbf {v} = {\biggl [}{\frac {m}{2\pi k_ {\text{B}}T}}{ \biggr ]}^{n/2}\exp \left(-{\frac {m|\mathbf {v} |^{2}}{2k_{\text{B}}T}}\right)~d ^{n}\mathbf {v} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ebd60f28dc06f14715812df5ca951ca908fe1fa2)


![{\displaystyle {\begin{aligned}\int _{0}^{\infty }v^{a}\exp \left(-{\frac {mv^{2}}{2k_{\text{B}} T}}\right)dv&=\left[{\frac {2k_{\text{B}}T}{m}}\right]^{\frac {a+1}{2}}\int _{0 }^{\infty }e^{-x}x^{a/2}\,dx^{1/2}\\[2pt]&=\left[{\frac {2k_{\text{B}} T}{m}}\right]^{\frac {a+1}{2}}\int _{0}^{\infty }e^{-x}x^{a/2}{\frac { x^{-1/2}}{2}}\,dx\\[2pt]&=\left[{\frac {2k_{\text{B}}T}{m}}\right]^{\ frac {a+1}{2}}{\frac {\Gamma {\left({\frac {a+1}{2}}\right)}}{2}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db7de1dcae3e4509e0985e796245060afef254f8)



![{\displaystyle {\begin{aligned}\langle v^{2}\rangle &={\frac {\displaystyle \int _{0}^{\infty }v^{2}\cdot v^{n-1 }\exp \left(-{\tfrac {mv^{2}}{2k_{\text{B}}T}}\right)\,dv}{\displaystyle \int _{0}^{\infty } v^{n-1}\exp \left(-{\tfrac {mv^{2}}{2k_{\text{B}}T}}\right)\,dv}}\\[1ex]&= \left[{\frac {2k_{\text{B}}T}{m}}\right]{\frac {\Gamma {\left({\frac {n+2}{2}}\right)} }{\Gamma {\left({\frac {n}{2}}\right)}}}\\[1.2ex]&=\left[{\frac {2k_{\text{B}}T}{ m}}\right]{\frac {n}{2}}={\frac {nk_{\text{B}}T}{m}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/209b86299f630bf948aac7c41b62f917f82647bb)

![{\displaystyle {\frac {df(v)}{dv}}=A\exp \left(- {\frac {mv^{2}}{2k_ {\text{B}}T}}\right){ \biggl [}-{\frac {mv}{k_{\text{B}}T}}v^{n-1}+(n-1)v^{n-2}{\biggr ]}=0 }](https://wikimedia.org/api/rest_v1/media/math/render/svg/2db18a7872b328bfaa2356d081c81686cb35a82c)

