Репарация ДНК

Репарация ДНК представляет собой набор процессов, с помощью которых ячейка идентифицирует и исправляет повреждение молекул ДНК , которые кодируют его геном . [ 1 ] В клетках человека как нормальная метаболическая активность, так и факторы окружающей среды, такие как радиация , могут вызывать повреждение ДНК, что приводит к десяткам тысяч отдельных молекулярных поражений на клетки в день. [ 2 ] Многие из этих поражений вызывают структурное повреждение молекулы ДНК и могут изменять или устранить способность клетки транскрибировать ген , который кодирует пораженная ДНК. Другие поражения вызывают потенциально вредные мутации в геноме клетки, которые влияют на выживание дочерних клеток после того, как он подвергается митозу . Как следствие, процесс восстановления ДНК постоянно активен, поскольку он реагирует на повреждение в структуре ДНК. Когда нормальные процессы восстановления терпят неудачу, и когда клеточный апоптоз не возникает, может возникнуть непоправимое повреждение ДНК. Это может в конечном итоге привести к злокачественным опухолям или раку в соответствии с гипотезой с двумя ударами .
Скорость восстановления ДНК зависит от различных факторов, включая тип клеток, возраст клетки и внеклеточную среду. Клетка, которая накапливала большое количество повреждения ДНК или больше не может эффективно восстанавливать свою ДНК, может войти в одно из трех возможных состояний:
- необратимое состояние покоя, известное как старение
- Клеточное самоубийство, также известное как апоптоз или запрограммированная гибель клеток
- привести к образованию опухоли раковой нерегулируемое клеточное деление, которое может
Способность к восстановлению ДНК клетки жизненно важна для целостности ее генома и, следовательно, для нормальной функциональности этого организма. Многие гены, которые изначально показали, что влияют на продолжительность жизни, оказались вовлеченными в восстановление повреждения ДНК и защиту. [ 3 ]
2015 года Нобелевская премия по химии была присуждена Томасу Линдалу , Полу Модриху и Азизу Санкару за их работу по молекулярным механизмам процессов восстановления ДНК. [ 4 ] [ 5 ]
Повреждение ДНК
[ редактировать ]Повреждение ДНК из -за факторов окружающей среды и нормальных метаболических процессов внутри клетки происходит со скоростью от 10 000 до 1 000 000 молекулярных поражений на клетку в день. [ 2 ] Несмотря на то, что это составляет не более 0,0003125% от приблизительно 3,2 миллиарда оснований человека, нетребившиеся поражения в критических генах (таких как гены -супрессоры опухолей ) могут препятствовать способности клетки выполнять свою функцию и заметно увеличить вероятность образования опухолей и способствовать Опухоль гетерогенности .
Подавляющее большинство повреждения ДНК влияет на первичную структуру двойной спирали; То есть сами базы химически модифицированы. Эти модификации, в свою очередь, могут нарушить обычную спиральную структуру молекул, внедряя неместные химические связи или громоздкие аддукты , которые не вписываются в стандартную двойную спираль. В отличие от белков и РНК , ДНК обычно не хватает третичной структуры , и, следовательно, повреждение или нарушение не возникают на этом уровне. ДНК, однако, суперксуренная и наводняясь вокруг «упаковки» белков, называемых гистонами (у эукариот), и обе суперструктуры уязвимы к воздействию повреждения ДНК.
Источники
[ редактировать ]Повреждение ДНК может быть разделено на два основных типа:
- Эндогенное повреждение, такое как атака активными формами кислорода, полученными из нормальных метаболических побочных продуктов (спонтанная мутация), особенно процесс окислительного дезаминации
- Также включает ошибки репликации
- экзогенное повреждение, вызванное внешними агентами, такими как
- Ультрафиолетовое (УФ) излучение (200–400 нм ) от солнца или других искусственных источников света
- Другие частоты радиации, включая рентген и гамма-лучи
- гидролиз или термическое нарушение
- Определенные растительные токсины
- человека Мутагенные химические вещества , особенно ароматические соединения, которые действуют как интеркалирующие агенты ДНК
- вирусы [ 6 ]
Репликация поврежденной ДНК до деления клеток может привести к включению неправильных оснований, противоположных поврежденным. Дочерние клетки, которые наследуют эти неверные основания, несут мутации, из которых исходная последовательность ДНК является невозможной (за исключением редкого случая задней мутации , например, посредством преобразования генов ).
Типы
[ редактировать ]Существует несколько типов повреждения ДНК из -за эндогенных клеточных процессов:
- Окисление оснований [например, 8-оксо-7,8-дигидрогуанин (8-оксог)] и генерация прерываний цепи ДНК от активных форм кислорода,
- Алкилирование оснований (обычно метилирование ), таких как образование 7-метилгуанозина , 1-метиладенин, 6-о-метилгуанин
- Гидролиз оснований, таких как дезаминирование , депутурирование и депурориминизация.
- «Образование громоздких аддуктов» (например, аддукт бензо [a] pyrene diol эпоксид-DG, Аддукт аристолактама I-DA)
- Несоответствие оснований из -за ошибок при репликации ДНК , в которых неправильная основа ДНК сшивается на место в недавно образующейся цепи ДНК, или основание ДНК пропускается или ошибочно вставлено.
- Повреждение моноаддука при изменении отдельного азотистого основания ДНК
- В урон аддукта
Повреждение, вызванное экзогенными агентами, соходит во многих формах. Некоторые примеры:
- Ультрафиолетовый свет вызывает сшивание между соседними основаниями цитозина и тимина , создавая димеры пиримидина . Это называется прямым повреждением ДНК .
- Ультрафиолетовый свет создает в основном свободные радикалы . Ущерб, вызванный свободными радикалами, называется косвенным повреждением ДНК .
- Ионизирующее излучение , такое как то, что создаваемое радиоактивным распадом или в космических лучах вызывает разрывы в цепях ДНК. Ионизирующее излучение промежуточного уровня может вызвать непоправимое повреждение ДНК (приводящее к репликационным и транскрипционным ошибкам, необходимым для неоплазии или может вызывать вирусные взаимодействия), что приводит к предварительному старению и раку.
- Тепловое нарушение при повышенной температуре увеличивает скорость депонирования (потеря пуриновых оснований от основы ДНК) и разрывы на одну цепь. Например, гидролитическая депонирование наблюдается в термофильных бактериях , которые растут в горячих источниках при 40–80 ° C. [ 7 ] [ 8 ] Скорость депорации (300 пуриновых остатков на геном на поколение) слишком высока у этих видов, чтобы их можно было восстановить с помощью нормального ремонта, поэтому возможность адаптивного ответа не может быть исключена.
- Промышленные химические вещества, такие как винилхлорид и перекись водорода , и химические вещества в окружающей среде, такие как полициклические ароматические углеводороды, обнаруженные в дыме, саже и смолы, создают огромное разнообразие аддуктов ДНК-этаната, окисленных оснований, алкилированных фосфодизистов и сшивки ДНК, просто имена из некоторых из них, алкилированные фосфодизисты и сшивание ДНК , просто на некоторые из них Полем
Повреждение ультрафиолета, алкилирование/метилирование, повреждение рентгеновских лучей и окислительное повреждение являются примерами индуцированного повреждения. Спонтанное повреждение может включать в себя потерю основания, дезаминанку, маринование сахарного кольца и таутомерный сдвиг. Конститутивное (спонтанное) повреждение ДНК, вызванное эндогенными окислителями, может быть обнаружено как низкий уровень фосфорилирования гистона H2AX в необработанных клетках. [ 9 ]
Ядерная и митохондрия
[ редактировать ]В клетках человека и эукариотических клетках в целом ДНК обнаруживается в двух клеточных местах - внутри ядра и внутри митохондрий . Ядерная ДНК (N-ДНК) существует в качестве хроматина на нерепликативных стадиях клеточного цикла и конденсируется в агрегатные структуры, известные как хромосомы во время деления клеток . В любом состоянии ДНК сильно уплотняется и нарастает вокруг шарипообразных белков, называемых гистонами . Всякий раз, когда клетка должна экспрессировать генетическую информацию, кодируемую в его N-ДНК, необходимая хромосомная область раскрывается, экспрессируются гены, расположенные в нем, а затем область сжата обратно к ее покоящейся конформации. Митохондриальная ДНК (мтДНК) расположена внутри органелл митохондрий , существует в нескольких копиях, а также тесно связана с рядом белков с образованием комплекса, известного как нуклеоид. Внутри митохондрий, активных форм кислорода (АФК) или свободных радикалов побочные продукты постоянной продукции аденозин -трихосфата (АТФ) посредством окислительного фосфорилирования , Создайте высоко окислительную среду, которая, как известно, повредит мтДНК. Критическим ферментом, противодействующим токсичности этих видов, является супероксиддисмутаза , которая присутствует как в митохондриях, так и в цитоплазме эукариотических клеток.
Старение и апоптоз
[ редактировать ]Старение, необратимый процесс, при котором ячейка больше не делит , является защитным ответом на укорочение концов хромосомы, называемое теломерами . Теломеры представляют собой длинные области повторяющейся некодирующей ДНК , которая ограничивает хромосомы и подвергается частичной деградации каждый раз, когда ячейка подвергается делению (см. Предел Hayflick ). [ 10 ] Напротив, покоя - это обратимое состояние клеточного покоя, которое не связано с повреждением генома (см. Клеточный цикл ). Старение в клетках может служить функциональной альтернативой апоптозу в тех случаях, когда организм требуется физическое присутствие клетки по пространственным причинам. [ 11 ] который служит механизмом «последнего курорта», чтобы предотвратить неподходящую передачу клетки с поврежденной ДНК в отсутствие передачи сигналов клеток Pro-роста . Нерегулируемое деление клеток может привести к образованию опухоли (см. Рак ), которая потенциально смертельно для организма. Следовательно, индукция старения и апоптоза считается частью стратегии защиты от рака. [ 12 ]
Мутация
[ редактировать ]Важно различать повреждение ДНК и мутацию, двумя основными типами ошибок в ДНК. Повреждение ДНК и мутация принципиально разные. Повреждение приводит к физическим аномалиям в ДНК, таких как разрывы с одной и двойной цепью, остатки 8-гидроксидеоксигуанозина и полициклические ароматические углеводородные аддукты. Повреждение ДНК может быть распознано ферментами и, следовательно, может быть правильно восстановлено, если избыточная информация, такая как неповрежденная последовательность в комплементарной цепи ДНК или в гомологичной хромосоме, доступна для копирования. Если клетка сохраняет повреждение ДНК, может быть предотвращена транскрипция гена, и, таким образом, трансляция в белок также будет блокироваться. Репликация также может быть заблокирована, или ячейка может умереть.
В отличие от повреждения ДНК, мутация - это изменение основания последовательности ДНК. Мутация не может быть распознана ферментами после того, как изменение основания присутствует в обеих целях ДНК, и, таким образом, мутация не может быть восстановлена. На клеточном уровне мутации могут вызывать изменения в функции и регуляции белка. Мутации воспроизводятся, когда клетки повторяются. В популяции клеток мутантные клетки будут увеличиваться или уменьшаться по частоте в зависимости от влияния мутации на способность клетки выживание и воспроизводить.
Хотя это отчетливо отличается друг от друга, повреждение и мутация ДНК связаны, потому что повреждение ДНК часто вызывает ошибки синтеза ДНК во время репликации или восстановления; Эти ошибки являются основным источником мутации.
Учитывая эти свойства повреждения ДНК и мутации, можно видеть, что повреждение ДНК является особой проблемой в невидающих или медленно дивиденных клетках, где нереплативное повреждение будет иметь тенденцию накапливаться с течением времени. С другой стороны, в быстро делящихся клетках не поврежденное повреждение ДНК, которое не убивает клетку путем блокировки репликации, будет иметь тенденцию вызывать ошибки репликации и, следовательно, мутацию. Подавляющее большинство мутаций, которые не являются нейтральными по своему эффекту, вредны для выживания клетки. Таким образом, в популяции клеток, составляющей ткань с реплицирующими клетками, мутантные клетки будут иметь тенденцию терять. Тем не менее, нечастые мутации, которые обеспечивают преимущество в выживании, будут иметь тенденцию к клонально расширять за счет соседних клеток в ткани. Это преимущество для клетки невыгодно для всего организма, потому что такие мутантные клетки могут привести к раку. Таким образом, повреждение ДНК в часто делящихся клетках, потому что оно дает мутации, является заметной причиной рака. Напротив, повреждение ДНК в нечасто-распадающихся клетках, вероятно, является выдающейся причиной старения. [ 13 ]
Механизмы
[ редактировать ]Клетки не могут функционировать, если повреждение ДНК повреждает целостность и доступность важной информации в геноме (но клетки остаются поверхностно функциональными, когда несущественные гены отсутствуют или повреждены). В зависимости от типа ущерба, нанесенного на двойную спиральную структуру ДНК, различные стратегии ремонта были разработаны для восстановления потерянной информации. Если возможно, клетки используют немодифицированную комплементарную цепь ДНК или сестринского хроматида в качестве шаблона для восстановления исходной информации. Без доступа к шаблону ячейки используют склонный механизм восстановления, известный как синтез трансквирования в качестве последнего средства.
Повреждение ДНК изменяет пространственную конфигурацию спирали, и такие изменения могут быть обнаружены ячейкой. Как только повреждение локализуется, специфические молекулы репарации ДНК связываются в месте повреждения или вблизи его, что вызывает другие молекулы связывать и образовывать комплекс, который позволяет фактическому восстановлению.
Прямое изменение
[ редактировать ]Известно, что клетки устраняют три типа повреждения своей ДНК, химически изменив ее. Эти механизмы не требуют шаблона, поскольку типы повреждений, которые они противодействуют, могут возникнуть только в одной из четырех оснований. Такие механизмы прямого изменения специфичны для типа повреждений и не связаны с поломкой фосфодиэфирной основы. Образование димеров пиримидина при облучении ультрафиолетовым светом приводит к ненормальной ковалентной связи между соседними основаниями пиримидина. Процесс фотореактивации непосредственно изменяет это повреждение путем действия ферментной фотолизы , активация которых обязательно зависит от энергии, поглощенной синим/ультрафиолетовым светом 300–500 нм ( длина волны ), чтобы способствовать катализу. [ 14 ] Фотолиаза, старый фермент, присутствующий в бактериях , грибах и большинстве животных больше не функционирует у людей, [ 15 ] Вместо этого используют ремонт нуклеотидного удаления , чтобы восстановить повреждение от ультрафиолетового излучения. Другой тип повреждения, метилирование гуаниновых оснований, непосредственно обращается вспять ферментом метил -гуаниновой метилтрансферазы (MGMT), бактериальный эквивалент которого называется OGT . Это дорогой процесс, потому что каждая молекула MGMT может использоваться только один раз; то есть реакция является стехиометрической, а не каталитической . [ 16 ] Обобщенный ответ на метилирующие агенты в бактериях известен как адаптивный ответ и дает уровень устойчивости к алкилирующим агентам при устойчивом воздействии путем активации ферментов репарации алкилирования. [ 17 ] Третий тип повреждения ДНК, обращенного к клеткам, представляет собой определенное метилирование оснований цитозина и аденина.
Одноцелевое повреждение
[ редактировать ]
Когда только одна из двух цепей двойной спирали имеет дефект, другая цепь можно использовать в качестве шаблона для направления коррекции поврежденной прядь. Чтобы восстановить повреждение одной из двух парных молекул ДНК, существует ряд механизмов восстановления иссечения , которые удаляют поврежденный нуклеотид и заменяют его неповрежденным нуклеотидом, дополненным тем, который обнаружен в непорочной нити ДНК. [ 16 ]
- Ремонт базового удаления (BER): поврежденные отдельные основания или нуклеотиды чаще всего ремонтируются путем удаления основания или нуклеотида, а затем вставка правильного основания или нуклеотида. При восстановлении базового удаления гликозилаза [ 18 ] Фермент удаляет поврежденное основание из ДНК, расщепляя связь между основанием и дезоксирибозой. Эти ферменты удаляют одно основание для создания аперинового или апиримидинового сайта ( сайт AP ). [ 18 ] Ферменты называют эндонуклеазы AP, пропускают поврежденную основу ДНК на сайте AP. Затем ДНК -полимераза удаляет поврежденную область, используя свою активность экзонуклеазы от 5 до 3 'и правильно синтезирует новую цепь, используя комплементарную цепь в качестве шаблона. [ 18 ] Затем зазор герметизируется ферментной ДНК -лигазой. [ 19 ]
- Реконструкция нуклеотидного удаления (NER): громоздкий, уравновешивающий спираль, такое как димеризация пиримидина, вызванную ультрафиолетовым светом, обычно восстанавливается трехэтапным процессом. Сначала ущерб распознается, затем 12-24 нуклеотидные нити ДНК удаляются как вверх, так и ниже по течению от места повреждения эндонуклеазами , а затем снятая область ДНК затем восстанавливается. [ 20 ] NER является очень эволюционно консервативным механизмом восстановления и используется практически во всех эукариотических и прокариотических клетках. [ 20 ] У прокариотов NER опосредуется UVR -белками . [ 20 ] У эукариот участвуют гораздо больше белков, хотя общая стратегия такая же. [ 20 ]
- Системы восстановления несоответствия присутствуют во всех клетках для исправления ошибок, которые не исправлены путем корректуры . Эти системы состоят как минимум из двух белков. Один обнаруживает несоответствие, а другой набирает эндонуклеазу, которая расщепляет недавно синтезированную цепь ДНК вблизи области повреждения. В E. coli участвующими белками являются белки класса Mut: Muts, Mutl и Muth. У большинства эукариот аналогом для MUT является MSH, а аналогом MUTL является MLH. Мут присутствует только у бактерий. За этим следует удаление поврежденной области экзонуклеазой, переселением ДНК -полимеразы и герметизации Ника ДНК -лигазой. [ 21 ]
Двойные перерывы
[ редактировать ]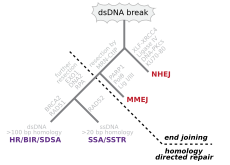
Двойные разрывы, в которых обе пряди в двойной спирали разрываются, особенно опасны для клетки, потому что они могут привести к перестройкам генома . Фактически, когда разрыв с двумя целями сопровождается сшитой, соединяющей две нити в одной и той же точке, ни одна цепь не может быть использована в качестве шаблона для механизмов восстановления, так что ячейка не сможет завершить митоз, когда Далее он делится и либо умрет, либо, в редких случаях, подвергается мутации. [ 22 ] [ 23 ] Существуют три механизмы для восстановления двухцепочечных разрывов (DSB): не-гомологичное соединение (NHEJ), микрогомологическое соединение (MMEJ) и гомологичная рекомбинация (HR): [ 16 ] [ 24 ]

- В NHEJ ДНК -лигаза IV , специализированная ДНК -лигаза , которая образует комплекс с кофактором XRCC4 , непосредственно соединяет два конца. [ 25 ] Чтобы направлять точное восстановление, NHEJ опирается на короткие гомологичные последовательности, называемые микрогомологиями, присутствующими на одноцепочечных хвостах концов ДНК, которые должны быть соединены. Если эти свесы совместимы, ремонт обычно является точным. [ 26 ] [ 27 ] [ 28 ] [ 29 ] NHEJ также может вводить мутации во время восстановления. Потеря поврежденных нуклеотидов на месте разрыва может привести к удалению и присоединению к не совместимым вставкам или транслокациям. NHEJ особенно важен до того, как клетка воспроизводила свою ДНК, поскольку для восстановления гомологичной рекомбинации нет шаблона. Есть «резервные» пути NHEJ у высших эукариот . [ 30 ] Помимо его роли в качестве смотрителя генома, NHEJ необходим для соединения двухцепочечных разрывов с покрытием, вызванными во время рекомбинации V (D) J , процесса, который генерирует разнообразие в B-клеточных и Т-клеточных рецепторах в позвоночных иммунной системе . [ 31 ]
- MMEJ начинается с краткосрочной резекции конечного уровня с помощью нуклеазы MRE11 по обе стороны от двойного разрыва, чтобы выявить области микрогомологии. [ 32 ] В дальнейших шагах, [ 33 ] Поли (ADP-рибоза) полимераза 1 (PARP1) требуется и может быть ранним этапом в MMEJ. Существует сочетание микрогомологических областей, за которыми следует рекрутирование специфической для структуры лоскута эндонуклеазы 1 (FEN1) для удаления нависающих клапанов. За этим следует рекрутирование XRCC1 - LIG3 на сайт для лигирования концов ДНК, что приводит к интактной ДНК. MMEJ всегда сопровождается делецией, так что MMEJ является мутагенным путем для репарации ДНК. [ 34 ]
- HR требует наличия идентичной или почти идентичной последовательности, которая будет использоваться в качестве шаблона для восстановления разрыва. Ферментативный механизм, ответственный за этот процесс восстановления, почти идентичен механизму, ответственному за хромосомный кроссовер во время мейоза. Этот путь позволяет восстановить поврежденную хромосому с помощью сестринской хроматиды (доступной в G2 после репликации ДНК) или гомологичной хромосомы в качестве шаблона. DSB, вызванные механическим оборудованием репликации, пытающейся синтезировать через одноцепочечный разрыв или нереплативное поражение, вызывает коллапс репликации вилки и обычно ремонтируется рекомбинацией.
В системе in vitro MMEJ произошел в клетках млекопитающих на уровнях 10–20% HR, когда были также доступны механизмы HR и NHEJ. [ 32 ]
Экстремафильный ионизирующего Deinococcus radiodurans обладает замечательной способностью выжить в повреждении ДНК от излучения и других источников. По крайней мере, две копии генома со случайными разрывами ДНК могут образовывать фрагменты ДНК путем отжига . Затем частично перекрывающиеся фрагменты используются для синтеза гомологичных областей через движущуюся D-петли , которая может продолжить расширение до тех пор, пока не будут обнаружены дополнительные нити партнеров. На последнем этапе происходит кроссовер с помощью RecA -зависимой гомологичной рекомбинации . [ 35 ]
Топоизомеразы вводят как одно-, так и двухцепочечные разрывы в ходе изменения состояния суперклейки ДНК , что особенно распространено в регионах рядом с открытой репликационной вилкой. Такие перерывы не считаются повреждением ДНК, потому что они являются естественным промежуточным звеном в биохимическом механизме топоизомеразы и немедленно восстанавливаются ферментами, которые их создали.
Другой тип двойных разрывов ДНК происходит от чувствительных к тепло или тепло-салонам ДНК. Эти сайты ДНК не являются начальными DSB. Тем не менее, они превращаются в DSB после обработки с повышенной температурой. Ионизирующее облучение может индуцировать очень сложную форму повреждения ДНК в качестве кластерного повреждения. Он состоит из различных типов поражений ДНК в различных местах спирали ДНК. Некоторые из этих тесно расположенных поражений, вероятно, могут преобразовать в DSB при воздействии высоких температур. Но точная природа этих поражений и их взаимодействия еще не известны [ 36 ]
Синтез транзирции
[ редактировать ]Синтез трансляции (TLS) представляет собой процесс толерантности к повреждению ДНК, который позволяет механизму репликации ДНК реплицировать прошлые поражения ДНК, такие как димеры тимина или сайты AP . [ 37 ] Он включает в себя переключение регулярных ДНК -полимераз для специализированных полимераз транзирования (т.е. ДНК -полимераза IV или V, из семейства Y -полимеразы), часто с более крупными активными участками, которые могут облегчить вставку оснований напротив поврежденных нуклеотидов. Считается, что переключение полимеразы опосредовано, среди прочих факторов, посттрансляционной модификацией процесса фактора репликации PCNA . Полимеразы синтеза трансляции часто имеют низкую верность (высокая склонность к вставке неправильных оснований) на неповрежденные шаблоны относительно регулярных полимераз. Тем не менее, многие из них чрезвычайно эффективны в вставке правильных оснований, противоположных конкретным типам повреждения. Например, POL η опосредует ошибку обхода поражений, вызванных ультрафиолетовым излучением , тогда как POL ι вводит мутации на этих участках. Известно, что Pol η добавляет первый аденин через T^T фотодимер с использованием спаривания основания Watson-Crick , а второй аденин будет добавлен в его син-конформацию с использованием спаривания основания Hoogsteen . С клеточной точки зрения, рискуя внедрением Точечные мутации во время синтеза трансляции могут быть предпочтительны, чтобы прибегнуть к более радикальным механизмам репарации ДНК, которые могут вызвать грубые хромосомные аберрации или гибель клеток. Короче говоря, этот процесс включает в себя специализированные полимеразы, либо обход, либо восстанавливают поражения в местах застопорившейся репликации ДНК. Например, ДНК-полимераза человека может обходить сложные поражения ДНК, такие как внутрицепочека гуанина-тимин, G [8,5-Me] T, хотя это может вызвать целевые и полуцелевые мутации. [ 38 ] Paromita raychauduery и Ashis Basu [ 39 ] изучал токсичность и мутагенез одного и того же поражения в Escherichia coli путем воспроизведения G [8,5-Me] T-модифицированной плазмиды в E. coli со специфическими нокаутами ДНК-полимеразы. Жизнеспособность была очень низкой в штамме, в котором отсутствовал Pol II, POL IV и POL V, три SOS-индуцируемые ДНК-полимеразы, что указывает на то, что синтез трансквирования проводится главным образом этими специализированными ДНК-полимеразами. Обходная платформа предоставляется для этих полимераз пролиферирующим ядерным антигеном клеток (PCNA). При нормальных обстоятельствах PCNA, связанная с полимеразами, повторяет ДНК. На месте поражения PCNA является убиквитинированным или модифицированным белками RAD6/ , RAD18 чтобы обеспечить платформу для специализированных полимераз для обхода повреждения и резюме репликации ДНК. [ 40 ] [ 41 ] После синтеза трансляции требуется расширение. Это расширение может быть выполнено репликативной полимеразой, если TLS не является ошибкой, как в случае Pol η, но если TLS приводит к несоответствию, для ее расширения необходима специализированная полимераза; Пол . Pol ζ уникален тем, что он может расширить несоответствия терминала, тогда как более обрабатывающие полимеразы не могут. Таким образом, когда встречается повреждение, вилка репликации будет задержка, PCNA переключается с обработанной полимеразы на полимеразу TLS, такую как Pol ι, чтобы исправить поражение, затем PCNA может переключаться на POL, чтобы расширить несоответствие, и последний PCNA будет переключаться к обрабатывающей полимеразе для продолжения репликации.
Глобальный ответ на повреждение ДНК
[ редактировать ]Клетки, подвергшиеся воздействию ионизирующего излучения , ультрафиолетового света или химикатов, подвержены получению нескольких мест громоздких поражений ДНК и двухцепочечных разрывов. Кроме того, наносящие ДНК -разрушительные агенты могут повредить другие биомолекулы, такие как белки , углеводы , липиды и РНК . Накопление повреждений, чтобы быть специфическим, двойным разрывами или аддуктами, останавливающими вилки репликации , являются одними из известных сигналов стимуляции для глобального ответа на повреждение ДНК. [ 42 ] Глобальный ответ на повреждение - это акт, направленный на собственное сохранение клеток, и запускает множественные пути макромолекулярного восстановления, обхода поражения, толерантности или апоптоза . Общие черты глобального ответа - индукция нескольких генов , остановка клеточного цикла и ингибирование клеточного деления .
Начальные шаги
[ редактировать ]Упаковка эукариотической ДНК в хроматин представляет собой барьер для всех процессов на основе ДНК, которые требуют рекрутирования ферментов в их участки действия. Чтобы разрешить восстановление ДНК, хроматин должен быть реконструирован . У эукариот АТФ зависимые от ремоделирования хроматина, комплексы , и гистон-модифицирующие ферменты являются двумя преобладающими факторами, использованными для выполнения этого процесса ремоделирования. [ 43 ]
Релаксация хроматина быстро происходит в месте повреждения ДНК. [ 44 ] [ 45 ] На одном из самых ранних этапов, активированная стрессом протеинкиназа, C-Jun N-концевая киназа (JNK) , фосфорилирует SIRT6 на серине 10 в ответ на двойные разрывы или другие повреждения ДНК. [ 46 ] Эта посттрансляционная модификация облегчает мобилизацию сайтов SIRT6 в повреждение ДНК и необходима для эффективного рекрутирования поли (ADP-рибозы) полимеразы 1 (PARP1) для участков разрыва ДНК и для эффективного восстановления DSB. [ 46 ] Белок PARP1 начинает появляться в местах повреждения ДНК менее чем за секунду, с половиной максимального накопления в течение 1,6 секунды после возникновения повреждения. [ 47 ] PARP1 синтезирует полимерные аденозин-дифхосфатные рибозы (поли (поли (ADP-рибоза) или номинальные) на себя. Chromatin Remodeler Далее ALC1 быстро прикрепляется к продукту действия PARP1, рибозной цепи поли-ADP, а ALC1 завершает прибытие при повреждении ДНК в течение 10 секунд после возникновения повреждения. [ 45 ] Около половины максимальной релаксации хроматина, предположительно из -за действия ALC1, происходит на 10 секунд. [ 45 ] Затем это позволяет рекрутировать фермент Mre11 , рекрутирующий ДНК , инициировать репарацию ДНК в течение 13 секунд. [ 47 ]
γH2AX, фосфорилированная форма H2AX также участвует в ранних этапах, приводящих к деконденсации хроматина после разрыва ДНК. Вариант гистонов H2AX составляет около 10% гистонов H2A в хроматине человека. [ 48 ] γH2AX (H2AX фосфорилируется на серине 139) может быть обнаружен через 20 секунд после облучения клеток (с образованием двойного разрыва ДНК), и половина максимального накопления γH2AX происходит за одну минуту. [ 48 ] Степень хроматина с фосфорилированным γH2AX составляет около двух миллионов пар оснований в месте разрыва с двумя целями ДНК. [ 48 ] γH2AX, сам по себе, вызывает деконденсацию хроматина, но в течение 30 секунд после облучения белок RNF8 может быть обнаружен в связи с γH2AX. [ 49 ] RNF8 опосредует обширную деконденсацию хроматина посредством последующего взаимодействия с CHD4 , [ 50 ] Компонент ремоделирования нуклеосомы и деацетилазного комплекса Nurd .
DDB2 встречается в гетеродимерном комплексе с DDB1 . Этот комплекс дальнейшие комплексы с убиквитин -лигазы белком Cul4a [ 51 ] и с PARP1 . [ 52 ] Этот более крупный комплекс быстро ассоциируется с ультрафиолетовым повреждением в рамках хроматина, а ассоциация полумаксимума завершена за 40 секунд. [ 51 ] Белок PARP1, прикрепленный как к DDB1, так и к DDB2, затем парилаты (создает рибозовую цепь поли-ADP) на DDB2, который притягивает белок ремоделирования ДНК ALC1 . [ 52 ] Действие ALC1 расслабляет хроматин в месте повреждения ультрафиолетового ультрафиолета ДНК. Эта релаксация позволяет другим белкам в пути восстановления нуклеотидных ударов , чтобы войти в хроматин и восстанавливать ультрафиолетовые ультрафиолетовые димер циклобутановых пиримидина .
После быстрого хроматина ремоделирования клеточного цикла активируется контрольно -пропускной способности , чтобы позволить репарации ДНК происходить до прогрессирования клеточного цикла. Во -первых, две киназы , ATM и ATR активируются в течение 5 или 6 минут после повреждения ДНК. За этим следует фосфорилирование белка контрольно -пропускной точки клеточного цикла CHK1 , инициируя его функцию, примерно через 10 минут после повреждения ДНК. [ 53 ]
Контрольные точки повреждения ДНК
[ редактировать ]После повреждения ДНК клеточного цикла контрольные точки активируются . Активация контрольно -пропускной пункты приостанавливает клеточный цикл и дает ячейку для восстановления повреждения, прежде чем продолжать разделять. Контрольные точки повреждения ДНК встречаются на G1 / S и G2 / M. границах Интрасферная контрольная точка также существует . Активация контрольной точки контролируется двумя мастер -киназами , ATM и ATR . АТМ реагирует на разрывы и нарушения ДНК в структуре хроматина, [ 54 ] в то время как ATR в первую очередь реагирует на остановленные репликационные вилки . Эти киназы фосфорилируют вниз по течению мишени в каскаде передачи сигнала , что в конечном итоге приводит к остановке клеточного цикла. класс межсетевников -концентраций, включая BRCA1 , MDC1 и 53BP1 . Был также идентифицирован [ 55 ] Эти белки, по -видимому, требуются для передачи сигнала активации контрольной точки на нижестоящие белки.
Контрольная точка повреждения ДНК представляет собой путь трансдукции сигнала , который блокирует прогрессирование клеточного цикла в G1, G2 и метафазе и замедляет скорость прогрессирования фазы S при ДНК повреждении . Это приводит к паузе в клеточном цикле, что позволяет временному ячейку восстановить повреждение, прежде чем продолжать разделять.
Белки контрольной точки могут быть разделены на четыре группы: фосфатидилинозитол 3-киназа (PI3K), подобная протеинкиназе , пролиферирующая ядерная антиген-антиген (PCNA), две киназы серина/треонина (S/T) и их адаптеры. Центрально во всех индуцированных поврежденными повреждениями ДНК ответы на контрольные точки-пара крупных протеинкиназ, принадлежащих к первой группе PI3K-подобных протеинкиназах-атмосфера ( атаксия телефангиэктазия мутированная ) и ATR (атаксиа- и RAD-связанные) киназы, чья последовательность и функции ATR (атаксиа- и RAD), последовательность и функции, последовательность, последовательность и функции AT были хорошо сохранились в эволюции. Весь ответ на повреждение ДНК требует либо ATM, либо ATR, поскольку они обладают способностью связываться с хромосомами в месте повреждения ДНК, вместе с вспомогательными белками, которые являются платформами, на которых могут быть собраны компоненты реакции на повреждение ДНК и комплексы репарации ДНК.
Важной нисходящей целью ATM и ATR является p53 , так как это требуется для индукции апоптоза после повреждения ДНК. [ 56 ] Ингибитор циклин -зависимой киназы p21 индуцируется как p53-зависимыми и p53-независимыми механизмами и может остановить клеточный цикл на контрольно-пропускных пунктах G1/S и G2/M путем деактивации циклина / циклина-зависимых киназных комплексов. [ 57 ]
Прокариотический ответ SOS
[ редактировать ]Ответ SOS - это изменения в экспрессии генов в Escherichia coli и других бактериях в ответ на обширное повреждение ДНК. Прокариотическая : система SOS регулируется двумя ключевыми белками Lexa и Reca . Lexa Гомодимер - это транскрипционный репрессор , который связывается с последовательностями операторов, обычно называемых коробками SOS. В Escherichia coli известно, что Lexa регулирует транскрипцию приблизительно 48 генов, включая гены Lexa и Reca. [ 58 ] Известно, что ответ SOS широко распространен в домене бактерий, но в основном он отсутствует в некоторых бактериальных филах, таких как спирохеты . [ 59 ] Наиболее распространенными клеточными сигналами, активирующими ответ SOS, являются области одноцепочечной ДНК (SSDNA), возникающие в результате застопорированных репликационных вилок или двухцепочечных разрывов, которые обрабатываются ДНК-геликазой для разделения двух цепи ДНК. [ 42 ] На стадии инициации белок RecA связывается с ssDNA в реакции, управляемой гидролизом АТФ, создавая нити RecA -SSDNA. Филаменты RecA -SSDNA активируют активность Auto Protease LEXA , что в конечном итоге приводит к расщеплению димера LEXA и последующей деградации LEXA. Потеря репрессора LEXA индуцирует транскрипцию генов SOS и обеспечивает дальнейшую индукцию сигнала, ингибирование клеточного деления и увеличение уровней белков, ответственных за обработку повреждений.
В Escherichia coli коробки SOS представляют собой 20-нуклеотидные последовательности вблизи промоторов с палиндромической структурой и высокой степенью сохранения последовательностей. В других классах и Phyla последовательность коробок SOS значительно варьируется, с различной длиной и составом, но она всегда высоко консервативна и один из самых сильных коротких сигналов в геноме. [ 59 ] Высокое информационное содержание в SOS -коробках позволяет дифференциальному связыванию LEXA с различными промоторами и позволяет использовать время ответа SOS. Гены восстановления поражения индуцируются в начале ответа SOS. Ошибные ошибки полимеразы, например, Umucd'2 (также называемый ДНК-полимеразой V), позже индуцируются в качестве последнего средства. [ 60 ] Как только повреждение ДНК восстанавливается или обходится с использованием полимераз или посредством рекомбинации, количество одноцепочечной ДНК в клетках уменьшается, снижая количество филаментов Reca, уменьшает активность расщепления гомодимера LEXA, который затем связывается с коробками SOS вблизи промоторов и восстановления Нормальная экспрессия генов.
Эукариотические транскрипционные реакции на повреждение ДНК
[ редактировать ]Эукариотические клетки, подвергшиеся воздействию ДНК, наносящие на нет агенты, также активируют важные защитные пути, индуцируя множественные белки, участвующие в репарации ДНК, контрольный контроль клеточного цикла , перенос белка и деградация. Такой транскрипционный отклик в широком геноме очень сложный и строго регулируемый, что позволяет скоординировать глобальный ответ на повреждение. Воздействие дрожжей Saccharomyces cerevisiae на разрушительные агенты ДНК приводит к перекрывающимся, но различным транскрипционным профилям. Сходство с ответом на экологический шок указывает на то, что на уровне транскрипционной активации существует общий глобальный путь реакции на стресс. Напротив, различные типы клеток человека реагируют на повреждение по -разному, указывая на отсутствие общего глобального ответа. Вероятное объяснение этого различия между дрожжами и клетками человека может быть в гетерогенности клеток млекопитающих . У животного различные типы клеток распределяются между различными органами, которые развивали различную чувствительность к повреждению ДНК. [ 61 ]
В общем глобальном ответе на повреждение ДНК включает экспрессию нескольких генов, ответственных за репарацию постеплирования , гомологичную рекомбинацию, репарацию нуклеотидного удаления, контрольную точку повреждения ДНК , глобальную активацию транскрипции, гены, контролирующие распад мРНК и многие другие. Большое количество повреждений клетки оставляет ее с важным решением: пройти апоптоз и умирать или выжить за счет жизни с модифицированным геномом. Увеличение толерантности к повреждению может привести к увеличению скорости выживаемости, что позволит большему накоплению мутаций. Дрожжи Rev1 и человеческая полимераза η являются членами семейства Y -обработки ДНК -полимеразы, присутствующих во время глобального ответа на повреждение ДНК, и отвечают за усиление мутагенеза во время глобального ответа на повреждение ДНК у эукариот. [ 42 ]
Старение
[ редактировать ]Патологические эффекты плохого восстановления ДНК
[ редактировать ]
Экспериментальные животные с генетическим дефицитом при восстановлении ДНК часто показывают снижение срока службы и повышение заболеваемости раком. [ 13 ] Например, мыши с дефицитом доминирующего пути NHEJ и в механизмах поддержания теломер чаще получают лимфому и инфекции и, как следствие, имеют более короткие сроки продолжительности, чем мыши дикого типа. [ 62 ] Аналогичным образом мыши с дефицитом ключевого репарации и транскрипционного белка, который раскручивает спирали ДНК, имеют преждевременное начало заболеваний, связанных с старением, и, как следствие, сокращение продолжительности жизни. [ 63 ] Однако не каждый дефицит восстановления ДНК создает именно прогнозируемые эффекты; Мыши с дефицитом в пути NER демонстрировали сокращенную продолжительность жизни без соответственно более высоких показателей мутации. [ 64 ]
Максимальная жизнь мышей и , голых молей составляет соответственно ~ 3, ~ 30 и людей ~ 129 лет. [ 65 ] Из них самые короткие живые виды, мышь, экспрессируют гены репарации ДНК, включая основные гены в нескольких путях репарации ДНК, на более низком уровне, чем люди и голые крот. [ 65 ] Кроме того, несколько путей репарации ДНК у людей и голых молей повышаются по сравнению с мышей. Эти наблюдения предполагают, что повышенная репарация ДНК облегчает большую долговечность . [ 65 ]
Если скорость повреждения ДНК превышает способность клетки восстанавливать ее, накопление ошибок может перегружать клетку и привести к раннему старению, апоптозу или раку. Унаследованные заболевания, связанные с неисправным функционированием репарации ДНК, приводят к преждевременному старению, [ 13 ] Повышенная чувствительность к канцерогенам и соответственно повышенный риск рака (см. Ниже ). С другой стороны, организмы с усиленными системами восстановления ДНК, такими как Deinococcus radiodurans , наиболее устойчивый к радиационно-устойчивому организму, демонстрируют удивительную устойчивость к двойной цепочке, индуцирующим эффекты радиоактивности , вероятно, из-за повышения эффективности ДНК и особенно Nhej. [ 66 ]
Долговечность и ограничение калорийности
[ редактировать ]
Ряд отдельных генов были идентифицированы как влияющие на различия в жизни в популяции организмов. Эффекты этих генов сильно зависят от окружающей среды, в частности, от диеты организма. Ограничение калорий , воспроизводимо, приводит к увеличению срока службы в различных организмах, вероятно, через пути зондирования питательных веществ и снижение скорости метаболизма . Молекулярные механизмы, с помощью которых такое ограничение приводит к удлиненному сроку службы, пока еще неясны (см. [ 67 ] для некоторого обсуждения); Однако поведение многих генов, которые, как известно, участвуют в репарации ДНК, изменяется в условиях ограничения калорий. Было показано, что несколько агентов обладают антивозрастными свойствами, ослабляют конститутивный уровень передачи сигналов mTOR , доказательства снижения метаболической активности и одновременно для снижения конститутивного уровня повреждения ДНК, индуцированного эндогенно генерируемыми активными видами кислорода. [ 68 ]
Например, увеличение дозировки генов гена SIR-2, которое регулирует упаковку ДНК в черве нематод Caenorhabditis elegans , может значительно продлить срок службы. [ 69 ] Известно, что гомолог с SIR-2 млекопитающего индуцирует факторы восстановления ДНК, связанные с NHEJ, активность, которая особенно продвигается в условиях ограничения калорий. [ 70 ] Ограничение калорий было тесно связано со скоростью восстановления базового удаления в ядерной ДНК грызунов, [ 71 ] Хотя аналогичные эффекты не наблюдались в митохондриальной ДНК. [ 72 ]
Age-1 гена C. elegans , возвышающийся эффектор путей восстановления ДНК, обеспечивает резкую продолжительность жизни в условиях свободного кормления, но приводит к снижению репродуктивной пригодности в условиях ограничения калорий. [ 73 ] Это наблюдение подтверждает плейотропии теорию биологического происхождения старения , что предполагает, что гены, дающие большое преимущество в выживании в начале жизни, будут выбраны, даже если они несут соответствующий недостаток в конце жизни.
Медицина и модуляция репарации ДНК
[ редактировать ]Наследственные расстройства восстановления ДНК
[ редактировать ]Дефекты в механизме NER ответственны за несколько генетических расстройств, в том числе:
- Pigmentosum xeroderma : гиперчувствительность к солнечному свету/УФ, что приводит к повышению заболеваемости раком кожи и преждевременным старению
- Синдром Кокейна : гиперчувствительность к ультрафиолетовым и химическим агентам
- Трихотиодистрофия : чувствительная кожа, хрупкие волосы и ногти
Ментальная отсталость часто сопровождает последние два расстройства, что указывает на повышенную уязвимость нейронов развития.
Другие расстройства восстановления ДНК включают:
- Синдром Вернера : преждевременное старение и отсталый рост
- Синдром Блума : гиперчувствительность солнечного света, высокая частота злокачественных новообразований (особенно лейкемии ).
- Атаксия Телангиэктазия : Чувствительность к ионизирующему радиации и некоторым химическим агентам
Все вышеперечисленные заболевания часто называют «сегментарными прогериями » (« ускоренные болезни старения »), потому что пожилые люди кажутся пожилыми и испытывают связанные с старением заболевания в ненормально молодом возрасте, а не проявляются все симптомы старости.
Другие заболевания, связанные с снижением функции восстановления ДНК, включают анемию Фанкони , наследственный рак молочной железы и наследственный рак толстой кишки .
Рак
[ редактировать ]Из -за неотъемлемых ограничений в механизмах восстановления ДНК, если бы люди жили достаточно долго, все они в конечном итоге развивают рак. [ 74 ] [ 75 ] Существует как минимум 34 наследственные мутации генов, репаратирующих ДНК человека, которые увеличивают риск рака . Многие из этих мутаций приводят к тому, что репарация ДНК будет менее эффективным, чем норм. В частности, наследственный неполипоз колоректальный рак (HNPCC) тесно связан со специфическими мутациями в пути восстановления несоответствия ДНК. BRCA1 и BRCA2 , два важных гена, чьи мутации дают чрезвычайно повышенный риск развития рака молочной железы на носителях, [ 76 ] оба связаны с большим количеством путей репарации ДНК, особенно NHEJ и гомологичной рекомбинации.
Процедуры терапии рака, такие как химиотерапия и лучевая работа, путем подавляющей способности клетки восстанавливать повреждение ДНК, что приводит к гибели клеток. Клетки, которые наиболее быстро делятся - наиболее обычно поражаются раковые клетки. Побочный эффект состоит в том, что также влияют другие нездоровые, но быстро разделительные клетки, такие как клетки-предшественники в кишечнике, коже и гемопоэтической системе. Современное лечение рака пытается локализовать повреждение ДНК к клеткам и тканям, связанным только с раком, либо с помощью физических средств (концентрация терапевтического агента в области опухоли), либо биохимическими средствами (используя особенность, уникальную для раковых клеток в организме) Полем В контексте терапии, нацеленной на гены реакции на повреждение ДНК, последний подход был назван «синтетической летальностью». [ 77 ]
Возможно, наиболее известным из этих препаратов «синтетической летальности» является ингибитор поли (ADP-Ribose) полимеразы 1 ( PARP1 ) Олапариб , который был одобрен Управлением по пищевым продуктам и лекарствам в 2015 году для лечения у женщин с яичниками BRCA, дефективными яичниками BRCA, яичниками, дефектными BRCA. рак. Опухолевые клетки с частичной потерей ответа на повреждение ДНК (в частности, гомологичной реконбиционированной реконструкции) зависят от другого механизма-восстановления разрыва с одной цепей-который является механизмом, частично состоящим из продукта гена PARP1. [ 78 ] Олапариб объединяется с химиотерапевтическими препаратами, чтобы ингибировать репарацию разрыва в одну цепь, вызванное повреждением ДНК, вызванным совместной химиотерапией. Опухолевые клетки, полагаемые на этот остаточный механизм восстановления ДНК, не могут восстановить повреждение и, следовательно, не способны выжить и пролиферировать, тогда как нормальные клетки могут восстанавливать повреждение с помощью функционирующего гомологичного механизма рекомбинации.
Многие другие препараты для использования против других остаточных механизмов восстановления ДНК, обычно встречающихся при раке, в настоящее время изучаются. Тем не менее, синтетическая летальность терапевтических подходов были подвергнуты сомнению из -за возникающих доказательств приобретенной устойчивости, достигнутых путем пересмотра путей ответа на повреждение ДНК и реверсии ранее ингибируемых дефектов. [ 79 ]
Дефекты восстановления ДНК при раке
[ редактировать ]За последние несколько лет стало очевидным, что реакция на повреждение ДНК действует как барьер для злокачественной трансформации прнеопластических клеток. [ 80 ] Предыдущие исследования показали повышенную реакцию повреждения ДНК в моделях клеток с активацией онкогена [ 81 ] и прнеопластические аденомы толстой кишки. [ 82 ] Механизмы ответа на повреждение ДНК запускают остановку клеточного цикла и пытаются восстановить поражения ДНК или способствовать гибели/старению клеток, если восстановление невозможно. Стресс репликации наблюдается в преенепластических клетках из -за повышенных сигналов пролиферации от онкогенных мутаций. Напряжение репликации характеризуется: повышенное инициацию репликации/увольнение происхождения; повышенная транскрипция и столкновения комплексов повторения транскрипции; дефицит нуклеотидов; Увеличение активных форм кислорода (АФК). [ 83 ]
Стресс репликации, наряду с отбором для инактивирующих мутаций в генах ответа на повреждение ДНК в эволюции опухоли, [ 84 ] приводит к подавлению и/или потере некоторых механизмов реакции на повреждение ДНК, а также, следовательно, потери репарации ДНК и/или старения/запрограммированной гибели клеток. В экспериментальных моделях мышей потерю ответа на повреждение ДНК наблюдалась старение клеток после использования РНК короткой шпильки (SHRNA) для ингибирования двухцепочкой киназы атаксии-атаксии ( ATM ), что приводит к увеличению размера опухоли и инвазивности. [ 82 ] Люди, рожденные с унаследованными дефектами в механизмах восстановления ДНК (например, синдром Лифамени ), имеют более высокий риск рака. [ 85 ]
Распространенность мутаций ответа на повреждение ДНК отличается по типам рака; Например, 30% инвазивных карциномы молочной железы имеют мутации в генах, участвующих в гомологичной рекомбинации. [ 80 ] При раке подавляющая регуляция наблюдается во всех механизмах ответа на повреждение ДНК (репарация базового удаления (BER), репарация нуклеотидного удаления (NER), восстановление несоответствия ДНК (MMR), гомологичная реконбинация (HR), не-гомологичное соединение (NHEJ) и Синтез ДНК транзирования (TLS). [ 86 ] Помимо мутаций к генам восстановления повреждения ДНК, мутации также возникают в генах, ответственных за арест клеточного цикла , чтобы обеспечить достаточное время для репарации ДНК, и некоторые гены участвуют как в репарации повреждения ДНК, так и в контроле контрольно -пропускного пункта клеточного цикла, например, например ATM и Checkpoint Kinase 2 (CHEK2)-супрессор опухоли, который часто отсутствует или подавляется при немелкоклеточном раке легких. [ 87 ]
| Кадровый | Nhej | SSA | Но | Направление | ВНИЗ | Ммр | |
|---|---|---|---|---|---|---|---|
| Банкомат | |||||||
| Аттра | |||||||
| Paxip | |||||||
| Rpa | |||||||
| KRCA1 | |||||||
| BRCA2 | |||||||
| RAD51 | |||||||
| RFC | |||||||
| Xrcc1 | |||||||
| PCNA | |||||||
| Парп1 | |||||||
| ERC1 | |||||||
| MSH3 |
Дефекты репарации эпигенетического восстановления ДНК при раке
[ редактировать ]Классически рак рассматривался как набор заболеваний, которые обусловлены прогрессирующими генетическими аномалиями, которые включают мутации в генах и онкогенах, а онкогены, а также хромосомные аберрации. Тем не менее, стало очевидно, что рак также обусловлен эпигенетическими изменениями . [ 88 ]
Эпигенетические изменения относятся к функционально значимым модификациям генома, которые не включают изменения в нуклеотидную последовательность. Примерами таких модификаций являются изменения в метилировании ДНК (гиперметилирование и гипометилирование) и модификация гистонов , [ 89 ] Изменения в хромосомной архитектуре (вызванные неуместной экспрессией белков, таких как HMGA2 или HMGA1 ) [ 90 ] и изменения, вызванные микроРНК . Каждое из этих эпигенетических изменений служит для регулирования экспрессии генов без изменения основной последовательности ДНК . Эти изменения обычно остаются через клеточные разделения , последующие для нескольких клеточных поколений и могут считаться эпимутациями (эквивалентны мутациям).
В то время как большое количество эпигенетических изменений обнаруживается при раке, эпигенетические изменения в генах репарации ДНК, вызывая сниженную экспрессию белков репарации ДНК, по -видимому, особенно важны. Считается, что такие изменения происходят на ранних стадиях рака и являются вероятной причиной генетической нестабильности, характерной для рака. [ 91 ] [ 92 ] [ 93 ]
Пониженная экспрессия генов репарации ДНК вызывает дефицит ДНК репарации. Когда репарация ДНК является дефицитным повреждением ДНК, остается в клетках на более высоком, чем обычный уровень, и эти избыточные повреждения вызывают увеличение частоты мутации или эпимутации. Скорость мутаций существенно увеличивается в клетках, дефектных при восстановлении несоответствия ДНК [ 94 ] [ 95 ] или в гомологичном рекомбинационном восстановлении (HRR). [ 96 ] Хромосомные перестройки и анеуплоидия также увеличиваются в дефектных клетках HRR. [ 97 ]
Более высокие уровни повреждения ДНК не только вызывают увеличение мутации, но и вызывают повышение эпимутации. Во время восстановления двойных разрывов ДНК или восстановления других повреждений ДНК не полностью очищенные участки восстановления могут вызвать эпигенетическое молчание генов. [ 98 ] [ 99 ]
Недостаточная экспрессия белков репарации ДНК из -за наследственной мутации может вызвать повышенный риск развития рака. Люди с унаследованным нарушением в любом из 34 генов репарации ДНК (см. Статью дефицит дефицита ДНК ) имеют повышенный риск развития рака, причем некоторые дефекты вызывают 100% вероятность жизни рака (например, мутации p53). [ 100 ] Тем не менее, такие мутации зародышевой линии (которые вызывают синдромы с высоким содержанием пенетрантов рака) являются причиной только около 1 процента раковых заболеваний. [ 101 ]
Частоты эпимутаций в генах репарации ДНК
[ редактировать ]
Недостатки в ферментах репарации ДНК иногда вызваны недавно возникающей соматической мутацией в гене репарации ДНК, но гораздо чаще вызваны эпигенетическими изменениями, которые снижают или молчали экспрессию генов репарации ДНК. Например, когда 113 колоректальных раковых заболеваний были исследованы в последовательности, только у четырех была миссенс -мутация в гене репарации ДНК MGMT , в то время как большинство имели снижение экспрессии MGMT из -за метилирования промоторной области MGMT (эпигенетическое изменение). [ 102 ] Пять различных исследований показали, что от 40% до 90% рака колоректального рака снизились экспрессия MGMT из -за метилирования промоторной области MGMT. [ 103 ] [ 104 ] [ 105 ] [ 106 ] [ 107 ]
Аналогично, из 119 случаев несоответствия дефицитного колоректального рака, в котором отсутствовала экспрессия гена DNA PMS2 , PMS2 был дефицит в 6 из-за мутаций в гене PMS2, в то время как в 103 случаях экспрессия PMS2 была дефицита, поскольку его партнер со спариванием MLH1 был репрессирован из-за из-за Для промотора метилирования (белок PMS2 нестабилен в отсутствие MLH1). [ 108 ] В других 10 случаях потеря экспрессии PMS2, вероятно, была вызвана эпигенетической сверхэкспрессией микроРНК , miR -155 , которая подавляет MLH1. [ 109 ]
В другом примере эпигенетические дефекты были обнаружены при различных раковых заболеваниях (например, грудь, яичники, колоректальная и голова и шея). Две или три недостатки в экспрессии ERCC1 , XPF или PMS2 возникают одновременно в большинстве раков толстой кишки, оцененных Facista et al. [ 110 ]
В таблице в этом разделе показаны некоторые частые ДНК -разрушительные агенты, примеры поражений ДНК, которые они вызывают, и пути, которые касаются этих повреждений ДНК. По меньшей мере 169 ферментов либо непосредственно используются в процессах репарации ДНК, либо влияют на процессы репарации ДНК. [ 111 ] Из них 83 непосредственно используются для восстановления 5 типов повреждений ДНК, проиллюстрированных на графике. [ Цитация необходима ]
Некоторые из наиболее хорошо изученных генов, центральных для этих процессов восстановления, показаны на графике. Обозначения генов, показанные в красном, сером или голубом, указывают на гены, часто эпигенетически измененные при различных типах рака. Статьи в Википедии на каждом из генов, выделенных красным, серого или голубом, описывают эпигенетические изменения (ы) и рак (ы), при которых обнаруживаются эти эпимутации. Обзор статьи, [ 112 ] и широкие статьи экспериментального обследования [ 113 ] [ 114 ] Также документируйте большую часть этих недостатков восстановления эпигенетических ДНК при раке.
Гены с красными зажиганиями часто уменьшаются или замолчают эпигенетическими механизмами при различных раковых заболеваниях. Когда эти гены имеют низкую или отсутствующую экспрессию, повреждения ДНК могут накапливаться. Ошибки репликации после этих повреждений (см. Синтез трансляции ) могут привести к увеличению мутаций и, в конечном счете, раке. Эпигенетическая репрессия генов репарации ДНК в точных путях репарации ДНК, по -видимому, является центральной для канцерогенеза .
Два гена с серым прославлением RAD51 и BRCA2 необходимы для гомологичного рекомбинационного восстановления. Иногда они эпигенетически чрезмерно экспрессируются, а иногда и недостаточно экспрессируются при определенных видах рака. Как указано в статьях Википедии на RAD51 и BRCA2 , такие раки обычно имеют эпигенетические недостатки в других генах репарации ДНК. Эти недостатки восстановления, вероятно, приведут к увеличению невыразированных повреждений ДНК. Чрезмерная экспрессия RAD51 и BRCA2, наблюдаемая при этих раковых заболеваниях, может отражать селективное давление для компенсаторной чрезмерной экспрессии RAD51 или BRCA2 и увеличение гомологичного рекомбинационного восстановления, по крайней мере частично, справляться с такими избыточными повреждениями ДНК. В тех случаях, когда RAD51 или BRCA2 недостаточно экспрессированы, это само по себе приведет к увеличению нерепласти. Ошибки репликации после этого ущерба (см. Синтез трансляции ) могут вызвать повышенные мутации и рак, так что недоэкспрессия RAD51 или BRCA2 сама по себе была канцерогенной.
Голосистые гены находятся в пути микрогомологии, опосредованного конечным соединением (MMEJ) и повышены при раке. MMEJ-это дополнительный неточный путь восстановления, подверженные ошибкам для разрывов с двумя целями. При восстановлении MMEJ двухцепочечного разрыва, гомология 5–25 комплементарных пар оснований между обеими парными прядями достаточна для выравнивания цепей, но обычно присутствуют несоответствующие концы (лоскуты). MMEJ удаляет дополнительные нуклеотиды (лоскуты), где соединяются пряди, а затем лигает пряди, чтобы создать интактную двойную спираль ДНК. MMEJ почти всегда включает в себя, по крайней мере, небольшую делецию, так что это мутагенный путь. [ 24 ] FEN1 , эндонуклеаза лоскута в MMEJ, эпигенетически увеличивается при гипометилировании промотора и чрезмерно экспрессируется при большинстве рака молочной железы, [ 115 ] простата, [ 116 ] желудок, [ 117 ] [ 118 ] нейробластомы, [ 119 ] поджелудочная железа, [ 120 ] и легкое. [ 121 ] PARP1 также чрезмерно экспрессируется, когда его промоторной области ETS сайт эпигенетически гипометилируется, и это способствует прогрессированию рака эндометрия [ 122 ] и BRCA-мутированный серозный рак яичников. [ 123 ] Другие гены в пути MMEJ также чрезмерно экспрессируются при ряде рака (см. MMEJ для резюме), а также показаны в голубе.
Распределение репарации ДНК в масштабах генома в соматических клетках человека
[ редактировать ]Дифференциальная активность путей репарации ДНК в различных областях генома человека вызывает очень неравномерно распределенные в геномах опухолей. [ 124 ] [ 125 ] с низким содержанием генов В частности, богатые генами, ранние реплицирующиеся области генома человека, демонстрируют более низкие частоты мутаций, чем гетерохроматин . Один механизм, лежащий в основе этого, включает в себя модификацию гистонов H3K36ME3 , которая может рекрутировать восстановления несоответствия , белки [ 126 ] тем самым снижая скорость мутаций в регионах, отмеченных H3K36ME3 . [ 127 ] Другой важный механизм касается восстановления удара нуклеотидов , который может быть набран транскрипционным механизмом, снижая скорости соматических мутаций в активных генах [ 125 ] и другие открытые области хроматина. [ 128 ]
Эпигенетические изменения из -за восстановления ДНК
[ редактировать ]Повреждение ДНК очень распространено и постоянно восстанавливается. Эпигенетические изменения могут сопровождать ДНК репарацию окислительного повреждения или разрывов с двумя целями. В клетках человека окислительное повреждение ДНК происходит около 10000 раз в день, а разрывы с двумя целями ДНК происходят примерно в 10-50 раз в клеточный цикл в соматических реплицирующихся клетках (см. Повреждение ДНК (естественное происхождение) ). Селективное преимущество репарации ДНК состоит в том, чтобы позволить клетке выжить перед лицом повреждения ДНК. Селективное преимущество эпигенетических изменений, которые происходят при восстановлении ДНК, неясно. [ Цитация необходима ]
Восстановление окислительного повреждения ДНК может изменить эпигенетические маркеры
[ редактировать ]В устойчивом состоянии (с эндогенными повреждениями, возникающими и восстановленными) существует около 2400 окисленных гуанинов, которые образуют 8-оксо-2'-дезоксигуанозин (8-OHDG) в средней ДНК клеток млекопитающих. [ 129 ] 8-OHDG составляет около 5% от окислительного повреждения, обычно присутствующего в ДНК. [ 130 ] Окисленные гуанины не встречаются случайным образом среди всех гуанинов в ДНК. Существует предпочтение последовательности для гуанина в метилированном сайте CpG (цитозин, за которым следует гуанин вдоль его 5 '→ 3-' направление и где цитозин метилирован (5-MCPG)). [ 131 ] Сайт 5-MCPG имеет самый низкий потенциал ионизации для окисления гуанина.

Окисленный гуанин имеет потенциал неправильной передачи и является мутагенным. [ 133 ] Оксугуанин -гликозилаза (OGG1) является первичным ферментом, ответственным за удаление окисленного гуанина во время репарации ДНК. OGG1 находит и связывается с 8-OHDG в течение нескольких секунд. [ 134 ] Тем не менее, OGG1 не сразу же актизирует 8-OHDG. В клетках HeLa Половина максимального удаления 8-OHDG происходит за 30 минут, [ 135 ] и у облученных мышей 8-OHDG, индуцированные в печени мыши, удаляются с полураспадом 11 минут. [ 130 ]
Когда OGG1 присутствует в окисленном гуанине в рамках метилированного сайта CPG, он рекрутирует TET1 в 8-OHDG-поражение (см. Рисунок). Это позволяет TET1 деметилитировать смежный метилированный цитозин. [ 136 ] Деметилирование цитозина является эпигенетическим изменением. [ 137 ]
В качестве примера, когда эпителиальные клетки молочной железы человека обрабатывали H 2 O 2 в течение шести часов, 8-OHDG увеличился примерно в 3,5 раза в ДНК, и это вызвало около 80% деметилирования 5-метилцитозинов в геноме. [ 132 ] Деметилирование CPG в геном промоторе с помощью активности фермента TET увеличивает транскрипцию гена в РНК мессенджера. [ 138 ] В клетках, обработанных H 2 O 2 , был исследован один конкретный ген, BACE1 . [ 132 ] Уровень метилирования острова BACE1 CPG был снижен (эпигенетическое изменение), и это позволило увеличить экспрессию РНК BACE1 Messenger RNA примерно в 6,5 раза. [ Цитация необходима ]
В то время как шестичасовая инкубация с H 2 O 2 вызывает значительное деметилирование 5-MCPG-сайтов, более короткие времена инкубации H 2 O 2 , по-видимому, способствуют другим эпигенетическим изменениям. Обработка клеток H 2 O 2 в течение 30 минут вызывает несоответствие репарации белка гетеродимер MSH2-MSH6 для рекрутирования ДНК метилтрансферазы 1 (DNMT1) в сайты некоторых видов окислительного повреждения ДНК. [ 139 ] Это может вызвать увеличение метилирования цитозинов (эпигенетические изменения) в этих местах.
Jiang et al. [ 140 ] Обработанные клетки HEK 293 с агентами, вызывающими окислительный повреждение ДНК ( калийский бромат (KBRO3) или хромат калия (K2CRO4)). Репарация базовой эксцизии (BER) окислительного повреждения произошло при бета -бета -полимеразе ДНК, локализующей окисленные гуанины. Бета-полимераза является основной человеческой полимеразой при короткометражном повреждении окислительного повреждения ДНК. Jiang et al. [ 140 ] Также обнаружили, что бета -полимераза рекрутировала ДНК -метилтрансферазу белка DNMT3B в сайты репарации BER. Затем они оценили схему метилирования на одиночном нуклеотидном уровне в небольшой области ДНК, включая промоторную область и раннюю область транскрипции гена BRCA1 . Окислительное повреждение ДНК от бромата модулировало схему метилирования ДНК (вызванные эпигенетические изменения) в сайтах CPG в области изученной ДНК. В необработанных клетках CPG, расположенные в -189, -134, -29, -19, +16 и +19 гена BRCA1, имели метилированные цитозины (где нумерация от РНК мессенджера начала транскрипции вверх по течению , а негативное число указывает на нуклеотиды в в область промотора ). Индуцированное обработкой бромата окисление приводило к потере метилирования цитозина при -189, -134, +16 и +19, а также приводит к образованию нового метилирования в CPG, расположенных при -80, -55, -21 и +8 после Репарация ДНК было разрешено. [ Цитация необходима ]
Гомологичный рекомбинационный восстановление изменяет эпигенетические маркеры
[ редактировать ]По меньшей мере четыре статьи сообщают о рекрутировании ДНК метилтрансферазы 1 (DNMT1) в сайты разрывов с двумя целями ДНК. [ 141 ] [ 142 ] [ 98 ] [ 143 ] Во время гомологичного рекомбинационного восстановления (ЧСС) разрыва с двойной цепью участие DNMT1 заставляет две восстановленные цепи ДНК иметь различные уровни метилированных цитозинов. Одна цепь часто метилируется при около 21 места CPG ниже по течению от восстановленного разрыва с двумя целями. Другая цепь ДНК теряет метилирование примерно в шести сайтах CPG, которые ранее были метилированы ниже по течению от разрыва с двойной цепи, а также теряли метилирование примерно в пяти сайтах CPG, которые ранее были метилированы вверх по течению от разрыва двойной цепи. Когда хромосома воспроизводится, это приводит к возникновению одной дочерней хромосомы, которая сильно метилированная ниже предыдущего места разрыва и таковой, которая неэлизована в области как вверх, так и ниже по течению от предыдущего места разрыва. Что касается гена, который был разбит двойным разрывом, половина клеток потомства экспрессирует этот ген на высоком уровне, а в другой половине потомства клеток экспрессии этого гена репрессируется. Когда клоны этих клеток поддерживались в течение трех лет, новые паттерны метилирования сохранялись в течение этого периода времени. [ 144 ]
У мышей с CRISPR-опосредованной гомологической рекомбинацией вставку рекомбинации в их геноме наблюдалось большое количество увеличенных метилирования сайтов CPG в рамках двухцепочечной инсерции. [ 145 ]
Нехомологичное соединение может вызвать некоторые эпигенетические изменения маркера
[ редактировать ]Несомологичное конец соединения (NHEJ) разрыва с двумя целями может вызвать небольшое количество деметилирования ранее существовавших метилирования ДНК цитозина ниже восстановленного разрыва с двумя целями. [ 142 ] Дальнейшая работа Allen et al. [ 146 ] показал, что NHEJ разрыва ДНК в клетке может привести к некоторым потомным клеткам, имеющим репрессированную экспрессию гена, несущего первоначальный разрыв с двойным цепью, и некоторого потомства, имеющего высокую экспрессию этого гена из-за эпигенетических изменений, связанных с восстановлением NHEJ Полем Частота эпигенетических изменений, вызывающих репрессию гена после восстановления NHEJ двухцелевого разрыва ДНК в этом ген, может составлять около 0,9%. [ 98 ]
Эволюция
[ редактировать ]Основные процессы репарации ДНК высоко сохраняются среди прокариот и эукариот , так и даже среди бактериофагов ( вирусы , которые заражают бактерии ); Тем не менее, более сложные организмы с более сложными геномами имеют соответственно более сложные механизмы восстановления. [ 147 ] Способность большого числа белковых структурных мотивов катализировать соответствующие химические реакции сыграла значительную роль в разработке механизмов восстановления во время эволюции. Для чрезвычайно подробного обзора гипотез, связанных с эволюцией репарации ДНК, см. [ 148 ]
Окаменечная запись что жизнь в одноклеточной жизни начала размножаться на планете в какой-то момент в течение докембрийского указывает на то, что в какой-то момент неясно неясно, периода, хотя именно когда впервые появилась узнаваемая современная жизнь. Нуклеиновые кислоты стали единственным и универсальным средством кодирования генетической информации, требующих механизмов репарации ДНК, которые в их основной форме были унаследованы всеми существующими формами жизни от их общего предка. Появление богатой кислородом атмосферы, богатой кислородом (известной как « кислородная катастрофа ») из-за фотосинтетических организмов, а также наличия потенциально повреждающих свободных радикалов в клетке из-за окислительного фосфорилирования , что требует эволюции механизмов восстановления ДНК, которые действуют специфично противостоять типам повреждения, вызванных окислительным стрессом . Механизм, с помощью которого это произошло, однако, неясен. [ Цитация необходима ]
Скорость эволюционных изменений
[ редактировать ]В некоторых случаях повреждение ДНК не восстанавливается или восстанавливается с помощью ошибки, подверженного ошибкам, который приводит к изменению исходной последовательности. Когда это происходит, мутации могут распространяться в геномы потомства клетки. Если такое событие произойдет в ячейке зародышевой линии , которая в конечном итоге приведет к гамете , мутация может быть передана потомству организма. Скорость эволюции у конкретного вида (или в определенном гене) является функцией скорости мутации. Как следствие, скорость и точность механизмов восстановления ДНК оказывают влияние на процесс эволюционных изменений. [ 149 ] Защита и восстановление ДНК не влияют на скорость адаптации с помощью регуляции генов, а также рекомбинации и отбора аллелей. С другой стороны, восстановление и защита ДНК влияют на скорость накопления непоправимого, выгодного, расширения кода, наследуемых мутаций и замедляет эволюционный механизм для расширения генома организмов с новыми функциями. Напряжение между эволюционностью и восстановлением мутаций и защитой требует дальнейшего изучения. [ Цитация необходима ]
Технология
[ редактировать ]Технология, называемая кластерной регулярно, была обнаружена в 2012 году с коротким палиндромным повторением (укороченным до CRISPR -CAS9). Новая технология позволяет любому, кто обладает молекулярной биологией, с точностью изменить гены любого вида, индуцируя повреждение ДНК в определенной точке, а затем, а затем, а затем, а затем, а затем и затем затем изменять Изменение механизмов репарации ДНК для вставки новых генов. [ 150 ] Это дешевле, более эффективно и точнее, чем другие технологии. С помощью CRISPR -CAS9 части генома могут быть отредактированы учеными, удаляя, добавляя или изменяя части в последовательности ДНК. [ Цитация необходима ]
Смотрите также
[ редактировать ]- Ускоренная болезни старения
- Старение ДНК
- Клеточный цикл
- Повреждение ДНК (естественно встречается)
- Теория повреждения ДНК старения
- Репликация ДНК
- Прямое повреждение ДНК
- Обнаружение ошибок и коррекция
- Генная терапия
- Митохондриальная генетика
- Косвенное повреждение ДНК
- Жизненное расширение
- Прогерия
- Ремонт
- Старение
- Наш Господь
- Научный журнал Ремонт ДНК в рамках мутационных исследований
Ссылки
[ редактировать ]- ^ «Природа рецензии серии: повреждение ДНК» . Природа обзор молекулярной клеточной биологии . 5 июля 2017 года . Получено 7 ноября 2018 года .
- ^ Jump up to: а беременный Lodish H, Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, et al. (2004). Молекулярная клеточная биология (5 -е изд.). WH Freeman. п. 963. ISBN 978-0-7167-4366-8 Полем OCLC 53798180 .
- ^ Браунер В.С., Кан А.Дж., Зив Е., Рейнер А.П., Осима Дж., Каутон Р.М. и др. (Декабрь 2004 г.). «Генетика человеческой долговечности». Американский журнал медицины . 117 (11): 851–60. Citeseerx 10.1.1.556.6874 . doi : 10.1016/j.amjmed.2004.06.033 . PMID 15589490 .
- ^ Широкий WJ (7 октября 2015 г.). «Нобелевская премия по химии, присужденная Томасу Линдалу, Полу Модричу и Азизу Санкар за исследования ДНК» . New York Times . Получено 7 октября 2015 года .
- ^ Персонал (7 октября 2015 г.). «Нобелевская премия по химии 2015 года - восстановление ДНК - обеспечивает химическую стабильность для жизни» (PDF) . Нобелевская премия . Получено 7 октября 2015 года .
- ^ Roulston A, Marcellus RC, Branton PE (1999). «Вирусы и апоптоз». Ежегодный обзор микробиологии . 53 : 577–628. doi : 10.1146/annurev.micro.53.1.577 . PMID 10547702 .
- ^ Мэдиган М.Т., Мартино Дж. М. (2006). Брок биология микроорганизмов (11 -е изд.). Пирсон. п. 136. ISBN 978-0-13-196893-6 .
- ^ Ohta T, Tokishita Si, Mochizuki K, Kawase J, Sakahira M, Yamagata H (2006). «Чувствительность УФ и мутагенез чрезвычайно термофильного эубактерий термофилуса HB27» . Гены и окружающая среда . 28 (2): 56–61. Bibcode : 2006genee..28 ... 56o . doi : 10.3123/jemsge.28.56 .
- ^ Tanaka T, Halicka HD, Huang X, Traganos F, Darzynkiewicz Z (сентябрь 2006 г.). «Конститутивное фосфорилирование гистона H2AX и активация ATM, репортеры повреждения ДНК эндогенными окислителями» . Клеточный цикл . 5 (17): 1940–45. doi : 10.4161/cc.5.17.3191 . PMC 3488278 . PMID 16940754 .
- ^ Брайг М., Шмитт Калифорния (март 2006 г.). «Полученное онкогеном старение: поставить тормоза на развитие опухоли» . РАНКА . 66 (6): 2881–4. doi : 10.1158/0008-5472.can-05-4006 . PMID 16540631 .
- ^ Lynch MD (февраль 2006 г.). «Как клеточное старение предотвращает рак?». ДНК и клеточная биология . 25 (2): 69–78. doi : 10.1089/dna.2006.25.69 . PMID 16460230 .
- ^ Campisi J, D'Adda di Fagagna F (сентябрь 2007 г.). «Клеточное старение: когда плохие вещи случаются с хорошими клетками». Природные обзоры. Молекулярная клеточная биология . 8 (9): 729–40. doi : 10.1038/nrm2233 . PMID 17667954 . S2CID 15664931 .
- ^ Jump up to: а беременный в Лучший АД (июнь 2009 г.). «Повреждение ядерной ДНК в качестве прямой причины старения» (PDF) . Исследование омоложения . 12 (3): 199–208. Citeseerx 10.1.1.318.738 . doi : 10.1089/rej.2009.0847 . PMID 19594328 . Архивировано из оригинала (PDF) 15 ноября 2017 года . Получено 29 сентября 2009 года .
- ^ Sancar A (июнь 2003 г.). «Структура и функция ДНК фотолиазы и криптохромных фоторецепторов синего света». Химические обзоры . 103 (6): 2203–37. doi : 10.1021/cr0204348 . PMID 12797829 .
- ^ Lucas-Lledó Ji, Lynch M (май 2009 г.). «Эволюция скорости мутаций: филогеномный анализ семейства фотолиазы/криптохром» . Молекулярная биология и эволюция . 26 (5): 1143–53. doi : 10.1093/molbev/msp029 . PMC 2668831 . PMID 19228922 .
- ^ Jump up to: а беременный в Уотсон Д.Д., Бейкер Т.А., Белл С.П., Ганн А., Левин М., Лосик Р. (2004). Молекулярная биология гена (5 -е изд.). Пирсон Бенджамин Каммингс; CSHL Press. Гнездо 9, 10. OCLC 936762772 .
- ^ Volkert MR (1988). «Адаптивный ответ Escherichia coli на повреждение алкилирования». Экологический и молекулярный мутагенез . 11 (2): 241–55. Bibcode : 1988envmm..11..241v . doi : 10.1002/em.2850110210 . PMID 3278898 . S2CID 24722637 .
- ^ Jump up to: а беременный в Willey J, Sherwood L, Woolverton C (2014). Микробиология Прескотта . Нью -Йорк: МакГроу Хилл. п. 381. ISBN 978-0-07-340240-6 .
- ^ Рассел П. (2018). я генетика . Ченнаи: Пирсон. п. 186. ISBN 978-93-325-7162-4 .
- ^ Jump up to: а беременный в дюймовый REARDON JT, Sancar A (2006). «Очистка и характеристика ферментных ферментных систем Escherichia Coli и нуклеотидных экстракзовых эксзидение». Репарация ДНК, часть а . Методы в фермере. Тол. 408. С. 189–213. doi : 10.1016/s0076-6879 (06) 08012-8 . ISBN 978-0-12-182813-4 Полем PMID 16793370 .
- ^ Berg M, Tymoczko J, Stryer L (2012). Биохимия 7 -е издание . Нью -Йорк: WH Freeman and Company. п. 840. ISBN 978-1-4292-2936-4 .
- ^ Ачарья П.В. (1971). «Выделение и частичная характеристика возрастных олиго-дезоксирибо-рибонуклеотидов с ковалентно связанными аспаратамил-полипептидами». Johns Hopkins Medical Journal. Дополнение (1): 254–60. PMID 5055816 .
- ^ Bjorksten J, Acharya PV, Ashman S, Wetlaufer DB (июль 1971 г.). «Жерогенные фракции у тритированной крысы». Журнал Американского общества гериатрии . 19 (7): 561–74. doi : 10.1111/j.1532-5415.1971.tb02577.x . PMID 5106728 . S2CID 33154242 .
- ^ Jump up to: а беременный Liang L, Deng L, Chen Y, Li GC, Shao C, Tischfield JA (сентябрь 2005 г.). «Модуляция конца ДНК, соединяющего ядерные белки» . Журнал биологической химии . 280 (36): 31442–49. doi : 10.1074/jbc.m503776200 . PMID 16012167 .
- ^ Уилсон Т.Е., Граундер У, Либер М.Р. (июль 1997 г.). «Дрожжевая ДНК-лигаза IV опосредует не-гомологичное соединение конец ДНК» . Природа . 388 (6641): 495–8. Bibcode : 1997natur.388..495W . doi : 10.1038/41365 . PMID 9242411 . S2CID 4422938 .
- ^ Мур JK, Haber Je (май 1996). «Клеточный цикл и генетические требования двух путей нехомологичного восстановления в конечном счете двойных разрывов у Saccharomyces cerevisiae» . Молекулярная и клеточная биология . 16 (5): 2164–73. doi : 10.1128/mcb.16.5.2164 . PMC 231204 . PMID 8628283 .
- ^ Боултон С.Дж., Джексон С.П. (сентябрь 1996 г.). «Saccharomyces cerevisiae Ku70 потенцирует незаконное восстановление двойного разрыва ДНК и служит барьером для подверженных ошибкам путей восстановления ДНК» . Embo Journal . 15 (18): 5093–103. doi : 10.1002/j.1460-2075.1996.tb00890.x . PMC 452249 . PMID 8890183 .
- ^ Уилсон Т.Е., Либер М.Р. (август 1999 г.). «Эффективная обработка ДНК заканчивается во время нехомологичного соединения дрожжей. Доказательства ДНК-полимеразы бета (POL4) -зависимый путь» . Журнал биологической химии . 274 (33): 23599–609. doi : 10.1074/jbc.274.33.23599 . PMID 10438542 .
- ^ Будман Дж, Чу Г (февраль 2005 г.). «Обработка ДНК для нехомологичного конечного соединения путем бесклеточного экстракта» . Embo Journal . 24 (4): 849–60. doi : 10.1038/sj.emboj.7600563 . PMC 549622 . PMID 15692565 .
- ^ Ван Х., Перро А.Р., Такеда Ю., Цинь В., Ван Х, Илиакис Г. (сентябрь 2003 г.). «Биохимические доказательства KU-независимых путей резервного копирования NHEJ» . Исследование нуклеиновых кислот . 31 (18): 5377–88. doi : 10.1093/nar/gkg728 . PMC 203313 . PMID 12954774 . (В этой статье в настоящее время возникает выражение беспокойства , см. Деньги : 10.1093 / nar / nar / gkaaa28 , PMID 32239214 )
- ^ Jung D, Alt FW (январь 2004 г.). «Раскрытие V (D) J рекомбинация; понимание регуляции генов» . Клетка . 116 (2): 299–311. doi : 10.1016/s0092-8674 (04) 00039-х . PMID 14744439 . S2CID 16890458 .
- ^ Jump up to: а беременный Truong Ln, Li Y, Shi Lz, Hwang Py, He J, Wang H, et al. (Май 2013). «Микрогомологическое соединение конечного соединения и гомологичная рекомбинация содержит начальную стадию конечной резекции для восстановления разрывов с двумя целями ДНК в клетках млекопитающих» . Труды Национальной академии наук Соединенных Штатов Америки . 110 (19): 7720–5. Bibcode : 2013pnas..110.7720t . doi : 10.1073/pnas.1213431110 . PMC 3651503 . PMID 23610439 .
- ^ Шарма С., Джавадекар С.М., Пандей М., Шривастава М., Кумари Р., Рагхаван С.С. (март 2015 г.). «Гомология и ферментативные требования к микрогомологическому альтернативному окончательному соединению» . Клеточная гибель и болезнь . 6 (3): E1697. doi : 10.1038/cddis.2015.58 . PMC 4385936 . PMID 25789972 .
- ^ Decottignes A (2013). «Альтернативные механизмы, связанные с конец,: историческая перспектива» . Границы в генетике . 4 : 48. doi : 10.3389/fgene.2013.00048 . PMC 3613618 . PMID 23565119 .
- ^ Захрадка К., Слэйд Д., Бейрон А., Соммер С., Авербек Д., Петранович М. и др. (Октябрь 2006 г.). «Повторная сборка разбитых хромосом у Deinococcus radiodurans». Природа . 443 (7111): 569–73. Bibcode : 2006natur.443..569Z . doi : 10.1038/nature05160 . PMID 17006450 . S2CID 4412830 .
- ^ Stenerlöw B, Karlsson KH, Cooper B, Rydberg B. «Измерение быстрых разрывов с двумя цепками ДНК в клетках млекопитающих без включения тепло-лабильных мест: результаты для клеток с дефицитом в нехолологическом конце соединения». Radiat Res. 2003 апрель; 159 (4): 502–10. doi : 10.1667/0033-7587 (2003) 159 [0502: Mopdds 2.0.co; 2] PMID 12643795 .
- ^ Уотерс Л.С., Минезингер Б.К., Уилтруут М.Е., Д'Суза С., Вудрафф Р.В., Уокер Г.С. (март 2009 г.). «Эукариотическая трансляция полимеразы и их роли и регуляция в устойчивости к повреждению ДНК» . Микробиология и молекулярная биология обзоры . 73 (1): 134–54. doi : 10.1128/mmbr.00034-08 . PMC 2650891 . PMID 19258535 .
- ^ Colis LC, Raychaudhury P, Basu AK (август 2008 г.). «Мутационная специфичность индуцированных гамма-радиацией гуанино-тиминового и тимин-гуанина внутритрастрандных сшивок в клетках млекопитающих и синтез трансквирования после поражения гуанинового тимина с помощью ДНК-полимеразы человека» . Биохимия . 47 (31): 8070–9. doi : 10.1021/bi800529f . PMC 2646719 . PMID 18616294 .
- ^ Raychaudhury P, Basu AK (март 2011 г.). «Генетическое потребность в мутагенезе G [8,5-Me] T-сшивки в Escherichia coli: ДНК-полимеразы IV и V конкурс за обход, подверженные ошибкам» . Биохимия . 50 (12): 2330–8. doi : 10.1021/bi102064z . PMC 3062377 . PMID 21302943 .
- ^ «Синтез трансляции» . Research.chem.psu.edu. Архивировано с оригинала 10 марта 2012 года . Получено 14 августа 2012 года .
- ^ Ван Z (июль 2001 г.). «Синтез трансляции семейством ДНК -полимеразы UMUC». Мутационные исследования . 486 (2): 59–70. doi : 10.1016/s0921-8777 (01) 00089-1 . PMID 114255512 .
- ^ Jump up to: а беременный в Friedberg EC, Walker GC, Siede W, Wood RD, Schultz RA, Ellenberger T. (2006). Репарация ДНК и мутагенез, часть 3. ASM Press. 2 -е изд.
- ^ Лю Б., Йип Р.К., Чжоу З (ноябрь 2012 г.). «Реконструирование хроматина, восстановление повреждения ДНК и старение» . Текущая геномика . 13 (7): 533–47. doi : 10.2174/138920212803251373 . PMC 3468886 . PMID 23633913 .
- ^ Halicka HD, Zhao H, Podhorecka M, Traganos F, Darzynkiewicz Z (июль 2009 г.). «Цитометрическое обнаружение релаксации хроматина, ранний репортер ответа на повреждение ДНК» . Клеточный цикл . 8 (14): 2233–7. doi : 10.4161/cc.8.14.8984 . PMC 3856216 . PMID 19502789 .
- ^ Jump up to: а беременный в Sellou H, Lebeaupin T, Chapuis C, Smith R, Hegele A, Singh HR, et al. (Декабрь 2016 г.). «Поли (ADP-Ribose) -зависимый хроматин Remodeler ALC1 индуцирует локальную релаксацию хроматина при повреждении ДНК» . Молекулярная биология клетки . 27 (24): 3791–9. doi : 10.1091/mbc.e16-05-0269 . PMC 5170603 . PMID 27733626 .
- ^ Jump up to: а беременный Van Meter M, Simon M, Tombline G, May A, Morello TD, Hubbard BP, et al. (Сентябрь 2016 г.). «JNK фосфорилирует SIRT6, чтобы стимулировать репарацию двойного разрыва ДНК в ответ на окислительный стресс путем рекрута PARP1 в разрывы ДНК» . Сотовые отчеты . 16 (10): 2641–50. doi : 10.1016/j.celrep.2016.08.006 . PMC 5089070 . PMID 27568560 .
- ^ Jump up to: а беременный Haince JF, McDonald D, Rodrigue A, Déry U, Masson JY, Hendzel MJ, et al. (Январь 2008 г.). «PARP1-зависимая кинетика рекрутирования белков MRE11 и NBS1 в множественные сайты повреждения ДНК» . Журнал биологической химии . 283 (2): 1197–208. doi : 10.1074/jbc.m706734200 . PMID 18025084 .
- ^ Jump up to: а беременный в Rogakou EP, Pilch Dr, Orr AH, Ivanova VS, Bonner Wm (март 1998 г.). «Двойные разрывы ДНК индуцируют фосфорилирование гистона H2AX на серине 139» . Журнал биологической химии . 273 (10): 5858–68. doi : 10.1074/jbc.273.10.5858 . PMID 9488723 .
- ^ MailAnd N, Bekker-Jensen S, Expustrup H, Melander F, Bartek J, Lukas C, et al. (Ноябрь 2007 г.). «RNF8 UbiquityLate Histones при двойных разрывах ДНК и способствует сборке репарационных белков» . Клетка . 131 (5): 887–900. doi : 10.1016/j.cell.2007.09.040 . PMID 18001824 . S2CID 14232192 .
- ^ Luijsterburg MS, ACS K, Ackermann L, Wiegant WW, Bekker-Jensen S, Larsen DH, et al. (Май 2012 г.). «Новая некаталитическая роль убиквитин-лигазы RNF8 в разворачивающейся структуре хроматина высшего порядка» . Embo Journal . 31 (11): 2511–27. doi : 10.1038/emboj.2012.104 . PMC 3365417 . PMID 22531782 .
- ^ Jump up to: а беременный Luijsterburg MS, Goedhart J, Moser J, Kool H, Geverts B, Houtsmuller AB, et al. (Август 2007 г.). «Динамическое взаимодействие in vivo убиквитин лигазы DDB2 E3 с УФ-поврежденной ДНК не зависит от белка для распознавания повреждений XPC» . Журнал сотовой науки . 120 (Pt 15): 2706–16. doi : 10.1242/jcs.008367 . PMID 17635991 .
- ^ Jump up to: а беременный Pines A, Vrouwe MG, Marteijn JA, Pypas D, Luijsterburg MS, Cansoy M, et al. (Октябрь 2012 г.). «PARP1 способствует восстановлению нуклеотидных ударов посредством стабилизации DDB2 и рекрутирования ALC1» . Журнал клеточной биологии . 199 (2): 235–49. doi : 10.1083/jcb.201112132 . PMC 3471223 . PMID 23045548 .
- ^ Jazayeri A, Falck J, Lukas C, Bartek J, Smith GC, Lukas J, et al. (Январь 2006 г.). «Атмосфера и клеточный цикл-зависимой регуляция ATR в ответ на разрывы с двумя целями ДНК». Природная клеточная биология . 8 (1): 37–45. doi : 10.1038/ncb1337 . PMID 16327781 . S2CID 9797133 .
- ^ Bakkenist CJ, Kastan MB (январь 2003 г.). «Повреждение ДНК активирует ATM через межмолекулярное аутофосфорилирование и диссоциацию димера». Природа . 421 (6922): 499–506. Bibcode : 2003natur.421..499b . doi : 10.1038/nature01368 . PMID 12556884 . S2CID 4403303 .
- ^ Вей Q, Ли Л., Чен Д. (2007). Репарация ДНК, генетическая нестабильность и рак . Мировой научный. ISBN 978-981-270-014-8 . [ страница необходима ]
- ^ Шонтал А.Х. (2004). Контрольные контрольные точки и рак . Humana Press. ISBN 978-1-58829-500-2 . [ страница необходима ]
- ^ Гартель А.Л., Тайнер Ал (июнь 2002 г.). «Роль циклина-зависимого ингибитора киназы p21 при апоптозе» . Молекулярная терапия рака . 1 (8): 639–49. PMID 12479224 .
- ^ Janion C (2001). «Некоторые аспекты системы ответа SOS-критический опрос» . Acta Biochimica Polonica . 48 (3): 599–610. doi : 10.18388/abp.2001_3894 . PMID 11833768 .
- ^ Jump up to: а беременный Erill I, Campoy S, Barbé J (ноябрь 2007 г.). «Эйоны дистресса: эволюционная перспектива бактериального ответа SOS» . Обзоры микробиологии FEMS . 31 (6): 637–56. doi : 10.1111/j.1574-6976.2007.00082.x . PMID 17883408 .
- ^ Schlacher K, Pham P, Cox MM, Goodman MF (февраль 2006 г.). «Роли ДНК-полимеразы V и белка RecA в мутации, вызванной повреждением SOS». Химические обзоры . 106 (2): 406–19. doi : 10.1021/cr0404951 . PMID 16464012 .
- ^ Фрай Р.К., Бегли Т.Дж., Самсон Л.Д. (2004). «Ответы по всему геному на агенты, наносящие ДНК». Ежегодный обзор микробиологии . 59 : 357–77. doi : 10.1146/annurev.micro.59.031805.133658 . PMID 16153173 .
- ^ Essejel S, Martín M, Calbalero J, Flores JM, Blasco MA (май 2004 г.). "PKCS-DNA-PKCS-DNA-PKCS-DNA-PKCS ДНК Embo сообщает 5 (5): 503–09. doi : 10.1038/sj . 1299048PMC PMID 15105825 .
- ^ De Boer J, Andressoo Jo, De Wit J, Huijmans J, Beems RB, Van Steeg H, et al. (Май 2002 г.). «Преждевременное старение у мышей с дефицитом репарации и транскрипции ДНК» . Наука . 296 (5571): 1276–79. Bibcode : 2002sci ... 296.1276d . doi : 10.1126/science.1070174 . PMID 11950998 . S2CID 41930529 .
- ^ Dollé Me, Busuttil RA, Garcia AM, Wijnhoven S, Van Drunen E, Niedernhofer LJ, et al. (Апрель 2006 г.). «Повышенная нестабильность генома не является предпосылкой для сокращения срока службы у мышей с дефицитом репарации ДНК». Мутационные исследования . 596 (1–2): 22–35. Bibcode : 2006mrfmm.596 ... 22d . doi : 10.1016/j.mrfmmm.2005.11.008 . PMID 16472827 .
- ^ Jump up to: а беременный в Macrae SL, Croken MM, Calder RB, Aliper A, Milholland B, White RR, ZhavorOnkov A, Gladyshev VN, Seluanov A, Gorbunova V, Zhang ZD, Vijg J (2015). «Репарация ДНК у видов с чрезвычайными различиями в жизни». Старение. 7 (12): 1171–84. doi: 10.18632/старение.100866. PMC 4712340. PMID 26729707
- ^ Kobayashi Y, Nasty I, Satoh K, Finama T, Kikuchi M, Kitayama S, et al. (Ноябрь 2004 г.). «Механизмы радиационного отклика чрезвычайно радиорезистентных бактерий Deinococcus adiodurans» UCHU SEIBTSU KAGAKU 18 (3): 134–3 PMID 15858357
- ^ Spindler SR (сентябрь 2005 г.). «Быстрая и обратимая индукция долговечности, противоопухолевых и геномных эффектов ограничения калорий». Механизмы старения и развития . 126 (9): 960–66. doi : 10.1016/j.mad.2005.03.016 . PMID 15927235 . S2CID 7067036 .
- ^ Halicka HD, Zhao H, Li J, Lee YS, Sieh TC, Wu JM, et al. (Декабрь 2012 г.). «Потенциальные антивозрастные агенты подавляют уровень конститутивной передачи сигналов повреждения и ДНК» . Старение . 4 (12): 952–65. doi : 10.18632/старение.100521 . PMC 3615161 . PMID 23363784 .
- ^ Тисенбаум HA, Guarente L (март 2001 г.). «Повышенная доза гена SIR-2 продлевает продолжительность жизни у Caenorhabditis elegans». Природа . 410 (6825): 227–30. Bibcode : 2001natur.410..227t . doi : 10.1038/35065638 . PMID 11242085 . S2CID 4356885 .
- ^ Коэн Хи, Миллер С., Биттерман К.Дж., Уолл Н.Р., Хеккинг Б., Кесслер Б. и др. (Июль 2004 г.). «Ограничение калорий способствует выживанию клеток млекопитающих, индуцируя диацетилазу SIRT1». Наука . 305 (5682): 390–92. Bibcode : 2004sci ... 305..390c . doi : 10.1126/science.1099196 . PMID 15205477 . S2CID 33503081 .
- ^ Cabelof DC, Yanamadala S, Raffoul JJ, Guo Z, Soofi A, Heydari AR (март 2003 г.). «Ограничение калорий способствует геномной стабильности путем индукции восстановления базового удаления и отмены его возрастного снижения». Репарация ДНК . 2 (3): 295–307. doi : 10.1016/s1568-7864 (02) 00219-7 . PMID 12547392 .
- ^ Стюарт Дж.А., Карахалил Б., Хог Б.А., Соуза-Пинто Н.К., Бор В.А. (март 2004 г.). «Направление митохондриальной и ядерной ДНК иссечения по -разному влияет ограничение калорий» . FASEB Journal . 18 (3): 595–97. doi : 10.1096/fj.03-0890fje . PMID 14734635 . S2CID 43118901 .
- ^ Walker DW, McColl G, Jenkins NL, Harris J, Lithgow GJ (май 2000). «Эволюция продолжительности жизни у C. elegans». Природа . 405 (6784): 296–97. doi : 10.1038/35012693 . PMID 10830948 . S2CID 4402039 .
- ^ Джонсон Г. (28 декабря 2010 г.). «Необходимость доисторических опухолей и дебаты» . New York Times .
Если бы мы жили достаточно долго, рано или поздно мы все заболели раком.
- ^ Alberts B, Johnson A, Lewis J, et al. (2002). «Предотвратимые причины рака» . Молекулярная биология клетки (4 -е изд.). Нью -Йорк: Гарлендская наука. ISBN 978-0-8153-4072-0 Полем
Независимо от обстоятельств, независимо от обстоятельств: мутации никогда не могут быть абсолютно избежать, можно ожидать определенной невидимой фоновой заболеваемости раком. Достаточно, неизбежно, что, по крайней мере, одна из его или ее клеток в конечном итоге накапливает набор мутаций, достаточных для развития рака.
- ^ Фриденсон Б (август 2007 г.). «Путь BRCA1/2 предотвращает гематологический рак в дополнение к раку молочной железы и яичников» . BMC Рак . 7 : 152. DOI : 10.1186/1471-2407-7-152 . PMC 1959234 . PMID 17683622 .
- ^ Gavande NS, Vandervere-Carozza PS, Hinshaw HD, Jalal Si, Sears CR, Pawelczak KS, et al. (Апрель 2016 г.). «Целевая терапия ДНК: прошлое или будущее лечения рака?» Полем Фармакология и терапия . 160 : 65–83. doi : 10.1016/j.pharmthera.2016.02.003 . PMC 4811676 . PMID 26896565 .
- ^ Bryant HE, Schultz N, Thomas HD, Parker KM, Flower D, Lopez E, et al. (Апрель 2005 г.). «Специфическое убийство BRCA2-дефицитных опухолей с помощью ингибиторов поли (ADP-рибозы) полимеразы». Природа . 434 (7035): 913–17. Bibcode : 2005natur.434..913b . doi : 10.1038/nature03443 . PMID 15829966 . S2CID 4391043 .
- ^ Гольдштейн М., Кастан М.Б. (2015). «Ответ на повреждение ДНК: последствия для реакций опухоли на радиацию и химиотерапию». Ежегодный обзор медицины . 66 : 129–43. doi : 10.1146/annurev-med-081313-121208 . PMID 25423595 .
- ^ Jump up to: а беременный Jeggo PA, Pearl LH, Carr Am (январь 2016 г.). «Репарация ДНК, стабильность генома и рак: историческая перспектива» (PDF) . Природные обзоры. Рак . 16 (1): 35–42. doi : 10.1038/nrc.2015.4 . PMID 26667849 . S2CID 14941857 .
- ^ Bartkova J, Horejsí Z, Koed K, Krämer A, Tort F, Zieger K, et al. (Апрель 2005 г.). «Ответ на повреждение ДНК в качестве противоракового барьера в раннем онкогенезе человека». Природа . 434 (7035): 864–70. Bibcode : 2005natur.434..864b . doi : 10.1038/nature03482 . PMID 15829956 . S2CID 4398393 .
- ^ Jump up to: а беременный Bartkova J, Rezaei N, Liontos M, Karakaidos P, Kletsas D, Issaeva N, et al. (Ноябрь 2006 г.). «Сталование, вызванное онкогеном, является частью барьера онкогенеза, наложенного контрольно-пропускными пунктами ДНК повреждения». Природа . 444 (7119): 633–37. Bibcode : 2006natur.444..633b . doi : 10.1038/nature05268 . PMID 17136093 . S2CID 4406956 .
- ^ Gaillard H, García-Muse T, Aguilera A (май 2015). «Стресс репликации и рак». Природные обзоры. Рак . 15 (5): 276–89. doi : 10.1038/nrc3916 . HDL : 10261/123721 . PMID 25907220 . S2CID 11342123 .
- ^ Halazonetis TD, Gorgoulis VG, Bartek J (март 2008 г.). «Индуцированная онкогеном модель повреждения ДНК для развития рака». Наука . 319 (5868): 1352–55. Bibcode : 2008Sci ... 319.1352H . doi : 10.1126/science.1140735 . PMID 18323444 . S2CID 16426080 .
- ^ De Boer J, Hoeijmakers JH (март 2000 г.). «Репарация нуклеотидного удаления и синдромы человека» (PDF) . Канцерогенез . 21 (3): 453–60. doi : 10.1093/карцин/21.3.453 . PMID 10688865 .
- ^ Broustas CG, Lieberman HB (февраль 2014 г.). «Гены реакции на повреждение ДНК и развитие раковых метастазий» . Радиационные исследования . 181 (2): 111–30. Bibcode : 2014radr..181..111b . doi : 10.1667/rr13515.1 . PMC 4064942 . PMID 24397478 .
- ^ Zhang P, Wang J, Gao W, Yuan Bz, Rogers J, Reed E (май 2004 г.). «Экспрессия киназы CHK2 понижается из-за метилирования промотора при немелкоклеточном раке легкого» . Молекулярный рак . 3 (4): 14. doi : 10.1186/1476-4598-3-14 . PMC 419366 . PMID 15125777 .
- ^ Baylin SB , Ohm Je (февраль 2006 г.). «Эпигенетическое молчание генов при раке - механизм ранней онкогенной зависимости пути?». Природные обзоры. Рак . 6 (2): 107–16. doi : 10.1038/nrc1799 . PMID 16491070 . S2CID 2514545 .
- ^ Канвал Р., Гупта С (апрель 2012 г.). «Эпигенетические модификации при раке» . Клиническая генетика . 81 (4): 303–11. doi : 10.1111/j.1399-0004.2011.01809.x . PMC 3590802 . PMID 22082348 .
- ^ Baldassarre G, Battista S, Belletti B, Thakur S, Pentimalli F, Trapasso F, et al. (Апрель 2003 г.). «Негативная регуляция экспрессии гена BRCA1 белками HMGA1 объясняет сниженные уровни белка BRCA1 при спорадической карциноме молочной железы» . Молекулярная и клеточная биология . 23 (7): 2225–38. doi : 10.1128/mcb.23.7.2225-2238.2003 . PMC 150734 . PMID 12640109 .
- ^ Jacinto FV, Esteller M (июль 2007 г.). «Пути мутатора, развязанные эпигенетическим молчанием при раке человека» . Мутагенез . 22 (4): 247–53. doi : 10.1093/mutage/gem009 . PMID 17412712 .
- ^ Lahtz C, Pfeifer GP (февраль 2011 г.). «Эпигенетические изменения генов репарации ДНК при раке» . Журнал молекулярной клеточной биологии . 3 (1): 51–58. doi : 10.1093/jmcb/mjq053 . PMC 3030973 . PMID 21278452 . Эпигенетические изменения генов репарации ДНК при раке
- ^ Бернштейн С., Нфонсам В., Прасад А.Р., Бернштейн Х (март 2013 г.). «Дефекты эпигенетического поля в прогрессировании рака» . Всемирный журнал желудочно -кишечной онкологии . 5 (3): 43–49. doi : 10.4251/wjgo.v5.i3.43 . PMC 3648662 . PMID 23671730 .
- ^ Нараянан Л., Фрицелл Дж.А., Бейкер С.М., Лискай Р.М., Глейзер П.М. (апрель 1997 г.). «Повышенные уровни мутации в нескольких тканях мышей с дефицитом в гене репарации несоответствия ДНК PMS2» . Труды Национальной академии наук Соединенных Штатов Америки . 94 (7): 3122–27. Bibcode : 1997pnas ... 94.3122N . doi : 10.1073/pnas.94.7.3122 . PMC 20332 . PMID 9096356 .
- ^ Hegan DC, Narayanan L, Jirik FR, Edelmann W, Liskay RM, Glazer PM (декабрь 2006 г.). «Разные паттерны генетической нестабильности у мышей с дефицитом в генах восстановления несоответствия PMS2, MLH1, MSH2, MSH3 и MSH6» . Канцерогенез . 27 (12): 2402–08. doi : 10.1093/carcin/bgl079 . PMC 2612936 . PMID 16728433 .
- ^ Tutt AN, Van Oostrom CT, Ross GM, Van Steeg H, Ashworth A (март 2002 г.). «Разрушение BRCA2 увеличивает скорость спонтанной мутации in vivo: синергизм с ионизирующим радиацией» . Embo сообщает . 3 (3): 255–60. doi : 10.1093/embo-reports/kvf037 . PMC 1084010 . PMID 11850397 .
- ^ Немецкий J (март 1969 г.). «Синдром Блума. И. Генетические и клинические наблюдения у первых двадцати семи пациентов» . Американский журнал человеческой генетики . 21 (2): 196–227. PMC 1706430 . PMID 5770175 .
- ^ Jump up to: а беременный в О'Хаган Х.М., Мохаммад Х.П., Бэйлин С.Б. (август 2008 г.). «Двойные разрывы цепей могут инициировать молчание генов и SIRT1-зависимое начало метилирования ДНК на экзогенном промоторе CPG Island» . PLOS Genetics . 4 (8): E1000155. doi : 10.1371/journal.pgen.1000155 . PMC 2491723 . PMID 18704159 .
- ^ Cuozzo C, Porcellini A, Angrisano T, Morano A, Lee B, Di Pardo A, et al. (Июль 2007 г.). «Повреждение ДНК, гомологическое восстановление и метилирование ДНК» . PLOS Genetics . 3 (7): E110. doi : 10.1371/journal.pgen.0030110 . PMC 1913100 . PMID 17616978 .
- ^ Малкин Д (апрель 2011 г.). «Синдром Ли-Фраумени» . Гены и рак . 2 (4): 475–84. doi : 10.1177/1947601911413466 . PMC 3135649 . PMID 21779515 .
- ^ Fearon ER (ноябрь 1997 г.). «Синдромы рака человека: подсказки о происхождении и природе рака». Наука . 278 (5340): 1043–50. Bibcode : 1997sci ... 278.1043f . doi : 10.1126/science.278.5340.1043 . PMID 9353177 .
- ^ Halford S, Rowan A, Sawyer E, Talbot I, Tomlinson I (июнь 2005 г.). «O (6) -метилгуаниновая метилтрансфераза при колоректальном раке: обнаружение мутаций, потеря экспрессии и слабая связь с переходами G: C> A: T» . Кишечник 54 (6): 797–802. doi : 10.1136/gut.2004.059535 . PMC 1774551 . PMID 15888787 .
- ^ Shen L, Kondo Y, Rosner GL, Xiao L, Hernandez NS, Vilaythong J, et al. (Сентябрь 2005 г.). «Метилирование промотора MGMT и дефект поля при спорадическом колоректальном раке» . Журнал Национального института рака . 97 (18): 1330–38. doi : 10.1093/jnci/dji275 . PMID 16174854 .
- ^ Psofaki V, Kalogera C, Tzambouras N, Stephanou D, Tsianos E, Seferiadis K, et al. (Июль 2010). «Статус метилирования промотора HMLH1, MGMT и CDKN2A/P16 в колоректальных аденомах» . Всемирный журнал гастроэнтерологии . 16 (28): 3553–60. doi : 10.3748/wjg.v16.i28.3553 . PMC 2909555 . PMID 20653064 .
- ^ Ли К.Х., Ли Дж.С., Нам Дж. Х., Чой С., Ли М.К., Парк К.С. и др. (Октябрь 2011). «Статус метилирования промотора генов HMLH1, HMSH2 и MGMT при колоректальном раке, связанных с последовательности аденомы-карциномы». Архив хирургии Лангенбека . 396 (7): 1017–26. doi : 10.1007/s00423-011-0812-9 . PMID 21706233 . S2CID 8069716 .
- ^ Amatu A, Sartore-Bianchi A, Moutinho C, Belotti A, Bencardino K, Chirico G, et al. (Апрель 2013). «Промотор CPG островного гиперметилирования фермента репарации ДНК MGMT прогнозирует клинический ответ на дакарбазин в исследовании фазы II для метастатического колоректального рака» . Клиническое исследование рака . 19 (8): 2265–72. doi : 10.1158/1078-0432.ccr-12-3518 . PMID 23422094 .
- ^ Mokarram P, Zamani M, Kavousipour S, Naghibalhossaini F, Irajie C, Moradi Sarabi M, et al. (Май 2013). «Различные паттерны метилирования ДНК двух различных промоторных областей O6-метилгуанин-ДНК-метилтрансфераза (O6-MGMT) при колоректальном раке». Молекулярная биология отчетов . 40 (5): 3851–57. doi : 10.1007/s11033-012-2465-3 . PMID 23271133 . S2CID 18733871 .
- ^ Truninger K, Menigatti M, Luz J, Russell A, Haider R, Gebbers Jo, et al. (Май 2005 г.). «Иммуногистохимический анализ выявляет высокую частоту дефектов PMS2 при колоректальном раке» . Гастроэнтерология . 128 (5): 1160–71. doi : 10.1053/j.gastro.2005.01.056 . PMID 15887099 .
- ^ Valeri N, Gasparini P, Fabbri M, Braconi C, Veronese A, Lovat F, et al. (Апрель 2010). «Модуляция восстановления несоответствия и стабильности генома с помощью miR-155» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (15): 6982–87. Bibcode : 2010pnas..107.6982V . doi : 10.1073/pnas.1002472107 . PMC 2872463 . PMID 20351277 .
- ^ Facista A, Nguyen H, Lewis C, Prasad AR, Ramsey L, Zaitlin B, et al. (Апрель 2012 г.). «Недостаточная экспрессия ферментов репарации ДНК в раннем прогрессировании с спорадическим раком толстой кишки» . Целостность генома . 3 (1): 3. DOI : 10.1186/2041-9414-3-3 . PMC 3351028 . PMID 22494821 .
- ^ Гены восстановления ДНК человека , 15 апреля 2014 года, онкологический центр MD Anderson, Техасский университет
- ^ Джин Б., Робертсон К.Д. (2013). «ДНК метилтрансферазы, восстановление повреждения ДНК и рак». Эпигенетические изменения в онкогенезе . Достижения в области экспериментальной медицины и биологии. Тол. 754. С. 3–29. doi : 10.1007/978-1-4419-9967-2_1 . ISBN 978-1-4419-9966-5 Полем PMC 3707278 . PMID 22956494 .
- ^ Кришнан К., Степто А.Л., Мартин Х.К., Вани С., Нонес К., Уодделл Н. и др. (Февраль 2013 г.). «МикроРНК-182-5p нацелена на сеть генов, участвующих в репарации ДНК» . РНК . 19 (2): 230–42. doi : 10.1261/rna.034926.112 . PMC 3543090 . PMID 23249749 .
- ^ Chaisaingmongkol J, Popanda O, Warta R, Dyckhoff G, Herpel E, Geiselhart L, et al. (Декабрь 2012 г.). «Эпигенетический экран генов репарации ДНК человека идентифицирует метилирование аберрантного промотора Neil1 в плоскоклеточной карциноме головы и шеи» . Онкоген . 31 (49): 5108–16. doi : 10.1038/onc.2011.660 . PMID 22286769 .
- ^ Сингх П., Ян М., Дай Х, Ю. Д., Хуанг К., Тан В. и др. (Ноябрь 2008 г.). «Сверхэкспрессия и гипометилирование гена эндонуклеазы 1 лоскута при молочной железе и других видах рака» . Молекулярное исследование рака . 6 (11): 1710–17. doi : 10.1158/1541-7786.mcr-08-0269 . PMC 2948671 . PMID 19010819 .
- ^ Lam JS, Seligson DB, Yu H, Li A, Eeva M, Pantuck AJ, et al. (Август 2006 г.). «Эндонуклеаза 1 лоскута сверхэкспрессируется при раке предстательной железы и связан с высокой оценкой Глисона». BJU International . 98 (2): 445–51. doi : 10.1111/j.1464-410x.2006.06224.x . PMID 16879693 . S2CID 22165252 .
- ^ Ким Дж. М., Сон Х. Х., Юн Си, О.Х., Ян Джо, Ким Дж. Х. и др. (Январь 2005 г.). «Идентификация генов, связанных с раком желудка, с использованием кДНК-микрочипа, содержащего новые экспрессируемые метки последовательности, экспрессируемые в клетках рака желудка» . Клиническое исследование рака . 11 (2 пт 1): 473–82. doi : 10.1158/1078-0432.473.11.2 . PMID 15701830 .
- ^ Wang K, Xie C, Chen D (май 2014). «Эндонуклеаза 1 лоскута - это многообещающий биомаркер -кандидат при раке желудка и участвует в пролиферации клеток и апоптозе» . Международный журнал молекулярной медицины . 33 (5): 1268–74. doi : 10.3892/ijmm.2014.1682 . PMID 24590400 .
- ^ Krause A, Combaret V, Iacono I, Lacroix B, Compagnon C, Bergeron C, et al. (Июль 2005 г.). «Анализ экспрессии генов в геноме в нейробластомах, обнаруженный с помощью массового скрининга» (PDF) . Раковые письма . 225 (1): 111–20. doi : 10.1016/j.canlet.2004.10.035 . PMID 15922863 . S2CID 446444467 .
- ^ Iacobuzio-Donahue CA, Maitra A, Olsen M, Lowe AW, Van Heek NT, Rosty C, et al. (Апрель 2003 г.). «Исследование глобальных паттернов экспрессии генов при аденокарциноме поджелудочной железы с использованием микрочипов кДНК » Американский журнал патологии 162 (4): 1151–62. Doi : 10.1016/s0002-9440 (10) 63911-9 1851213PMC 12651607PMID
- ^ Сато М, Жирар Л., Секин I, Сунага Н., Рамирес Р.Д., Камибаяши С. и др. (Октябрь 2003 г.). «Повышенная экспрессия и отсутствие мутации гена эндонуклеазы (FEN1) при раке легких человека» . Онкоген . 22 (46): 7243–46. doi : 10.1038/sj.onc.1206977 . PMID 14562054 .
- ^ Bi Ff, Li D, Yang Q (2013). «Гипометилирование сайтов связывания транскрипционного фактора ETS и активация экспрессии PARP1 при раке эндометрия» . Biomed Research International . 2013 : 946268. DOI : 10.1155/2013/946268 . PMC 3666359 . PMID 23762867 .
- ^ Bi Ff, Li D, Yang Q (февраль 2013 г.). «Гипометилирование промотора, особенно вокруг трансформации E26-специфического мотива, и повышенная экспрессия поли (ADP-рибозы) полимеразы 1 при BRCA-мутированном серозном раке яичников» . BMC Рак . 13 : 90. DOI : 10.1186/1471-2407-13-90 . PMC 3599366 . PMID 23442605 .
- ^ Supek F, Lehner B (май 2015). «Дифференциальное восстановление несоответствия ДНК лежит в основе изменения скорости мутаций в геноме человека» . Природа . 521 (7550): 81–84. Bibcode : 2015natur.521 ... 81S . doi : 10.1038/nature14173 . PMC 44255546 . PMID 25707793 .
- ^ Jump up to: а беременный Zheng CL, Wang NJ, Chung J, Moslehi H, Sanborn JZ, Hur JS, et al. (Ноябрь 2014). «Транскрипция восстанавливает репарацию ДНК в гетерохроматин, определяя частоту региональных мутаций в геномах рака» . Сотовые отчеты . 9 (4): 1228–34. doi : 10.1016/j.celrep.2014.10.031 . PMC 4254608 . PMID 25456125 .
- ^ Li F, Mao G, Tong D, Huang J, Gu L, Yang W, et al. (Апрель 2013). «Гистоновая марка H3K36ME3 регулирует восстановление несоответствия ДНК человека посредством его взаимодействия с MUTSα» . Клетка . 153 (3): 590–600. doi : 10.1016/j.cell.2013.03.025 . PMC 3641580 . PMID 23622243 .
- ^ Supek F, Lehner B (июль 2017 г.). «Компания кластеризованных мутационных сигнатур показывает, что подверженные ошибкам, подверженные мутациям репарации ДНК, мутациям активных генов» . Клетка . 170 (3): 534–547.E23. doi : 10.1016/j.cell.2017.07.003 . HDL : 10230/35343 . PMID 28753428 .
- ^ Полак П., Лоуренс М.С., Хауген Е., Столецки Н., Стоянов П., Турман Р.Е. и др. (Январь 2014). «Снижение плотности локальной мутации в регуляторной ДНК геномов рака связано с репарацией ДНК» . Nature Biotechnology . 32 (1): 71–75. doi : 10.1038/nbt.2778 . PMC 4116484 . PMID 24336318 .
- ^ Суенберг Дж.А., Лу К, Мёллер Б.К., Гао Л., Аптон П.Б., Накамура Дж. И др. (Март 2011 г.). «Эндогенные и экзогенные аддукты ДНК: их роль в канцерогенезе, эпидемиологии и оценке риска» . Toxicol Sci . 120 (Suppl 1): S130–45. doi : 10.1093/toxsci/kfq371 . PMC 3043087 . PMID 21163908 .
- ^ Jump up to: а беременный Hamilton ML, Guo Z, Fuller CD, Van Remmen H, Ward WF, Austad SN, et al. (Май 2001). «Надежная оценка уровней 8-оксо-2-дезоксигуанозина в ядерной и митохондриальной ДНК с использованием метода йодида натрия для изоляции ДНК» . Нуклеиновые кислоты Res . 29 (10): 2117–26. doi : 10.1093/nar/29.10.2117 . PMC 55450 . PMID 11353081 .
- ^ Ming X, Matter B, Song M, Veliath E, Shanley R, Jones R, et al. (Март 2014 г.). «Картирование структурно определенных продуктов окисления гуанина вдоль ДНК -дуплексов: влияние контекста локальной последовательности и эндогенного метилирования цитозина» . J Am Chem Soc . 136 (11): 4223–35. doi : 10.1021/ja411636j . PMC 3985951 . PMID 24571128 .
- ^ Jump up to: а беременный в Zhou X, Zhuang Z, Wang W, He L, Wu H, Cao Y, et al. (Сентябрь 2016 г.). «OGG1 имеет важное значение при деметилировании ДНК, вызванном окислительным стрессом». Клеточный сигнал . 28 (9): 1163–1171. doi : 10.1016/j.cellsig.2016.05.021 . PMID 27251462 .
- ^ Poetsch AR (2020). «Геномика окислительного повреждения, восстановления и возникающего мутагенеза» . Comput Struct Biotechnol J. 18 : 207–219. doi : 10.1016/j.csbj.2019.12.013 . PMC 6974700 . PMID 31993111 .
- ^ D'austin O, Huet S, Campalans A, Radicella JP (ноябрь 2020 г.). «Потерянный в толпе: как человеческая 8-оксогуаниновая гликозилаза 1 (OGG1) находит 8-оксогуанин в геноме?» Полем Int J Mol Sci . 21 (21): 8360. DOI : 10.3390/IJMS21218360 . PMC 7664663 . PMID 33171795 .
- ^ Lan L, Nakajima S, Oohata Y, Takao M, Okano S, Masutani M, et al. (Сентябрь 2004 г.). «Анализ процессов восстановления in situ для окислительного повреждения ДНК в клетках млекопитающих» . Proc Natl Acad Sci USA . 101 (38): 13738–43. Bibcode : 2004pnas..10113738L . doi : 10.1073/pnas.0406048101 . PMC 518826 . PMID 15365186 .
- ^ Zhou X, Zhuang Z, Wang W, He L, Wu H, Cao Y, et al. (Сентябрь 2016 г.). «OGG1 имеет важное значение в окислительном стрессе, вызванном деметилированием ДНК». Клеточный сигнал . 28 (9): 1163–1171. doi : 10.1016/j.cellsig.2016.05.021 . PMID 27251462 .
- ^ Мур LD, Le T, Fan G (январь 2013 г.). «Метилирование ДНК и ее основная функция» . Нейропсихофармакология . 38 (1): 23–38. doi : 10.1038/npp.2012.112 . PMC 3521964 . PMID 22781841 .
- ^ Maeder ML, Angstman JF, Richardson ME, Linder SJ, Cascio VM, Tsai SQ, et al. (Декабрь 2013). «Целевое деметилирование ДНК и активация эндогенных генов с использованием программируемых слитых белков Tale-TET1» . НАТ Биотехнол . 31 (12): 1137–42. doi : 10.1038/nbt.2726 . PMC 3858462 . PMID 24108092 .
- ^ Ding N, Bonham EM, Hannon BE, Amick TR, Baylin SB, O'Hagan HM (июнь 2016 г.). «Ремонтные белки несоответствия рекрутируют ДНК метилтрансферазу 1 в сайты окислительного повреждения ДНК» . J Mol Cell Biol . 8 (3): 244–54. doi : 10.1093/jmcb/mjv050 . PMC 4937888 . PMID 26186941 .
- ^ Jump up to: а беременный Jiang Z, Lai Y, Beaver JM, Tsegay PS, Zhao ML, Horton JK, et al. (Январь 2020 г.). «Окислительное повреждение ДНК модулирует паттерн метилирования ДНК в гене рака молочной железы человека 1 (BRCA1) через перекрестные помехи между ДНК -полимеразой β и ДНК -метилтрансферазой ДНК» . Ячейки 9 (1): 225. doi : 10.3390/cells9010225 . PMC 7016758 . PMID 31963223 .
- ^ Mortusewicz O, Schermelleh L, Walter J, Cardoso MC, Leonhardt H (июнь 2005 г.). «Рекрутирование ДНК метилтрансферазы I в сайты репарации ДНК» . Proc Natl Acad Sci USA . 102 (25): 8905–9. Bibcode : 2005pnas..102.8905m . doi : 10.1073/pnas.0501034102 . PMC 1157029 . PMID 15956212 .
- ^ Jump up to: а беременный Cuozzo C, Porcellini A, Angrisano T, Morano A, Lee B, Di Pardo A, et al. (Июль 2007 г.). «Повреждение ДНК, гомологическое восстановление и метилирование ДНК» . PLOS GENET . 3 (7): E110. doi : 10.1371/journal.pgen.0030110 . PMC 1913100 . PMID 17616978 .
- ^ Ha K, Lee GE, Palii SS, Brown KD, Takeda Y, Liu K, et al. (Январь 2011). «Быстрый и временный рекрутирование DNMT1 в ДНК-разрывы двойной цепь опосредована его взаимодействием с несколькими компонентами механизма реакции на повреждение ДНК» . Hum Mol Genet . 20 (1): 126–40. doi : 10.1093/hmg/ddq451 . PMC 3000680 . PMID 20940144 .
- ^ Руссо Г., Ланди Р., Пезоне А., Морано А., Зучегна С., Романо А. и др. (Сентябрь 2016 г.). «Повреждение ДНК и репарация модифицируют метилирование ДНК и домен хроматина целевого локуса: механизм полиморфизма метилирования аллеля» . SCI Rep . 6 : 33222. Bibcode : 2016Natsr ... 6332222R . doi : 10.1038/srep33222 . PMC 5024116 . PMID 27629060 .
- ^ Фаррис М.Х., Текстер П.А., Мора А.А., Уайлс М.В., Мак Гарригл Э.Ф., Клаус С.А. и др. (Декабрь 2020 г.). «Обнаружение CRISPR-опосредованных модификаций генома посредством измененных паттернов метилирования островов CPG» . BMC Genomics . 21 (1): 856. doi : 10.1186/s12864-020-07233-2 . PMC 7709351 . PMID 33267773 .
- ^ Аллен Б., Пезоне А., Порчеллини А., Мюллер М.Т., Мастернак М.М. (июнь 2017 г.). «Неумологичное соединение, индуцированное изменение метилирования ДНК: источник постоянного эпигенетического изменения» . Oncotarget . 8 (25): 40359–40372. doi : 10.18632/oncotarget.16122 . PMC 5522286 . PMID 28423717 .
- ^ Cromie GA, Connelly JC, Leach DR (декабрь 2001 г.). «Рекомбинация при двойных разрывах и заканчивается ДНК: консервативные механизмы от фага до людей» . Молекулярная клетка . 8 (6): 1163–74. doi : 10.1016/s1097-2765 (01) 00419-1 . PMID 11779493 .
- ^ О'Брайен П.Дж. (февраль 2006 г.). «Каталитическая распущенность и дивергентная эволюция ферментов репарации ДНК». Химические обзоры . 106 (2): 720–52. doi : 10.1021/cr040481v . PMID 16464022 .
- ^ Maresca B, Schwartz JH (январь 2006 г.). «Внезапное происхождение: общий механизм эволюции, основанный на концентрации стресса белка и быстрых изменениях окружающей среды» . Анатомическая запись Часть B: новый анатомист . 289 (1): 38–46. doi : 10.1002/ar.b.20089 . PMID 16437551 .
- ^ «Инструмент редактирования генов CRISPR заставляет ученых взволнованы-но нервные» CBC News. Автор Келли Кроу. 30 ноября 2015 года.
Внешние ссылки
[ редактировать ] СМИ, связанные с восстановлением ДНК в Wikimedia Commons
СМИ, связанные с восстановлением ДНК в Wikimedia Commons - Лекции по восстановлению ДНК Института рака Розуэлл Парк
- Комплексный список генов репарации ДНК человека
- 3D -структуры некоторых ферментов репарации ДНК
- Machado CR, Menck CF (декабрь 1997 г.). «Болезни ДНК человека: от нестабильности генома до рака» . Бразировка J. Genet . 20 (4): 755–762. doi : 10.1590/s0100-84551997000400032 .
- Группа специальных интересов ДНК
- Ремонт ДНК архивировал 12 февраля 2018 года на машине Wayback
- Повреждение ДНК и восстановление ДНК
- Сегментарная прогерия
- Hakem R (февраль 2008 г.). «Ремонт нанесения ДНК; хорошее, плохое и уродливое» . Embo j . 27 (4): 589–605. doi : 10.1038/emboj.2008.15 . PMC 2262034 . PMID 18285820 .
- Morales Me, Derbes RS, Ade CM, Ortego JC, Stark J, Deininger PL, et al. (2016). «Экспозиция тяжелых металлов влияет на результаты восстановления ДНК двойного разрыва» . Plos один . 11 (3): E0151367. BIBCODE : 2016PLOSO..1151367M . doi : 10.1371/journal.pone.0151367 . PMC 4788447 . PMID 26966913 .