Домен протеинкиназы
| Домен протеинкиназы | |||
|---|---|---|---|
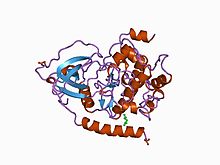 Структура каталитической субъединицы цАМФ-зависимой протеинкиназы. [ 1 ] | |||
| Идентификаторы | |||
| Символ | пкиназы | ||
| Пфам | PF00069 | ||
| ИнтерПро | IPR000719 | ||
| УМНЫЙ | ТирКс | ||
| PROSITE | PDOC00100 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 13:00 / СКОПе / СУПФАМ | ||
| Суперсемейство OPM | 186 | ||
| CDD | cd00180 | ||
| Мембраном | 3 | ||
| |||
Домен протеинкиназы представляет собой структурно консервативный белковый домен, содержащий каталитическую функцию протеинкиназы . [ 2 ] [ 3 ] [ 4 ] Протеинкиназы — это группа ферментов , которые перемещают фосфатную группу на белки в процессе, называемом фосфорилированием. Он функционирует как переключатель включения/выключения многих клеточных процессов, включая метаболизм, транскрипцию, развитие клеточного цикла, перестройку цитоскелета и движение клеток, апоптоз и дифференцировку. Они также участвуют в эмбриональном развитии, физиологических реакциях, а также в нервной и иммунной системах. Аномальное фосфорилирование вызывает многие заболевания человека, включая рак, и лекарства, влияющие на фосфорилирование, могут лечить эти заболевания. [ 5 ]
Протеинкиназы обладают каталитической субъединицей, которая переносит гамма-фосфат из нуклеозидтрифосфатов (почти всегда АТФ ) в боковую цепь аминокислоты белка, что приводит к конформационным и/или динамическим изменениям, влияющим на функцию белка. Эти ферменты делятся на два широких класса, характеризующихся субстратной специфичностью: специфичные к серину/треонину и специфичные к тирозину . [ 6 ]
Функция
[ редактировать ]Функция протеинкиназы эволюционно законсервирована от Escherichia coli до Homo sapiens . Протеинкиназы играют роль во множестве клеточных процессов, включая деление, пролиферацию, апоптоз и дифференцировку. [ 7 ] Фосфорилирование обычно приводит к функциональному изменению белка-мишени за счет изменения структуры, динамики, активности фермента, клеточного расположения или ассоциации с другими белками.
Структура
[ редактировать ]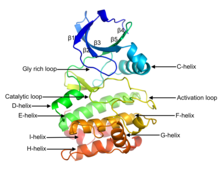
Каталитические субъединицы протеинкиназ высококонсервативны, и определены структуры более 280 из примерно 500 киназных доменов человека. [ 8 ] что привело к проведению масштабных исследований по разработке специфичных киназных ингибиторов для лечения ряда заболеваний. [ 9 ] У людей есть только 437 киназных доменов, обладающих каталитической активностью; остальные являются псевдокиназами или катализируют другие реакции. [ нужна ссылка ]
Эукариотические протеинкиназы [ 2 ] [ 3 ] [ 10 ] [ 11 ] Это ферменты, принадлежащие к очень обширному семейству белков, которые имеют консервативное каталитическое ядро, общее как с серин/треониновыми, так и с тирозиновыми протеинкиназами. Домен состоит из двух субдоменов, называемых N- и C-концевыми доменами. N-концевой домен состоит из пяти нитей бета-листа и альфа-спирали, называемой C-спиралью, а C-концевой домен обычно состоит из шести альфа-спиралей (обозначенных D, E, F, G, H и I). С-концевой домен содержит две длинные петли, называемые каталитической петлей и петлей активации, которые необходимы для каталитической активности. Каталитическая петля включает «HRD-мотив» (для аминокислотной последовательности His-Arg-Asp), остаток аспарагиновой кислоты которого непосредственно взаимодействует с гидроксильной группой целевого остатка серина, треонина или тирозина, который фосфорилируется. [ 12 ]
Петля активации начинается с мотива DFG (аминокислотной последовательности Asp-Phe-Gly), который помогает связывать АТФ и магний в активном центре. В широком смысле состояние или конформацию киназы можно классифицировать как DFGin или DFGout , в зависимости от того, находится ли остаток Asp мотива DFG в активном сайте или вне его. В активной форме первые несколько остатков активационной петли принимают специфическую форму конформации DFGin. Некоторые неактивные структуры могут принимать одну из нескольких других конформаций DFGin, тогда как другие неактивные структуры представляют собой DFGout. [ 13 ]
Примеры
[ редактировать ]Ниже приводится список белков человека, содержащих домен протеинкиназы: [ 14 ]
ААК1 ; ААТК ; АБЛ1 ; АБЛ2 ; ACVR1 ; ACVR1B ; ACVR1C ; ACVR2A ; ACVR2B ; АКВРЛ1 ; АКТ1 ; АКТ2 ; АКТ3 ; АЛК ; АМХР2 ; АНКК1 ; ВРАФ ; ПРОТИВ АУРКБ АУРКК ; АХL ЧЛК БМП2К ; БМПР1А ; БМПР1Б ; БМПР2 ; БМХ ; БРАФ ; БРСК1 ; БРСК2 ; БТК ; БУБ1 ; БУБ1Б ; САМК1 ; САМК1Д ; САМК1Г ; САМК2А ; САМК2Б ; САМК2Д ; САМК2Г ; САМК4 ; САМКК1 ; САМКК2 ; ЦАМКВ ; БОЧКА ; CDC42BPA ; CDC42BPB ; CDC42BPG ; CDC7 ; CDK1 ; CDK10 ; CDK11A ; CDK11B ; CDK12 ; CDK13 ; CDK14 ; CDK15 ; CDK16 ; CDK17 ; CDK18 ; CDK19 ; CDK2 ; CDK20 ; CDK3 ; CDK4 ; CDK5 ; CDK6 ; CDK7 ; CDK8 ; CDK9 ; CDKL1 ; CDKL2 ; CDKL3 ; CDKL4 ; CDKL5 ; ЧЕК1 ; ЧЕК2 ; ЧУК КПИТ ; КЛК1 ; КЛК2 ; КЛК3 ; КЛК4 ; КСФ1Р ; ЦСК ; ЦСНК1А1 ; ЦСНК1А1Л ; ЦСНК1Д ; ЦСНК1Е ; ЦСНК1G1 ; ЦСНК1G2 ; ЦСНК1G3 ; ЦСНК2А1 ; ЦСНК2А2 ; ЦСНК2А3 ; ДАПК1 ; ДАПК2 ; ДАПК3 ; ДКЛК1 ; ДКЛК2 ; ДКЛК3 ; ДДР1 ; ДДР2 ; ДМПК ; ДСТИК ; ДИРК1А ; ДИРК1Б ; ДИРК2 ; ДИРК3 ; ДИРК4 ; РЭФР ЭИФ2АК1 ; ЭИФ2АК2 ; ЭИФ2АК3 ; ЭИФ2АК4 ; ЭФА1 ; ЭФА10 ; ЭФА2 ; ЭФА3 ; ЭФА4 ; ЭФА5 ; ЭФА6 ; ЭФА7 ; ЭФА8 ; ЭПХБ1 ; ЭПХБ2 ; ЭПХБ3 ; ЭПХБ4 ; ЭПХБ6 ; ЭРББ2 ; ЭРББ3 ; ЭРББ4 ; ЭРН1 ; ЭРН2 ; ФЕР ; ФЭС ; ФГФР1 ; ФГФР2 ; ФГФР3 ; ФГФР4 ; ФГР ; ФЛТ1 ; ФЛТ3 ; ФЛТ4 ; ФРК ; ФИН ; ГАК ; ГРК1 ; ГРК2 ; ГРК3 ; ГРК4 ; ГРК5 ; ГРК6 ; ГРК7 ; ГСГ2 ; ГСК3А ; ГСК3Б ; ГУСИ2С ; ГУСИ2Д ; ГУСИ2Ф ; ХКК ; ХИПК1 ; ХИПК2 ; ХИПК3 ; ХИПК4 ; ХАНК ; ИКК ; ИФР1Р ; ИКБКБ ; ИКБКЭ ; ИЛК ; ИНСР ; ИНСРР ; ИРАК1 ; ИРАК2 ; ИРАК3 ; ИРАК4 ; ИТК ; ЯК1 ; ЯК2 ; ЯК3 ; КАЛРН ; КДР ; НАБОР ; КСР1 ; КСР2 ; ЛАТС1 ; ЛАТС2 ; ЛКК ; ЛИМК1 ; ЛИМК2 ; ЛМТК2 ; ЛМТК3 ; ЛРРК1 ; ЛРРК2 ; ЛТК ; ЛИН ; МАК ; МАР2К1 ; МАР2К2 ; МАР2К3 ; МАР2К4 ; МАР2К5 ; МАР2К6 ; МАР2К7 ; МАР3К1 ; МАР3К10 ; МАР3К11 ; МАР3К12 ; МАР3К13 ; МАР3К14 ; МАР3К15 ; МАР3К19 ; МАР3К2 ; МАП3К20 ; МАП3К21 ; МАР3К3 ; МАР3К4 ; МАР3К5 ; МАР3К6 ; МАР3К7 ; МАР3К8 ; МАР3К9 ; МАР4К1 ; МАР4К2 ; МАР4К3 ; МАР4К4 ; МАР4К5 ; МАПК1 ; МАПК10 ; МАПК11 ; МАПК12 ; МАПК13 ; МАПК14 ; МАПК15 ; МАПК3 ; МАПК4 ; МАПК6 ; МАПК7 ; МАПК8 ; МАПК9 ; МАПКАПК2 ; МАПКАПК3 ; МАПКАПК5 ; МАРК1 ; МАРК2 ; МАРК3 ; МАРК4 ; МАСТ1 ; МАСТ2 ; МАСТ3 ; МАСТ4 ; МАЧТА ; ПЕШИЙ ТУРИЗМ ; МЕЛК ; МЕРТС ; МЕТ ; НОРКА1 ; МКНК1 ; МКНК2 ; МЛКЛ ; МОК ; МОС ; МСТ1Р ; МУСК ; МЫЛК ; МИЛК2 ; МИЛК3 ; МИЛК4 ; МИО3А ; МИО3Б ; НЭК1 ; НЭК10 ; НЭК11 ; НЭК2 ; НЭК3 ; НЭК4 ; НЭК5 ; НЭК6 ; НЭК7 ; НЭК8 ; НЭК9 ; НИМ1К ; НЛК ; НПР1 ; НПР2 ; НРБП1 ; НРБП2 ; НРК ; НТРК1 ; НТРК2 ; НТРК3 ; НУАК1 ; НУАК2 ; ОБСКН ; ОХСР1 ; ПАК1 ; ПАК2 ; ПАК3 ; ПАК4 ; ПАК5 ; ПАК6 ; ПАН3 ; ДЕРЬМО ; ПБК ; ПДГФРА ; ПДГФРБ ; ПДИК1Л ; ПДПК1 ; ПДПК2П ; ПИК1 ; ПИК3 ; ПХГ1 ; ПХКГ2 ; ПИК3Р4 ; ПИМ1 ; ПИМ2 ; ПИМ3 ; СКАМЬЯ1 ; ПКДКК ; ПКМИТ1 ; ПКН1 ; ПКН2 ; ПКН3 ; ПЛК1 ; ПЛК2 ; ПЛК3 ; ПЛК4 ; ПЛК5 ; ПНКК ; ПОМК ; ПРКАА1 ; ПРКАА2 ; ПРКАЦА ; ПРКАКБ ; ПРКАКГ ; ПРККА ; ПРККБ ; ПРККД ; ПРКЦЕ ; ПРККГ ; ПРКЧ ; ПРККИ ; ПРККК ; ПРКЦЗ ; ПРКД1 ; ПРКД2 ; ПРКД3 ; ПРКГ1 ; ПРКГ2 ; ПРККС ; ПРККИ ; ПРПФ4Б ; ПСХ1 ; ПСХ2 ; ПТК2 ; ПТК2Б ; ПТК6 ; ПТК7 ; ПХК ; РАФ1 ; РЭТ ; РИОК1 ; РИОК2 ; РИОК3 ; РИПК1 ; РИПК2 ; РИПК3 ; РИПК4 ; РНАСЕЛ ; РОК1 ; РОК2 ; РОР1 ; РОР2 ; РОС1 ; РПС6КА1 ; РПС6КА2 ; РПС6КА3 ; РПС6КА4 ; РПС6КА5 ; РПС6КА6 ; РПС6КБ1 ; РПС6КБ2 ; РПС6КС1 ; РПС6КЛ1 ; РСКР ; РИК ; СБК1 ; СБК2 ; СБК3 ; СЦИЛ1 ; СЦИЛ2 ; СЦИЛ3 ; СГК1 ; СГК2 ; СГК223 ; СГК3 ; СИК1 ; СИК1Б ; СИК2 ; СИК3 ; СЛК ; СНРК ; СПЭГ ; СРК ; СРМС ; СРПК1 ; СРПК2 ; СРПК3 ; СТК10 ; СТК11 ; СТК16 ; СТК17А ; СТК17Б ; СТК24 ; СТК25 ; СТК26 ; СТК3 ; СТК31 ; СТК32А ; СТК32Б ; СТК32С ; СТК33 ; СТК35 ; СТК36 ; СТК38 ; СТК38Л ; СТК39 ; СТК4 ; СТК40 ; СТКЛД1 ; СТРАДА ; СТРАДБ ; СТИК1 ; СИК ; ТАОК1 ; ТАОК2 ; ТАОК3 ; ТБСК ; ТБК1 ; ТЭК ; ТЭК ; ТЭСК1 ; ТЭСК2 ; ТЭК14 ; ТГФБР1 ; ТГФБР2 ; СВЯЗЬ1 ; ТЛК1 ; ТЛК2 ; ТНИК ; ТНК1 ; ТНК2 ; ТННИ3К ; ТП53РК ; ТРИБ1 ; ТРИБ2 ; ТРИБ3 ; ТРИО ; ЦСК1Б ; ЦСК2 ; ЦСК3 ; ЦСК4 ; ЦСК6 ; ТТБК1 ; ТТБК2 ; ТТК ; ТТН ; ТХК ; ТИК2 ; ТИРО3 ; УХМК1 ; УЛК1 ; УЛК2 ; УЛК3 ; УЛК4 ; ВРК1 ; ВРК2 ; ВРК3 ; МЭЭ1 ; ОЭЭ2 ; ВНК1 ; ВНК2 ; ВНК3 ; ВНК4 ; ДА1 ; ЗАП70
Ссылки
[ редактировать ]- ^ Найтон Д.Р., Белл С.М., Чжэн Дж. и др. (май 1993 г.). «2.0 Уточненная кристаллическая структура каталитической субъединицы цАМФ-зависимой протеинкиназы в комплексе с пептидным ингибитором и детергентом». Акта Кристаллогр. Д. 49 (Часть 3): 357–61. Бибкод : 1993AcCrD..49..357K . дои : 10.1107/S0907444993000502 . ПМИД 15299526 .
- ^ Перейти обратно: а б Хэнкс С.К., Куинн А.М. (1991). «База данных последовательностей каталитических доменов протеинкиназы: идентификация консервативных особенностей первичной структуры и классификация членов семейства». Фосфорилирование белков. Часть A: Протеинкиназы: анализы, очистка, антитела, функциональный анализ, клонирование и экспрессия . Методы энзимологии. Том. 200. С. 38–62. дои : 10.1016/0076-6879(91)00126-H . ISBN 978-0-12-182101-2 . ПМИД 1956325 .
- ^ Перейти обратно: а б Хэнкс С.К., Хантер Т. (май 1995 г.). «Протеинкиназы 6. Суперсемейство эукариотических протеинкиназ: структура киназного (каталитического) домена и классификация» . ФАСЕБ Дж . 9 (8): 576–96. дои : 10.1096/fasebj.9.8.7768349 . ПМИД 7768349 . S2CID 21377422 .
- ^ Шифф Э.Д., Борн П.Е. (октябрь 2005 г.). «Структурная эволюция суперсемейства протеинкиназоподобных» . ПЛОС Компьютер. Биол . 1 (5): е49. Бибкод : 2005PLSCB...1...49S . дои : 10.1371/journal.pcbi.0010049 . ПМЦ 1261164 . ПМИД 16244704 .
- ^ Мэннинг Дж., Уайт Д.Б., Мартинес Р., Хантер Т., Сударсанам С. (декабрь 2002 г.). «Протеинкиназный комплемент генома человека». Наука . 298 (5600): 1912–1934. Бибкод : 2002Sci...298.1912M . дои : 10.1126/science.1075762 . ПМИД 12471243 . S2CID 26554314 .
- ^ Хантер Т., Хэнкс С.К., Куинн А.М. (1988). «Семейство протеинкиназ: консервативные особенности и установленная филогения каталитических доменов». Наука . 241 (4861): 42–51. Бибкод : 1988Sci...241...42H . дои : 10.1126/science.3291115 . ПМИД 3291115 .
- ^ Мэннинг Дж., Пахарь Г.Д., Хантер Т., Сударсанам С. (октябрь 2002 г.). «Эволюция передачи сигналов протеинкиназы от дрожжей к человеку». Тенденции биохимии. Наука . 27 (10): 514–20. дои : 10.1016/S0968-0004(02)02179-5 . ПМИД 12368087 .
- ^ Моди, В; Данбрэк, РЛ (24 декабря 2019 г.). «Структурно подтвержденное множественное выравнивание последовательностей 497 доменов протеинкиназы человека» . Научные отчеты . 9 (1): 19790. Бибкод : 2019НатСР...919790М . дои : 10.1038/s41598-019-56499-4 . ПМК 6930252 . ПМИД 31875044 .
- ^ Ли Б, Лю Ю, Уно Т, Грей Н (август 2004 г.). «Создание химического разнообразия для воздействия на протеинкиназы» . Гребень. хим. Экран высокой пропускной способности . 7 (5): 453–72. дои : 10.2174/1386207043328580 . ПМИД 15320712 . Архивировано из оригинала 14 апреля 2013 года.
- ^ Хэнкс С.К. (2003). «Геномный анализ суперсемейства эукариотических протеинкиназ: перспективы» . Геном Биол . 4 (5): 111. doi : 10.1186/gb-2003-4-5-111 . ПМК 156577 . ПМИД 12734000 .
- ^ Хантер Т. (1991). «Классификация протеинкиназ». Фосфорилирование белков. Часть A: Протеинкиназы: анализы, очистка, антитела, функциональный анализ, клонирование и экспрессия . Методы энзимологии. Том. 200. стр. 3–37. дои : 10.1016/0076-6879(91)00125-G . ISBN 978-0-12-182101-2 . ПМИД 1835513 .
- ^ Найтон Д.Р., Чжэн Дж.Х., Тен Эйк Л.Ф., Эшфорд В.А., Сюонг Н.Х., Тейлор С.С., Совадски Дж.М. (июль 1991 г.). «Кристаллическая структура каталитической субъединицы циклической аденозинмонофосфатзависимой протеинкиназы». Наука . 253 (5018): 407–14. Бибкод : 1991Sci...253..407K . дои : 10.1126/science.1862342 . ПМИД 1862342 .
- ^ Моди, В; Данбрэк, РЛ (2 апреля 2019 г.). «Определение новой номенклатуры структур активных и неактивных киназ» . Труды Национальной академии наук Соединенных Штатов Америки . 116 (14): 6818–6827. Бибкод : 2019PNAS..116.6818M . дои : 10.1073/pnas.1814279116 . ПМК 6452665 . ПМИД 30867294 .
- ^ «Протеинкиназы человека и мыши: классификация и индекс» . pkinfam.txt . Консорциум ЮниПрот . Проверено 10 июня 2019 г.