Неметалл
Данная статья может содержать цитаты , не подтверждающие текст . Причина такова: проверка раздела критериев показала, что многие из них были неверными, поэтому необходимо проверить все. ( Август 2024 г. ) |
| Отрывок из таблицы Менделеева с выделением неметаллов. |

|
| всегда/обычно считаются неметаллами [ 1 ] [ 2 ] [ 3 ] |
| металлоиды, иногда считающиеся неметаллами [ а ] |
| статус неметалла или металла не подтвержден [ 5 ] |
| Часть серии о |
| Периодическая таблица |
|---|
В контексте таблицы Менделеева неметалл — это химический элемент , который в большинстве случаев не обладает характерными металлическими свойствами. Они варьируются от бесцветных газов, таких как водород, до блестящих кристаллов, таких как йод . Физически они обычно легче (менее плотны), чем элементы, образующие металлы, и часто являются плохими проводниками тепла и электричества . С химической точки зрения неметаллы имеют относительно высокую электроотрицательность или обычно притягивают электроны в химической связи с другим элементом, а их оксиды имеют тенденцию быть кислотными .
Семнадцать элементов широко признаны неметаллами. Кроме того, некоторые или все из шести пограничных элементов ( металлоидов ) иногда считаются неметаллами.
Два самых легких неметалла, водород и гелий , вместе составляют около 98% массы наблюдаемой Вселенной . Пять неметаллических элементов — водород, углерод, азот , кислород и кремний — составляют основную часть земной атмосферы , биосферы , коры и океанов .
Промышленное использование неметаллов включает электронику , хранение энергии , сельское хозяйство и химическое производство .
Большинство неметаллических элементов было обнаружено в XVIII и XIX веках. Хотя различие между металлами и другими минералами существовало с древности, основная классификация химических элементов на металлические и неметаллические возникла только в конце 18 века. С тех пор около двадцати свойств было предложено в качестве критериев отличия неметаллов от металлов.
Определение и применимые элементы
[ редактировать ]- Если не указано иное, в этой статье описывается стабильная форма элемента при стандартной температуре и давлении (STP). [ б ]

Неметаллические химические элементы часто описываются как лишенные свойств, свойственных металлам, а именно блеска, пластичности, хорошей тепло- и электропроводности и общей способности образовывать основные оксиды. [ 8 ] [ 9 ] Не существует общепринятого точного определения; [ 10 ] любой список неметаллов открыт для обсуждения и пересмотра. [ 1 ] Включенные элементы зависят от свойств, которые считаются наиболее характерными для неметаллического или металлического характера.
Четырнадцать элементов почти всегда признаются неметаллами: [ 1 ] [ 2 ]
Еще три обычно относят к неметаллам, но в некоторых источниках их называют « металлоидами ». [ 3 ] термин, обозначающий элементы, которые считаются промежуточными между металлами и неметаллами: [ 11 ]
Один или несколько из шести элементов, чаще всего называемых металлоидами, иногда вместо этого считаются неметаллами:
Около 15–20% из 118 известных элементов. [ 12 ] таким образом, классифицируются как неметаллы. [ с ]
Общие свойства
[ редактировать ]Физический
[ редактировать ]некоторых неметаллических элементов
Неметаллы сильно различаются по внешнему виду: бесцветные, цветные или блестящие. Для бесцветных неметаллов (водорода, азота, кислорода и благородных газов) в видимой части спектра поглощение света не происходит, и весь видимый свет проходит. [ 15 ] Цветные неметаллы (сера, фтор, хлор, бром) поглощают некоторые цвета (длины волн) и передают дополнительные или противоположные цвета. Например, «знакомый желто-зеленый цвет хлора... обусловлен широкой областью поглощения в фиолетовой и синей областях спектра». [ 16 ] [ д ] Блеск бора, графита (углерода), кремния, черного фосфора, германия, мышьяка, селена, сурьмы, теллура и йода. [ и ] Это результат различной степени металлической проводимости, при которой электроны могут отражать падающий видимый свет. [ 19 ]
Около половины неметаллических элементов представляют собой газы при стандартных температуре и давлении ; большая часть остальных - твердые вещества. Бром, единственная жидкость, обычно покрыт слоем красновато-коричневых паров. Газообразные и жидкие неметаллы имеют очень низкие плотности, температуры плавления и кипения и являются плохими проводниками тепла и электричества. [ 20 ] Твердые неметаллы имеют низкую плотность и низкую механическую прочность (твёрдые и хрупкие, либо мягкие и рассыпчатые). [ 21 ] и широкий диапазон электропроводности. [ ж ]
Это разнообразие форм связано с изменчивостью внутренних структур и механизмов связи. Ковалентные неметаллы, существующие в виде отдельных атомов, таких как ксенон, или в виде небольших молекул, таких как кислород, сера и бром, имеют низкие температуры плавления и кипения; многие из них являются газами при комнатной температуре, поскольку они удерживаются вместе слабыми дисперсионными силами Лондона, действующими между их атомами или молекулами, хотя сами молекулы имеют сильные ковалентные связи. [ 25 ] Напротив, неметаллы, образующие протяженные структуры, такие как длинные цепочки атомов селена, [ 26 ] листы атомов углерода в графите, [ 27 ] или трехмерные решетки атомов кремния [ 28 ] имеют более высокие температуры плавления и кипения и все являются твердыми веществами, поскольку для преодоления их более прочной связи требуется больше энергии. [ 29 ] [ сомнительно – обсудить ] Неметаллы, находящиеся ближе к левому или нижнему краю таблицы Менделеева (и, следовательно, ближе к металлам), часто имеют металлические взаимодействия между их молекулами, цепочками или слоями; это происходит в боре, [ 30 ] углерод, [ 31 ] фосфор, [ 32 ] мышьяк, [ 33 ] селен, [ 34 ] сурьма, [ 35 ] теллур [ 36 ] и йод. [ 37 ]
| Аспект | Металлы | Неметаллы |
|---|---|---|
| Появление и форма |
Блестящий, если свежеприготовленный или сломан; мало цветных; [ 38 ] все кроме одного твердое [ 39 ] |
Блестящие, цветные или прозрачный; [ 40 ] все, кроме один твердый или газообразный [ 39 ] |
| Плотность | Часто выше | Часто ниже |
| Пластичность | В основном податливый и пластичный |
Часто хрупкие твердые тела |
| Электрический проводимость [ 41 ] |
Хороший | От плохого к хорошему |
| Электронный структура [ 42 ] |
Металлический или полуметаллический | Полуметалл, полупроводник , или изолятор |
Неметаллы с ковалентной связью часто разделяют только те электроны, которые необходимы для достижения электронной конфигурации благородного газа. [ 43 ] Например, азот образует двухатомные молекулы с тройными связями между каждым атомом, оба из которых таким образом приобретают конфигурацию благородного газа неона. Больший размер атома сурьмы предотвращает тройную связь, в результате чего образуются искривленные слои, в которых каждый атом сурьмы одиночно связан с тремя другими соседними атомами. [ 44 ]
Хорошая электропроводность возникает при наличии металлической связи . [ 45 ] однако электроны в неметаллах часто не металлические. [ 45 ] Хорошая электро- и теплопроводность, связанная с металлическими электронами, наблюдается у углерода (в виде графита по его плоскостям), мышьяка и сурьмы. [ г ] Хорошей теплопроводностью обладают бор, кремний, фосфор и германий; [ 22 ] такая проводимость передается посредством колебаний кристаллических решеток этих элементов. [ 46 ] Умеренная электропроводность наблюдается в полупроводниках. [ 47 ] бор, кремний, фосфор, германий, селен, теллур и йод.
Многие неметаллические элементы тверды и хрупки. [ 21 ] где дислокации не могут легко перемещаться, поэтому они имеют тенденцию подвергаться хрупкому разрушению, а не деформации. [ 48 ] Некоторые из них деформируются, например, белый фосфор (мягкий, как воск, податливый, его можно резать ножом при комнатной температуре), [ 49 ] в пластиковой сере , [ 50 ] и в селене, который можно вытягивать в провода из расплавленного состояния. [ 51 ] Графит является стандартной твердой смазкой , в которой дислокации очень легко перемещаются в базисных плоскостях. [ 52 ]
Аллотропы
[ редактировать ]Более половины неметаллических элементов имеют ряд менее стабильных аллотропных форм, каждая из которых имеет свои физические свойства. [ 53 ] Например, углерод, наиболее стабильной формой которого является графит , может проявляться как алмаз , бакминстерфуллерен , [ 54 ] аморфный [ 55 ] и паракристаллический [ 56 ] вариации. Аллотропы также встречаются у азота, кислорода, фосфора, серы, селена и йода. [ 57 ]
Химическая
[ редактировать ]| Аспект | Металлы | Неметаллы | |
|---|---|---|---|
| Реактивность [ 58 ] | Широкий диапазон: очень реактивный к благородному | ||
| Оксиды | ниже | Базовый | Кислый ; никогда не простой [ 59 ] |
| выше | Все более кислый | ||
| Соединения с металлами [ 60 ] |
Сплавы | Ионные соединения | |
| Энергия ионизации [ 61 ] | От низкого к высокому | От умеренного до очень высокого | |
| Электроотрицательность [ 62 ] | От низкого к высокому | От умеренного до очень высокого | |
Неметаллы имеют относительно высокие значения электроотрицательности, а их оксиды обычно кислые. Исключения могут возникнуть, если неметалл не очень электроотрицательный, или если его степень окисления низкая, или и то, и другое. Эти некислотные оксиды неметаллов могут быть амфотерными (например, вода, H 2 O [ 63 ] ) или нейтральный (как закись азота , N 2 O [ 64 ] [ ч ] ), но никогда не является базовым.
Неметаллы имеют тенденцию приобретать электроны во время химических реакций, в отличие от металлов, которые имеют тенденцию отдавать электроны. Такое поведение связано со стабильностью электронных конфигураций в благородных газах, которые имеют полные внешние оболочки , как это резюмируется эмпирическими правилами дуэта и октета , что более правильно объясняется с точки зрения теории валентных связей . [ 67 ]
Они обычно демонстрируют более высокие энергии ионизации , сродство к электрону и стандартные электродные потенциалы , чем металлы. Как правило, чем выше эти значения (включая электроотрицательность), тем более неметаллическим является элемент. [ 68 ] Например, химически очень активные неметаллы фтор, хлор, бром и йод имеют среднюю электроотрицательность 3,19 — цифру [ я ] выше, чем у любого металлического элемента.
Химические различия между металлами и неметаллами связаны с силой притяжения между положительным зарядом ядра отдельного атома и его отрицательно заряженными внешними электронами. Слева направо в каждом периоде таблицы Менделеева заряд ядра (количество протонов в атомном ядре ) увеличивается. [ 69 ] Происходит соответствующее уменьшение атомного радиуса. [ 70 ] поскольку увеличенный заряд ядра притягивает внешние электроны ближе к ядру ядра. [ 71 ] При химической связи неметаллы имеют тенденцию присоединять электроны из-за более высокого заряда ядра, что приводит к образованию отрицательно заряженных ионов. [ 72 ]
Число соединений, образуемых неметаллами, огромно. [ 73 ] Первые 10 мест в таблице «топ-20» элементов, наиболее часто встречающихся в 895 501 834 соединениях, согласно реестру Chemical Abstracts Service на 2 ноября 2021 года, заняли неметаллы. Водород, углерод, кислород и азот вместе присутствовали в большинстве (80%) соединений. Кремний, металлоид, занял 11-е место. Самым рейтинговым металлом с частотой встречаемости 0,14% оказалось железо, занявшее 12-е место. [ 74 ] Несколько примеров неметаллических соединений: борная кислота ( H
33БО
3 ), используется в керамических глазурях ; [ 75 ] селеноцистеин ( C
3 H
7 НЕТ
2 Se ), 21-я аминокислота жизни; [ 76 ] полуторный сульфид фосфора (P 4 S 3 ), встречающийся в спичках ; [ 77 ] и тефлон ( (C
22F
4 ) н ), используется для создания антипригарных покрытий сковород и другой кухонной посуды. [ 78 ]
Осложнения
[ редактировать ]Химию неметаллов усложняют аномалии, возникающие в первой строке каждого блока таблицы Менделеева ; неравномерные периодические тенденции; высшие степени окисления; образование множественных связей; и свойства совпадают с металлами.
Аномалия первого ряда
[ редактировать ]| Выделение сокращенной таблицы Менделеева первая строка каждого блока: с п д и ж | |||||||||||||
| Период | S-блок | ||||||||||||
| 1 | ЧАС 1 |
Он 2 |
p-блок | ||||||||||
| 2 | Что 3 |
Быть 4 |
Б 5 |
С 6 |
Н 7 |
ТО 8 |
Ф 9 |
Ne 10 | |||||
| 3 | Уже 11 |
мг 12 |
d-блок |
Ал 13 |
И 14 |
П 15 |
С 16 |
кл. 17 |
С 18 | ||||
| 4 | К 19 |
Что 20 |
Sc-Zn 21-30 |
Здесь 31 |
Ге 32 |
Как 33 |
Се 34 |
Бр 35 |
НОК 36 | ||||
| 5 | руб. 37 |
старший 38 |
f-блок |
Y-Cd 39-48 |
В 49 |
Сн 50 |
Сб 51 |
Te 52 |
я 53 |
Машина 54 | |||
| 6 | Cs 55 |
Нет 56 |
Ла-Иб 57-70 |
Лу-Hg 71-80 |
Тл 81 |
Pb 82 |
С 83 |
Po 84 |
В 85 |
Рн 86 | |||
| 7 | Пт 87 |
Солнце 88 |
Ак-Нет 89-102 |
Lr-Cn 103-112 |
Нх 113 |
В 114 |
Мак 115 |
Лев 116 |
Ц 117 |
И 118 | |||
| Группа | (1) | (2) | (3-12) | (13) | (14) | (15) | (16) | (17) | (18) | ||||
| Сила аномалии первого ряда по блокам равна s >> p > d > f . [ 79 ] [ Дж ] | |||||||||||||
Начиная с водорода, аномалия первого ряда обусловлена главным образом электронными конфигурациями рассматриваемых элементов. Водород примечателен своим разнообразным поведением связывания. Чаще всего он образует ковалентные связи, но может также потерять свой единственный электрон в водном растворе , оставив после себя голый протон с огромной поляризующей способностью. [ 80 ] Следовательно, этот протон может присоединяться к неподеленной электронной паре атома кислорода в молекуле воды, закладывая основу кислотно-щелочной химии . [ 81 ] Более того, атом водорода в молекуле может образовывать вторую, хотя и более слабую, связь с атомом или группой атомов другой молекулы. Такое соединение «помогает придать снежинкам шестиугольную симметрию, связывает ДНК в двойную спираль ; формирует трехмерные формы белков ; и даже повышает температуру кипения воды настолько высоко, что можно приготовить приличную чашку чая». [ 82 ]
Водород и гелий, а также бор и неон имеют необычно малые атомные радиусы. Это явление возникает из-за того, что подоболочки 1s и 2p не имеют внутренних аналогов (то есть нет нулевой оболочки и подоболочки 1p), и поэтому они испытывают меньше электрон-электронных обменных взаимодействий , в отличие от подоболочек 3p, 4p и 5p более тяжелых элементов. [ 83 ] [ сомнительно – обсудить ] В результате энергии ионизации и электроотрицательности этих элементов выше, чем можно было бы предположить, исходя из периодических тенденций . Компактные атомные радиусы углерода, азота и кислорода способствуют образованию двойных или тройных связей. [ 84 ]
Хотя обычно по соображениям согласованности электронной конфигурации можно было бы ожидать, что водород и гелий будут размещены поверх элементов s-блока, значительная аномалия первого ряда, показанная этими двумя элементами, оправдывает альтернативное размещение. Водород иногда располагается над фтором в группе 17, а не над литием в группе 1. Гелий почти всегда располагается над неоном в группе 18, а не над бериллием в группе 2. [ 85 ]
Вторичная периодичность
[ редактировать ]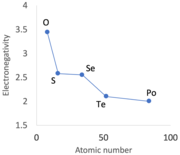
Чередование определенных периодических тенденций, иногда называемое вторичной периодичностью , становится очевидным при нисхождении групп 13–15 и в меньшей степени групп 16 и 17. [ 86 ] [ к ] Сразу после первого ряда металлов d-блока , от скандия до цинка, 3d-электроны в элементах p-блока — в частности, галлии (металле), германии, мышьяке, селене и броме — оказываются менее эффективными для экранирования возрастающего количества металлов. положительный заряд ядра.
Советский химик Щукарев приводит еще два наглядных примера: [ 88 ]
- «Токсичность некоторых соединений мышьяка и отсутствие этого свойства у аналогичных соединений фосфора [P] и сурьмы [Sb] и способность селеновой кислоты [ H 2 SeO 4 ] переводить металлическое золото [Au] в раствор, и отсутствие этого свойства у серных [ H 2 SO 4 ] и [ H 2 TeO 4 ] кислоты».
Высшие степени окисления
[ редактировать ]- Римские цифры, такие как III, V и VIII, обозначают степени окисления.
Некоторые неметаллические элементы проявляют степени окисления , которые отличаются от тех, которые предсказываются правилом октетов, что обычно приводит к степени окисления –3 в группе 15, –2 в группе 16, –1 в группе 17 и 0 в группе 18. Примеры включают в себя аммиак NH 3 , сероводород H 2 S, фторид водорода HF и элементарный ксенон Xe. При этом максимально возможная степень окисления увеличивается с +5 в группе 15 до +8 в группе 18 . Степень окисления +5 наблюдается, начиная со второго периода, в таких соединениях, как азотная кислота HN(V)O 3 и пентафторид фосфора PCl 5 . [ л ] Более высокие степени окисления в более поздних группах возникают, начиная с периода 3, как это видно в гексафториде серы SF 6 , гептафториде йода IF 7 и тетраоксиде ксенона (VIII) XeO 4 . Для более тяжелых неметаллов их больший атомный радиус и более низкие значения электроотрицательности позволяют образовывать соединения с более высокими степенями окисления, поддерживая более высокие объемные координационные числа . [ 89 ]
Образование множественных связей
[ редактировать ]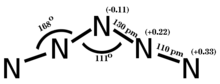
Неметаллы периода 2, особенно углерод, азот и кислород, проявляют склонность к образованию множественных связей. Соединения, образованные этими элементами, часто обладают уникальной стехиометрией и структурой, как это видно на примере различных оксидов азота. [ 89 ] которые обычно не встречаются в элементах более поздних периодов.
Недвижимость перекрывается
[ редактировать ]Хотя некоторые элементы традиционно относят к неметаллам, а другие к металлам, происходит некоторое совпадение свойств. В начале двадцатого века, когда эра современной химии уже утвердилась, [ 91 ] Хамфри [ 92 ] заметил, что:
- ... эти две группы, однако, не отделены друг от друга совершенно резко; некоторые неметаллы по некоторым своим свойствам напоминают металлы, а некоторые металлы в чем-то приближаются к неметаллам.

Примеры металлоподобных свойств, встречающихся в неметаллических элементах, включают:
- Кремний имеет электроотрицательность (1,9), сравнимую с такими металлами, как кобальт (1,88), медь (1,9), никель (1,91) и серебро (1,93); [ 62 ]
- Электропроводность графита превышает электропроводность некоторых металлов; [ н ]
- Селен можно превратить в проволоку; [ 51 ]
- Радон является наиболее металлическим из благородных газов и начинает проявлять некоторое катионное поведение, необычное для неметалла; [ 96 ] и
- В экстремальных условиях чуть более половины неметаллических элементов могут образовывать гомополиатомные катионы. [ о ]
Примерами неметаллоподобных свойств, встречающихся в металлах, являются:
- Вольфрам проявляет некоторые неметаллические свойства, иногда бывает хрупким, имеет высокую электроотрицательность и в водном растворе образует только анионы. [ 98 ] и преимущественно кислотные оксиды. [ 9 ] [ 99 ]
- Золото , «король металлов», имеет самый высокий электродный потенциал среди металлов, что указывает на предпочтение приобретения, а не потери электронов. Энергия ионизации золота — одна из самых высоких среди металлов, а его сродство к электрону и электроотрицательность высоки, причем последняя превышает таковую у некоторых неметаллов. Он образует Au – аурид-анион и проявляет тенденцию к связыванию с самим собой, что является неожиданным для металлов. В ауридах (MAu, где M = Li–Cs) поведение золота аналогично поведению галогена. [ 100 ] Золото имеет достаточно большой ядерный потенциал, поэтому электроны необходимо учитывать с учетом релятивистских эффектов, которые меняют некоторые свойства. [ 101 ]
Относительно недавняя разработка включает в себя определенные соединения более тяжелых элементов p-блока, таких как кремний, фосфор, германий, мышьяк и сурьма, демонстрирующие поведение, обычно связанное с комплексами переходных металлов . Это связано с небольшой энергетической щелью между заполненными и пустыми молекулярными орбиталями — областями молекулы, где находятся электроны и где они могут быть доступны для химических реакций. В таких соединениях это обеспечивает необычную реакционную способность с небольшими молекулами, такими как водород (H 2 ), аммиак (NH 3 ) и этилен (C 2 H 4 ), характеристика, ранее наблюдавшаяся в основном в соединениях переходных металлов. Эти реакции могут открыть новые возможности в каталитических приложениях. [ 102 ]
Типы
[ редактировать ]Схемы классификации неметаллов сильно различаются: некоторые включают всего два подтипа, а другие - до семи. Например, периодическая таблица Британской энциклопедии признает благородные газы, галогены и другие неметаллы, а элементы, обычно считающиеся металлоидами, разделяет на «другие металлы» и «другие неметаллы». [ 103 ] С другой стороны, семь из двенадцати цветовых категорий в периодической таблице Королевского химического общества включают неметаллы. [ 104 ] [ п ]
| Группа (1, 13−18) | Период | ||||||
| 13 | 14 | 15 | 16 | 1 / 17 | 18 | (1−6) | |
| ЧАС | Он | 1 | |||||
| Б | С | Н | ТО | Ф | Ne | 2 | |
| И | П | С | кл. | С | 3 | ||
| Ге | Как | Се | Бр | НОК | 4 | ||
| Сб | Te | я | Машина | 5 | |||
| Рн | 6 | ||||||
Начиная с правой стороны таблицы Менделеева, можно выделить три типа неметаллов:
Элементы четвертого набора иногда признают неметаллами:
Хотя многие из первых исследователей пытались классифицировать элементы, ни одна из их классификаций не была удовлетворительной. Их разделили на металлы и неметаллы, но вскоре было обнаружено, что некоторые из них обладают свойствами того и другого. Их называли металлоидами. Это только усугубило путаницу, образовав два нечетких подразделения там, где одно существовало раньше. [ 125 ]
Уайтфорд и Гроб 1939, Основы студенческой химии
Границы между этими типами не резкие. [ в ] Углерод, фосфор, селен и йод граничат с металлоидами и имеют некоторый металлический характер, как и водород .
Наибольшее разногласие между авторами возникает на металлоидной «пограничной территории». [ 127 ] Некоторые считают, что металлоиды отличаются как от металлов, так и от неметаллов, в то время как другие классифицируют их как неметаллы. [ 4 ] Некоторые относят к металлам определенные металлоиды (например, мышьяк и сурьму из-за их сходства с тяжелыми металлами ). [ 128 ] [ v ] Металлоиды напоминают элементы, которые повсеместно считаются «неметаллами», поскольку имеют относительно низкую плотность, высокую электроотрицательность и схожее химическое поведение. [ 124 ] [ В ]
Благородные газы
[ редактировать ]
Шесть неметаллов относятся к благородным газам: гелий, неон, аргон, криптон, ксенон и радиоактивный радон. В обычных таблицах Менделеева они занимают крайний правый столбец. Их называют благородными газами из-за их исключительно низкой химической активности . [ 105 ]
Эти элементы обладают схожими свойствами, характеризующимися бесцветностью, отсутствием запаха и негорючестью. Благодаря закрытым внешним электронным оболочкам благородные газы обладают слабыми межатомными силами притяжения, что приводит к исключительно низким температурам плавления и кипения. [ 129 ] Как следствие, все они существуют в виде газов при стандартных условиях, даже те, атомная масса которых превосходит многие обычно твердые элементы. [ 130 ]
В химическом отношении благородные газы обладают относительно высокой энергией ионизации, незначительным или отрицательным сродством к электрону и электроотрицательностью от высокой до очень высокой. Число соединений, образуемых благородными газами, исчисляется сотнями и продолжает увеличиваться. [ 131 ] причем большинство этих соединений включают комбинацию кислорода или фтора с криптоном, ксеноном или радоном. [ 132 ]
Галогенные неметаллы
[ редактировать ]Хотя галогенные неметаллы являются особенно активными и коррозионными элементами, их также можно найти в повседневных соединениях, таких как зубная паста ( NaF ); обычная поваренная соль (NaCl); дезинфицирующее средство для бассейнов ( NaBr ); и пищевые добавки ( КИ ). Сам термин «галоген» означает « солеобразователь ». [ 133 ]
В химическом отношении галогенные неметаллы обладают высокими энергиями ионизации, сродством к электрону и значениями электроотрицательности и в основном являются относительно сильными окислителями . [ 134 ] Эти характеристики способствуют их коррозионному характеру. [ 135 ] Все четыре элемента имеют тенденцию образовывать преимущественно ионные соединения с металлами. [ 136 ] в отличие от остальных неметаллов (за исключением кислорода), которые склонны образовывать с металлами преимущественно ковалентные соединения . [ х ] Высокореактивная и сильно электроотрицательная природа галогенных неметаллов воплощает неметаллический характер. [ 140 ]
Неклассифицированные неметаллы
[ редактировать ]

Водород ведет себя в некоторых отношениях как металлический элемент, а в других — как неметалл. [ 142 ] Подобно металлическому элементу, он может, например, образовывать сольватированный катион в водном растворе ; [ 143 ] он может заменять щелочные металлы в таких соединениях, как хлориды ( NaCl ср. HCl ) и нитраты ( KNO 3 ср. HNO 3 ), а также в некоторых комплексах щелочных металлов. [ 144 ] [ 145 ] как неметалл. [ 146 ] Он достигает этой конфигурации за счет образования ковалентной или ионной связи. [ 147 ] или, если он изначально отдал свой электрон, присоединившись к неподеленной паре электронов. [ 148 ]
Некоторые или все эти неметаллы имеют несколько общих свойств. Будучи обычно менее реактивными, чем галогены, [ 149 ] большинство из них могут встречаться в окружающей среде естественным путем. [ 150 ] Они играют важную роль в биологии. [ 151 ] и геохимия . [ 152 ] В совокупности их физические и химические характеристики можно охарактеризовать как «умеренно неметаллические». [ 152 ] Иногда они имеют коррозионный аспект. Углеродная коррозия может возникнуть в топливных элементах . [ 153 ] Необработанный селен в почвах может привести к образованию агрессивного газообразного селеноводорода . [ 154 ] Совсем другое дело: неклассифицированные неметаллы в сочетании с металлами могут образовывать межузельные или тугоплавкие соединения. [ 155 ] из-за их относительно небольшого атомного радиуса и достаточно низкой энергии ионизации. [ 152 ] Они также проявляют тенденцию связываться друг с другом , особенно в твердых соединениях. [ 156 ] Кроме того, диагональные отношения в таблице Менделеева между этими неметаллами отражают аналогичные отношения между металлоидами. [ 157 ]
Обилие, добыча и использование
[ редактировать ]Избыток
[ редактировать ]| Вселенная [ 158 ] | 75% водорода | 23% гелий | 1% кислорода |
| Атмосфера [ 159 ] | 78% азота | 21% кислорода | 0,5% аргона |
| Гидросфера [ 160 ] | 86% кислорода | 11% водорода | 2% хлора |
| Биомасса [ 161 ] | 63% кислорода | 20% углерода | 10% водорода |
| Корочка [ 160 ] | 46% кислорода | 27% кремния | 8% алюминия |
Обилие элементов во Вселенной является результатом процессов ядерной физики, таких как нуклеосинтез и радиоактивный распад .
Летучие неметаллические элементы благородного газа менее распространены в атмосфере, чем ожидалось, исходя из их общего содержания из-за космического нуклеосинтеза . Механизмы, объясняющие эту разницу, являются важным аспектом планетологии . [ 162 ] Даже в рамках этой проблемы неметаллический элемент Xe неожиданно обедняется. Возможное объяснение исходит из теоретических моделей высокого давления в ядре Земли, предполагающих, что их может быть около 10. 13 тонн ксенона в виде стабильных XeFe 3 и XeNi 3 интерметаллидов . [ 163 ]
Пять неметаллов — водород, углерод, азот, кислород и кремний — составляют основную часть непосредственно наблюдаемой структуры Земли: около 73% земной коры , 93% биомассы , 96% гидросферы и более 99% атмосферу , как показано в прилагаемой таблице. Кремний и кислород образуют высокостабильные тетраэдрические структуры, известные как силикаты . Здесь «мощная связь, объединяющая ионы кислорода и кремния, является цементом, скрепляющим земную кору». [ 164 ]
В биомассе относительное содержание первых четырех неметаллов (и в незначительной степени фосфора, серы и селена) объясняется сочетанием относительно небольшого размера атомов и достаточного количества запасных электронов. Эти два свойства позволяют им связываться друг с другом и «некоторыми другими элементами, образуя молекулярный суп, достаточный для построения самовоспроизводящейся системы». [ 165 ]
Добыча
[ редактировать ]Девять из 23 неметаллических элементов являются газами или образуют соединения, которые являются газами и извлекаются из природного газа или жидкого воздуха . К этим элементам относятся водород, гелий, азот, кислород, неон, сера, аргон, криптон и ксенон. Например, азот и кислород извлекаются из воздуха путем фракционной перегонки жидкого воздуха. Этот метод использует их разные точки кипения для их эффективного разделения. [ 166 ] Серу добывали с помощью процесса Фраша , который включал закачку перегретой воды в подземные месторождения для плавления серы, которая затем перекачивалась на поверхность. В этом методе использовалась низкая температура плавления серы по сравнению с другими геологическими материалами. Сейчас его получают путем реакции сероводорода в природном газе с кислородом. Образуется вода, оставляя серу. [ 167 ]
Неметаллические элементы добываются из следующих источников: [ 150 ]
| Группа (1, 13−18) | Период | ||||||
| 13 | 14 | 15 | 16 | 1 / 17 | 18 | (1−6) | |
| ЧАС | Он | 1 | |||||
| Б | С | Н | ТО | Ф | Ne | 2 | |
| И | П | С | кл. | С | 3 | ||
| Ге | Как | Се | Бр | НОК | 4 | ||
| Сб | я | Машина | 5 | ||||
| Рн | 6 | ||||||
Использование
[ редактировать ]Использование неметаллов и неметаллических элементов в общих чертах подразделяется на бытовое, промышленное, смягчающее (смазочное, замедляющее, изолирующее или охлаждающее) и сельскохозяйственное.
Многие из них имеют бытовое и промышленное применение в домашнем хозяйстве; [ 169 ] [ С ] медицина и фармацевтика; [ 171 ] лазеры . и освещение [ 172 ] Они являются компонентами минеральных кислот ; [ 173 ] и распространен в подключаемых гибридных автомобилях; [ 174 ] и смартфоны . [ 175 ]
Значительное количество из них имеет аттенуативное и сельскохозяйственное применение. Они используются в смазочных материалах ; [ 176 ] а также антипирены и огнетушители . [ 177 ] Они могут служить инертными заменителями воздуха; [ 178 ] и используются в криогенике и хладагентах . [ 179 ] Их значение распространяется и на сельское хозяйство благодаря использованию в удобрениях . [ 180 ]
Кроме того, меньшее количество неметаллов или неметаллических элементов находят специализированное применение во взрывчатых веществах ; [ 181 ] и сварочные газы . [ 182 ]
-
Азотная кислота (здесь она окрашена из-за присутствия диоксида азота ) часто используется в промышленности взрывчатых веществ. [ 183 ]
-
Высоковольтный автоматический выключатель, использующий гексафторид серы (SF 6 ) в качестве инертной (замена воздуха) прерывающей среды. [ 184 ]
-
Система COIL ( химический кислородно-йодный лазер ), установленная на варианте Боинга 747, известная как бортовой лазер YAL-1.
-
Баллоны с аргоном для использования при тушении пожара без повреждения серверного компьютерного оборудования.
Таксономическая история
[ редактировать ]Фон
[ редактировать ]
Около 340 г. до н.э. в книге III своего трактата «Метеорология » древнегреческий философ Аристотель разделил вещества, обнаруженные на Земле, на металлы и «ископаемые ископаемые». [ аа ] В последнюю категорию входили различные минералы, такие как реальгар , охра , рудуль , сера, киноварь и другие вещества, которые он называл «камнями, которые нельзя плавить». [ 185 ]
До средневековья классификация минералов оставалась практически неизменной, хотя и с различной терминологией. В четырнадцатом веке английский алхимик Ричард Англикус расширил классификацию минералов в своей работе Correctorium Alchemiae . В этом тексте он предположил существование двух основных типов минералов. В первую категорию, которую он назвал «основными минералами», вошли такие хорошо известные металлы, как золото, серебро, медь, олово, свинец и железо. Вторая категория, обозначенная как «второстепенные минералы», включала такие вещества, как соли, атрамента ( сульфат железа ), квасцы , купорос , мышьяк, аурипигмент , сера и подобные вещества, которые не были металлическими телами. [ 186 ]
Термин «неметаллический» восходит как минимум к 16 веку. В своем медицинском трактате 1566 года французский врач Луа де Л'Оне различал вещества растительного происхождения в зависимости от того, произошли они из металлических или неметаллических почв. [ 187 ]
Позже французский химик Николя Лемери обсуждал металлические и неметаллические минералы в своей работе « Всеобщий трактат о простых лекарствах, расположенных в алфавитном порядке», опубликованной в 1699 году. В своих трудах он размышлял о том, принадлежит ли вещество «кадмий» к первой категории, сродни кобальту ( кобальтит ), или вторая категория, примером которой является то, что тогда было известно как каламин — смешанная руда, содержащая карбонат и силикат цинка . [ 188 ]
Организация элементов по типам
[ редактировать ]Точно так же, как древние отличали металлы от других минералов, аналогичные различия возникли по мере того, как в конце 1700-х годов возникло современное представление о химических элементах. Французский химик Антуан Лавуазье опубликовал первый современный список химических элементов в своем революционном труде. [ 190 ] 1789 Traité élémentaire de chiemie . 33 элемента, известные Лавуазье, были разделены на четыре отдельные группы, включая газы, металлические вещества, неметаллические вещества, образующие кислоты при окислении, [ 191 ] и земли (термостойкие оксиды). [ 192 ] Работа Лавуазье получила широкое признание и была переиздана в двадцати трёх изданиях на шести языках за первые семнадцать лет своего существования, что значительно продвинуло понимание химии в Европе и Америке. [ 193 ]
В 1802 году термин «металлоиды» был введен для элементов, обладающих физическими свойствами металлов, но химическими свойствами неметаллов. [ 194 ] Однако, в 1811 году шведский химик Берцелиус употребил термин «металлоиды». [ 195 ] описать все неметаллические элементы, отметив их способность образовывать отрицательно заряженные ионы с кислородом в водных растворах . [ 196 ] [ 197 ] Таким образом, в 1864 году «Руководство по металлоидам» разделило все элементы на металлы и металлоиды, причем последняя группа включала элементы, которые теперь называются неметаллами. [ 198 ] : 31 Рецензии на книгу показали, что термин «металлоиды» все еще одобрялся ведущими авторитетами. [ 199 ] но были сомнения относительно его целесообразности. Хотя терминология Берцелиуса получила широкое признание, [ 200 ] Позже он подвергся критике со стороны некоторых, кто счел его нелогичным, [ 197 ] неправильное применение, [ 201 ] или даже недействителен. [ 202 ] [ 203 ] идея обозначить такие элементы, как мышьяк , как металлоиды. Рассматривалась [ 199 ] Уже в 1866 году некоторые авторы начали предпочитать термин «неметалл» термину «металлоид» для описания неметаллических элементов. [ 204 ] В 1875 году Кемсхед [ 205 ] заметил, что элементы были разделены на две группы: неметаллы (или металлоиды) и металлы. Он отметил, что термин «неметалл», несмотря на его составной характер, является более точным и стал общепринятым в качестве предпочтительной номенклатуры.
Разработка типов
[ редактировать ]
В 1844 году Альфонс Дюпаскье , французский врач, фармацевт и химик, [ 206 ] установил базовую таксономию неметаллов, чтобы помочь в их изучении. Он написал: [ 207 ]
- Они будут разделены на четыре группы или раздела, как показано ниже:
- Органогены – кислород, азот, водород, углерод.
- Сульфуроиды – сера, селен, фосфор.
- Хлороиды – фтор, хлор, бром, йод.
- Бороиды – бор, кремний.
Квартет Дюпаскье соответствует современным неметаллическим типам. Органогены и сульфуроиды родственны неклассифицированным неметаллам. Хлориды позже были названы галогенами. [ 208 ] Бороиды в конечном итоге превратились в металлоиды, причем эта классификация началась еще в 1864 году. [ 199 ] Неизвестные тогда благородные газы были признаны отдельной группой неметаллов после открытия в конце 1800-х годов. [ 209 ]
Его таксономия отличалась своей естественной основой. [ 210 ] [ аб ] Тем не менее, это было существенным отличием от других современных классификаций, поскольку в ней группировались кислород, азот, водород и углерод. [ 212 ]
В 1828 и 1859 годах французский химик Дюма классифицировал неметаллы как (1) водород; (2) фтор в йод; (3) кислород в серу; (4) азот в мышьяк; и (5) углерод, бор и кремний, [ 213 ] тем самым предвосхищая вертикальные группировки периодической таблицы Менделеева 1871 года. Пять классов Дюма делятся на современные группы 1 , 17 , 16 , 15 и 14 . 13 соответственно.
Предлагаемые критерии различия
[ редактировать ] этого раздела Фактическая точность оспаривается . ( Август 2024 г. ) |
| Год | Свойство и тип | |
|---|---|---|
| 1803 | Общие свойства [ 214 ] | П |
| 1906 | Гидролиз галогенидов [ 215 ] | С |
| 1911 | катионов Образование [ 216 ] [ сомнительно – обсудить ] | С |
| 1927 | Голдхаммер-Херцфельд критерий металлизации [ и ] [ 218 ] |
П |
| 1931 | Электронно- зонная структура [ 219 ] | А |
| 1949 | Массовый координационный номер [ 220 ] | П |
| 1956 | Температурный коэффициент удельного сопротивления [ 221 ] |
С |
| 1956 | Кислотно-основная природа оксидов [ 222 ] | С |
| 1962 | Звонкость [ объявление ] [ 223 ] | П |
| 1969 | Точки плавления и кипения, электропроводность [ 224 ] |
П |
| 1977 | сульфатов Образование [ 59 ] | С |
| 1977 | Растворимость оксидов в кислотах [ 225 ] | С |
| 1986 | Энтальпия испарения [ 226 ] | П |
| 1991 | Жидкостный диапазон [ но ] [ 227 ] | П |
| 1998 | Электропроводность при абсолютном нуле [ 219 ] |
П |
| 1999 | Структура элемента (объемно) [ 228 ] [ сомнительно – обсудить ] | П |
| 2001 | Эффективность упаковки [ 229 ] | П |
| 2020 | Параметр Мотта [ из ] [ 230 ] | А |
| Физический / химический / атомный : P/ C / A | ||
Большая часть ранних анализов была феноменологической, и для отличия металлов от неметаллов (или других тел) было предложено множество физических, химических и атомных свойств; Полный ранний набор характеристик был изложен преподобным Таддеусом Мэйсоном Харрисом в Малой энциклопедии 1803 года . [ 214 ]
- МЕТАЛЛ, в естествознании и химии, название класса простых тел; из которых замечено, что они обладают; блеск; что они непрозрачны; что они плавкие или могут быть расплавлены; что их удельный вес больше, чем у любых других открытых тел; что они являются лучшими проводниками электричества, чем любое другое тело; что они податливы или их можно растянуть и сплющить молотком; и что они пластичны или цепки, то есть их можно вытягивать в нити или проволоку.
Некоторые критерии просуществовали недолго; например, в 1809 году британский химик и изобретатель Хамфри Дэви выделил натрий и калий , [ 231 ] их низкая плотность контрастировала с их металлическим внешним видом, поэтому плотность была незначительна, хотя эти металлы были твердо установлены по их химическим свойствам. [ 232 ]
Джонсон [ 233 ] имеет аналогичный подход Мэйсона, проводя различие между металлами и неметаллами на основе их физического состояния, электропроводности, механических свойств и кислотно-основной природы их оксидов:
- газообразные элементы – неметаллы (водород, азот, кислород, фтор, хлор и благородные газы);
- жидкости (ртуть, бром) бывают металлическими и неметаллическими: ртуть, как хороший проводник, является металлом; бром, обладая плохой проводимостью, является неметаллом;
- Твердые тела бывают либо пластичными и податливыми, твёрдыми и хрупкими, либо мягкими и рассыпчатыми:
- а. пластичные и ковкие элементы – металлы;
- б. к твердым и хрупким элементам относятся бор, кремний и германий, которые являются полупроводниками и, следовательно, не являются металлами; и
- в. к мягким и рассыпчатым элементам относятся углерод, фосфор, сера, мышьяк, сурьма, [ в ] теллур и йод, имеющие кислотные оксиды, указывающие на неметаллический характер. [ ах ]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Несколько авторов [ 238 ] отметили, что неметаллы обычно имеют низкую плотность и высокую электроотрицательность. Прилагаемая таблица с использованием порога 7 г/см. 3 для плотности и 1,9 для электроотрицательности (пересмотренный Полингом), показывает, что все неметаллы имеют низкую плотность и высокую электроотрицательность. Напротив, все металлы имеют либо высокую плотность, либо низкую электроотрицательность (или и то, и другое). Голдуайт и Спилман [ 239 ] добавил, что «... более легкие элементы имеют тенденцию быть более электроотрицательными, чем более тяжелые». Средняя электроотрицательность для элементов таблицы плотностью менее 7 г/см 3 (металлы и неметаллы) составляет 1,97 по сравнению с 1,66 для металлов плотностью более 7 г/см. 3 .
Полного согласия по поводу использования феноменологических свойств нет. Эмсли [ 240 ] указывал на сложность этой задачи, утверждая, что ни одно отдельное свойство само по себе не может однозначно отнести элементы ни к категории металлов, ни к категории неметаллов. Некоторые авторы делят элементы на металлы, металлоиды и неметаллы, но Одерберг [ 241 ] не согласен, утверждая, что в соответствии с принципами категоризации все, что не классифицируется как металл, должно считаться неметаллом.
Книн и коллеги [ 242 ] предположил, что классификацию неметаллов можно осуществить путем установления единого критерия металличности. Они признали, что существуют различные правдоподобные классификации, и подчеркнули, что, хотя эти классификации могут в некоторой степени различаться, в целом они согласны с категоризацией неметаллов. Они описывают электропроводность как ключевое свойство, утверждая, что это наиболее распространенный подход.
Одним из наиболее часто используемых свойств является температурный коэффициент удельного сопротивления , влияние нагрева на электрическое сопротивление и проводимость. С повышением температуры проводимость металлов снижается, а проводимость неметаллов увеличивается. [ 243 ] Однако плутоний , углерод, мышьяк и сурьма, похоже, не соответствуют нормам. При нагревании плутония (металла) в диапазоне температур от –175 до +125 °C его проводимость увеличивается. [ 244 ] Аналогичным образом, несмотря на общепринятую классификацию неметаллического элемента, углерод (как и графит) представляет собой полуметалл, электропроводность которого при нагревании снижается. [ 245 ] Мышьяк и сурьма, которые иногда классифицируются как неметаллические элементы, также являются полуметаллами и ведут себя аналогично углероду. [ 246 ] [ сомнительно – обсудить ]
Сравнение выбранных объектов недвижимости
[ редактировать ]В двух таблицах этого раздела перечислены некоторые свойства пяти типов элементов (благородных газов, галогенных неметаллов, неклассифицированных неметаллов, металлоидов и, для сравнения, металлов) на основе их наиболее стабильных форм при стандартной температуре и давлении. Пунктирные линии вокруг столбцов для металлоидов означают, что рассмотрение этих элементов как отдельного типа может варьироваться в зависимости от автора или используемой схемы классификации.
Физические свойства по типу элемента
[ редактировать ]Физические свойства перечислены в произвольном порядке для удобства их определения.
| Свойство | Тип элемента | ||||
|---|---|---|---|---|---|
| Металлы | Металлоиды | Унк. неметаллы | Галогенные неметаллы | Благородные газы | |
| Общий внешний вид | блестящий [ 20 ] | блестящий [ 247 ] | бесцветный [ 252 ] | ||
| Форма и плотность [ 253 ] | твердый (Ртуть жидкая) |
твердый | твердое или газообразное | твердое или газообразное (бром жидкий) |
газ |
| часто высокой плотности, например, железо, свинец, вольфрам | плотность от низкой до умеренно высокой | низкая плотность | низкая плотность | низкая плотность | |
| некоторые легкие металлы, включая бериллий, магний, алюминий | все легче железа | водород, азот легче воздуха [ 254 ] | гелий, неон легче воздуха [ 255 ] | ||
| Пластичность | в основном податливый и пластичный [ 20 ] | часто хрупкий [ 247 ] | фосфор, сера, селен, хрупкий [ также ] | йод хрупкий [ 259 ] | непригодный |
| Электропроводность | хороший [ и ] |
|
|
|
бедный [ к ] |
| Электронная структура [ 42 ] | металл (бериллий, стронций, α-олово, иттербий, висмут являются полуметаллами) | полуметалл (мышьяк, сурьма) или полупроводник |
|
полупроводник ( I ) или изолятор | изолятор |
Химические свойства по типу элемента
[ редактировать ]Химические свойства перечислены от общих характеристик до более конкретных деталей.
| Свойство | Тип элемента | ||||
|---|---|---|---|---|---|
| Металлы | Металлоиды | Унк. неметаллы | Галогенные неметаллы | Благородные газы | |
| Общее химическое поведение |
|
слабо неметаллический [ ап ] | умеренно неметаллический [ 265 ] | сильно неметаллический [ 266 ] | |
| Оксиды | базовый; некоторые амфотерные или кислотные [ 9 ] | амфотерный или слабокислый [ 269 ] [ ] так | кислый [ с ] или нейтральный [ как ] | кислый [ в ] | метастабильный XeO 3 является кислым; [ 276 ] стабильный XeO 4 сильно так [ 277 ] |
| несколько стеклоформующих [ В ] | все стеклоформы [ 279 ] | некоторые стеклоформы [ из ] | не сообщалось о стеклоформующих устройствах | не сообщалось о стеклоформующих устройствах | |
| ионные, полимерные, слоистые, цепные и молекулярные структуры [ 281 ] | полимерный по структуре [ 282 ] |
|
|||
| Соединения с металлами | сплавы [ 20 ] или интерметаллические соединения [ 285 ] | имеют тенденцию образовывать сплавы или интерметаллические соединения. [ 286 ] | преимущественно ионный [ 136 ] | простые соединения при СТП не известны [ оу ] | |
| Энергия ионизации (кДж моль −1 ) [ 61 ] ‡ | от низкого к высокому | умеренный | от умеренного до высокого | высокий | от высокого до очень высокого |
| с 376 до 1007 | с 762 по 947 | с 941 до 1402 | от 1008 до 1681 | от 1037 до 2372 | |
| средний 643 | средний 833 | в среднем 1152 | в среднем 1270 | в среднем 1589 | |
| Электроотрицательность (Полинг) [ топор ] [ 62 ] ‡ | от низкого к высокому | умеренный | от умеренного до высокого | высокий | от высокого (радон) до очень высокого |
| от 0,7 до 2,54 | от 1,9 до 2,18 | 2,19–3,44 | от 2,66 до 3,98 | ок. 2,43–4,7 | |
| средний 1,5 | средний 2,05 | средний 2,65 | средний 3,19 | средний 3,3 | |
† Водород также может образовывать сплавоподобные гидриды. [ 145 ]
‡ Ярлыки «низкий» , «средний» , «высокий » и «очень высокий» произвольно основаны на диапазонах значений, перечисленных в таблице.
См. также
[ редактировать ]- ХОН (углерод, водород, кислород, азот)
- Список монографий по неметаллам
- Давление металлизации
- Неметалл (астрофизика)
- Элементы первого периода (водород, гелий)
- Свойства неметаллов (и металлоидов) по группам
Примечания
[ редактировать ]- ^ Эти шесть элементов (бор, кремний, германий, мышьяк, сурьма и теллур) являются элементами, обычно называемыми «металлоидами». [ 3 ] категория иногда считается подкатегорией неметаллов, а иногда как категория, отдельная как от металлов, так и от неметаллов. [ 4 ]
- ^ Наиболее стабильными формами являются: двухатомный водород H 2 ; β-ромбоэдрический бор ; графит для углерода ; двухатомный азот N 2 ; двухатомный кислород O 2 ; тетраэдрический кремний ; черный фосфор ; орторомбическая сера S 8 ; α-германий ; серый мышьяк ; серый селен ; серая сурьма ; серый теллур ; и двухатомный йод I 2 . Все остальные неметаллические элементы имеют только одну стабильную форму при СТП . [ 6 ]
- ^ При более высоких температурах и давлениях количество неметаллов может быть поставлено под сомнение. Например, когда германий плавится, он превращается из полупроводникового металлоида в металлический проводник с электропроводностью, аналогичной электропроводности жидкой ртути. [ 13 ] При достаточно высоком давлении натрий (металл) становится непроводящим изолятором . [ 14 ]
- ^ Поглощенный свет может быть преобразован в тепло или переизлучен во всех направлениях, так что спектр излучения в тысячи раз слабее, чем падающее световое излучение. [ 17 ]
- ^ Твердый йод имеет серебристый металлический вид под белым светом при комнатной температуре. При обычных и более высоких температурах он сублимирует из твердой фазы непосредственно в пар фиолетового цвета. [ 18 ]
- ^ Твердые неметаллы имеют значения электропроводности от 10. −18 S•cm −1 для серы [ 22 ] до 3 × 10 4 в графите [ 23 ] или 3,9 × 10 4 для мышьяка ; [ 24 ] ср. 0,69 × 10 4 по марганцу до 63×10 4 для серебра оба металла. [ 22 ] Проводимость графита (неметалла) и мышьяка (металлоидного неметалла) превышает проводимость марганца. Такое совпадение показывает, что может быть трудно провести четкую грань между металлами и неметаллами.
- ^ Значения теплопроводности металлов варьируются от 6,3 Вт·м. −1 К −1 для нептуния до 429 для серебра ; ср. сурьма 24,3, мышьяк 50 и углерод 2000. [ 22 ] Значения электропроводности металлов колеблются в пределах 0,69 См•см. −1 × 10 4 по марганцу до 63×10 4 за серебро ; ср. углерод 3 × 10 4 , [ 23 ] мышьяк 3,9×10 4 и сурьма 2,3×10 4 . [ 22 ]
- ^ Хотя CO и NO обычно называют нейтральными, CO представляет собой слегка кислый оксид, реагирующий с основаниями с образованием формиатов (CO + OH). − → ОХОО − ); [ 65 ] а в воде NO реагирует с кислородом с образованием азотистой кислоты HNO 2 (4NO + O 2 + 2H 2 O → 4HNO 2 ). [ 66 ]
- ^ Значения электроотрицательности фтора к йоду составляют: 3,98 + 3,16 + 2,96 + 2,66 = 12,76/4 3,19.
- ^ Гелий показан над бериллием для обеспечения согласованности электронной конфигурации; как благородный газ его обычно помещают выше неона, в 18-й группе.
- ^ Конечным результатом является четно-нечетная разница между периодами (кроме s-блока ): элементы в четных периодах имеют меньшие атомные радиусы и предпочитают терять меньше электронов, тогда как элементы в нечетных периодах (кроме первого) отличаются обратным направление. Тогда многие свойства в p-блоке демонстрируют зигзагообразную, а не плавную тенденцию вдоль группы. Например, фосфор и сурьма в нечетные периоды 15-й группы легко достигают степени окисления +5, тогда как азот, мышьяк и висмут в четные периоды предпочитают оставаться при +3. [ 87 ]
- ^ Состояния окисления, которые обозначают гипотетические заряды для концептуализации распределения электронов при химической связи, не обязательно отражают суммарный заряд молекул или ионов. Эту концепцию иллюстрируют такие анионы, как NO 3 − , где считается, что атом азота имеет степень окисления +5 из-за распределения электронов. Однако чистый заряд иона остается -1. Такие наблюдения подчеркивают роль состояний окисления в описании потери или приобретения электронов в контексте связей, в отличие от указания фактического электрического заряда, особенно в ковалентно связанных молекулах.
- ^ Гринвуд [ 93 ] прокомментировал, что: «Степень, в которой металлические элементы имитируют бор (имея меньше электронов, чем орбиталей, доступных для связи), была плодотворной последовательной концепцией в развитии химии металлоборанов ... Действительно, металлы назывались «почетными атомами бора». «или даже как «атомы флексибора». Очевидно, что обратное соотношение также справедливо».
- ^ Например, проводимость графита составляет 3 × 10 4 S•cm −1. [ 94 ] тогда как у марганца 6,9 × 10 3 S•cm −1 . [ 95 ]
- ^ Гомополиатомный катион состоит из двух или более атомов одного и того же элемента, связанных между собой и несущих положительный заряд, например, N 5 + , О 2 + и Cl 4 + . Это необычное поведение для неметаллов, поскольку образование катионов обычно связано с металлами, а неметаллы обычно связаны с образованием анионов. Гомополиатомные катионы также известны для углерода, фосфора, сурьмы, серы, селена, теллура, брома, йода и ксенона. [ 97 ]
- ^ Из двенадцати категорий в таблице Менделеева Королевского общества пять отображаются только с металлическим фильтром, три - только с неметаллическим фильтром и четыре - с обоими фильтрами. Интересно, что шесть элементов, отмеченных как металлоиды (бор, кремний, германий, мышьяк, сурьма и теллур), видны под обоими фильтрами. Шесть других элементов (113–118: нихоний, флеровий, московий, ливерморий, теннессин и оганессон), статус которых неизвестен, также отображаются под обоими фильтрами, но не включены ни в одну из двенадцати цветовых категорий.
- ^ Кавычки в источнике не встречаются; они используются здесь, чтобы прояснить, что в источнике слово « неметаллы» используется как формальный термин для рассматриваемого подмножества химических элементов, а не применяется к неметаллам в целом.
- ^ Различные конфигурации этих неметаллов называются, например, основными неметаллами. [ 107 ] биоэлементы, [ 108 ] центральные неметаллы, [ 109 ] ЧНОПС, [ 110 ] основные элементы, [ 111 ] «неметаллы», [ 112 ] [ q ] бесхозные неметаллы, [ 113 ] или окислительно-восстановительные неметаллы. [ 114 ]
- ^ Мышьяк стабилен в сухом воздухе. Длительное пребывание во влажном воздухе приводит к образованию черного налета на поверхности. «Мышьяк плохо подвергается воздействию воды, щелочных растворов или неокисляющих кислот». [ 119 ] Иногда его можно встретить в природе в несвязанном виде. [ 120 ] Он имеет положительный стандартный потенциал восстановления (As → As 3+ +3e = +0,30 В), соответствующий классификации полублагородного металла. [ 121 ]
- ^ «Кристаллический бор относительно инертен». [ 115 ] Кремний «как правило, крайне инертен». [ 116 ] «Германий — относительно инертный полуметалл». [ 117 ] «Чистый мышьяк также относительно инертен». [ 118 ] [ с ] «Металлическая сурьма… инертна при комнатной температуре». [ 122 ] «По сравнению с S и Se , Te имеет относительно низкую химическую активность». [ 123 ]
- ^ В классификационных схемах часто встречаются нечеткость границ и перекрытия. [ 126 ]
- ^ Джонс придерживается философского или прагматического взгляда на эти вопросы. Он пишет: «Хотя классификация является неотъемлемой чертой всех отраслей науки, на границах всегда есть трудные случаи. Граница класса редко бывает резкой ... Ученым не следует терять сон из-за трудных случаев. Система классификации полезна для экономии описания, структурирования знаний и нашего понимания, а сложные случаи составляют небольшое меньшинство, тогда сохраните ее, если система станет менее полезной, откажитесь от нее и замените ее системой, основанной на других общих чертах. характеристики». [ 126 ]
- ^ Соответствующее сравнение свойств металлов, металлоидов и неметаллов см. в Rudakiya & Patel (2021), p. 36.
- ^ Оксиды металлов обычно являются несколько ионными, в зависимости от электроположительности элемента металла. [ 137 ] С другой стороны, оксиды металлов с высокими степенями окисления часто бывают либо полимерными, либо ковалентными. [ 138 ] Полимерный оксид имеет связанную структуру, состоящую из множества повторяющихся звеньев. [ 139 ]
- ^ В исключительных случаях исследование, проведенное в 2012 году, отметило наличие 0,04% природного фтора ( F
2 ) по весу в антозоните , приписывая эти включения излучению крошечных количеств урана. [ 168 ] - ^ Радон иногда встречается как потенциально опасный загрязнитель помещений. [ 170 ]
- ^ Термин «ископаемое» не следует путать с современным использованием ископаемого для обозначения сохранившихся останков, отпечатков или следов любого некогда живого существа.
- ^ Естественная классификация была основана на «всех признаках классифицируемых веществ, в отличие от« искусственных классификаций », основанных на одном единственном признаке», например, на сродстве металлов к кислороду. «Естественная классификация в химии учитывала бы самые многочисленные и наиболее существенные аналогии». [ 211 ]
- ^ Соотношение Голдхаммера-Герцфельда примерно равно кубу атомного радиуса, разделенному на молярный объем . [ 217 ] Более конкретно, это соотношение силы, удерживающей внешние электроны отдельного атома на месте, с силами, действующими на тех же электронах, возникающими в результате взаимодействия между атомами твердого или жидкого элемента. Когда межатомные силы больше или равны атомной силе, указывается внешняя межатомная сила и прогнозируется металлическое поведение. В противном случае ожидается неметаллическое поведение.
- ^ Звонкость – это издание звонкого звука при ударе.
- ^ Диапазон жидкости — это разница между температурой плавления и температурой кипения.
- ^ Параметр Мотта равен N 1/3 ɑ* H , где N — число атомов в единице объёма, а ɑ* H «— их эффективный размер, обычно принимаемый как эффективный боровский радиус максимума в распределении вероятностей самых внешних (валентных) электронов». В условиях окружающей среды значение разделительной линии между металлами и неметаллами составляет 0,45.
- ^ Хотя триоксид сурьмы обычно считается амфотерным, его свойства очень слабой кислоты преобладают над свойствами очень слабого основания. [ 234 ]
- ^ Джонсон считал бор неметаллом, а кремний, германий, мышьяк, сурьму, теллур, полоний и астат «полуметаллами», то есть металлоидами.
- ^ (а) В таблицу включены элементы до эйнштейния (99), за исключением астата (85) и франция (87), с плотностью и большей частью электроотрицательности по Эйлуорду и Финдли; [ 235 ] Электроотрицательность благородных газов по Раму, Зенгу и Гофману. [ 236 ]
(b) Обзор определений термина «тяжелый металл» показал критерии плотности в диапазоне от более 3,5 г/см. 3 выше 7 г/см 3 ; [ 237 ]
(c) Вернон указал минимальную электроотрицательность 1,9 для металлоидов по пересмотренной шкале Полинга; [ 3 ] - ^ Все четыре имеют менее стабильные нехрупкие формы: углерод в виде расслоенного (вспученного) графита , [ 256 ] [ 257 ] и в виде из углеродных нанотрубок ; проволоки [ 258 ] фосфор в виде белого фосфора (мягкий, как воск, податливый, его можно резать ножом при комнатной температуре); [ 49 ] сера в виде пластиковой серы; [ 50 ] и селен в виде селеновых проволок. [ 51 ]
- ^ Металлы имеют значения электропроводности от 6,9 × 10. 3 S•cm −1 по марганцу до 6,3 × 10 5 за серебро . [ 260 ]
- ^ Металлоиды имеют значения электропроводности от 1,5 × 10. −6 S•cm −1 для бора до 3,9 × 10 4 для мышьяка . [ 261 ]
- ^ Неклассифицированные неметаллы имеют значения электропроводности от ок. 1 × 10 −18 S•cm −1 для элементарных газов до 3 × 10 4 в графите. [ 94 ]
- ^ Галогенные неметаллы имеют значения электропроводности от ок. 1 × 10 −18 S•cm −1 для F и Cl до 1,7 × 10 −8 S•cm −1 для йода. [ 94 ] [ 262 ]
- ^ Элементарные газы имеют значения электропроводности ок. 1 × 10 −18 S•cm −1 . [ 94 ]
- ^ Металлоиды всегда дают «соединения менее кислого характера, чем соответствующие соединения [типичных] неметаллов». [ 247 ]
- ^ Триоксид мышьяка реагирует с триоксидом серы, образуя «сульфат» мышьяка As 2 (SO 4 ) 3 . [ 270 ] Это вещество является ковалентным по своей природе, а не ионным; [ 271 ] его также называют As 2 O 3 ·3SO 3 . [ 272 ]
- ^ НЕТ
2 , Н
22О
5 , ТАК
3 , СеО
3 сильно кислые. [ 273 ] - ^ H 2 O, CO, NO, N 2 O — нейтральные оксиды; CO и N 2 O «формально представляют собой ангидриды муравьиной O → и азотистой кислоты соответственно, а именно: CO + H 2 O → H 2 CO 2 (HCOOH, муравьиная кислота); N 2 O + H 2 H 2 N 2 O 2 (гипонитистая кислота)». [ 274 ]
- ^ ClO
2 , кл.
22О
7 , я
22О
5 сильно кислые. [ 275 ] - ^ Металлы, образующие стекла: ванадий; молибден, вольфрам; алюминий, индий, таллий; олово, свинец; и висмут. [ 278 ]
- ^ Неклассифицированные неметаллы, образующие стекла, — это фосфор, сера, селен; [ 278 ] CO 2 образует стекло при давлении 40 ГПа. [ 280 ]
- ^ Динатрийгелид (Na 2 He) представляет собой соединение гелия и натрия, стабильное при высоких давлениях выше 113 ГПа. Аргон образует сплав с никелем при давлении 140 ГПа и температуре около 1500 К, однако при этом давлении аргон больше не является благородным газом. [ 288 ]
- ^ Значения для благородных газов взяты из данных Рама, Зенга и Хоффмана. [ 236 ]
Ссылки
[ редактировать ]Цитаты
[ редактировать ]- ^ Перейти обратно: а б с Ларраньяга, Льюис и Льюис, 2016, с. 988
- ^ Перейти обратно: а б Штойдель 2020, с. 43 : Монография Штойделя представляет собой обновленный перевод пятого немецкого издания 2013 года, включающий литературу до весны 2019 года.
- ^ Перейти обратно: а б с д и Вернон 2013 г.
- ^ Перейти обратно: а б Гудрич 1844, с. 264 ; Химические новости 1897, с. 189 ; Хэмпель и Хоули, 1976, стр. 174, 191 ; Льюис 1993, с. 835 ; Герольд 2006, стр. 149–50.
- ^ В: Рестрепо и др. 2006, с. 411 ; Торнтон и Бердетт, 2010, с. 86 ; Герман, Хоффманн и Эшкрофт 2013, стр. 11604‒1‒11604‒5 ; Сп: Мьюс и др. 2019 ; Флорида: Флорес и др. 2022 ; Например: Смитс и др. 2020 год
- ^ Висмер 1997, с. 72 : H, He, C, N, O, F, Ne, S, Cl, Ar, As, Se, Br, Kr, Sb, I, Xe; Пауэлл 1974, стр. 174, 182 : P, Te; Гринвуд и Эрншоу 2002, с. 143 : Б; Поле 1979, с. 403 : Си, Ге; Аддисон 1964, с. 120 : Рн
- ^ Паско 1982, с. 3 [ сломанный якорь ]
- ^ Мэлоун и Долтер, 2010, стр. 110–111.
- ^ Перейти обратно: а б с Портерфилд 1993, с. 336
- ^ Godovikov & Nenasheva 2020, p. 4 ; Morely & Muir 1892, p. 241
- ^ Перейти обратно: а б Вернон 2020, с. 220 ; Рохов 1966, с. 4
- ^ Периодическая таблица элементов ИЮПАК
- ^ Бергер 1997, стр. 71–72.
- ^ Гатти, Токатлы и Рубио, 2010 г.
- ^ Вибо 1951, с. 33 : «Многие вещества... бесцветны и поэтому не проявляют избирательного поглощения в видимой части спектра».
- ^ Эллиот 1929, с. 629
- ^ Фокс 2010, с. 31
- ^ Тиди 1887, стр. 107–108 ; Кениг 1962, с. 108
- ^ Виберг 2001, с. 416 ; Здесь Виберг имеет в виду йод.
- ^ Перейти обратно: а б с д и ж Книн, Роджерс и Симпсон, 1972, стр. 261–264.
- ^ Перейти обратно: а б Джонсон 1966, с. 4
- ^ Перейти обратно: а б с д и Эйлуорд и Финдли, 2008 г., стр. 6–12.
- ^ Перейти обратно: а б Дженкинс и Кавамура 1976, с. 88
- ^ Карапелла 1968, с. 30
- ^ Zumdahl & DeCoste 2010, стр. 455, 456, 469, A40 ; Эрл и Уилфорд 2021, с. 3-24
- ^ Корб, БВ; Вэй, В.Д.; Авербах, Б.Л. (1982). «Атомные модели аморфного селена» . Журнал некристаллических твердых тел . 53 (1–2): 29–42. дои : 10.1016/0022-3093(82)90016-3 .
- ^ Виберг 2001, стр. 780.
- ^ Виберг 2001, стр. 824, 785.
- ^ Эрл и Уилфорд 2021, с. 3-24
- ^ Секиерски и Берджесс 2002, стр. 86.
- ^ Шарлье, Гонз и Мишено, 1994 г.
- ^ Танигучи и др. 1984, с. 867 : «...черный фосфор... [характеризуется] широкими валентными зонами довольно делокализованного характера»; Кармальт и Норман 1998, с. 7 : «Следует ожидать, что фосфор... будет обладать некоторыми металлоидными свойствами».; Ду и др. 2010 : Считается, что межслоевые взаимодействия в черном фосфоре, которые объясняются силами Ван дер Ваальса-Кисома, способствуют меньшей запрещенной зоне объемного материала (рассчитано 0,19 эВ; наблюдаемо 0,3 эВ) в отличие от большей запрещенной зоны у однослойный (расчет ~0,75 эВ).
- ^ Виберг 2001, стр. 742.
- ^ Эванс 1966, стр. 124–25.
- ^ Виберг 2001, стр. 758.
- ^ Стьюк 1974, с. 178 ; Донохью 1982, стр. 386–87 ; Коттон и др. 1999, с. 501
- ^ Штойдель 2020, с. 601 : "...Можно ожидать значительного перекрытия орбиталей. По-видимому, в кристаллическом йоде существуют межмолекулярные многоцентровые связи, которые распространяются по всему слою и приводят к делокализации электронов, подобной таковой в металлах. Этим объясняются некоторые физические свойства йода: темная цвет, блеск и слабая электропроводность, которая внутри слоев в 3400 раз сильнее, чем перпендикулярно им. Таким образом, кристаллический йод является двумерным полупроводником.»; Сигал 1989, с. 481 : «Йод проявляет некоторые металлические свойства…»
- ^ Тейлор 1960, с. 207 ; Брандт 1919, с. 34
- ^ Перейти обратно: а б Грин 2012, с. 14
- ^ Спенсер, Боднер и Рикард 2012, стр. 178
- ^ Redmer, Hensel & Holst 2010, предисловие
- ^ Перейти обратно: а б Килер и Уотерс 2013, с. 293
- ^ ДеКок и Грей 1989, стр. 423, 426–427.
- ^ Боресков 2003, с. 45
- ^ Перейти обратно: а б Эшкрофт и Мермин
- ^ Ян 2004, с. 9
- ^ Виберг 2001, стр. 416, 574, 681, 824, 895, 930 ; Секерский и Берджесс 2002, стр. 129.
- ^ Вертман, Йоханнес; Вертман, Джулия Р. (1992). Элементарная теория дислокаций . Нью-Йорк: Издательство Оксфордского университета. ISBN 978-0-19-506900-6 .
- ^ Перейти обратно: а б Фарадей 1853, с. 42 ; Холдернесс и Берри 1979, с. 255
- ^ Перейти обратно: а б Партингтон 1944, с. 405
- ^ Перейти обратно: а б с Реньо 1853, с. 208
- ^ Шарф, ТВ; Прасад, С.В. (январь 2013 г.). «Твердые смазочные материалы: обзор» . Журнал материаловедения . 48 (2): 511–531. Бибкод : 2013JMatS..48..511S . дои : 10.1007/s10853-012-7038-2 . ISSN 0022-2461 .
- ^ Бартон 2021, с. 200
- ^ Виберг 2001, с. 796
- ^ Шан и др. 2021 год
- ^ Тан и др. 2021 год
- ^ Штойдель, 2020, проходящее ; Карраско и др. 2023 ; Шанабрук, Ланнин и Хисацунэ 1981, стр. 130–133.
- ^ Веллер и др. 2018, предисловие
- ^ Перейти обратно: а б Эбботт 1966, с. 18
- ^ Гангули 2012, с. 1-1
- ^ Перейти обратно: а б Эйлуорд и Финдли 2008, с. 132
- ^ Перейти обратно: а б с Эйлуорд и Финдли 2008, с. 126
- ^ Иглсон 1994, 1169.
- ^ Муди 1991, с. 365
- ^ Дом 2013, с. 427
- ^ Льюис и Дин 1994, с. 568
- ^ Смит 1990, стр. 177–189.
- ^ Йодер, Суйдам и Снавли 1975, стр. 58
- ^ Янг и др. 2018, с. 753
- ^ Браун и др. 2014, с. 227
- ^ Секиерски и Берджесс 2002, стр. 21, 133, 177
- ^ Мур 2016 ; Берфорд, Пассмор и Сандерс 1989, с. 54
- ^ Брэди и Сенезе 2009, с. 69
- ^ Служба химических рефератов, 2021 г.
- ^ Эмсли 2011, стр. 81.
- ^ Кокелл 2019, с. 210
- ^ Скотт 2014, с. 3
- ^ Эмсли 2011, с. 184
- ^ Дженсен 1986, с. 506
- ^ Ли 1996, с. 240
- ^ Гринвуд и Эрншоу 2002, с. 43
- ^ Кресси 2010
- ^ Секиерски и Берджесс 2002, стр. 24–25
- ^ Секиерски и Берджесс 2002, стр. 23.
- ^ Петрушевский и Цветкович 2018 ; Грочал 2018
- ^ Книн, Роджерс и Симпсон 1972, с. 226, 360 ; Секерский и Берджесс 2002, с. 52, 101, 111, 124,
- ^ Шерри 2020, стр. 407–420
- ^ Shchukarev 1977, p. 229
- ^ Перейти обратно: а б Кокс 2004, с. 146
- ^ Видж и др. 2001 г.
- ^ Дорси 2023, стр. 12–13.
- ^ Хамфри 1908 г.
- ^ Гринвуд 2001, с. 2057
- ^ Перейти обратно: а б с д Bogoroditskii & Pasynkov 1967, p. 77 ; Jenkins & Kawamura 1976, p. 88
- ^ Десаи, Джеймс и Хо 1984, стр. 1160
- ^ Штейн 1983, с. 165
- ^ Энгессер и Кроссинг 2013, стр. 947.
- ^ Швейцер и Пестерфилд 2010, с. 305
- ^ Рик 1967, с. 97 : Триоксид вольфрама растворяется в плавиковой кислоте с образованием оксифторидного комплекса .
- ^ Виберг 2001, с. 1279
- ^ Пайпер, Северная Каролина (18 сентября 2020 г.). «Относительность и таблица Менделеева» . Философские труды Королевского общества A: Математические, физические и технические науки . 378 (2180): 20190305. Бибкод : 2020RSPTA.37890305P . дои : 10.1098/rsta.2019.0305 . ISSN 1364-503X . ПМИД 32811360 .
- ^ Мощность 2010 ; Ворона 2013 [ сломанный якорь ] ; Ветман и Иноуэ 2018
- ^ Британская энциклопедия 2021 г.
- ^ Королевское химическое общество 2021 г.
- ^ Перейти обратно: а б Мэтсон и Орбек 2013, с. 203
- ^ Кернион и Маскетта 2019, с. 191 ; Цао и др. 2021, стр. 20–21 ; Хусейн и др. 2023 ; также называемые «неметаллическими галогенами»: Chambers & Holliday 1982, стр. 273–274 ; Больманн 1992, с. 213 ; Йентч и Матиле, 2015, с. 247 или «стабильные галогены»: Василакис, Калемос и Мавридис 2014, стр. 1 ; Хэнли и Кога, 2018, с. 24 ; Кайхо 2017, гл. 2, с. 1
- ^ Уильямс 2007, стр. 1550–1561: H , C , N , P , O , S
- ^ Waechtershäuser 2014, с. 5: Ч , С , Н , П , О , С , Се
- ^ Хенгевелд и Федонкин 2007, стр. 181–226: С , Н , П , О , С
- ^ Уэйкман 1899, с. 562
- ^ Фрапс 1913, с. 11: H , C , Si , N , P , O , S , Cl
- ^ Парамесваран и др. 2020, с. 210: Ч , С , Н , П , О , С , Се
- ^ Найт 2002, с. 148: Ч , Ц , Н , П , О , С , Се
- ^ Фраусто да Силва и Уильямс 2001, с. 500: Ч , С , Н , О , С , Се
- ^ Zhu et al. 2022
- ^ Могилы 2022 г.
- ^ Розенберг 2013, с. 847
- ^ Obodovskiy 2015, p. 151
- ^ Гринвуд и Эрншоу 2002, с. 552
- ^ Иглсон 1994, с. 91
- ^ Хуан 2018, стр. 30, 32.
- ^ Орисакве 2012, с. 000
- ^ Инь и др. 2018, с. 2
- ^ Перейти обратно: а б Мёллер и др. 1989, с. 742
- ^ Уайтфорд и Гроб 1939, с. 239
- ^ Перейти обратно: а б Джонс 2010, стр. 169–71.
- ^ Рассел и Ли 2005, с. 419
- ^ Тайлер 1948, с. 105 ; Рейли 2002, стр. 5–6.
- ^ Веселый 1966, с. 20
- ^ Клагстон и Флемминг 2000, стр. 100–101, 104–105, 302.
- ^ Маошэн 2020, стр. 962.
- ^ Май 2020 г.
- ^ Виберг 2001, с. 402
- ^ Рудольф 1973, с. 133 : «Кислород и особенно галогены ... поэтому являются сильными окислителями».
- ^ Дэниел и Рэпп 1976, с. 55
- ^ Перейти обратно: а б Коттон и др. 1999, с. 554
- ^ Вудворд и др. 1999, стр. 133–194.
- ^ Филлипс и Уильямс 1965, стр. 478–479.
- ^ Мёллер и др. 1989, с. 314
- ^ Лэнфорд 1959, с. 176
- ^ Эмсли 2011, с. 478
- ^ Seese & Daub 1985, стр. 65
- ^ Маккей, Маккей и Хендерсон 2002, стр. 209, 211.
- ^ Казинс, Дэвидсон и Гарсиа-Вива 2013, стр. 11809–11811
- ^ Перейти обратно: а б Цао и др. 2021, с. 4
- ^ Липтрот 1983, с. 161 ; Мэлоун и Долтер 2008, с. 255
- ^ Виберг 2001, стр. 255–257.
- ^ Скотт и Канда 1962, с. 153
- ^ Тейлор 1960, с. 316
- ^ Перейти обратно: а б Эмсли, 2011 г., проходной
- ^ Кроуфорд 1968, с. 540 ; Беннер, Рикардо и Кэрриган, 2018, стр. 167–168 : «Стабильность связи углерод-углерод … сделала его элементом первого выбора для создания каркаса биомолекул. Водород необходим по многим причинам; по крайней мере, он разрывает Цепочки CC (атомы, не являющиеся ни углеродом, ни водородом) определяют реакционную способность биомолекул, содержащих углерод. В жизни это кислород, азот и, в меньшей степени — сера, фосфор, селен и иногда галоген».
- ^ Перейти обратно: а б с Цао и др. 2021, с. 20
- ^ Чжао, Ту и Чан, 2021 г.
- ^ Васевар 2021, стр. 322–323.
- ^ Месслер 2011, с. 10
- ^ Кинг 1994, с. 1344 ; Пауэлл и Тимс 1974, стр. 189–191 ; Цао и др. 2021, стр. 20–21.
- ^ Вернон 2020, стр. 221–223 ; Рейнер-Кэнхем 2020, с. 216
- ^ Рентгеновский центр Чандра, 2018 г.
- ^ Чапин, Мэтсон и Витоусек 2011, с. 27
- ^ Перейти обратно: а б Фортескью 1980, с. 56
- ^ Георгиевский 1982, с. 58
- ^ Пепин, Р.О.; Порчелли, Д. (1 января 2002 г.). «Происхождение благородных газов на планетах земной группы» . Обзоры по минералогии и геохимии . 47 (1): 191–246. Бибкод : 2002RvMG...47..191P . дои : 10.2138/rmg.2002.47.7 . ISSN 1529-6466 .
- ^ Чжу и др. 2014, стр. 644–648.
- ^ Кляйн и Датроу 2007, с. 435 [ сломанный якорь ]
- ^ Кокелл 2019, с. 212, 208–211
- ^ Эмсли 2011, стр. 363, 379.
- ^ Эмсли 2011, с. 516
- ^ Шмедт, Мангстл и Краус 2012, с. 7847‒7849
- ^ Эмсли 2011, стр. 39, 44, 80–81, 85, 199, 248, 263, 367, 478, 531, 610 ; Смолдерс, 2011 г., стр. 416–421 ; Чен 1990, часть 17.2.1 ; Зал 2021, с. 143 : H (основной компонент воды); Он (партия воздушных шаров); Б (в моющих средствах ); С ( карандашами , как графит); N ( пивные виджеты ); O (в виде пероксида в моющих средствах ); F (в виде фторида в зубной пасте ); Нэ (освещение); Си (в стеклянной посуде); П ( спички ); S (садовые процедуры); Cl ( компонент отбеливателя ); Ар ( утепленные окна ); Ge (в широкоугольных объективах фотоаппаратов ); Se ( стекло ; солнечные элементы ); Br (в виде бромида для очистки курортной воды); Кр (энергосберегающие люминесцентные лампы ); Сб (в батареях); Те (в керамике , солнечных батареях, перезаписываемых DVD ); I (в антисептических растворах); Xe (в ячейках плазменных телевизоров , технология, которая впоследствии стала ненужной из-за недорогих светодиодных и OLED-дисплеев .
- ^ Марони 1995, стр. 108–123
- ^ Imbertierti 2020 : H, He, B, C, N, O, F, Si, P, S, Cl, Ar, As, Se, Br, Kr, Sb, Te, I, Xe и Rn
- ^ Чеселе 2016 ; Винстел 2000 ; Дэвис и др. 2006, с. 431–432 ; Грондзик и др. 2010, с. 561 : Cl, Ar, Ge, As, Se, Br, Kr, Te, I и Xe.
- ^ Оксфордский словарь английского языка ; Eagleson 1994 (полностью германская кислота ); Виберг 2001, с. 897 , германовая кислота: H, B, C, N, O, F, Si, P, S, Cl, Ge, As, Sb, Br, Te, I и Xe.
- ^ Бхувалка и др. 2021, стр. 10097–10107 : H, He, B, C, N, O, F, Si, P, S, Cl, Ar, Br, Sb, Te и I.
- ^ Король 2019, с. 408 : H, He, B, C, N, O, F, Si, P, S, Cl, Ge, As, Se, Br, Sb.
- ^ Эмсли 2011, стр. 98, 117, 331, 487 ; Грешам и др. 2015, стр. 25, 55, 60, 63 : H, He, B, C, N, O, F, Si, P, S, Cl, Ar, Se, Sb.
- ^ Бирд и др. 2021 ; Слай 2008 : H, B, C (включая графит), N, O, F, Si, P, S, Cl, Ar, Br и Sb.
- ^ Рейнхардт и др. 2015 ; Иглсон 1994, с. 1053 : H, He, C, N, O, F, P, S и Ar.
- ^ Windmeier & Barron 2013 : H, He, N, O, F, Ne, S, Cl и Ar
- ^ Кииски и др. 2016 : Ч, Б, С, Н, О, Си, П, С
- ^ Эмсли 2011, стр. 113, 231, 327, 362, 377, 393, 515:: H, C, N, O, P, S, Cl.
- ^ Брандт и Вейлер 2000 : H, He, C, N, O, Ar
- ^ Харбисон, Буржуа и Джонсон 2015, с. 364
- ^ Болин 2017, с. 2-1 [ сломанный якорь ]
- ^ Иордания, 2016 г.
- ^ Стиллман 1924, с. 213
- ^ де Л'Оне 1566, с. 7
- ^ Лемери 1699, с. 118 ; Дежонге 1998, с. 329
- ^ Лавуазье 1790, с. 175
- ^ Стратерн 2000, с. 239
- ^ Мур, Ф.Дж.; Холл, Уильям Т. (1918). История химии . МакГроу-Хилл. п. 99 . Проверено 1 августа 2024 г. Таблица Лавуазье воспроизведена на стр. 99.
- ^ Крисвелл 2007, с. 1140
- ^ Зальцберг 1991, с. 204
- ^ Friend JN 1953, Человек и химические элементы, 1-е изд., Сыновья Чарльза Скрибнера, Нью-Йорк
- ^ Берцелиус 1811, стр. 258.
- ^ Партингтон 1964, с. 168
- ^ Перейти обратно: а б Баше 1832, с. 250
- ^ Апджон, Дж. (1864). Руководство Металлоидов. Соединенное Королевство: Лонгман.
- ^ Перейти обратно: а б с Химические новости и журнал физических наук 1864 г.
- ^ Голдсмит 1982, с. 526
- ^ Роско и Шормлеммер 1894, с. 4
- ^ Глинка 1960, с. 76
- ^ Вестник 2006, стр. 149–150
- ^ Оксфордский словарь английского языка, 1989 г.
- ^ Кемсхед 1875, с. 13
- ^ Бертомеу-Санчес и др. 2002, стр. 248–249
- ^ Дюпаскье 1844, стр. 66–67
- ^ Баче 1832, стр. 248–276.
- ^ Ренуф 1901, стр. 268.
- ^ Бертомеу-Санчес и др. 2002, с. 248
- ^ Бертомеу-Санчес и др. 2002, с. 236
- ^ Хофер 1845, с. 85
- ^ Дюма 1828 ; Дюма 1859 г.
- ^ Перейти обратно: а б Харрис 1803, с. 274
- ^ Смит 1906, стр. 646–647.
- ^ Пляж 1911 г.
- ^ Эдвардс и Сиенко 1983, с. 693
- ^ Херцфельд 1927 ; Эдвардс 2000, стр. 100–103.
- ^ Перейти обратно: а б Эдвардс 2010, стр. 941–965.
- ^ Кубашевский 1949, стр. 931–940.
- ^ Бутера, Ричард А.; Вальдек, Дэвид Х. (сентябрь 1997 г.). «Зависимость сопротивления металлов, полупроводников и сверхпроводников от температуры» . Журнал химического образования . 74 (9): 1090. doi : 10.1021/ed074p1090 . ISSN 0021-9584 .
- ^ Стотт 1956, стр. 100–102
- ^ Уайт 1962, с. 106
- ^ Мартин 1969, с. 6
- ^ Приход 1977, с. 178
- ^ Рао и Гангули, 1986 г.
- ^ Смит и Дуайер 1991, стр. 65
- ^ Скотт 2001, с. 1781 г.
- ^ Суреш и Кога 2001, стр. 5940–5944.
- ^ Яо Б., Кузнецов В.Л., Сяо Т. и др. (2020). «Металлы и неметаллы в таблице Менделеева» . Философские труды Королевского общества A: Математические, физические и технические науки . 378 (2180): 1–21. Бибкод : 2020RSPTA.37800213Y . дои : 10.1098/rsta.2020.0213 . ПМЦ 7435143 . ПМИД 32811363 .
- ^ Дэвид Найт (2004) «Дэви, сэр Хамфри, баронет (1778–1829)». Архивировано 24 сентября 2015 года в Wayback Machine в Оксфордском национальном биографическом словаре , Oxford University Press.
- ^ Эдвардс 2000, с. 85
- ^ Джонсон 1966, стр. 3–6, 15.
- ^ Shkol'nikov 2010, p. 2127
- ^ Эйлуорд и Финдли, 2008, стр. 6–13; 126
- ^ Перейти обратно: а б Рам, Зенг и Хоффманн, 2019, стр. 345
- ^ Даффус 2002, с. 798
- ^ Hein & Arena 2011, стр. 228, 523 ; Тимберлейк 1996, стр. 88, 142 ; Книн, Роджерс и Симпсон 1972, с. 263 ; Бейкер 1962, стр. 21, 194 ; Меллер 1958, стр. 11, 178.
- ^ Голдуайт и Спилман 1984, с. 130
- ^ Эмсли 1971, с. 1
- ^ Одерберг 2007, с. 97
- ^ Книн, Роджерс и Симпсон 1972, стр. 218–219.
- ^ Герман 1999, с. 702
- ^ Рассел и Ли 2005, с. 466
- ^ Аткинс и др. 2006, стр. 320–21.
- ^ Zhigal'skii & Jones 2003, p. 66
- ^ Перейти обратно: а б с Рохов 1966, с. 4
- ^ Виберг 2001, с. 780 ; Эмсли 2011, с. 397 ; Рохов 1966, стр. 23, 84.
- ^ Книн, Роджерс и Симпсон 1972, с. 439
- ^ Книн, Роджерс и Симпсон 1972, стр. 321, 404, 436.
- ^ Книн, Роджерс и Симпсон 1972, с. 465
- ^ Книн, Роджерс и Симпсон 1972, с. 308
- ^ Трегартен 2003, с. 10
- ^ Льюис 1993, стр. 28, 827.
- ^ Льюис 1993, стр. 28, 813.
- ^ Чунг 1987
- ^ Годфрин и Лаутер 1995, стр. 216–218.
- ^ Янас, Кабреро-Вилатела и Балмер, 2013 г.
- ^ Виберг 2001, с. 416
- ^ Десаи, Джеймс и Хо 1984, стр. 1160 ; Март 1979 г., с. 1260
- ^ Шефер 1968, с. 76 ; Карапелла 1968, стр. 29‒32
- ^ Гринвуд и Эрншоу 2002, с. 804
- ^ Книн, Роджерс и Симпсон 1972, с. 264
- ^ Рейнер-Кэнхэм 2018, стр. 203
- ^ Уэлчер 2009, с. 3–32 : «Элементы изменяются от ... металлоидов до умеренно активных неметаллов, очень активных неметаллов и благородного газа».
- ^ Маккин 2014, с. 80
- ^ Джонсон 1966, стр. 105–108.
- ^ Штейн 1969, стр. 5396–5397 ; Питцер 1975, стр. 760–761.
- ^ Рохов 1966, с. 4 ; Аткинс и др. 2006, стр. 8, 122–123.
- ^ Виберг 2001, с. 750 .
- ^ Дуглас и Мерсье 1982, стр. 723
- ^ Гиллеспи и Робинсон 1959, с. 418
- ^ Сандерсон 1967, с. 172 ; Мингос 2019, с. 27
- ^ Дом 2008, с. 441
- ^ Мингос 2019, с. 27 ; Сандерсон 1967, с. 172
- ^ Виберг 2001, с. 399
- ^ Кленинг и Аппельман 1988, с. 3760
- ^ Перейти обратно: а б Рао 2002, с. 22
- ^ Sidorov 1960, pp. 599–603
- ^ Макмиллан 2006, с. 823
- ^ Уэллс 1984, с. 534
- ^ Перейти обратно: а б Паддефатт и Монаган 1989, с. 59
- ^ Кинг 1995, с. 182
- ^ Риттер 2011, с. 10
- ^ Ямагути и Шираи 1996, стр. 3.
- ^ Вернон 2020, с. 223
- ^ Вудворд и др. 1999, с. 134
- ^ Далтон 2019
Библиография
[ редактировать ]- Эбботт Д. 1966, Введение в периодическую таблицу , JM Dent & Sons, Лондон.
- Аддисон WE 1964, Аллотропия элементов , Oldbourne Press, Лондон
- Аткинс П.А. и др. 2006, Неорганическая химия Шрайвера и Аткинса , 4-е изд., Oxford University Press, Оксфорд, ISBN 978-0-7167-4878-6
- Эйлуорд Г. и Финдли Т. 2008, SI Chemical Data , 6-е изд., John Wiley & Sons Australia, Милтон, ISBN 978-0-470-81638-7
- Бах нашей эры, 1832 г., «Очерк химической номенклатуры перед трактатом по химии Дж. Дж. Берцелиуса» , American Journal of Science , vol. 22, стр. 248–277.
- Бейкер и др. PS 1962, Химия и вы , Лайонс и Карнахан, Чикаго
- Barton AFM 2021, Состояния материи, состояния разума , CRC Press, Бока-Ратон, ISBN 978-0-7503-0418-4
- Бич ФК (редактор) 1911, Американа: универсальная справочная библиотека , том. XIII, Мел-Нью, Металлоид, Отдел сбора данных Scientific American, Нью-Йорк
- Берд А., Баттенберг, К. и Саткер Б.Дж. 2021, «Антипирены», в Энциклопедии промышленной химии Ульмана, два : 10.1002/14356007.a11_123.pub2
- Бейзер А. 1987, Концепции современной физики , 4-е изд., МакГроу-Хилл, Нью-Йорк, ISBN 978-0-07-004473-9
- Беннер С.А., Рикардо А. и Кэрриган М.А. 2018, «Существует ли общая химическая модель жизни во Вселенной?», в Клеланде К.Э. и Бедо М.А. (ред.), Природа жизни: классические и современные перспективы философии и науки , Издательство Кембриджского университета, Кембридж, ISBN 978-1-108-72206-3
- Бенжен и др. 2020, Металлы и неметаллы в периодической таблице, Философские труды Королевского общества A , том. 378, 20200213
- Бергер Л.И. 1997, Полупроводниковые материалы , CRC Press, Бока-Ратон, ISBN 978-0-8493-8912-2
- Бертомеу-Санчес-младший, Гарсия-Бельмар А. и Бенсоде-Винсент Б. 2002, «В поисках порядка вещей: учебники и химические классификации во Франции девятнадцатого века», Ambix , vol. 49, нет. 3, дои : 10.1179/amb.2002.49.3.227
- Берцелиус Дж. Дж. 1811, «Очерк химической номенклатуры», Журнал физики, химии, естественной истории , том. LXXIII, с. 253‒286
- Бхувалка и др. 2021, «Характеристика изменений в использовании материалов в связи с электрификацией транспортных средств», Environmental Science & Technology vol. 55, нет. 14, doi : 10.1021/acs.est.1c00970
- Богородицкий Н.П. и Пасынков В.В. 1967, Радио и электронные материалы , Iliffe Books, Лондон.
- Больманн Р. 1992, «Синтез галогенидов», в Винтерфельдте Э. (ред.), Манипулирование гетероатомами , Pergamon Press, Оксфорд, ISBN 978-0-08-091249-3
- Боресков Г.К. 2003, Гетерогенный катализ , Nova Science, Нью-Йорк, ISBN 978-1-59033-864-3
- Брэди Дж. Э. и Сенезе Ф. 2009, Химия: исследование материи и ее изменений , 5-е изд., John Wiley & Sons, Нью-Йорк, ISBN 978-0-470-57642-7
- Бранде WT 1821, Руководство по химии , вып. II, Джон Мюррей, Лондон
- Брандт Х.Г. и Вейлер Х., 2000, «Сварка и резка», в Энциклопедии промышленной химии Ульмана, два : 10.1002/14356007.a28_203
- Брант WT 1919, Справочник приемок и процессов для металлистов , HC Baird & Company, Филадельфия
- Браун Т.Л. и др. 2014, Химия: Центральная наука , 3-е изд., Pearson Australia: Сидней, ISBN 978-1-4425-5460-3
- Берфорд Н., Пассмор Дж. и Сандерс JCP 1989, «Приготовление, структура и энергетика гомополиатомных катионов групп 16 (халькогены) и 17 (галогены)», в книге Либмана Дж. Ф. и Гринберга А. (ред.), От атомов к полимеры: изоэлектронные аналогии , ВЧ, Нью-Йорк, ISBN 978-0-89573-711-3
- Байнум В.Ф., Браун Дж. и Портер Р. 1981 (ред.), Словарь истории науки , Princeton University Press, Принстон, ISBN 978-0-691-08287-5
- Кан Р.В. и Хаасен П., Физическая металлургия: Том. 1 , 4-е изд., Elsevier Science, Амстердам, ISBN 978-0-444-89875-3
- Цао С и др. 2021, «Понимание периодической и непериодической химии в периодических таблицах», Frontiers in Chemistry , vol. 8, нет. 813, два : 10.3389/fchem.2020.00813
- Carapella SC 1968, «Мышьяк» в Хампеле, Калифорния (ред.), Энциклопедия химических элементов , Рейнхольд, Нью-Йорк.
- Кармалт CJ и Норман NC 1998, «Мышьяк, сурьма и висмут: некоторые общие свойства и аспекты периодичности», в Norman NC (ред.), Химия мышьяка, сурьмы и висмута , Blackie Academic & Professional, Лондон, стр. 1– 38, ISBN 0-7514-0389-X
- Карраско и др. 2023, «Антимонен: настраиваемый постграфеновый материал для перспективных применений в оптоэлектронике, катализе, энергетике и биомедицине», Chemical Society Reviews , vol. 52, нет. 4, с. 1288–1330, дои : 10.1039/d2cs00570k
- Чаллонер Дж. 2014, Элементы: Новое руководство по строительным блокам нашей Вселенной , Carlton Publishing Group, ISBN 978-0-233-00436-5
- Чемберс E 1743, в «Металл» , Циклопедия: Или Универсальный словарь искусств и наук (и т. д.) , том. 2, D Midwinter, Лондон
- Чемберс С. и Холлидей А.К., 1982, Неорганическая химия , Баттерворт и Ко, Лондон, ISBN 978-0-408-10822-5
- Рентгеновская обсерватория Чандра, 2018 г., Круговая диаграмма изобилия , по состоянию на 26 октября 2023 г.
- Чапин Ф.С., Мэтсон П.А. и Витоусек П.М. 2011, Климатическая система Земли, в «Принципах экологии наземной экосистемы», Спрингер, Нью-Йорк, ISBN 978-1-4419-9503-2
- Шарлье Дж.К., Гонз Х., Мишено Дж.П. 1994, "Исследование из первых принципов эффекта суммирования на электронных свойствах графита(ов)", Carbon , vol. 32, нет. 2, стр. 289–99, дои : 10.1016/0008-6223(94)90192-9
- Чедд Дж. 1969, Половинные элементы: технология металлоидов , Double Day, Гарден-Сити, Нью-Йорк.
- Chemical Abstracts Service 2021, база данных CAS REGISTRY по состоянию на 2 ноября, дело № 01271182.
- Чен К. 1990, Промышленные системы распределения электроэнергии и освещения, Марсель Деккер, Нью-Йорк, ISBN 978-0-8247-8237-5
- Чунг Д.Д. 1987, «Обзор расслоенного графита», Journal of Materials Science , vol. 22, два : 10.1007/BF01132008
- Клагстон М.Дж. и Флемминг Р. 2000, Высшая химия , Издательство Оксфордского университета, Оксфорд, ISBN 978-0-19-914633-8
- Cockell C 2019, Уравнения жизни: как физика формирует эволюцию , Atlantic Books, Лондон, ISBN 978-1-78649-304-0
- Кук К.Г., 1923 г., «Химия в повседневной жизни: с лабораторным руководством» , Д. Эпплтон, Нью-Йорк.
- Коттон А и др. 1999, Продвинутая неорганическая химия , 6-е изд., Уайли, Нью-Йорк, ISBN 978-0-471-19957-1
- Казинс Д.М., Дэвидсон М.Г. и Гарсия-Виво Д. 2013, «Беспрецедентное участие четырехкоординационного атома водорода в кубановом ядре фенолятов лития и натрия», Chemical Communications , vol. 49, два : 10.1039/C3CC47393G
- Кокс П.А. 1997, Элементы: их происхождение, изобилие и распространение , Oxford University Press, Оксфорд, ISBN 978-0-19-855298-7
- Кокс Т. 2004, Неорганическая химия , 2-е изд., Издательство BIOS Scientific Publishers, Лондон, ISBN 978-1-85996-289-3
- Кроуфорд Ф.Х. 1968, Введение в физику , Harcourt, Brace & World, Нью-Йорк
- Кресси Д., 2010 г., «Химики переосмысливают водородную связь». Архивировано 24 января 2019 г. в Wayback Machine , Nature блоге новостей , по состоянию на 23 августа 2017 г.
- Крайтон Р. 2012, Биологическая неорганическая химия: новое введение в молекулярную структуру и функцию , 2-е изд., Elsevier, Амстердам, ISBN 978-0-444-53783-6
- Крисвелл Б. 2007, «Ошибка, когда студенты были Менделеевыми всего на один день», Журнал химического образования , том. 84, нет. 7, стр. 1140–1144, два : 10.1021/ed084p1140
- Crow JM 2013, Ренессанс основной группы , Мир химии , 31 мая, по состоянию на 26 декабря 2023 г.
- Csele M 2016, Лазеры , в Энциклопедии промышленной химии Ульмана, два : 10.1002/14356007.a15_165.pub2
- Далтон Л. 2019, «Аргон реагирует с никелем в условиях скороварки» , Chemical & Engineering News , по состоянию на 6 ноября 2019 г.
- Клаве E 1651, Новый философский свет истинных принципов и элементов природы, а также их качества вопреки общепринятому мнению, Оливье де Варенн, Париж
- Дэниел П.Л. и Рапп РА, 1976, «Галогенная коррозия металлов», в Fontana MG и Staehle RW (ред.), « Достижения в области науки и технологии коррозии» , Спрингер, Бостон, дои : 10.1007/978-1-4615-9062-0_2
- де Л'Онэ L 1566, Ответ на речь мэтра Яка Гревена, доктора Парижа, которую он написал против книги мэтра Луа де Л'Онэ, доктора из Ла-Рошели, о способности сурьмы (Ответ на речь Л'Оне, L 1566). Мастер Жак Гревен,... который он написал на фоне книги мастера Луа де Л'Онэ... Касаясь факультета сурьмы), De l'Imprimerie de Barthelemi Berton, Ла-Рошель
- Дэвис и др. 2006, «Лазеры на атомном йоде», в Endo M & Walter RF (ред.), 2006, Gas Lasers, CRC Press, Бока-Ратон, Флорида, ISBN 978-0-470-19565-9
- ДеКок Р.Л. и Грей Х.Б., 1989, Химическая структура и связь , Университетские научные книги, Милл-Вэлли, Калифорния, ISBN 978-0-935702-61-3
- Дежонге Л. 1998, «Цинко-свинцовые месторождения Бельгии», Ore Geology Reviews , vol. 12, нет. 5, 329–354, два : 10.1016/s0169-1368(98)00007-9
- Десаи П.Д., Джеймс Х.М. и Хо CY 1984, «Электрическое сопротивление алюминия и марганца» , Журнал физических и химических справочных данных , том. 13, нет. 4, дои : 10.1063/1.555725
- Донохью Дж. 1982, Структуры элементов , Роберт Э. Кригер, Малабар, Флорида, ISBN 978-0-89874-230-5
- Дорси MG 2023, Затаив дыхание: как союзники противостояли угрозе химической войны во Второй мировой войне , издательство Корнельского университета, Итака, Нью-Йорк, стр. 12–13, ISBN 978-1-5017-6837-8
- Дуглас Дж., Мерсье Р. 1982, Кристаллическая структура и ковалентность связей в сульфате мышьяка (III), As 2 (SO 4 ) 3 , Acta Crystallographica Раздел B Структурная кристаллография и кристаллохимия , том. 38, нет, 3, 720–723, дои : 10.1107/s056774088200394x
- Ду Ю, Оуян С., Ши С. и Лей М. 2010, Ab initio исследования атомной и электронной структуры черного фосфора, Journal of Applied Physics , vol. 107, нет. 9, стр. 093718–1–4, дои : 10.1063/1.3386509
- Даффус Дж.Х. 2002, «Тяжелые металлы — бессмысленный термин?», Pure and Applied Chemistry , vol. 74, нет. 5, стр. 793–807, дои : 10.1351/pac200274050793
- Дюма JBA 1828, Трактат о химии, прикладной к искусству , Беше Жен, Париж
- Дюма JBA 1859, Мемуары об эквивалентах простых тел , Малле-Башелье, Париж
- Дюпаскье А. 1844, Элементарный трактат по промышленной химии , Шарль Сави Жюэн, Лион
- Иглсон М. 1994, Краткая энциклопедия химии , Вальтер де Грюйтер, Берлин, ISBN 3-11-011451-8
- Earl B & Wilford D 2021, Кембриджский курс химии O , Hodder Education, Лондон, ISBN 978-1-3983-1059-9
- Эдвардс П.П. 2000, «Что, почему и когда является металлом?», в зале N (ред.), « Новая химия» , Кембриджский университет, Кембридж, стр. 85–114, ISBN 978-0-521-45224-3
- Эдвардс П.П. и др. 2010, «... металл проводит, а неметалл — нет», Philosophical Transactions of the Royal Society A , 2010, vol, 368, no. 1914, два : 10.1098/rsta.2009.0282
- Эдвардс П.П. и Сиенко М.Дж. 1983, «О появлении металлического характера в периодической таблице элементов», Журнал химического образования , том. 60, нет. 9, два : 10.1021/ed060p691 , ПМИД 25666074
- Эллиот А., 1929, «Спектр полосы поглощения хлора», Труды Королевского общества А , том. 123, нет. 792, стр. 629–644, два : 10.1098/rspa.1929.0088
- Эмсли Дж. 1971, Неорганическая химия неметаллов , Метуэн Образовательный, Лондон, ISBN 978-0-423-86120-4
- Эмсли Дж. 2011, Строительные блоки природы: Путеводитель по элементам от А до Я , Oxford University Press, Оксфорд, ISBN 978-0-19-850341-5
- Британская энциклопедия , 2021 г., Периодическая таблица , по состоянию на 21 сентября 2021 г.
- Энгессер Т.А. и Кроссинг I, 2013, «Последние достижения в синтезе гомополиатомных катионов неметаллических элементов C , N , P , S , Cl , Br , I и Xe », Обзоры координационной химии , том. 257, нет. 5–6, стр. 946–955, два : 10.1016/j.ccr.2012.07.025
- Эрман П и Саймон P 1808, «Третий отчет профессора Эрмана и государственного архитектора Саймона об их совместных экспериментах», Annalen der Physik , vol. 28, нет. 3, стр. 347–367.
- Эванс Р.К. 1966, Введение в кристаллохимию , 2-е изд., Кембриджский университет, Кембридж.
- Фарадей М. 1853, Тема курса из шести лекций по неметаллическим элементам (в аранжировке Джона Скофферна ), Лонгман, Браун, Грин и Лонгманс, Лондон
- Филд Дж. Э. (ред.), 1979, Свойства алмаза, Academic Press, Лондон, ISBN 978-0-12-255350-9
- Флорез и др. 2022, «Из газовой фазы в твердое состояние: химическая связь в сверхтяжелом элементе флеровии», Журнал химической физики , том. 157, 064304, дои : 10.1063/5.0097642
- Fortescue JAC 2012, Геохимия окружающей среды: целостный подход , Спрингер-Верлаг, Нью-Йорк, ISBN 978-1-4612-6047-9
- Fox M 2010, Оптические свойства твердых тел , 2-е изд., Oxford University Press, Нью-Йорк, ISBN 978-0-19-957336-3
- Fraps GS 1913, Принципы агрохимии , The Chemical Publishing Company, Истон, Пенсильвания.
- Фраусто да Силва JJR и Уильямс RJP 2001, Биологическая химия элементов: неорганическая химия жизни , 2-е изд., Oxford University Press, Оксфорд, ISBN 978-0-19-850848-9
- Гаффни Дж. и Марли Н. 2017, «Общая химия для инженеров» , Elsevier, Амстердам, ISBN 978-0-12-810444-6
- Гангули А. 2012, Основы неорганической химии , 2-е изд., Дорлинг Киндерсли (Индия), Нью-Дели ISBN 978-81-317-6649-1
- Гарго М. и др. (ред.) 2006, Лекции по астробиологии, том. 1, часть 1: Ранняя Земля и другие космические среды обитания жизни , Шпрингер, Берлин, ISBN 978-3-540-29005-6
- Гатти М., Токатли IV и Рубио А., 2010, Натрий: изолятор с переносом заряда при высоких давлениях, Physical Review Letters , vol. 104, нет. 21, doi : 10.1103/PhysRevLett.104.216404
- Георгиевский В.И. 1982, Минеральный состав тел и тканей животных, Георгиевский В.И., Анненков Б.Н. и Самохин В.Т. (ред.), Минеральное питание животных: исследования в области сельскохозяйственных и пищевых наук, Баттервортс, Лондон, ISBN 978-0-408-10770-9
- Гиллеспи Р.Дж., Робинсон Э.А. 1959, Система растворителей серной кислоты, в книге Эмелеус Х.Дж., Шарп А.Г. (редакторы), « Достижения в области неорганической химии и радиохимии» , том. 1, стр. 386–424, Academic Press, Нью-Йорк.
- Гиллхэм Э.Дж., 1956, Полупроводниковый болометр сурьмы, Журнал научных инструментов , том. 33, нет. 9, дои : 10.1088/0950-7671/33/9/303
- Глинка Н 1960, Общая химия , Соболев Д (пер.), Издательство иностранных языков, Москва
- Годфрин Х. и Лаутер Х.Дж. 1995, «Экспериментальные свойства 3 Он адсорбировался на графите», в книге Гальперина В.П. (редактор), «Прогресс в физике низких температур», том 14 , Elsevier Science BV, Амстердам, ISBN 978-0-08-053993-5
- Годовиков А.А., Ненашева Н. 2020, Структурно-химическая систематика минералов , 3-е изд., Шпрингер, Шам, Швейцария, ISBN 978-3-319-72877-3
- Голдсмит Р.Х. 1982, «Металлоиды», Журнал химического образования , том. 59, нет. 6, стр. 526–527, два : 10.1021/ed059p526
- Голдвайт Х. и Спилман-младший, 1984, Химический колледж , Харкорт Брейс Йованович, Сан-Диего, ISBN 978-0-15-601561-5
- Гудрич Б.Г. 1844, Взгляд на физические науки , Брэдбери, Соден и компания, Бостон
- Грешам и др. 2015, Смазка и смазочные материалы, Энциклопедия химической технологии Кирка-Отмера, John Wiley & Sons, doi : 10.1002/0471238961.1221021802151519.a01.pub3 , по состоянию на 3 июня 2024 г.
- Грондзик В.Т. и др. 2010, Механическое и электрическое оборудование для зданий, 11-е изд., John Wiley & Sons, Хобокен, ISBN 978-0-470-19565-9
- Правительство Канады, 2015 г., Периодическая таблица элементов , по состоянию на 30 августа 2015 г.
- Грейвс-младший, JL, 2022 г., Голос в пустыне: биолог-новатор объясняет, как эволюция может помочь нам решить наши самые большие проблемы , Basic Books, Нью-Йорк, ISBN 978-1-6686-1610-9 ,
- Green D 2012, The Elements , Scholastic, Саутэм, Уорикшир, ISBN 978-1-4071-3155-9
- Гринберг А. 2007, От алхимии к химии в картинках и рассказах , John Wiley & Sons, Хобокен, Нью-Джерси, 978-0-471-75154-0
- Гринвуд Н.Н. 2001, Химия элементов основной группы на рубеже тысячелетий, Журнал Химического общества, Dalton Transactions , вып. 14, стр. 2055–66, два : 10.1039/b103917m
- Гринвуд Н.Н. и Эрншоу А. 2002, Химия элементов , 2-е изд., Баттерворт-Хейнеманн, ISBN 978-0-7506-3365-9
- Грочала В. 2018, «О положении гелия и неона в периодической таблице элементов», Foundations of Chemistry , vol. 20, стр. 191–207, два : 10.1007/s10698-017-9302-7
- Зал RA 2021, Pop Goes the Decade: 2000-е, ABC-CLIO, Санта-Барбара, Калифорния, ISBN 978-1-4408-6812-2
- Халлер Э.Э. 2006, «Германий: от открытия до устройств SiGe» , Материаловедение в области полупроводниковой обработки , том. 9, № 4–5, по состоянию на 9 октября 2013 г.
- Хампель Калифорния и Хоули Г.Г. 1976, Глоссарий химических терминов , Ван Ностранд Рейнхольд, Нью-Йорк, ISBN 978-0-442-23238-2
- Хэнли Дж. Дж. и Кога К. Т. 2018, «Галогены в земных и космических геохимических системах: распространенность, геохимическое поведение и аналитические методы» в книге «Роль галогенов в земных и внеземных геохимических процессах: поверхность, кора и мантия» , Харлов Д. Е. и Аранович Л. ( ред.), Спрингер, Чам, ISBN 978-3-319-61667-4
- Харбисон Р.Д., Буржуа ММ и Джонсон GT 2015, Промышленная токсикология Гамильтона и Харди , 6-е изд., John Wiley & Sons, Хобокен, ISBN 978-0-470-92973-5
- Hare RA & Bache F 1836, Краткое содержание курса химического обучения на медицинском факультете Пенсильванского университета , 3-е изд., Дж. Г. Аунер, Филадельфия
- Харрис ТМ 1803, Малая энциклопедия , том. III, Вест и Гринлиф, Бостон
- Hein M & Arena S 2011, Основы студенческой химии , 13-е изд., John Wiley & Sons, Хобокен, Нью-Джерси, ISBN 978-0470-46061-0
- Хенгевельд Р. и Федонкин М.А. 2007, «Стартизация потока энергии в начале жизни», Acta Biotheoretica , vol. 55, два : 10.1007/s10441-007-9019-4
- Герман З.С. 1999, «Природа химической связи в металлах, сплавах и интерметаллических соединениях по мнению Лайнуса Полинга», в Максич, З.Б., Орвилл-Томас В.Дж. (ред.), 1999, Наследие Полинга: современное моделирование химического Бонд , Эльзевир, Амстердам, два : 10.1016/S1380-7323(99)80030-2
- Герман А., Хоффманн Р. и Эшкрофт Н.В., 2013 г., «Конденсированный астат: одноатомный и металлический», Physical Review Letters , vol. 111, doi : 10.1103/PhysRevLett.111.116404
- Герольд А. 2006, «Расположение химических элементов нескольких классов внутри таблицы Менделеева в соответствии с их общими свойствами» , Comptes Rendus Chimie , vol. 9, нет. 1, дои : 10.1016/j.crci.2005.10.002
- Герцфельд К. 1927, «Об атомных свойствах, которые делают элемент металлом», Physical Review , vol. 29, нет. 5, doi : 10.1103/PhysRev.29.701
- Хилл Дж., Холман Дж. и Халм П.Г. 2017, Химия в контексте , 7-е изд., Oxford University Press, Оксфорд, ISBN 978-0-19-839618-5
- Хофер Ф 1845, Химическая номенклатура и классификации , Ж.-Б. Байьер, Париж.
- Холдернесс А. и Берри М. 1979, Неорганическая химия продвинутого уровня , 3-е изд., Образовательные книги Heinemann, Лондон, ISBN 978-0-435-65435-1
- Хорват А.Л. 1973, «Критическая температура элементов и периодическая система», Журнал химического образования , том. 50, нет. 5, два : 10.1021/ed050p335
- House JE 2008, Неорганическая химия , Elsevier, Амстердам, ISBN 978-0-12-356786-4
- House JE 2013, Неорганическая химия , 2-е изд., Elsevier, Кидлингтон, ISBN 978-0-12-385110-9
- Хуан И, 2018 г., Термодинамика коррозии материалов, Хуан И и Чжан Дж. (редакторы), Коррозия и защита материалов , Де Грюйтер, Бостон, стр. 25–58, дои : 10.1515/9783110310054-002
- Хамфри TPJ 1908, «Систематический курс обучения химии и физики», Pharmaceutical Journal , vol. 80, с. 58
- Хусейн и др. 2023, «Настройка электронных свойств монослоев дисульфида молибдена путем легирования с использованием расчетов из первых принципов», Physica Scripta , vol. 98, нет. 2, два : 10.1088/1402-4896/acacd1
- Имберти С. и Сэдлер П.Дж., 2020, «150 лет таблицы Менделеева: Новые лекарства и диагностические средства», в Сэдлер П.Дж. и ван Элдик Р., 2020, « Достижения в области неорганической химии» , том. 75, Академик Пресс, ISBN 978-0-12-819196-5
- Периодическая таблица элементов ИЮПАК , по состоянию на 11 октября 2021 г.
- Янас Д., Кабреро-Вилатела А. и Балмер Дж. 2013, «Проволоки из углеродных нанотрубок для работы при высоких температурах», Carbon , vol. 64, стр. 305–314, doi : 10.1016/j.carbon.2013.07.067
- Дженкинс Г.М. и Кавамура К. 1976, Полимерные углероды — углеродное волокно, стекло и уголь , Издательство Кембриджского университета, Кембридж, ISBN 978-0-521-20693-8
- Йентч А.В. и Матил С. 2015, «Перенос анионов с помощью галогенных связей», в Metrangolo P и Resnati G (ред.), Галогенная связь I: Влияние на химию материалов и науки о жизни , Спрингер, Чам, ISBN 978-3-319-14057-5
- Дженсен В.Б. 1986, Классификация, симметрия и периодическая таблица, Компьютеры и математика с приложениями , том. 12Б, н.у. 1/2, стр. 487−510, дои : 10.1016/0898-1221(86)90167-7
- Джонсон Р.К. 1966, Вводная описательная химия , Вашингтон Бенджамин, Нью-Йорк
- Джолли У.Л., 1966, Химия неметаллов , Прентис-Холл, Энглвуд-Клиффс, Нью-Джерси.
- Джонс BW 2010, Плутон: страж внешней солнечной системы , Кембриджский университет, Кембридж, ISBN 978-0-521-19436-5
- Джордан Дж.М. 2016 «Древняя эпистема» и природа окаменелостей: исправление современной научной ошибки», History and Philosophy of the Life Sciences , vol. 38, вып. 1, с. 90–116, два : 10.1007/s40656-015-0094-6
- Kaiho T 2017, Iodine Made Simple , CRC Press, электронная книга, дои : 10.1201/9781315158310
- Килер Дж. и Уотерс П. 2013, Химическая структура и реакционная способность: комплексный подход , Oxford University Press, Оксфорд, ISBN 978-0-19-960413-5
- Kemshead WB 1875, Неорганическая химия , William Collins, Sons & Company, Лондон
- Kernion MC и Mascetta JA 2019, Химия: простой путь , 6-е изд., Каплан, Нью-Йорк, ISBN 978-1-4380-1210-0
- King AH 2019, «Наш след стихии», Nature Materials , том. 18, два : 10.1038/s41563-019-0334-3
- Кинг РБ 1994, Энциклопедия неорганической химии , том. 3, «Джон Уайли и сыновья», Нью-Йорк, ISBN 978-0-471-93620-6
- Кинг Р.Б. 1995, Неорганическая химия элементов основных групп , VCH, Нью-Йорк, ISBN 978-1-56081-679-9
- Кийски и др. 2016, «Удобрения, 1. Общие сведения», в Энциклопедии промышленной химии Ульмана, два : 10.1002/14356007.a10_323.pub4
- Кленинг Великобритания и Аппельман Э.Х. 1988, «Протолитические свойства перксеновой кислоты», Неорганическая химия , том. 27, нет. 21, два : 10.1021/ic00294a018
- Книн В.Р., Роджерс М.Дж.В. и Симпсон П. 1972, Химия: факты, закономерности и принципы , Аддисон-Уэсли, Лондон, ISBN 978-0-201-03779-1
- Найт Дж. 2002, Наука повседневных вещей: химия в реальной жизни , Gale Group, Детройт, ISBN 9780787656324
- Кениг С.Х., 1962 г., в материалах Международной конференции по физике полупроводников , проходившей в Эксетере, 16–20 июля 1962 г., Институт физики и Физического общества, Лондон.
- Косанке и др. 2012, Энциклопедический словарь по пиротехнике (и смежным предметам) , Часть 3 – от P до Z, Справочная серия по пиротехнике № 5, Журнал пиротехники, Уайтуотер, Колорадо, ISBN 978-1-889526-21-8
- Кубашевский О. 1949, «Изменение энтропии, объема и связующего состояния элементов при плавлении», Труды Фарадеевского общества , том. 45, дои : 10.1039/TF9494500931
- Labinger JA 2019, «История (и предыстория) открытия и химии благородных газов», в Джунта К.Дж., Майнц В.В. и Джиролами Г.С. (ред.), 150 лет периодической таблицы: памятный симпозиум , Springer Природа, Чам, Швейцария, ISBN 978-3-030-67910-1
- Лэнфорд О.Э., 1959, Использование химии , МакГроу-Хилл, Нью-Йорк.
- Ларраньяга, доктор медицинских наук, Льюис Р.Дж. и Льюис Р.А. 2016, Сокращенный химический словарь Хоули , 16-е изд., Уайли, Хобокен, Нью-Йорк, ISBN 978-1-118-13515-0
- Лавуазье А. 1790, Элементы химии , Р. Керр (пер.), Уильям Крич, Эдинбург
- Ли Дж.Д., 1996, Краткая неорганическая химия , 5-е изд., Blackwell Science, Оксфорд, ISBN 978-0-632-05293-6
- Лемери N 1699, Универсальный трактат о простых лекарствах, расположенный в алфавитном порядке , L d'Houry, Париж, с. 118
- Льюис Р.Дж. 1993, Сокращенный химический словарь Хоули , 12-е изд., Ван Ностранд Рейнхольд, Нью-Йорк, ISBN 978-0-442-01131-4
- Льюис Р.С. и Дин В.М. 1994, «Кинетика реакции оксида азота с кислородом в водных растворах», Химические исследования в токсикологии , том. 7, нет. 4, стр. 568–574, два : 10.1021/tx00040a013
- Липтрот Г.Ф. 1983, Современная неорганическая химия , 4-е изд., Bell & Hyman, ISBN 978-0-7135-1357-8
- Национальная лаборатория Лос-Аламоса, 2021 г., Периодическая таблица элементов: ресурс для учащихся начальной, средней и старшей школы , по состоянию на 19 сентября 2021 г.
- Лундгрен А. и Бенсауд-Винсент Б. 2000, «Информационная химия: учебники и их аудитория», 1789–1939 гг ., История науки, Кантон, Массачусетс, ISBN 0-88135-274-8
- Маккей К.М., Маккей Р.А. и Хендерсон В. 2002, Введение в современную неорганическую химию , 6-е изд., Нельсон Торнс, Челтнем, ISBN 978-0-7487-6420-4
- Маккин М. 2014, Учебное пособие по основам химии , Elsevier Science, Сент-Луис, ISBN 978-0-323-14652-4
- Мэлоун Л.Дж. и Долтер Т. 2008, Основные понятия химии , 8-е изд., John Wiley & Sons, Хобокен, ISBN 978-0-471-74154-1
- Манн и др. 2000, Энергии конфигурации элементов d-блока, Журнал Американского химического общества , том. 122, нет. 21, стр. 5132–5137, дои : 10.1021/ja9928677
- Маошэн М. 2020, «Благородные газы в твердых соединениях демонстрируют богатую химию при достаточном давлении», Frontiers in Chemistry , vol. 8, два : 10.3389/fchem.2020.570492
- Марони М., Зайферт Б. и Линдвалл Т. (редакторы) 1995, «Физические загрязнители», в « Качество воздуха в помещении: всеобъемлющий справочник» , Elsevier, Амстердам, ISBN 978-0-444-81642-9
- Мартин Дж.В., 1969, Элементарная наука о металлах , Wykeham Publications, Лондон.
- Мэтсон М и Орбаек AW 2013, Неорганическая химия для чайников , John Wiley & Sons: Hoboken, ISBN 978-1-118-21794-8
- Матула Р.А. 1979, «Электрическое сопротивление меди, золота, палладия и серебра», Журнал физических и химических справочных данных , том. 8, нет. 4, дои : 10.1063/1.555614
- Mazej Z 2020, «Химия благородных газов более чем через полвека после первого сообщения о соединениях благородных газов», Molecules , vol. 25, нет. 13, дои : 10.3390/molecules25133014 , ПМИД 32630333 , ПМК 7412050
- Макмиллан П. 2006, «Стакан углекислого газа», Nature , vol. 441, дои : 10.1038/441823a
- Менделеев Д.И. 1897, Основы химии , т. 1, с. 2, 5-е изд., пер. Дж. Каменски, А. Дж. Гринуэй (редактор), Longmans, Green & Co., Лондон
- Месслер-младший RW 2011, Сущность материалов для инженеров , Jones and Bartlett Learning, Садбери, Массачусетс, ISBN 978-0-7637-7833-0
- Мьюс и др. 2019, «Коперниций: релятивистская благородная жидкость», Angewandte Chemie International Edition , vol. 58, стр. 17964–17968, два : 10.1002/anie.201906966
- Mingos DMP 2019, «Открытие элементов в периодической таблице», в Mingos DMP (ред.), Периодическая таблица I. Структура и связь , Springer Nature, Cham, дои : 10.1007/978-3-030-40025-5
- Мёллер Т. 1958, Качественный анализ: введение в химию равновесия и растворов , МакГроу-Хилл, Нью-Йорк.
- Мёллер Т и др. 1989, Химия: с неорганическим качественным анализом , 3-е изд., Academic Press, Нью-Йорк, ISBN 978-0-12-503350-3
- Муди Б. 1991, Сравнительная неорганическая химия , 3-е изд., Эдвард Арнольд, Лондон, ISBN 978-0-7131-3679-1
- Мур Дж.Т. 2016, Химия для чайников , 2-е изд., гл. 16. Отслеживание периодических тенденций, John Wiley & Sons: Hoboken, ISBN 978-1-119-29728-4
- Морли HF и Muir MM 1892, Химический словарь Ватта , том. 3, Лонгманс Грин и Ко, Лондон
- Мосс, Т.С. 1952, Фотопроводимость в элементах , Butterworths Scientific, Лондон.
- Майерс RT 1979, «Физические и химические свойства и связь металлических элементов», Журнал химического образования , том. 56, нет. 11, стр. 712–73, два : 10.1021/ed056p71
- Ободовский I 2015, Основы радиационной и химической безопасности , Elsevier, Амстердам, ISBN 978-0-12-802026-5
- Одерберг Д.С. 2007, Настоящий эссенциализм , Рутледж, Нью-Йорк, ISBN 978-1-134-34885-5
- Острайкер Дж. П. и Стейнхардт П. Дж. 2001, «Квинтэссенция вселенной», Scientific American , vol. 284, нет. 1, стр. 46–53 ПМИД 11132422 , дои : 10.1038/scientificamerican0101-46
- Оксфордский словарь английского языка , 1989 г., «неметалл».
- Орисакве О.Е., 2012 г., Другие тяжелые металлы: сурьма, кадмий, хром и ртуть, в Пачеко-Торгал Ф., Джалали С. и Фучич А. (ред.), Токсичность строительных материалов , Woodhead Publishing, Оксфорд, стр. 297–333, дои : 10.1533/9780857096357.297
- Парамесваран П. и др. 2020, «Фазовая эволюция и характеристики механически легированного гексанариевого сплава Al 16,6 Mg 16,6 Ni 16,6 Cr 16,6 Ti 16,6 Mn 16,6 с высокой энтропией», Metal Powder Report , vol. 75, нет. 4, дои : 10.1016/j.mprp.2019.08.001
- Пэриш RV 1977, The Metallic Elements , Лонгман, Лондон, ISBN 978-0-582-44278-8
- Партингтон-младший, 1944, Учебник неорганической химии , 5-е изд., Macmillan & Co., Лондон.
- Партингтон Дж. Р. 1964, История химии , том. 4, Макмиллан, Лондон
- Паско К.Дж., 1982, Введение в свойства инженерных материалов , 3-е изд., Фон Ностранд Рейнхольд (Великобритания), Уокингем, Беркшир, ISBN 978-0-442-30233-7
- Полинг Л. 1947, Общая химия: введение в описательную химию и современную химическую теорию , WH Freeman, Сан-Франциско.
- Павлицкий Т., Скандербег DJ и Старкшалл Г. 2016, Физика лучевой терапии Хенди , 4-е изд., John Wiley & Sons, Хобокен, Нью-Джерси, с. 228, ISBN 978-0-470-37651-5
- Петрушевский В.М. и Цветкович Дж. 2018, «Об истинном положении» водорода в периодической таблице, Основы химии , том. 20, стр. 251–260, дои : 10.1007/s10698-018-9306-y
- Phillips CSG и Williams RJP 1965, Неорганическая химия , том. 1, Принципы и неметаллы, Clarendon Press, Оксфорд.
- Питцер К. 1975, «Фториды радона и элементы 118», Журнал Химического общества, Chemical Communications , вып. 18, дои : 10.1039/C3975000760B
- Портерфилд WW 1993, Неорганическая химия , Academic Press, Сан-Диего, ISBN 978-0-12-562980-5
- Пов Б. и Розина М. 2017, Рассеяние и структуры: основы и аналогии в квантовой физике , 2-е изд., Спрингер, Берлин, дои : 10.1007/978-3-662-54515-7
- Пауэлл П. и Тиммс П. 1974, Химия неметаллов , Чепмен и Холл, Лондон, ISBN 978-0-412-12200-2
- Power PP 2010, Элементы главной группы как переходные металлы, Природа , вып. 463, 14 января 2010 г., стр. 171–177, дои : 10.1038/nature08634
- Паддефатт Р.Дж. и Монаган П.К. 1989, Периодическая таблица элементов , 2-е изд., Clarendon Press, Оксфорд, ISBN 978-0-19-855516-2
- Рам М., Зенг Т. и Хоффманн Р. 2019, «Электроотрицательность, рассматриваемая как средняя энергия связи валентного электрона в основном состоянии», Журнал Американского химического общества , том. 141, нет. 1, стр. 342–351, дои : 10.1021/jacs.8b10246
- Рамдор П. 1969, Рудные минералы и их сростки , Pergamon Press, Оксфорд.
- Рао CNR и Гангули П.А. 1986, «Новый критерий металличности элементов», Solid State Communications , vol. 57, нет. 1, стр. 5–6, дои : 10.1016/0038-1098(86)90659-9
- Рао К.Ю. 2002, Структурная химия стекол , Elsevier, Оксфорд, ISBN 0-08-043958-6
- Rayner-Canham G 2018, «Организация переходных металлов», в Scerri E & Restrepo G (ред.) «Менделеев — Оганессон: междисциплинарный взгляд на периодическую таблицу» , Оксфордский университет, Нью-Йорк, ISBN 978-0-190-668532
- Rayner-Canham G 2020, Периодическая таблица: прошлое, настоящее и будущее , World Scientific, Нью-Джерси, ISBN 978-981-121-850-7
- Редмер Р., Хензель Ф. и Хольст Б. (редакторы) 2010, «Переходы металл-неметалл», Springer, Берлин, ISBN 978-3-642-03952-2
- Реньо М.В. 1853, Элементы химии , вып. 1, 2-е изд., Clark & Hesser, Филадельфия.
- Рейли С. 2002, Загрязнение пищевых продуктов металлами , Blackwell Science, Оксфорд, ISBN 978-0-632-05927-0
- Рейнхардт и др. 2015, Инертизация в химической промышленности , Линде, Пуллах, Германия, по состоянию на 19 октября 2021 г.
- Реми Х. 1956, Трактат по неорганической химии , Андерсон Дж. С. (пер.), Кляйнберг Дж. (ред.), Том. II, Эльзевир, Амстердам
- Ренуф Э. 1901, «Учебник неорганической химии», Science , vol. 13, № 320, дои : 10.1126/science.13.320.268
- Рестрепо Г., Льянос Э.Дж. и Меса Х. 2006, «Топологическое пространство химических элементов и его свойств», Журнал математической химии , том. 39, два : 10.1007/s10910-005-9041-1
- Рик Г.Д., 1967, Вольфрам и его соединения , Pergamon Press, Оксфорд.
- Риттер С.К. 2011, «Дело о пропавшем ксеноне» , «Новости химии и техники» , том. 89, нет. 9, ISSN 0009-2347
- Рочоу Э.Г. 1966, Металлоиды , DC Heath and Company, Бостон
- Розенберг Е. 2013, Германийсодержащие соединения, современные знания и применение, Крецингер Р.Х., Уверский В.Н. и Пермяков Е.А. (редакторы), Энциклопедия металлопротеинов , Springer, Нью-Йорк, дои : 10.1007/978-1-4614-1533-6_582
- Роско Х.Э. и Шорлеммер, FRS 1894, Трактат по химии: Том II: Металлы , Д. Эпплтон, Нью-Йорк
- Королевское химическое общество 2021 г., Таблица Менделеева: неметаллы , по состоянию на 3 сентября 2021 г.
- Рудакия Д.М. и Патель И., 2021, Биоремедиация металлов, металлоидов и неметаллов, в Панпатте Д.Г. и Джала Ю.К. (ред.), Микробное омоложение загрязненной окружающей среды , том. 2, Springer Nature, Сингапур, стр. 33–49, дои : 10.1007/978-981-15-7455-9_2
- Рудольф Дж. 1973, Химия для современного разума , Макмиллан, Нью-Йорк.
- Рассел А.М. и Ли К.Л. 2005, Отношения структура-свойство в цветных металлах , Wiley-Interscience, Нью-Йорк, ISBN 0-471-64952-X
- Салинас Дж.Т., 2019 г. «Изучение физических наук в лаборатории» , издательство Moreton Publishing, Энглвуд, Колорадо, ISBN 978-1-61731-753-8
- Зальцберг HW 1991, От пещерного человека до химика: обстоятельства и достижения , Американское химическое общество, Вашингтон, округ Колумбия, ISBN 0-8412-1786-6
- Сандерсон RT 1967, Неорганическая химия , Рейнхольд, Нью-Йорк.
- Скерри Э. (редактор) 2013, 30-секундные элементы: 50 наиболее важных элементов, каждый из которых объясняется за полминуты , Ivy Press, Лондон, ISBN 978-1-84831-616-4
- Scerri E 2020, Периодическая таблица: ее история и значение , Oxford University Press, Нью-Йорк, ISBN 978-0-19091-436-3
- Шефер Дж. К. 1968, «Бор» в Хампеле, Калифорния (редактор), Энциклопедия химических элементов , Рейнхольд, Нью-Йорк.
- Шмедт ауф дер Гюнне Дж., Мангстл М. и Краус Ф. 2012, «Присутствие дифтора F 2 в природе — доказательство in situ и количественная оценка методом ЯМР-спектроскопии», Angewandte Chemie International Edition , vol. 51, нет. 31, два : 10.1002/anie.201203515
- Швейцер Г.К. и Пестерфилд Л.Л. 2010, Водная химия элементов , Oxford University Press, Оксфорд, ISBN 978-0-19-539335-4
- Скотт Д. 2014, «Вокруг света в 18 элементах» , Королевское химическое общество, электронная книга, ISBN 978-1-78262-509-4
- Скотт Э.К. и Канда Ф.А. 1962, Природа атомов и молекул: общая химия , Harper & Row, Нью-Йорк.
- Скотт WAH 2001, Основные факты по химии , 5-е изд., HarperCollins, Глазго, ISBN 978-0-00-710321-8
- Seese WS & Daub GH 1985, Основная химия , 4-е изд., Прентис-Холл, Энглвуд Клиффс, Нью-Джерси, ISBN 978-0-13-057811-2
- Сигал Б.Г., 1989, Химия: эксперимент и теория , 2-е изд., John Wiley & Sons, Нью-Йорк, ISBN 0-471-84929-4
- Шанабрук Б.В., Ланнин Дж.С. и Хисацуне И.С. 1981, «Неупругое рассеяние света в однокоординированном аморфном полупроводнике», Physical Review Letters , vol. 46, нет. 2, 12 января, doi : 10.1103/PhysRevLett.46.130
- Шан и др. 2021, «Сверхтвердый объемный аморфный углерод из коллапсированного фуллерена», Nature , vol. 599, стр. 599–604, два : 10.1038/s41586-021-03882-9
- Щукарев С.А. 1977, Новые взгляды на систему Д.И. Менделеева. I. Периодичность стратиграфии атомных электронных оболочек в системе и понятие кайносимметрии», Журнал «Общий Кимии» , т. 47, № 2, стр. 246–259.
- Школьников Е.В. 2010, "Термодинамическая характеристика амфотерности оксидов M 2 O 3 (M = AS , Sb , Bi ) и их гидратов в водных средах, Журнал прикладной химии , т. 83, № 12, с. 2121–2127, дои : 10.1134/S1070427210120104
- Сидоров Т.А. 1960, "Связь между структурными оксидами и склонностью их к стеклованию", Стекло и керамика , вып. 17, нет. 11, дои : 10.1007BF00670116
- Сикерски С. и Берджесс Дж. 2002, Краткая химия элементов , Horwood Press, Чичестер, ISBN 978-1-898563-71-6
- Слай О.М. младший, 2008 г., «Огнетушащие вещества», в Энциклопедии промышленной химии Ульмана, два : 10.1002/14356007.a11_113.pub2
- Смит А., 1906, Введение в неорганическую химию , The Century Co., Нью-Йорк.
- Смит А. и Дуайер С. 1991, Ключевая химия: исследование химии в современном мире: Книга 1: Материалы и повседневная жизнь , издательство Мельбурнского университета, Карлтон, Виктория, ISBN 978-0-522-84450-4
- Смит Д.В. 1990, Неорганические вещества: прелюдия к изучению описательной химии , издательство Кембриджского университета, Кембридж, ISBN 978-0-521-33136-4
- Смитс и др. 2020, «Оганессон: элемент благородного газа, который не является ни благородным газом», Angewandte Chemie International Edition , vol. 59, стр. 23636–23640, два : 10.1002/anie.202011976
- Smulders E & Sung E 2011, «Средства для стирки, 2, ингредиенты и продукты», В Энциклопедии промышленной химии Ульмана, два : 10.1002/14356007.o15_o13
- Спенсер Дж.Н., Боднер Г.М., Рикард Л.И. 2012, Химия: структура и динамика , 5-е изд., John Wiley & Sons, Хобокен, ISBN 978-0-470-58711-9
- Штейн Л. 1969, «Окисленный радон в растворах фторида галогена», Журнал Американского химического общества , том. 19, нет. 19, два : 10.1021/ja01047a042
- Штейн Л. 1983, «Химия радона», Radiochimica Acta , vol. 32, два : 10.1524/ract.1983.32.13.163
- Штойдель Р. 2020, Химия неметаллов: синтезы – структуры – связь – приложения , в сотрудничестве с Д. Шешкевицем, Берлин, Вальтером де Грюйтером, дои : 10.1515/9783110578065
- Still B 2016 Тайная жизнь таблицы Менделеева , Касселл, Лондон, ISBN 978-1-84403-885-5
- Стиллман Дж. М. 1924, История ранней химии , Д. Эпплтон, Нью-Йорк.
- Стотт RWA 1956, научный сотрудник по физической и неорганической химии , Longmans, Green and Co, Лондон
- Стьюк Дж. 1974, «Оптические и электрические свойства селена», в Zingaro RA & Cooper WC (ред.), Selenium , Ван Ностранд Рейнхольд, Нью-Йорк, стр. 174.
- Стратерн П. 2000, Мечта Менделеева: В поисках элементов , Хэмиш Гамильтон, Лондон, ISBN 9780425184677
- Суреш Ч. и Кога Н.А. 2001, «Последовательный подход к атомным радиусам», Журнал физической химии A , том 105, № 24. два : 10.1021/jp010432b
- Тан и др. 2021, «Синтез паракристаллического алмаза», Nature , вып. 599, стр. 605–610, дои : 10.1038/s41586-021-04122-w
- Танигучи М., Суга С., Секи М., Сакамото Х., Канзаки Х., Акахама Ю., Эндо С., Терада С. и Нарита С. 1984, «Резонансная фотоэмиссия, индуцированная стержневым экситоном, в ковалентном полупроводниковом черном фосфоре», Solid State Communications , vo1. 49, нет. 9, с. 867–7, дои : 10.1016/0038-1098(84)90441-1
- Тейлор, доктор медицинских наук, 1960, Первые принципы химии , Ван Ностранд, Принстон.
- The Chemical News and Journal of Physical Science 1864, «Уведомления о книгах: Руководство по металлоидам» , том. 9, с. 22
- The Chemical News and Journal of Physical Science 1897, «Уведомления о книгах: Руководство по химии, теоретической и практической», В. А. Тилден, том 75, стр. 188–189.
- Торнтон Б.Ф. и Бердетт С.С. 2010, «Обнаружение эка-йода: приоритет открытия в наше время» , Бюллетень истории химии , том. 35, нет. 2, по состоянию на 14 сентября 2021 г.
- Tidy CM 1887, Справочник по современной химии , 2-е изд., Smith, Elder & Co., Лондон
- Тимберлейк К.К., 1996, Химия: введение в общую, органическую и биологическую химию , 6-е изд., HarperCollinsCollege, ISBN 978-0-673-99054-9
- Toon R 2011, «Открытие фтора» , Химическое образование , Королевское химическое общество, по состоянию на 7 октября 2023 г.
- Трегартен Л. 2003, Предварительная химия , Macmillan Образование: Мельбурн, ISBN 978-0-7329-9011-4
- Тайлер П.М., 1948, С нуля: факты и цифры горнодобывающей промышленности США , МакГроу-Хилл, Нью-Йорк.
- Вассилакис А.А., Калемос А. и Мавридис А. 2014, «Точные расчеты из первых принципов по фториду хлора ClF и его ионам ClF». ± ", "Очеты по теоретической химии" , т. 133, № 1436, два : 10.1007/s00214-013-1436-7
- Вернон Р. 2013, «Какие элементы являются металлоидами?», Журнал химического образования , том. 90, нет. 12, стр. 1703–1707, два : 10.1021/ed3008457
- Вернон Р. 2020, «Организация металлов и неметаллов», Основы химии , том. 22, стр. 217–233. doi : 10.1007/s10698-020-09356-6 (открытый доступ)
- Видж и др. 2001, Химия полиазота. Синтез, характеристика и кристаллическая структура удивительно стабильных фторантимонатных солей N 5+ . Журнал Американского химического общества , том. 123, нет. 26, стр. 6308−6313, два : 10.1021/ja010141g
- Wächtershäuser G 2014, «От химической инвариантности к генетической изменчивости», в Weigand W и Schollhammer P (ред.), Биоинспирированный катализ: комплексы металлической серы , Wiley-VCH, Вайнхайм, два : 10.1002/9783527664160.ch1
- Уэйкман TH 1899, «Свободная мысль — прошлое, настоящее и будущее» , журнал Free Thought Magazine , vol. 17
- Ван Х.С., Lineweaver CH и Ирландия TR 2018, Содержание элементов (с неопределенностями) на планете, наиболее похожей на Землю, Икаре , том. 299, стр. 460–474, дои : 10.1016/j.icarus.2017.08.024
- Wasewar KL 2021, «Усиление подходов к удалению селена», в Devi et al. (ред.), Загрязнение воды селеном , John Wiley & Sons, Хобокен, стр. 319–355, ISBN 978-1-119-69354-3
- Уикс МЭ и Лестер ХМ, 1968, Открытие элементов , 7-е изд., Журнал химического образования , Истон, Пенсильвания.
- Weetman C & Inoue S 2018, Пройденный путь: после элементов основной группы в качестве переходных металлов, ChemCatChem , vol. 10, нет. 19, стр. 4213–4228, два : 10.1002/cctc.201800963
- Welcher SH 2009, Высокие оценки: Regents Chemistry Made Easy , 2-е изд., High Marks Made Easy, Нью-Йорк, ISBN 978-0-9714662-0-3
- Веллер и др. 2018, Неорганическая химия , 7-е изд., Oxford University Press, Оксфорд, ISBN 978-0-19-252295-5
- Уэллс А. Ф. 1984, Структурная неорганическая химия , 5-е изд., Clarendon Press, Оксфорд, ISBN 978-0-19-855370-0
- Уайт Дж. Х. 1962, Неорганическая химия: продвинутый уровень и уровень стипендии , University of London Press, Лондон
- Уайтфорд Г.Х. и Коффин Р.Г. 1939, Основы студенческой химии , 2-е изд., Mosby Co., Сент-Луис
- Уиттен К.В. и Дэвис Р.Э. 1996, Общая химия , 5-е изд., Издательство Saunders College, Филадельфия, ISBN 978-0-03-006188-2
- Вибо П. 1951, Органическая химия , издательство Elsevier, Нью-Йорк.
- Виберг Н. 2001, Неорганическая химия , Academic Press, Сан-Диего, ISBN 978-0-12-352651-9
- Уильямс RPJ 2007, «Жизнь, окружающая среда и наша экосистема», Журнал неорганической биохимии , том. 101, нет. 11–12, дои : 10.1016/j.jinorgbio.2007.07.006
- Windmeier C & Barron RF 2013, «Криогенная технология», в Энциклопедии промышленной химии Ульмана, два : 10.1002/14356007.b03_20.pub2
- Winstel G 2000, «Электролюминесцентные материалы и устройства», в Энциклопедии промышленной химии Ульмана, два : 10.1002/14356007.a09_255
- Висмер Р.К. 1997, Учебное пособие для студентов, Общая химия: принципы и современные применения, 7-е изд., Прентис-Холл, Аппер-Седл-Ривер, ISBN 978-0-13-281990-9
- Вудворд и др. 1999, «Электронная структура оксидов металлов», в Fierro JLG (ред.), Оксиды металлов: химия и применение , CRC Press, Бока-Ратон, ISBN 1-4200-2812-X
- Всемирный экономический форум 2021, Визуализация содержания элементов в земной коре , по состоянию на 21 марта 2024 г.
- Вульфсберг Г. 2000, Неорганическая химия , Университетские научные книги, Саусалито, Калифорния, ISBN 978-1-891389-01-6
- Ямагути М. и Шираи И., 1996, «Дефектные структуры», Столофф Н.С. и Сикка В.К. (ред.), Физическая металлургия и обработка интерметаллических соединений , Chapman & Hall, Нью-Йорк, ISBN 978-1-4613-1215-4
- Ян Дж. 2004, «Теория теплопроводности», в Tritt TM (редактор), Теплопроводность: теория, свойства и приложения , Kluwer Academic/Plenum Publishers, Нью-Йорк, стр. 1–20, ISBN 978-0-306-48327-1
- Инь и др. 2018, Постростовое замещение теллура с помощью водорода в монослои дисульфида молибдена с регулируемым составом, Нанотехнологии , том. 29, № 14, два : 10.1088/1361-6528/aaabe8
- Йодер Ч., Суйдам Ф.Х. и Снавли Ф.А. 1975, Химия , 2-е изд., Харкорт Брейс Йованович, Нью-Йорк, ISBN 978-0-15-506470-6
- Янг Дж.А. 2006, «Йод», Журнал химического образования , том. 83, нет. 9, два : 10.1021/ed083p1285
- Янг и др. 2018, Общая химия: прежде всего атомы , Cengage Learning: Бостон, ISBN 978-1-337-61229-6
- Чжао Дж., Ту З и Чан Ш. 2021, «Механизм углеродной коррозии и стратегии борьбы с ней в топливном элементе с протонообменной мембраной (PEMFC): обзор», Journal of Power Sources , vol. 488, #229434, дои : 10.1016/j.jpowsour.2020.229434
- Жигальский Г.П. и Джонс Б.К. 2003, Физические свойства тонких металлических пленок , Тейлор и Фрэнсис, Лондон, ISBN 978-0-415-28390-8
- Чжу В 2020, Химические элементы в жизни , World Scientific, Сингапур, ISBN 978-981-121-032-7
- Чжу и др. 2014, «Реакции ксенона с железом и никелем предсказаны во внутреннем ядре Земли», Nature Chemistry , vol. 6, два : 10.1038/нхим.1925 , ПМИД 24950336
- Чжу и др. 2022, Введение: основные понятия о боре и его физических и химических свойствах, в «Основах и применениях химии бора» , том. 2, Чжу Ю (редактор), Elsevier, Амстердам, ISBN 978-0-12-822127-3
- Zumdahl SS и DeCoste DJ 2010, Вводная химия: основа , 7-е изд., Cengage Learning, Мейсон, Огайо, ISBN 978-1-111-29601-8
Внешние ссылки
[ редактировать ] СМИ, связанные с неметаллами, на Викискладе?
СМИ, связанные с неметаллами, на Викискладе?



















