Фермент

| Часть серии на |
| Биохимия |
|---|
 |
Ферменты ( / ˈ ɛ n z aɪ m z / ) являются белками , которые действуют как биологические катализаторы, путем ускорения химических реакций . Молекулы , на которых могут действовать ферменты, называются субстратами , а фермент превращает субстраты в различные молекулы, известные как продукты . Почти все метаболические процессы в клетках нуждаются в катализе ферментов , чтобы возникнуть по скоростям достаточно быстро, чтобы поддерживать жизнь. [ 1 ] : 8.1 Метаболические пути зависят от ферментов, чтобы катализировать отдельные шаги. Изучение ферментов называется ферментами , а область анализа псевдоэфермента признает, что во время эволюции некоторые ферменты потеряли способность выполнять биологический катализ, который часто отражается в их аминокислотных последовательностях и необычных псевдокаталитических свойствах. [ 2 ] [ 3 ]
Известно, что ферменты катализируют более 5000 типов биохимических реакций. [ 4 ]
Другими биокатализаторами являются каталитические молекулы РНК , также называемые рибозимами . Иногда они описываются как тип фермента, а не как фермент, но даже в течение десятилетий после открытия рибозимов в 1980-1982 годах слово только слово фермент часто означает конкретно тип белка (как используется в этой статье).
фермента Специфичность исходит из его уникальной трехмерной структуры .

Как и все катализаторы, ферменты увеличивают скорость реакции , снижая энергию ее активации . Некоторые ферменты могут сделать свое преобразование субстрата в продукт, в течение всего миллионов раз быстрее. Чрезвычайным примером является оротидин 5'-фосфат декарбоксилаза , которая позволяет реакции, которая в противном случае потребовалось бы миллионы лет, на миллисекундах. [ 5 ] [ 6 ] Химически ферменты похожи на любой катализатор и не потребляются в химических реакциях, а также не изменяют равновесие реакции. Ферменты отличаются от большинства других катализаторов, будучи гораздо более специфическими. На активность ферментов может влиять другие молекулы: ингибиторы представляют собой молекулы, которые снижают активность фермента, а активаторами являются молекулы, которые увеличивают активность. Многие терапевтические препараты и яды являются ингибиторами ферментов. Активность фермента заметно уменьшается вне его оптимальной температуры и рН , и многие ферменты (постоянно) денатурируются при воздействии чрезмерного тепла, теряя свою структуру и каталитические свойства.
Некоторые ферменты используются в коммерческих целях, например, в синтезе антибиотиков . Некоторые домохозяйственные продукты используют ферменты для ускорения химических реакций: ферменты в биологических порошках для промывки разбивают белок, крахмал или жировые пятна на одежде, а ферменты в мясном тендереозере разбивают белки на более мелкие молекулы, что облегчает мясо.
Этимология и история

К концу 17 и начала 18 -го веков пищеварение мяса выделителей желудка [ 7 ] и преобразование крахмала в сахар с помощью растительных экстрактов и слюны было известно, но механизмы, с помощью которых они произошли, не были идентифицированы. [ 8 ]
Французский химик Ансельм Пейен был первым, кто обнаружил фермент, диастаза , в 1833 году. [ 9 ] Через несколько десятилетий, изучая ферментацию сахара в алкоголь с помощью дрожжей , Луи Пастер пришел к выводу, что эта ферментация была вызвана жизненно важной силой, содержащейся в дрожжевых клетках, называемых «ферментами», которые, как считалось, функционировало только в живых организмах. Он писал, что «алкогольная ферментация - это акт коррелирует с жизнью и организацией дрожжевых клеток, а не с смертью или гниением клеток». [ 10 ]
В 1877 году немецкий физиолог Вильгельм Кюне (1837–1900) впервые использовал термин фермент , который поступает из древнегреческого ἔνζυμον (énzymon), « в дрожжах», чтобы описать этот процесс. [ 11 ] Слово фермент использовался позже для обозначения неживых веществ, таких как пепсин , и слово фермент использовалось для обозначения химической активности, создаваемой живыми организмами. [ 12 ]
Эдуард Бухнер представил свою первую статью об изучении дрожжевых экстрактов в 1897 году. В серии экспериментов в Берлинском университете он обнаружил, что сахар ферментируется дрожжевыми экстрактами, даже когда в смеси не было живых дрожжевых клеток. [ 13 ] Он назвал фермент, который привел к ферментации сахарозы " Zymase ". [ 14 ] В 1907 году он получил Нобелевскую премию по химии за «его открытие бесклеточного ферментации». Следуя примеру Бухнера, ферменты обычно названы в соответствии с реакцией, которую они выполняют: суффикс -са объединяется с именем субстрата ( например, лактаза -это фермент, который расщепляет лактозу ) или тип реакции (например, ДНК -полимер формирует ДНК -полимеры). [ 15 ]
Биохимическая идентичность ферментов была до сих пор неизвестна в начале 1900 -х годов. Многие ученые наблюдали, что ферментативная активность была связана с белками, но другие (такие как Нобелевский лауреат Ричард Уилстаттер ) утверждали, что белки были просто носителями для истинных ферментов и что белки как таковые не способны к катализу. [ 16 ] В 1926 году Джеймс Б. Самнер показал, что ферментная уреаза была чистым белком и кристаллизовал его; Он сделал также для ферментной каталазы в 1937 году. Вывод о том, что чистые белки могут быть ферментами, был окончательно продемонстрирован Джоном Ховардом Нортропом и Венделлом Мередитом Стэнли , которые работали над пищеварительными ферментами Пепсин (1930), трипсин и химотрипсин . Эти три ученых были удостоены Нобелевской премии 1946 года по химии. [ 17 ]
Открытие того, что ферменты могут быть кристаллизованы, в конечном итоге позволило решить их структуры с помощью рентгеновской кристаллографии . Это было впервые сделано для лизоцима , фермента, обнаруженного в слезах, слюне и яичных белках , которые переваривают покрытие некоторых бактерий; Структура была решена группа во главе с Дэвидом Чилтоном Филлипсом и опубликованной в 1965 году. [ 18 ] Эта структура с высоким разрешением лизоцима отмечала начало области структурной биологии и усилия по пониманию того, как ферменты работают на атомном уровне детализации. [ 19 ]
Классификация и номенклатура
Ферменты могут быть классифицированы по двум основным критериям: либо сходство аминокислотной последовательности (и, следовательно, эволюционная взаимосвязь) или ферментативная активность.
Активность фермента . Название фермента часто происходит от его субстрата или химической реакции, которую он катализирует, со словом, заканчивающимся в -азой . [ 1 ] : 8.1.3 Примерами являются лактаза , алкогольдегидрогеназа и ДНК -полимераза . Различные ферменты, которые катализируют одну и ту же химическую реакцию, называются изозимами . [ 1 ] : 10.3
Международный союз биохимии и молекулярной биологии разработал номенклатуру для ферментов, числа ЕС (для «Комиссии по ферментативности») . Каждый фермент описывается «ЕС», за которой следует последовательность из четырех чисел, которые представляют иерархию ферментативной активности (от очень общего до очень специфического). То есть первое число широко классифицирует фермент на основе его механизма, в то время как другие цифры добавляют все больше и больше специфичности. [ 20 ]
Классификация верхнего уровня:
- ЕС 1, оксидоредуктазы : катализируют окисления /восстановления реакции
- EC 2, трансферазы : переносить функциональную группу ( например, метила или фосфатная группа)
- EC 3, Гидролазы : катализируйте гидролиз различных связей
- EC 4, Lyases : расщепление различных связей с помощью, кроме гидролиза и окисления
- EC 5, изомеразы : катализируйте изменения изомеризации в одной молекуле
- EC 6, Лигазы : соединяйте две молекулы с ковалентными связями .
- EC 7, трансаказы : катализируйте движение ионов или молекул через мембраны или их разделение в мембранах.
Эти разделы подразделяются другими функциями, такими как субстрат, продукты и химический механизм . Фермент полностью указан по четырем численным обозначениям. Например, гексокиназа (EC 2.7.1.1) представляет собой трансферазу (EC 2), которая добавляет фосфатную группу (EC 2.7) в гексозный сахар, молекула, содержащая спиртовую группу (EC 2.7.1). [ 21 ]
Сходство последовательности . Категории ЕС не отражают сходства последовательности. Например, две лигазы того же числа ЕС, которые катализируют точно одинаковую реакцию, могут иметь совершенно разные последовательности. Независимо от их функции, ферменты, как и любые другие белки, были классифицированы по сходству последовательностей на многочисленные семейства. Эти семьи были задокументированы в десятках различных баз данных семейства белков и белков, таких как PFAM . [ 22 ]
Не-гомологичные изофункциональные ферменты . Несвязанные ферменты, обладающие одинаковой ферментативной активностью, были названы нехологичными изофункциональными ферментами . [ 23 ] Горизонтальный перенос генов может распространять эти гены до не связанных видов, особенно бактерий, где они могут заменить эндогенные гены той же функции, что приводит к смещению дон-гомологичного гена.
Структура

Ферменты, как правило, представляют собой глобулярные белки , действующие в одиночку или в более крупных комплексах . Последовательность аминокислот указывает структуру, которая, в свою очередь, определяет каталитическую активность фермента. [ 24 ] Хотя структура определяет функцию, новая ферментативная активность еще не может быть предсказана только из структуры. [ 25 ] Ферментные структуры разворачиваются ( денатуру ) при нагревании или подверженности химическим денатурирующим средствам, и это нарушение в структуре обычно вызывает потерю активности. [ 26 ] Денатурация фермента обычно связана с температурами выше нормального уровня вида; В результате ферменты из бактерий, живущих в вулканических средах, таких как горячие источники, ценятся промышленными пользователями за их способность функционировать при высоких температурах, что позволяет реакциям, катализируемым ферментами, работать с очень высокой скоростью.
Ферменты обычно намного больше, чем их субстраты. Размеры варьируются только от 62 аминокислотных остатков, для мономера таутомеразы 4-оксалокротонат , [ 27 ] до более чем 2500 остатков в синтазе животных жирных кислот . [ 28 ] Только небольшая часть их структуры (около 2–4 аминокислот) непосредственно участвует в катализе: каталитический сайт. [ 29 ] Этот каталитический сайт расположен рядом с одним или несколькими сайтами связывания , где остатки ориентируют субстраты. фермента Каталитический сайт и сайт связывания вместе составляют активный сайт . Оставшееся большинство структуры фермента служит для поддержания точной ориентации и динамики активного сайта. [ 30 ]
В некоторых ферментах ни одна аминокислоты не участвует непосредственно в катализе; Вместо этого фермент содержит сайты для связывания и ориентации каталитических кофакторов . [ 30 ] Ферментные структуры также могут содержать аллостерические сайты , где связывание небольшой молекулы вызывает конформационное изменение , которое увеличивает или уменьшает активность. [ 31 ]
Существует небольшое количество РНК на основе биологических катализаторов , которые снова могут действовать в одиночку или в комплексе с белками. Наиболее распространенной из них является рибосома , которая является комплексом белковых и каталитических компонентов РНК. [ 1 ] : 2.2
Механизм

Привязка субстрата
Ферменты должны связывать свои субстраты, прежде чем они смогут катализировать любую химическую реакцию. Ферменты обычно очень специфичны в отношении того, какие субстраты они связывают, а затем химическая реакция катализировалась. Специфичность достигается путем связывания карманов с комплементарной формой, зарядкой и гидрофильными / гидрофобными характеристиками с субстратами. Следовательно, ферменты могут различать очень сходные молекулы субстрата, как химиселективные , региоселективные и стереоспецифические . [ 32 ]
демонстрирующих высшую специфичность и точность, участвуют в копировании и экспрессии генома Некоторые из ферментов , . Некоторые из этих ферментов имеют механизмы « корректировки ». Здесь фермент, такой как ДНК -полимераза, катализирует реакцию на первом этапе, а затем проверяет, что продукт верен на втором этапе. [ 33 ] Этот двухэтапный процесс приводит к средней частоте ошибок менее 1 ошибки в 100 миллионах реакций в полимеразах млекопитающих с высокой точностью. [ 1 ] : 5.3.1 Аналогичные механизмы корректуры также обнаружены в РНК -полимеразе , [ 34 ] Аминоацил тРНК синтетазы [ 35 ] и рибосомы . [ 36 ]
И наоборот, некоторые ферменты демонстрируют распущенность фермента , имеющие широкую специфичность и действуя на ряд различных физиологически значимых субстратов. Многие ферменты обладают небольшими побочными видами деятельности, которые возникли случайно (т.е. нейтрально ), что может быть отправной точкой для эволюционного выбора новой функции. [ 37 ] [ 38 ]

Модель "Lock and Key"
Чтобы объяснить наблюдаемую специфичность ферментов, в 1894 году Эмиль Фишер предположил, что как фермент, так и субстрат обладают специфическими комплементарными геометрическими формами, которые точно вписываются друг в друга. [ 39 ] Это часто называют моделью «блокировки и ключа». [ 1 ] : 8.3.2 Эта ранняя модель объясняет специфичность фермента, но не может объяснить стабилизацию переходного состояния, которое достигают ферменты. [ 40 ]
Индуцированная модель подгонки
В 1958 году Даниэль Кошленд предложил модификацию модели блокировки и ключей: поскольку ферменты являются довольно гибкими структурами, активный сайт непрерывно изменяется взаимодействием с субстратом, поскольку субстрат взаимодействует с ферментом. [ 41 ] В результате подложка не просто связывается с жестким активным сайтом; Аминокислотные боковые цепи , которые составляют активное участок, формируются в точные положения, которые позволяют ферменту выполнять свою каталитическую функцию. В некоторых случаях, таких как гликозидазы субстрата , молекула также слегка изменяет форму, когда она входит в активный сайт. [ 42 ] Активный сайт продолжает меняться, пока субстрат не будет полностью связан, после чего определяется конечная форма и распределение зарядов. [ 43 ] Индуцированная соответствие может усилить точность молекулярного распознавания в присутствии конкуренции и шума с помощью конформационного механизма корректуры . [ 44 ]
Катализ
Ферменты могут ускорить реакции несколькими способами, все из которых снижают энергию активации (ΔG ‡ , Free Energy Gibbs ) [ 45 ]
- Стабилизируя переходное состояние:
- Создание среды с распределением зарядов, дополняющих среду переходного состояния, для снижения своей энергии [ 46 ]
- Предоставляя альтернативный путь реакции:
- Временно реагировать с подложкой, образуя ковалентное промежуточное соединение для обеспечения более низкого переходного состояния энергии [ 47 ]
- Дестабилизируя основное состояние субстрата:
- Искажение подложки (ы) в их переходном состоянии, чтобы уменьшить энергию, необходимую для достижения переходного состояния [ 48 ]
- Ориентируя субстраты в продуктивное расположение, чтобы уменьшить энтропии реакции изменение [ 49 ] (Вклад этого механизма в катализ относительно невелик) [ 50 ]
Ферменты могут использовать некоторые из этих механизмов одновременно. Например, протеазы, такие как трипсин, выполняют ковалентный катализ с использованием каталитической триады , стабилизируйте наращивание заряда на переходных состояниях с использованием отверстия из оксианиона , полный гидролиз с использованием ориентированного водного субстрата. [ 51 ]
Динамика
Ферменты не являются жесткими, статическими структурами; Вместо этого они имеют сложные внутренние динамические движения, то есть движения частей структуры фермента, такие как индивидуальные аминокислотные остатки, группы остатков, образующих петлю белка или единицу вторичной структуры , или даже целый белковый домен . Эти движения приводят к конформационному ансамблу немного разных структур, которые взаимодействуют друг с другом в равновесии . Различные состояния в этом ансамбле могут быть связаны с различными аспектами функции фермента. Например, различные конформации фермента дигидрофолатредуктазы связаны с связыванием субстрата, катализом, высвобождением кофакторов и этапами высвобождения продукта каталитического цикла, [ 52 ] в соответствии с теорией каталитического резонанса .
Презентация субстрата
В этом разделе нужны дополнительные цитаты для проверки . ( Октябрь 2023 г. ) |
Презентация субстрата - это процесс, в котором фермент секвестрируется вдали от его субстрата. Ферменты могут быть секвестрированы в плазматическую мембрану от субстрата в ядре или цитозоле. Или внутри мембраны, фермент может быть секвестрирован в липидные рафты от его субстрата в неупорядоченной области. Когда фермент выпущен, он смешивается со своей подложкой. Альтернативно, фермент может быть секвестрирован вблизи своего субстрата для активации фермента. Например, фермент может быть растворим и при активации связываться с липидом в плазматической мембране, а затем действовать на молекулах в плазматической мембране.
Аллостерическая модуляция
Аллостерические сайты представляют собой карманы на ферменте, отличные от активного сайта, которые связываются с молекулами в клеточной среде. Эти молекулы затем вызывают изменение конформации или динамики фермента, который трансдуцируется в активный сайт и, таким образом, влияет на скорость реакции фермента. [ 53 ] Таким образом, аллостерические взаимодействия могут либо ингибировать, либо активировать ферменты. Аллостерические взаимодействия с метаболитами вверх по течению или вниз по течению в метаболическом пути фермента вызывают регуляцию обратной связи , изменяя активность фермента в соответствии с потоком через остальную часть пути. [ 54 ]
Кофакторы

Некоторым ферментам не нужны дополнительные компоненты, чтобы показать полную активность. Другие требуют, чтобы небелковые молекулы называли кофакторами, чтобы быть связанными с активностью. [ 55 ] Кофакторы могут быть либо неорганическими (например, ионами металлов и железными кластерами ) или органическими соединениями (например, флавин и гем ). Эти кофакторы служат многим целям; Например, ионы металлов могут помочь в стабилизации нуклеофильных видов в активном участке. [ 56 ] Органические кофакторы могут быть либо коэнзими , которые высвобождаются из активного сайта фермента во время реакции, либо протезными группами , которые тесно связаны с ферментом. Органические протезные группы могут быть ковалентно связаны (например, биотин в ферментах, таких как пируват -карбоксилаза ). [ 57 ]
Примером фермента, который содержит кофактор, является карбоангидраза , которая использует цинковой кофактор, связанный как часть своего активного сайта. [ 58 ] Эти плотно связанные ионы или молекулы обычно встречаются в активном участке и участвуют в катализе. [ 1 ] : 8.1.1 Например, кофакторы Flavin и Heme часто участвуют в окислительно -восстановительных реакциях. [ 1 ] : 17
Ферменты, которые требуют кофактора, но не имеют одной границы, называются апоферментами или апопротеинами . Фермент вместе с кофактором, необходимым для активности, называется голоюзмом (или галоферментом). Термин голофермент также может применяться к ферментам, которые содержат несколько белковых субъединиц, таких как ДНК -полимеразы ; Здесь голоофермент является полным комплексом, содержащим все субъединицы, необходимые для активности. [ 1 ] : 8.1.1
Коэнзименты
Коэнзименты представляют собой небольшие органические молекулы, которые могут быть свободно или тесно связаны с ферментом. Коэнзименты транспортируют химические группы из одного фермента в другой. [ 59 ] Примеры включают NADH , NADPH и аденозин -трифосфат (АТФ). Некоторые коэнзименты, такие как мононуклеотид флавина (FMN), флавин аденин -динуклеотид (FAD), тиамин пирофосфат (TPP) и тетрагидрофолат (THF), получены из витаминов . Эти коэнзименты не могут быть синтезированы с помощью организма de novo , и у диеты должны быть приобретены тесно связанные соединения (витамины). Химические группы, перенесенные, включают в себя:
- гидрид -ион ( h − ), переносится NAD или NADP +
- Фосфатная группа, переносимая аденозин -трифосфатом
- ацетильная группа, переносимая коэнзим А
- формальные, меенильные или метильные группы, переносимые фолиевой кислотой и
- метильная группа, переносимая S-аденозилметионином [ 59 ]
Поскольку коэнзименты химически изменяются в результате действия фермента, полезно считать коэнзименты специальным классом субстратов, или второго субстрата, которые являются общими для многих различных ферментов. Например, известно, что около 1000 ферментов используют коэнзим NADH. [ 60 ]
Коэнзименты обычно непрерывно регенерируются, а их концентрации поддерживаются на устойчивом уровне внутри клетки. Например, NADPH регенерируется через пентозофосфатный путь и S -аденозилметинин с помощью метиониновой аденозилтрансферазы . Эта непрерывная регенерация означает, что небольшие количества коэнзимов можно использовать очень интенсивно. Например, человеческое тело переворачивает свой вес в АТФ каждый день. [ 61 ]
Термодинамика

Как и во всех катализаторах, ферменты не изменяют положение химического равновесия реакции. В присутствии фермента реакция проходит в том же направлении, что и без фермента, более быстро. [ 1 ] : 8.2.3 Например, карбонгидраза катализирует ее реакцию в любом направлении в зависимости от концентрации его реагентов: [ 62 ]
| (в тканях ; высокая CO 2 ) концентрация | ( 1 ) |
| (в легких ; низкая CO 2 ) концентрация | ( 2 ) |
Скорость реакции зависит от энергии активации, необходимой для формирования переходного состояния , которое затем распадается в продукты. Ферменты увеличивают скорость реакции за счет снижения энергии переходного состояния. Во-первых, связывание образует комплекс с низким энергетическим ферментом-субстратом (ES). Во -вторых, фермент стабилизирует переходное состояние так, что для достижения меньшей энергии по сравнению с некатализированной реакцией (ES ‡ ) Наконец, комплекс ферментативного продукта (EP) диссоциирует для высвобождения продуктов. [ 1 ] : 8.3
Ферменты могут соединить две или более реакции, так что термодинамически благоприятная реакция может использоваться для «управления» термодинамически неблагоприятной, чтобы комбинированная энергия продуктов ниже субстратов. Например, гидролиз АТФ часто используется для управления другими химическими реакциями. [ 63 ]
Кинетика
Кинетика фермента - это исследование того, как ферменты связывают субстраты и превращают их в продукты. [ 64 ] Данные скорости, используемые в кинетических анализах, обычно получают из анализа ферментов . В 1913 году Леонор Михаэлис и Мод Леонора Менден предложили количественную теорию кинетики ферментов, которая называется кинетикой Михаэлис -Мюмонти . [ 65 ] Основным вкладом Михаэлиса и Менден было подумать о реакциях ферментов на двух этапах. Во-первых, субстрат обратимо связывается с ферментом, образуя комплекс фермента-субстрата. Иногда это называется комплексом Михаэлиса -Ментена в их честь. Затем фермент катализирует химическую стадию в реакции и высвобождает продукт. Эта работа была дополнительно разработана Г. Э. Бриггсом и Дж. Б. С. Халдейном , которые вывели кинетические уравнения, которые до сих пор широко используются сегодня. [ 66 ]
Скорости фермента зависят от условий раствора и концентрации субстрата . Чтобы найти максимальную скорость ферментативной реакции, концентрация субстрата увеличивается до тех пор, пока не будет замечена постоянная скорость образования продукта. Это показано в кривой насыщения справа. Насыщение происходит потому, что по мере увеличения концентрации субстрата все больше и больше свободного фермента превращается в комплекс ES-связанного субстрата. При максимальной скорости реакции ( v max ) фермента все активные сайты фермента связаны с субстратом, а количество ES -комплекса совпадает с общим количеством фермента. [ 1 ] : 8.4
V MAX - только один из нескольких важных кинетических параметров. Количество субстрата, необходимое для достижения заданной скорости реакции, также важно. Это дается константа Михаэлис-Менден ( K M ), которая представляет собой концентрацию субстрата, необходимая для фермента, чтобы достичь половины максимальной скорости реакции; Как правило, каждый фермент имеет характерный K M для данного субстрата. Другая полезная константа - K Cat , также называемая номером оборота , который представляет собой количество молекул субстрата, обрабатываемые одним активным сайтом в секунду. [ 1 ] : 8.4
Эффективность фермента может быть выражена с точки K Cat / K M. зрения Это также называется постоянной специфичностью и включает в себя константы скорости для всех этапов реакции вплоть до первого необратимого шага. Поскольку константа специфичности отражает как аффинность, так и каталитическую способность, она полезна для сравнения различных ферментов друг с другом или одного и того же фермента с разными субстратами. Теоретический максимум для константы специфичности называется пределом диффузии и составляет около 10 8 до 10 9 (М −1 с −1 ) На этом этапе каждое столкновение фермента с его субстратом приведет к катализу, а скорость образования продукта не ограничена скоростью реакции, а скоростью диффузии. Ферменты с этим свойством называются каталитически совершенными или кинетически идеальными . Примером таких ферментов являются триозо-фосфат изомераза , карбоангидраза , ацетилхолинэстераза , каталаза , фумараза , β-лактамаза и супероксиддисмутаза . [ 1 ] : 8.4.2 Оборот таких ферментов может достигать нескольких миллионов реакций в секунду. [ 1 ] : 9.2 Но большинство ферментов далеки от совершенства: средние значения и около и , соответственно. [ 67 ]
Кинетика Михаэлиса - Мюмом зависит от закона массовых действий , который получен из предположений свободной диффузии и термодинамического случайного столкновения. Многие биохимические или клеточные процессы значительно отклоняются от этих условий из -за макромолекулярной толпы и ограниченного молекулярного движения. [ 68 ] Более поздние, сложные расширения модели пытаются исправить эти эффекты. [ 69 ]
Торможение
Скорость реакции фермента может быть снижена различными типами ингибиторов ферментов. [ 70 ] : 73–74
Типы запрета
Конкурентоспособный
и Конкурентный ингибитор субстрат не могут связываться с ферментом одновременно. [ 71 ] Часто конкурентные ингибиторы сильно напоминают настоящий субстрат фермента. Например, метотрексат препарата является конкурентным ингибитором фермента дигидрофолатредуктазы , которая катализирует снижение дигидрофолата до тетрагидрофолата. [ 72 ] Сходство между структурами дигидрофолата и этого препарата показано на сопровождающей фигуре. Этот тип ингибирования может быть преодолен с высокой концентрацией субстрата. В некоторых случаях ингибитор может связываться с сайтом, отличным от сайта связывания обычного субстрата и оказывать аллостерический эффект , чтобы изменить форму обычного сайта связывания. [ 73 ]
Неконкурентный
связывается Неконкурентный ингибитор с сайтом, кроме того, где связывает субстрат. Субстрат все еще связывается со своей обычной аффинностью, и, следовательно, K M остается прежним. Однако ингибитор снижает каталитическую эффективность фермента, так что V MAX снижается. В отличие от конкурентного ингибирования, неконкурентное ингибирование не может быть преодолена с высокой концентрацией субстрата. [ 70 ] : 76–78
Неконкурентоспособность
не Неконкурентоспособный ингибитор может связываться со свободным ферментом, только с комплексом фермента-субстрата; Следовательно, эти типы ингибиторов наиболее эффективны при высокой концентрации субстрата. В присутствии ингибитора комплекс фермента-субстрата неактивен. [ 70 ] : 78 Этот тип торможения встречается редко. [ 74 ]
Смешанный
связывается Смешанный ингибитор с аллостерическим сайтом, а связывание субстрата и ингибитор влияет друг на друга. Функция фермента снижается, но не устраняется при связи с ингибитором. Этот тип ингибитора не следует уравнению Михаэлиса -Менден. [ 70 ] : 76–78
Необратимый
постоянно Необратимый ингибитор инактивирует фермент, обычно образуя ковалентную связь с белком. [ 75 ] Пенициллин [ 76 ] и аспирин [ 77 ] являются обычными лекарствами, которые действуют таким образом.
Функции ингибиторов
Во многих организмах ингибиторы могут действовать как часть механизма обратной связи . Если фермент продуцирует слишком много одного вещества в организме, это вещество может действовать как ингибитор фермента в начале пути, который его производит, вызывая выработку вещества замедляться или останавливаться, когда существует достаточное количество. Это форма отрицательной обратной связи . Основные метаболические пути, такие как цикл лимонной кислоты, используют этот механизм. [ 1 ] : 17.2.2
Поскольку ингибиторы модулируют функцию ферментов, они часто используются в качестве лекарств. Многие такие препараты являются обратимыми конкурентными ингибиторами, которые напоминают нативный субстрат фермента, аналогичный метотрексату выше; Другие известные примеры включают статины, используемые для лечения высокого уровня холестерина , [ 78 ] и ингибиторы протеазы, используемые для лечения ретровирусных инфекций, таких как ВИЧ . [ 79 ] Общим примером необратимого ингибитора, который используется в качестве препарата, является аспирин , который ингибирует ферменты COX-1 и COX-2 которые продуцируют воспаления простагландин , . [ 77 ] Другие ингибиторы фермента являются ядами. Например, ядовитый цианид является необратимым ингибитором фермента, который в сочетании с медью и железом в активном сайте фермента цитохром С оксидазы и блокирует клеточное дыхание . [ 80 ]
Факторы, влияющие на активность ферментов
Поскольку ферменты состоят из белков, их действия чувствительны к изменению многих физических химических факторов, таких как pH, температура, концентрация субстрата и т. Д.
Следующая таблица показывает оптимуму pH для различных ферментов. [ 81 ]
| Фермент | Оптимальный pH | PH Описание |
|---|---|---|
| Пепсин | 1.5–1.6 | Высококислый |
| Инвертаза | 4.5 | Кислый |
| Липаза (желудок) | 4.0–5.0 | Кислый |
| Липаза (касторовое масло) | 4.7 | Кислый |
| Липаза (поджелудочная железа) | 8.0 | Щелочный |
| Амилаза (солод) | 4.6–5.2 | Кислый |
| Амилаза (поджелудочная железа) | 6.7–7.0 | Кислый нейтральный |
| Cellobiase | 5.0 | Кислый |
| Малтаза | 6.1–6.8 | Кислый |
| Он отстой | 6.2 | Кислый |
| Каталаза | 7.0 | Нейтральный |
| Уреада | 7.0 | Нейтральный |
| Холинэстераза | 7.0 | Нейтральный |
| Рибонуклеаза | 7.0–7.5 | Нейтральный |
| Фумараза | 7.8 | Щелочный |
| Трипсин | 7.8–8.7 | Щелочный |
| Аденозин трифосфат | 9.0 | Щелочный |
| Аргиназа | 10.0 | Высоко щелочная |
Биологическая функция
Ферменты служат широкому разнообразию функций внутри живых организмов. Они необходимы для передачи сигнала и регуляции клеток, часто через киназы и фосфатазы . [ 82 ] Они также генерируют движение, с миозином гидролизующим аденозин -трифосфат (АТФ) для создания сокращения мышц , а также транспортируют груз вокруг клетки в рамках цитоскелета . [ 83 ] Другие АТФазы в клеточной мембране представляют собой ионные насосы, участвующие в активном транспорте . Ферменты также участвуют в более экзотических функциях, таких как люцифераза, генерирующие свет у светлячков . [ 84 ] Вирусы также могут содержать ферменты для инфицирования клеток, таких как ВИЧ интеграза и обратная транскриптаза , или для высвобождения вируса из клеток, таких как гриппа вируса нейрораминидаза . [ 85 ]
Важная функция ферментов заключается в пищеварительных системах животных. Ферменты, такие как амилазы и протеазы, разбивают большие молекулы ( крахмал или белки соответственно) на более мелкие, поэтому они могут поглощаться кишечником. Например, молекулы крахмала слишком велики, чтобы их поглощать из кишечника, но ферменты гидролизуют цепи крахмала в более мелкие молекулы, такие как мальтоза и в конечном итоге глюкозу , которые затем можно поглощать. Различные ферменты переваривают разные пищевые вещества. У жвачных животных , которые имеют травоядные диеты, микроорганизмы в кишечнике продуцируют другой фермент, целлюлазу , чтобы разрушить целлюлозные клеточные стенки растительного волокна. [ 86 ]
Метаболизм
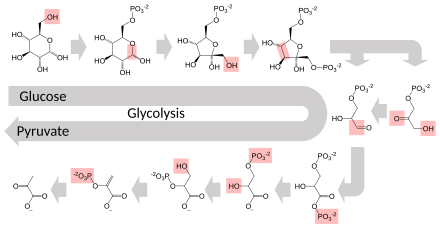
Несколько ферментов могут работать вместе в определенном порядке, создавая метаболические пути . [ 1 ] : 30.1 В метаболическом пути один фермент принимает продукт другого фермента в качестве субстрата. После каталитической реакции продукт затем передается в другой фермент. Иногда более одного фермента может катализировать ту же реакцию параллельно; Это может позволить более сложную регуляцию: например, с низкой постоянной активностью, обеспечиваемой одним ферментом, но индуцируемой высокой активностью второго фермента. [ 87 ]
Ферменты определяют, какие шаги происходят в этих путях. Без ферментов метаболизм не будет прогрессировать на одних и тех же шагах и не мог бы регулироваться для удовлетворения потребностей клетки. Большинство центральных метаболических путей регулируются на нескольких ключевых этапах, как правило, через ферменты, активность которых включает гидролиз АТФ. Поскольку эта реакция выделяет столько энергии, другие реакции, которые термодинамически неблагоприятны , могут быть связаны с гидролизом АТФ, что ведет общую серию связанных метаболических реакций. [ 1 ] : 30.1
Контроль деятельности
Есть пять основных способов, которыми ферментная активность контролируется в клетке. [ 1 ] : 30.1.1
Регулирование
Ферменты могут быть активированы или ингибированы другими молекулами. Например, конечный продукт (ы) метаболического пути часто являются ингибиторами для одного из первых ферментов пути (обычно первого необратимого шага, называемого преданным шагом), что регулирует количество конечного продукта, сделанного путями. Такой регуляторный механизм называется механизмом отрицательной обратной связи , потому что количество полученного конечного продукта регулируется собственной концентрацией. [ 88 ] : 141–48 Механизм отрицательной обратной связи может эффективно корректировать скорость синтеза промежуточных метаболитов в соответствии с требованиями клеток. Это помогает с эффективным распределением материалов и энергетической экономики, и это предотвращает избыточное производство конечных продуктов. Как и другие гомеостатические устройства , контроль ферментативных действий помогает поддерживать стабильную внутреннюю среду в живых организмах. [ 88 ] : 141
Посттрансляционная модификация
Примеры посттрансляционной модификации включают фосфорилирование , миристоилирование и гликозилирование . [ 88 ] : 149–69 Например, в ответ на инсулин фосфорилирование сахара множественных ферментов, включая гликогенсинтазу , помогает контролировать синтез или деградацию гликогена и позволяет клетке реагировать на изменения в крови . [ 89 ] Другим примером посттрансляционной модификации является расщепление полипептидной цепи. Химотрипсин , пищеварительная протеаза, вырабатывается в неактивной форме в виде химотрипсиногена в поджелудочной железе и транспортируется в этой форме в желудок , где он активируется. Это мешает ферменту переваривать поджелудочную железу или другие ткани, прежде чем он попадет в кишку. Этот тип неактивного предшественника фермента известен как зимоген [ 88 ] : 149–53 или пронзим.
Количество
Продукция фермента ( транскрипция и трансляция генов ферментов) может быть усилена или уменьшена клеткой в ответ на изменения в среде клетки. Эта форма регуляции генов называется индукцией фермента . Например, бактерии могут стать устойчивыми к антибиотикам, таким как пенициллин , потому что ферменты, называемые бета-лактамазами , индуцируются, которые гидролизируют важнейшее бета-лактамное кольцо в молекуле пенициллина. [ 90 ] Другой пример поступает из ферментов в печени , называемых цитохромом P450 оксидазами , которые важны для метаболизма лекарств . Индукция или ингибирование этих ферментов может вызывать лекарственные взаимодействия . [ 91 ] Уровни ферментов также могут регулироваться путем изменения скорости деградации ферментов . [ 1 ] : 30.1.1 Противоположностью индукции фермента является репрессия фермента .
Субклеточное распределение
Ферменты могут быть разделены, с различными метаболическими путями, встречающимися в различных клеточных компартментах . Например, жирные кислоты синтезируются одним набором ферментов в цитозоле , эндоплазматической ретикулуме и гольджи и используются другим набором ферментов в качестве источника энергии в митохондриях посредством β-окисления . [ 92 ] Кроме того, перенос фермента в различные компартменты может изменить степень протонирования (например, нейтральная цитоплазма и кислотная лизосома ) или окислительного состояния (например, окисление периплазмы или снижение цитоплазмы ), что, в свою очередь, влияет на активность фермента. [ 93 ] В отличие от разбиения на органеллы, связанные с мембраной, ферментная субклеточная локализация также может быть изменена путем полимеризации ферментов в макромолекулярные цитоплазматические филаменты. [ 94 ] [ 95 ]
Специализация органов
У многоклеточных эукариот клетки в разных органах и тканях имеют разные паттерны экспрессии генов и, следовательно, имеют различные наборы ферментов (известные как изозимы ), доступные для метаболических реакций. Это обеспечивает механизм регулирования общего метаболизма организма. Например, гексокиназа , первый фермент в пути гликолиза , имеет специализированную форму, называемую глюкокиназой, экспрессируемой в печени и поджелудочной железе , которая имеет более низкую аффинность к глюкозе, но более чувствительна к концентрации глюкозы. [ 96 ] Этот фермент участвует в восприятии сахара в крови и регулировании производства инсулина. [ 97 ]
Участие в болезнях


Поскольку жесткий контроль активности фермента необходим для гомеостаза , любая неисправность (мутация, перепроизводство, недопродукция или делеция) одного критического фермента может привести к генетическому заболеванию. Неисправность только одного типа фермента из тысяч типов, присутствующих в организме человека, может быть фатальной. Примером смертельного генетического заболевания из -за недостаточности фермента является заболевание Tay -Sachs фермента , при которой пациентам не хватает гексосаминидазы . [ 98 ] [ 99 ]
Одним из примеров дефицита фермента является наиболее распространенный тип фенилкетонурии . Многие различные одно аминокислотные мутации в ферментной фенилаланиновой гидроксилазе , которая катализирует первую стадию в деградации фенилаланина , приводят к наращиванию фенилаланина и родственных продуктов. Некоторые мутации находятся в активном сайте, непосредственно нарушая связывание и катализ, но многие из них далеки от активного сайта и снижают активность, дестабилизируя структуру белка или влияя на правильную олигомеризацию. [ 100 ] [ 101 ] Это может привести к интеллектуальной инвалидности , если болезнь не лечится. [ 102 ] Другим примером является дефицит псевдохолинэстеразы , в котором способность организма разрушать лекарства от эфира холина нарушена. [ 103 ] Пероральное введение ферментов может использоваться для лечения некоторых функциональных дефицитов ферментов, таких как недостаточность поджелудочной железы [ 104 ] и непереносимость лактозы . [ 105 ]
Другой способ неисправности ферментов может вызвать заболевание, возникающие в результате мутаций зародышевой линии в генах, кодирующих ферменты репарации ДНК . Дефекты в этих ферментах вызывают рак, потому что клетки менее способны восстанавливать мутации в своих геномах . Это вызывает медленное накопление мутаций и приводит к развитию рака . Примером такого наследственного синдрома рака является Xeroderma Pigmentosum , который вызывает развитие рака кожи в ответ даже на минимальное воздействие ультрафиолетового света . [ 106 ] [ 107 ]
Эволюция
Подобно любому другому белке, ферменты меняются во времени посредством мутаций и дивергенции последовательностей. Учитывая их центральную роль в метаболизме , эволюция ферментов играет критическую роль в адаптации . Поэтому ключевой вопрос заключается в том, могут ли и как ферменты могут изменить свою ферментативную деятельность вместе. Общепринято, что многие новые ферментные активности развивались благодаря дублированию генов и мутации дублирующих копий, хотя эволюция также может произойти без дублирования. Одним из примеров фермента, который изменил его активность, является предок метионил-аминопептидазы (MAP) и креатин-амидиногидролаза ( креатиназа ), которые явно гомологичны, но катализируют очень разные реакции (карта удаляет аминоконцеминальный метионин в новых белках, в то время как креатив-гидролизы для креатина на карту для креатина на карту Саркозин и мочевина ). Кроме того, карта зависит от металлической ионины, в то время как креатаза не является, следовательно, это свойство также было потеряно с течением времени. [ 108 ] Небольшие изменения ферментативной активности чрезвычайно распространены среди ферментов. В частности, специфичность связывания субстрата (см. Выше) может легко и быстро измениться с помощью отдельных аминокислотных изменений в своих карманах для связывания субстрата. Это часто встречается в основных классах ферментов, таких как киназы . [ 109 ]
Искусственная (in vitro) эволюция в настоящее время обычно используется для изменения активности ферментов или специфичности для промышленных применений (см. Ниже).
Промышленные применения
Ферменты используются в химической промышленности и других промышленных применениях, когда требуются чрезвычайно специфические катализаторы. Ферменты в целом ограничены в количестве реакций, которые они развивались на катализирование, а также из -за отсутствия стабильности в органических растворителях и при высоких температурах. Как следствие, белковая инженерия является активной областью исследований и включает в себя попытки создать новые ферменты с новыми свойствами, либо посредством рационального дизайна, либо эволюции in vitro . [ 110 ] [ 111 ] Эти усилия стали успешными, и теперь несколько ферментов были разработаны «с нуля», чтобы катализировать реакции, которые не встречаются в природе. [ 112 ]
Смотрите также
Ферментные базы данных
Ссылки
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. ведущий с Т в Stryer L, Berg JM, JL Tymical (2002). Биохимики (5 -е изд.). Сан -Франциско: WH Freeman. Я 0-7167-4955-6 .

- ^ Мерфи Дж. М., Фархан Х, Эйерс П.А. (апрель 2017 г.). «Био-зомби: рост псевдоферментов в биологии». Биохимическое общество транзакций . 45 (2): 537–544. doi : 10.1042/bst20160400 . PMID 28408493 .
- ^ Murphy JM, Zhang Q, Young SN, Reese ML, Bailey FP, Eyers PA, et al. (Январь 2014). «Надежная методология подклассификации псевдокиназ на основе их нуклеотидсвязывающих свойств» . Биохимический журнал . 457 (2): 323–334. doi : 10.1042/bj20131174 . PMC 5679212 . PMID 24107129 .
- ^ Schomburg I, Chang A, Placzek S, Söhngen C, Rother M, Lang M, et al. (Январь 2013). «Бренда в 2013 году: интегрированные реакции, кинетические данные, данные о функции ферментов, улучшенная классификация заболевания: новые варианты и содержание в Бренде» . Исследование нуклеиновых кислот . 41 (выпуск базы данных): D764 - D772. doi : 10.1093/nar/gks1049 . PMC 3531171 . PMID 23203881 .
- ^ Радзицка А., Вольфенден Р. (январь 1995 г.). «Опытный фермент». Наука . 267 (5194): 90–93. Bibcode : 1995sci ... 267 ... 90r . doi : 10.1126/science.7809611 . PMID 7809611 . S2CID 8145198 .
- ^ Callahan BP, Miller BG (декабрь 2007 г.). «Омпарбоксилаза-загадка сохраняется». Биоорганическая химия . 35 (6): 465–469. doi : 10.1016/j.bioorg.2007.07.004 . PMID 17889251 .
- ^ Де Реймур Р.А. (1752). «Наблюдения за пищеварением птиц». История Королевской научной академии . 1752 : 266, 461.
- ^ Уильямс Х.С. (1904). История науки: в пяти томах . Том IV: Современное развитие химических и биологических наук . Харпер и братья.
- ^ Payen A, Persoz JF (1833). «Память на диастазе, основные продукты ее реакций и их применение к промышленным искусствам» [Мемуар на диастазе, основной продукт его реакций и их применение для промышленного искусства]. Анналы химии и физики . 2 -й (по -французски). 53 : 73–92.
- ^ Манчестер К.Л. (декабрь 1995 г.). «Луи Пастер (1822–1895)-шанс и подготовленный ум». Тенденции в биотехнологии . 13 (12): 511–515. doi : 10.1016/s0167-7799 (00) 89014-9 . PMID 8595136 .
- ^ Кюн придумал слово «фермент» в: Kühne W (1877). «О поведении различных организованных и так называемых неподвижных ферментов» [о поведении различных организованных и так называемых не сформулированных ферментов]. Переговоры ассоциации медицина естественной истории в Гейдельберге . Новая серия (на немецком языке). 1 (3): 190–193. Соответствующий отрывок на стр. 190: «Чтобы предотвратить недоразумения и избежать раздражающих описаний, докладчики предполагают, что неразрешенные или неорганизованные ферменты, эффект которого может происходить без наличия организмов и за пределами того же, как ферменты ». (Перевод: чтобы устранить недоразумения и избежать громоздких перифраз, [автор, преподаватель университета] предполагает обозначение как «фермент», не сформированные или не организованные ферменты, чье действие может произойти без присутствия организма и издания того же самого.
- ^ Холмс Ф.Л. (2003). «Ферменты» . В Хейлброне JL (ред.). Оксфордский компаньон истории современной науки . Оксфорд: издательство Оксфордского университета. п. 270. ISBN 9780199743766 .
- ^ "Эдуард Бухнер" . Нобелевская лауреат биография . Nobelprize.org . Получено 23 февраля 2015 года .
- ^ «Эдуард Бухнер-Нобелевская лекция: бесклеточная ферментация» . Nobelprize.org . 1907 . Получено 23 февраля 2015 года .
- ^ Наименование ферментов путем добавления суффикса «-аза» к субстрату, на котором действует фермент, был прослежено французским ученым Эмиле Дюкло (1840–1904), который намеревался почтить дальности диастазы -первый энзим изолирован - введя эту практику в его книге Duclaux E (1899). Договор о микробиологии: диастазы, токсины и яды [ Микробиологический трактат: диастазы, токсины и яды ] (на французском языке). Париж, Франция: Массон и Ко. См. Главу 1, особенно стр. 9.
- ^ Willstätter R (1927). «Лекция Фарадея. Проблемы и методы в исследовании ферментов». Журнал химического общества (возобновление) : 1359–1381. doi : 10.1039/jr9270001359 . цитируется в Удар D (апрель 2000 г.). "Так мы понимаем, как работают ферменты?" Полем Структура 8 (4): R77 - R81. doi : 10.1016/s0969-2126 (00) 00125-8 . PMID 10801479 .
- ^ «Нобелевские призы и лауреаты: Нобелевская премия по химии 1946 года» . Nobelprize.org . Получено 23 февраля 2015 года .
- ^ Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR (май 1965). «Структура куриного яичного лизоцима. Трехмерный синтез Фурье при 2 Angstrom разрешении». Природа . 206 (4986): 757–761. Bibcode : 1965natur.206..757b . doi : 10.1038/206757a0 . PMID 5891407 . S2CID 4161467 .
- ^ Джонсон Л.Н., Петско Г.А. (июль 1999 г.). «Дэвид Филлипс и происхождение структурной фермеры». Тенденции в биохимических науках . 24 (7): 287–289. doi : 10.1016/s0968-0004 (99) 01423-1 . PMID 10390620 .
- ^ Мосс GP. «Рекомендации Комитета по номенклатуре Международного союза биохимии и молекулярной биологии по номенклатуре и классификации ферментов по реакциям, которые они катализируют» . Международный союз биохимии и молекулярной биологии . Получено 28 августа 2021 года .
- ^ Комитет по номенклатуру. "EC 2.7.1.1" . Международный союз биохимии и молекулярной биологии (NC-IUBMB) . Школа биологических и химических наук, королева Мария, Лондонский университет. Архивировано с оригинала 1 декабря 2014 года . Получено 6 марта 2015 года .
- ^ Малдер Нью -Джерси (28 сентября 2007 г.). «Базы данных семейства белков». эл . Чичестер, Великобритания: John Wiley & Sons, Ltd. с. A0003058.Pub2. doi : 10.1002/9780470015902.a0003058.pub2 . ISBN 978-0-470-01617-6 .
- ^ Omelchenko MV, Galperin MY, Wolf Yi, Koonin EV (апрель 2010 г.). «Не-гомологичные изофункциональные ферменты: систематический анализ альтернативных решений в эволюции ферментов» . Биология прямой . 5 (1): 31. doi : 10.1186/1745-6150-5-31 . PMC 2876114 . PMID 20433725 .
- ^ Anfinsen CB (июль 1973 г.). «Принципы, которые регулируют складывание белковых цепей». Наука . 181 (4096): 223–230. Bibcode : 1973sci ... 181..223a . doi : 10.1126/science.181.4096.223 . PMID 4124164 .
- ^ Dunawy-Mariano D (ноябрь 2008 г.). «Открытие функции фермента» . Структура 16 (11): 1599–1600. doi : 10.1016/j.str.2008.10.001 . PMID 19000810 .
- ^ Петско Г.А., Ринг Д. (2003). «Глава 1: от последовательности к структуре» . Структура и функция белка . Лондон: новая наука. п. 27. ISBN 978-1405119221 .
- ^ Чен Л.Х., Кенион Г.Л., Кертин Ф., Харайама С., Бембенек М.Е., Хаджипур Г., Уитмен К.П. (сентябрь 1992). «4-оксалокротонат таутомераза, фермент, состоящий из 62 аминокислотных остатков на мономер» . Журнал биологической химии . 267 (25): 17716–17721. doi : 10.1016/s0021-9258 (19) 37101-7 . PMID 1339435 .
- ^ Смит С (декабрь 1994 г.). «Синтаза животных жирных кислот: один ген, один полипептид, семь ферментов» . FASEB Journal . 8 (15): 1248–1259. doi : 10.1096/fasebj.8.15.8001737 . PMID 8001737 . S2CID 22853095 .
- ^ «Каталитический сайт атлас» . Европейский институт биоинформатики. Архивировано с оригинала 27 сентября 2018 года . Получено 4 апреля 2007 года .
- ^ Jump up to: а беременный Suzuki H (2015). «Глава 7: Активная структура сайта». Как работают ферменты: от структуры к функционированию . Boca Raton, FL: CRC Press. С. 117–140. ISBN 978-981-4463-92-8 .
- ^ Краусс Г. (2003). «Правила ферментной активности» . Биохимия передачи сигнала и регуляции (3 -е изд.). Вейнхайм: Wiley-VCH. С. 89–114. ISBN 9783527605767 .
- ^ Jaeger Ke, Eggert T (август 2004 г.). «Энантиоселективный биокатализ, оптимизированный направленной эволюцией». Текущее мнение о биотехнологии . 15 (4): 305–313. doi : 10.1016/j.copbio.2004.06.007 . PMID 15358000 .
- ^ Шевевев IV, Hübscher U (май 2002 г.). «3 '5' экзонуклеазы». Природные обзоры. Молекулярная клеточная биология . 3 (5): 364–376. doi : 10.1038/nrm804 . PMID 11988770 . S2CID 31605786 .
- ^ Зенкин Н., Юзенкова Ю, Северинов К (июль 2006 г.). «Транскрипционная корректура с помощью транскрипта». Наука . 313 (5786): 518–520. Bibcode : 2006sci ... 313..518Z . doi : 10.1126/science.1127422 . PMID 16873663 . S2CID 40772789 .
- ^ IBBA M, Soll D (2000). «Аминоацил-трна синтез». Ежегодный обзор биохимии . 69 : 617–650. doi : 10.1146/annurev.biochem.69.1.617 . PMID 10966471 .
- ^ Rodnina MV, Wintermeyer W (2001). «Фамилия отбора аминоацил-трны на рибосоме: кинетические и структурные механизмы». Ежегодный обзор биохимии . 70 : 415–435. doi : 10.1146/annurev.biochem.70.1.415 . PMID 11395413 .
- ^ Херсонский О., Тауфик Д.С. (2010). «Распространенность фермента: механистическая и эволюционная перспектива». Ежегодный обзор биохимии . 79 : 471–505. doi : 10.1146/annurev-biochem-030409-143718 . PMID 20235827 .
- ^ О'Брайен П.Дж., Гершлаг Д. (апрель 1999 г.). «Каталитическая распущенность и эволюция новой ферментативной активности» . Химия и биология . 6 (4): R91 - R105. doi : 10.1016/s1074-5521 (99) 80033-7 . PMID 10099128 .
- ^ Фишер Э (1894). «Влияние конфигурации на влияние ферментов» [Влияние конфигурации на действие фермента]. Отчеты Германского химического общества в Берлине (на немецком языке). 27 (3): 2985–93. Doi : 10.1002/cber.18940270364 . На стр. 2992: «Чтобы использовать изображение, я хочу сказать, что фермент и глюкозид, такие как замок и ключи, должны соответствовать друг другу, чтобы иметь возможность оказывать химическое воздействие друг на друга». (Чтобы использовать для изображения, я хочу, чтобы это на ферментах и глюкозид [т.е. производное глюкозы] должен соответствовать блокировку и ключ, чтобы иметь возможность оказывать химическое воздействие друг на друга.)
- ^ Купер Г.М. (2000). «Глава 2.2: Центральная роль ферментов как биологических катализаторов» . Клетка: молекулярный подход (2 -е изд.). Вашингтон (округ Колумбия): ASM Press. ISBN 0-87893-106-6 .
- ^ Кошленд де (февраль 1958 г.). «Применение теории ферментной специфичности к синтезу белка» . Труды Национальной академии наук Соединенных Штатов Америки . 44 (2): 98–104. Bibcode : 1958pnas ... 44 ... 98K . doi : 10.1073/pnas.44.2.98 . PMC 335371 . PMID 16590179 .
- ^ Васелла А., Дэвис Г.Дж., Бум М (октябрь 2002 г.). «Гликозидазные механизмы». Современное мнение о химической биологии . 6 (5): 619–629. doi : 10.1016/s1367-5931 (02) 00380-0 . PMID 12413546 .
- ^ Бойер Р. (2002). «Глава 6: Ферменты I, реакции, кинетика и ингибирование». Концепции в биохимии (2 -е изд.). Нью -Йорк, Чичестер, Вайнхайм, Брисбен, Сингапур, Торонто.: John Wiley & Sons, Inc., стр. 137–8. ISBN 0-470-00379-0 Полем OCLC 51720783 .
- ^ Савир Y, Tlusty T (май 2007 г.). Scalas E (ред.). «Конформационная корректура: влияние конформационных изменений на специфичность молекулярного распознавания» . Plos один . 2 (5): E468. Bibcode : 2007ploso ... 2..468s . doi : 10.1371/journal.pone.0000468 . PMC 1868595 . PMID 17520027 .
- ^ Fersht A (1985). Ферментная структура и механизм . Сан -Франциско: WH Freeman. С. 50–2. ISBN 978-0-7167-1615-0 .
- ^ Warshel A, Sharma PK, Kato M, Xiang Y, Liu H, Olsson MH (август 2006 г.). «Электростатическая основа для ферментного катализа». Химические обзоры . 106 (8): 3210–3235. doi : 10.1021/cr0503106 . PMID 16895325 .
- ^ Кокс М.М., Нельсон Д.Л. (2013). «Глава 6.2: Как работают ферменты». Лехнингер Принципы биохимии (6 -е изд.). Нью -Йорк, Нью -Йорк: WH Freeman. п. 195. ISBN 978-1464109621 .
- ^ Бенкович С.Дж., Хаммс-Шиффер S (август 2003 г.). «Перспектива ферментного катализа». Наука . 301 (5637): 1196–1202. Bibcode : 2003sci ... 301.1196b . doi : 10.1126/science.10855515 . PMID 12947189 . S2CID 7899320 .
- ^ Jencks WP (1987). Катализ в химии и фермере . Mineola, NY: Dover. ISBN 978-0-486-65460-7 .
- ^ Villa J, Strajbl M, Glennon TM, Sham Yy, Chu ZT, Warshel A (октябрь 2000 г.). «Насколько важен энтропийный вклад в ферментный катализ?» Полем Труды Национальной академии наук Соединенных Штатов Америки . 97 (22): 11899–11904. Bibcode : 2000pnas ... 9711899V . doi : 10.1073/pnas.97.22.11899 . PMC 17266 . PMID 11050223 .
- ^ Polgár L (октябрь 2005 г.). «Каталитическая триада сериновых пептидаз» . Клеточные и молекулярные науки о жизни . 62 (19–20): 2161–2172. doi : 10.1007/s00018-005-5160-x . PMC 11139141 . PMID 16003488 . S2CID 3343824 .
- ^ Раманатан А., Савол А., Бургер В., Ченнубхотла К.С., Агарвал П.К. (январь 2014 г.). «Белковые конформационные популяции и функционально релевантные субстанции». Счета химических исследований . 47 (1): 149–156. doi : 10.1021/ar400084s . Ости 1565147 . PMID 23988159 .
- ^ Tsai CJ, Del Sol A, Nussinov R (март 2009 г.). «Алсостерия белка, передача сигнала и динамика: схема классификации аллостерических механизмов» . Молекулярные биосистемы . 5 (3): 207–216. doi : 10.1039/b819720b . PMC 2898650 . PMID 19225609 .
- ^ Changeux JP, Edelstein SJ (июнь 2005 г.). «Аллостерические механизмы передачи сигнала». Наука . 308 (5727): 1424–1428. Bibcode : 2005sci ... 308.1424c . doi : 10.1126/science.1108595 . PMID 15933191 . S2CID 10621930 .
- ^ De Bolster MW (1997). «Глоссарий терминов, используемых в бионорганической химии: кофактор» . Международный союз чистой и прикладной химии. Архивировано из оригинала 21 января 2017 года . Получено 30 октября 2007 года .
- ^ Voet D, Voet J, Pratt C (2016). Основы биохимии . Хобокен, Нью -Джерси: John Wiley & Sons, Inc. с. 336. ISBN 978-1-118-91840-1 .
- ^ Чепмен-Смит А., Кронан Дж. (Сентябрь 1999 г.). «Ферментативное биотинилирование белков: посттрансляционная модификация исключительной специфичности». Тенденции в биохимических науках . 24 (9): 359–363. doi : 10.1016/s0968-0004 (99) 01438-3 . PMID 10470036 .
- ^ Фишер З., Эрнандес Прада Дж.А., Ту С., Дуда Д., Йошиока С., А. и др. (Февраль 2005 г.). «Структурная и кинетическая характеристика гистидина активного сайта в качестве протонного челнока в катализе человеческой карбо-ангидразе II». Биохимия . 44 (4): 1097–1105. doi : 10.1021/bi0480279 . PMID 15667203 .
- ^ Jump up to: а беременный Вагнер А.Л. (1975). Витамины и коэнзимы . Warrior Pub Co. ISBN 0-88275-258-8 .
- ^ «Бренда комплексная информационная система ферментов» . Технический университет Брауншвейга . Получено 23 февраля 2015 года .
- ^ Törnroth-Horsefield S, Neutze R (декабрь 2008 г.). «Открытие и закрытие метаболитных ворот» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (50): 19565–19566. BIBCODE : 2008PNAS..10519565T . doi : 10.1073/pnas.0810654106 . PMC 2604989 . PMID 19073922 .
- ^ McArdle WD, Katch F, Katch VL (2006). «Глава 9: Легочная система и упражнения» . Основы физиологии упражнений (3 -е изд.). Балтимор, Мэриленд: Липпинкотт Уильямс и Уилкинс. С. 312–3. ISBN 978-0781749916 .
- ^ Фергюсон С.Дж., Николс Д., Фергюсон С. (2002). Биоэнергетика 3 (3 -е изд.). Сан -Диего: академический. ISBN 0-12-518121-3 .
- ^ Биссвангер Х (2017). Кинетика фермента: принципы и методы (в -третьих, увеличенные и улучшенные изд.). Вейнхейм, Германия: Wiley-VCH. ISBN 9783527806461 Полем OCLC 992976641 .
- ^ Michaelis L, Menten M (1913). «Die Kinetik der Invertinwirkung» [Кинетика действия инвертазы]. Биохимия. З. (на немецком языке). 49 : 333–369. ; Michaelis L, Menten ML, Johnson Ka, Goody Rs (октябрь 2011). «Оригинальная константа Михаэлиса: перевод бумаги Michaelis-Mexher-Mexhing» 1913 года » . Биохимия . 50 (39): 8264–8269. doi : 10.1021/bi201284u . PMC 3381512 . PMID 21888353 .
- ^ Бриггс Г.Е., Холдейн Дж.Б. (1925). «Примечание о кинетике действий фермента» . Биохимический журнал . 19 (2): 338–339. doi : 10.1042/bj0190338 . PMC 1259181 . PMID 16743508 .
- ^ Bar-Evon A, Noor E, Savir Y, Liebermeister W, Davidi D, Tawfik DS, Milo R (май 2011 г.). «Умеренно эффективный фермент: эволюционные и физико -химические тенденции формирующие параметры фермента». Биохимия . 50 (21): 4402–4410. doi : 10.1021/bi2002289 . PMID 21506553 .
- ^ Эллис Р.Дж. (октябрь 2001 г.). «Макромолекулярная толпа: очевидная, но недооцененная». Тенденции в биохимических науках . 26 (10): 597–604. doi : 10.1016/s0968-0004 (01) 01938-7 . PMID 11590012 .
- ^ Kopelman R (сентябрь 1988 г.). «Кинетика фрактальной реакции». Наука . 241 (4873): 1620–1626. Bibcode : 1988sci ... 241.1620K . doi : 10.1126/science.241.4873.1620 . PMID 17820893 . S2CID 23465446 .
- ^ Jump up to: а беременный в дюймовый Корниш-Боуден А (2004). Основы кинетики фермента (3 изд.). Лондон: Portland Press. ISBN 1-85578-158-1 .
- ^ Прайс NC (1979). «Что подразумевается под« конкурентным запретом »?». Тенденции в биохимических науках . 4 (11): N272 - N273. doi : 10.1016/0968-0004 (79) 90205-6 .
- ^ Goodsell DS (1 августа 1999 г.). «Молекулярная перспектива: метотрексат» . Онколог . 4 (4): 340–341. doi : 10.1634/theoncologe.4-4-340 . PMID 10476546 .
- ^ Wu P, Clausen MH, Nielsen TE (декабрь 2015 г.). «Аллостерические ингибиторы киназы малой молекулы» (PDF) . Фармакология и терапия . 156 : 59–68. doi : 10.1016/j.pharmthera.2015.10.002 . PMID 26478442 . S2CID 1550698 .
- ^ Корниш-Боуден А (июль 1986 г.). «Почему неконкурентоспособное ингибирование так редко? Возможное объяснение, имеющее последствия для дизайна лекарств и пестицидов». Письма Febs . 203 (1): 3–6. doi : 10.1016/0014-5793 (86) 81424-7 . PMID 3720956 . S2CID 45356060 .
- ^ Стрелоу Дж. М. (январь 2017 г.). «Перспектива кинетики ковалентного и необратимого торможения» . SLAS Discovery . 22 (1): 3–20. doi : 10.1177/108705711671509 . PMID 27703080 .
- ^ Фишер JF, Meroueh SO, Mobashery S (февраль 2005 г.). «Устойчивость бактерий к бета-лактамным антибиотикам: убедительный оппортунизм, убедительная возможность». Химические обзоры . 105 (2): 395–424. doi : 10.1021/cr030102i . PMID 15700950 .
- ^ Jump up to: а беременный Johnson DS, Weerapana E, Cravatt BF (июнь 2010 г.). «Стратегии для обнаружения и ухудшения ковалентных, необратимых ингибиторов ферментов» . Будущая лекарственная химия . 2 (6): 949–964. doi : 10.4155/fmc.10.21 . PMC 2904065 . PMID 20640225 .
- ^ Эндо А (ноябрь 1992). «Обнаружение и развитие ингибиторов hmg-coa-редуктазы» . Журнал липидных исследований . 33 (11): 1569–1582. doi : 10.1016/s0022-2275 (20) 41379-3 . PMID 1464741 .
- ^ Wlodawer A, Vondrasek J (1998). «Ингибиторы протеазы ВИЧ-1: основной успех дизайна лекарств с помощью структуры». Ежегодный обзор биофизики и биомолекулярной структуры . 27 : 249–284. doi : 10.1146/annurev.biophys.27.1.249 . PMID 9646869 . S2CID 10205781 .
- ^ Yoshikawa S, Caughey WS (май 1990). «Инфракрасные доказательства связывания цианида с участками железа и меди в цитохромосидазе Coxine Heart Heart. Последствия в отношении восстановления кислорода» . Журнал биологической химии . 265 (14): 7945–7958. doi : 10.1016/s0021-9258 (19) 39023-4 . PMID 2159465 .
- ^ Jain JL (май 1999). Основы биохимии . Нью -Дели: С. Чанд и Ко. ISBN 8121903432 Полем OCLC 818809626 .
- ^ Охотник Т (январь 1995 г.). «Протеинкиназы и фосфатазы: инь и ян фосфорилирования и передачи сигналов белка» . Клетка . 80 (2): 225–236. doi : 10.1016/0092-8674 (95) 90405-0 . PMID 7834742 . S2CID 13999125 .
- ^ Berg JS, Powell BC, Cheney Re (апрель 2001 г.). «Перепись тысячелетнего миозина» . Молекулярная биология клетки . 12 (4): 780–794. doi : 10.1091/mbc.12.4.780 . PMC 32266 . PMID 11294886 .
- ^ Meighen EA (март 1991 г.). «Молекулярная биология бактериальной биолюминесценции» . Микробиологические обзоры . 55 (1): 123–142. doi : 10.1128/mmbr.55.1.123-142.1991 . PMC 372803 . PMID 2030669 .
- ^ De clercq e (апрель 2002 г.). «Основные моменты в разработке новых противовирусных агентов». Мини -обзоры по лекарственной химии . 2 (2): 163–175. doi : 10.2174/1389557024605474 . PMID 12370077 .
- ^ Mackie Ri, White Ba (октябрь 1990). «Последние достижения в области микробной экологии и метаболизма рубца: потенциальное влияние на продукцию питательных веществ» . Журнал молочной науки . 73 (10): 2971–2995. doi : 10.3168/jds.s0022-0302 (90) 78986-2 . PMID 2178174 .
- ^ Rouzer CA, Marnett LJ (апрель 2009 г.). «Циклооксигеназы: структурные и функциональные идеи» . Журнал липидных исследований . 50 (Suppl): S29 - S34. doi : 10.1194/jlr.r800042-jlr200 . PMC 2674713 . PMID 18952571 .
- ^ Jump up to: а беременный в дюймовый Suzuki H (2015). «Глава 8: Контроль активности фермента». Как работают ферменты: от структуры к функционированию . Boca Raton, FL: CRC Press. С. 141–69. ISBN 978-981-4463-92-8 .
- ^ Doble BW, Woodgett Jr (апрель 2003 г.). «GSK-3: уловки торговли для многозадачной киназы» . Журнал сотовой науки . 116 (Pt 7): 1175–1186. doi : 10.1242/jcs.00384 . PMC 3006448 . PMID 12615961 .
- ^ Беннетт П.М., Чопра I (февраль 1993 г.). «Молекулярная основа индукции бета-лактамазы у бактерий» . Антимикробные агенты и химиотерапия . 37 (2): 153–158. doi : 10.1128/aac.37.2.153 . PMC 187630 . PMID 8452343 .
- ^ Светт П., Гибсон Г.Г. (2001). «Глава 3: Индукция и ингибирование метаболизма лекарств». Введение в метаболизм наркотиков (3 изд.). Челтенхэм, Великобритания: издательство Нельсона Торнеса. С. 87–118. ISBN 978-0748760114 .
- ^ Faergeman NJ, Knudsen J (апрель 1997 г.). «Роль длинноцепочечных жировых эфиров ацил-КоА в регуляции метаболизма и в клеточной передаче» . Биохимический журнал . 323 (Pt 1) (Pt 1): 1–12. doi : 10.1042/bj3230001 . PMC 1218279 . PMID 9173866 .
- ^ Suzuki H (2015). «Глава 4: Влияние рН, температуры и высокого давления на ферментативную активность». Как работают ферменты: от структуры к функционированию . Boca Raton, FL: CRC Press. С. 53–74. ISBN 978-981-4463-92-8 .
- ^ Noree C, Sato BK, Broyer RM, Wilhelm JE (август 2010 г.). «Идентификация новых питательных белков у Saccharomyces cerevisiae и Drosophila melanogaster» . Журнал клеточной биологии . 190 (4): 541–551. doi : 10.1083/jcb.201003001 . PMC 2928026 . PMID 20713603 .
- ^ Aughey GN, Liu JL (2015). «Метаболическая регуляция с помощью ферментативного нити» . Критические обзоры биохимии и молекулярной биологии . 51 (4): 282–293. doi : 10.3109/10409238.2016.1172555 . PMC 4915340 . PMID 27098510 .
- ^ Камата К., Мицуя М., Нишимура Т., Эйки Дж., Нагата Y (март 2004 г.). «Структурная основа для аллостерической регуляции мономерного аллостерического фермента человеческого глюкокиназы» . Структура 12 (3): 429–438. doi : 10.1016/j.str.2004.02.005 . PMID 15016359 .
- ^ Froguel P, Zouali H, Vionnet N, Velho G, Vaxillaire M, Sun F, et al. (Март 1993 г.). «Семейная гипергликемия из -за мутаций в глюкокиназе. Определение подтипа сахарного диабета» . Новая Англия Журнал медицины . 328 (10): 697–702. doi : 10.1056/nejm199303113281005 . PMID 8433729 .
- ^ Okada S, O'Brien JS (август 1969 г.). «Болезнь Тай-Сакса: генерализованное отсутствие компонента бета-дн-ацетилгексозаминидазы». Наука . 165 (3894): 698–700. Bibcode : 1969sci ... 165..698o . doi : 10.1126/science.165.3894.698 . PMID 5793973 . S2CID 8473726 .
- ^ «Изучение болезни Тай -саха» . Национальный институт исследований генома человека . Получено 1 марта 2015 года .
- ^ Erlandsen H, Stevens RC (октябрь 1999 г.). «Структурная основа фенилкетонурии». Молекулярная генетика и метаболизм . 68 (2): 103–125. doi : 10.1006/mgme.1999.2922 . PMID 10527663 .
- ^ Flatmark T, Stevens RC (август 1999 г.). «Структурное понимание ароматических аминокислотных гидроксилаз и их мутантных форм, связанных с заболеванием». Химические обзоры . 99 (8): 2137–2160. doi : 10.1021/cr980450y . PMID 11849022 .
- ^ «Фенилкетонурия» . Гены и болезнь [Интернет] . Bethesda (MD): Национальный центр информации о биотехнологии (США). 1998–2015.
- ^ «Дефицит псевдохолинэстеразы» . Национальная библиотека медицины США . Получено 5 сентября 2013 года .
- ^ Fieker A, Philpott J, Armand M (2011). «Заместительная терапия фермента для недостаточности поджелудочной железы: настоящее и будущее» . Клиническая и экспериментальная гастроэнтерология . 4 : 55–73. doi : 10.2147/ceg.s17634 . PMC 3132852 . PMID 21753892 .
- ^ Misselwitz B, Pohl D, Frühauf H, Fried M, Vavricka Sr, Fox M (июнь 2013 г.). «Мальбоза и непереносимость лактозы: патогенез, диагностика и лечение» . Объединенная европейская гастроэнтерологическая журнал . 1 (3): 151–159. doi : 10.1177/2050640613484463 . PMC 4040760 . PMID 24917953 .
- ^ Кливер JE (май 1968). «Дефектная репарация репликации ДНК в Xeroderma Pigmentosum». Природа . 218 (5142): 652–656. Bibcode : 1968natur.218..652c . doi : 10.1038/218652A0 . PMID 5655953 . S2CID 4171859 .
- ^ Джеймс В.Д., Элстон Д., Бергер Т.Г. (2011). Болезни Эндрюса кожи: клиническая дерматология (11 -е изд.). Лондон: Saunders/ Elsevier. п. 567. ISBN 978-1437703146 .
- ^ Мурзин А.Г. (ноябрь 1993 г.). «Могут ли гомологичные белки развивать различную ферментативную активность?». Тенденции в биохимических науках . 18 (11): 403–405. doi : 10.1016/0968-0004 (93) 90132-7 . PMID 8291080 .
- ^ Ochoa D, Bradley D, Beltrao P (февраль 2018 г.). «Эволюция, динамика и дисрегуляция передачи сигналов киназы». Современное мнение в структурной биологии . 48 : 133–140. doi : 10.1016/j.sbi.2017.12.008 . PMID 29316484 .
- ^ Renugopalakrishnan V, Garduño-Juárez R, Narasimhan G, Verma CS, Wei X, Li P (ноябрь 2005 г.). «Рациональный дизайн термически стабильных белков: отношение к бионанотехнологии». Журнал нанонауки и нанотехнологии . 5 (11): 1759–1767. doi : 10.1166/jnn.2005.441 . PMID 16433409 .
- ^ Hult K, Berglund P (август 2003 г.). «Инженерные ферменты для улучшения органического синтеза». Текущее мнение о биотехнологии . 14 (4): 395–400. doi : 10.1016/s0958-1669 (03) 00095-8 . PMID 12943848 .
- ^ Цзян Л., Альтофф Э.А., Клементе Ф.Р., Дойл Л., Ретлисбергер Д., Зангеллини А. и др. (Март 2008 г.). «De novo Computational Design of Retro-aldol ферментов» . Наука . 319 (5868): 1387–1391. Bibcode : 2008Sci ... 319.1387J . doi : 10.1126/science.1152692 . PMC 3431203 . PMID 18323453 .
- ^ Jump up to: а беременный Sun Y, Cheng J (май 2002). «Гидролиз лигноцеллюлозных материалов для производства этанола: обзор». Технология Bioresource . 83 (1): 1–11. Bibcode : 2002bitec..83 .... 1s . doi : 10.1016/s0960-8524 (01) 00212-7 . PMID 12058826 .
- ^ Jump up to: а беременный Кирк О., Борхерт ТВ, Фуглсанг К.С. (август 2002 г.). «Применение промышленных ферментов». Текущее мнение о биотехнологии . 13 (4): 345–351. doi : 10.1016/s0958-1669 (02) 00328-2 . PMID 12323357 .
- ^ Jump up to: а беременный в Бриггс де (1998). Солодование и солод (1 -е изд.). Лондон: Blackie Academic. ISBN 978-0412298004 .
- ^ Dulieu C, Moll M, Boudrant J, Poncelet D (2000). «Улучшенные характеристики и контроль ферментации пива с использованием инкапсулированной альфа-ацетолактат-декарбоксилазы и моделирования» . Биотехнологический прогресс . 16 (6): 958–965. doi : 10.1021/bp000128k . PMID 11101321 . S2CID 25674881 .
- ^ Tarté R (2008). Ингредиенты в свойствах, функциональность и применение мясных продуктов . Нью -Йорк: Спрингер. п. 177. ISBN 978-0-387-71327-4 .
- ^ «Химозин - база данных ГМО» . ГМО компас . Евросоюз. 10 июля 2010 г. Архивировано с оригинала 26 марта 2015 года . Получено 1 марта 2015 года .
- ^ Molimard P, Spinnler He (февраль 1996 г.). «Обзор: соединения, связанные с вкусом сыров, ослабленных поверхности: происхождение и свойства» . Журнал молочной науки . 79 (2): 169–184. doi : 10.3168/jds.s0022-0302 (96) 76348-8 .
- ^ Guzmán-Maldonado H, Paredes-López O (сентябрь 1995 г.). «Амилолитические ферменты и продукты, полученные из крахмала: обзор». Критические обзоры в области питания и питания . 35 (5): 373–403. doi : 10.1080/10408399509527706 . PMID 8573280 .
- ^ Jump up to: а беременный «Протеаза - база данных ГМО» . ГМО компас . Евросоюз. 10 июля 2010 г. Архивировано с оригинала 24 февраля 2015 года . Получено 28 февраля 2015 года .
- ^ Alkorta I, Garbisu C, Llama MJ, Serra JL (январь 1998 г.). «Промышленные применения пектических ферментов: обзор». Процесс биохимия . 33 (1): 21–28. doi : 10.1016/s0032-9592 (97) 00046-0 .
- ^ Bajpai P (март 1999 г.). «Применение ферментов в целлюлозной и бумажной промышленности». Биотехнологический прогресс . 15 (2): 147–157. doi : 10.1021/bp990013k . PMID 10194388 . S2CID 26080240 .
- ^ Begley CG, Paragina S, Sporn A (март 1990 г.). «Анализ очистителей ферментов контактной линзы». Журнал Американской оптометрической ассоциации . 61 (3): 190–194. PMID 2186082 .
- ^ Фаррис П.Л. (2009). «Экономический рост и организация индустрии крахмала США». В Bemiller JN, Whistler RL (ред.). Химия и технологии крахмала (3 -е изд.). Лондон: академический. ISBN 9780080926551 .
Дальнейшее чтение
|
|
Внешние ссылки
 СМИ, связанные с ферментами в Wikimedia Commons
СМИ, связанные с ферментами в Wikimedia Commons
![{\ displaystyle {\ ce {co2 {}+h2o-> [{\ text {карбонгидраза}}}] h2co3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb4c8837b26e96fe552c17d863f93e0618cd998b)
![{\ displayStyle {\ ce {co2 {}+h2o <-[{\ text {карбон-ангидраза}}] h2co3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/618e95485aa1c3c44a29c557ac448ae5b544ff07)







