Валентность (химия)
В химии валентность валентность (правописание США) или химические (британское правописание) атома является мерой его комбинированной способности с другими атомами, когда он образует соединения или молекулы . Валентность, как правило, понимается как количество химических связей , которые обычно образует каждый атом данного химического элемента . Двойные облигации считаются двумя облигациями, тройные облигации составляют три, четырехкратные связи составляют четыре, Quintuple Bonds составляют пять, а Sextuple Spends - шесть. В большинстве соединений валентность водорода составляет 1, а кислорода - 2, азота - 3, а углерода - 4. Валентность не следует путать с связанными концепциями координационного числа , состоянием окисления или количества валентные электроны для данного атома.
Описание
Валентность представляет собой комбинирующую способность атома данного элемента, определяемое количеством атомов водорода, с которым он сочетается. В метане углерод имеет валентность 4; В аммиаке азот имеет валентность 3; В воде кислород имеет валентность 2; А в водороде хлорид хлор имеет валентность 1. Хлор, поскольку он имеет валентность из одного, может быть заменен водородом во многих соединениях. Фосфор имеет валентность 3 в фосфине ( PH 3 ) и валентность 5 в пентахлориде Phosphorus ( PCL 5 ), который показывает, что элемент может демонстрировать более одной валентности. Структурная формула соединения представляет собой связь атомов, причем линии, проведенные между двумя атомами для представления связей. [ 1 ] В двух таблицах, приведенных ниже примерами различных соединений, их структурных формул и валеней для каждого элемента соединения.
| Сложный | H 2 Водород |
Ch 4 Метан |
C 3 H 8 Пропан |
C 3 H 6 Пропилен |
C 2 H 2 Ацетилен |
|---|---|---|---|---|---|
| Диаграмма | 
|

|

|
||
| Царапина |
|
|
|
|
|
| Сложный | NH 3 Аммиак |
Нахн Цианид натрия |
PSCL 3 Тиофосфорилхлорид |
H 2 с Сероводород |
H 2 SO 4 Серная кислота |
H 2 S 2 O 6 Дитионовая кислота |
Cl 2 O 7 Дихлор гептоксид |
Ксео 4 Ксенон тетроксид |
|---|---|---|---|---|---|---|---|---|
| Диаграмма | 
|

|

|

|

|

|

| |
| Царапина |
|
|
|
|
|
|
|
|
Определение
Валентность определяется IUPAC как : [ 2 ]
- Максимальное количество одноваленных атомов (первоначально водорода или атомов хлора), которые могут сочетаться с атомом рассматриваемого элемента, или с фрагментом, или для которого может быть заменен атом этого элемента.
Альтернативное современное описание: [ 3 ]
- Количество атомов водорода, которые могут сочетаться с элементом в бинарном гидриде или вдвое больше атомов кислорода, объединяющихся с элементом в его оксиде или оксидах.
Это определение отличается от определения IUPAC как элемент, который имеет более чем одну валентность.
Историческое развитие
Этимология слов валентность валентии ( валентность во множественном числе ) и валентность ( сорта по численности ) отслеживается до 1425 года, что означает «экстракт, подготовка», из латинской . «прочность, способность», из более ранней доблестной «ценности» и химического вещества Значение, относящееся к «комбинированной силе элемента», записано с 1884 года, из Германии Валенца . [ 4 ]

Концепция валентности была разработана во второй половине 19 -го века и помогла успешно объяснить молекулярную структуру неорганических и органических соединений. [ 1 ] Стремление к основным причинам валентности привело к современным теориям химической связи, включая кубический атом (1902), Льюис Структуры (1916), теория валентной связи (1927), молекулярные орбитали (1928), теория пары валентной пары спиртных оболочков. (1958), и все продвинутые методы квантовой химии .
В 1789 году Уильям Хиггинс опубликовал взгляды на то, что он назвал комбинациями «конечных» частиц, которые предвещали концепцию валентных связей . [ 5 ] Если, например, согласно Хиггинсу, сила между окончательной частицей кислорода и конечной частицей азота была 6, то сила силы была бы соответствующей, а также для других комбинаций конечных частиц (см. Иллюстрацию) Полем
Точное начало, однако, теории химических валентных веществ может быть прослежена до статьи Эдварда Франкленда 1852 года , в которой он объединил более старую радикальную теорию с мыслями о химической сродстве, чтобы показать, что определенные элементы имеют тенденцию объединять с другими элементами с формировать соединения, содержащие 3, т.е. в 3-атомных группах (например, № 3 , NH 3 , Ni 3 и т. Д.) или 5, т.е. в группах 5-атом (например, № 5 , NH 4 O , PO 5 и т. Д.), Эквиваленты прикрепленных элементов. По его словам, это то, как их сродство лучше всего удовлетворено, и, следуя этим примерам и постулатам, он заявляет, насколько очевидно это [ 6 ]
Тенденция или закон преобладают (здесь), и что, независимо от того, какими могут быть символы объединяющих атомов, комбинирующая сила привлекательного элемента, если мне может быть разрешен этот термин, всегда удовлетворяется тем же количеством этих атомов Полем
Это «комбинированная власть» впоследствии называлась количественной или валентностью (и валентностью американских химиков). [ 5 ] В 1857 году Кекуле предложил фиксированные валентности для многих элементов, таких как 4 для углерода, и использовал их для предложения структурных формул для многих органических молекул, которые до сих пор принимаются сегодня.
Лотар Мейер в своей книге 1864 года « Die Modernen Theorien Der Chemie » содержал раннюю версию периодической таблицы, содержащей 28 элементов, впервые классифицированные элементы в шесть семей по их валентности . Работает над организацией элементов по атомному весу , до тех пор, как это было закупоривалось благодаря широкому использованию эквивалентных весов для элементов, а не атомных весов. [ 7 ]
Большинство химиков 19-го века определили валентность элемента как количество его связей без различия различных типов валентности или связи. Однако в 1893 году Альфред Вернер описал переходных металлов, координационные комплексы такие как [CO (NH 3 ) 6 ] CL 3 , в котором он отличил основные и вспомогательные валентности (немецкий: «hauptvalenz» и «nebenvalenz»), соответствующие современным концепциям состояния окисления и координационного числа соответственно.
Для элементов основной группы в 1904 году Ричард Абегг рассмотрел положительную и отрицательную валентность (максимальные и минимальные состояния окисления) и предложил правление Абегга на то, что их различие часто составляет 8.
атома Альтернативное определение валентности, разработанное в 1920 -х годах и наличие современных сторонников, отличается в тех случаях, когда формальный заряд не равен нулю. Он определяет валентность данного атома в ковалентной молекуле как количество электронов, которое атом использовал в связи: [ 8 ] [ 9 ] [ 10 ] [ 11 ]
- валентность = количество электронов в валентной оболочке свободного атома - количество не связанных с связью электронов на атом в молекуле ,
или эквивалентно:
- Валентность = количество связей + формальный заряд .
На этой конвенции азот в аммония ионе [NH 4 ] + Связаны с четырьмя атомами водорода, но считается, что это нехватка, потому что все пять валентных электронов азота участвуют в связи. [ 8 ]
Электроны и валентность
Модель ядерного атома в Резерфорде (1911) показала, что внешняя часть атома занята электронами , что предполагает, что электроны ответственны за взаимодействие атомов и образование химических связей. В 1916 году Гилберт Н. Льюис объяснил валентность и химическую связь с точки зрения тенденции атомов (основной группы) для достижения стабильного октета из 8 электронов валентности. По словам Льюиса, ковалентная связь приводит к окте, приводящимся к электронам, а ионная связь приводит к октетам путем переноса электронов от одного атома к другому. Термин ковалентность приписывается Ирвингу Лэнгмуру , который заявил в 1919 году, что «количество пар электронов , которые любой данный атом разделяет с прилегающими атомами, называется ковалентностью этого атома». [ 12 ] Префикс совместно означает «вместе», так что коалентная связь означает, что атомы разделяют валентность. После этого в настоящее время чаще говоря о ковалентных связях , а не о валентности , которая вышла из работы на более высоком уровне от достижений в теории химической связи, но все еще широко используется в начальных исследованиях, где Это обеспечивает эвристическое введение в предмет.
В 1930 -х годах Линус Полинг предположил, что существуют также полярные ковалентные связи , которые являются промежуточными между ковалентными и ионными, и что степень ионного характера зависит от разности электроотрицательности двух связанных атомов.
Полингинг также рассматривал гипервалентные молекулы , в которых элементы основной группы имеют кажущиеся валентность, превышающие максимальные 4, разрешенные правилом октета. Например, в молекуле гексафторида серы ( SF 6 ), Полингинг считал, что сера образует 6 истинных двухэлектронных связей с использованием SP 3 дюймовый 2 Гибридные атомные орбитали , которые сочетают в себе один S, три P и две D Orbitals. Однако в последнее время квантово-механические расчеты по этому и аналогичным молекулам показали, что роль D-орбиталей в связывании минимальна и что Молекула SF 6 должна быть описана как имеющая 6 полярных ковалентных (частично ионных) связей, изготовленных только из четырех орбиталей на серре (один s и три р) в соответствии с правилом октета вместе с шестью орбиталями на фторинах. [ 13 ] Аналогичные расчеты по молекулам переходного металла показывают, что роль P-орбиталей незначительна, так что одного S и пять D орбиталей на металле являются достаточными для описания связи. [ 14 ]
Общие валенации
Для элементов в основных группах периодической таблицы валентность может варьироваться от 1 до 8.
| Группа | Валентность 1 | Валентность 2 | Валентность 3 | Валентность 4 | Валентность 5 | Валентность 6 | Валентность 7 | Валентность 8 | Типичные валентные |
|---|---|---|---|---|---|---|---|---|---|
| 1 (i) | Нахль Kcl |
1 | |||||||
| 2 (II) | MGCL 2 CACL 2 |
2 | |||||||
| 13 (iii) | Внедорожник Тли |
BCL 3 Alcl 3 AL 2 O 3 |
3 | ||||||
| 14 (iv) | Сопутствующий PBCL 2 |
CO 2 Ch 4 SICL 4 |
2 и 4 | ||||||
| 15 (V) | НЕТ | NH 3 PH 3 Как 2 O 3 |
№ 2 | N 2 O 5 PCL 5 |
3 и 5 | ||||
| 16 (мы) | H 2 o H 2 с SCL 2 |
Итак , 2 SF 4 |
Итак 3 SF 6 H 2 SO 4 |
2, 4 и 6 | |||||
| 17 (vii) | Hcl ICL |
HCLO 2 CLF 3 |
Clo 2 | Если 5 HCLO 3 |
Если 7 Cl 2 O 7 Hclo 4 |
1, 3, 5 и 7 | |||
| 18 (viii) | KRF 2 | XEF 4 | Ксео 3 | Ксео 4 | 0, 2, 4, 6 и 8 |
Многие элементы имеют общую валентность, связанную с их позицией в периодической таблице, и в настоящее время это рационализируется правилом октета . Предыфиксы греческого/латинского , три-/терра цифр (моно-/уни-, ди-/ би- Поливалентность или мультивалентность относится к видам , которые не ограничены определенным количеством валентных связей . Виды с одним зарядом являются одновалентными (одновалентными). Например, CS + катион - это одновалентный или одновалентный катион, тогда как Что 2+ катион - это двухвалентный катион, а Фей 3+ Катион - это тривалентный катион. В отличие от CS и CA, Fe также может существовать в других состояниях заряда, особенно 2+ и 4+, и, таким образом, известен как многовалентный (поливалентный) ион. [ 15 ] Переходные металлы и металлы справа, как правило, являются многовалентными, но нет простого шаблона, предсказывающего их валентность. [ 16 ]
| Валентность | Более распространенное прилагательное ‡ | Менее распространенный синонимичный прилагательный ‡ § |
|---|---|---|
| 0-валент | zerovalent | неценку |
| 1-валентный | моновалент | Univalent |
| 2-валент | дивалент | бивалентный |
| 3-валент | тривалентный | смол |
| 4-валентный | тетравалентный | квадвалуент |
| 5-валент | Пентавалент | Quinquevalent , пятивалентный |
| 6-валент | гексавалентный | сексуален |
| 7-валент | Гептавалент | сеплент |
| 8-валент | октавалент | — |
| 9 валент | неценку | — |
| 10-валент | декавалент | — |
| 11-валент | некален | — |
| 12-валент | Додекавалент | — |
| несколько / много / переменная | поливалент | многовалентный |
| вместе | ковалент | — |
| не вместе | нековалентный | — |
† Те же прилагательные также используются в медицине для обозначения вакциновой валентности, с небольшой разницей в том, что в последнем смысле квадрат чаще встречается, чем тетра- .
‡ Как продемонстрировано подсчетом хитов в Google Web Search и Google Books Search Corpora (по состоянию на 2017 год).
§ Несколько других форм можно найти в крупных англоязычных корпусах (например, *Quintavalent, *Quintivalent, *Decivals ), но они не являются традиционно установленными формами на английском языке и, следовательно, не вводятся в основных словарях.
Валентность против состояния окисления
Из -за неоднозначности термина валентности, [ 17 ] Другие обозначения в настоящее время предпочтительнее. Помимо нотации Lambda, используемых в номенклатуре IUPAC неорганической химии , [ 18 ] Состояние окисления является более четким признаком электронного состояния атомов в молекуле.
Состояние окисления атома в молекуле дает количество валентных электронов, которые он получил или потерял. [ 19 ] В отличие от числа валентности, состояние окисления может быть положительным (для электропозитивного атома) или отрицательным (для электроотрицательного атома).
Элементы в высоком уровне окисления имеют состояние окисления выше +4, а также элементы в состоянии высокой валентности ( гипервалентные элементы) имеют валентность выше 4. Например, в перхлоратах Clo - 4 , хлор имеет 7 валентных связей (таким образом, он гептавалент, другими словами, имеет валентность 7), и он имеет состояние окисления +7; В рутении тетроксид Ruo 4 , Ruthenium имеет 8 валентных связей (таким образом, он октавалентен, другими словами, имеет валентность 8), и имеет состояние окисления +8.
В некоторых молекулах существует разница между валентностью и состоянием окисления для данного атома. Например, в негрикорида диульфур молекуле S 2 F 10 , каждый атом серы имеет 6 валентных связей (5 отдельных связей с атомами фтора и 1 одиночной связью с другим атом серы). Таким образом, каждый атом серы является гексавалентным или имеет валентность 6, но имеет состояние окисления +5. В диоксигена молекуле O 2 , каждый кислорода атом имеет 2 валентные связи, и поэтому является двухвалентным (валентность 2), но имеет значение окисления 0. В ацетилене H - C≡C - H , каждый атом углерода имеет 4 валентные связи (1 одиночная связь с атомом водорода и тройной связью с другим атом углерода ). Каждый атом углерода является тетравалентным (валентность 4), но имеет состояние окисления -1.
Примеры
| Сложный | Формула | Валентность | Состояние окисления | Диаграмма |
|---|---|---|---|---|
| Хлорид водорода | Hcl | H = 1 cl = 1 | H = +1 cl = −1 | H -CL |
| Перхловая кислота * | Hclo 4 | H = 1 Cl = 7 O = 2 | H = +1 Cl = +7 O = −2 | 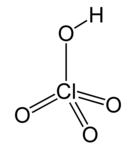
|
| Метан | Ch 4 | C = 4 ч = 1 | C = –4 ч = +1 | 
|
| Дихлорметан ** | CH 2 CL 2 | C = 4 H = 1 Cl = 1 | C = 0 H = +1 Cl = −1 | 
|
| Оксид железа *** | Голос | Fe = 2 o = 2 | Fe = +2 o = −2 | Fe = o |
| Оксид железа *** | Fe 2 O 3 | Fe = 3 O = 2 | Fe = +3 o = −2 | O = fe -o -he = o |
| Гидрид натрия | Сейчас | По = 1 ч = 1 | Na = +1 H = -1 | Най-H. |
* Перхлорат ион Clo - 4 - одновалентно, другими словами, он имеет валентность 1.
** Валенции также могут отличаться от абсолютных значений состояний окисления из -за различной полярности связей. Например, в дихлорметане , CH 2 Cl 2 , углерод имеет валентность 4, но состояние окисления 0.
*** Оксиды железа появляются в кристаллической структуре , поэтому типичная молекула не может быть идентифицирована. В оксиде железа Fe имеет состояние окисления +2; В оксиде железа, состояние окисления +3.
| Сложный | Формула | Валентность | Состояние окисления | Диаграмма |
|---|---|---|---|---|
| Водород | H 2 | H = 1 | H = 0 | H - H. |
| Хлор | CL 2 | Cl = 1 | Cl = 0 | Cl - cl |
| Перекись водорода | H 2 O 2 | H = 1 O = 2 | H = +1 O = −1 | 
|
| Гидразин | N 2 H 4 | H = 1 n = 3 | H = +1 n = −2 | 
|
| Дисульфид нигенид | S 2 F 10 | S = 6 F = 1 | S = +5 F = −1 | 
|
| Дитионовая кислота | H 2 S 2 O 6 | S = 6 O = 2 H = 1 | S = +5 O = −2 H = +1 | 
|
| Гексахлорэтан | C 2 Cl 6 | C = 4 Cl = 1 | C = +3 Cl = −1 | 
|
| Этилен | C 2 H 4 | C = 4 ч = 1 | C = -2 ч = +1 | 
|
| Ацетилен | C 2 H 2 | C = 4 ч = 1 | C = -1 ч = +1 | H - C≡C - H. |
| Меркурий (I) хлорид | Hg 2 Cl 2 | Hg = 2 cl = 1 | Hg = +1 cl = −1 | Cl - Hg - Hg - Cl |
«Максимальное количество связей»
Франкленд принял мнение, что валентность (он использовал термин «атомность») элемента была единственным значением, которое соответствовало наблюдаемому максимальному значению. Количество неиспользуемых валентных веществ на атомы того, что сейчас называют элементами P-блока , обычно равномерно, и Франкленд предположил, что неиспользованные валентные вещества насыщают друг друга. Например, азот имеет максимальную валентность 5, при формировании аммиака Две валентные вещества остаются непривязанными; Сера имеет максимальную валентность 6, образуя сероводород, четыре ценности остаются непривязанными. [ 20 ] [ 21 ]
Международный союз чистой и прикладной химии (IUPAC) предпринял несколько попыток прийти к однозначному определению валентности. Текущая версия, принятая в 1994 году: [ 22 ]
- Максимальное количество одноваленных атомов (первоначально водорода или атомов хлора), которые могут сочетаться с атомом рассматриваемого элемента, или с фрагментом, или для которого может быть заменен атом этого элемента. [ 2 ]
Водород и хлор первоначально использовались в качестве примеров одновалентных атомов из -за их природы, образуя только одну единственную связь. Водород имеет только один валентный электрон и может образовывать только одну связь с атомом с неполной внешней оболочкой . Хлор имеет семь валентных электронов и может образовывать только одну связь с атомом, которая жертвует валентный электрон для завершения внешней оболочки хлора. Тем не менее, хлор также может иметь состояния окисления от +1 до +7 и может образовывать более одной связи, пожертвовав валентные электроны .
Водород имеет только один валентный электрон, но он может образовывать связи с более чем одним атом. В бифторидном ионе ( [HF 2 ] − ), например, он образует трехцентровую четырехэлектронную связь с двумя атомами фтора:
- [F - Hf − ↔ f − H - f]
Другим примером является трехцентровая двухэлектронная связь в диборане ( B 2 H 6 ).
Максимальные валенции элементов
Максимальные валентности для элементов основаны на данных из списка состояний окисления элементов . Они показаны цветовым кодом в нижней части таблицы.
| Максимальные валенции элементов | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||
| Группа → | |||||||||||||||||||||
| ↓ Период | |||||||||||||||||||||
| 1 | 1 ЧАС |
2 Он | |||||||||||||||||||
| 2 | 3 Что |
4 Быть |
5 Беременный |
6 В |
7 Не |
8 А |
9 Фон |
10 Ne | |||||||||||||
| 3 | 11 НА |
12 Мг |
13 Ал |
14 И |
15 П |
16 С |
17 Калькуляция |
18 С | |||||||||||||
| 4 | 19 K |
20 Что |
21 В |
22 Из |
23 V |
24 Герметичный |
25 Мнжен |
26 Фей |
27 Сопутствующий |
28 В |
29 С |
30 Zn |
31 Для |
32 Гей |
33 Как |
34 С |
35 Бренд |
36 КР | |||
| 5 | 37 РБ |
38 Старший |
39 И |
40 Zr |
41 Нб |
42 Для |
43 ТК |
44 Ру |
45 Раствор |
46 ПД |
47 В |
48 Диск |
49 В |
50 С |
51 Сб |
52 А |
53 я |
54 Машина | |||
| 6 | 55 CS |
56 Нет |
71 А |
72 Hf |
73 Лицом к лицу |
74 В |
75 Репутация |
76 Ты |
77 И |
78 Пт |
79 В |
80 Hg |
81 TL |
82 Пб |
83 С |
84 Po |
85 В |
86 Рн | |||
| 7 | 87 Фр |
88 Солнце |
103 Лр |
104 Rf |
105 ДБ |
106 Подготовительный |
107 BH |
108 HS |
109 Гору |
110 Дюймовый |
111 Rg |
112 CN |
113 Нын -н.э. |
114 В |
115 МС |
116 Дольдо |
117 Т.С. |
118 И | |||
| 57 А |
58 Этот |
59 Премьер -министр |
60 Н.д. |
61 Премьер -министр |
62 СМ |
63 Евросоюз |
64 Г.Д. |
65 Туберкулез |
66 Те |
67 К |
68 Является |
69 ТМ |
70 Yb |
||||||||
| 89 И |
90 Тур |
91 Затем |
92 В |
93 Например |
94 Мог |
95 Являюсь |
96 См |
97 Бенк |
98 См |
99 Является |
100 Фм |
101 Доктор медицинских наук |
102 Нет | ||||||||
| Максимальные валентности основаны на списке состояний окисления элементов | |||||||||||||||||||||
|
0 1 2 3 4 5 6 7 8 9 Неизвестный цвет фона показывает максимальную валентность химического элемента | |||||||||||||||||||||
Смотрите также
Ссылки
- ^ Jump up to: а беременный Партингтон, Джеймс Риддик (1921). Учебник неорганической химии для студентов университетов (1-е изд.). OL 7221486M .
- ^ Jump up to: а беременный Определение золотой книги IUPAC : Валентность
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2 -е изд.). Баттерворт-Хейнеманн . ISBN 978-0-08-037941-8 .
- ^ Харпер, Дуглас. "Валентность" . Онлайн этимологический словарь .
- ^ Jump up to: а беременный Партингтон, младший (1989). Короткая история химии . Dover Publications, Inc. ISBN 0-486-65977-1 .
- ^ Франкленд, Э. (1852). «На новой серии органических тел, содержащих металлы». Философские транзакции Королевского общества Лондона . 142 : 417–444. doi : 10.1098/rstl.1852.0020 . S2CID 186210604 .
- ^ Алан Дж. Рок (1984). Химический атомизм в девятнадцатом веке: от Далтона до Канниццаро . Издательство штата Огайо издательство.
- ^ Jump up to: а беременный Паркин, Джерард (май 2006 г.). «Валентность, количество окисления и формальный заряд: три связанных, но принципиально разных понятия». Журнал химического образования . 83 (5): 791. Bibcode : 2006jched..83..791p . doi : 10.1021/ed083p791 . ISSN 0021-9584 .
Хотя концепции и определения валентности были уточнены на протяжении многих лет, описанный Сидгвиком остается наиболее полезным и простым определением для ковалентных молекул: валентность атома в ковалентной молекуле - это просто количество электронов, которые атом использовал в связывание.
- ^ Sidgwick, NV (1927). Электронная теория валентности . Лондон: издательство Оксфордского университета (Clarendon Press). п. 199.
В целом наилучшим определением абсолютной валентности, по -видимому, является то, что принят Гримм и Соммерфельд, что он численно равен количеству электронов атома «вовлеченного» (Beansprucht) при прикреплении других атомов.
- ^ Гримм, Hg; Sommerfeld, A (1926). «О соединении конца электронных групп в атоме с числами химической валентности». Журнал физики . 36 (1): 36–59. Bibcode : 1926zphy ... 36 ... 36G . Doi : 10.1007/bf01383924 . S2CID 120248399 .
- ^ Смит, Дерек В. (2005). «Валентность, ковалентность, гипервалентность, состояние окисления и координационное число». Журнал химического образования . 82 (8): 1202. Bibcode : 2005jched..82.1202S . doi : 10.1021/ed082p1202 . ISSN 0021-9584 .
- ^ Лангмюр, Ирвинг (1919). «Расположение электронов в атомах и молекулах» . Журнал Американского химического общества . 41 (6): 868–934. doi : 10.1021/ja02227a002 .
- ^ Магнуссон, Эрик (1990). «Гиперкоординатные молекулы элементов второго ряда: D функции или D орбиталей?». J. Am. Химический Соц 112 (22): 7940–7951. doi : 10.1021/ja00178a014 .
- ^ Френкинг, Герно; Шайк, Сасон, ред. (Май 2014). «Глава 7: Химическая связь в соединениях переходных металлов». Химическая связь: химическая связь по периодической таблице . Wiley - Vch. ISBN 978-3-527-33315-8 .
- ^ Merriam-Webster , неприменимый словарь Мерриам-Уэбстера , Merriam-Webster, архивировав с оригинала на 2020-05-25 , извлечен 2017-05-11 .
- ^ «Урок 7: Ионы и их имена» . Clackamas Community College . Архивировано с оригинала 21 января 2019 года . Получено 5 февраля 2019 года .
- ^ Свободный словарь: валентность
- ^ Iupac , сборник химической терминологии , 2 -е изд. («Золотая книга») (1997). Онлайн -исправленная версия: (2006–) « Лэмбда ». doi : 10.1351/goldbook.l03418
- ^ Iupac , сборник химической терминологии , 2 -е изд. («Золотая книга») (1997). Онлайн -исправленная версия: (2006–) « Состояние окисления ». два : 10.1351/goldbook.o04365
- ^ Франкленд, Э. (1870). Примечания к лекции для студентов -химических веществ (Google Ebook) (2d Ed.). Дж. Ван Вурст. п. 21
- ^ Франкленд, Э .; JAPP, FR (1885). Неорганическая химия (1 -е изд.). С. 75–85. OL 6994182M .
- ^ Мюллер, П. (1994). «Глоссарий терминов, используемых в физической органической химии (рекомендации IUPAC 1994)» . Чистая и прикладная химия . 66 (5): 1077–1184. doi : 10.1351/pac199466051077 . S2CID 195819485 .