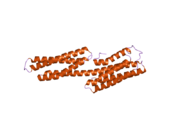Винкулин
| ВКЛ | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | VCL , CMD1W, CMH15, HEL114, МВ, Мвинкулин | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 193065 ; МГИ : 98927 ; Гомологен : 7594 ; GeneCards : VCL ; OMA : VCL — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||

В клетках млекопитающих винкулин представляет собой мембранно-цитоскелетный белок в бляшках фокальной адгезии , который участвует в связывании молекул адгезии интегрина с актиновым цитоскелетом . Винкулин представляет собой белок цитоскелета , связанный с соединениями клетка-клетка и клетка-матрикс, где, как полагают, он действует как один из нескольких взаимодействующих белков, участвующих в закреплении F-актина на мембране.
Открыт независимо Бенни Гейгером. [ 5 ] и Кит Берридж , [ 6 ] его последовательность на 20–30% сходна с α- катенином , выполняющим аналогичную функцию.
При поочередном связывании с талином или α-актинином изменяются форма винкулина и, как следствие, его связывающие свойства. Ген винкулина встречается в виде единственной копии и, похоже, не является его близким родственником, способным взять на себя функции в его отсутствие. Его сплайсинговый вариант метавинкулин (см. ниже) также нуждается в винкулине для гетеродимеризации и работы зависимым образом.
Структура
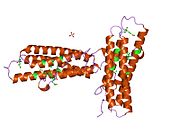
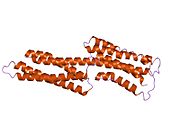
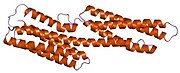
[ редактировать ]Винкулин представляет собой цитоскелетный белок массой 117 кДа, содержащий 1066 аминокислот . Белок содержит кислый N-концевой домен и основной С-концевой домен, разделенные богатым пролином средним сегментом. Винкулин состоит из глобулярного головного домена, который содержит сайты связывания талина и α-актинина , а также сайт фосфорилирования тирозина, тогда как хвостовая область содержит сайты связывания для F-актина , паксиллина и липидов . [ 7 ]
По сути, существует N-концевая головка из 835 аминокислот, которая разделена на четыре домена. Он связан с С-концевым хвостом с помощью линкерной области.
Недавнее открытие 3D-структуры [ нужна ссылка ] проливает свет на то, как этот белок адаптирует свою форму для выполнения различных функций. Например, винкулин способен контролировать подвижность клетки, просто изменяя ее форму с активной на неактивную. В «неактивном» состоянии конформация винкулина характеризуется взаимодействием между его головным и хвостовым доменами. А при переходе в «активную» форму, например, когда талин запускает связывание, внутримолекулярное взаимодействие между хвостом и головой разрывается. Другими словами, когда сайты связывания талина (VBS) α-спиралей связываются со структурой спирального пучка в головном домене винкулина, инициируется «конверсия спирального пучка», что приводит к реорганизации α-спиралей (α1-α- 4), что приводит к совершенно новой пятиспиральной структуре пучка. Эта функция также распространяется на раковые клетки и регулирует их движение и распространение рака на другие части тела. [ нужна ссылка ]
Механизм и функции
[ редактировать ]Распространение и движение клеток происходят в процессе связывания рецепторов интегрина клеточной поверхности с молекулами адгезии внеклеточного матрикса . Винкулин связан с фокальной адгезией и слипчивыми соединениями , что приводит к значительной динамике белка. [ нужна ссылка ] . Это комплексы, образующие актиновые филаменты и сшивающие агенты между внешней средой, плазматической мембраной и актиновым цитоскелетом. [ 8 ] Комплекс фокальных спаек состоит из нескольких белков, таких как винкулин, α-актинин, паксиллин и талин, на внутриклеточной поверхности плазматической мембраны.
Говоря более конкретно, аминоконец винкулина связывается с талином, который, в свою очередь, связывается с β-интегринами, а карбоксиконец связывается с актином, фосфолипидами и гомодимерами, образующими паксиллин. Связывание винкулина с талином и актином регулируется полифосфоинозитидами и ингибируется кислыми фосфолипидами. Затем комплекс служит для прикрепления актиновых нитей к мембране и, таким образом, помогает усилить силу талина внутри фокальных спаек. [ 9 ]
Потеря винкулина влияет на различные функции клеток; он нарушает образование комплекса и предотвращает адгезию и распространение клеток. Отсутствие белка демонстрирует уменьшение распространения клеток, что сопровождается снижением образования стрессовых волокон, образованием меньшего количества фокальных спаек и ингибированием расширения ламеллиподий . [ 7 ] Было обнаружено, что клетки с дефицитом винкулина имеют конусы роста, которые продвигаются медленнее, а также филоподии и ламеллиподии, которые менее стабильны, чем у дикого типа. На основе исследований [ нужна ссылка ] Было высказано предположение, что недостаток винкулина может снижать адгезию клеток за счет ингибирования сборки фокальной адгезии и предотвращения полимеризации актина. С другой стороны, сверхэкспрессия винкулина может восстановить адгезию и распространение, способствуя привлечению белков цитоскелета в комплекс фокальной адгезии в месте связывания интегрина. [ 9 ] Способность винкулина взаимодействовать с интегринами цитоскелета при фокальной адгезии, по-видимому, имеет решающее значение для контроля механики цитоскелета, распространения клеток и образования ламеллиподий. Таким образом, винкулин, по-видимому, играет ключевую роль в контроле формы, основываясь на его способности модулировать структуру и функцию фокальной адгезии.
Активация
[ редактировать ]Винкулин находится в равновесии между активным и неактивным состоянием. [ 10 ] Активное состояние срабатывает при привязке к назначенному партнеру. Эти изменения происходят, когда винкулин взаимодействует с фокальными точками адгезии, с которыми он связывается. Когда винкулин находится в неактивной форме, белок остается в цитоплазме, в отличие от фокальных точек адгезии, связанных из активного состояния. Молекула талин считается основным инициатором активации винкулина из-за ее присутствия в фокальных комплексах. Комбинаторная модель винкулина утверждает, что α-актинин или талин могут активировать винкулин либо отдельно, либо с помощью PIP2 или актина . Эта активация происходит путем разделения связи «голова-хвост» внутри неактивного винкулина. [ 10 ]
Связывающий сайт
[ редактировать ]| ВБС | |||
|---|---|---|---|
 Головка винкулина человека (1-258) в комплексе с сайтом связывания винкулина талина 3 (остатки 1944-1969) | |||
| Идентификаторы | |||
| Символ | ВБС | ||
| Пфам | PF08913 | ||
| ИнтерПро | ИПР015009 | ||
| |||
винкулина Сайты связывания преимущественно обнаруживаются в талине и талин-подобных молекулах, что позволяет связывать винкулин с талином, стабилизируя опосредованные интегрином соединения клетка-матрикс. Талин, в свою очередь, связывает интегрины с актиновым цитоскелетом . Консенсусной последовательностью винкулина сайтов связывания является LxxAAxxVAxxVxxLIxxA, с предсказанной вторичной структурой четырех амфипатических спиралей . Гидрофобные , остатки которые определяют VBS, сами по себе «замаскированы» и похоронены в ядре серии спиральных пучков, составляющих стержень талина. [ 11 ]
Варианты сращивания
[ редактировать ]Гладкие мышцы и скелетные мышцы (и, вероятно, в меньшей степени сердечная мышца ) в их хорошо дифференцированном (сократительном) состоянии совместно экспрессируют (наряду с винкулином) вариант сплайсинга, несущий дополнительный экзон в 3'-кодирующей области, кодируя таким образом более длинная изоформа мета-винкулина (мета-ВКЛ) с молекулярной массой ~150 кД — белка, о существовании которого известно с 1980-х годов. [ 12 ] Трансляция дополнительного экзона вызывает вставку, богатую аминокислотами, от 68 до 79 между спиралями I и II в С-концевом хвостовом домене. Мутации внутри области вставки коррелируют с наследственной идиопатической дилатационной кардиомиопатией . [ 13 ]
Длина вставки в метавинкулине составляет 68 АК у млекопитающих и 79 у лягушки. [ 14 ] Сравнили последовательности метавинкулина свиньи, человека, курицы и лягушки и обнаружили, что вставка двудольная: первая часть вариабельна, а вторая высококонсервативна. Обе изоформы винкулина совместно локализуются в мышечных адгезивных структурах, таких как плотные бляшки в гладких мышцах , вставочные диски в кардиомиоцитах и костамеры в скелетных мышцах . [ 15 ] Хвостовой домен метавинкулина имеет более низкое сродство к головке по сравнению с хвостом винкулина. В случае метавинкулина разворачивание С-концевой гидрофобной шпильки хвостового домена нарушается из-за отрицательных зарядов вставки из 68 аминокислот, поэтому для полной активации молекулы метавинкулина требуется активируемая фосфолипидом обычная изоформа винкулина.
Взаимодействия
[ редактировать ]Было показано, что винкулин взаимодействует с:
В случаях избыточного бактериального роста тонкого кишечника , проявляющегося симптомами СРК , было обнаружено, что антитела против CdtB влияют на функцию винкулина, которая необходима для моторики кишечника. [ 22 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000035403 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000021823 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Гейгер Б (сентябрь 1979 г.). «Белок 130К из куриного желудка: его локализация на концах пучков микрофиламентов в культивируемых куриных клетках». Клетка . 18 (1): 193–205. дои : 10.1016/0092-8674(79)90368-4 . ПМИД 574428 . S2CID 33153559 .
- ^ Берридж К., Ферамиско-младший (март 1980 г.). «Микроинъекция и локализация белка 130К в живых фибробластах: связь с актином и фибронектином». Клетка . 19 (3): 587–95. дои : 10.1016/s0092-8674(80)80035-3 . ПМИД 6988083 . S2CID 43087259 .
- ^ Перейти обратно: а б Гольдманн В.Х., Ингбер Д.Е. (январь 2002 г.). «Интактный белок винкулин необходим для контроля формы клеток, клеточной механики и rac-зависимого образования ламеллиподий». Связь с биохимическими и биофизическими исследованиями . 290 (2): 749–55. дои : 10.1006/bbrc.2001.6243 . ПМИД 11785963 .
- ^ Сюй В., Барибо Х., Адамсон Э.Д. (январь 1998 г.). «Нокаут винкулина приводит к дефектам сердца и мозга во время эмбрионального развития». Разработка . 125 (2): 327–37. дои : 10.1242/dev.125.2.327 . ПМИД 9486805 .
- ^ Перейти обратно: а б Эззелл Р.М., Гольдманн В.Х., Ван Н., Парашурама Н., Парашарама Н., Ингбер Д.Е. (февраль 1997 г.). «Винкулин способствует распространению клеток путем механического соединения интегринов с цитоскелетом». Экспериментальные исследования клеток . 231 (1): 14–26. дои : 10.1006/excr.1996.3451 . ПМИД 9056408 .
- ^ Перейти обратно: а б Боргон Р.А., Вонрейн С., Бриконь Г., Буа П.Р., Изард Т. (июль 2004 г.). «Кристаллическая структура винкулина человека» . Структура . 12 (7): 1189–97. дои : 10.1016/j.str.2004.05.009 . ПМИД 15242595 .
- ^ Гинграс А.Р., Фогель К.П., Стейнхофф Х.Дж., Зиглер В.Х., Патель Б., Эмсли Дж., Кричли Д.Р., Робертс Г.К., Барсуков И.Л. (февраль 2006 г.). «Структурная и динамическая характеристика места связывания винкулина в талиновом стержне». Биохимия . 45 (6): 1805–17. дои : 10.1021/bi052136l . ПМИД 16460027 .
- ^ Ферамиско-младший, Смарт Дж.Э., Берридж К., Хелфман Д.М., Томас Г.П. (сентябрь 1982 г.). «Сосуществование винкулина и винкулиноподобного белка с более высокой молекулярной массой в гладких мышцах» . Журнал биологической химии . 257 (18): 11024–31. дои : 10.1016/S0021-9258(18)33927-9 . ПМИД 6809764 .
- ^ Витт С., Цизенисс А., Фок У., Йокуш Б.М., Илленбергер С. (июль 2004 г.). «Сравнительный биохимический анализ показывает, что винкулин и метавинкулин взаимодействуют в местах мышечной адгезии» . Журнал биологической химии . 279 (30): 31533–43. дои : 10.1074/jbc.M314245200 . ПМИД 15159399 .
- ^ Штрассер П., Гимона М., Херцог М., Гейгер Б., Small JV (февраль 1993 г.). «Вариабельные и константные области С-конца винкулина и метавинкулина. Клонирование и экспрессия фрагментов в E. coli» . Письма ФЭБС . 317 (3): 189–94. дои : 10.1016/0014-5793(93)81274-4 . ПМИД 8425604 . S2CID 39567003 .
- ^ Белкин А.М., Орнатский О.И., Глухова М.А., Котелянский В.Е. (август 1988 г.). «Иммунолокализация метавинкулина в гладких и сердечных мышцах человека» . Журнал клеточной биологии . 107 (2): 545–53. дои : 10.1083/jcb.107.2.545 . ПМК 2115213 . ПМИД 3138246 .
- ^ Хазан Р.Б., Канг Л., Роу С., Борген П.И., Римм Д.Л. (декабрь 1997 г.). «Винкулин связан с адгезионным комплексом Е-кадгерина» . Журнал биологической химии . 272 (51): 32448–53. дои : 10.1074/jbc.272.51.32448 . ПМИД 9405455 .
- ^ Хазан Р.Б., Нортон Л. (апрель 1998 г.). «Рецептор эпидермального фактора роста модулирует взаимодействие Е-кадгерина с актиновым цитоскелетом» . Журнал биологической химии . 273 (15): 9078–84. дои : 10.1074/jbc.273.15.9078 . ПМИД 9535896 .
- ^ Тернер С.Э., Браун MC, Перротта Дж.А., Риди MC, Николопулос С.Н., Макдональд А.Р., Бародиа С., Томас С., Левенталь П.С. (май 1999 г.). «Мотив LD4 паксиллина связывает PAK и PIX через новый анкириновый повтор массой 95 кДа, белок ARF-GAP: роль в ремоделировании цитоскелета» . Журнал клеточной биологии . 145 (4): 851–63. дои : 10.1083/jcb.145.4.851 . ПМК 2133183 . ПМИД 10330411 .
- ^ Мазаки Ю., Хасимото С., Сабе Х. (март 1997 г.). «Моноцитарные и раковые клетки экспрессируют новые изоформы паксиллина с различными свойствами связывания с белками фокальной адгезии» . Журнал биологической химии . 272 (11): 7437–44. дои : 10.1074/jbc.272.11.7437 . ПМИД 9054445 .
- ^ Браун MC, Перротта Дж.А., Тернер CE (ноябрь 1996 г.). «Идентификация LIM3 как основного детерминанта локализации фокальной адгезии паксиллина и характеристика нового мотива паксиллина, направляющего связывание винкулина и киназы фокальной адгезии» . Журнал клеточной биологии . 135 (4): 1109–23. дои : 10.1083/jcb.135.4.1109 . ПМК 2133378 . ПМИД 8922390 .
- ^ Мандай К., Наканиси Х., Сато А., Такахаши К., Сато К., Нисиока Х., Мидзогучи А., Такаи Ю. (март 1999 г.). «Понсин / SH3P12: l-афадин- и винкулин-связывающий белок, локализованный в адгезионных соединениях клетка-клетка и клетка-матрикс» . Журнал клеточной биологии . 144 (5): 1001–17. дои : 10.1083/jcb.144.5.1001 . ПМК 2148189 . ПМИД 10085297 .
- ^ Пиментел М., Моралес В., Поккунури В., Брикос С., Ким С.М., Ким С.Э., Триантафиллу К., Вейтсман С., Марш З., Марш Е., Чуа К.С., Шринивасан С., Барлоу Г.М., Чанг С. (май 2015 г.). «Аутоиммунитет связывает винкулин с патофизиологией хронических функциональных изменений кишечника после инфекции Campylobacter jejuni на модели крыс». Пищеварительные заболевания и науки . 60 (5): 1195–205. дои : 10.1007/s10620-014-3435-5 . ПМИД 25424202 . S2CID 22408999 .
Дальнейшее чтение
[ редактировать ]- Кричли Д.Р. (ноябрь 2004 г.). «Цитоскелетные белки талин и винкулин в интегрин-опосредованной адгезии». Труды Биохимического общества . 32 (Часть 5): 831–6. дои : 10.1042/BST0320831 . ПМИД 15494027 .
- Котелянский В.Е., Огрызко Е.П., Жидкова Н.И., Веллер П.А., Кричли Д.Р., Ванкомпернолле К., Вандекерхове Дж., Штрассер П., Уэй М., Гимона М. (март 1992 г.). «Дополнительный экзон в гене винкулина человека специфически кодирует специфичный для метавинкулина разностный пептид. Межвидовое сравнение выявляет изменчивые и консервативные мотивы во вставке метавинкулина» . Европейский журнал биохимии . 204 (2): 767–72. дои : 10.1111/j.1432-1033.1992.tb16692.x . ПМИД 1339348 .
- Маллиган Л.М., Гарднер Э., Телениус Х., Пондер Б.А. (август 1992 г.). «Дополнительные физические и генетические методы картируют ген винкулина (VCL) на хромосоме 10q». Геномика . 13 (4): 1347–9. дои : 10.1016/0888-7543(92)90066-2 . ПМИД 1505973 .
- Веллер П.А., Огрызко Е.П., Корбен Е.Б., Жидкова Н.И., Патель Б., Прайс Г.Дж., Сперр Н.К., Котелянский В.Е., Кричли Д.Р. (август 1990 г.). «Полная последовательность человеческого винкулина и отнесение гена к хромосоме 10» . Труды Национальной академии наук Соединенных Штатов Америки . 87 (15): 5667–71. дои : 10.1073/pnas.87.15.5667 . ПМК 54388 . ПМИД 2116004 .
- Тернер CE, Берридж К. (июнь 1989 г.). «Обнаружение метавинкулина в тромбоцитах человека с использованием модифицированного анализа наложения талина». Европейский журнал клеточной биологии . 49 (1): 202–6. ПМИД 2503380 .
- Тернер CE, Миллер Дж. Т. (июнь 1994 г.). «Первичная последовательность паксиллина содержит предполагаемые мотивы связывания доменов SH2 и SH3 и несколько доменов LIM: идентификация винкулина и области связывания pp125Fak». Журнал клеточной науки . 107 (Часть 6) (6): 1583–91. дои : 10.1242/jcs.107.6.1583 . ПМИД 7525621 .
- Салгия Р., Ли Дж.Л., Ло Ш., Брунхорст Б., Канзас Г.С., Собхани Э.С., Сан Ю., Писик Э., Халлек М., Эрнст Т. (март 1995 г.). «Молекулярное клонирование человеческого паксиллина, белка фокальной адгезии, фосфорилированного P210BCR/ABL» . Журнал биологической химии . 270 (10): 5039–47. дои : 10.1074/jbc.270.10.5039 . ПМИД 7534286 .
- Адамс МД, Керлаваж А.Р., Флейшманн Р.Д., Фулднер Р.А., Балт С.Дж., Ли Н.Х., Киркнесс Э.Ф., Вайнсток К.Г., Гокейн Дж.Д., Уайт О (сентябрь 1995 г.). «Первоначальная оценка разнообразия и моделей экспрессии генов человека на основе 83 миллионов нуклеотидов последовательности кДНК» (PDF) . Природа . 377 (6547 Приложение): 3–174. ПМИД 7566098 .
- Хагманн Дж. (апрель 1993 г.). «Формирование структуры и направленность цитоскелета тромбоцитов человека» . Труды Национальной академии наук Соединенных Штатов Америки . 90 (8): 3280–3. дои : 10.1073/pnas.90.8.3280 . ПМК 46283 . ПМИД 7682697 .
- Джонсон Р.П., Крейг С.В. (январь 1995 г.). «Сайт связывания F-актина, замаскированный внутримолекулярной ассоциацией головных и хвостовых доменов винкулина». Природа . 373 (6511): 261–4. дои : 10.1038/373261a0 . ПМИД 7816144 . S2CID 4369795 .
- Хирш М.С., Лоу Л.Ю., Тринкаус-Рэндалл В., Свобода К.К. (1995). «Внутриклеточное распределение винкулина и альфа-2 интегрина в эпителиальных клетках и хондроцитах» . Сканирование . 16 (5): 275–84. дои : 10.1002/sca.4950160306 . ПМИД 7994488 .
- Фауссер Дж.Л., Унгевикелл Э., Рух Дж.В., Лесот Х. (октябрь 1993 г.). «Взаимодействие винкулина с тяжелой цепью клатрина». Журнал биохимии . 114 (4): 498–503. doi : 10.1093/oxfordjournals.jbchem.a124206 . ПМИД 8276759 .
- Моисеева Е.П., Веллер П.А., Жидкова Н.И., Корбен Е.Б., Патель Б., Ясинска И., Котелянский В.Е., Кричли Д.Р. (февраль 1993 г.). «Организация человеческого гена, кодирующего цитоскелетный белок винкулин, и последовательность промотора винкулина» . Журнал биологической химии . 268 (6): 4318–25. дои : 10.1016/S0021-9258(18)53612-7 . ПМИД 8440716 .
- Йошида М., Вестлин В.Ф., Ван Н., Ингбер Д.Е., Розенцвейг А., Резник Н., Гимброне М.А. (апрель 1996 г.). «Адгезия лейкоцитов к эндотелию сосудов индуцирует связь Е-селектина с актиновым цитоскелетом» . Журнал клеточной биологии . 133 (2): 445–55. дои : 10.1083/jcb.133.2.445 . ПМК 2120789 . ПМИД 8609175 .
- Скотт Г.А., Лян Х., Кэссиди Л.Л. (август 1995 г.). «Регуляция развития экспрессии белков фокального контакта в меланоцитах человека». Исследование пигментных клеток . 8 (4): 221–8. дои : 10.1111/j.1600-0749.1995.tb00667.x . ПМИД 8610074 .
- Дероанн CF, Колидж AC, Нусгенс Б.В., Лапьер CM (май 1996 г.). «Модуляция экспрессии и сборки винкулина во время ангиогенеза, индуцированного фибриллярным коллагеном in vitro, и его обращение». Экспериментальные исследования клеток . 224 (2): 215–23. дои : 10.1006/excr.1996.0131 . ПМИД 8612698 .
- Маэда М., Холдер Э., Лоуз Б., Валент С., Бис Р.Д. (январь 1997 г.). «Дилятационная кардиомиопатия, связанная с дефицитом цитоскелетного белка метавинкулина». Тираж . 95 (1): 17–20. дои : 10.1161/01.cir.95.1.17 . ПМИД 8994410 .
- Мазаки Ю., Хасимото С., Сабе Х. (март 1997 г.). «Моноцитарные и раковые клетки экспрессируют новые изоформы паксиллина с различными свойствами связывания с белками фокальной адгезии» . Журнал биологической химии . 272 (11): 7437–44. дои : 10.1074/jbc.272.11.7437 . ПМИД 9054445 .
- Хазан Р.Б., Канг Л., Роу С., Борген П.И., Римм Д.Л. (декабрь 1997 г.). «Винкулин связан с адгезионным комплексом Е-кадгерина» . Журнал биологической химии . 272 (51): 32448–53. дои : 10.1074/jbc.272.51.32448 . ПМИД 9405455 .
- Хазан Р.Б., Нортон Л. (апрель 1998 г.). «Рецептор эпидермального фактора роста модулирует взаимодействие Е-кадгерина с актиновым цитоскелетом» . Журнал биологической химии . 273 (15): 9078–84. дои : 10.1074/jbc.273.15.9078 . ПМИД 9535896 .