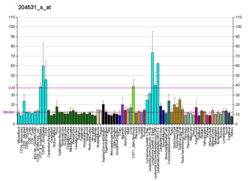
БРЦА1
| БРЦА1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | BRCA1 , рак молочной железы 1, раннее начало, BRCAI, BRCC1, BROVCA1, IRIS, PNCA4, PPP1R53, PSCP, RNF53, FANCS, рак молочной железы 1, связанный с репарацией ДНК, связанный с репарацией ДНК BRCA1, Гены | |||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 113705 ; МГИ : 104537 ; Гомологен : 5276 ; Генные карты : BRCA1 ; OMA : BRCA1 — ортологи | |||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
Белок предрасположенности к раку молочной железы 1 типа представляет собой белок , который у человека кодируется BRCA1 ( / ˌ b r æ k ə ˈ w ʌ n / ) геном . [ 5 ] Ортологи распространены у других видов позвоночных , тогда как геномы беспозвоночных могут кодировать более отдаленно родственные гены. [ 6 ] BRCA1 человека . — ген-супрессор опухолей [ 7 ] [ 8 ] (также известный как ген-смотритель ) и отвечает за восстановление ДНК . [ 9 ]
BRCA1 и BRCA2 — неродственные белки. [ 10 ] но оба обычно экспрессируются в клетках молочной железы и других тканей, где они помогают восстановить поврежденную ДНК или уничтожить клетки, если ДНК не может быть восстановлена. Они участвуют в восстановлении хромосомных повреждений, играя важную роль в безошибочном восстановлении двухцепочечных разрывов ДНК . [ 11 ] [ 12 ] Если BRCA1 или сам BRCA2 поврежден мутацией BRCA , поврежденная ДНК не восстанавливается должным образом, и это увеличивает риск рака молочной железы . [ 13 ] [ 11 ] BRCA1 и BRCA2 были описаны как «гены предрасположенности к раку молочной железы» и «белки восприимчивости к раку молочной железы». Преобладающий аллель имеет нормальную функцию подавления опухоли, тогда как мутации с высокой пенетрантностью в этих генах вызывают потерю функции подавления опухоли, что коррелирует с повышенным риском рака молочной железы. [14]
BRCA1 combines with other tumor suppressors, DNA damage sensors and signal transducers to form a large multi-subunit protein complex known as the BRCA1-associated genome surveillance complex (BASC).[15] The BRCA1 protein associates with RNA polymerase II, and through the C-terminal domain, also interacts with histone deacetylase complexes. Thus, this protein plays a role in transcription, and DNA repair of double-strand DNA breaks[11] ubiquitination, transcriptional regulation as well as other functions.[16]
Methods to test for the likelihood of a patient with mutations in BRCA1 and BRCA2 developing cancer were covered by patents owned or controlled by Myriad Genetics.[17][18] Myriad's business model of offering the diagnostic test exclusively led from Myriad being a startup in 1994 to being a publicly traded company with 1200 employees and about $500 million in annual revenue in 2012;[19] it also led to controversy over high prices and the inability to obtain second opinions from other diagnostic labs, which in turn led to the landmark Association for Molecular Pathology v. Myriad Genetics lawsuit.[20]
Discovery
[edit]The first evidence for the existence of a gene encoding a DNA repair enzyme involved in breast cancer susceptibility was provided by Mary-Claire King's laboratory at UC Berkeley in 1990.[21] Four years later, after an international race to find it,[22] the gene was cloned in 1994 by scientists at University of Utah, National Institute of Environmental Health Sciences (NIEHS) and Myriad Genetics.[17][23]
Gene
[edit]BRCA1 orthologs have been identified in most vertebrates for which complete genome data are available.[6]
Protein structure
[edit]The BRCA1 protein contains the following domains:[24]
- Zinc finger, C3HC4 type (RING finger)
- BRCA1 C Terminus (BRCT) domain
This protein also contains nuclear localization signals and nuclear export signal motifs.[25]
The human BRCA1 protein consists of four major protein domains; the Znf C3HC4- RING domain, the BRCA1 serine domain and two BRCT domains. These domains encode approximately 27% of BRCA1 protein. There are six known isoforms of BRCA1,[26] with isoforms 1 and 2 comprising 1863 amino acids each.[citation needed]
BRCA1 is unrelated to BRCA2, i.e. they are not homologs or paralogs.[10]

Zinc RING finger domain
[edit]The RING motif, a Zn finger found in eukaryotic peptides, is 40–60 amino acids long and consists of eight conserved metal-binding residues, two quartets of cysteine or histidine residues that coordinate two zinc atoms.[28] This motif contains a short anti-parallel beta-sheet, two zinc-binding loops and a central alpha helix in a small domain. This RING domain interacts with associated proteins, including BARD1, which also contains a RING motif, to form a heterodimer. The BRCA1 RING motif is flanked by alpha helices formed by residues 8–22 and 81–96 of the BRCA1 protein. It interacts with a homologous region in BARD1 also consisting of a RING finger flanked by two alpha-helices formed from residues 36–48 and 101–116. These four helices combine to form a heterodimerization interface and stabilize the BRCA1-BARD1 heterodimer complex. Additional stabilization is achieved by interactions between adjacent residues in the flanking region and hydrophobic interactions. The BARD1/BRCA1 interaction is disrupted by tumorigenic amino acid substitutions in BRCA1, implying that the formation of a stable complex between these proteins may be an essential aspect of BRCA1 tumor suppression.[28]
The RING domain is an important element of ubiquitin E3 ligases, which catalyze protein ubiquitination. Ubiquitin is a small regulatory protein found in all tissues that direct proteins to compartments within the cell. BRCA1 polypeptides, in particular, Lys-48-linked polyubiquitin chains are dispersed throughout the resting cell nucleus, but at the start of DNA replication, they gather in restrained groups that also contain BRCA2 and BARD1. BARD1 is thought to be involved in the recognition and binding of protein targets for ubiquitination.[29] It attaches to proteins and labels them for destruction. Ubiquitination occurs via the BRCA1 fusion protein and is abolished by zinc chelation.[28] The enzyme activity of the fusion protein is dependent on the proper folding of the RING domain.[citation needed]
Serine cluster domain
[edit]BRCA1 serine cluster domain (SCD) spans amino acids 1280–1524. A portion of the domain is located in exons 11–13. High rates of mutation occur in exons 11–13. Reported phosphorylation sites of BRCA1 are concentrated in the SCD, where they are phosphorylated by ATM/ATR kinases both in vitro and in vivo. ATM/ATR are kinases activated by DNA damage. Mutation of serine residues may affect localization of BRCA1 to sites of DNA damage and DNA damage response function.[27]
BRCT domains
[edit]The dual repeat BRCT domain of the BRCA1 protein is an elongated structure approximately 70 Å long and 30–35 Å wide.[30] The 85–95 amino acid domains in BRCT can be found as single modules or as multiple tandem repeats containing two domains.[31] Both of these possibilities can occur in a single protein in a variety of different conformations.[30] The C-terminal BRCT region of the BRCA1 protein is essential for repair of DNA, transcription regulation and tumor suppressor function.[32] In BRCA1 the dual tandem repeat BRCT domains are arranged in a head-to-tail-fashion in the three-dimensional structure, burying 1600 Å of hydrophobic, solvent-accessible surface area in the interface. These all contribute to the tightly packed knob-in-hole structure that comprises the interface. These homologous domains interact to control cellular responses to DNA damage. A missense mutation at the interface of these two proteins can perturb the cell cycle, resulting a greater risk of developing cancer.[citation needed]
Function and mechanism
[edit]BRCA1 is part of a complex that repairs double-strand breaks in DNA. The strands of the DNA double helix are continuously breaking as they become damaged. Sometimes only one strand is broken, sometimes both strands are broken simultaneously. DNA cross-linking agents are an important source of chromosome/DNA damage. Double-strand breaks occur as intermediates after the crosslinks are removed, and indeed, biallelic mutations in BRCA1 have been identified to be responsible for Fanconi Anemia, Complementation Group S (FA-S),[33] a genetic disease associated with hypersensitivity to DNA crosslinking agents. BRCA1 is part of a protein complex that repairs DNA when both strands are broken. When this happens, it is difficult for the repair mechanism to "know" how to replace the correct DNA sequence, and there are multiple ways to attempt the repair. The double-strand repair mechanism in which BRCA1 participates is homology-directed repair, where the repair proteins copy the identical sequence from the intact sister chromatid.[34] FA-S is almost always a lethal condition in utero; only a handful cases of biallelic BRCA1 mutations have been reported in literature despite the high carrier frequencies in the Ashkenazim, and none since 2013.[35]
In the nucleus of many types of normal cells, the BRCA1 protein interacts with RAD51 during repair of DNA double-strand breaks.[36] These breaks can be caused by natural radiation or other exposures, but also occur when chromosomes exchange genetic material (homologous recombination, e.g., "crossing over" during meiosis). The BRCA2 protein, which has a function similar to that of BRCA1, also interacts with the RAD51 protein. By influencing DNA damage repair, these three proteins play a role in maintaining the stability of the human genome.[37]
BRCA1 is also involved in another type of DNA repair, termed mismatch repair. BRCA1 interacts with the DNA mismatch repair protein MSH2.[38] MSH2, MSH6, PARP and some other proteins involved in single-strand repair are reported to be elevated in BRCA1-deficient mammary tumors.[39]
A protein called valosin-containing protein (VCP, also known as p97) plays a role to recruit BRCA1 to the damaged DNA sites. After ionizing radiation, VCP is recruited to DNA lesions and cooperates with the ubiquitin ligase RNF8 to orchestrate assembly of signaling complexes for efficient DSB repair.[40] BRCA1 interacts with VCP.[41] BRCA1 also interacts with c-Myc, and other proteins that are critical to maintain genome stability.[42]
BRCA1 directly binds to DNA, with higher affinity for branched DNA structures. This ability to bind to DNA contributes to its ability to inhibit the nuclease activity of the MRN complex as well as the nuclease activity of Mre11 alone.[43] This may explain a role for BRCA1 to promote lower fidelity DNA repair by non-homologous end joining (NHEJ).[44] BRCA1 also colocalizes with γ-H2AX (histone H2AX phosphorylated on serine-139) in DNA double-strand break repair foci, indicating it may play a role in recruiting repair factors.[16][45]
Formaldehyde and acetaldehyde are common environmental sources of DNA cross links that often require repairs mediated by BRCA1 containing pathways.[46]
This DNA repair function is essential; mice with loss-of-function mutations in both BRCA1 alleles are not viable, and as of 2015 only two adults were known to have loss-of-function mutations in both alleles (leading to FA-S); both had congenital or developmental issues, and both had cancer. One was presumed to have survived to adulthood because one of the BRCA1 mutations was hypomorphic.[47]
Transcription
[edit]BRCA1 was shown to co-purify with the human RNA polymerase II holoenzyme in HeLa extracts, implying it is a component of the holoenzyme.[48] Later research, however, contradicted this assumption, instead showing that the predominant complex including BRCA1 in HeLa cells is a 2 megadalton complex containing SWI/SNF.[49] SWI/SNF is a chromatin remodeling complex. Artificial tethering of BRCA1 to chromatin was shown to decondense heterochromatin, though the SWI/SNF interacting domain was not necessary for this role.[45] BRCA1 interacts with the NELF-B (COBRA1) subunit of the NELF complex.[45]
Mutations and cancer risk
[edit]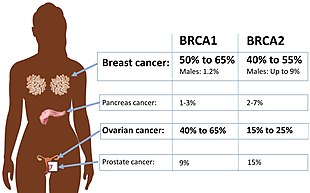
Certain variations of the BRCA1 gene lead to an increased risk for breast cancer as part of a hereditary breast–ovarian cancer syndrome. Researchers have identified hundreds of mutations in the BRCA1 gene, many of which are associated with an increased risk of cancer. Females with an abnormal BRCA1 or BRCA2 gene have up to an 80% risk of developing breast cancer by age 90; increased risk of developing ovarian cancer is about 55% for females with BRCA1 mutations and about 25% for females with BRCA2 mutations.[51]
These mutations can be changes in one or a small number of DNA base pairs (the building-blocks of DNA), and can be identified with PCR and DNA sequencing.[52]
In some cases, large segments of DNA are rearranged. Those large segments, also called large rearrangements, can be a deletion or a duplication of one or several exons in the gene. Classical methods for mutation detection (sequencing) are unable to reveal these types of mutation.[53] Other methods have been proposed: traditional quantitative PCR,[54] multiplex ligation-dependent probe amplification (MLPA),[55] and Quantitative Multiplex PCR of Short Fluorescent Fragments (QMPSF).[56] Newer methods have also been recently proposed: heteroduplex analysis (HDA) by multi-capillary electrophoresis or also dedicated oligonucleotides array based on comparative genomic hybridization (array-CGH).[57]
Some results suggest that hypermethylation of the BRCA1 promoter, which has been reported in some cancers, could be considered as an inactivating mechanism for BRCA1 expression.[58]
A mutated BRCA1 gene usually makes a protein that does not function properly. Researchers believe that the defective BRCA1 protein is unable to help fix DNA damage leading to mutations in other genes. These mutations can accumulate and may allow cells to grow and divide uncontrollably to form a tumor. Thus, BRCA1 inactivating mutations lead to a predisposition for cancer.[citation needed]
BRCA1 mRNA 3' UTR can be bound by an miRNA, Mir-17 microRNA. It has been suggested that variations in this miRNA along with Mir-30 microRNA could confer susceptibility to breast cancer.[59]
In addition to breast cancer, mutations in the BRCA1 gene also increase the risk of ovarian and prostate cancers. Moreover, precancerous lesions (dysplasia) within the fallopian tube have been linked to BRCA1 gene mutations. Pathogenic mutations anywhere in a model pathway containing BRCA1 and BRCA2 greatly increase risks for a subset of leukemias and lymphomas.[11]
Women who have inherited a defective BRCA1 or BRCA2 gene are at a greatly elevated risk to develop breast and ovarian cancer. Their risk of developing breast and/or ovarian cancer is so high, and so specific to those cancers, that many mutation carriers choose to have prophylactic surgery. There has been much conjecture to explain such apparently striking tissue specificity. Major determinants of where BRCA1/2 hereditary cancers occur are related to tissue specificity of the cancer pathogen, the agent that causes chronic inflammation or the carcinogen. The target tissue may have receptors for the pathogen, may become selectively exposed to an inflammatory process or to a carcinogen. An innate genomic deficit in a tumor suppressor gene impairs normal responses and exacerbates the susceptibility to disease in organ targets. This theory also fits data for several tumor suppressors beyond BRCA1 or BRCA2. A major advantage of this model is that it suggests there may be some options in addition to prophylactic surgery.[60]
As aforementioned, biallelic and homozygous inheritance of the BRCA1 gene leads to FA-S, which is almost always an embryonically lethal condition.
Low expression of BRCA1 in breast and ovarian cancers
[edit]BRCA1 expression is reduced or undetectable in the majority of high grade, ductal breast cancers.[61] It has long been noted that loss of BRCA1 activity, either by germ-line mutations or by down-regulation of gene expression, leads to tumor formation in specific target tissues. In particular, decreased BRCA1 expression contributes to both sporadic and inherited breast tumor progression.[62] Reduced expression of BRCA1 is tumorigenic because it plays an important role in the repair of DNA damages, especially double-strand breaks, by the potentially error-free pathway of homologous recombination.[63] Since cells that lack the BRCA1 protein tend to repair DNA damages by alternative more error-prone mechanisms, the reduction or silencing of this protein generates mutations and gross chromosomal rearrangements that can lead to progression to breast cancer.[63]
Similarly, BRCA1 expression is low in the majority (55%) of sporadic epithelial ovarian cancers (EOCs) where EOCs are the most common type of ovarian cancer, representing approximately 90% of ovarian cancers.[64] In serous ovarian carcinomas, a sub-category constituting about 2/3 of EOCs, low BRCA1 expression occurs in more than 50% of cases.[65] Bowtell[66] reviewed the literature indicating that deficient homologous recombination repair caused by BRCA1 deficiency is tumorigenic. In particular this deficiency initiates a cascade of molecular events that sculpt the evolution of high-grade serous ovarian cancer and dictate its response to therapy. Especially noted was that BRCA1 deficiency could be the cause of tumorigenesis whether due to BRCA1 mutation or any other event that causes a deficiency of BRCA1 expression.
In addition to its role in repairing DNA damages, BRCA1 facilitates apoptosis in breast and ovarian cell lines when cells are stressed by agents, including ionizing radiation, that cause DNA damages.[67] Repair of DNA damages and apoptosis are two enzymatic processes essential for maintaining genome integrity in humans. Cells that are deficient in DNA repair tend to accumulate DNA damages, and when such cells are also defective in apoptosis they tend to survive even with excess DNA damage.[68] Replication of DNA in such cells leads to mutations and these mutations may cause cancer. Thus BRCA1 appears to have two roles related to the prevention of cancer, where one role is to promote repair of a specific class of damages and the second role is to induce apoptosis if the level of such DNA damage is beyond the cell's repair capability[68]
Mutation of BRCA1 in breast and ovarian cancer
[edit]Only about 3%–8% of all women with breast cancer carry a mutation in BRCA1 or BRCA2.[69] Similarly, BRCA1 mutations are only seen in about 18% of ovarian cancers (13% germline mutations and 5% somatic mutations).[70]
Thus, while BRCA1 expression is low in the majority of these cancers, BRCA1 mutation is not a major cause of reduced expression. Certain latent viruses, which are frequently detected in breast cancer tumors, can decrease the expression of the BRCA1 gene and cause the development of breast tumors.[71]
BRCA1 promoter hypermethylation in breast and ovarian cancer
[edit]BRCA1 promoter hypermethylation was present in only 13% of unselected primary breast carcinomas.[72] Similarly, BRCA1 promoter hypermethylation was present in only 5% to 15% of EOC cases.[64]
Thus, while BRCA1 expression is low in these cancers, BRCA1 promoter methylation is only a minor cause of reduced expression.
MicroRNA repression of BRCA1 in breast cancers
[edit]There are a number of specific microRNAs, when overexpressed, that directly reduce expression of specific DNA repair proteins (see MicroRNA section DNA repair and cancer) In the case of breast cancer, microRNA-182 (miR-182) specifically targets BRCA1.[73] Breast cancers can be classified based on receptor status or histology, with triple-negative breast cancer (15%–25% of breast cancers), HER2+ (15%–30% of breast cancers), ER+/PR+ (about 70% of breast cancers), and Invasive lobular carcinoma (about 5%–10% of invasive breast cancer). All four types of breast cancer were found to have an average of about 100-fold increase in miR-182, compared to normal breast tissue.[74] In breast cancer cell lines, there is an inverse correlation of BRCA1 protein levels with miR-182 expression.[73] Thus it appears that much of the reduction or absence of BRCA1 in high grade ductal breast cancers may be due to over-expressed miR-182.
In addition to miR-182, a pair of almost identical microRNAs, miR-146a and miR-146b-5p, also repress BRCA1 expression. These two microRNAs are over-expressed in triple-negative tumors and their over-expression results in BRCA1 inactivation.[75] Thus, miR-146a and/or miR-146b-5p may also contribute to reduced expression of BRCA1 in these triple-negative breast cancers.
MicroRNA repression of BRCA1 in ovarian cancers
[edit]In both serous tubal intraepithelial carcinoma (the precursor lesion to high grade serous ovarian carcinoma (HG-SOC)), and in HG-SOC itself, miR-182 is overexpressed in about 70% of cases.[76] In cells with over-expressed miR-182, BRCA1 remained low, even after exposure to ionizing radiation (which normally raises BRCA1 expression).[76] Thus much of the reduced or absent BRCA1 in HG-SOC may be due to over-expressed miR-182.
Another microRNA known to reduce expression of BRCA1 in ovarian cancer cells is miR-9.[64] Among 58 tumors from patients with stage IIIC or stage IV serous ovarian cancers (HG-SOG), an inverse correlation was found between expressions of miR-9 and BRCA1,[64] so that increased miR-9 may also contribute to reduced expression of BRCA1 in these ovarian cancers.
Deficiency of BRCA1 expression is likely tumorigenic
[edit]DNA damage appears to be the primary underlying cause of cancer,[77] and deficiencies in DNA repair appears to underlie many forms of cancer.[78] If DNA repair is deficient, DNA damage tends to accumulate. Such excess DNA damage may increase mutational errors during DNA replication due to error-prone translesion synthesis. Excess DNA damage may also increase epigenetic alterations due to errors during DNA repair.[79][80] Such mutations and epigenetic alterations may give rise to cancer. The frequent microRNA-induced deficiency of BRCA1 in breast and ovarian cancers likely contribute to the progression of those cancers.
Germ-line mutations and founder effect
[edit]All germ-line BRCA1 mutations identified to date have been inherited, suggesting the possibility of a large "founder" effect in which a certain mutation is common to a well-defined population group and can, in theory, be traced back to a common ancestor. Given the complexity of mutation screening for BRCA1, these common mutations may simplify the methods required for mutation screening in certain populations. Analysis of mutations that occur with high frequency also permits the study of their clinical expression.[81] Examples of manifestations of a founder effect are seen among Ashkenazi Jews. Three mutations in BRCA1 have been reported to account for the majority of Ashkenazi Jewish patients with inherited BRCA1-related breast and/or ovarian cancer: 185delAG, 188del11 and 5382insC in the BRCA1 gene.[82][83] In fact, it has been shown that if a Jewish woman does not carry a BRCA1 185delAG, BRCA1 5382insC founder mutation, it is highly unlikely that a different BRCA1 mutation will be found.[84] Additional examples of founder mutations in BRCA1 are given in Table 1 (mainly derived from[81]).
| Population or subgroup | BRCA1 mutation(s)[85] | Reference(s) |
|---|---|---|
| African-Americans | 943ins10, M1775R | [86] |
| Afrikaners | E881X, 1374delC | [87][88] |
| Ashkenazi Jewish | 185delAG, 188del11, 5382insC | [82][83] |
| Austrians | 2795delA, C61G, 5382insC, Q1806stop | [89] |
| Belgians | 2804delAA, IVS5+3A>G | [90][91] |
| Dutch | Exon 2 deletion, exon 13 deletion, 2804delAA | [90][92][93] |
| Finns | 3745delT, IVS11-2A>G | [94][95] |
| French | 3600del11, G1710X | [96] |
| French Canadians | C4446T | [97] |
| Germans | 5382insC, 4184del4 | [98][99] |
| Greeks | 5382insC | [100] |
| Hungarians | 300T>G, 5382insC, 185delAG | [101] |
| Italians | 5083del19 | [102] |
| Japanese | L63X, Q934X | [103] |
| Native North Americans | 1510insG, 1506A>G | [104] |
| Northern Irish | 2800delAA | [105] |
| Norwegians | 816delGT, 1135insA, 1675delA, 3347delAG | [106][107] |
| Pakistanis | 2080insA, 3889delAG, 4184del4, 4284delAG, IVS14-1A>G | [108] |
| Poles | 300T>G, 5382insC, C61G, 4153delA | [109][110] |
| Russians | 5382insC, 4153delA | [111] |
| Scots | 2800delAA | [105][112] |
| Spaniards | R71G | [113][114] |
| Swedes | Q563X, 3171ins5, 1201del11, 2594delC | [86][115] |
Female fertility
[edit]As women age, reproductive performance declines, leading to menopause. This decline is tied to a reduction in the number of ovarian follicles. Although about 1 million oocytes are present at birth in the human ovary, only about 500 (about 0.05%) of these ovulate. The decline in ovarian reserve appears to occur at a constantly increasing rate with age,[116] and leads to nearly complete exhaustion of the reserve by about age 52. As ovarian reserve and fertility decline with age, there is also a parallel increase in pregnancy failure and meiotic errors, resulting in chromosomally abnormal conceptions.[117]
Women with a germ-line BRCA1 mutation appear to have a diminished oocyte reserve and decreased fertility compared to normally aging women.[118] Furthermore, women with an inherited BRCA1 mutation undergo menopause prematurely.[119] Since BRCA1 is a key DNA repair protein, these findings suggest that naturally occurring DNA damages in oocytes are repaired less efficiently in women with a BRCA1 defect, and that this repair inefficiency leads to early reproductive failure.[118]
As noted above, the BRCA1 protein plays a key role in homologous recombinational repair. This is the only known cellular process that can accurately repair DNA double-strand breaks. DNA double-strand breaks accumulate with age in humans and mice in primordial follicles.[120] Primordial follicles contain oocytes that are at an intermediate (prophase I) stage of meiosis. Meiosis is the general process in eukaryotic organisms by which germ cells are formed, and it is likely an adaptation for removing DNA damages, especially double-strand breaks, from germ line DNA.[121] (Also see article Meiosis). Homologous recombinational repair employing BRCA1 is especially promoted during meiosis. It was found that expression of four key genes necessary for homologous recombinational repair of DNA double-strand breaks (BRCA1, MRE11, RAD51 and ATM) decline with age in the oocytes of humans and mice,[120] leading to the hypothesis that DNA double-strand break repair is necessary for the maintenance of oocyte reserve and that a decline in efficiency of repair with age plays a role in ovarian aging.
Cancer chemotherapy
[edit]Non-small cell lung cancer (NSCLC) is the leading cause of cancer deaths worldwide. At diagnosis, almost 70% of persons with NSCLC have locally advanced or metastatic disease. Persons with NSCLC are often treated with therapeutic platinum compounds (e.g. cisplatin, carboplatin or oxaliplatin) that cause inter-strand cross-links in DNA. Among individuals with NSCLC, low expression of BRCA1 in the primary tumor correlated with improved survival after platinum-containing chemotherapy.[122][123] This correlation implies that low BRCA1 in cancer, and the consequent low level of DNA repair, causes vulnerability of cancer to treatment by the DNA cross-linking agents. High BRCA1 may protect cancer cells by acting in a pathway that removes the damages in DNA introduced by the platinum drugs. Thus the level of BRCA1 expression is a potentially important tool for tailoring chemotherapy in lung cancer management.[122][123]
Level of BRCA1 expression is also relevant to ovarian cancer treatment. Patients having sporadic ovarian cancer who were treated with platinum drugs had longer median survival times if their BRCA1 expression was low compared to patients with higher BRCA1 expression (46 compared to 33 months).[124]
Patents, enforcement, litigation, and controversy
[edit]Заявка на патент на изолированный ген BRCA1 и мутации, способствующие раку, обсуждавшиеся выше, а также на методы диагностики вероятности заболевания раком молочной железы была подана Университетом Юты, Национальным институтом наук об охране окружающей среды (NIEHS) и Myriad Genetics в 1994 году. ; [17] over the next year, Myriad, (in collaboration with investigators at Endo Recherche, Inc., HSC Research & Development Limited Partnership, and University of Pennsylvania), isolated and sequenced the BRCA2 gene and identified key mutations, and the first BRCA2 patent was filed in the U.S. by Myriad and other institutions in 1995.[18] Myriad is the exclusive licensee of these patents and has enforced them in the US against clinical diagnostic labs.[20] This business model led from Myriad being a startup in 1994 to being a publicly traded company with 1200 employees and about $500M in annual revenue in 2012;[19] it also led to controversy over high prices and the inability to get second opinions from other diagnostic labs, which in turn led to the landmark Association for Molecular Pathology v. Myriad Genetics lawsuit.[20][ 125 ] Срок действия патентов начал истекать в 2014 году.
Согласно статье, опубликованной в журнале « Генетическая медицина » в 2010 году: «История с патентами за пределами Соединенных Штатов более сложна… Например, патенты были получены, но они игнорируются провинциальными системами здравоохранения в Канаде. В Австралии и Великобритании лицензиат Myriad разрешил использование Myriad в системах здравоохранения, но объявил об изменении планов в августе 2008 года. В единственном общеевропейском патенте Myriad была запатентована только одна мутация, хотя некоторые патенты все еще находятся на рассмотрении в рамках процедуры возражения. По сути, Соединенные Штаты являются единственной юрисдикцией, где сильная патентная позиция Myriad предоставила статус единственного поставщика». [ 126 ] [ 127 ] Питер Мелдрам, генеральный директор Myriad Genetics, признал, что у Myriad есть «другие конкурентные преимущества, которые могут сделать такое [патентное] обеспечение ненужным» в Европе. [ 128 ]
Как и в случае с любым другим геном, найти вариации в BRCA1 несложно. Реальная ценность заключается в понимании клинических последствий любого конкретного варианта. У Myriad есть большая собственная база данных таких корреляций генотип-фенотип. В ответ на это разрабатываются параллельные базы данных с открытым исходным кодом.
Юридические решения, касающиеся патентов BRCA1 и BRCA2, повлияют на область генетического тестирования в целом. [ 129 ] В статье, опубликованной в июне 2013 года в деле «Ассоциация молекулярной патологии против Myriad Genetics» (№ 12-398), цитировалось единогласное постановление Верховного суда США о том, что «естественный сегмент ДНК является продуктом природы и не подлежит патентованию только потому, что он был изолирован», что делает недействительными патенты Myriad на гены BRCA1 и BRCA2. Однако Суд также постановил, что манипуляция геном с целью создания чего-то, не встречающегося в природе, все еще может иметь право на патентную защиту. [ 130 ] Федеральный суд Австралии пришел к противоположному выводу, подтвердив в феврале 2013 года действительность патента австралийской компании Myriad Genetics на ген BRCA1. [ 131 ] Федеральный суд также отклонил апелляцию в сентябре 2014 года. [ 132 ] Ивонн Д'Арси выиграла дело против американской биотехнологической компании Myriad Genetics в Высоком суде Австралии . В своем единогласном решении от 7 октября 2015 года «высокий суд установил, что выделенная нуклеиновая кислота, кодирующая белок BRCA1, со специфическими отклонениями от нормы, которые указывают на предрасположенность к раку молочной железы и раку яичников, не является «запатентованным изобретением». .'" [ 133 ]
Взаимодействия
[ редактировать ]Было показано, что BRCA1 взаимодействует со следующими белками:
- АБЛ1 [ 134 ]
- АКТ1 [ 135 ] [ 136 ]
- АР [ 137 ]
- ATR [ 138 ] [ 139 ] [ 140 ] [ 141 ]
- банкомат [ 15 ] [ 138 ] [ 139 ] [ 140 ] [ 141 ] [ 142 ] [ 143 ]
- АТФ1 [ 144 ]
- БАХ1 [ 145 ]
- БАРД1 [ 28 ] [ 38 ] [ 42 ] [ 145 ]
- БРЦА2 [ 146 ] [ 147 ] [ 148 ] [ 149 ]
- БРСС3 [ 146 ]
- БРЭ [ 146 ]
- БРИП1 [ 32 ] [ 150 ] [ 151 ] [ 152 ] [ 153 ]
- С-июнь [ 154 ]
- CHEK2 [ 155 ] [ 156 ]
- КЛСПН [ 157 ]
- КОБРА1 [ 45 ]
- КРЕББП [ 158 ] [ 159 ] [ 160 ] [ 161 ] [ 162 ]
- ЦСНК2Б [ 163 ]
- CSTF2 [ 164 ] [ 165 ]
- CDK2 [ 166 ] [ 167 ] [ 168 ]
- DHX9 [ 169 ] [ 170 ]
- ЕЛК4 [ 171 ]
- ЭП300 [ 159 ] [ 161 ]
- СОЭ1 [ 161 ] [ 172 ] [ 173 ] [ 174 ]
- Фэнтези [ 175 ]
- ФАНКД2 [ 176 ] [ 148 ]
- ФХЛ2 [ 177 ] [ 178 ]
- H2AFX [ 179 ] [ 180 ] [ 181 ]
- ЮНБ [ 154 ]
- ЮнД [ 154 ]
- ЛМО4 [ 182 ] [ 183 ]
- МАП3К3 [ 184 ]
- МЕД17 [ 185 ] [ 186 ]
- МЕД21 [ 48 ]
- МРЭ11А [ 15 ] [ 185 ] [ 187 ] [ 43 ]
- МШ2 [ 15 ] [ 38 ]
- МШ3 [ 38 ] [ 150 ]
- MH6 [ 15 ] [ 38 ]
- Мик [ 42 ] [ 188 ] [ 189 ] [ 190 ]
- НБН [ 15 ] [ 185 ] [ 187 ]
- НМИ [ 188 ]
- НПМ1 [ 191 ]
- НКОА2 [ 150 ] [ 192 ]
- НУФИП1 [ 193 ]
- P53 [ 146 ] [ 160 ] [ 194 ] [ 195 ] [ 196 ]
- ПАЛБ2 [ 197 ]
- ПОЛР2А [ 185 ] [ 48 ] [ 198 ] [ 199 ]
- PPP1CA [ 200 ]
- Рад50 [ 15 ] [ 185 ] [ 187 ]
- РАД51 [ 38 ] [ 146 ] [ 147 ] [ 201 ]
- РББП4 [ 202 ]
- РББП7 [ 202 ] [ 203 ] [ 204 ]
- РББП8 [ 205 ] [ 150 ] [ 206 ] [ 207 ] [ 208 ] [ 209 ] [ 210 ]
- РЕЛА [ 158 ]
- РБ1 [ 202 ] [ 211 ] [ 212 ]
- 1 руб. [ 211 ]
- РБЛ2 [ 211 ]
- РПЛ31 [ 204 ]
- SMARCA4 [ 49 ] [ 213 ]
- SMARCB1 [ 49 ]
- СТАТ1 [ 214 ]
- ТОПБП1 [ 215 ]
- УБЭ2Д1 [ 179 ] [ 216 ] [ 217 ] [ 218 ] [ 180 ] [ 146 ] [ 191 ] [ 176 ] [ 219 ] [ 220 ]
- USF2 [ 221 ]
- ВКП [ 41 ]
- ХИСТ [ 222 ] [ 223 ]
- ЗНФ350 [ 224 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000012048 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000017146 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Хамель П.Дж. (29 мая 2007 г.). «BRCA1 и BRCA2: больше не единственные проблемные гены» . Центр здоровья . Проверено 2 июля 2010 г.
- ^ Перейти обратно: а б «Геновое дерево BRCA1» . ансамбль
- ^ Дункан Дж.А., Ривз-младший, Кук Т.Г. (октябрь 1998 г.). «Белки BRCA1 и BRCA2: роль в здоровье и болезни» . Молекулярная патология . 51 (5): 237–47. дои : 10.1136/mp.51.5.237 . ПМЦ 395646 . ПМИД 10193517 .
- ^ Ёсида К., Мики Ю (ноябрь 2004 г.). «Роль BRCA1 и BRCA2 как регуляторов репарации ДНК, транскрипции и клеточного цикла в ответ на повреждение ДНК» . Раковая наука . 95 (11): 866–71. дои : 10.1111/j.1349-7006.2004.tb02195.x . ПМЦ 11159131 . ПМИД 15546503 . S2CID 24297965 .
- ^ Проверьте W (сентябрь 2006 г.). «BRCA: Что мы знаем сейчас» . Колледж американских патологов . Проверено 23 августа 2010 г.
- ^ Перейти обратно: а б Ирмингер-Фингер И., Ратайска М., Пилюгин М. (2016). «Новые концепции BARD1: регулятор путей BRCA и не только» . Международный журнал биохимии и клеточной биологии . 72 : 1–17. дои : 10.1016/j.biocel.2015.12.008 . ПМИД 26738429 .
- ^ Перейти обратно: а б с д Фриденсон Б. (август 2007 г.). «Путь BRCA1/2 предотвращает гематологический рак в дополнение к раку молочной железы и яичников» . БМК Рак . 7 : 152–162. дои : 10.1186/1471-2407-7-152 . ЧВК 1959234 . ПМИД 17683622 .
- ^ Фриденсон Б (8 июня 2008 г.). «Гены рака молочной железы защищают от некоторых лейкозов и лимфом» (видео) . SciVee.
- ^ «Генетический скрининг рака молочной железы и яичников» . Медицинский фонд Пало-Альто. Архивировано из оригинала 4 октября 2008 года . Проверено 11 октября 2008 г.
- ^ О'Донован П.Дж., Ливингстон DM (апрель 2010 г.). «BRCA1 и BRCA2: продукты генов предрасположенности к раку молочной железы/яичников и участники восстановления двухцепочечных разрывов ДНК» . Канцерогенез . 31 (6): 961–7. дои : 10.1093/carcin/bgq069 . ПМИД 20400477 .
- ^ Перейти обратно: а б с д и ж г Ван Ю, Кортес Д., Язди П., Нефф Н., Элледж С.Дж., Цинь Дж. (апрель 2000 г.). «BASC, суперкомплекс белков, связанных с BRCA1, участвующих в распознавании и восстановлении аберрантных структур ДНК» . Генс Дев . 14 (8): 927–39. дои : 10.1101/gad.14.8.927 . ПМК 316544 . ПМИД 10783165 .
- ^ Перейти обратно: а б Старита Л.М., Парвин Дж.Д. (2003). «Множественные ядерные функции BRCA1: транскрипция, убиквитинирование и репарация ДНК». Современное мнение в области клеточной биологии . 15 (3): 345–350. дои : 10.1016/S0955-0674(03)00042-5 . ПМИД 12787778 .
- ^ Перейти обратно: а б с Патент США 5747282 , Сколник Х.С., Голдгар Д.Е., Мики Й., Свенсон Дж., Камб А., Харшман К.Д., Шаттук-Эйденс Д.М., Тавтигян С.В., Уайзман Р.В., Фуреал П.А., «7Q-связанный ген предрасположенности к раку молочной железы и яичников», выдан в 1998 г. -05-05, закреплен за Myriad Genetics, Inc., США. Америка в лице министра здравоохранения и социальных служб и Исследовательского фонда Университета Юты.
- ^ Перейти обратно: а б Патент США 5837492 , Тавтигян С.В., Камб А., Симард Дж., Коуч Ф., Ромменс Дж.М., Вебер Б.Л., «Ген предрасположенности к раку молочной железы, связанный с хромосомой 13», выдан 17 ноября 1998 г., передан Myriad Genetics, Inc., Endo Recherche. , Inc., Товарищество с ограниченной ответственностью HSC Research & Development, Попечители Пенсильванского университета
- ^ Перейти обратно: а б Страница Myriad Investor - см. «Мириады с первого взгляда». Архивировано 18 октября 2012 г. на Wayback Machine , доступ октябрь 2012 г.
- ^ Перейти обратно: а б с Шварц Дж. (12 мая 2009 г.). «Больные раком бросают вызов патентованию гена» . Нью-Йорк Таймс . Здоровье.
- ^ Холл Дж.М., Ли М.К., Ньюман Б., Морроу Дж.Э., Андерсон Л.А., Хьюи Б. и др. (декабрь 1990 г.). «Связь раннего семейного рака молочной железы с хромосомой 17q21». Наука . 250 (4988): 1684–9. Бибкод : 1990Sci...250.1684H . дои : 10.1126/science.2270482 . ПМИД 2270482 .
- ^ Высокоэффективная наука: отслеживание генов BRCA (Часть 1). Архивировано 20 февраля 2016 г. в Wayback Machine - научный блог Cancer Research UK, 2012 г.
- ^ Мики Й., Свенсен Дж., Шаттук-Эйденс Д., Фуреал П.А., Харшман К., Тавтигян С. и др. (октябрь 1994 г.). «Сильный кандидат на ген предрасположенности к раку молочной железы и яичников BRCA1» . Наука . 266 (5182): 66–71. Бибкод : 1994Sci...266...66M . дои : 10.1126/science.7545954 . ПМИД 7545954 .
- ^ Патерсон Дж.В. (февраль 1998 г.). «BRCA1: обзор структуры и предполагаемых функций» . Дис. Маркеры . 13 (4): 261–74. дои : 10.1155/1998/298530 . ПМИД 9553742 .
- ^ Хендерсон Б.Р. (сентябрь 2005 г.). «Регуляция внутриклеточного трафика BRCA1, BRCA2 и BARD1». Биоэссе . 27 (9): 884–93. дои : 10.1002/bies.20277 . ПМИД 16108063 . S2CID 10138907 .
- ^ Номер доступа к универсальному белковому ресурсу P38398 для «Белка восприимчивости к раку молочной железы типа 1» в UniProt .
- ^ Перейти обратно: а б Кларк С.Л., Родригес А.М., Снайдер Р.Р., Ханкинс Г.Д., Боенинг Д. (апрель 2012 г.). «Структура-функция опухолевого супрессора BRCA1» . Comput Struct Biotechnol Дж . 1 (1): e201204005. дои : 10.5936/csbj.201204005 . ПМК 3380633 . ПМИД 22737296 .
- ^ Перейти обратно: а б с д Бжович П.С., Раджагопал П., Хойт Д.В., Кинг М.С., Клевит Р.Э. (октябрь 2001 г.). «Структура гетеродимерного комплекса RING-RING BRCA1-BARD1». Структурная и молекулярная биология природы . 8 (10): 833–7. дои : 10.1038/nsb1001-833 . ПМИД 11573085 . S2CID 37617901 .
- ^ Баер Р. (октябрь 2001 г.). «Конец виден: изображения супрессора опухоли BRCA1». Структурная и молекулярная биология природы . 8 (10): 822–4. дои : 10.1038/nsb1001-822 . ПМИД 11573079 . S2CID 20552445 .
- ^ Перейти обратно: а б Уильямс Р.С., Грин Р., Гловер Дж.Н. (октябрь 2001 г.). «Кристаллическая структура области повторов BRCT из белка BRCA1, связанного с раком молочной железы». Структурная и молекулярная биология природы . 8 (10): 838–42. дои : 10.1038/nsb1001-838 . ПМИД 11573086 . S2CID 19275284 .
- ^ Хайтон Т., Бейтс П.А., Чжан X, Штернберг М.Дж., Фримонт П.С. (август 2000 г.). «С-концевой домен BRCA1: структура и функция». Мутат. Рез . 460 (3–4): 319–32. дои : 10.1016/S0921-8777(00)00034-3 . ПМИД 10946236 .
- ^ Перейти обратно: а б Джу В.С., Джеффри П.Д., Кантор С.Б., Финнин М.С., Ливингстон Д.М., Павлетич Н.П. (март 2002 г.). «Структура региона BRCT 53BP1, связанного с p53, и ее сравнение со структурой BRCT Brca1» . Генс Дев . 16 (5): 583–93. дои : 10.1101/gad.959202 . ПМК 155350 . ПМИД 11877378 .
- ^ Сойер С.Л., Тиан Л., Кахконен М., Шварцентрубер Дж., Кирхер М., Маевски Дж. и др. (2014). «Биаллельные мутации в BRCA1 вызывают новый подтип анемии Фанкони» . Рак Дисков . 5 (2): 135–42. дои : 10.1158/2159-8290.CD-14-1156 . ПМК 4320660 . ПМИД 25472942 .
- ^ «Биологические страницы Кимбалла» . Архивировано из оригинала 12 февраля 2018 г. Проверено 25 февраля 2010 г.
- ^ Домчек С.М., Тан Дж., Стопфер Дж., Лилли Д.Р., Хамель Н., Тишковитц М. и др. (апрель 2013 г.). «Биаллельные вредные мутации BRCA1 у женщины с ранним раком яичников» . Открытие рака . 3 (4): 399–405. дои : 10.1158/2159-8290.CD-12-0421 . ПМЦ 3625496 . ПМИД 23269703 .
- ^ Бултон С.Дж. (ноябрь 2006 г.). «Клеточные функции белков-супрессоров опухолей BRCA». Биохим. Соц. Транс . 34 (Часть 5): 633–45. дои : 10.1042/BST0340633 . ПМИД 17052168 .
- ^ Рой Р., Чун Дж., Пауэлл С.Н. (декабрь 2011 г.). «BRCA1 и BRCA2: разные роли в общем пути защиты генома» . Обзоры природы. Рак . 12 (1): 68–78. дои : 10.1038/nrc3181 . ПМЦ 4972490 . ПМИД 22193408 .
- ^ Перейти обратно: а б с д и ж Ван Ц., Чжан Х., Герретт С., Чен Дж., Мазурек А., Уилсон Т. и др. (август 2001 г.). «Аденозиновый нуклеотид модулирует физическое взаимодействие между hMSH2 и BRCA1» . Онкоген . 20 (34): 4640–9. дои : 10.1038/sj.onc.1204625 . ПМИД 11498787 .
- ^ Вармоэс М., Джасперс Дж.Э., Фам ТВ, Пирсма С.Р., Уджноег Г., Массинк М.П. и др. (июль 2012 г.). «Протеомика опухолей молочной железы с дефицитом BRCA1 у мышей идентифицирует белки репарации ДНК, имеющие потенциальную диагностическую и прогностическую ценность при раке молочной железы человека» . Мол. Клетка. Протеомика . 11 (7): М111.013334-1-М111.013334-19. дои : 10.1074/mcp.M111.013334 . ПМЦ 3394939 . ПМИД 22366898 .
- ^ Миранг М., Ритц Д., Паливал С., Гаражова З., Боссхард М., Майланд Н. и др. (ноябрь 2011 г.). «Убиквитин-селективная сегрегаза VCP/p97 управляет реакцией на двухцепочечные разрывы ДНК». Нат. Клеточная Биол . 13 (11): 1376–82. дои : 10.1038/ncb2367 . ПМИД 22020440 . S2CID 22109822 .
- ^ Перейти обратно: а б Чжан Х., Ван Ц., Каджино К., Грин М.И. (май 2000 г.). «VCP, слабая АТФаза, участвующая во многих клеточных событиях, физически взаимодействует с BRCA1 в ядре живых клеток». ДНК Клеточная Биол . 19 (5): 253–63. дои : 10.1089/10445490050021168 . ПМИД 10855792 .
- ^ Перейти обратно: а б с Ван Ц, Чжан Х, Каджино К., Грин М.И. (октябрь 1998 г.). «BRCA1 связывает c-Myc и ингибирует его транскрипционную и трансформирующую активность в клетках» . Онкоген . 17 (15): 1939–48. дои : 10.1038/sj.onc.1202403 . ПМИД 9788437 .
- ^ Перейти обратно: а б Полл Т.Т., Кортес Д., Бауэрс Б., Элледж С.Дж., Геллерт М. (2001). «Прямое связывание ДНК с помощью Brca1» . Труды Национальной академии наук . 98 (11): 6086–91. дои : 10.1073/pnas.111125998 . ПМК 33426 . ПМИД 11353843 .
- ^ Дюрант С.Т., Николофф Дж.А. (2005). «Удачное время клеточного цикла для точного восстановления ДНК с помощью BRCA1» . Клеточный цикл . 4 (9): 1216–22. дои : 10.4161/cc.4.9.2027 . ПМИД 16103751 .
- ^ Перейти обратно: а б с д Йе Кью, Ху Ю.Ф., Чжун Х., Най А.С., Бельмонт А.С., Ли Р. (декабрь 2001 г.). «Крупномасштабное развертывание хроматина, индуцированное BRCA1, и аллель-специфические эффекты мутаций, предрасполагающих к раку» . Дж. Клеточная Биол . 155 (6): 911–21. дои : 10.1083/jcb.200108049 . ПМК 2150890 . ПМИД 11739404 .
- ^ Ридпат Дж.Р., Накамура А., Тано К., Люк А.М., Сонода Э., Аракава Х. и др. (декабрь 2007 г.). «Клетки, дефицитные по пути FANC/BRCA, гиперчувствительны к уровням формальдегида в плазме» . Рак Рез . 67 (23): 11117–22. дои : 10.1158/0008-5472.CAN-07-3028 . ПМИД 18056434 .
- ^ Пракаш Р., Чжан Ю, Фэн В., Джасин М. (апрель 2015 г.). «Гомологичная рекомбинация и здоровье человека: роль BRCA1, BRCA2 и связанных с ними белков» . Перспективы Колд-Спринг-Харбор в биологии . 7 (4): а016600. doi : 10.1101/cshperspect.a016600 . ПМЦ 4382744 . ПМИД 25833843 .
- ^ Перейти обратно: а б с Скалли Р., Андерсон С.Ф., Чао Д.М., Вэй В., Йе Л., Янг Р.А. и др. (май 1997 г.). «BRCA1 является компонентом голофермента РНК-полимеразы II» . Учеб. Натл. акад. наук. США . 94 (11): 5605–10. Бибкод : 1997PNAS...94.5605S . дои : 10.1073/pnas.94.11.5605 . ПМК 20825 . ПМИД 9159119 .
- ^ Перейти обратно: а б с Бочар Д.А., Ван Л., Бения Х., Кинев А., Сюэ Ю., Лейн В.С. и др. (июль 2000 г.). «BRCA1 связан с комплексом, связанным с SWI/SNF человека: связывая ремоделирование хроматина с раком молочной железы» . Клетка . 102 (2): 257–65. дои : 10.1016/S0092-8674(00)00030-1 . ПМИД 10943845 .
- ^ Петручелли Н., Дейли М.Б., Пал Т. (декабрь 2016 г.) [сентябрь 1998 г.]. «BRCA1- и BRCA2-ассоциированный наследственный рак молочной железы и яичников» . Адам М.П., Ардингер Х.Х., Пагон Р.А., Уоллес С.Е., Бин Л.Дж., Мирзаа Г., Амемия А. (ред.). Джин Обзоры . Вашингтонский университет, Сиэтл. ПМИД 20301425 . НБК1247.
- ^ «Генетика» . Сайт рака груди. 17 сентября 2012 г.
- ^ Эльстродт Ф., Холлестелле А., Нагель Дж. Х., Горин М., Василевски М., ван ден Оувеланд А. и др. (январь 2006 г.). «Анализ мутаций BRCA1 41 клеточной линии рака молочной железы человека выявил три новых вредных мутанта». Исследования рака . 66 (1): 41–45. дои : 10.1158/0008-5472.CAN-05-2853 . ПМИД 16397213 .
- ^ Мазойер С. (май 2005 г.). «Геномные перестройки в генах BRCA1 и BRCA2» . Хм. Мутат . 25 (5): 415–22. дои : 10.1002/humu.20169 . ПМИД 15832305 . S2CID 32023181 .
- ^ Барруа М., Бьеш И., Мазуайе С., Шампем М.Х., Брессак-де Пайере Б., Лидеро Р. (февраль 2004 г.). «Анализ дозировки генов на основе ПЦР в реальном времени для выявления перестроек BRCA1 в семьях с раком молочной железы и яичников». Клин. Жене . 65 (2): 131–6. дои : 10.1111/j.0009-9163.2004.00200.x . ПМИД 14984472 . S2CID 11583160 .
- ^ Хогерворст Ф.Б., Недерлоф П.М., Гилле Дж.Дж., МакЭлганн С.Дж., Гриппелинг М., Прунтель Р. и др. (апрель 2003 г.). «Крупные геномные делеции и дупликации гена BRCA1, выявленные новым количественным методом». Рак Рез . 63 (7): 1449–53. ПМИД 12670888 .
- ^ Касилли Ф., Ди Рокко З.К., Гад С., Турнье И., Стоппа-Лионне Д., Фребур Т. и др. (сентябрь 2002 г.). «Быстрое обнаружение новых перестроек BRCA1 в семьях с высоким риском рака молочной железы и яичников с использованием мультиплексной ПЦР коротких флуоресцентных фрагментов» . Хм. Мутат . 20 (3): 218–26. дои : 10.1002/humu.10108 . ПМИД 12203994 . S2CID 24737909 .
- ^ Руло Э., Лефол С., Тозлу С., Андрие С., Гай С., Копиньи Ф. и др. (сентябрь 2007 г.). «Массив олигонуклеотидов высокого разрешения-CGH применяется для обнаружения и характеристики крупных перестроек в наследственном гене рака молочной железы BRCA1». Клин. Жене . 72 (3): 199–207. дои : 10.1111/j.1399-0004.2007.00849.x . ПМИД 17718857 . S2CID 2393567 .
- ^ Тапиа Т., Смолли С.В., Коэн П., Муньос А., Солис Л.М., Корвалан А. и др. (2008). «Гиперметилирование промотора BRCA1 коррелирует с отсутствием экспрессии в наследственных опухолях рака молочной железы» . Эпигенетика . 3 (3): 157–63. дои : 10.4161/epi.3.3.6387 . ПМИД 18567944 . S2CID 35616414 .
- ^ Шен Дж., Амброзон CB, Чжао Х. (март 2009 г.). «Новые генетические варианты генов микроРНК и семейный рак молочной железы» . Межд. Дж. Рак . 124 (5): 1178–82. дои : 10.1002/ijc.24008 . ПМИД 19048628 .
- ^ Левин Б., Лех Д., Фриденсон Б. (2012). «Доказательства того, что рак, связанный с BRCA1 или BRCA2, не является неизбежным» . Мол Мед . 18 (9): 1327–37. дои : 10.2119/molmed.2012.00280 . ПМЦ 3521784 . ПМИД 22972572 .
- ^ Уилсон К.А., Рамос Л., Вильясеньор М.Р., Андерс К.Х., Пресс М.Ф., Кларк К. и др. (1999). «Локализация человеческого BRCA1 и его потеря при ненаследственных карциномах молочной железы высокой степени злокачественности». Нат. Жене . 21 (2): 236–40. дои : 10.1038/6029 . ПМИД 9988281 . S2CID 7988460 .
- ^ Мюллер CR, CD Роскелли (2003). «Регуляция экспрессии BRCA1 и ее связь со спорадическим раком молочной железы» . Рак молочной железы . 5 (1): 45–52. дои : 10.1186/bcr557 . ПМК 154136 . ПМИД 12559046 .
- ^ Перейти обратно: а б Хасинто Ф.В., Эстеллер М (2007). «Мутаторные пути, вызванные эпигенетическим молчанием при раке человека» . Мутагенез . 22 (4): 247–53. дои : 10.1093/mutage/gem009 . ПМИД 17412712 .
- ^ Перейти обратно: а б с д Сунь С., Ли Н., Ян З., Чжоу Б., Хэ Ю., Венг Д. и др. (2013). «Регуляция миР-9 BRCA1 и чувствительность рака яичников к ингибированию цисплатина и PARP» . Дж. Натл. Онкологический институт . 105 (22): 1750–8. дои : 10.1093/jnci/djt302 . ПМИД 24168967 .
- ^ Макмиллен Б.Д., Апонте М.М., Лю З., Хеленовски И.Б., Шолтенс Д.М., Буттин Б.М. и др. (2012). «Анализ экспрессии MIR182 и связанных с ним генов-мишеней при распространенной карциноме яичников» . Мод. Патол . 25 (12): 1644–53. дои : 10.1038/modpathol.2012.118 . ПМИД 22790015 .
- ^ Боутелл Д.Д. (2010). «Генезис и эволюция серозного рака яичников высокой степени злокачественности». Нат. Преподобный Рак . 10 (11): 803–8. дои : 10.1038/nrc2946 . ПМИД 20944665 . S2CID 22688947 .
- ^ Тангараджу М., Кауфманн С.Х., Коуч Ф.Дж. (октябрь 2000 г.). «BRCA1 способствует индуцированному стрессом апоптозу в клеточных линиях рака молочной железы и яичников» . J Биол Хим . 275 (43): 33487–96. дои : 10.1074/jbc.M005824200 . ПМИД 10938285 .
- ^ Перейти обратно: а б Бернштейн С., Бернштейн Х., Пейн С.М., Гаревал Х. (июнь 2002 г.). «Репарация ДНК / проапоптотические белки двойной роли в пяти основных путях репарации ДНК: надежная защита от канцерогенеза». Мутат Рес . 511 (2): 145–78. дои : 10.1016/s1383-5742(02)00009-1 . ПМИД 12052432 .
- ^ Броуди LC, Бисеккер BB (1998). «Гены предрасположенности к раку молочной железы. BRCA1 и BRCA2» . Медицина (Балтимор) . 77 (3): 208–26. дои : 10.1097/00005792-199805000-00006 . ПМИД 9653432 .
- ^ Пеннингтон К.П., Уолш Т., Харрелл М.И., Ли М.К., Пеннил К.С., Ренди М.Х. и др. (2014). «Зародышевые и соматические мутации в генах гомологичной рекомбинации предсказывают реакцию платины и выживаемость при карциномах яичников, фаллопиевых труб и брюшины» . Клин. Рак Рез . 20 (3): 764–75. дои : 10.1158/1078-0432.CCR-13-2287 . ПМЦ 3944197 . ПМИД 24240112 .
- ^ Полански Х., Шваб Х. (август 2019 г.). «Как латентные вирусы вызывают рак молочной железы: объяснение, основанное на модели микроконкуренции» . Боснийский журнал фундаментальных медицинских наук . 19 (3): 221–6. дои : 10.17305/bjbms.2018.3950 . ПМК 6716096 . ПМИД 30579323 .
- ^ Эстеллер М., Сильва Х.М., Домингес Г., Бонилья Ф., Матиас-Гю Х., Лерма Е. и др. (2000). «Гиперметилирование промотора и инактивация BRCA1 при спорадических опухолях молочной железы и яичников» . Дж. Натл. Онкологический институт . 92 (7): 564–9. дои : 10.1093/jnci/92.7.564 . ПМИД 10749912 .
- ^ Перейти обратно: а б Москва П., Буффа Ф.М., Пан Ю., Панчакшари Р., Готтипати П., Мушел Р.Дж. и др. (2011). «Опосредованное миР-182 подавление BRCA1 влияет на репарацию ДНК и чувствительность к ингибиторам PARP» . Мол. Клетка . 41 (2): 210–20. doi : 10.1016/j.molcel.2010.12.005 . ПМЦ 3249932 . ПМИД 21195000 .
- ^ Кришнан К., Степто А.Л., Мартин Х.К., Вани С., Нонес К., Уодделл Н. и др. (2013). «МикроРНК-182-5p нацелена на сеть генов, участвующих в репарации ДНК» . РНК . 19 (2): 230–42. дои : 10.1261/rna.034926.112 . ПМК 3543090 . ПМИД 23249749 .
- ^ Гарсия А.И., Бюиссон М., Бертран П., Римох Р., Руло Э., Лопес Б.С. и др. (2011). «Понижение экспрессии BRCA1 с помощью миР-146a и миР-146b-5p при трижды негативном спорадическом раке молочной железы» . ЭМБО Мол Мед . 3 (5): 279–90. дои : 10.1002/emmm.201100136 . ПМК 3377076 . ПМИД 21472990 .
- ^ Перейти обратно: а б Лю З, Лю Дж, Сегура М.Ф., Шао С., Ли П., Гонг Ю. и др. (2012). «Сверхэкспрессия МиР-182 при онкогенезе серозной карциномы яичников высокой степени». Дж. Патол . 228 (2): 204–15. дои : 10.1002/путь.4000 . ПМИД 22322863 . S2CID 206325689 .
- ^ Кастан М.Б. (2008). «Реакция на повреждение ДНК: механизмы и роль в заболеваниях человека: лекция на премию Мемориала ГСГ Клоуза 2007 г.» . Мол. Рак Рез . 6 (4): 517–24. дои : 10.1158/1541-7786.MCR-08-0020 . ПМИД 18403632 .
- ^ Харпер Дж.В., Элледж С.Дж. (2007). «Реакция на повреждение ДНК: десять лет спустя» . Мол. Клетка . 28 (5): 739–45. doi : 10.1016/j.molcel.2007.11.015 . ПМИД 18082599 .
- ^ О'Хаган Х.М., Мохаммад Х.П., Бэйлин С.Б. (2008). «Двухнитевые разрывы могут инициировать молчание генов и SIRT1-зависимое начало метилирования ДНК на экзогенном промоторном острове CpG» . ПЛОС Генетика . 4 (8): е1000155. дои : 10.1371/journal.pgen.1000155 . ПМЦ 2491723 . ПМИД 18704159 .
- ^ Куоццо С., Порчеллини А., Ангризано Т., Морано А., Ли Б., Ди Пардо А. и др. (июль 2007 г.). «Повреждение ДНК, репарация, направленная на гомологию, и метилирование ДНК» . ПЛОС Генетика . 3 (7): е110. дои : 10.1371/journal.pgen.0030110 . ЧВК 1913100 . ПМИД 17616978 .
- ^ Перейти обратно: а б Лакруа М., Леклерк Г. (2005). «Портрет» наследственного рака молочной железы». Исследование и лечение рака молочной железы . 89 (3): 297–304. дои : 10.1007/s10549-004-2172-4 . ПМИД 15754129 . S2CID 23327569 .
- ^ Перейти обратно: а б Стрюинг Дж.П., Абелиович Д., Перец Т., Авишай Н., Кабак М.М., Коллинз Ф.С. и др. (октябрь 1995 г.). «Частота носительства мутации BRCA1 185delAG составляет примерно 1 процент у евреев-ашкенази». Нат. Жене . 11 (2): 198–200. дои : 10.1038/ng1095-198 . ПМИД 7550349 . S2CID 21387351 .
- ^ Перейти обратно: а б Тонин П., Серова О., Ленуар Г., Линч Х., Дюрошер Ф., Симард Дж. и др. (1995). «Мутации BRCA1 у еврейских женщин-ашкенази» . Американский журнал генетики человека . 57 (1):189. ПМК 1801236 . ПМИД 7611288 .
- ^ Народ С.А., Фулкс В.Д. (2004). «BRCA1 и BRCA2: 1994 год и далее». Обзоры природы Рак . 4 (9): 665–676. дои : 10.1038/nrc1431 . ПМИД 15343273 . S2CID 30686068 .
- ^ ден Даннен Дж.Т., Антонаракис С.Е. (2000). «Расширение номенклатуры мутаций и предложения для описания сложных мутаций: обсуждение» . Человеческая мутация . 15 (1): 7–12. doi : 10.1002/(SICI)1098-1004(200001)15:1<7::AID-HUMU4>3.0.CO;2-N . ПМИД 10612815 .
- ^ Перейти обратно: а б Нойхаузен С.Л. (2000). «Популяции-основатели и их использование в генетике рака молочной железы» . Исследования рака . 2 (2): 77–81. дои : 10.1186/bcr36 . ПМК 139426 . ПМИД 11250694 .
- ^ Ривз, доктор медицинских наук, Явич Т.М., ван дер Мерве, Северная Каролина, ван ден Берг Х.Дж., Дрейер Г., ван Ренсбург Э.Дж. (июль 2004 г.). «Мутации BRCA1 в южноафриканских семьях с раком молочной железы и / или яичников: свидетельства новой мутации-основателя в семьях африканеров» . Межд. Дж. Рак . 110 (5): 677–82. дои : 10.1002/ijc.20186 . ПМИД 15146556 . S2CID 22970255 .
- ^ Фрэнсис Ф.З., Вайнштейн Т., Де Линер К., Кэрнс А., Мердок М., Ниц С. и др. (ноябрь 2015 г.). «Мутации BRCA1, BRCA2 и PALB2 и CHEK2 c.1100delC в различных южноафриканских этнических группах с диагнозом пременопаузальный и / или тройной негативный рак молочной железы» . БМК Рак . 15 : 912. doi : 10.1186/s12885-015-1913-6 . ПМЦ 4647511 . ПМИД 26577449 .
- ^ Вагнер Т.М., Мёслингер Р.А., Мюр Д., Лангбауэр Г., Хиртенленер К., Концин Х. и др. (1998). «Рак молочной железы, связанный с BRCA1, в австрийских семьях рака молочной железы и яичников: специфические мутации BRCA1 и патологические характеристики» . Международный журнал рака . 77 (3): 354–360. doi : 10.1002/(SICI)1097-0215(19980729)77:3<354::AID-IJC8>3.0.CO;2-N . ПМИД 9663595 .
- ^ Перейти обратно: а б Пилен Т., ван Влит М., Петрий-Бош А., Миремет Р., Сабо С., ван ден Оувеланд AM и др. (1997). «Высокая доля новых мутаций в BRCA1 с сильными эффектами основателя среди голландских и бельгийских семей с наследственным раком молочной железы и яичников» . Американский журнал генетики человека . 60 (5): 1041–9. ПМЦ 1712432 . ПМИД 9150151 .
- ^ Клаас К., Мачакова Е., Де Вос М., Поппе Б., Де Паепе А., Мессиан Л. (1999). «Анализ мутаций генов BRCA1 и BRCA2 в бельгийской популяции пациентов и идентификация бельгийской мутации-основателя BRCA1 IVS5 + 3A > G» . Маркеры заболеваний . 15 (1–3): 69–73. дои : 10.1155/1999/241046 . ПМЦ 3851655 . ПМИД 10595255 .
- ^ Петрий-Бош А., Пилен Т., ван Влит М., ван Эйк Р., Олмер Р., Дрюседау М. и др. (1997). «Геномные делеции BRCA1 являются основными мутациями-основателями у голландских пациентов с раком молочной железы» (PDF) . Природная генетика . 17 (3): 341–5. дои : 10.1038/ng1197-341 . hdl : 1765/54808 . ПМИД 9354803 . S2CID 13028232 .
- ^ Верхоог Л.С., ван ден Оувеланд А.М., Бернс Э., ван Вегел-Пландсоен М.М., ван Ставерен И.Л., Вагнер А. и др. (2001). «Большие региональные различия в частоте различных мутаций BRCA1/BRCA2 в 517 голландских семьях рака молочной железы и / или яичников». Европейский журнал рака . 37 (16): 2082–90. дои : 10.1016/S0959-8049(01)00244-1 . ПМИД 11597388 .
- ^ Хууско П., Пяакконен К., Лаунонен В., Пёйхёнен М., Бланко Г., Кауппила А. и др. (1998). «Доказательства мутаций-основателей финских семейств BRCA1 и BRCA2» . Американский журнал генетики человека . 62 (6): 1544–8. дои : 10.1086/301880 . ПМЦ 1377159 . ПМИД 9585608 .
- ^ Пяакконен К., Саурамо С., Сарантаус Л., Вахтеристо П., Хартикайнен А., Вехманен П. и др. (2001). «Вовлечение BRCA1 и BRCA2 в развитие рака молочной железы в западной части населения Финляндии». Генетическая эпидемиология . 20 (2): 239–246. doi : 10.1002/1098-2272(200102)20:2<239::AID-GEPI6>3.0.CO;2-Y . ПМИД 11180449 . S2CID 41804152 .
- ^ Мюллер Д., Бонаити-Пелли С., Абекассис Дж., Стоппа-Лионне Д., Фрикер Дж. П. (2004). «Тестирование BRCA1 в семьях с раком молочной железы и / или яичников из северо-восточной Франции выявило две распространенные мутации с эффектом основателя». Семейный рак . 3 (1): 15–20. doi : 10.1023/B:FAME.0000026819.44213.df . ПМИД 15131401 . S2CID 24615109 .
- ^ Тонин П.Н., Мес-Массон А.М., Народ С.А., Гадирян П., Прованшер Д. (1999). «Мутации-основатели BRCA1 и BRCA2 во франко-канадских случаях рака яичников, не выбранные для семейного анамнеза». Клиническая генетика . 55 (5): 318–324. дои : 10.1034/j.1399-0004.1999.550504.x . ПМИД 10422801 . S2CID 23931343 .
- ^ Бакке Дж., Хофферберт С., Скавран Б., Дорк Т., Штурманн М., Карстенс Дж. Х. и др. (1999). «Частота мутации BRCA1 5382insC у немецких больных раком молочной железы». Гинекологическая онкология . 72 (3): 402–6. дои : 10.1006/gyno.1998.5270 . ПМИД 10053113 .
- ^ «Данные мутации гена BRCA1» . KMDB/MutationView (базы данных мутаций Keio) . Университет Кейо.
- ^ Ладопулу А., Крупис С., Константинопулу И., Иоанниду-Музака Л., Шофилд А.С., Пантазидис А. и др. (2002). «Мутации зародышевой линии BRCA1 и BRCA2 в греческих семьях рака молочной железы/яичников: 5382insC является наиболее часто наблюдаемой мутацией». Письма о раке . 185 (1): 61–70. дои : 10.1016/S0304-3835(01)00845-X . ПМИД 12142080 .
- ^ Ван дер Лоой М., Сабо С., Бесняк И., Лишка Г., Чокай Б., Пулай Т. и др. (2000). «Распространенность мутаций-основателей BRCA1 и BRCA2 среди больных раком молочной железы и яичников в Венгрии» . Международный журнал рака . 86 (5): 737–740. doi : 10.1002/(SICI)1097-0215(20000601)86:5<737::AID-IJC21>3.0.CO;2-1 . ПМИД 10797299 . S2CID 25394976 .
- ^ Бауди Ф., Кварезима Б., Грандинетти С., Куда Г., Фаниелло С., Тассоне П. и др. (2001). «Доказательства мутации-основателя BRCA1 в высокооднородной популяции из южной Италии с раком молочной железы / яичников» . Человеческая мутация . 18 (2): 163–4. дои : 10.1002/humu.1167 . ПМИД 11462242 . S2CID 2995 .
- ^ Секине М., Нагата Х., Цудзи С., Хираи Ю., Фудзимото С., Хатаэ М. и др. (2001). «Мутационный анализ BRCA1 и BRCA2 и клинико-патологический анализ рака яичников в 82 семьях рака яичников: две распространенные мутации-основатели BRCA1 в японской популяции». Клинические исследования рака . 7 (10): 3144–50. ПМИД 11595708 .
- ^ Лиде А., Джек Э., Хегеле Р.А., Народ С.А. (2002). «Мутация BRCA1 в семьях коренных жителей Северной Америки» . Человеческая мутация . 19 (4): 460. doi : 10.1002/humu.9027 . ПМИД 11933205 . S2CID 37710898 .
- ^ Перейти обратно: а б Шотландско-Северо-Ирландский консорциум BRCA1/BRCA2 (2003 г.). «Мутации BRCA1 и BRCA2 в Шотландии и Северной Ирландии» . Британский журнал рака . 88 (8): 1256–62. дои : 10.1038/sj.bjc.6600840 . ПМЦ 2747571 . ПМИД 12698193 .
- ^ Борг А, Дорум А, Хеймдал К, Мэле Л, Ховиг Э, Мёллер П (1999). «BRCA1 1675delA и 1135insA составляют одну треть норвежского семейного рака молочной железы и яичников и связаны с более поздним началом заболевания, чем менее частые мутации» . Маркеры заболеваний . 15 (1–3): 79–84. дои : 10.1155/1999/278269 . ПМЦ 3851406 . ПМИД 10595257 .
- ^ Хеймдал К., Мэле Л., Апольд Дж., Педерсен Дж.К., Мёллер П. (2003). «Норвежские мутации-основатели BRCA1: высокая пенетрантность, подтвержденная в серии случаев рака, и различия, наблюдаемые в риске рака яичников». Европейский журнал рака . 39 (15): 2205–13. дои : 10.1016/S0959-8049(03)00548-3 . ПМИД 14522380 .
- ^ Лиеде А., Малик И.А., Азиз З., Риос Пд Пде Л., Кван Э., Народ С.А. (2002). «Вклад мутаций BRCA1 и BRCA2 в рак молочной железы и яичников в Пакистане» . Американский журнал генетики человека . 71 (3): 595–606. дои : 10.1086/342506 . ПМК 379195 . ПМИД 12181777 .
- ^ Гурски Б, Бирски Т, Хузарски Т, Якубовска А, Менкишак Дж, Гронвальд Дж и др. (2000). «Мутации-основатели гена BRCA1 в польских семьях с раком молочной железы и яичников» . Американский журнал генетики человека . 66 (6): 1963–8. дои : 10.1086/302922 . ПМК 1378051 . ПМИД 10788334 .
- ^ Перковска М., Брозек И., Высоцка Б., Харальдссон К., Сандберг Т., Йоханссон У. и др. (май 2003 г.). «Анализ мутаций BRCA1 и BRCA2 в семьях с раком молочной железы и яичников из северо-восточной Польши» . Хм. Мутат . 21 (5): 553–4. дои : 10.1002/humu.9139 . ПМИД 12673801 . S2CID 7001156 .
- ^ Гейтер С.А., Харрингтон П., Рассел П., Харкевич Г., Гаркавцева Р.Ф., Пондер Б.А. (май 1997 г.). «Часто встречающиеся зародышевые мутации гена BRCA1 в семьях рака яичников из России» . Являюсь. Дж. Хум. Жене . 60 (5): 1239–42. ПМЦ 1712436 . ПМИД 9150173 .
- ^ Лиде А., Коэн Б., Блэк Д.М., Дэвидсон Р.Х., Ренвик А., Худфар Е. и др. (февраль 2000 г.). «Доказательства мутации-основателя BRCA1 в Шотландии» . Бр. Дж. Рак . 82 (3): 705–11. дои : 10.1054/bjoc.1999.0984 . ПМЦ 2363321 . ПМИД 10682686 .
- ^ Вега А., Кампос Б., Брессак-Де-Пайере Б., Бонд П.М., Джанин Н., Дуглас Ф.С. и др. (июнь 2001 г.). «R71G BRCA1 является испанской мутацией-основателем и приводит к аберрантному сплайсингу транскрипта» . Хм. Мутат . 17 (6): 520–1. дои : 10.1002/humu.1136 . ПМИД 11385711 . S2CID 39462456 .
- ^ Кампос Б., Диес О., Одефри Ф., Доменек М., Монкутье В., Мартинес-Феррандис Дж.И. и др. (апрель 2003 г.). «Анализ гаплотипов рекуррентной мутации BRCA2 9254delATCAT в семьях с раком молочной железы и яичников из Испании» . Хм. Мутат . 21 (4): 452. doi : 10.1002/humu.9133 . ПМИД 12655574 . S2CID 34333797 .
- ^ Бергман А., Эйнбейги З., Олофссон Ю., Тайб З., Валлгрен А., Карлссон П. и др. (октябрь 2001 г.). «Западно-шведская мутация-основатель BRCA1 3171ins5; сегодняшний консервативный гаплотип размером 3,7 см является воспоминанием о мутации 1500-летней давности» . Евро. Дж. Хум. Жене . 9 (10): 787–93. дои : 10.1038/sj.ejhg.5200704 . ПМИД 11781691 .
- ^ Хансен К.Р., Ноултон Н.С., Тайер А.С., Чарльстон Дж.С., Соулз М.Р., Кляйн Н.А. (март 2008 г.). «Новая модель репродуктивного старения: снижение количества нерастущих фолликулов яичников от рождения до менопаузы» . Хм. Репродукция . 23 (3): 699–708. дои : 10.1093/humrep/dem408 . ПМИД 18192670 .
- ^ Хассольд Т., Хант П. (декабрь 2009 г.). «Материнский возраст и хромосомные аномалии беременности: что мы знаем и что нам хотелось бы знать» . Современное мнение в педиатрии . 21 (6): 703–8. дои : 10.1097/MOP.0b013e328332c6ab . ПМЦ 2894811 . ПМИД 19881348 .
- ^ Перейти обратно: а б Октай К., Ким Дж.Ю., Барад Д., Бабаев С.Н. (январь 2010 г.). «Связь мутаций BRCA1 со скрытой первичной недостаточностью яичников: возможное объяснение связи между бесплодием и риском рака молочной железы / яичников» . Дж. Клин. Онкол . 28 (2): 240–4. дои : 10.1200/JCO.2009.24.2057 . ПМК 3040011 . ПМИД 19996028 .
- ^ Ржепка-Гурска И, Тарновски Б, Чудецка-Глаз А, Гурски Б, Зелинска Д, Толочко-Грабарек А (ноябрь 2006 г.). «Преждевременная менопауза у пациенток с мутацией гена BRCA1». Рак молочной железы Рез. Обращаться . 100 (1): 59–63. дои : 10.1007/s10549-006-9220-1 . ПМИД 16773440 . S2CID 19572648 .
- ^ Перейти обратно: а б Титус С., Ли Ф., Стобезки Р., Акула К., Унсал Э., Чон К. и др. (февраль 2013 г.). «Нарушение репарации двухцепочечных разрывов ДНК, связанных с BRCA1, приводит к старению яичников у мышей и людей» . Научный перевод Мед . 5 (172): 172ра21. doi : 10.1126/scitranslmed.3004925 . ПМК 5130338 . ПМИД 23408054 .
- ^ Бернштейн Х., Хопф Ф.А., Мишод Р.Э. (1987). «Молекулярная основа эволюции пола». Достижения генетики . Том. 24. С. 323–370. дои : 10.1016/S0065-2660(08)60012-7 . ISBN 978-0-12-017624-3 . ПМИД 3324702 .
- ^ Перейти обратно: а б Тэрон М., Роселл Р., Фелип Э., Мендес П., Суглакос Дж., Ронко М.С. и др. (октябрь 2004 г.). «Уровни экспрессии мРНК BRCA1 как показатель химиорезистентности при раке легких» . Хм. Мол. Жене . 13 (20): 2443–9. дои : 10.1093/hmg/ddh260 . ПМИД 15317748 .
- ^ Перейти обратно: а б Пападаки С., Сфакианаки М., Иоаннидис Г., Лагудаки Е., Трипаки М., Трифонидис К. и др. (апрель 2012 г.). «Уровни экспрессии мРНК ERCC1 и BRAC1 в первичной опухоли могут предсказать эффективность химиотерапии второй линии на основе цисплатина у пациентов с метастатическим немелкоклеточным раком легкого, прошедших предварительное лечение» . Дж Торак Онкол . 7 (4): 663–71. дои : 10.1097/JTO.0b013e318244bdd4 . ПМИД 22425915 .
- ^ Веберпалс Дж., Гарбуйо К., О'Брайен А., Кларк-Ноулз К., Дусетт С., Антониук О. и др. (февраль 2009 г.). «Белки репарации ДНК BRCA1 и ERCC1 как прогностические маркеры спорадического рака яичников» . Межд. Дж. Рак . 124 (4): 806–15. дои : 10.1002/ijc.23987 . ПМИД 19035454 . S2CID 13357407 .
- ^ «ACLU подает в суд на патенты на гены рака молочной железы» . Си-Эн-Эн. Архивировано из оригинала 15 мая 2009 года . Проверено 14 мая 2009 г.
- ^ Кук-Диган Р., ДеРиенцо С., Карбоне Дж., Чандрасекхаран С., Хини С., Коновер С. (апрель 2010 г.). «Влияние генных патентов и практики лицензирования на доступ к генетическому тестированию наследственной предрасположенности к раку: сравнение рака груди и яичников с раком толстой кишки» . Генетика в медицине . 12 (4 доп.): С15–С38. дои : 10.1097/GIM.0b013e3181d5a67b . ПМК 3047448 . ПМИД 20393305 .
- ^ Беновиц С. (январь 2003 г.). «Европейские группы выступают против последнего патента Myriad на BRCA1». Дж. Натл. Онкологический институт . 95 (1): 8–9. дои : 10.1093/jnci/95.1.8 . ПМИД 12509391 .
- ^ Конли Дж., Ворхаус Д., Кук-Диган Дж. (март 2011 г.). «Как Myriad отреагирует на следующее поколение тестов BRCA?» . Робинсон, Брэдшоу и Хинсон . Проверено 9 декабря 2012 г.
- ^ «Генетика и патентование» . Информация о проекте «Геном человека» . Программы генома Министерства энергетики США. 07.07.2010.
- ^ Липтак А (13 июня 2013 г.). «Верховный суд постановил, что человеческие гены не могут быть запатентованы» . Нью-Йорк Таймс . Проверено 13 июня 2013 г.
- ^ Кордерой А. (15 февраля 2013 г.). «Веховое патентное решение в отношении гена рака молочной железы BRCA1» . Сидней Морнинг Геральд . Проверено 14 июня 2013 г.
- ^ «Австралийский федеральный суд постановил, что изолированный генетический материал может быть запатентован» . Хранитель . 5 сентября 2014 года . Проверено 14 сентября 2014 г.
- ^ «Пациент выиграл дело в Высоком суде против патента компании на ген рака » Хранитель . 7 октября 2015 г. Проверено 6 октября 2015 г.
- ^ Форей Н., Маро Д., Рандрианарисон В., Венеция Н.Д., Пикард Д., Перрикоде М. и др. (июнь 2002 г.). «Конститутивная ассоциация BRCA1 и c-Abl и ее АТМ-зависимое нарушение после облучения» . Мягкий. Клетка. Биол . 22 (12): 4020–32. дои : 10.1128/MCB.22.12.4020-4032.2002 . ПМК 133860 . ПМИД 12024016 .
- ^ Алтиок С., Батт Д., Альтиок Н., Папаутски А., Даунвард Дж., Робертс Т.М. и др. (ноябрь 1999 г.). «Герегулин индуцирует фосфорилирование BRCA1 посредством фосфатидилинозитол-3-киназы/АКТ в клетках рака молочной железы» . Ж. Биол. Хим . 274 (45): 32274–8. дои : 10.1074/jbc.274.45.32274 . ПМИД 10542266 .
- ^ Сян Т., Охаши А., Хуан Й., Пандита Т.К., Людвиг Т., Пауэлл С.Н. и др. (декабрь 2008 г.). «Негативная регуляция активации AKT с помощью BRCA1» . Рак Рез . 68 (24): 10040–4. дои : 10.1158/0008-5472.CAN-08-3009 . ПМК 2605656 . ПМИД 19074868 .
- ^ Йе С., Ху Ю.К., Рахман М., Лин Х.К., Сюй К.Л., Тинг Х.Дж. и др. (октябрь 2000 г.). «Увеличение андроген-индуцированной гибели клеток и трансактивации андрогенных рецепторов с помощью BRCA1 в клетках рака простаты» . Учеб. Натл. акад. наук. США . 97 (21): 11256–61. Бибкод : 2000PNAS...9711256Y . дои : 10.1073/pnas.190353897 . ЧВК 17187 . ПМИД 11016951 .
- ^ Перейти обратно: а б Ким С.Т., Лим Д.С., Канман С.Э., Кастан М.Б. (декабрь 1999 г.). «Специфичность субстратов и идентификация предполагаемых субстратов членов семейства ATM-киназ» . Ж. Биол. Хим . 274 (53): 37538–43. дои : 10.1074/jbc.274.53.37538 . ПМИД 10608806 .
- ^ Перейти обратно: а б Тиббетс Р.С., Кортес Д., Брамбо К.М., Скалли Р., Ливингстон Д., Элледж С.Дж. и др. (декабрь 2000 г.). «Функциональные взаимодействия между BRCA1 и киназой контрольной точки ATR во время генотоксического стресса» . Генс Дев . 14 (23): 2989–3002. дои : 10.1101/gad.851000 . ПМК 317107 . ПМИД 11114888 .
- ^ Перейти обратно: а б Чен Дж (сентябрь 2000 г.). «Белок, связанный с атаксией телеангиэктазии, участвует в фосфорилировании BRCA1 после повреждения дезоксирибонуклеиновой кислотой». Рак Рез . 60 (18): 5037–9. ПМИД 11016625 .
- ^ Перейти обратно: а б Гатей М., Чжоу Б.Б., Хобсон К., Скотт С., Янг Д., Ханна К.К. (май 2001 г.). «Киназа с мутацией телеангиэктазии атаксии (ATM) и киназа, связанная с ATM и Rad3, опосредуют фосфорилирование Brca1 в отдельных и перекрывающихся сайтах. Оценка in vivo с использованием фосфоспецифичных антител» . Ж. Биол. Хим . 276 (20): 17276–80. дои : 10.1074/jbc.M011681200 . ПМИД 11278964 .
- ^ Гатей М., Скотт С.П., Филиппович И., Сороника Н., Лавин М.Ф., Вебер Б. и др. (июнь 2000 г.). «Роль ATM в фосфорилировании BRCA1, вызванном повреждением ДНК». Рак Рез . 60 (12): 3299–304. ПМИД 10866324 .
- ^ Кортес Д., Ван Ю, Цинь Дж., Элледж С.Дж. (ноябрь 1999 г.). «Требование АТМ-зависимого фосфорилирования brca1 в ответ на повреждение ДНК на двухцепочечные разрывы». Наука . 286 (5442): 1162–6. дои : 10.1126/science.286.5442.1162 . ПМИД 10550055 .
- ^ Уврас Ю., Бенезра М., Чжан Х., Манфреди Дж. Дж., Вебер Б. Л., Лихт Дж. Д. (ноябрь 2000 г.). «BRCA1 физически и функционально взаимодействует с ATF1» . Ж. Биол. Хим . 275 (46): 36230–7. дои : 10.1074/jbc.M002539200 . ПМИД 10945975 .
- ^ Перейти обратно: а б Кантор С.Б., Белл Д.В., Ганесан С., Касс Э.М., Драпкин Р., Гроссман С. и др. (апрель 2001 г.). «BACH1, новый геликазоподобный белок, напрямую взаимодействует с BRCA1 и способствует его функции восстановления ДНК» . Клетка . 105 (1): 149–60. дои : 10.1016/S0092-8674(01)00304-X . ПМИД 11301010 .
- ^ Перейти обратно: а б с д и ж Донг Ю, Хакими М.А., Чен Х, Кумарасвами Э, Куч Н.С., Годвин А.К. и др. (ноябрь 2003 г.). «Регуляция BRCC, голоферментного комплекса, содержащего BRCA1 и BRCA2, с помощью сигналосомоподобной субъединицы и ее роль в репарации ДНК» . Мол. Клетка . 12 (5): 1087–99. дои : 10.1016/S1097-2765(03)00424-6 . ПМИД 14636569 .
- ^ Перейти обратно: а б Чен Дж., Сильвер Д.П., Уолпита Д., Кантор С.Б., Газдар А.Ф., Томлинсон Дж. и др. (сентябрь 1998 г.). «Стабильное взаимодействие продуктов генов-супрессоров опухолей BRCA1 и BRCA2 в митотических и мейотических клетках» . Мол. Клетка . 2 (3): 317–28. дои : 10.1016/S1097-2765(00)80276-2 . ПМИД 9774970 .
- ^ Перейти обратно: а б Рейтер Т., Медхерст А.Л., Вайсфиш К., Чжи Ю., Хертерих С., Хоэн Х. и др. (октябрь 2003 г.). «Двугибридные дрожжевые скрининги подразумевают участие белков анемии Фанкони в регуляции транскрипции, передаче сигналов в клетках, окислительном метаболизме и клеточном транспорте». Эксп. Сотовый Res . 289 (2): 211–21. дои : 10.1016/S0014-4827(03)00261-1 . ПМИД 14499622 .
- ^ Саркисян CJ, Мастер SR, Хубер LJ, Ха С.И., Чодош Л.А. (октябрь 2001 г.). «Анализ мышиного Brca2 показывает сохранение белок-белковых взаимодействий, но различия в сигналах ядерной локализации» . Ж. Биол. Хим . 276 (40): 37640–8. дои : 10.1074/jbc.M106281200 . ПМИД 11477095 .
- ^ Перейти обратно: а б с д Родригес М., Юй Х, Чен Дж., Сунъян З. (декабрь 2003 г.). «Специфичность связывания фосфопептидов COOH-концевых доменов BRCA1 (BRCT)» . Ж. Биол. Хим . 278 (52): 52914–8. дои : 10.1074/jbc.C300407200 . ПМИД 14578343 .
- ^ Ботуян М.В., Номине Ю, Ю Х, Джуранич Н, Макура С, Чен Дж и др. (июль 2004 г.). «Структурные основы распознавания фосфопептида BACH1 тандемными доменами BRCT BRCA1» . Структура . 12 (7): 1137–46. дои : 10.1016/j.str.2004.06.002 . ПМЦ 3652423 . ПМИД 15242590 .
- ^ Ю Х, Чини CC, Хэ М, Мер Г, Чен Дж (октябрь 2003 г.). «Домен BRCT представляет собой домен, связывающий фосфобелок». Наука . 302 (5645): 639–42. Бибкод : 2003Sci...302..639Y . дои : 10.1126/science.1088753 . ПМИД 14576433 . S2CID 29407635 .
- ^ Клэппертон Дж.А., Манке И.А., Лоури Д.М., Хо Т., Хайр Л.Ф., Яффе М.Б. и др. (июнь 2004 г.). «Структура и механизм распознавания домена BRCA1 BRCT фосфорилированного BACH1 с последствиями для рака». Структурная и молекулярная биология природы . 11 (6): 512–8. дои : 10.1038/nsmb775 . ПМИД 15133502 . S2CID 7354915 .
- ^ Перейти обратно: а б с Ху Ю.Ф., Ли Р. (июнь 2002 г.). «JunB усиливает функцию домена активации 1 BRCA1 (AD1) посредством взаимодействия, опосредованного спиральной спиралью» . Генс Дев . 16 (12): 1509–17. дои : 10.1101/gad.995502 . ЧВК 186344 . ПМИД 12080089 .
- ^ Ли Дж.С., Коллинз К.М., Браун А.Л., Ли Ч., Чанг Дж.Х. (март 2000 г.). «hCds1-опосредованное фосфорилирование BRCA1 регулирует реакцию на повреждение ДНК». Природа . 404 (6774): 201–4. Бибкод : 2000Natur.404..201L . дои : 10.1038/35004614 . ПМИД 10724175 . S2CID 4345911 .
- ^ Chabalier-Taste C, Racca C, Dozier C, Larminat F (декабрь 2008 г.). «BRCA1 регулируется Chk2 в ответ на повреждение шпинделя» . Биохим. Биофиз. Акта . 1783 (12): 2223–33. дои : 10.1016/j.bbamcr.2008.08.006 . ПМИД 18804494 .
- ^ Лин С.Ю., Ли К., Стюарт Г.С., Элледж С.Дж. (апрель 2004 г.). «Человеческий Claspin работает с BRCA1, регулируя как позитивную, так и негативную пролиферацию клеток» . Учеб. Натл. акад. наук. США . 101 (17): 6484–9. Бибкод : 2004PNAS..101.6484L . дои : 10.1073/pnas.0401847101 . ПМК 404071 . ПМИД 15096610 .
- ^ Перейти обратно: а б Бенезра М., Шевалье Н., Моррисон Д.Д., Маклахлан Т.К., Эль-Дейри В.С., Лихт Дж.Д. (июль 2003 г.). «BRCA1 усиливает транскрипцию с помощью фактора транскрипции NF-kappaB путем связывания с доменом Rel субъединицы p65/RelA» . Ж. Биол. Хим . 278 (29): 26333–41. дои : 10.1074/jbc.M303076200 . ПМИД 12700228 .
- ^ Перейти обратно: а б Пао ГМ, Янкнехт Р., Раффнер Х., Хантер Т., Верма И.М. (февраль 2000 г.). «CBP/p300 взаимодействует и действует как коактиватор транскрипции BRCA1» . Учеб. Натл. акад. наук. США . 97 (3): 1020–5. Бибкод : 2000PNAS...97.1020P . дои : 10.1073/pnas.97.3.1020 . ПМЦ 15508 . ПМИД 10655477 .
- ^ Перейти обратно: а б Чай Ю.Л., Цуй Дж., Шао Н., Шьям Э., Редди П., Рао В.Н. (январь 1999 г.). «Второй домен BRCT белков BRCA1 взаимодействует с p53 и стимулирует транскрипцию с промотора p21WAF1/CIP1» . Онкоген . 18 (1): 263–8. дои : 10.1038/sj.onc.1202323 . ПМИД 9926942 .
- ^ Перейти обратно: а б с Фань С., Ма YX, Ван С., Юань RQ, Мэн Q, Ван JA и др. (январь 2002 г.). «p300 модулирует ингибирование BRCA1 активности рецептора эстрогена». Рак Рез . 62 (1): 141–51. ПМИД 11782371 .
- ^ Нейш А.С., Андерсон С.Ф., Шлегель Б.П., Вэй В., Парвин Дж.Д. (февраль 1998 г.). «Факторы, связанные с голоферментом РНК-полимеразы II млекопитающих» . Нуклеиновые кислоты Рез . 26 (3): 847–53. дои : 10.1093/нар/26.3.847 . ПМК 147327 . ПМИД 9443979 .
- ^ О'Брайен К.А., Лемке С.Дж., Кокк К.С., Рао Р.Н., Бекманн Р.П. (июль 1999 г.). «Казеинкиназа 2 связывается и фосфорилирует BRCA1». Биохим. Биофиз. Рез. Коммун . 260 (3): 658–64. дои : 10.1006/bbrc.1999.0892 . ПМИД 10403822 .
- ^ Клейман Ф.Е., Мэнли Дж.Л. (март 2001 г.). «Взаимодействие BARD1-CstF-50 связывает образование 3'-конца мРНК с повреждением ДНК и подавлением опухоли» . Клетка . 104 (5): 743–53. дои : 10.1016/S0092-8674(01)00270-7 . ПМИД 11257228 .
- ^ Клейман Ф.Е., Мэнли Дж.Л. (сентябрь 1999 г.). «Функциональное взаимодействие BRCA1-ассоциированного BARD1 с фактором полиаденилирования CstF-50». Наука . 285 (5433): 1576–9. дои : 10.1126/science.285.5433.1576 . ПМИД 10477523 .
- ^ Ван Х., Шао Н., Дин К.М., Цуй Дж., Редди Э.С., Рао В.Н. (июль 1997 г.). «Белки BRCA1 транспортируются в ядро в отсутствие сывороточных и сплайсинговых вариантов BRCA1a, BRCA1b представляют собой тирозиновые фосфопротеины, которые связываются с E2F, циклинами и циклинзависимыми киназами» . Онкоген . 15 (2): 143–57. дои : 10.1038/sj.onc.1201252 . ПМИД 9244350 .
- ^ Чен Ю, Фармер А.А., Чен К.Ф., Джонс Д.С., Чен П.Л., Ли В.Х. (июль 1996 г.). «BRCA1 представляет собой ядерный фосфопротеин массой 220 кДа, который экспрессируется и фосфорилируется в зависимости от клеточного цикла». Рак Рез . 56 (14): 3168–72. ПМИД 8764100 .
- ^ Раффнер Х., Цзян В., Крейг А.Г., Хантер Т., Верма И.М. (июль 1999 г.). «BRCA1 фосфорилируется по серину 1497 in vivo в сайте фосфорилирования циклин-зависимой киназы 2» . Мол. Клетка. Биол . 19 (7): 4843–54. дои : 10.1128/MCB.19.7.4843 . ПМЦ 84283 . ПМИД 10373534 .
- ^ Шлегель Б.П., Старита Л.М., Парвин Дж.Д. (февраль 2003 г.). «Сверхэкспрессия белкового фрагмента РНК-хеликазы А вызывает ингибирование эндогенной функции BRCA1 и дефекты плоидности и цитокинеза в эпителиальных клетках молочной железы» . Онкоген . 22 (7): 983–91. дои : 10.1038/sj.onc.1206195 . ПМИД 12592385 .
- ^ Андерсон С.Ф., Шлегель Б.П., Накадзима Т., Вулпин Э.С., Парвин Дж.Д. (июль 1998 г.). «Белок BRCA1 связан с голоферментным комплексом РНК-полимеразы II через РНК-хеликазу А». Нат. Жене . 19 (3): 254–6. дои : 10.1038/930 . ПМИД 9662397 . S2CID 10953768 .
- ^ Чай Ю, Чипицына Г, Цуй Дж, Ляо Б, Лю С, Айсола К и др. (март 2001 г.). «Регулятор онкогена c-Fos Elk-1 взаимодействует с вариантами сплайсинга BRCA1 BRCA1a/1b и усиливает опосредованное BRCA1a/1b подавление роста в клетках рака молочной железы» . Онкоген . 20 (11): 1357–67. дои : 10.1038/sj.onc.1204256 . ПМИД 11313879 .
- ^ Чжэн Л., Аннаб Л.А., Афшари К.А., Ли В.Х., Бойер Т.Г. (август 2001 г.). «BRCA1 опосредует лиганд-независимую репрессию транскрипции рецептора эстрогена» . Учеб. Натл. акад. наук. США . 98 (17): 9587–92. Бибкод : 2001PNAS...98.9587Z . дои : 10.1073/pnas.171174298 . ПМК 55496 . ПМИД 11493692 .
- ^ Фань С., Ма YX, Ван С., Юань RQ, Мэн Q, Ван JA и др. (январь 2001 г.). «Роль прямого взаимодействия в ингибировании BRCA1 активности рецептора эстрогена» . Онкоген . 20 (1): 77–87. дои : 10.1038/sj.onc.1204073 . ПМИД 11244506 .
- ^ Кавай Х., Ли Х., Чун П., Авраам С., Авраам Х.К. (октябрь 2002 г.). «Прямое взаимодействие между BRCA1 и рецептором эстрогена регулирует транскрипцию и секрецию фактора роста эндотелия сосудов (VEGF) в клетках рака молочной железы» . Онкоген . 21 (50): 7730–9. дои : 10.1038/sj.onc.1205971 . ПМИД 12400015 .
- ^ Фолиас А., Маткович М., Бруун Д., Рид С., Хейна Дж., Громпе М. и др. (октябрь 2002 г.). «BRCA1 напрямую взаимодействует с белком анемии Фанкони FANCA» . Хм. Мол. Жене . 11 (21): 2591–7. дои : 10.1093/hmg/11.21.2591 . ПМИД 12354784 .
- ^ Перейти обратно: а б Ванденберг С.Дж., Гергели Ф., Онг С.И., Пейс П., Маллери Д.Л., Хиом К. и др. (июль 2003 г.). «BRCA1-независимое убиквитинирование FANCD2» . Мол. Клетка . 12 (1): 247–54. дои : 10.1016/S1097-2765(03)00281-8 . ПМИД 12887909 .
- ^ Ян Дж, Чжу Дж, Чжун Х, Лу Ц, Хуан С, Е Ц (октябрь 2003 г.). «BRCA1 взаимодействует с FHL2 и усиливает функцию трансактивации FHL2» . ФЭБС Летт . 553 (1–2): 183–9. Бибкод : 2003FEBSL.553..183Y . дои : 10.1016/S0014-5793(03)00978-5 . ПМИД 14550570 . S2CID 31566004 .
- ^ Ян Дж. Х., Е Ц. Н., Чжу Дж. Х., Чжун Х. Дж., Чжэн Х. И., Хуан К. Ф. (декабрь 2003 г.). «[Выделение и характеристика белка, взаимодействующего с BRCA1]». И Чуань Сюэ Бао (на китайском языке). 30 (12): 1161–6. ПМИД 14986435 .
- ^ Перейти обратно: а б Маллери Д.Л., Ванденберг С.Дж., Хиом К. (декабрь 2002 г.). «Активация функции лигазы Е3 комплекса BRCA1/BARD1 полиубиквитиновыми цепями» . ЭМБО Дж . 21 (24): 6755–62. дои : 10.1093/emboj/cdf691 . ПМК 139111 . ПМИД 12485996 .
- ^ Перейти обратно: а б Чен А., Клейман Ф.Е., Мэнли Дж.Л., Оучи Т., Пан ZQ (июнь 2002 г.). «Аутоубиквитинирование убиквитинлигазы BRCA1*BARD1 RING» . Ж. Биол. Хим . 277 (24): 22085–92. дои : 10.1074/jbc.M201252200 . ПМИД 11927591 .
- ^ Полл Т.Т., Рогаку Е.П., Ямазаки В., Кирхгесснер К.У., Геллерт М., Боннер В.М. (2000). «Критическая роль гистона H2AX в привлечении факторов репарации в ядерные очаги после повреждения ДНК» . Курс. Биол . 10 (15): 886–95. Бибкод : 2000CBio...10..886P . дои : 10.1016/S0960-9822(00)00610-2 . ПМИД 10959836 .
- ^ Сазерленд К.Д., Висвадер Дж.Э., Чунг Д.Ю., Сум Э.Ю., Линдеман Г.Дж., Кэмпбелл И.Г. (октябрь 2003 г.). «Мутационный анализ гена LMO4, кодирующего белок, взаимодействующий с BRCA1, при карциноме молочной железы» . Межд. Дж. Рак . 107 (1): 155–8. дои : 10.1002/ijc.11343 . ПМИД 12925972 . S2CID 20908722 .
- ^ Сум Э.Ю., Пэн Б., Юй X, Чен Дж., Бирн Дж., Линдеман Г.Дж. и др. (март 2002 г.). «Белок домена LIM LMO4 взаимодействует с кофактором CtIP и супрессором опухоли BRCA1 и ингибирует активность BRCA1» . Ж. Биол. Хим . 277 (10): 7849–56. дои : 10.1074/jbc.M110603200 . ПМИД 11751867 .
- ^ Гилмор П.М., Маккейб Н., Куинн Дж.Э., Кеннеди Р.Д., Горски Дж.Дж., Эндрюс Х.Н. и др. (июнь 2004 г.). «BRCA1 взаимодействует и необходим для индуцированной паклитакселом активации митоген-активируемой протеинкиназной киназы киназы 3» . Рак Рез . 64 (12): 4148–54. doi : 10.1158/0008-5472.CAN-03-4080 . ПМИД 15205325 .
- ^ Перейти обратно: а б с д и Чиба Н., Парвин Дж.Д. (октябрь 2001 г.). «Перераспределение BRCA1 между четырьмя различными белковыми комплексами после блокировки репликации» . Ж. Биол. Хим . 276 (42): 38549–54. дои : 10.1074/jbc.M105227200 . ПМИД 11504724 .
- ^ Чиба Н., Парвин Дж.Д. (август 2002 г.). «Ассоциация BRCA1 и BARD1 с голоферментом РНК-полимеразы II». Рак Рез . 62 (15): 4222–8. ПМИД 12154023 .
- ^ Перейти обратно: а б с Чжун Ц, Чен К.Ф., Ли С., Чен Ю., Ван К.С., Сяо Дж. и др. (июль 1999 г.). «Ассоциация BRCA1 с комплексом hRad50-hMre11-p95 и реакция на повреждение ДНК». Наука . 285 (5428): 747–50. дои : 10.1126/science.285.5428.747 . ПМИД 10426999 .
- ^ Перейти обратно: а б Ли Х, Ли Т.Х., Авраам Х (июнь 2002 г.). «Новый трикомплекс BRCA1, Nmi и c-Myc ингибирует c-Myc-индуцированную активность промотора гена обратной транскриптазы теломеразы человека (hTERT) при раке молочной железы» . Ж. Биол. Хим . 277 (23): 20965–73. дои : 10.1074/jbc.M112231200 . ПМИД 11916966 .
- ^ Сюн Дж., Фань С., Мэн К., Шрамм Л., Ван С., Бузаза Б. и др. (декабрь 2003 г.). «Ингибирование теломеразной активности BRCA1 в культивируемых клетках» . Мол. Клетка. Биол . 23 (23): 8668–90. дои : 10.1128/MCB.23.23.8668-8690.2003 . ПМК 262673 . ПМИД 14612409 .
- ^ Чжоу С., Лю Дж. (март 2003 г.). «Ингибирование экспрессии гена обратной транскриптазы теломеразы человека с помощью BRCA1 в клетках рака яичников человека». Биохим. Биофиз. Рез. Коммун . 303 (1): 130–6. дои : 10.1016/S0006-291X(03)00318-8 . ПМИД 12646176 .
- ^ Перейти обратно: а б Сато К., Хаями Р., Ву В., Нисикава Т., Нисикава Х., Окуда Ю. и др. (июль 2004 г.). «Нуклеофосмин/B23 является кандидатом на субстрат для убиквитинлигазы BRCA1-BARD1» . Ж. Биол. Хим . 279 (30): 30919–22. дои : 10.1074/jbc.C400169200 . ПМИД 15184379 .
- ^ Парк Дж.Дж., Ирвин Р.А., Бьюкенен Дж., Ко С.С., Парк Дж.М., Тилли В.Д. и др. (ноябрь 2000 г.). «Ген 1 предрасположенности к раку молочной железы (BRCAI) является коактиватором рецептора андрогена». Рак Рез . 60 (21): 5946–9. ПМИД 11085509 .
- ^ Кабарт П., Чу Х.К., Мерфи С. (июль 2004 г.). «BRCA1 взаимодействует с NUFIP и P-TEFb, чтобы активировать транскрипцию РНК-полимеразой II» . Онкоген . 23 (31): 5316–29. дои : 10.1038/sj.onc.1207684 . ПМИД 15107825 .
- ^ Абрамович С., Вернер Х. (2003). «Функциональные и физические взаимодействия между BRCA1 и p53 в регуляции транскрипции гена IGF-IR». Горм. Метаб. Рез . 35 (11–12): 758–62. дои : 10.1055/s-2004-814154 . ПМИД 14710355 . S2CID 20898175 .
- ^ Оучи Т., Монтейро А.Н., Август А., Ааронсон С.А., Ханафуса Х. (март 1998 г.). «BRCA1 регулирует p53-зависимую экспрессию генов» . Учеб. Натл. акад. наук. США . 95 (5): 2302–6. Бибкод : 1998PNAS...95.2302O . дои : 10.1073/pnas.95.5.2302 . ЧВК 19327 . ПМИД 9482880 .
- ^ Чжан Х., Сомасундарам К., Пэн Ю., Тянь Х., Чжан Х., Би Д. и др. (апрель 1998 г.). «BRCA1 физически связывается с p53 и стимулирует его транскрипционную активность» . Онкоген . 16 (13): 1713–21. дои : 10.1038/sj.onc.1201932 . ПМИД 9582019 .
- ^ Си С.М., Хуэнь М.С., Чен Дж. (апрель 2009 г.). «PALB2 является неотъемлемым компонентом комплекса BRCA, необходимого для репарации гомологичной рекомбинации» . Учеб. Натл. акад. наук. США . 106 (17): 7155–60. Бибкод : 2009PNAS..106.7155S . дои : 10.1073/pnas.0811159106 . ПМЦ 2678481 . ПМИД 19369211 .
- ^ Крам С.А., Миранда Г.А., Лин С., Лейн Т.Ф. (декабрь 2003 г.). «BRCA1 связывается с процессивной РНК-полимеразой II» . Ж. Биол. Хим . 278 (52): 52012–20. дои : 10.1074/jbc.M308418200 . ПМИД 14506230 .
- ^ Крам С.А., Вомак Дж.Э., Лейн Т.Ф. (сентябрь 2003 г.). «Бычий BRCA1 демонстрирует классические ответы на генотоксический стресс, но низкую активность активации транскрипции in vitro» . Онкоген . 22 (38): 6032–44. дои : 10.1038/sj.onc.1206515 . ПМИД 12955082 .
- ^ Лю Ю, Виршуп Д.М., Уайт Р.Л., Сюй Л.К. (ноябрь 2002 г.). «Регуляция фосфорилирования BRCA1 путем взаимодействия с протеинфосфатазой 1альфа». Рак Рез . 62 (22): 6357–61. ПМИД 12438214 .
- ^ Скалли Р., Чен Дж., Плаг А., Сяо Ю., Уивер Д., Фойнтын Дж. и др. (январь 1997 г.). «Ассоциация BRCA1 с Rad51 в митотических и мейотических клетках» . Клетка . 88 (2): 265–75. дои : 10.1016/S0092-8674(00)81847-4 . ПМИД 9008167 .
- ^ Перейти обратно: а б с Ярден Р.И., Броуди Л.К. (апрель 1999 г.). «BRCA1 взаимодействует с компонентами комплекса деацетилазы гистонов» . Учеб. Натл. акад. наук. США . 96 (9): 4983–8. Бибкод : 1999PNAS...96.4983Y . дои : 10.1073/pnas.96.9.4983 . ПМК 21803 . ПМИД 10220405 .
- ^ Чен Г.К., Гуань Л.С., Ю Дж.Х., Ли Г.К., Чхве Ким Х.Р., Ван Цзы (июнь 2001 г.). «Rb-ассоциированный белок 46 (RbAp46) ингибирует транскрипционную трансактивацию, опосредованную BRCA1». Биохим. Биофиз. Рез. Коммун . 284 (2): 507–14. дои : 10.1006/bbrc.2001.5003 . ПМИД 11394910 .
- ^ Перейти обратно: а б Ярден Р.И., Броуди Л.К. (2001). «Идентификация белков, взаимодействующих с BRCA1, путем скрининга библиотеки Дальнего Запада» . Дж. Селл. Биохим . 83 (4): 521–31. дои : 10.1002/jcb.1257 . ПМИД 11746496 . S2CID 29703139 .
- ^ Ю X, Ву LC, Боукок AM, Аронхейм А, Баер Р (сентябрь 1998 г.). «С-концевые (BRCT) домены BRCA1 взаимодействуют in vivo с CtIP, белком, участвующим в пути репрессии транскрипции CtBP» . Ж. Биол. Хим . 273 (39): 25388–92. дои : 10.1074/jbc.273.39.25388 . ПМИД 9738006 .
- ^ Ли С., Чен П.Л., Субраманиан Т., Чиннадурай Г., Томлинсон Г., Осборн С.К. и др. (апрель 1999 г.). «Связывание CtIP с повторами BRCT BRCA1, участвующими в регуляции транскрипции p21, нарушается при повреждении ДНК» . Ж. Биол. Хим . 274 (16): 11334–8. дои : 10.1074/jbc.274.16.11334 . ПМИД 10196224 .
- ^ Вонг А.К., Ормонд П.А., Перо Р., Чен Ю., Лиан Л., Салада Г. и др. (ноябрь 1998 г.). «Характеристика белка, взаимодействующего с карбокси-концевым BRCA1» . Онкоген . 17 (18): 2279–85. дои : 10.1038/sj.onc.1202150 . ПМИД 9811458 .
- ^ Ли С., Тин Н.С., Чжэн Л., Чен П.Л., Зив Ю., Шайло Ю. и др. (июль 2000 г.). «Функциональная связь BRCA1 и продукта гена атаксии телеангиэктазии в реакции на повреждение ДНК». Природа . 406 (6792): 210–5. Бибкод : 2000Natur.406..210L . дои : 10.1038/35018134 . ПМИД 10910365 . S2CID 3266654 .
- ^ Ву-Баер Ф., Баер Р. (ноябрь 2001 г.). «Влияние повреждения ДНК на комплекс BRCA1» . Природа . 414 (6859): 36. дои : 10.1038/35102118 . ПМИД 11689934 . S2CID 4329675 .
- ^ Ю Х, Баер Р. (июнь 2000 г.). «Ядерная локализация и специфическая для клеточного цикла экспрессия CtIP, белка, который связывается с опухолевым супрессором BRCA1» . Ж. Биол. Хим . 275 (24): 18541–9. дои : 10.1074/jbc.M909494199 . ПМИД 10764811 .
- ^ Перейти обратно: а б с Фань С., Юань Р., Ма YX, Сюн Дж., Мэн К., Эрдос М. и др. (август 2001 г.). «Нарушение мотива BRCA1 LXCXE изменяет функциональную активность BRCA1 и регуляцию семейства RB, но не связывание белков RB» . Онкоген . 20 (35): 4827–41. дои : 10.1038/sj.onc.1204666 . ПМИД 11521194 .
- ^ Апреликова О.Н., Фанг Б.С., Мейснер Э.Г., Коттер С., Кэмпбелл М., Кутиала А. и др. (октябрь 1999 г.). «Задержка роста, связанная с BRCA1, зависит от RB» . Учеб. Натл. акад. наук. США . 96 (21): 11866–71. Бибкод : 1999PNAS...9611866A . дои : 10.1073/pnas.96.21.11866 . ЧВК 18378 . ПМИД 10518542 .
- ^ Хилл Д.А., де ла Серна, Иллинойс, Вил ТМ, Имбальцано А.Н. (апрель 2004 г.). «BRCA1 взаимодействует с доминантно-негативными ферментами SWI/SNF, не влияя на гомологичную рекомбинацию или радиационно-индуцированную активацию генов p21 или Mdm2» . Дж. Селл. Биохим . 91 (5): 987–98. дои : 10.1002/jcb.20003 . ПМИД 15034933 . S2CID 40668596 .
- ^ Оучи Т., Ли С.В., Оучи М., Ааронсон С.А., Хорват К.М. (май 2000 г.). «Сотрудничество преобразователя сигнала и активатора транскрипции 1 (STAT1) и BRCA1 в дифференциальной регуляции генов-мишеней IFN-гамма» . Учеб. Натл. акад. наук. США . 97 (10): 5208–13. Бибкод : 2000PNAS...97.5208O . дои : 10.1073/pnas.080469697 . ПМК 25807 . ПМИД 10792030 .
- ^ Сокка М., Парккинен С., Поспих Х., Сиваоя Дж.Э. (апрель 2012 г.). «Функция TopBP1 в стабильности генома». В Нашеуере HP (ред.). Стабильность генома и болезни человека . Субклеточная биохимия. Том. 50. Спрингер. стр. 119–141. дои : 10.1007/978-90-481-3471-7_7 . ISBN 978-90-481-3471-7 . ПМИД 20012580 .
- ^ Бржович П.С., Киф Дж.Р., Нисикава Х., Миямото К., Фокс Д., Фукуда М. и др. (май 2003 г.). «Связывание и распознавание при сборке активного комплекса убиквитин-лигазы BRCA1/BARD1» . Учеб. Натл. акад. наук. США . 100 (10): 5646–51. Бибкод : 2003PNAS..100.5646B . дои : 10.1073/pnas.0836054100 . ПМК 156255 . ПМИД 12732733 .
- ^ Нишикава Х., Оока С., Сато К., Арима К., Окамото Дж., Клевит Р.Э. и др. (февраль 2004 г.). «Масс-спектрометрический и мутационный анализы выявляют Lys-6-связанные полиубиквитиновые цепи, катализируемые убиквитинлигазой BRCA1-BARD1» . Ж. Биол. Хим . 279 (6): 3916–24. дои : 10.1074/jbc.M308540200 . ПМИД 14638690 .
- ^ Кенцис А., Гордон Р.Э., Борден К.Л. (ноябрь 2002 г.). «Контроль биохимических реакций посредством самосборки супрамолекулярного домена RING» . Учеб. Натл. акад. наук. США . 99 (24): 15404–9. Бибкод : 2002PNAS...9915404K . дои : 10.1073/pnas.202608799 . ПМК 137729 . ПМИД 12438698 .
- ^ Ву-Баер Ф., Лаграсон К., Юань В., Баер Р. (сентябрь 2003 г.). «Гетеродимер BRCA1/BARD1 собирает полиубиквитиновые цепи посредством нетрадиционной связи с участием остатка лизина K6 убиквитина» . Ж. Биол. Хим . 278 (37): 34743–6. дои : 10.1074/jbc.C300249200 . ПМИД 12890688 .
- ^ Хасидзуме Р., Фукуда М., Маэда И., Нисикава Х., Ояке Д., Ябуки Ю. и др. (май 2001 г.). «Гетеродимер RING BRCA1-BARD1 представляет собой убиквитинлигазу, инактивированную мутацией, вызванной раком молочной железы» . Ж. Биол. Хим . 276 (18): 14537–40. дои : 10.1074/jbc.C000881200 . ПМИД 11278247 .
- ^ Кейбл П.Л., Уилсон К.А., Кальцоне Ф.Дж., Раушер Ф.Дж., Скалли Р., Ливингстон Д.М. и др. (октябрь 2003 г.). «Новая консенсусная ДНК-связывающая последовательность для белковых комплексов BRCA1» . Мол. Карциног . 38 (2): 85–96. дои : 10.1002/mc.10148 . ПМИД 14502648 . S2CID 24956554 .
- ^ Ганесан С., Сильвер Д.П., Драпкин Р., Гринберг Р., Фойнтеун Дж., Ливингстон Д.М. (январь 2004 г.). «Ассоциация BRCA1 с неактивной Х-хромосомой и РНК XIST» . Филос. Пер. Р. Сок. Лонд. Б Биол. Наука . 359 (1441): 123–8. дои : 10.1098/rstb.2003.1371 . ПМЦ 1693294 . ПМИД 15065664 .
- ^ Ганесан С., Сильвер Д.П., Гринберг Р.А., Авни Д., Драпкин Р., Мирон А. и др. (ноябрь 2002 г.). «BRCA1 поддерживает концентрацию РНК XIST на неактивной Х-хромосоме» . Клетка . 111 (3): 393–405. дои : 10.1016/S0092-8674(02)01052-8 . ПМИД 12419249 .
- ^ Чжэн Л., Пан Х., Ли С., Флескен-Никитин А., Чен П.Л., Бойер Т.Г. и др. (октябрь 2000 г.). «Специфическая для последовательности транскрипционная корепрессорная функция для BRCA1 посредством нового белка цинковых пальцев, ZBRK1» . Мол. Клетка . 6 (4): 757–68. дои : 10.1016/S1097-2765(00)00075-7 . ПМИД 11090615 .
Внешние ссылки
[ редактировать ]- Белок BRCA1 Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)
- Гены, BRCA1 в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- PDBe-KB предоставляет обзор всей информации о структуре, доступной в PDB для Human BRCA1.