Гептоксид дихлора
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Гептоксид дихлора | |
| Другие имена оксид хлора(VII); Перхлорный ангидрид; (Перхлорилокси)триоксид хлорана | |
| Идентификаторы | |
3D model ( JSmol ) | |
| КЭБ | |
| ХимическийПаук | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Cl2OCl2O7 | |
| Молярная масса | 182.901 g/mol |
| Появление | бесцветная жидкость, бесцветный газ |
| Плотность | 1,9 г/см 3 |
| Температура плавления | -91,57 ° C (-132,83 ° F; 181,58 К) |
| Точка кипения | 82,07 ° С (179,73 ° F; 355,22 К) |
| гидролизуется с образованием хлорной кислоты | |
| Термохимия | |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | 275,7 кДж/моль |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | окислитель, контактное взрывчатое вещество [1] |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Родственные соединения | Гептоксид марганца |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Гептоксид дихлора представляет собой соединение формулы O Cl 2 химическое 7 . Этот оксид хлора представляет собой ангидрид кислоты хлорной . Его получают путем тщательной перегонки хлорной кислоты в присутствии дегидратирующего агента пятиокиси фосфора : [1]
- 2 HClO 4 + P 4 O 10 → Cl 2 O 7 + H 2 P 4 O 11
Оксид хлора(VII) можно отогнать из смеси.
Он также может образовываться при освещении смесей хлора и озона синим светом. [2] Он медленно гидролизуется обратно в хлорную кислоту .
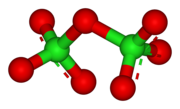
Структура
[ редактировать ]Cl 2 O 7 является эндергонической молекулой, то есть она по своей природе нестабильна и разлагается на составные элементы с выделением энергии: [3]
- 2 Cl 2 O 7 → 2 Cl 2 + 7 O 2 (Δ H° = –132 ккал/моль)
Гептоксид дихлора представляет собой ковалентное соединение, состоящее из двух частей ClO 3 , связанных атомом кислорода. Он имеет общую изогнутую молекулярную геометрию C 2 ( симметрия ) с углом Cl-O-Cl 118,6°. хлор–кислород Длины связей составляют 1,709 Å в центральной области и 1,405 Å внутри каждого ClO 3 . кластера [1] В этом соединении хлор существует в высшей формальной степени окисления +7.
Химия
[ редактировать ]Гептоксид дихлора реагирует с первичными и вторичными аминами в растворе четыреххлористого углерода с образованием перхлорных амидов: [4]
- 2 РНХ
2 + кл.
22О
7 → 2 RNHClO
3 + Ч
22О - 2 р
2 NH + Cl
22О
7 → 2 Р
2 НClO
3 + Ч
22О
Он также реагирует с алкенами с образованием алкилперхлоратов. Например, он реагирует с пропеном в растворе четыреххлористого углерода с образованием изопропилперхлората и 1-хлор-2-пропилперхлората. [5]
Гептоксид дихлора реагирует со спиртами с образованием алкилперхлоратов. [6]
Гептоксид дихлора является сильнокислотным оксидом и в растворе образует равновесие с хлорной кислотой.
Безопасность
[ редактировать ]является наиболее стабильным оксидом хлора, он Хотя Cl 2 O 7 является сильным окислителем, а также взрывчатым веществом, которое может взорваться при воздействии пламени, механическом ударе или при контакте с йодом . [7] Тем не менее, он менее сильно окисляется, чем другие оксиды хлора, и не разъедает серу , фосфор или бумагу в холодном состоянии. [1] Он оказывает такое же воздействие на организм человека, как и элементарный хлор , и требует тех же мер предосторожности. [8]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д Холлеман, Арнольд Ф.; Виберг, Эгон (2001). Неорганическая химия . Перевод Мэри Иглсон; Уильям Брюэр. Сан-Диего: Академическая пресса. п. 464. ИСБН 0-12-352651-5 .
- ^ Бирнс, AC; Роллефсон, ГК (1934). «Образование гептоксида хлора при освещении смесей хлора и озона». Журнал Американского химического общества . 56 (5): 1250–1251. дои : 10.1021/ja01320a506 .
- ^ Мартин, Ян М.Л. (12 октября 2006 г.). «Теплота образования хлорной кислоты HClO 4 и хлорного ангидрида Cl 2 O 7 . Исследование границ теории W1 и W2». Журнал молекулярной структуры: THEOCHEM . Моделирование структуры и реактивности: 7-я конференция Всемирной ассоциации химиков-теоретиков и вычислительной химии, проводимая раз в три года (WATOC, 2005). 771 (1): 19–26. arXiv : физика/0508076 . doi : 10.1016/j.theochem.2006.03.035 . ISSN 0166-1280 . S2CID 98385268 .
- ^ Борода, компакт-диск; Баум, К. (1974). «Реакции гептоксида дихлора с аминами». Журнал Американского химического общества . 96 (10): 3237–3239. дои : 10.1021/ja00817a034 .
- ^ Баум, К. . (1976). «Реакции гептоксида дихлора с олефинами». Журнал органической химии . 41 (9): 1663–1665. дои : 10.1021/jo00871a048 .
- ^ Баум, Курт; Борода, Чарльз Д. (1 мая 1974 г.). «Реакции гептоксида дихлора со спиртами» . Журнал Американского химического общества . 96 (10): 3233–3237. дои : 10.1021/ja00817a033 . ISSN 0002-7863 .
- ^ Льюис, Роберт Алан (1998). Токсикологический словарь Льюиса . ЦРК Пресс. п. 260 . ISBN 1-56670-223-2 .
- ^ Жанна Магер Стеллман, изд. (1998). «Галогены и их соединения» . Энциклопедия охраны труда и техники безопасности (4-е изд.). Международная организация труда. п. 104.210 . ISBN 92-2-109817-6 .
