Химия
| Часть серии о |
| Химия |
|---|
 |
|
Химия – это научное исследование свойств и поведения материи . [1] Это физическая наука в рамках естественных наук , которая изучает химические элементы , из которых состоит вещество, и соединения, состоящие из атомов , молекул и ионов : их состав, структуру, свойства, поведение и изменения, которым они претерпевают в ходе реакций с другими веществами . [2] [3] [4] [5] Химия также изучает природу химических связей в химических соединениях .
По объему своего предмета химия занимает промежуточное положение между физикой и биологией . [6] Ее иногда называют центральной наукой , поскольку она обеспечивает основу для понимания как фундаментальных , так и прикладных научных дисциплин на фундаментальном уровне. [7] Например, химия объясняет аспекты роста растений ( ботаника ), образования магматических пород ( геология ), как образуется атмосферный озон и как разлагаются загрязнители окружающей среды ( экология ), свойства почвы на Луне ( космохимия ), как действие лекарств ( фармакология ) и как собрать доказательства ДНК на месте преступления ( криминалистика ).
Химия существовала под разными названиями с древних времен. [8] Она развивалась, и теперь химия охватывает различные области специализации или субдисциплины, число которых продолжает увеличиваться и взаимосвязываться, создавая дальнейшие междисциплинарные области исследования. в хозяйственных целях часто используются приложения различных областей химии В химической промышленности .
Этимология
Слово «химия» происходит от модификации во время Ренессанса слова «алхимия» , которое относилось к более раннему набору практик, включавших в себя элементы химии, металлургии , философии , астрологии , астрономии , мистицизма и медицины . Алхимия часто ассоциируется со стремлением превратить свинец или другие недрагоценные металлы в золото, хотя алхимиков также интересовали многие вопросы современной химии. [9] [10]
Современное слово «алхимия», в свою очередь, происходит от арабского слова «ал-кимиа» ( الكیمیاء ). Оно может иметь египетское происхождение, поскольку слово «al-kīmīā» происходит от древнегреческого слова χημία , которое, в свою очередь, происходит от слова «кемет» , которое является древним названием Египта на египетском языке. [11] С другой стороны, аль-кимиа может происходить от χημεία «собрать вместе». [12]
Современные принципы

Современная модель атомной структуры — это квантово-механическая модель . [13] Традиционная химия начинается с изучения элементарных частиц , атомов , молекул , [14] вещества , металлы , кристаллы и другие агрегаты материи . Вещество можно изучать в твердом, жидком, газообразном и плазменном состояниях , изолированно или в сочетании. Взаимодействия, реакции и превращения, изучаемые в химии, обычно являются результатом взаимодействий между атомами, приводящих к перегруппировке химических связей , удерживающих атомы вместе. Такое поведение изучается в химической лаборатории .
В химической лаборатории стереотипно используются различные формы лабораторной посуды . Однако стеклянная посуда не играет решающей роли в химии, и значительная часть экспериментальной (а также прикладной/промышленной) химии обходится без нее.

– Химическая реакция это превращение некоторых веществ в одно или несколько различных веществ. [15] В основе такого химического превращения лежит перегруппировка электронов в химических связях между атомами. Это можно символически изобразить с помощью химического уравнения , в котором в качестве субъектов обычно участвуют атомы. Число атомов слева и справа в уравнении химического превращения одинаково. (Когда число атомов с обеих сторон неравно, преобразование называется ядерной реакцией или радиоактивным распадом .) Тип химических реакций, которым может подвергаться вещество, и изменения энергии, которые могут сопровождать это, ограничиваются определенными основными правилами: известные как химические законы .
Соображения энергии и энтропии неизменно важны почти во всех химических исследованиях. Химические вещества классифицируются по строению , фазе, а также химическому составу . Их можно анализировать с помощью инструментов химического анализа , например, спектроскопии и хроматографии . Учёных, занимающихся химическими исследованиями, называют химиками . [16] Большинство химиков специализируются на одной или нескольких субдисциплинах. несколько концепций Для изучения химии необходимы ; некоторые из них: [17]
Иметь значение
В химии материя определяется как все, что имеет массу покоя и объем (занимает пространство) и состоит из частиц . Частицы, из которых состоит материя, также имеют массу покоя – не все частицы имеют массу покоя, например фотон . Материя может быть чистым химическим веществом или смесью веществ. [18]
Атом

Атом . — основная единица химии Он состоит из плотного ядра, называемого атомным ядром, окруженного пространством, занимаемым электронным облаком . Ядро состоит из положительно заряженных протонов и незаряженных нейтронов (вместе называемых нуклонами ), а электронное облако состоит из отрицательно заряженных электронов , которые вращаются вокруг ядра. В нейтральном атоме отрицательно заряженные электроны уравновешивают положительный заряд протонов. Ядро плотное; масса нуклона примерно в 1836 раз больше массы электрона, однако радиус атома примерно в 10 000 раз больше его ядра. [19] [20]
Атом также является наименьшим объектом, который можно предусмотреть для сохранения химических свойств элемента, таких как электроотрицательность , потенциал ионизации , предпочтительная степень(я) окисления , координационное число и предпочтительные типы образующихся связей (например, металлические , ионные). , ковалентный ).
Элемент
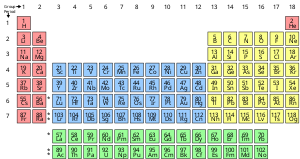
состоящее из одного типа атомов, характеризующееся определенным числом протонов в ядрах его атомов, известным как атомный номер и представленным символом Z. Химический элемент — это чистое вещество , Массовое число — это сумма числа протонов и нейтронов в ядре. Хотя все ядра всех атомов, принадлежащих одному элементу, будут иметь одинаковый атомный номер, они не обязательно могут иметь одинаковое массовое число; Атомы элемента, имеющие разные массовые числа, называются изотопами . Например, все атомы с 6 протонами в ядрах являются атомами химического элемента углерода , но атомы углерода могут иметь массовые числа 12 или 13. [20]
Стандартное представление химических элементов находится в таблице Менделеева , в которой элементы упорядочены по атомному номеру. Таблица Менделеева организована в группы или столбцы и периоды или строки. Таблица Менделеева полезна для выявления периодических тенденций . [21]
Сложный

Соединение . – это чистое химическое вещество, состоящее из более чем одного элемента Свойства соединения мало похожи на свойства его элементов. [22] Стандартная номенклатура соединений установлена Международным союзом теоретической и прикладной химии (IUPAC). Органические соединения называют по системе органической номенклатуры . [23] Названия неорганических соединений создаются по системе неорганической номенклатуры . Когда соединение имеет более одного компонента, их разделяют на два класса: электроположительные и электроотрицательные компоненты. [24] Кроме того, Служба химических рефератов разработала метод индексации химических веществ. В этой схеме каждое химическое вещество идентифицируется по номеру, известному как его регистрационный номер CAS .
Молекула

Молекула — это мельчайшая неделимая часть чистого химического вещества , обладающая уникальным набором химических свойств, то есть способностью вступать в определенный набор химических реакций с другими веществами. Однако это определение хорошо работает только для веществ, состоящих из молекул, чего нельзя сказать о многих веществах (см. ниже). Молекулы обычно представляют собой набор атомов, связанных между собой ковалентными связями , так что структура электрически нейтральна, и все валентные электроны соединены с другими электронами либо в связи, либо в неподеленные пары .
Таким образом, молекулы существуют как электрически нейтральные единицы, в отличие от ионов. Когда это правило нарушается, придавая «молекуле» заряд, результат иногда называют молекулярным ионом или многоатомным ионом. Однако дискретный и обособленный характер молекулярной концепции обычно требует, чтобы молекулярные ионы присутствовали только в хорошо разделенной форме, например, в виде направленного луча в вакууме в масс-спектрометре . Совокупности заряженных многоатомных веществ, находящихся в твердых веществах (например, обычные ионы сульфата или нитрата), обычно не считаются в химии «молекулами». Некоторые молекулы содержат один или несколько неспаренных электронов, образуя радикалы . Большинство радикалов сравнительно реакционноспособны, но некоторые, например оксид азота (NO), могут быть стабильными.

«Инертные» или благородные газовые элементы ( гелий , неон , аргон , криптон , ксенон и радон ) состоят из одиночных атомов как их наименьшей дискретной единицы, но другие изолированные химические элементы состоят либо из молекул, либо из сетей атомов, связанных друг с другом. каким-то образом. Идентифицируемые молекулы составляют знакомые вещества, такие как вода, воздух и многие органические соединения, такие как спирт, сахар, бензин и различные фармацевтические препараты .
Однако не все вещества или химические соединения состоят из дискретных молекул, и действительно, большинство твердых веществ, составляющих твердую кору, мантию и ядро Земли, представляют собой химические соединения без молекул. Эти другие типы веществ, такие как ионные соединения и твердые сети , организованы таким образом, что не существует идентифицируемых молекул как таковых . Вместо этого эти вещества обсуждаются в терминах формульных единиц или элементарных ячеек как наименьшей повторяющейся структуры внутри вещества. Примерами таких веществ являются минеральные соли (например, поваренная соль ), твердые вещества, такие как углерод и алмаз, металлы, а также знакомые кремнезем и силикатные минералы, такие как кварц и гранит.
Одной из основных характеристик молекулы является ее геометрия, которую часто называют структурой . В то время как структура двухатомных, трехатомных или четырехатомных молекул может быть тривиальной (линейной, угловато-пирамидальной и т. д.), структура многоатомных молекул, состоящих из более чем шести атомов (несколько элементов), может иметь решающее значение для ее химической природы. .
Вещество и смесь
  | |
  | |
  | |
| Примеры чистых химических веществ. Слева направо: элементы олово (Sn) и сера (S), алмаз ( аллотроп углерода . ), сахароза (чистый сахар), хлорид натрия (соль) и бикарбонат натрия (пищевая сода), которые оба являются ионными соединениями . |
Химическое вещество – это разновидность материи, имеющая определенный состав и набор свойств . [25] Совокупность веществ называется смесью. Примерами смесей являются воздух и сплавы . [26]
Моль и количество вещества
Моль — это единица измерения, обозначающая количество вещества (также называемое химическим количеством). В одном моле содержится ровно 6,022 140 76 × 10 23 частицы ( атомы , молекулы , ионы или электроны ), где число частиц на моль известно как константа Авогадро . [27] Молярная концентрация — это количество определенного вещества на объем раствора , обычно выражается в моль/ дм. 3 . [28]
Фаза

Помимо специфических химических свойств, которые отличают различные химические классификации, химические вещества могут существовать в нескольких фазах. По большей части химические классификации не зависят от классификаций объемных фаз; однако некоторые более экзотические фазы несовместимы с определенными химическими свойствами. Фаза — это набор состояний химической системы, которые имеют схожие объемные структурные свойства в диапазоне условий, таких как давление или температура .
Физические свойства, такие как плотность и показатель преломления, имеют тенденцию находиться в пределах значений, характерных для фазы. Фаза материи определяется фазовым переходом , когда энергия, введенная в систему или забранная из нее, идет на перестройку структуры системы, а не на изменение объемных условий.
Иногда различие между фазами может быть непрерывным, а не иметь дискретной границы; в этом случае вещество считается находящимся в сверхкритическом состоянии. Когда три состояния встречаются на основе условий, это называется тройной точкой , и, поскольку она инвариантна, это удобный способ определить набор условий.
Наиболее знакомыми примерами фаз являются твердые тела , жидкости и газы . Многие вещества содержат несколько твердых фаз. Например, существует три фазы твердого железа (альфа, гамма и дельта), которые различаются в зависимости от температуры и давления. Принципиальное различие между твердыми фазами заключается в кристаллической структуре или расположении атомов. Другой фазой, часто встречающейся при изучении химии, является водная фаза, которая представляет собой состояние веществ, растворенных в водном растворе (то есть в воде).
Менее знакомые фазы включают плазму , конденсаты Бозе-Эйнштейна и фермионные конденсаты , а также парамагнитные и ферромагнитные фазы магнитных материалов. Хотя большинство известных этапов связаны с трехмерными системами, также возможно определить аналоги в двумерных системах, которые привлекли внимание из-за своей значимости для систем в биологии .
Склеивание

Говорят, что атомы, слипающиеся в молекулы или кристаллы, связаны друг с другом. Химическую связь можно представить как мультипольный баланс между положительными зарядами в ядрах и отрицательными зарядами, колеблющимися вокруг них. [29] Энергии и распределения характеризуют не просто притяжение и отталкивание, а способность электрона связываться с другим атомом.
Химическая связь может быть ковалентной , ионной , водородной или просто благодаря силе Ван-дер-Ваальса . Каждому из этих видов связей приписывается некоторый потенциал. Эти потенциалы создают взаимодействия, которые удерживают атомы вместе в молекулах или кристаллах . Во многих простых соединениях теорию валентных связей , модель отталкивания электронных пар валентной оболочки ( VSEPR ) и концепцию степени окисления для объяснения молекулярной структуры и состава можно использовать .
Ионная связь образуется, когда металл теряет один или несколько своих электронов, становясь положительно заряженным катионом, а затем электроны приобретаются атомом неметалла, становясь отрицательно заряженным анионом. Два противоположно заряженных иона притягивают друг друга, а ионная связь представляет собой электростатическую силу притяжения между ними. Например, натрий (Na) теряет один электрон и становится Na. металл + катион, в то время как хлор (Cl), неметалл, получает этот электрон, превращаясь в Cl. − . Ионы удерживаются вместе благодаря электростатическому притяжению, в результате чего образуется соединение хлорида натрия (NaCl) или поваренная соль.

В ковалентной связи одна или несколько пар валентных электронов являются общими для двух атомов: образующаяся электрически нейтральная группа связанных атомов называется молекулой . Атомы будут иметь общие валентные электроны таким образом, чтобы создать электронную конфигурацию благородного газа (восемь электронов во внешней оболочке) для каждого атома. Говорят, что атомы, которые имеют тенденцию объединяться таким образом, что каждый из них имеет восемь электронов в своей валентной оболочке, подчиняются правилу октетов . Однако некоторым элементам, таким как водород и литий, для достижения этой стабильной конфигурации достаточно всего двух электронов на внешней оболочке; Говорят, что эти атомы следуют правилу дуэта , и таким образом они достигают электронной конфигурации благородного газа гелия , который имеет два электрона во внешней оболочке.
Точно так же теории классической физики можно использовать для предсказания многих ионных структур. Для более сложных соединений, таких как комплексы металлов , теория валентных связей менее применима, и молекулярных орбиталей обычно используются альтернативные подходы, такие как теория . См. диаграмму электронных орбиталей.
Энергия
В контексте химии энергия — это атрибут вещества как следствие его атомной , молекулярной или агрегатной структуры . Поскольку химическое превращение сопровождается изменением одной или нескольких структур такого типа, оно неизменно сопровождается увеличением или уменьшением энергии участвующих веществ . Некоторая энергия передается между окружающей средой и реагентами реакции в виде тепла или света ; таким образом, продукты реакции могут иметь больше или меньше энергии, чем реагенты.
Реакция называется экзергонической , если конечное состояние ниже по шкале энергии, чем начальное состояние; в случае эндергонических реакций ситуация обратная. Реакция называется экзотермической, если в результате реакции выделяется тепло в окружающую среду; в случае эндотермических реакций реакция поглощает тепло из окружающей среды.
Химические реакции всегда невозможны, если реагенты не преодолеют энергетический барьер, известный как энергия активации . Скорость . химической реакции (при данной температуре T) связана с энергией активации E коэффициентом численности Больцмана – это вероятность того, что молекула будет иметь энергию, большую или равную E при данной температуре T. Эта экспоненциальная зависимость скорости реакции от температуры известна как уравнение Аррениуса .Энергия активации, необходимая для возникновения химической реакции, может быть в форме тепла, света, электричества или механической силы в виде ультразвука . [30]
Родственная концепция свободной энергии , которая также включает в себя соображения энтропии, является очень полезным средством для прогнозирования возможности реакции и определения состояния равновесия химической реакции в химической термодинамике . Реакция возможна только в том случае, если полное изменение свободной энергии Гиббса отрицательно: ; если оно равно нулю, химическая реакция называется равновесной .
Существуют лишь ограниченные возможные состояния энергии для электронов, атомов и молекул. Они определяются правилами квантовой механики , которые требуют квантования энергии связанной системы. Говорят, что атомы/молекулы, находящиеся в более высоком энергетическом состоянии, возбуждены. Молекулы/атомы вещества в возбужденном энергетическом состоянии часто гораздо более реакционноспособны; то есть более поддающиеся химическим реакциям.
Фаза вещества неизменно определяется его энергией и энергией окружающей среды. Когда межмолекулярные силы вещества таковы, что энергии окружающей среды недостаточно для их преодоления, оно возникает в более упорядоченной фазе, например жидкой или твердой, как в случае с водой (H 2 O); жидкость при комнатной температуре, поскольку ее молекулы связаны водородными связями . [31] Тогда как сероводород (H 2 S) при комнатной температуре и стандартном давлении является газом, так как его молекулы связаны более слабыми диполь-дипольными взаимодействиями .
Передача энергии от одного химического вещества к другому зависит от величины энергии, квантов излучаемых одним веществом. Однако тепловая энергия часто легче передается практически от любого вещества к другому, поскольку фононы, ответственные за колебательные и вращательные уровни энергии в веществе, имеют гораздо меньшую энергию, чем фотоны, используемые для электронной передачи энергии. Таким образом, поскольку уровни колебательной и вращательной энергии расположены ближе друг к другу, чем уровни электронной энергии, тепло легче передается между веществами по сравнению со светом или другими формами электронной энергии. Например, ультрафиолетовое электромагнитное излучение не передается от одного вещества к другому с такой же эффективностью, как тепловая или электрическая энергия.
Существование характерных уровней энергии для различных химических веществ полезно для их идентификации путем анализа спектральных линий . часто используются различные виды спектров В химической спектроскопии , например , ИК , микроволновые , ЯМР , ЭПР и т. д. Спектроскопия также используется для определения состава удаленных объектов – таких как звезды и далекие галактики – путем анализа их спектров излучения.

Термин «химическая энергия» часто используется для обозначения способности химического вещества претерпевать трансформацию посредством химической реакции или трансформировать другие химические вещества.
Реакция

Когда химическое вещество преобразуется в результате его взаимодействия с другим веществом или с энергией, говорят, что произошла химическая реакция. Таким образом, химическая реакция — это концепция, связанная с «реакцией» вещества, когда оно вступает в тесный контакт с другим веществом, будь то в виде смеси или раствора ; воздействие той или иной формы энергии или того и другого. В результате происходит некоторый обмен энергией между компонентами реакции, а также с окружающей средой системы, в качестве которой могут выступать сосуды — часто лабораторная посуда .
Химические реакции могут привести к образованию или диссоциации молекул, то есть к распаду молекул с образованием двух или более молекул или к перегруппировке атомов внутри молекул или между ними. Химические реакции обычно включают образование или разрыв химических связей. Окисление, восстановление , диссоциация , кислотно-основная нейтрализация и молекулярная перегруппировка являются примерами распространенных химических реакций.
Химическую реакцию можно символически изобразить с помощью химического уравнения . В то время как в неядерной химической реакции число и тип атомов в обеих частях уравнения равны, для ядерной реакции это справедливо только для ядерных частиц, а именно. протоны и нейтроны. [32]
Последовательность стадий, в которых может происходить перестройка химических связей в ходе химической реакции, называется ее механизмом . Можно представить, что химическая реакция протекает в несколько стадий, каждая из которых может иметь разную скорость. множество промежуточных продуктов реакции Таким образом, в ходе реакции можно предусмотреть с переменной стабильностью. Механизмы реакции предложены для объяснения кинетики и относительного состава продуктов реакции. Многие физико-химики специализируются на изучении и предположении механизмов различных химических реакций. Некоторые эмпирические правила, такие как правила Вудворда-Гоффмана, часто пригодятся при предложении механизма химической реакции.
Согласно золотой книге ИЮПАК , химическая реакция — это «процесс, приводящий к взаимопревращению химических веществ». [33] Соответственно, химическая реакция может быть элементарной реакцией или ступенчатой реакцией . Сделано дополнительное предостережение: это определение включает случаи, когда взаимное превращение конформеров наблюдаемо экспериментально. Такие обнаруживаемые химические реакции обычно включают наборы молекулярных объектов, как указано в этом определении, но часто концептуально удобно использовать этот термин также для изменений, включающих отдельные молекулярные объекты (т.е. «микроскопические химические события»).
Ионы и соли

Ион — это заряженная частица, атом или молекула, которая потеряла или приобрела один или несколько электронов. Когда атом теряет электрон и, таким образом, имеет больше протонов, чем электронов, атом представляет собой положительно заряженный ион или катион . Когда атом получает электрон и, таким образом, имеет больше электронов, чем протонов, атом представляет собой отрицательно заряженный ион или анион . Катионы и анионы могут образовывать кристаллическую решетку нейтральных солей , таких как Na + и Cl − ионы, образующие хлорид натрия или NaCl. Примерами многоатомных ионов , не распадающихся в ходе кислотно-основных реакций, являются гидроксид ( OH − ) и фосфат (PO 4 3− ).
Плазма состоит из газообразного вещества, полностью ионизированного, обычно при высокой температуре.
Кислотность и основность

Вещество часто можно классифицировать как кислоту или основание . Существует несколько различных теорий, объясняющих кислотно-основное поведение. Простейшей является теория Аррениуса , которая утверждает, что кислота — это вещество, образующее ионы гидроксония при растворении в воде, а основание — это такое вещество, которое при растворении в воде образует ионы гидроксония . Согласно кислотно-основной теории Брёнстеда-Лоури , кислоты — это вещества, которые отдают положительный водорода ион другому веществу в химической реакции; в более широком смысле, основание — это вещество, которое принимает этот ион водорода.
Третья распространенная теория — это кислотно-основная теория Льюиса , которая основана на образовании новых химических связей. Теория Льюиса объясняет, что кислота — это вещество, способное принимать пару электронов от другого вещества в процессе образования связи, а основание — это вещество, которое может предоставить пару электронов для образования новой связи. Существует несколько других способов классифицировать вещество как кислоту или основание, что очевидно из истории этой концепции. [34]
Силу кислоты обычно измеряют двумя методами. Одним из измерений, основанным на определении кислотности по Аррениусу, является pH , который представляет собой измерение концентрации ионов гидроксония в растворе, выраженное в отрицательной логарифмической шкале. Таким образом, растворы с низким pH имеют высокую концентрацию ионов гидроксония и, можно сказать, более кислые. Другим измерением, основанным на определении Брёнстеда-Лоури, является константа диссоциации кислоты (Ka ) , которая измеряет относительную способность вещества действовать как кислота в соответствии с определением кислоты Брёнстеда-Лоури. То есть вещества с более высоким значением K a с большей вероятностью отдают ионы водорода в химических реакциях, чем вещества с более низкими значениями K a .
Редокс
Окислительно-восстановительные реакции ( восстановление - окисление ) включают все химические реакции , в которых атомы меняют степень окисления либо за счет приобретения электронов (восстановление), либо за счет потери электронов (окисление). Вещества, обладающие способностью окислять другие вещества, называются окислителями и известны как окислители , окислители или окислители. Окислитель отбирает электроны у другого вещества. Аналогичным образом, вещества, которые обладают способностью восстанавливать другие вещества, называются восстановителями и известны как восстановители , восстановители или восстановители.
Восстановитель передает электроны другому веществу и таким образом окисляется. И поскольку он «жертвует» электроны, его еще называют донором электронов. Окисление и восстановление по существу относятся к изменению степени окисления — реальный перенос электронов может никогда не произойти. Таким образом, окисление лучше определить как увеличение степени окисления , а восстановление – как уменьшение степени окисления.
Равновесие
Хотя концепция равновесия широко используется в науках, в контексте химии она возникает всякий раз, когда возможны несколько различных состояний химического состава, как, например, в смеси нескольких химических соединений, которые могут вступать в реакцию друг с другом. или когда вещество может присутствовать более чем в одной фазе.
Система химических веществ, находящихся в равновесии, хотя и имеет неизменный состав, чаще всего не статична ; Молекулы веществ продолжают реагировать друг с другом, приводя, таким образом, к динамическому равновесию . Таким образом, концепция описывает состояние, в котором такие параметры, как химический состав, остаются неизменными с течением времени.
Химические законы
Химические реакции подчиняются определенным законам, ставшим фундаментальными понятиями химии. Некоторые из них:
- Закон Авогадро
- Закон Бера – Ламберта
- Закон Бойля (1662 г., связывающий давление и объем)
- Закон Шарля (1787 г., касающийся объема и температуры)
- Законы диффузии Фика
- Закон Гей-Люссака (1809 г., связывающий давление и температуру)
- Принцип Ле Шателье
- Закон Генри
- Закон Гесса
- Закон сохранения энергии приводит к важным понятиям равновесия , термодинамики и кинетики .
- Закон сохранения массы продолжает сохраняться в изолированных системах даже в современной физике. Однако специальная теория относительности показывает, что из-за эквивалентности массы и энергии всякий раз, когда нематериальная «энергия» (тепло, свет, кинетическая энергия) удаляется из неизолированной системы, некоторая масса будет потеряна вместе с ней. Высокие потери энергии приводят к потере значительного количества массы, что является важной темой ядерной химии .
- Закон определенного состава , хотя во многих системах (особенно в биомакромолекулах и минералах) соотношения, как правило, требуют больших чисел и часто представляются в виде дробей.
- Закон кратных пропорций
- Закон Рауля
История
История химии охватывает период от древнего прошлого до наших дней. За несколько тысячелетий до нашей эры цивилизации использовали технологии, которые в конечном итоге легли в основу различных отраслей химии. Примеры включают извлечение металлов из руд , изготовление керамики и глазури, ферментацию пива и вина, извлечение химикатов из растений для медицины и парфюмерии, переработку жира в мыло , изготовление стекла и изготовление сплавов , таких как бронза .
Химии предшествовала ее протонаука, алхимия , которая использовала ненаучный подход к пониманию составляющих материи и их взаимодействий. Несмотря на то, что алхимики не смогли объяснить природу материи и ее превращений, они подготовили почву для современной химии, проводя эксперименты и записывая результаты. Роберт Бойль , хотя и скептически относился к элементам и был убежден в алхимии, сыграл ключевую роль в возвышении «священного искусства» как независимой, фундаментальной и философской дисциплины в своей работе «Скептический химик» (1661). [35]
Хотя и алхимия, и химия занимаются материей и ее превращениями, решающее различие заключалось в научном методе , который химики использовали в своей работе. Химия, как совокупность знаний, отличная от алхимии, стала признанной наукой благодаря работе Антуана Лавуазье , который разработал закон сохранения массы , требовавший тщательного измерения и количественного наблюдения за химическими явлениями. История химии впоследствии переплетается с историей термодинамики , особенно благодаря работам Уилларда Гиббса . [36]
Определение
Определение химии со временем изменилось, поскольку новые открытия и теории расширяют функциональность науки. Термин «химия», по мнению известного ученого Роберта Бойля в 1661 году, означал предмет материальных принципов смешанных тел. [37] В 1663 году химик Кристофер Глейзер описал «химию» как научное искусство, с помощью которого учатся растворять тела и извлекать из них различные вещества по их составу, а также тому, как снова объединять их и доводить до высшего совершенства. [38]
Определение слова «химия» 1730 года, использованное Георгом Эрнстом Сталем , означало искусство разделения смешанных, составных или агрегатных тел на их принципы; и составления таких органов на основе этих принципов. [39] В 1837 году Жан-Батист Дюма считал, что слово «химия» относится к науке, изучающей законы и эффекты молекулярных сил. [40] Это определение развивалось дальше, пока в 1947 году оно не стало означать науку о веществах: их структуре, свойствах и реакциях, которые превращают их в другие вещества – характеристика, принятая Лайнусом Полингом . [41] Совсем недавно, в 1998 году, профессор Рэймонд Чанг расширил определение «химии», включив в него изучение материи и изменений, которым она подвергается. [42]
Фон

Ранние цивилизации, такие как египтяне [43] Вавилоняне и индейцы [44] накопил практические знания в области металлургического, гончарного и красильного искусства, но не разработал систематической теории.
Основная химическая гипотеза впервые возникла в классической Греции с теорией четырех элементов , окончательно сформулированной Аристотелем, утверждавшей, что огонь , воздух , земля и вода были фундаментальными элементами, из которых все формируется как комбинация. Греческий атомизм восходит к 440 году до нашей эры, возник в работах таких философов, как Демокрит и Эпикур . В 50 г. до н. э. римский философ Лукреций подробно изложил эту теорию в своей поэме De rerum natura («О природе вещей»). [45] [46] В отличие от современных концепций науки, греческий атомизм носил чисто философский характер, мало уделяя внимания эмпирическим наблюдениям и химическим экспериментам. [47]
Ранней формой идеи сохранения массы является представление о том, что « Ничто не возникает из ничего » в древнегреческой философии , которое можно найти у Эмпедокла (ок. 4 в. до н.э.): «Ибо невозможно, чтобы что-либо могло возникнуть из того, чего нет, и невозможно вызвать или услышать о том, что то, что есть, должно быть полностью уничтожено». [48] и Эпикур (3 век до н.э.), который, описывая природу Вселенной, писал, что «совокупность вещей всегда была такой, какая она есть сейчас, и всегда будет». [49]

В эллинистическом мире искусство алхимии впервые распространилось, смешав магию и оккультизм с изучением природных веществ с конечной целью превращения элементов в золото и открытия эликсира вечной жизни. [50] Работа, особенно развитие дистилляции , продолжалась в ранний византийский период, причем самым известным практиком был греко-египет IV века Зосима из Панополя . [51] Алхимия продолжала развиваться и практиковаться во всем арабском мире после мусульманских завоеваний . [52] и оттуда, и из византийских остатков, [53] распространился в средневековую Европу и Европу эпохи Возрождения через латинские переводы.
Арабские работы, приписываемые Джабиру ибн Хайяну , представили систематическую классификацию химических веществ и предоставили инструкции по получению неорганических соединений ( аммиак или хлорид аммония ) из органических веществ (таких как растения, кровь и волосы) химическими методами. [54] Некоторые арабские произведения Джабира (например, «Книга милосердия» и «Книга семидесяти») были позже переведены на латынь под латинизированным названием «Гебер». [55] а в Европе 13-го века анонимный писатель, которого обычно называют псевдо-Гебером , начал писать под этим именем алхимические и металлургические сочинения. [56] Более поздние влиятельные мусульманские философы, такие как Абу ар-Райхан аль-Бируни. [57] и Авиценна [58] оспаривал теории алхимии, в частности теорию трансмутации металлов .

Улучшения в переработке руд и их извлечении для выплавки металлов были широко используемым источником информации для первых химиков 16 века, в том числе Георга Агриколы (1494–1555), опубликовавшего свою главную работу De re Metallica в 1556 году. Его работа: описывающие высокоразвитые и сложные процессы добычи металлических руд и извлечения металлов, были вершиной металлургии того времени. Его подход устранил весь мистицизм, связанный с этой темой, создав практическую основу, на которой другие могли и будут строить. Работа описывает множество видов печей, используемых для выплавки руды, и стимулирует интерес к минералам и их составу. Агриколу называют «отцом металлургии» и основателем геологии как научной дисциплины. [62] [60] [61]
Под влиянием новых эмпирических методов, Роберта Гука и Джона начала Мэйоу предложенных сэром Фрэнсисом Бэконом и другими, группа химиков из Оксфорда Роберта Бойля, преобразовывать старые алхимические традиции в научную дисциплину. поставил под сомнение некоторые общепринятые химические теории и призвал практикующих химиков быть более «философскими» и менее коммерчески ориентированными Бойль, в частности, в своей книге «Химик-скептик» . [35] Он сформулировал закон Бойля , отверг классические «четыре элемента» и предложил механистическую альтернативу атомов и химических реакций , которую можно было бы подвергнуть строгим экспериментам. [63]

В последующие десятилетия было сделано много важных открытий, таких как природа «воздуха», который, как выяснилось, состоит из множества различных газов. Шотландский химик Джозеф Блэк и фламандец Ян Баптист ван Гельмонт открыли углекислый газ , или то, что Блэк назвал «неподвижным воздухом», в 1754 году; Генри Кавендиш открыл водород и объяснил его свойства, а Джозеф Пристли и независимо Карл Вильгельм Шееле выделили чистый кислород . Теория флогистона (вещества, лежащего в основе всякого горения) была выдвинута немцем Георгом Эрнстом Сталем в начале 18 века и была опровергнута только к концу века французским химиком Антуаном Лавуазье , химическим аналогом Ньютона в физика. Лавуазье сделал больше, чем кто-либо другой, чтобы поставить новую науку на надлежащую теоретическую основу, разъяснив принцип сохранения массы и разработав новую систему химической номенклатуры, используемую по сей день. [65]
английский учёный Джон Дальтон предложил современную теорию атомов ; что все вещества состоят из неделимых «атомов» материи и что разные атомы имеют разный атомный вес.
Развитие электрохимической теории химических соединений произошло в начале 19 века в результате работы двух ученых, в частности, Йенса Якоба Берцелиуса и Хамфри Дэви , что стало возможным благодаря предшествующему изобретению гальванической батареи Алессандро Вольтой . Дэви открыл девять новых элементов, включая щелочные металлы , извлекая их из оксидов с помощью электрического тока. [66]

Британец Уильям Праут первым предложил упорядочить все элементы по их атомному весу, поскольку все атомы имели вес, в точности кратный атомному весу водорода. JAR Newlands разработал раннюю таблицу элементов, которая затем была преобразована в современную периодическую таблицу элементов. [69] в 1860-х годах Дмитрием Менделеевым и независимо несколькими другими учеными, включая Юлиуса Лотара Мейера . [70] [71] Инертные газы, позже названные благородными газами, были открыты Уильямом Рамзи в сотрудничестве с лордом Рэлеем в конце века, тем самым заполнив основную структуру таблицы.

Внизу: наблюдаемые результаты: небольшая часть частиц отклонилась, что указывает на небольшой концентрированный заряд .
На рубеже двадцатого века теоретические основы химии были окончательно поняты благодаря ряду замечательных открытий, позволивших исследовать и раскрыть саму природу внутренней структуры атомов. В 1897 году Дж. Дж. Томсон из Кембриджского университета открыл электрон , а вскоре после этого французский учёный Беккерель , а также супруги Пьер и Мария Кюри исследовали явление радиоактивности . В серии новаторских экспериментов по рассеянию Эрнест Резерфорд из Манчестерского университета открыл внутреннюю структуру атома и существование протона, классифицировал и объяснил различные типы радиоактивности и успешно трансмутировал первый элемент путем бомбардировки азота альфа -частицами .
Его работа по атомной структуре была усовершенствована его учениками, датским физиком Нильсом Бором , англичанином Генри Мозли и немцем Отто Ханом , которые впоследствии стали отцом новой ядерной химии и открыли деление ядра . Электронная теория химических связей и молекулярных орбиталей была разработана американскими учёными Лайнусом Полингом и Гилбертом Н. Льюисом .
2011 год был объявлен Организацией Объединенных Наций Международным годом химии. [72] Это была инициатива Международного союза теоретической и прикладной химии и Организации Объединенных Наций по вопросам образования, науки и культуры, в которой участвуют химические общества, ученые и учреждения по всему миру, и она основывалась на индивидуальных инициативах по организации местных и региональных мероприятий.
Органическая химия была разработана Юстусом фон Либихом и другими после Фридрихом Вёлером синтеза мочевины . [73] Другими важными достижениями XIX века были; понимание валентных связей ( Эдвард Франкленд в 1852 году) и применение термодинамики в химии ( Дж. Гиббс и Сванте Аррениус в 1870-х годах).
Упражняться
В химической практике чистая химия — это изучение фундаментальных принципов химии, а прикладная химия применяет эти знания для разработки технологий и решения реальных проблем.
Субдисциплины
Химию обычно делят на несколько основных дисциплин. Есть также несколько основных междисциплинарных и более специализированных областей химии. [74]
- Аналитическая химия — это анализ образцов материалов с целью понимания их химического состава и структуры . Аналитическая химия включает стандартизированные экспериментальные методы в химии. Эти методы могут быть использованы во всех разделах химии, за исключением чисто теоретической химии. [75]

В аналитической химии спектроскопия изучает взаимодействие между электромагнитным излучением (светом) и веществом. [76] Спектрофотометр — это прибор , используемый для измерения воздействия света на вещество. На фото модель Beckman DU-640. - Биохимия – это изучение химических веществ , химических реакций и взаимодействий, которые происходят на молекулярном уровне в живых организмах . Биохимия является очень междисциплинарной и охватывает медицинскую химию , нейрохимию , молекулярную биологию , судебную медицину , науку о растениях и генетику . [77]
- Неорганическая химия — это изучение свойств и реакций неорганических соединений, таких как металлы и минералы. [78] Различие между органическими и неорганическими дисциплинами не является абсолютным, и существует много совпадений, особенно в рамках дисциплины металлоорганической химии .

Катализатор Каминского представляет собой металлоорганический комплекс, содержащий металлические центры циркония или гафния . катализатора В зависимости от расположения циклопентадиеновых лигандов можно производить полипропилены с различной тактичностью . [79] 1 создает атактический полипропилен, который является мягким, аморфным и имеет сыпучий состав. 2 создает изотактический полипропилен, который является твердым и используется в пластиковых контейнерах многоразового использования. 3 создает синдиотактический полипропилен, эластичный и полукристаллический. [80] - Химия материалов — это подготовка, характеристика и понимание твердотельных компонентов или устройств с полезной текущей или будущей функцией. [81] Эта область представляет собой новое направление обучения в программах магистратуры и объединяет элементы из всех классических областей химии, таких как органическая химия , неорганическая химия и кристаллография , с акцентом на фундаментальные вопросы, уникальные для материалов . Основные системы исследования включают химию конденсированных фаз (твердых тел, жидкостей, полимеров ) и границ раздела между различными фазами.
- Нейрохимия — это изучение нейрохимических веществ ; включая передатчики, пептиды, белки, липиды, сахара и нуклеиновые кислоты; их взаимодействие и роль, которую они играют в формировании, поддержании и изменении нервной системы.
- Ядерная химия — это изучение того, как субатомные частицы соединяются и образуют ядра. Современная трансмутация — важная составляющая ядерной химии, а таблица нуклидов — важный результат и инструмент в этой области. Помимо медицинских применений , ядерная химия включает в себя ядерную технику , которая исследует тему использования ядерных источников энергии для производства энергии. [82] [83]

« Маленький мальчик» — атомная бомба , использующая урана-235 реакцию деления . [84] Путем сжигания докритического урана в другой массе докритического урана внутри бомбы - самоподдерживающаяся ядерная реакция ( критическая масса ). Он произвел взрывную силу, превышающую 15 000 тонн в тротиловом эквиваленте. - Органическая химия – это изучение структуры, свойств, состава, механизмов и реакций органических соединений . Органическое соединение определяется как любое соединение на основе углеродного скелета. Органические соединения можно классифицировать, организовывать и понимать в реакциях по их функциональным группам , элементарным атомам или молекулам, которые проявляют характерные химические свойства в соединении. [85]
4-Гидроксибутаналь представляет собой органическое соединение с альдегидной (справа) функциональной группой и спиртовой (слева) функциональной группой. - Физическая химия — это изучение физических и фундаментальных основ химических систем и процессов. В частности, энергетика и динамика таких систем и процессов представляют интерес для физико-химиков. Важные области исследования включают химическую термодинамику , химическую кинетику , электрохимию , статистическую механику , спектроскопию и, в последнее время, астрохимию . Физическая химия во многом пересекается с молекулярной физикой . Физическая химия предполагает использование исчисления бесконечно малых при выводе уравнений. Обычно это связано с квантовой химией и теоретической химией. Физическая химия — это отдельная от химической физики дисциплина , но, опять же, между ними очень сильное совпадение.
- Теоретическая химия — это изучение химии посредством фундаментальных теоретических рассуждений (обычно в рамках математики или физики ). В частности, применение квантовой механики к химии называется квантовой химией . После окончания Второй мировой войны развитие компьютеров позволило систематически развивать вычислительную химию , которая представляет собой искусство разработки и применения компьютерных программ для решения химических задач. Теоретическая химия во многом пересекается с (теоретической и экспериментальной) физикой конденсированного состояния и молекулярной физикой .

На Сольвеевской конференции 1927 года были представлены ученые-основатели теоретической химии и физики. На этой конференции обсуждались электроны и фотоны.
Другие подразделения включают электрохимию , фемтохимию , ароматическую химию , проточную химию , иммуногистохимию , химию гидрогенизации , математическую химию , молекулярную механику , химию натуральных продуктов , металлоорганическую химию , нефтехимию , фотохимию , физическую органическую химию , химию полимеров , радиохимию , сонохимию , супрамолекулярную химию , синтетическую. химия и многие другие.
Междисциплинарный
Междисциплинарные области включают агрохимию , астрохимию (и космохимию ), химию атмосферы , химическую инженерию , химическую биологию , хемоинформатику , химию окружающей среды , геохимию , зеленую химию , иммунохимию , морскую химию , материаловедение , механохимию , медицинскую химию , молекулярную биологию , нанотехнологии , энология , фармакология , фитохимия , химия твердого тела , наука о поверхности , термохимия и многие другие.
Промышленность
Химическая промышленность представляет собой важную экономическую деятельность во всем мире. Объем продаж 50 крупнейших мировых производителей химической продукции в 2013 году составил 980,5 млрд долларов США , а рентабельность составила 10,3%. [86]
Профессиональные общества
- Американское химическое общество
- Американское общество нейрохимии
- Химический институт Канады
- Химическое общество Перу
- Международный союз теоретической и прикладной химии
- Королевский австралийский химический институт
- Королевское химическое общество Нидерландов
- Королевское химическое общество
- Общество химической промышленности
- Всемирная ассоциация химиков-теоретиков и вычислительных химиков
- Список химических обществ
См. также
- Сравнение программного обеспечения для моделирования молекулярной механики
- Словарь химических терминов
- Международный год химии
- Список химиков
- Список соединений
- Список важных публикаций по химии
- Список нерешенных задач по химии
- Очерк химии
- Периодические системы малых молекул
- Философия химии
- Научный туризм
Ссылки
- ^ Браун, Теодор Л.; ЛеМэй, Х. Юджин младший; Берстен, Брюс Э.; Мерфи, Кэтрин Дж.; Вудворд, Патрик М.; Штольцфус, Мэтью В.; Луфасо, Майкл В. (2018). «Введение: материя, энергия и измерение». Химия: Центральная наука (14-е изд.). Нью-Йорк: Пирсон. стр. 46–85. ISBN 978-0134414232 .
- ^ «Что такое химия?» . Chemweb.ucc.ie. Архивировано из оригинала 3 октября 2018 года . Проверено 12 июня 2011 г.
- ^ «Определение ХИМИИ» . Мерриам-Вебстер . Архивировано из оригинала 7 августа 2020 года . Проверено 24 августа 2020 г.
- ^ «Определение химии | Dictionary.com» . www.dictionary.com . Архивировано из оригинала 5 марта 2016 года . Проверено 24 августа 2020 г.
- ^ «Химия повсюду» . Американское химическое общество . Архивировано из оригинала 29 ноября 2020 года . Проверено 1 декабря 2020 г.
- ^ Карстен Рейнхардт. Химические науки в ХХ веке: преодоление границ . Вайли-ВЧ, 2001. ISBN 3-527-30271-9 . стр. 1–2.
- ^ Теодор Л. Браун, Х. Юджин Лемей, Брюс Эдвард Берстен, Х. Лемей. Химия: Центральная наука . Прентис Холл; 8 изд. (1999). ISBN 0-13-010310-1 . стр. 3–4.
- ^ «Химия – Химия и общество» . Британника . Архивировано из оригинала 6 мая 2023 года . Проверено 6 мая 2023 г.
- ^ Иде, Аарон Дж. (1984). Развитие современной химии . Нью-Йорк: Дувр. ISBN 978-0-486-64235-2 .
- ^ Ньюман, Уильям Р. (2011). «Чему мы научились из новейшей историографии алхимии?» . Исида . 102 (2): 313–321. дои : 10.1086/660140 . ISSN 0021-1753 . ПМИД 21874691 .
- ^ «алхимия», запись в Оксфордском словаре английского языка , JA Simpson и ESC Weiner, vol. 1, 2-е изд., 1989 г., ISBN 0-19-861213-3 .
- ^ Уикли, Эрнест (1967). Этимологический словарь современного английского языка. Нью-Йорк: Dover Publications. ISBN 0-486-21873-2
- ^ «химическая связь» . Британника . Британская энциклопедия. Архивировано из оригинала 26 апреля 2012 года . Проверено 1 ноября 2012 г.
- ^ Материя: Атомы от Демокрита до Дальтона. Архивировано 28 февраля 2007 года в Wayback Machine Энтони Карпи, доктор философии.
- ↑ ИЮПАК. Золотой книги Определение Архивировано 4 марта 2007 г. в Wayback Machine.
- ^ «Калифорнийский профессиональный справочник № 22: Химики» . Calmis.ca.gov. 29 октября 1999 года. Архивировано из оригинала 10 июня 2011 года . Проверено 12 июня 2011 г.
- ^ «Общая химия онлайн - Сопутствующие заметки: Материя» . Antoine.frostburg.edu. Архивировано из оригинала 24 июня 2011 года . Проверено 12 июня 2011 г.
- ^ Армстронг, Джеймс (2012). Общая, органическая и биохимия: прикладной подход . Брукс/Коул . п. 48. ИСБН 978-0-534-49349-3 .
- ^ Берроуз и др. 2009 , с. 13.
- ^ Перейти обратно: а б Хаускрофт и Шарп 2008 , с. 2.
- ^ Берроуз и др. 2009 , с. 110.
- ^ Берроуз и др. 2009 , с. 12.
- ^ «Номенклатура органической химии ИЮПАК» . Acdlabs.com. Архивировано из оригинала 8 июня 2011 года . Проверено 12 июня 2011 г.
- ^ Коннелли, Нил Г.; Дамхус, Туре; Хартшом, Ричард М.; Хаттон, Алан Т. (2005). Номенклатура неорганической химии. Рекомендации ИЮПАК 2005 . Кембридж: Издательство Королевского химического общества / ИЮПАК. ISBN 0854044388 . Проверено 13 июня 2022 г.
- ^ Хилл, JW; Петруччи, Р.Х.; МакКрири, ТВ; Перри, СС (2005). Общая химия (4-е изд.). Река Аппер-Сэддл, Нью-Джерси: Пирсон Прентис Холл. п. 37.
- ^ М.М. Аведезян; Хью Бейкер. Магний и магниевые сплавы . АСМ Интернешнл. п. 59.
- ^ Берроуз и др. 2009 , с. 16.
- ^ Аткинс и де Паула 2009 , с. 9.
- ^ Видениеобучения. «Химическая связь», Энтони Карпи, доктор философии . видениеобучение. Архивировано из оригинала 17 июля 2011 года . Проверено 12 июня 2011 г.
- ^ Рейли, Майкл. (2007). Механическая сила вызывает химическую реакцию. Архивировано 14 августа 2014 года в Wayback Machine , служба новостей NewScientist.com, Рейли.
- ^ Изменение состояний материи. Архивировано 28 апреля 2007 г. на Wayback Machine - Chemforkids.com.
- ^ Уравнение химической реакции. Архивировано 12 октября 2007 г. в Wayback Machine - Золотая книга ИЮПАК.
- ↑ Золотая книга «Химическая реакция» . Архивировано 4 марта 2007 г. в Золотой книге Wayback Machine IUPAC.
- ^ «История кислотности» . Би-би-си. 27 мая 2004 г. Архивировано из оригинала 27 февраля 2009 г. Проверено 12 июня 2011 г.
- ^ Перейти обратно: а б Принсипи, Л. (2011). «Оглядываясь назад: химик-скептик» . Природа . 469 (7328): 30–31. Бибкод : 2011Natur.469...30P . дои : 10.1038/469030a . ISSN 1476-4687 . S2CID 6490305 .
- ^ «Избранные классические статьи из истории химии» . Архивировано из оригинала 17 сентября 2018 года . Проверено 8 октября 2017 г.
- ^ Бойль, Роберт (1661). Скептический химик . Нью-Йорк: Dover Publications, Inc. (перепечатка). ISBN 978-0-486-42825-3 .
- ^ Глейзер, Кристофер (1663). Справляется с химией . Париж. как найдено в: Ким, Ми Гён (2003). Близость, эта неуловимая мечта – генеалогия химической революции . Массачусетский технологический институт Пресс. ISBN 978-0-262-11273-4 .
- ^ Шталь, Джордж (1730). Философские основы универсальной химии . Лондон.
- ^ Дюма, JB (1837). «Аффинит» (примечания к чтению), vii, стр. 4. «Химическая статика», Париж: Академия наук.
- ^ Полинг, Лайнус (1947). Общая химия . Dover Publications, Inc. ISBN 978-0-486-65622-9 .
- ^ Чанг, Раймонд (1998). Химия, 6-е изд . Нью-Йорк: МакГроу Хилл. ISBN 978-0-07-115221-1 .
- ↑ Первые химики . Архивировано 8 января 2015 г. в Wayback Machine , 13 февраля 1999 г., New Scientist.
- ^ Барнс, Рут (2004). Текстиль в обществах Индийского океана . Рутледж. п. 1 . ISBN 978-0415297660 .
- ^ Лукреций. «de Rerum Natura (О природе вещей)» . Архив интернет-классики . Массачусетский технологический институт. Архивировано из оригинала 29 июня 2011 года . Проверено 9 января 2007 г.
- ^ Симпсон, Дэвид (29 июня 2005 г.). «Лукреций (ок. 99–55 до н.э.)» . Интернет-история философии . Архивировано из оригинала 28 мая 2010 года . Проверено 10 ноября 2020 г.
- ^ Стродач, Джордж К. (2012). Искусство счастья . Нью-Йорк: Классика Пингвинов. стр. 7–8. ISBN 978-0-14-310721-7 .
- ^ О. 12; см. стр. 291–2 из Кирк, Г.С.; Дж. Э. Рэйвен; Малькольм Шофилд (1983). Досократические философы (2-е изд.). Кембридж: Издательство Кембриджского университета . ISBN 978-0-521-27455-5 .
- ^ Лонг, А.А.; Д.Н. Седли (1987). «Эпикуреизм: принципы сохранения». Эллинистические философы. Том 1: Переводы основных источников с философскими комментариями . Кембридж: Издательство Кембриджского университета. стр. 25–26. ISBN 978-0-521-27556-9 .
- ^ «Международный год химии – история химии» . Лабораторный журнал GIT Europe. 25 февраля 2011 года. Архивировано из оригинала 15 июня 2013 года . Проверено 12 марта 2013 г.
- ^ Брайан Х. Банч и Александр Хеллеманс (2004). История науки и техники . Хоутон Миффлин Харкорт. п. 88 . ISBN 978-0-618-22123-3 .
- ^ Моррис Клайн (1985) Математика для нематематиков. Архивировано 5 сентября 2015 года в Wayback Machine . Публикации Курьера Дувра. п. 284. ISBN 0-486-24823-2
- ^ Марселин Бертло , Коллекция древних греческих алхимиков (3 тома, Париж, 1887–1888, стр. 161); Ф. Шервуд Тейлор, «Происхождение греческой алхимии», Ambix 1 (1937), 40.
- ^ Стэплтон, Генри Э .; Азо, РФ; Хидаят Хусейн, М. (1927). «Химия в Ираке и Персии в десятом веке нашей эры» Мемуары Азиатского общества Бенгалии . VIII (6): 317–418. OCLC 706947607 . стр. 338–340; Краус, Пауль (1942–1943). Джабир ибн Хайян: Вклад в историю научных идей в исламе. I. Корпус джабирских сочинений. II. Джабир и греческая наука . Каир: Французский институт восточной археологии. ISBN 978-3-487-09115-0 . OCLC 468740510 . том. II, стр. 41–42.
- ^ Дармштедтер, Эрнст. «Liber Misericordiae Geber: латинский перевод Большого Китаб л-рахма», Архив истории медицины , 17/4, 1925, стр. 181–197; Бертло, Марселлен. «Археология и история наук», Mémoires de l'Académie des Sciences de l'Institut de France , 49, 1906, стр. 308–363; см. также Форстер, Регула. «Джабир ибн Хайян». Архивировано 18 апреля 2021 года в Wayback Machine , Энциклопедия ислама, Three .
- ^ Ньюман, Уильям Р. «Новый взгляд на личность Гебера», Sudhoffs Archiv , 1985, 69, стр. 76–90; Ньюман, Уильям Р. Summa Perfectionis Псевдо-Гебера: критическое издание, перевод и исследование , Лейден: Брилл, 1991, стр. 57–103. Ахмад Й. Аль-Хасан утверждал, что произведения псевдо-Гебера на самом деле были переведены на латынь с арабского языка (см. Аль-Хассан, Ахмад Й. «Арабское происхождение латинских произведений Суммы и Гебера: опровержение Бертло , Руска и Ньюман на основе арабских источников», в: Ахмад Й. Аль-Хасан. Исследования аль-Кимья: критические проблемы латинской и арабской алхимии и химии . Хильдесхайм: Георг Олмс Верлаг, 2009, стр. 53–104. также доступно онлайн. Архивировано 25 февраля 2021 г. на Wayback Machine ).
- ^ Мармура, Майкл Э.; Наср, Сейед Хосейн (1965). « Введение в исламские космологические доктрины. Представления о природе и методы, используемые для ее изучения Ихваном Ас-Сафааном, Аль-Бируни и Ибн Синой, автор Сейед Хосейн Наср» . Зеркало . 40 (4): 744–746. дои : 10.2307/2851429 . JSTOR 2851429 .
- ^ Роберт Бриффо (1938). Создание человечества , стр. 196–197.
- ^ Маршалл, Джеймс Л.; Маршалл, Вирджиния Р. (осень 2005 г.). «Повторное открытие элементов: Агрикола» (PDF) . Шестиугольник . 96 (3). Альфа Хи Сигма: 59. ISSN 0164-6109 . OCLC 4478114 . Проверено 7 января 2024 г.
- ^ Перейти обратно: а б «Георгиус Агрикола» . Калифорнийский университет — Музей палеонтологии . Проверено 4 апреля 2019 г.
- ^ Перейти обратно: а б Рафферти, Джон П. (2012). геологические науки; Геология: формы рельефа, минералы и горные породы . Нью-Йорк: Образовательное издательство Britannica, стр. 10. ISBN 9781615305445
- ^ Карл Альфред фон Циттель (1901) История геологии и палеонтологии , с. 15
- ^ «История – Роберт Бойль (1627–1691)» . Би-би-си. Архивировано из оригинала 9 января 2011 года . Проверено 12 июня 2011 г.
- ^ Игл, Кассандра Т.; Дженнифер Слоан (1998). «Мария-Анн Поль Лавуазье: мать современной химии». Химический педагог . 3 (5): 1–18. дои : 10.1007/s00897980249a . S2CID 97557390 .
- ^ Ми Гён Ким (2003). Близость, эта неуловимая мечта: генеалогия химической революции . МТИ Пресс. п. 440 . ISBN 978-0-262-11273-4 .
- ^ Дэви, Хамфри (1808). «О некоторых новых явлениях химических изменений, производимых электричеством, в частности о разложении фиксированных щелочей и проявлении новых веществ, составляющих их основы» . Философские труды Королевского общества . 98 : 1–45. дои : 10.1098/rstl.1808.0001 . Архивировано из оригинала 18 апреля 2021 года . Проверено 30 ноября 2020 г. .
- ^ «Краткая история развития таблицы Менделеева» . Конспект курса химии 412 . Университет Западного Орегона. Архивировано из оригинала 9 февраля 2020 года . Проверено 20 июля 2015 г.
- ^ Заметка. Архивировано 24 сентября 2015 г. в Wayback Machine : «... это правда, что, если бы Менделеев никогда не жил, современные химики использовали бы Периодическую таблицу» и «Дмитрий Менделеев» . Королевское химическое общество. Архивировано из оригинала 2 июля 2014 года . Проверено 18 июля 2015 г.
- ^ Зима, Марк. «WebElements: периодическая таблица в Интернете» . Университет Шеффилда . Архивировано из оригинала 4 января 2014 года . Проверено 27 января 2014 г.
- ^ «Юлиус Лотар Мейер и Дмитрий Иванович Менделеев» . Институт истории науки. Июнь 2016. Архивировано из оригинала 21 марта 2018 года . Проверено 20 марта 2018 г.
- ^ «Что делает эти семейные сходства среди элементов? В 1860-х годах все ломали голову над этим, и несколько ученых подошли к довольно похожим ответам. Человеком, который решил проблему наиболее триумфально, был молодой русский по имени Дмитрий Иванович Менделеев, посетивший соляная шахта в Величке в 1859 году». Броновский, Джейкоб (1973). Восхождение человека . Литтл, Браун и компания. п. 322 . ISBN 978-0-316-10930-7 .
- ^ «Химия» . Химия2011.org. Архивировано из оригинала 8 октября 2011 года . Проверено 10 марта 2012 г.
- ^ Иде, Аарон Джон (1984). Развитие современной химии . Публикации Курьера Дувра. п. 164. ИСБН 978-0-486-64235-2 .
- ^ «Химические дисциплины» . www.thecanadianencyclepedia.ca . Проверено 1 апреля 2024 г.
- ^ «Аналитическая химия» . Американское химическое общество . Проверено 1 апреля 2024 г.
- ^ Скуг, Дуглас А.; Холлер, Ф. Джеймс; Крауч, Стэнли Р. (2018). Принципы инструментального анализа (7-е изд.). Австралия: Cengage Learning. п. 120. ИСБН 978-1-305-57721-3 .
- ^ «Изучение биохимии» . www.biochemistry.org . Проверено 11 апреля 2024 г.
- ^ «Неорганическая химия» . Американское химическое общество . Проверено 1 апреля 2024 г.
- ^ Каминский, Уолтер (1 января 1998 г.). «Высокоактивные металлоценовые катализаторы полимеризации олефинов» . Журнал Химического общества, Dalton Transactions (9): 1413–1418. дои : 10.1039/A800056E . ISSN 1364-5447 .
- ^ «Полипропилен» . pslc.ws. Проверено 11 апреля 2024 г.
- ^ Фалман, Брэдли Д. (2011). Химия материалов (1-е изд.). Дордрехт: Springer Нидерланды Электронные книги Springer Выходные данные: Springer. стр. 1–4. ISBN 978-94-007-0693-4 .
- ^ «Ядерная химия» . Американское химическое общество . Проверено 11 апреля 2024 г.
- ^ «21: Ядерная химия» . Либретексты . 18 ноября 2014 года . Проверено 11 апреля 2024 г.
- ^ «Маленький мальчик и толстяк — Ядерный музей» . ahf.nuclearmuseum.org/ . Проверено 11 апреля 2024 г.
- ^ Браун, Уильям Генри; Айверсон, Брент Л.; Анслин, Эрик В.; Фут, Кристофер С. (2018). Органическая химия (8-е изд.). Бостон, Массачусетс: Cengage Learning. п. 19. ISBN 978-1-305-58035-0 .
- ^ Тулло, Александр Х. (28 июля 2014 г.). «50 крупнейших химических компаний мира по версии C&EN в 2014 году» . Новости химии и техники . Американское химическое общество . Архивировано из оригинала 26 августа 2014 года . Проверено 22 августа 2014 г.
Библиография
- Аткинс, Питер ; де Паула, Хулио (2009) [1992]. Элементы физической химии (5-е изд.). Нью-Йорк: Издательство Оксфордского университета . ISBN 978-0-19-922672-6 .
- Берроуз, Эндрю; Холман, Джон; Парсонс, Эндрю; Пиллинг, Гвен; Прайс, Гарет (2009). Химия 3 . Италия: Издательство Оксфордского университета . ISBN 978-0-19-927789-6 .
- Хаускрофт, Кэтрин Э.; Шарп, Алан Г. (2008) [2001]. Неорганическая химия (3-е изд.). Харлоу, Эссекс: Pearson Education . ISBN 978-0-13-175553-6 .
Дальнейшее чтение
Популярное чтение
- Аткинс, Палец П.В. Галилея ( Издательство Оксфордского университета ) ISBN 0-19-860941-8
- Аткинс, Молекулы П.В. Аткинса (издательство Кембриджского университета) ISBN 0-521-82397-8
- Кин, Сэм. Исчезающая ложка - и другие правдивые истории из таблицы Менделеева (Черный лебедь) Лондон, 2010 г. ISBN 978-0-552-77750-6
- Леви, Примо Периодическая таблица (Penguin Books) [1975] в переводе с итальянского Раймонда Розенталя (1984) ISBN 978-0-14-139944-7
- Ствертка, А. Путеводитель по элементам (Oxford University Press) ISBN 0-19-515027-9
- «Словарь истории идей» . Архивировано из оригинала 10 марта 2008 года.
- . Британская энциклопедия . Том. 6 (11-е изд.). 1911. стр. 33–76.
Вводные учебники для бакалавриата
- Аткинс, П.В., Овертон, Т., Рурк, Дж., Веллер, М. и Армстронг, Ф. Шрайвер и неорганическая химия Аткинса (4-е изд.), 2006 г. (Oxford University Press) ISBN 0-19-926463-5
- Чанг, Раймонд. Химия 6-е изд. Бостон: Джеймс М. Смит, 1998. ISBN 0-07-115221-0 .
- Клейден, Джонатан ; Гривз, Ник; Уоррен, Стюарт ; Уотерс, Питер (2001). Органическая химия (1-е изд.). Издательство Оксфордского университета. ISBN 978-0-19-850346-0 .
- Нога и нога. Биохимия (Уайли) ISBN 0-471-58651-X
Учебники для продвинутого уровня бакалавриата или магистратуры
- Аткинс, PW Физическая химия (Издательство Оксфордского университета) ISBN 0-19-879285-9
- Аткинс, PW и др. Молекулярная квантовая механика (Издательство Оксфордского университета)
- МакВини, Валентность Р. Коулсона (Oxford Science Publications) ISBN 0-19-855144-4
- Полинг, Л. Природа химической связи (издательство Корнельского университета) ISBN 0-8014-0333-2
- Полинг Л. и Уилсон Э.Б. Введение в квантовую механику с приложениями к химии (Dover Publications) ISBN 0-486-64871-0
- Смарт и Мур. Химия твердого тела: Введение (Чепмен и Холл) ISBN 0-412-40040-5
- Стивенсон, Г. Математические методы для студентов-естественников (Лонгман) ISBN 0-582-44416-0






