Цезий
 | ||||||||||||||||||||||||||||||||||||||
| Цезий | ||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | / ˈ s iː z i ə m / | |||||||||||||||||||||||||||||||||||||
| Альтернативное название | цезий (США) | |||||||||||||||||||||||||||||||||||||
| Появление | бледное золото | |||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес А р °(Cs) | ||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||
| Цезий в таблице Менделеева | ||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||
| Атомный номер ( Z ) | 55 | |||||||||||||||||||||||||||||||||||||
| Группа | группа 1: водород и щелочные металлы | |||||||||||||||||||||||||||||||||||||
| Период | период 6 | |||||||||||||||||||||||||||||||||||||
| Блокировать | S-блок | |||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [ Х ] 6 с 1 | |||||||||||||||||||||||||||||||||||||
| Электроны на оболочку | 2, 8, 18, 18, 8, 1 | |||||||||||||||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||||||||||||||
| Фаза в СТП | твердый | |||||||||||||||||||||||||||||||||||||
| Температура плавления | 301,7 К (28,5 °С, 83,3 °F) | |||||||||||||||||||||||||||||||||||||
| Точка кипения | 944 К (671 °С, 1240 °F) | |||||||||||||||||||||||||||||||||||||
| Плотность (при 20°С) | 1,886 г/см 3 [3] | |||||||||||||||||||||||||||||||||||||
| в жидком состоянии (при температуре плавления ) | 1,843 г/см 3 | |||||||||||||||||||||||||||||||||||||
| Критическая точка | 1938 К, 9,4 МПа [4] | |||||||||||||||||||||||||||||||||||||
| Теплота плавления | 2,09 кДж/моль | |||||||||||||||||||||||||||||||||||||
| Теплота испарения | 63,9 кДж/моль | |||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 32 210 Дж/(моль·К) | |||||||||||||||||||||||||||||||||||||
Давление пара
| ||||||||||||||||||||||||||||||||||||||
| Атомные свойства | ||||||||||||||||||||||||||||||||||||||
| Стадии окисления | −1, +1 [5] (сильноосновный оксид ) | |||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 0,79. | |||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
| |||||||||||||||||||||||||||||||||||||
| Атомный радиус | эмпирический: 265 вечера | |||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 244±23:00 | |||||||||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 15:43 | |||||||||||||||||||||||||||||||||||||
| Другие объекты недвижимости | ||||||||||||||||||||||||||||||||||||||
| Естественное явление | первобытный | |||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | объемно-центрированная кубическая (bcc) ( cI2 ) | |||||||||||||||||||||||||||||||||||||
| Постоянная решетки | а = 616,2 пм (при 20 °С) [3] | |||||||||||||||||||||||||||||||||||||
| Тепловое расширение | 92.6 × 10 −6 /К (при 20 °С) [3] | |||||||||||||||||||||||||||||||||||||
| Теплопроводность | 35,9 Вт/(м⋅К) | |||||||||||||||||||||||||||||||||||||
| Электрическое сопротивление | 205 нОм⋅м (при 20 °C) | |||||||||||||||||||||||||||||||||||||
| Магнитный заказ | парамагнитный [6] | |||||||||||||||||||||||||||||||||||||
| Модуль Юнга | 1,7 ГПа | |||||||||||||||||||||||||||||||||||||
| Объемный модуль | 1,6 ГПа | |||||||||||||||||||||||||||||||||||||
| Твердость по шкале Мооса | 0.2 | |||||||||||||||||||||||||||||||||||||
| Твердость по Бринеллю | 0,14 МПа | |||||||||||||||||||||||||||||||||||||
| Номер CAS | 7440-46-2 | |||||||||||||||||||||||||||||||||||||
| История | ||||||||||||||||||||||||||||||||||||||
| Мы | от латинского caesius «голубовато-серый», из-за его спектральных цветов. | |||||||||||||||||||||||||||||||||||||
| Открытие | Роберт Бунзен и Густав Кирхгоф (1860) | |||||||||||||||||||||||||||||||||||||
| Первая изоляция | Карл Сеттерберг (1882) | |||||||||||||||||||||||||||||||||||||
| Изотопы цезия | ||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||
Цезий ( ИЮПАК ; написание [9] цезий в американском английском ) [примечание 1] является химическим элементом ; он имеет символ Cs и атомный номер 55. Это мягкий серебристо-золотистый щелочной металл с температурой плавления 28,5 ° C (83,3 ° F; 301,6 К), что делает его одним из пяти элементарных металлов , которые являются жидкими при температуре или около комнатной температуры . [примечание 2] Цезий имеет физические и химические свойства, подобные свойствам рубидия и калия . Он пирофорен и реагирует с водой даже при температуре -116 ° C (-177 ° F). Это наименее электроотрицательный элемент со значением 0,79 по шкале Полинга . Он имеет только один стабильный изотоп — цезий-133 . Цезий добывается в основном из поллуцита . Цезий-137 , продукт деления , добывается из отходов ядерных реакторов . Он имеет самый большой атомный радиус среди всех элементов, радиусы которых были измерены или рассчитаны, — около 260 пикометров .
Немецкий химик Роберт Бунзен и физик Густав Кирхгоф открыли цезий в 1860 году с помощью недавно разработанного метода пламенной спектроскопии . Первые небольшие применения цезия были в качестве « поглотителя » в электронных лампах и фотоэлектрических элементах . Цезий широко используется в высокоточных атомных часах . В 1967 году Международная система единиц начала использовать особый сверхтонкий переход нейтральных атомов цезия-133 для определения основной единицы времени — секунды .
С 1990-х годов наибольшее применение этого элемента было в качестве формиата цезия для буровых растворов , но он имеет ряд применений в производстве электроэнергии, в электронике и химии. Радиоактивный изотоп цезий-137 имеет период полураспада около 30 лет и используется в медицине, промышленных датчиках и гидрологии. Нерадиоактивные соединения цезия лишь слегка токсичны , но склонность чистого металла к взрывной реакции с водой означает, что цезий считается опасным материалом, а радиоизотопы представляют значительную опасность для здоровья и окружающей среды.
Характеристики
[ редактировать ]Физические свойства
[ редактировать ]
Из всех элементов, твердых при комнатной температуре, цезий самый мягкий: его твердость составляет 0,2 Мооса . Это очень пластичный , бледный металл, темнеющий в присутствии следовых количеств кислорода . [14] [15] [16] В присутствии минерального масла (где его лучше всего хранить при транспортировке) оно теряет металлический блеск и приобретает более тусклый, серый вид. Его температура плавления составляет 28,5 °C (83,3 °F), что делает его одним из немногих элементарных металлов, которые находятся в жидком состоянии при температуре около комнатной . Ртуть — единственный стабильный элементный металл с известной температурой плавления ниже, чем у цезия. [примечание 3] [18] Кроме того, металл имеет довольно низкую температуру кипения — 641 °C (1186 °F), самую низкую из всех металлов, кроме ртути. [19] Его соединения горят синим цветом. [20] [21] или фиолетовый [21] цвет.

Цезий образует сплавы с другими щелочными металлами, золотом и ртутью ( амальгамы ). При температуре ниже 650 °C (1202 °F) он не сплавляется с кобальтом , железом , молибденом , никелем , платиной , танталом или вольфрамом . Он образует четко определенные интерметаллические соединения с сурьмой , галлием , индием и торием , которые являются светочувствительными . [14] Он смешивается со всеми другими щелочными металлами (кроме лития); сплав с молярным распределением 41% цезия, 47% калия и 12% натрия имеет самую низкую температуру плавления среди всех известных металлических сплавов - -78 ° C (-108 ° F). [18] [22] Было изучено несколько амальгам: CsHg.
2 — черный с фиолетовым металлическим блеском , а CsHg — золотистый, также с металлическим блеском. [23]
Золотой цвет цезия обусловлен уменьшением частоты света, необходимого для возбуждения электронов щелочных металлов по мере нисхождения группы. Для лития через рубидий эта частота находится в ультрафиолете, а для цезия она попадает в сине-фиолетовый конец спектра; другими словами, плазмонная частота щелочных металлов становится ниже от лития к цезию. Таким образом, цезий преимущественно пропускает и частично поглощает фиолетовый свет, в то время как другие цвета (имеющие более низкую частоту) отражаются; поэтому он кажется желтоватым. [24]
Аллотропы
[ редактировать ]Цезий существует в виде различных аллотропов , один из которых — димер, называемый дицезием. [25]
Химические свойства
[ редактировать ]Металлический цезий обладает высокой реакционной способностью и пирофорностью . Он самовозгорается на воздухе и взрывоопасно реагирует с водой даже при низких температурах, в большей степени, чем другие щелочные металлы . [14] Он реагирует со льдом при температуре до -116 ° C (-177 ° F). [18] Из-за своей высокой реакционной способности металлический цезий классифицируется как опасный материал . Его хранят и отправляют в сухих насыщенных углеводородах, таких как минеральное масло . С ним можно работать только в среде инертного газа , например аргона . Однако взрыв воды цезия часто менее мощный, чем взрыв воды натрия с аналогичным количеством натрия. Это связано с тем, что цезий мгновенно взрывается при контакте с водой, оставляя мало времени для водорода . накопления [26] Цезий можно хранить в из боросиликатного стекла, ампулах запаянных под вакуумом . В количествах более 100 граммов (3,5 унции) цезий поставляется в герметично закрытых контейнерах из нержавеющей стали. [14]
Химический состав цезия аналогичен химическому составу других щелочных металлов, в частности рубидия , элемента, расположенного выше цезия в периодической таблице. [27] Как и ожидалось для щелочного металла, единственная общая степень окисления — +1. [примечание 4] Некоторые небольшие различия возникают из-за того, что он имеет более высокую атомную массу и более электроположителен , чем другие (нерадиоактивные) щелочные металлы. [30] Цезий – самый электроположительный химический элемент. [примечание 5] [18] Ион цезия также крупнее и менее «твердый», чем ионы более легких щелочных металлов .
Соединения
[ редактировать ]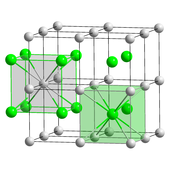
Большинство соединений цезия содержат этот элемент в виде катиона Cs. +
, который ионно связывается с широким спектром анионов . Заслуживающим внимания исключением является цезид- анион ( Cs −
), [28] и другие представляют собой несколько субоксидов (см. раздел об оксидах ниже). Совсем недавно было предсказано, что цезий будет вести себя как элемент p-блока и способен образовывать высшие фториды с более высокими степенями окисления (т.е. CsF n с n > 1) под высоким давлением. [32] Это предсказание нуждается в подтверждении дальнейшими экспериментами. [33]
Соли Cs + обычно бесцветны, если только сам анион не окрашен. Многие простые соли гигроскопичны , но в меньшей степени, чем соответствующие соли более легких щелочных металлов. Фосфат , [34] Соли ацетата , карбоната , галогенидов , оксида , нитрата и сульфата растворимы в воде. Его двойные соли часто менее растворимы, и низкая растворимость сульфата алюминия-цезия используется при очистке Cs из руд. Двойные соли сурьмы (например, CsSbCl
4 ), висмут , кадмий , медь , железо и свинец также плохо растворимы . [14]
Гидроксид цезия (CsOH) гигроскопичен и сильноосновен . [27] Он быстро травит поверхность полупроводников, таких как кремний . [35] CsOH ранее считался химиками «самым сильным основанием», что отражает относительно слабое притяжение между большими Cs + ион и ОН − ; [20] это действительно сильнейшая база Аррениуса ; однако ряд соединений, таких как н -бутиллитий , амид натрия , гидрид натрия , гидрид цезия и т. д., которые не растворяются в воде, поскольку бурно с ней реагируют, а скорее используются только в некоторых безводных полярных апротонных растворителях , являются гораздо более основными. на основе кислотно-основной теории Брёнстеда-Лоури . [27]
Стехиометрическая ( смесь цезия и золота вступит в реакцию с образованием желтого аурида цезия Cs + В − ) при нагреве. Аурид-анион здесь ведет себя как псевдогалоген . Соединение бурно реагирует с водой, образуя гидроксид цезия , металлическое золото и газообразный водород; в жидком аммиаке он может вступать в реакцию с ионообменной смолой, специфичной для цезия, с образованием аурида тетраметиламмония . Аналогичное соединение платины — красный платинид цезия ( Cs 2 Pt ), содержит ион платинида, который ведет себя как псевдохалькоген . [36]
Комплексы
[ редактировать ]Как и все катионы металлов, Cs + В растворе образует комплексы с основаниями Льюиса . Из-за большого размера Cs + обычно принимает координационные числа больше 6, числа, типичного для меньших катионов щелочных металлов. Эта разница проявляется в 8-координации CsCl. Это высокое координационное число и мягкость (склонность к образованию ковалентных связей) являются свойствами, используемыми при разделении Cs. + от других катионов при утилизации ядерных отходов, где 137 Cs + необходимо отделять от больших количеств нерадиоактивного K + . [37]
Галогениды
[ редактировать ]
Фторид цезия (CsF) представляет собой гигроскопичное белое твердое вещество, широко используемое во фторорганической химии в качестве источника фторид- анионов. [39] Фторид цезия имеет структуру галита, что означает, что Cs + и Ф − упаковать в кубический наиболее плотно упакованный массив, как это делает Na + и Cl − в хлориде натрия . [27] Примечательно, что цезий и фтор имеют самую низкую и самую высокую электроотрицательность соответственно среди всех известных элементов.
Хлорид цезия (CsCl) кристаллизуется в простой кубической кристаллической системе . Также называется «структурой хлорида цезия». [30] этот структурный мотив состоит из примитивной кубической решетки с двухатомной основой, каждый из которых имеет восьмеричную координацию ; атомы хлорида лежат в узлах решетки на краях куба, а атомы цезия лежат в отверстиях в центре кубов. Эта структура является общей с CsBr и CsI , а также многими другими соединениями, не содержащими Cs. Напротив, большинство других щелочных галогенидов имеют структуру хлорида натрия (NaCl). [30] Структура CsCl предпочтительна, поскольку Cs + имеет ионный радиус 174 пм и Cl −
181 вечера. [40]
Оксиды
[ редактировать ]
11 О
3 кластера
В большей степени, чем другие щелочные металлы, цезий образует с кислородом многочисленные бинарные соединения . При горении цезия на воздухе образуется супероксид CsO.
2 – основной продукт. [41] «Обычный» оксид цезия ( Cs
2 O ) образует желто-оранжевые шестиугольные кристаллы, [42] и является единственным оксидом анти- CdCl.
2 тип. [43] Он испаряется при 250 ° C (482 ° F) и разлагается на металлический цезий и пероксид Cs.
22О
2 при температуре выше 400 °C (752 °F). Помимо супероксида и озонида CsO
3 , [44] [45] несколько ярко окрашенных субоксидов . также было изучено [46] К ним относятся Cs
7 О , Cs
4 О , Чт
11 О
3 , Цс
3 О (темно-зеленый [47] ), CsO, Cs
33О
2 , [48] а также Cs
77О
2 . [49] [50] Последний можно нагревать в вакууме для получения Cs.
2О . [43] бинарные соединения с серой , селеном и теллуром . Также существуют [14]
изотопы
[ редактировать ]Цезий имеет 41 известный изотоп в ядре) варьируется , массовое число (т. е. число нуклонов от 112 до 152. Некоторые из них синтезируются из более легких элементов с помощью медленного процесса захвата нейтронов ( S-процесса ) внутри старых звезд. [51] и R-процессом при взрывах сверхновых . [52] Единственным стабильным изотопом цезия является 133 Cs, с 78 нейтронами . Хотя он имеет большой ядерный спин ( 7/2 + 11,7 ), исследования ядерного магнитного резонанса позволяют использовать этот изотоп на резонансной частоте МГц . [53]

Радиоактивный 135 Cs имеет очень длительный период полураспада — около 2,3 миллиона лет — самый длинный из всех радиоактивных изотопов цезия. 137 Cs и 134 Cs составляют 30 и два года соответственно. Периоды полураспада 137 Cs разлагается до короткоживущих 137 м Ba путем бета-распада , а затем в нерадиоактивный барий, при этом 134 Cs превращается в 134 Ба прямо. Изотопы с массовыми числами 129, 131, 132 и 136 имеют период полураспада от одного дня до двух недель, в то время как у большинства других изотопов период полураспада составляет от нескольких секунд до долей секунды. Существует по крайней мере 21 метастабильный ядерный изомер . Кроме 134 м Cs (с периодом полураспада чуть менее 3 часов) очень нестабильны и распадаются с периодом полураспада несколько минут или меньше. [54] [55]
Изотоп 135 Cs — один из долгоживущих продуктов деления урана, производимого в ядерных реакторах . [56] Однако выход продуктов деления в большинстве реакторов снижается, поскольку предшественник, 135 Xe — мощный нейтронный яд , часто преобразующийся в стабильные 136 Xe, прежде чем он сможет распасться на 135 Кс. [57] [58]
Бета -распад от 137 Cs к 137 м Ba приводит к гамма-излучению, поскольку 137 м Ба расслабляется до основного состояния 137 Ba, при этом излучаемые фотоны имеют энергию 0,6617 МэВ. [59] 137 Cs и 90 Sr — основные среднеживущие продукты ядерного деления и основные источники радиоактивности отработавшего ядерного топлива после нескольких лет охлаждения, продолжающегося несколько сотен лет. [60] Эти два изотопа являются крупнейшим источником остаточной радиоактивности в районе чернобыльской катастрофы . [61] Из-за низкой скорости улавливания утилизация 137 Cs путем захвата нейтронов невозможен, и единственное нынешнее решение — позволить ему распасться с течением времени. [62]
Почти весь цезий, образующийся в результате ядерного деления, происходит в результате бета-распада изначально более богатых нейтронами продуктов деления, проходящих через различные изотопы йода и ксенона . [63] Поскольку йод и ксенон летучи и могут диффундировать через ядерное топливо или воздух, радиоактивный цезий часто образуется далеко от исходного места деления. [64] Испытания ядерного оружия в 1950-1980-е гг. 137 Cs был выброшен в атмосферу и вернулся на поверхность земли в составе радиоактивных осадков . Это готовый маркер движения почвы и отложений того времени. [14]
возникновение
[ редактировать ]
Цезий — относительно редкий элемент, содержание которого оценивается в среднем в 3 части на миллион в земной коре . [65] Это 45-й по распространенности элемент и 36-й среди металлов. [66] Цезия в 30 раз меньше, чем рубидия , с которым он тесно связан химически. [14]
Из-за большого ионного радиуса цезий относится к числу « несовместимых элементов ». [67] При кристаллизации магмы цезий концентрируется в жидкой фазе и кристаллизуется последним. Поэтому крупнейшими месторождениями цезия являются зональные пегматитовые рудные тела, образовавшиеся в результате этого процесса обогащения. Поскольку цезий не заменяет калий так легко, как рубидий, минералы щелочного эвапорита сильвин (KCl) и карналлит ( KMgCl
3 6Ч
2 O ) может содержать всего 0,002% цезия. Следовательно, цезий содержится в немногих минералах. Процентное количество цезия можно найти в берилле ( Be
3 Ал
2 (SiO
3 )
6 ) и авогадрит ( (K,Cs)BF
4 ), до 15 мас.% Cs 2 O в близкородственном минерале пеццоттаите ( Cs(Be
2 Ли)Ал
2 Си
6 Ох
18 ), до 8,4 мас.% Cs 2 O в редком минерале лондоните ( (Cs,K)Al
4 Будь
4 (Б,Бе)
12 О
28 ), и в меньшей степени — в более распространенном родизите . [14] Единственной экономически важной рудой для получения цезия является поллуцит Cs(AlSi
22О
6 ) , который встречается в нескольких местах по всему миру в зональных пегматитах, связанных с более важными с коммерческой точки зрения минералами лития , лепидолитом и петалитом . Большой размер зерен и сильное разделение минералов в пегматитах приводят к получению высококачественной руды для добычи полезных ископаемых. [68]
Самым значительным и богатым известным источником цезия в мире является шахта Танко на озере Берник в Манитобе , Канада, которая, по оценкам, содержит 350 000 метрических тонн поллуцитовой руды, что составляет более двух третей мировых запасов. [68] [69] Хотя стехиометрическое содержание цезия в поллуците составляет 42,6%, чистые образцы поллуцита этого месторождения содержат лишь около 34% цезия при среднем содержании 24 мас.%. [69] Коммерческий поллуцит содержит более 19% цезия. [70] Месторождение пегматита Бикита в Зимбабве добывается из-за петалита, но оно также содержит значительное количество поллуцита. Другой известный источник поллуцита находится в пустыне Карибиб , Намибия . [69] При нынешних темпах мировой добычи полезных ископаемых от 5 до 10 метрических тонн в год запасов хватит на тысячи лет. [14]
Производство
[ редактировать ]Добыча и переработка поллуцитовой руды является селективным процессом и осуществляется в меньших масштабах, чем добыча большинства других металлов. Руду измельчают, сортируют вручную, но обычно не концентрируют, а затем измельчают. Затем цезий извлекают из поллуцита в основном тремя методами: кислотным разложением, щелочным разложением и прямым восстановлением. [14] [71]
При кислотном разложении силикатная поллуцитовая порода растворяется сильными кислотами, такими как соляная (HCl), серная ( H
2 ТАК
4 ), бромистоводородной (HBr) или плавиковой (HF) кислот. С соляной кислотой образуется смесь растворимых хлоридов, а нерастворимые хлоридные двойные соли цезия осаждаются в виде хлорида цезия и сурьмы ( Cs
4 СбСл
7 ), хлорид цезия иода ( Cs
2 ICl ), или гексахлорцерат цезия ( Cs
2 (ЦеСл
6 ) ). После разделения чистая выпавшая в осадок двойная соль разлагается, а чистый CsCl осаждается выпариванием воды.
Метод серной кислоты дает нерастворимую двойную соль непосредственно в виде цезиевых квасцов ( CsAl(SO
4 )
2 · 12 ч.
2 О ). Компонент сульфата алюминия преобразуется в нерастворимый оксид алюминия путем обжига квасцов углем , а полученный продукт выщелачивается водой с получением Cs.
2 ТАК
4 решение. [14]
Обжиг поллуцита с карбонатом кальция и хлоридом кальция дает нерастворимые силикаты кальция и растворимый хлорид цезия. Выщелачивание водой или разбавленным аммиаком ( NH
4 OH ) дает разбавленный раствор хлорида (CsCl). Этот раствор можно выпарить для получения хлорида цезия или превратить в цезиевые квасцы или карбонат цезия. Хотя это коммерчески неосуществимо, руду можно напрямую восстановить калием, натрием или кальцием в вакууме для непосредственного получения металлического цезия. [14]
Большая часть добытого цезия (в виде солей) напрямую преобразуется в формиат цезия (HCOO − Cs + ) для таких применений, как бурение нефтяных скважин . Для снабжения развивающегося рынка компания Cabot Corporation в 1997 году построила производственный завод на руднике Танко недалеко от озера Берник в Манитобе мощностью 12 000 баррелей (1900 м3). 3 ) в год раствора формиата кальция. [72] Основными мелкомасштабными коммерческими соединениями цезия являются хлорид и нитрат цезия . [73]
Альтернативно, металлический цезий может быть получен из очищенных соединений, полученных из руды. Хлорид цезия и другие галогениды цезия можно восстановить при температуре от 700 до 800 ° C (от 1292 до 1472 ° F) с помощью кальция или бария , а из полученного продукта перегнать металлический цезий. Таким же образом алюминат, карбонат или гидроксид можно восстановить магнием . [14]
Металл также можно выделить электролизом плавленого цианида цезия (CsCN). Исключительно чистый и безгазовый цезий может быть получен термическим разложением азида цезия CsN при температуре 390 °C (734 °F).
3 , который можно получить из водного раствора сульфата цезия и азида бария . [71] В вакууме дихромат цезия может взаимодействовать с цирконием с образованием чистого металлического цезия без других газообразных продуктов. [73]
- Cs
2 Кр
22О
7 + 2 Zr → 2 Cs + 2 ZrO
2 + Кр
22О
3
Цена цезия с чистотой 99,8% (в металлической основе) в 2009 году составляла около 10 долларов за грамм (280 долларов за унцию), но эти соединения значительно дешевле. [69]
История
[ редактировать ]
В 1860 году Роберт Бунзен и Густав Кирхгоф обнаружили цезий в минеральной воде из Дюркгейма , Германия. Из-за ярких синих линий в спектре излучения они получили название от латинского слова caesius , что означает « голубовато-серый » . [примечание 6] [74] [75] [76] Цезий был первым элементом, открытым с помощью спектроскопа , изобретенного Бунзеном и Кирхгофом всего год назад. [18]
Чтобы получить чистый образец цезия, необходимо было выпарить 44 000 литров (9 700 имп галлонов; 12 000 галлонов США) минеральной воды, чтобы получить 240 килограммов (530 фунтов) концентрированного раствора соли. Щелочноземельные металлы осаждаются в виде сульфатов или оксалатов , оставляя щелочной металл в растворе. После перевода в нитраты и экстракции этанолом получали смесь, не содержащую натрия. Из этой смеси литий осаждали карбонатом аммония . Калий, рубидий и цезий образуют с платинохлористоводородной кислотой нерастворимые соли , но эти соли обнаруживают небольшую разницу в растворимости в горячей воде, а менее растворимые гексахлорплатинат цезия и рубидия ( (Cs,Rb) 2 PtCl 6 ) получали фракционной кристаллизацией . После восстановления гексахлорплатината водородом цезий и рубидий разделились за счет разницы растворимости их карбонатов в спирте. В результате процесса было получено 9,2 грамма (0,32 унции) хлорида рубидия и 7,3 грамма (0,26 унции) хлорида цезия. из первоначальных 44 000 литров минеральной воды [75]
По хлориду цезия двое ученых оценили атомный вес нового элемента в 123,35 (по сравнению с принятым в настоящее время значением в 132,9). [75] Они попытались получить элементарный цезий электролизом расплавленного хлорида цезия, но вместо металла получили синее однородное вещество, которое «ни невооруженным глазом, ни под микроскопом не показало ни малейшего следа металлического вещества»; в результате они отнесли его к субхлориду ( Cs
2 Кл ). На самом деле продукт, вероятно, представлял собой коллоидную смесь металла и хлорида цезия. [77] При электролизе водного раствора хлорида ртутным катодом образуется амальгама цезия, которая легко разлагается в водных условиях. [75] Чистый металл был в конечном итоге выделен шведским химиком Карлом Сеттербергом, когда он работал над докторской диссертацией вместе с Кекуле и Бунзеном. [76] В 1882 году он получил металлический цезий путем электролиза цианида цезия , избежав проблем с хлоридом. [78]
Исторически сложилось так, что наиболее важным применением цезия были исследования и разработки, прежде всего в химической и электротехнической областях. Для цезия существовало очень мало применений до 1920-х годов, когда он начал использоваться в радиовакуумных лампах , где у него было две функции; в качестве геттера он удалял лишний кислород после изготовления, а в качестве покрытия на нагретом катоде увеличивал электропроводность . Цезий не был признан высокоэффективным промышленным металлом до 1950-х годов. [79] Нерадиоактивный цезий применялся в фотоэлектрических элементах , фотоумножителях , оптических компонентах инфракрасных спектрофотометров , катализаторах некоторых органических реакций, кристаллах для сцинтилляционных счетчиков и в магнитогидродинамических генераторах энергии . [14] Цезий также используется в качестве источника положительных ионов во вторичной ионной масс-спектрометрии (ВИМС).
С 1967 года Международная система измерений основывает основную единицу времени, вторую, на свойствах цезия. Международная система единиц (СИ) определяет секунду как продолжительность 9 192 631 770 циклов на микроволновой частоте соответствующей спектральной линии, переходу между двумя уровнями сверхтонкой энергии основного состояния цезия -133 . [80] 13-я Генеральная конференция по мерам и весам 1967 года определила секунду как «продолжительность 9 192 631 770 циклов микроволнового света, поглощаемого или излучаемого в результате сверхтонкого перехода атомов цезия-133 в их основном состоянии, не подвергающегося воздействию внешних полей».
Приложения
[ редактировать ]Разведка нефти
[ редактировать ]Наибольшее использование нерадиоактивного цезия в настоящее время приходится на на основе формиата цезия буровые растворы для добывающей нефтяной промышленности . [14] Водные растворы формиата цезия (HCOO − Cs + ) — полученные путем реакции гидроксида цезия с муравьиной кислотой — были разработаны в середине 1990-х годов для использования в качестве жидкостей для бурения нефтяных скважин и заканчивания скважин . Функция бурового раствора заключается в смазке буровых долот, выведении шлама на поверхность и поддержании давления на пласт во время бурения скважины. Жидкости для заканчивания способствуют установке контрольно-измерительного оборудования после бурения, но до начала добычи, поддерживая давление. [14]
Высокая плотность рассола формиата цезия (до 2,3 г/см3). 3 , или 19,2 фунта на галлон), [81] в сочетании с относительно безвредной природой большинства соединений цезия снижает потребность в токсичных взвешенных твердых веществах высокой плотности в буровом растворе, что является значительным технологическим, инженерным и экологическим преимуществом. В отличие от компонентов многих других тяжелых жидкостей, формиат цезия относительно безопасен для окружающей среды. [81] Рассол формиата цезия можно смешать с формиатами калия и натрия, чтобы снизить плотность жидкостей до плотности воды (1,0 г/см3). 3 или 8,3 фунта на галлон). Кроме того, он биоразлагаем и может быть переработан, что немаловажно ввиду его высокой стоимости (около 4000 долларов за баррель в 2001 году). [82] Формиаты щелочи безопасны в обращении и не повреждают продуктивный пласт или скважинные металлы, как коррозионная альтернатива рассолам высокой плотности (таким как бромид цинка ZnBr).
2 решения) иногда делают; они также требуют меньше очистки и снижают затраты на утилизацию. [14]
Атомные часы
[ редактировать ]
на основе цезия Атомные часы используют электромагнитные переходы в сверхтонкой структуре в качестве точки отсчета атомов цезия-133. Первые точные цезиевые часы были построены Луисом Эссеном в 1955 году в Национальной физической лаборатории Великобритании. [83] Цезиевые часы усовершенствовались за последние полвека и считаются «наиболее точной реализацией устройства, которого когда-либо достигло человечество». [80] Эти часы измеряют частоту с погрешностью от 2 до 3 частей из 10. 14 , что соответствует точности 2 наносекунды в день или одной секунды за 1,4 миллиона лет. Последние версии точнее, чем 1 часть из 10. 15 , примерно 1 секунда за 20 миллионов лет. [14] Цезиевый стандарт является основным стандартом для соответствующих стандартам измерений времени и частоты. [84] Цезиевые часы регулируют время работы сетей сотовой связи и Интернета. [85]
Определение второго
[ редактировать ]Второй символ s — единица времени в системе СИ. МБМВ подтвердил свое определение на своей 26 - й конференции в 2018 году: «[Второе] определяется путем принятия фиксированного численного значения частоты цезия Δ ν Cs , невозмущенной частоты сверхтонкого перехода в основное состояние атома цезия-133, как 9 192 631 770 в единицах измерения Гц , что равно с. −1 ." [86]
Электроэнергетика и электроника
[ редактировать ]на парах цезия Термоэмиссионные генераторы представляют собой устройства малой мощности, преобразующие тепловую энергию в электрическую. В двухэлектродном ламповом преобразователе цезий нейтрализует пространственный заряд вблизи катода и усиливает ток. [87]
Цезий также важен своими фотоэмиссионными свойствами, преобразующими свет в поток электронов. Он используется в фотоэлектрических элементах , поскольку катоды на основе цезия, такие как интерметаллическое соединение K
2 CsSb , имеют низкое пороговое напряжение эмиссии электронов . [88] В число фотоэмиссионных устройств, использующих цезий, входят оптического распознавания символов устройства , фотоумножители и трубки видеокамер . [89] [90] Тем не менее, германий , рубидий, селен, кремний, теллур и некоторые другие элементы могут заменить цезий в светочувствительных материалах. [14]
Кристаллы йодида цезия (CsI), бромида (CsBr) и фторида (CsF) используются в качестве сцинтилляторов в сцинтилляционных счетчиках, широко используемых в разведке полезных ископаемых и исследованиях в области физики элементарных частиц для обнаружения гамма- и рентгеновского излучения. Будучи тяжелым элементом, цезий обеспечивает хорошую останавливающую способность и лучшее обнаружение. Соединения цезия могут обеспечивать более быстрый отклик (CsF) и быть менее гигроскопичными (CsI).
Пары цезия используются во многих распространенных магнитометрах . [91]
Этот элемент используется в качестве внутреннего стандарта в спектрофотометрии . [92] Как и другие щелочные металлы , цезий имеет большое сродство к кислороду и используется в качестве « поглотителя » в электронных лампах . [93] Другие области применения металла включают высокоэнергетические лазеры , паровые лампы накаливания и выпрямители пара . [14]
Жидкости для центрифугирования
[ редактировать ]Высокая плотность иона цезия делает растворы хлорида цезия, сульфата цезия и трифторацетата цезия ( Cs(O)
2 ККФ
3 ) в градиенте плотности ) полезен в молекулярной биологии для ультрацентрифугирования . [94] Эта технология используется в первую очередь для выделения вирусных частиц , субклеточных органелл и фракций, а также нуклеиновых кислот из биологических образцов. [95]
Химическое и медицинское применение
[ редактировать ]
Относительно немногие химические приложения используют цезий. [96] Легирование соединениями цезия повышает эффективность некоторых металл-ионных катализаторов химического синтеза, таких как акриловая кислота , антрахинон , оксид этилена , метанол , фталевый ангидрид , стирол , мономеры метилметакрилата и различные олефины . Он также используется при каталитической конверсии диоксида серы в триоксид серы при производстве серной кислоты . [14]
Фторид цезия занимает нишу применения в органической химии в качестве основания. [27] и в качестве безводного источника фторид- ионов. [97] Соли цезия иногда заменяют соли калия или натрия в органическом синтезе , например при циклизации , этерификации и полимеризации . Цезий также использовался в дозиметрии термолюминесцентного излучения (ТЛД) : при воздействии радиации он приобретает кристаллические дефекты, которые при нагревании возвращаются с испусканием света, пропорционального полученной дозе. Таким образом, измерение светового импульса с помощью фотоумножителя может позволить количественно оценить накопленную дозу радиации.
Ядерные и изотопные применения
[ редактировать ]Цезий-137 — радиоизотоп, обычно используемый в качестве гамма -излучателя в промышленности. Его преимущества включают период полураспада около 30 лет, его доступность из ядерного топливного цикла и наличие 137 Ба как стабильный конечный продукт. Высокая растворимость в воде является недостатком, который делает его несовместимым с облучателями больших бассейнов для пищевых продуктов и медикаментов. [98] Его использовали в сельском хозяйстве, лечении рака, стерилизации продуктов питания, осадка сточных вод и хирургического оборудования. [14] [99] Радиоактивные изотопы цезия в радиационных устройствах использовались в медицинской сфере для лечения некоторых видов рака. [100] но появление лучших альтернатив и использование водорастворимого хлорида цезия в источниках, которое могло вызвать широкомасштабное загрязнение, постепенно вывело некоторые из этих источников цезия из употребления. [101] [102] Цезий-137 использовался в различных промышленных измерительных приборах, включая измерители влажности, плотности, нивелирования и толщиномеры. [103] Он также использовался в устройствах каротажа скважин для измерения электронной плотности горных пород, которая аналогична объемной плотности пород. [104]
Цезий-137 использовался в гидрологических исследованиях, аналогичных исследованиям трития . В качестве дочернего продукта испытаний бомбы деления в период с 1950-х по середину 1980-х годов цезий-137 был выброшен в атмосферу, где он легко абсорбировался в раствор. Известные межгодовые колебания в течение этого периода позволяют провести корреляцию со слоями почвы и отложений. Цезий-134 и, в меньшей степени, цезий-135 также использовался в гидрологии для измерения выхода цезия в атомной энергетике. Хотя они менее распространены, чем цезий-133 или цезий-137, эти изотопы-лидеры производятся исключительно из антропогенных источников. [105]
Другое использование
[ редактировать ]
Цезий и ртуть использовались в качестве топлива в первых ионных двигателях, предназначенных для движения космических кораблей в очень длительных межпланетных или внепланетных полетах. Ионизация топлива осуществлялась контактом с заряженным вольфрамовым электродом. Но коррозия компонентов космического корабля цезием подтолкнула разработку в направлении использования топлива из инертного газа, такого как ксенон , с которым легче обращаться при наземных испытаниях и которое наносит меньший потенциальный ущерб космическому кораблю. [14] Ксенон использовался в экспериментальном космическом корабле Deep Space 1, запущенном в 1998 году. [106] [107] Тем не менее, автоэмиссионные электрические двигательные установки, которые ускоряют ионы жидких металлов, таких как цезий. были созданы [108]
Нитрат цезия используется в качестве окислителя и пиротехнического красителя для сжигания кремния в инфракрасных вспышках . [109] такие как вспышка ЛУУ-19, [110] потому что он излучает большую часть своего света в ближнем инфракрасном спектре. [111] Соединения цезия, возможно, использовались в качестве добавок к топливу для уменьшения заметности радиолокационной выхлопных газов самолета Lockheed A-12 -разведчика ЦРУ . [112] Цезий и рубидий добавляются в стекло в виде карбоната , поскольку они уменьшают электропроводность и улучшают стабильность и долговечность оптоволокна и приборов ночного видения . Фторид цезия или фторид цезия-алюминия используются во флюсах, предназначенных для пайки алюминиевых сплавов, содержащих магний . [14]
Магнитогидродинамические (МГД) энергогенерирующие системы были исследованы, но не получили широкого распространения. [113] Металлический цезий также рассматривался в качестве рабочего тела в высокотемпературных с циклом Ренкина . турбоэлектрических генераторах [114]
Соли цезия были оценены как противошоковые реагенты после применения препаратов мышьяка . Однако из-за их влияния на сердечный ритм их используют реже, чем соли калия или рубидия. Их также использовали для лечения эпилепсии . [14]
Цезий-133 можно охладить лазером и использовать для исследования фундаментальных и технологических проблем квантовой физики . Он имеет особенно удобный спектр Фешбаха , позволяющий изучать ультрахолодные атомы, требующие настраиваемых взаимодействий. [115]
Опасности для здоровья и безопасности
[ редактировать ]| Опасности | |
|---|---|
| СГС Маркировка : [116] | |
  | |
| Опасность | |
| Х260 , Х314 | |
| П223 , П231+П232 , П280 , П305+П351+П338 , П370+П378 , П422 | |
| NFPA 704 (огненный алмаз) | |

Нерадиоактивные соединения цезия умеренно токсичны, а нерадиоактивный цезий не представляет значительной опасности для окружающей среды. Поскольку биохимические процессы могут сбить с толку и заменить цезий калием , избыток цезия может привести к гипокалиемии , аритмии и острой остановке сердца , но такие количества обычно не встречаются в природных источниках. [118] [119]
Средняя смертельная доза (LD 50 ) хлорида цезия для мышей составляет 2,3 г на килограмм, что сопоставимо со LD 50 значениями хлорида калия и хлорида натрия . [120] Нерадиоактивный цезий в основном используется в качестве формиата цезия в нефтяных буровых растворах, поскольку он гораздо менее токсичен, чем альтернативы, хотя и более дорог. [81]
Цезий является одним из наиболее реакционноспособных элементов и очень взрывоопасен в присутствии воды. Газообразный водород, образующийся в результате реакции, нагревается за счет выделяющейся при этом тепловой энергии, вызывая возгорание и сильный взрыв. Это может происходить и с другими щелочными металлами, но цезий настолько силен, что эту взрывную реакцию может вызвать даже холодная вода. [14]
Он очень пирофорен : температура самовоспламенения цезия составляет -116 ° C (-177 ° F), и он взрывоопасно воспламеняется на воздухе с образованием гидроксида цезия и различных оксидов. Гидроксид цезия является очень сильным основанием и быстро разъедает стекло. [19]
Изотопы биосфере 134 и 137 присутствуют в в небольших количествах в результате деятельности человека и различаются в зависимости от местоположения. Радиоцезий не накапливается в организме так быстро, как другие продукты деления (такие как радиойод и радиостронций). Около 10% поглощенного радиоцезия относительно быстро вымывается из организма с потом и мочой. Остальные 90% имеют биологический период полураспада от 50 до 150 дней. [121] Радиоцезий следует за калием и имеет тенденцию накапливаться в тканях растений, включая фрукты и овощи. [122] [123] [124] Растения сильно различаются по поглощению цезия, иногда проявляя к нему большую устойчивость. Также хорошо известно, что грибы из загрязненных лесов накапливают радиоцезий (цезий-137) в спорокарпиях грибов . [125] Накопление цезия-137 в озерах стало серьезной проблемой после чернобыльской катастрофы . [126] [127] Эксперименты на собаках показали, что разовая доза 3,8 милликюри (140 МБк , 4,1 мкг цезия-137) на килограмм летальна в течение трех недель; [128] меньшие количества могут вызвать бесплодие и рак. [129] Международное агентство по атомной энергии и другие источники предупреждают, что радиоактивные материалы, такие как цезий-137, могут использоваться в устройствах радиологического рассеивания или « грязных бомбах ». [130]
См. также
[ редактировать ]- Цезий-137 § Инциденты и аварии
- Авария с Acerinox , авария, связанная с загрязнением цезием-137, в 1998 году.
- Авария в Гоянии , крупный инцидент с радиоактивным загрязнением, связанный с цезием-137, в 1987 году.
- Краматорская радиологическая авария , 137 Инцидент с потерей источника Cs между 1980 и 1989 годами.
Примечания
[ редактировать ]- ^ Цезий — это написание, рекомендованное Международным союзом теоретической и прикладной химии (IUPAC). [10] Американское химическое общество (ACS) использует написание цезий с 1921 года. [11] [12] следуя Новому международному словарю Вебстера . Элемент был назван в честь латинского слова caesius , что означает «голубовато-серый». [13] В средневековых и ранних современных сочинениях цезий писался с лигатурой æ как цезиус ; следовательно, альтернативной, но теперь старомодной орфографией является цезий . Дополнительные объяснения правописания можно найти на сайте ae/oe vs e .
- ^ Наряду с рубидием (39 ° C [102 ° F]), францием (оценка 27 ° C [81 ° F]), ртутью (-39 ° C [-38 ° F]) и галлием (30 ° C [ 86 °F]); бром также является жидким при комнатной температуре (плавится при -7,2 ° C [19,0 ° F]), но это галоген , а не металл. Предварительные работы с коперницием и флеровием позволяют предположить, что при комнатной температуре они являются газообразными металлами.
- ^ Радиоактивный элемент франций также может иметь более низкую температуру плавления, но его радиоактивность не позволяет выделить достаточное его количество для прямого тестирования. [17] Коперниций и флеровий также могут иметь более низкие температуры плавления.
- ^ Оно отличается от этого значения у цезидов, содержащих Cs. − анион и, таким образом, имеют цезий в степени окисления -1. [28] Кроме того, расчеты Мао-шэн Мяо в 2013 году показывают, что в условиях экстремального давления (более 30 ГПа ) внутренние 5p-электроны могут образовывать химические связи, в которых цезий будет вести себя как седьмой 5p-элемент. Это открытие указывает на то, что в таких условиях могут существовать высшие фториды цезия со степенью окисления цезия от +2 до +6. [29]
- ^ Электроположительность франция не измерялась экспериментально из-за его высокой радиоактивности. Измерения первой энергии ионизации франция предполагают, что его релятивистские эффекты могут снизить его реакционную способность и повысить его электроотрицательность выше, чем ожидалось из периодических тенденций . [31]
- ↑ Бунзен цитирует Авла Геллия Ноктеса Аттика II, 26 Нигидия Фигула : Но нашим древним говорят, что цезия, которая для греков, как говорит Нигид, по цвету неба подобна небу.
Ссылки
[ редактировать ]- ^ «Стандартные атомные массы: цезий» . ЦИАВ . 2013.
- ^ Прохаска, Томас; Ирргехер, Йоханна; Бенефилд, Жаклин; Бёлке, Джон К.; Чессон, Лесли А.; Коплен, Тайлер Б.; Дин, Типинг; Данн, Филип Дж. Х.; Грёнинг, Манфред; Холден, Норман Э.; Мейер, Харро Эй Джей (4 мая 2022 г.). «Стандартные атомные веса элементов 2021 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . дои : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ^ Jump up to: а б с Арбластер, Джон В. (2018). Некоторые значения кристаллографических свойств элементов . Парк материалов, Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ Хейнс, Уильям М., изд. (2011). Справочник CRC по химии и физике (92-е изд.). Бока-Ратон, Флорида: CRC Press . п. 4.121. ISBN 1-4398-5511-0 .
- ^ Дай, Дж.Л. (1979). «Соединения анионов щелочных металлов». Angewandte Chemie, международное издание . 18 (8): 587–598. дои : 10.1002/anie.197905871 .
- ^ «Магнитная восприимчивость элементов и неорганических соединений». Справочник по химии и физике (PDF) (87-е изд.). ЦРК Пресс. ISBN 0-8493-0487-3 . Проверено 26 сентября 2010 г.
- ^ Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С.; Ауди, Г. (2021). «Оценка ядерных свойств NUBASE2020» (PDF) . Китайская физика C . 45 (3): 030001. doi : 10.1088/1674-1137/abddae .
- ^ «Измерения периода полураспада радионуклидов НИСТ» . НИСТ . Проверено 13 марта 2011 г.
- ^ «Периодическая таблица элементов ИЮПАК» . Международный союз теоретической и прикладной химии. Архивировано из оригинала 10 апреля 2016 года . Проверено 2 февраля 2018 г.
- ^ Международный союз теоретической и прикладной химии (2005). Номенклатура неорганической химии (Рекомендации ИЮПАК 2005 г.). Кембридж (Великобритания): RSC – IUPAC . ISBN 0-85404-438-8 . стр. 248–49. Электронная версия. .
- ^ Когхилл, Энн М.; Гарсон, Лоррин Р., ред. (2006). Руководство по стилю ACS: эффективная передача научной информации (3-е изд.). Вашингтон, округ Колумбия: Американское химическое общество. п. 127 . ISBN 978-0-8412-3999-9 .
- ^ Коплен, ТБ; Пейзер, HS (1998). «История рекомендуемых значений атомного веса с 1882 по 1997 год: сравнение различий от текущих значений с предполагаемыми неопределенностями более ранних значений» (PDF) . Чистое приложение. Хим . 70 (1): 237–257. дои : 10.1351/pac199870010237 . S2CID 96729044 . Архивировано (PDF) из оригинала 21 мая 2011 года.
- ↑ Запись в OED для «цезия». Архивировано 5 марта 2024 года в Wayback Machine . Второе издание, 1989 г.; онлайн-версия, июнь 2012 г. Проверено 7 сентября 2012 г. Более ранняя версия впервые опубликована в New English Dictionary , 1888 г.
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа Баттерман, Уильям К.; Брукс, Уильям Э.; Риз, Роберт Дж. младший (2004). «Профиль минерального сырья: цезий» (PDF) . Геологическая служба США. Архивировано из оригинала (PDF) 7 февраля 2007 года . Проверено 27 декабря 2009 г.
- ^ Хейзерман, Дэвид Л. (1992). Изучение химических элементов и их соединений . МакГроу-Хилл. стр. 201–203 . ISBN 978-0-8306-3015-8 .
- ^ Аддисон, CC (1984). Химия жидких щелочных металлов . Уайли. ISBN 978-0-471-90508-0 . Архивировано из оригинала 8 сентября 2021 года . Проверено 28 сентября 2012 г.
- ^ «Франциум» . Periodic.lanl.gov. Архивировано из оригинала 28 ноября 2016 года . Проверено 23 февраля 2010 г.
- ^ Jump up to: а б с д и Канер, Ричард (2003). «C&EN: Это элементарно: Таблица Менделеева - Цезий» . Американское химическое общество. Архивировано из оригинала 18 июня 2015 года . Проверено 25 февраля 2010 г.
- ^ Jump up to: а б «Химические данные – Цезий – Cs» . Королевское химическое общество. Архивировано из оригинала 23 ноября 2021 года . Проверено 27 сентября 2010 г.
- ^ Jump up to: а б Линч, Чарльз Т. (1974). Справочник CRC по материаловедению . ЦРК Пресс. п. 13. ISBN 978-0-8493-2321-8 . Архивировано из оригинала 5 марта 2024 года . Проверено 8 мая 2021 г.
- ^ Jump up to: а б Кларк, Джим (2005). «Испытания пламенем» . химгид . Архивировано из оригинала 4 декабря 2017 года . Проверено 29 января 2012 г.
- ^ Таова, ТМ; и др. (22 июня 2003 г.). Плотность расплавов щелочных металлов и их тройных систем Na-K-Cs и Na-K-Rb (PDF) . Пятнадцатый симпозиум по теплофизическим свойствам, Боулдер, Колорадо, США. Архивировано из оригинала (PDF) 9 октября 2006 года . Проверено 26 сентября 2010 г.
- ^ Дейсерот, HJ (1997). «Амальгамы щелочных металлов, группа необычных сплавов». Прогресс в химии твердого тела . 25 (1–2): 73–123. дои : 10.1016/S0079-6786(97)81004-7 .
- ^ Аддисон, CC (1984). Химия жидких щелочных металлов . Уайли. п. 7. ISBN 9780471905080 .
- ^ Калифорния, Онате (18 марта 2021 г.). «Ровно-колебательные энергии димера цезия и димера лития с молекулярным потенциалом притяжения» . Научные отчеты . 11 (1): 6198. doi : 10.1038/s41598-021-85761-x . ПМЦ 7973739 . ПМИД 33737625 .
- ^ Грей, Теодор (2012) Элементы , Black Dog & Leventhal Publishers, стр. 131, ISBN 1-57912-895-5 .
- ^ Jump up to: а б с д и Гринвуд, штат Нью-Йорк; Эрншоу, А. (1984). Химия элементов . Оксфорд, Великобритания: Pergamon Press. ISBN 978-0-08-022057-4 .
- ^ Jump up to: а б Дай, Дж.Л. (1979). «Соединения анионов щелочных металлов». Angewandte Chemie, международное издание . 18 (8): 587–598. дои : 10.1002/anie.197905871 .
- ^ Московиц, Клара. «Основное правило химии можно нарушить, как показывают расчеты» . Научный американец . Архивировано из оригинала 22 ноября 2013 года . Проверено 22 ноября 2013 г.
- ^ Jump up to: а б с Холлеман, Арнольд Ф.; Виберг, Эгон; Виберг, Нильс (1985). «Сравнительный обзор группы щелочных металлов». Учебник неорганической химии (на немецком языке) (91–100 изд.). Вальтер де Грюйтер. стр. 953–955. ISBN 978-3-11-007511-3 .
- ^ Андреев С.В.; Летохов В.С.; Мишин, В.И. (1987). «Лазерная резонансная фотоионизационная спектроскопия ридберговских уровней во Fr». Письма о физических отзывах . 59 (12): 1274–76. Бибкод : 1987PhRvL..59.1274A . дои : 10.1103/PhysRevLett.59.1274 . ПМИД 10035190 .
- ^ Мяо, Мао-шэн (2013). «Цезий в высоких степенях окисления и как элемент p-блока» . Природная химия . 5 (10): 846–852. arXiv : 1212.6290 . Бибкод : 2013НатЧ...5..846М . дои : 10.1038/nchem.1754 . ISSN 1755-4349 . ПМИД 24056341 . S2CID 38839337 . Архивировано из оригинала 9 июля 2023 года . Проверено 29 июля 2022 г.
- ^ Снид, Д.; Правица, М.; Ким, Э.; Чен, Н.; Парк, К.; Уайт, М. (1 октября 2017 г.). «Принуждение цезия к состояниям более высокого окисления с использованием полезной химии, индуцированной жестким рентгеновским излучением, под высоким давлением» . Физический журнал: серия конференций . 950 (11, 2017): 042055. Бибкод : 2017JPhCS.950d2055S . дои : 10.1088/1742-6596/950/4/042055 . ISSN 1742-6588 . ОСТИ 1409108 . S2CID 102912809 .
- ^ Хоган, CM (2011). «Фосфат» . Архивировано из оригинала 25 октября 2012 года . Проверено 17 июня 2012 г. в Энциклопедии Земли . Йоргенсен А. и Кливленд С.Дж. (ред.). Национальный совет по науке и окружающей среде. Вашингтон, округ Колумбия
- ^ Кёлер, Майкл Дж. (1999). Травление в микросистемной технике . Вайли-ВЧ. п. 90. ИСБН 978-3-527-29561-6 . [ постоянная мертвая ссылка ]
- ^ Янсен, Мартин (30 ноября 2005 г.). «Влияние релятивистского движения электронов на химию золота и платины» . Науки о твердом теле . 7 (12): 1464–1474. Бибкод : 2005SSSci...7.1464J . doi : 10.1016/j.solidstatesciences.2005.06.015 .
- ^ Мойер, Брюс А.; Бердвелл, Джозеф Ф.; Боннесен, Питер В.; Дельмау, Летиция Х. (2005). Использование макроциклов при очистке ядерных отходов: реальное применение каликскрауна в технологии разделения цезия . стр. 383–405. дои : 10.1007/1-4020-3687-6_24 . ISBN 978-1-4020-3364-3 .
{{cite book}}:|journal=игнорируется ( помощь ) . - ^ Сенга, Рёске; Суэнага, Кадзу (2015). «Спектроскопия одноатомных электронных потерь энергии легких элементов» . Природные коммуникации . 6 : 7943. Бибкод : 2015NatCo...6.7943S . дои : 10.1038/ncomms8943 . ПМЦ 4532884 . ПМИД 26228378 .
- ^ Эванс, ФРВ; Литт, Миннесота; Вейдлер-Кубанек, AM; Авонда, ФП (1968). «Реакции, катализируемые фторидом калия. 111. Реакция Кнёвенагеля». Журнал органической химии . 33 (5): 1837–1839. дои : 10.1021/jo01269a028 .
- ^ Уэллс, А. Ф. (1984). Структурная неорганическая химия (5-е изд.). Оксфордские научные публикации. ISBN 978-0-19-855370-0 .
- ^ Коттон, Ф. Альберт; Уилкинсон, Г. (1962). Продвинутая неорганическая химия . John Wiley & Sons, Inc. с. 318. ИСБН 978-0-471-84997-1 .
- ^ Лиде, Дэвид Р., изд. (2006). Справочник CRC по химии и физике (87-е изд.). Бока-Ратон, Флорида: CRC Press . стр. 451, 514. ISBN. 0-8493-0487-3 .
- ^ Jump up to: а б Цай, Хи-Руэй; Харрис, премьер-министр; Лассеттр, EN (1956). «Кристаллическая структура монооксида цезия» . Журнал физической химии . 60 (3): 338–344. дои : 10.1021/j150537a022 . Архивировано из оригинала 24 сентября 2017 года.
- ^ Вольнов, И.И.; Матвеев, В.В. (1963). «Синтез озонида цезия через супероксид цезия». Вестник Отделения химических наук Академии наук СССР . 12 (6): 1040–1043. дои : 10.1007/BF00845494 .
- ^ Токарева С.А. (1971). «Озониды щелочных и щелочноземельных металлов». Российское химическое обозрение . 40 (2): 165–174. Бибкод : 1971RuCRv..40..165T . дои : 10.1070/RC1971v040n02ABEH001903 . S2CID 250883291 .
- ^ Саймон, А. (1997). «Субоксиды и субнитриды групп 1 и 2 — металлы с отверстиями и туннелями атомного размера». Обзоры координационной химии . 163 : 253–270. дои : 10.1016/S0010-8545(97)00013-1 .
- ^ Цай, Хи-Руэй; Харрис, премьер-министр; Лассеттр, EN (1956). «Кристаллическая структура монооксида трицезия». Журнал физической химии . 60 (3): 345–347. дои : 10.1021/j150537a023 .
- ^ Окамото, Х. (2009). «Cs-O (Цезий-Кислород)». Журнал фазового равновесия и диффузии . 31 : 86–87. дои : 10.1007/s11669-009-9636-5 . S2CID 96084147 .
- ^ Банд, А.; Альбу-Ярон, А.; Ливне, Т.; Коэн, Х.; Фельдман, Ю.; Шимон, Л.; Поповиц-Биро, Р.; Ляховицкая В.; Тенне, Р. (2004). «Характеристика оксидов цезия». Журнал физической химии Б. 108 (33): 12360–12367. дои : 10.1021/jp036432o .
- ^ Брауэр, Г. (1947). «Исследования системы ций-кислород». Журнал неорганической химии . 255 (1–3): 101–124. дои : 10.1002/zaac.19472550110 .
- ^ Буссо, М.; Галлино, Р.; Вассербург, Дж.Дж. (1999). «Нуклеосинтез в асимптотических звездах ветви гигантов: актуальность для обогащения галактики и формирования Солнечной системы» (PDF) . Ежегодный обзор астрономии и астрофизики . 37 : 239–309. Бибкод : 1999ARA&A..37..239B . дои : 10.1146/annurev.astro.37.1.239 . Архивировано (PDF) из оригинала 10 октября 2022 года . Проверено 20 февраля 2010 г.
- ^ Арнетт, Дэвид (1996). Сверхновые и нуклеосинтез: исследование истории материи от Большого взрыва до наших дней . Издательство Принстонского университета. п. 527. ИСБН 978-0-691-01147-9 .
- ^ Гофф, К.; Матчетт, Майкл А.; Шабестары, Нахид; Хазаэли, Садег (1996). «Комплексообразование катионов цезия и рубидия с краун-эфирами в N,N-диметилформамиде». Многогранник . 15 (21): 3897–3903. дои : 10.1016/0277-5387(96)00018-6 .
- ^ Браун, Ф.; Холл, Греция; Уолтер, Эй Джей (1955). «Период полураспада Cs137». Журнал неорганической и ядерной химии . 1 (4–5): 241–247. Бибкод : 1955PhRv...99..188W . дои : 10.1016/0022-1902(55)80027-9 .
- ^ Сонцогни, Алехандро. «Интерактивная карта нуклидов» . Национальный центр ядерных данных: Брукхейвенская национальная лаборатория. Архивировано из оригинала 22 мая 2008 года . Проверено 6 июня 2008 г.
- ^ Оки, Шигео; Такаки, Наоюки (14–16 октября 2002 г.). Трансмутация цезия-135 с помощью быстрых реакторов (PDF) . Седьмое совещание по обмену информацией по разделению и трансмутации актинидов и продуктов деления. Чеджу, Корея. Архивировано из оригинала (PDF) 28 сентября 2011 года . Проверено 26 сентября 2010 г.
- ^ «20 Ксенон: яд продуктов деления» (PDF) . Основы CANDU (Отчет). CANDU Owners Group Inc. Архивировано из оригинала (PDF) 23 июля 2011 года . Проверено 15 сентября 2010 г.
- ^ Тейлор, В.Ф.; Эванс, РД; Корнетт, Р.Дж. (2008). «Предварительная оценка 135 Cs/ 137 Cs как судебно-медицинский инструмент для выявления источника радиоактивного загрязнения». Журнал «Радиоактивность окружающей среды » . 99 (1): 109–118. doi : 10.1016/j.jenvrad.2007.07.006 . PMID 17869392 .
- ^ «Цезий | Радиационная защита» . Агентство по охране окружающей среды США. 28 июня 2006 г. Архивировано из оригинала 15 марта 2011 г. Проверено 15 февраля 2010 г.
- ^ Зерриффи, Хишам (24 мая 2000 г.). Отчет IEER: Трансмутация – игра в ядерную алхимию (Отчет). Институт энергетических и экологических исследований. Архивировано из оригинала 30 мая 2011 года . Проверено 15 февраля 2010 г.
- ^ Наследие Чернобыля: последствия для здоровья, окружающей среды и социально-экономической ситуации и рекомендации правительствам Беларуси, Российской Федерации и Украины (PDF) (Отчет). Международное агентство по атомной энергии. Архивировано из оригинала (PDF) 15 февраля 2010 года . Проверено 18 февраля 2010 г.
- ^ Касе, Такеши; Конаши, Кенджи; Такахаши, Хироши; Хирао, Ясуо (1993). «Трансмутация цезия-137 с помощью ускорителя протонов» . Журнал ядерной науки и технологий . 30 (9): 911–918. дои : 10.3327/jnst.30.911 .
- ^ Книф, Рональд Аллен (1992). «Осколки деления» . Атомная энергетика: теория и технология коммерческой атомной энергетики . Тейлор и Фрэнсис. п. 42. ИСБН 978-1-56032-088-3 . Архивировано из оригинала 5 марта 2024 года . Проверено 8 мая 2021 г.
- ^ Ишиватари, Н.; Нагай, Х. «Высвобождение ксенона-137 и йода-137 из гранул UO2 в результате импульсного нейтронного облучения в NSRR». Ниппон Генсирёку Гаккаиси . 23 (11): 843–850. ОСТИ 5714707 .
- ^ Турекян, К.К.; Ведеполь, К.Х. (1961). «Распределение элементов в некоторых основных подразделениях земной коры» . Бюллетень Геологического общества Америки . 72 (2): 175–192. Бибкод : 1961GSAB...72..175T . doi : 10.1130/0016-7606(1961)72[175:DOTEIS]2.0.CO;2 . ISSN 0016-7606 .
- ^ Клопрогге, Дж. Тео; Понсе, Консепсьон П.; Лумис, Том (18 ноября 2020 г.). Таблица Менделеева: Строительные блоки природы: введение в встречающиеся в природе элементы, их происхождение и использование . Эльзевир. ISBN 978-0-12-821538-8 . Архивировано из оригинала 16 мая 2024 года . Проверено 16 мая 2024 г.
- ^ Роуленд, Саймон (4 июля 1998 г.). «Цезий как сырье: возникновение и использование» . Международное общество Артемиды. Архивировано из оригинала 8 июля 2021 года . Проверено 15 февраля 2010 г.
- ^ Jump up to: а б Черный, Петр ; Симпсон, FM (1978). «Пегматит Танко на озере Берник, Манитоба: X. Поллуцит» (PDF) . Канадский минералог . 16 : 325–333. Архивировано (PDF) из оригинала 10 октября 2022 года . Проверено 26 сентября 2010 г.
- ^ Jump up to: а б с д Поляк, Дезире Э. «Цезий» (PDF) . Геологическая служба США. Архивировано (PDF) из оригинала 8 мая 2009 г. Проверено 17 октября 2009 г.
- ^ Нортон, Джей-Джей (1973). «Литий, цезий и рубидий — редкие щелочные металлы» . В Бробсте, Д.А.; Пратт, В.П. (ред.). Минеральные ресурсы США . Том. Документ 820. Специалист геологической службы США. стр. 365–378. Архивировано из оригинала 21 июля 2010 года . Проверено 26 сентября 2010 г.
- ^ Jump up to: а б Берт, Р.О. (1993). «Цезий и соединения цезия». Энциклопедия химической технологии Кирка-Отмера . Том. 5 (4-е изд.). Нью-Йорк: John Wiley & Sons, Inc., стр. 749–764. ISBN 978-0-471-48494-3 .
- ^ Бентон, Уильям; Тернер, Джим (2000). «Формиат цезия успешно прошел полевые испытания HPHT в Северном море» (PDF) . Буровой подрядчик (май/июнь): 38–41. Архивировано (PDF) из оригинала 6 июля 2001 г. Проверено 26 сентября 2010 г.
- ^ Jump up to: а б Иглсон, Мэри, изд. (1994). Краткая энциклопедия по химии . Иглсон, Мэри. Берлин: де Грюйтер. п. 198. ИСБН 978-3-11-011451-5 . Архивировано из оригинала 5 марта 2024 года . Проверено 8 мая 2021 г.
- ^ Оксфордский словарь английского языка , 2-е издание
- ^ Jump up to: а б с д Кирхгоф, Г .; Бунзен, Р. (1861). «Химический анализ методом спектральных наблюдений» (PDF) . Анналы физики и химии . 189 (7): 337–381. Бибкод : 1861АнП...189..337К . дои : 10.1002/andp.18611890702 . hdl : 2027/hvd.32044080591324 . Архивировано (PDF) из оригинала 2 марта 2016 г.
- ^ Jump up to: а б Уикс, Мария Эльвира (1932). «Открытие элементов. XIII. Некоторые спектроскопические открытия». Журнал химического образования . 9 (8): 1413–1434. Бибкод : 1932JChEd...9.1413W . дои : 10.1021/ed009p1413 .
- ^ Жигмонди, Ричард (2007). Коллоиды и ультрамикроскоп . Читайте книги. п. 69. ИСБН 978-1-4067-5938-9 . Архивировано из оригинала 5 марта 2024 года . Проверено 11 октября 2015 г.
- ^ Сеттерберг, Карл (1882). «О получении соединений рубидия и цезия и об извлечении самих металлов» . «Анналы химии» Юстуса Либиха . 211 : 100–116. дои : 10.1002/jlac.18822110105 . Архивировано из оригинала 27 апреля 2021 года . Проверено 25 августа 2019 г.
- ^ Строд, Эй Джей (1957). «Цезий — новый промышленный металл». Американский керамический бюллетень . 36 (6): 212–213.
- ^ Jump up to: а б «Атомы цезия за работой» . Департамент службы времени — Военно-морская обсерватория США — Департамент военно-морского флота. Архивировано из оригинала 23 февраля 2015 года . Проверено 20 декабря 2009 г.
- ^ Jump up to: а б с Даунс, Джей Ди; Блащинский, М.; Тернер, Дж.; Харрис, М. (февраль 2006 г.). Бурение и заканчивание сложных скважин высокого/высокого давления с помощью рассолов формиата цезия – обзор эффективности . Конференция IADC/SPE по бурению. Майами, Флорида, США. Общество инженеров-нефтяников. дои : 10.2118/99068-MS . Архивировано из оригинала 12 октября 2007 года.
- ^ Флатерн, Рик (2001). «Сохранение хладнокровия в среде HPHT». Морской инженер (февраль): 33–37.
- ^ Эссен, Л.; Парри, JVL (1955). «Атомный стандарт частоты и временного интервала: цезиевый резонатор». Природа . 176 (4476): 280–282. Бибкод : 1955Natur.176..280E . дои : 10.1038/176280a0 . S2CID 4191481 .
- ^ Марковиц, В.; Холл, Р.; Эссен, Л.; Парри, Дж. (1958). «Частота цезия в эфемеридном времени». Письма о физических отзывах . 1 (3): 105–107. Бибкод : 1958PhRvL...1..105M . дои : 10.1103/PhysRevLett.1.105 .
- ^ Рил, Монте (22 июля 2003 г.). «Где время действительно решает все» . Вашингтон Пост . п. Б1. Архивировано из оригинала 29 апреля 2013 года . Проверено 26 января 2010 г.
- ^ «Резолюция 1 26-й ГКМВ» (на французском и английском языках). Париж: Международное бюро мер и веса. 2018. стр. 472 официального французского издания. Архивировано из оригинала 4 февраля 2021 года . Проверено 29 декабря 2019 г.
- ^ Расор, Нед С.; Уорнер, Чарльз (сентябрь 1964 г.). «Корреляция эмиссионных процессов пленок адсорбированных щелочей на металлических поверхностях». Журнал прикладной физики . 35 (9): 2589–2600. Бибкод : 1964JAP....35.2589R . дои : 10.1063/1.1713806 .
- ^ «Поставщик цезия и техническая информация» . Американские элементы. Архивировано из оригинала 7 октября 2023 года . Проверено 25 января 2010 г.
- ^ Смедли, Джон; Рао, Тривени; Ван, Эрдонг (2009). «Разработка катода K 2 CsSb». Материалы конференции AIP . 1149 (1): 1062–1066. Бибкод : 2009AIPC.1149.1062S . дои : 10.1063/1.3215593 .
- ^ Гёрлих, П. (1936). «О композитных прозрачных фотокатодах». Журнал физики . 101 (5–6): 335–342. Бибкод : 1936ZPhy..101..335G . дои : 10.1007/BF01342330 . S2CID 121613539 .
- ^ Грегер, С.; Пазгалев А.С.; Вайс, А. (2005). «Сравнение цезиевых магнитометров с газоразрядной лампой и лазерной накачкой». Прикладная физика Б. 80 (6): 645–654. arXiv : физика/0412011 . Бибкод : 2005ApPhB..80..645G . дои : 10.1007/s00340-005-1773-x . S2CID 36065775 .
- ^ Хейвен, Мэри К.; Тетро, Грегори А.; Шенкен, Джеральд Р. (1994). «Внутренние стандарты» . Лабораторное оборудование . Нью-Йорк: Джон Уайли и сыновья. п. 108. ИСБН 978-0-471-28572-4 . Архивировано из оригинала 5 марта 2024 года . Проверено 8 мая 2021 г.
- ^ МакГи, Джеймс Д. (1969). Фотоэлектронные устройства изображения: материалы четвертого симпозиума, состоявшегося в Имперском колледже в Лондоне, 16–20 сентября 1968 г. Том. 1. Академическая пресса. п. 391. ИСБН 978-0-12-014528-7 . Архивировано из оригинала 5 марта 2024 года . Проверено 8 мая 2021 г.
- ^ Манфред Бик, Хорст Принц, «Цезий и соединения цезия» в Энциклопедии промышленной химии Ульмана, 2005, Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a06_153 .
- ^ Десаи, Мохамед А., изд. (2000). «Градиентные материалы» . Последующие методы обработки . Тотова, Нью-Джерси: Humana Press. стр. 61–62. ISBN 978-0-89603-564-5 . Архивировано из оригинала 5 марта 2024 года . Проверено 8 мая 2021 г.
- ^ Берт, Р.О. (1993). «Цезий и соединения цезия». Энциклопедия химической технологии Кирка-Отмера . Том. 5 (4-е изд.). Нью-Йорк: Джон Уайли и сыновья. п. 759. ИСБН 978-0-471-15158-6 .
- ^ Фристад, Грегори К.; Браншо, Брюс П.; Наваррини, Уолтер и Сансотера, Маурицио (2007) «Фторид цезия» в Энциклопедии реагентов для органического синтеза , John Wiley & Sons. дои : 10.1002/047084289X.rc050.pub2
- ^ Окумура, Такеши (21 октября 2003 г.). «Материальный поток радиоактивного цезия-137 в США в 2000 году» (PDF) . Агентство по охране окружающей среды США. Архивировано из оригинала (PDF) 20 июля 2011 года . Проверено 20 декабря 2009 г.
- ^ Дженсен, Нидерланды (1985). «Цезий». Минеральные факты и проблемы . Том. Бюллетень 675. Горное бюро США. стр. 133–138.
- ^ «Медицинский изотоп цезия-131 компании IsoRay, используемый в важной процедуре лечения рака глаз в Медицинском центре Тафтс-Новая Англия» . Медицинские новости сегодня . 17 декабря 2007 г. Архивировано из оригинала 29 апреля 2021 г. Проверено 15 февраля 2010 г.
- ^ Бентель, Гунилла Карлесон (1996). «Машины с цезием-137» . Планирование лучевой терапии . МакГроу-Хилл Профессионал. стр. 22–23. ISBN 978-0-07-005115-7 . Архивировано из оригинала 5 марта 2024 года . Проверено 26 сентября 2010 г.
- ^ Национальный исследовательский совет (США). Комитет по использованию и замене источников радиации (2008 г.). Использование и замена источников излучения: сокращенная версия . Пресса национальных академий. ISBN 978-0-309-11014-3 . Архивировано из оригинала 5 марта 2024 года . Проверено 11 октября 2015 г.
- ^ Локстон, Р.; Поуп, П., ред. (1995). «Измерение уровня и плотности бесконтактными ядерными датчиками» . Инструментарий: Читатель . Лондон: Чепмен и Холл. стр. 82–85. ISBN 978-0-412-53400-3 . Архивировано из оригинала 5 марта 2024 года . Проверено 8 мая 2021 г.
- ^ Тимур А.; Токсоз, Миннесота (1985). «Скважинный геофизический каротаж». Ежегодный обзор наук о Земле и планетах . 13 : 315–344. Бибкод : 1985AREPS..13..315T . doi : 10.1146/annurev.ea.13.050185.001531 .
- ^ Кендалл, Кэрол . «Проект изотопных трассеров - Ресурсы по изотопам - цезию» . Национальная исследовательская программа – Геологическая служба США. Архивировано из оригинала 8 июля 2021 года . Проверено 25 января 2010 г.
- ^ Маркуччи, МГ; Полк, Дж. Э. (2000). «Ксеноново-ионный двигатель NSTAR в глубоком космосе 1: наземные и летные испытания (приглашены)». Обзор научных инструментов . 71 (3): 1389–1400. Бибкод : 2000RScI...71.1389M . дои : 10.1063/1.1150468 .
- ^ Сови, Джеймс С.; Роулин, Винсент К.; Паттерсон, Майкл Дж. «Краткий обзор проектов развития ионного движения в Соединенных Штатах: от SERT I до Deep Space I» (PDF) . НАСА. Архивировано из оригинала (PDF) 29 июня 2009 года . Проверено 12 декабря 2009 г.
- ^ Маррезе, К.; Полк, Дж.; Мюллер, Дж.; Оуэнс, А.; Таймар, М.; Финк Р. и Спиндт К. (октябрь 2001 г.). Ионно-лучевая нейтрализация двигателя In-FEEP с помощью термоэмиссионных и автоэмиссионных катодов . 27-я Международная конференция по электродвижению. Пасадена, Калифорния. стр. 1–15. Архивировано из оригинала (PDF) 27 мая 2010 года . Проверено 25 января 2010 г.
- ^ «Инфракрасные осветительные композиции и изделия, содержащие их» . Патент США 6230628 . Freepatentsonline.com. Архивировано из оригинала 8 июля 2021 года . Проверено 25 января 2010 г.
- ^ «Вспышка ЛУУ-19» . Федерация американских ученых. 23 апреля 2000 г. Архивировано из оригинала 6 августа 2010 г. Проверено 12 декабря 2009 г.
- ^ Чарриер, Э.; Чарсли, Эл.; Лэй, П.Г.; Маркхэм, HM; Бергер, Б.; Гриффитс, Т.Т. (2006). «Определение температуры и энтальпии фазового перехода твердое тело-твердое тело нитрата цезия методом дифференциальной сканирующей калориметрии». Термохимика Акта . 445 (1): 36–39. Бибкод : 2006TcAc..445...36C . дои : 10.1016/j.tca.2006.04.002 .
- ^ Крикмор, Пол Ф. (2000). Lockheed SR-71: раскрыты секретные миссии . Скопа. п. 47. ИСБН 978-1-84176-098-8 .
- ^ Национальный исследовательский совет (США) (2001). Энергетические исследования в Министерстве энергетики. Стоило ли оно того? . Национальная Академия Пресс. стр. 190–194. дои : 10.17226/10165 . ISBN 978-0-309-07448-3 . Архивировано из оригинала 23 марта 2016 года . Проверено 26 сентября 2010 г.
- ^ Информационные службы Роскилла (1984). Экономика цезия и рубидия (Отчеты о металлах и минералах) . Лондон, Великобритания: Информационные службы Roskill. п. 51. ИСБН 978-0-86214-250-6 .
- ^ Чин, Ченг; Гримм, Рудольф; Жюльен, Поль; Тиесинга, Эйте (29 апреля 2010 г.). «Резонансы Фешбаха в ультрахолодных газах». Обзоры современной физики . 82 (2): 1225–1286. arXiv : 0812.1496 . Бибкод : 2010РвМП...82.1225С . дои : 10.1103/RevModPhys.82.1225 . S2CID 118340314 .
- ^ «Цезий 239240» . Сигма-Олдрич. 26 сентября 2021 г. Архивировано из оригинала 30 октября 2020 г. Проверено 21 декабря 2021 г.
- ^ Данные из Радиохимического руководства и Уилсона, Б.Дж. (1966) Радиохимического руководства (2-е изд.).
- ^ Мельников П.; Занони, LZ (июнь 2010 г.). «Клинические эффекты приема цезия». Исследование биологических микроэлементов . 135 (1–3): 1–9. дои : 10.1007/s12011-009-8486-7 . ПМИД 19655100 . S2CID 19186683 .
- ^ Пинский, Карл; Бозе, Ранджан; Тейлор, младший; Макки, Джаспер; Лапуант, Клод; Бирчалл, Джеймс (1981). «Цезий у млекопитающих: острая токсичность, изменения органов и накопление в тканях». Журнал экологических наук и здоровья, часть A. 16 (5): 549–567. Бибкод : 1981JESHA..16..549P . дои : 10.1080/10934528109375003 .
- ^ Джонсон, Гарланд Т.; Льюис, Трент Р.; Вагнер, Д. Вагнер (1975). «Острая токсичность соединений цезия и рубидия». Токсикология и прикладная фармакология . 32 (2): 239–245. Бибкод : 1975ToxAP..32..239J . дои : 10.1016/0041-008X(75)90216-1 . ПМИД 1154391 .
- ^ Рундо, Дж. (1964). «Обзор метаболизма цезия у человека». Британский журнал радиологии . 37 (434): 108–114. дои : 10.1259/0007-1285-37-434-108 . ПМИД 14120787 .
- ^ Нишита, Х.; Диксон, Д.; Ларсон, К.Х. (1962). «Накопление Cs и K и рост растений фасоли в питательном растворе и почве». Растение и почва . 17 (2): 221–242. Бибкод : 1962PlSoi..17..221N . дои : 10.1007/BF01376226 . S2CID 10293954 .
- ^ Эйвери, С. (1996). «Судьба цезия в окружающей среде: Распределение между абиотическими и биотическими компонентами водных и наземных экосистем». Журнал радиоактивности окружающей среды . 30 (2): 139–171. Бибкод : 1996JEnvR..30..139A . дои : 10.1016/0265-931X(96)89276-9 .
- ^ Сальбу, Британия; Остби, Георг; Гармо, Торстейн Х.; Хоув, Кнут (1992). «Наличие изотопов цезия в растительности оценено на основе экспериментов по инкубации и экстракции». Аналитик . 117 (3): 487–491. Бибкод : 1992Ана...117..487С . дои : 10.1039/AN9921700487 . ПМИД 1580386 .
- ^ Виничук, М. (2010). «Накопление калия, рубидия и цезия ( 133 Cs и 137 Cs) в различных фракциях почвы и грибах шведского леса» . Science of the Total Environment . 408 (12): 2543–2548. Bibcode : 2010ScTEn.408.2543V . doi : 10.1016/j.scitotenv.2010.02.024 . PMID 20334900. . Архивировано 4 апреля 2023 года Проверено 30 октября 2017 года .
- ^ Смит, Джим Т.; Бересфорд, Николас А. (2005). Чернобыль: катастрофа и последствия . Берлин: Шпрингер. ISBN 978-3-540-23866-9 .
- ^ Еремеев В.Н.; Чудиновских, ТВ; Батраков Г.Ф.; Иванова, ТМ (1991). «Радиоактивные изотопы цезия в водах и приводном слое атмосферы Черного моря». Физическая океанография . 2 (1): 57–64. дои : 10.1007/BF02197418 . S2CID 127482742 .
- ^ Редман, ХК; Макклеллан, Род-Айленд; Джонс, РК; Бекер, Б.Б.; Чиффель, ТЛ; Пикрелл, Дж.А.; Рыпка, EW (1972). «Токсичность 137-CsCl у бигля. Ранние биологические эффекты». Радиационные исследования . 50 (3): 629–648. Бибкод : 1972РадР...50..629Р . дои : 10.2307/3573559 . JSTOR 3573559 . ПМИД 5030090 .
- ^ «Китайцы «нашли» радиоактивный шар» . Новости Би-би-си. 27 марта 2009 г. Архивировано из оригинала 10 октября 2021 г. Проверено 25 января 2010 г.
- ^ Шарбонно, Луи (12 марта 2003 г.). «Директор МАГАТЭ предупреждает о риске появления «грязной бомбы»» . Вашингтон Пост . Рейтер. п. А15. Архивировано из оригинала 5 декабря 2008 года . Проверено 28 апреля 2010 г.
Внешние ссылки
[ редактировать ]- Цезий или цезий в Периодической таблице видео (Ноттингемский университет)
- Посмотрите реакцию цезия (наиболее реакционноспособного металла в таблице Менделеева) с фтором (наиболее реакционноспособным неметаллом), любезно предоставлено Королевским институтом.
- Рогачев Андрей Юрьевич; Мяо, Мао-Шэн; Мерино, Габриэль; Хоффманн, Роальд (2015). «Молекулярный CsF5 и CsF2+». Ангеванде Хеми . 127 (28): 8393–8396. Бибкод : 2015АнгЧ.127.8393Р . дои : 10.1002/ange.201500402 .


