Белок синдрома Вискотта-Олдрича
| БЫЛ | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | WAS , SCNX, THC, THC1, WASPA, WASP, IMD2, синдром Вискотта-Олдрича, фактор, способствующий нуклеации актина WASP | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 300392 ; МГИ : 105059 ; Гомологен : 30970 ; GeneCards : БЫЛО ; ОМА : WAS – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
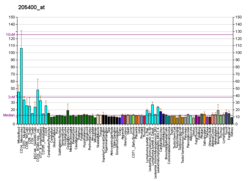
Белок синдрома Вискотта-Олдрича ( WASP ) представляет собой белок из 502 аминокислот , экспрессирующийся в клетках кроветворной системы, который у человека кодируется WAS геном . В неактивном состоянии WASp существует в аутоингибированной конформации, при этом последовательности вблизи его С-конца связываются с областью вблизи его N-конца . Его активация зависит от CDC42 и PIP2, которые нарушают это взаимодействие, вызывая «открытие» белка WASp. Это открывает домен рядом с С-концом WASP, который связывается с комплексом Arp2/3 и активирует его . Активированный Arp2/3 образует новый F- актин .
WASp является членом-основателем семейства генов, которое также включает широко экспрессируемый N-WASP (нейрональный белок синдрома Вискотта-Олдрича), SCAR / WAVE1 , WASH , WHAMM и JMY . [ 5 ] [ 6 ] Совсем недавно были обнаружены WAML (WASP и MIM-подобные), WAWH (WASP без домена WH1) и WHIMP (WAVE-гомология в мембранных выступах). [ 7 ] [ 8 ]
Структура и функции
[ редактировать ]Семейство белков синдрома Вискотта-Олдрича (WAS) имеет схожую доменную структуру и участвует в передаче сигналов от рецепторов на поверхности клетки к актиновому цитоскелету. Наличие ряда различных мотивов предполагает, что они регулируются рядом различных стимулов и взаимодействуют с множеством белков. Эти белки прямо или косвенно связываются с небольшой ГТФазой CDC42, которая, как известно, регулирует образование актиновых филаментов, и цитоскелетным организующим комплексом Arp2/3 .
Белки семейства WASp включают WASp, N-WASp, SCAR/WAVE, WHAMM и WASH. Пять из них имеют общий C-концевой домен VCA (верпролин, центральный, кислый), где они взаимодействуют с нуклеирующим комплексом актина (ARP2/3), и различаются своими терминальными доменами. WASp и N-WASP являются аналогами, они содержат N-концевой домен EVH1, C-концевой домен VCA и центральные домены B и GBD (GTP-связывающий домен). WASp экспрессируется исключительно в гемопоэтических клетках, а WASp в нейронах (N-WASp) экспрессируется повсеместно. N-WASp содержит область вывода и область управления, которые необходимы для его регулирования. Выходная область называется доменом VVCA. Он расположен ближе к С-концу белка и содержит четыре мотива: два мотива гомологии верпролина (VV) связывают мономеры актина и доставляют их к Arp2/3; Когда-то считалось, что центральный домен (C) связывает кофилин, но теперь считается, что он усиливает взаимодействия между доменами V и мономерами актина, а также взаимодействие между доменом A и Arp2/3; а кислотный мотив (А) связывает Arp2/3. [ 9 ] Изолировано, регион VCA конститутивно активен. Однако в полноразмерном N-WASP контрольная область подавляет активность домена VCA. Контрольная область расположена на N-конце N-WASp. [ 10 ] Контрольная область содержит домен связывания CDC42 (GBP) и домен связывания PIP2 (B), оба из которых имеют решающее значение для правильной регуляции N-WASp. [ 10 ] Совместное связывание CDC42 и PIP2 снимает аутоингибирование N-WASp, заставляя Arp2/3 осуществлять полимеризацию актина. [ 10 ] Взаимодействующий белок WASp (WIP) взаимодействует с N-концевым доменом WASp (WH1), предотвращая его деградацию и стабилизируя его аутоингибирующую конформацию.
В отсутствие CDC42 и PIP2 N-WASp находится в неактивной, заблокированной конформации. [ 10 ] Совместное связывание CDC42 и PIP2 снимает аутоингибирование. Совместное связывание CDC42 и PIP2 термодинамически выгодно; связывание одного усиливает связывание другого. [ 10 ] CDC42 и PIP2 локализуют комплекс N-WASp-Arp2/3 на плазматической мембране. Такая локализация гарантирует, что полимеры актина смогут проникать через плазматическую мембрану и образовывать филоподий, необходимый для подвижности клеток. [ 11 ]
WASP необходим для различных функций миелоидных и лимфоидных иммунных клеток. Многие из них, такие как фагоцитоз и образование подосом, связаны с его ролью в регуляции полимеризации актиновых филаментов. Другие функции WASP зависят от его активности в качестве каркасного белка для сборки эффективных сигнальных комплексов после взаимодействия с антигенным рецептором или интегрином. [ 12 ] В частности, в NK-клетках он участвует в образовании синапсов и поляризации перфорина к иммунному синапсу, вызывая цитотоксичность NK-клеток. Когда WASp отсутствует или мутирует Т-клетки и В-клетки, это также влияет на образование иммунных синапсов и нисходящую передачу сигналов TCR/BCR.
Клиническое значение
[ редактировать ]Синдром Вискотта-Олдрича — редкое наследственное Х-сцепленное рецессивное заболевание, характеризующееся нарушением иммунной регуляции и микротромбоцитопенией и вызванное мутациями в гене WASp . Продукт гена WASp представляет собой цитоплазматический белок, экспрессируемый исключительно в гемопоэтических клетках, которые демонстрируют сигнальные и цитоскелетные аномалии у пациентов с WAS. Описан вариант транскрипта, возникающий в результате использования альтернативного промотора и содержащий другую последовательность 5'-UTR, но его полноразмерная природа неизвестна. [ 13 ]
WASp является продуктом WASp , и мутации в WASp могут привести к синдрому Вискотта-Олдрича (Х-сцепленному заболеванию, которое в основном поражает мужчин с такими симптомами, как тромбоцитопения , экзема , рецидивирующие инфекции и тромбоциты малого размера ) у этих пациентов. белок обычно значительно снижен или отсутствует. Другие, менее инактивирующие мутации, влияющие на WASp, вызывают Х-сцепленную тромбоцитопению , или XLT, при которой уровни белка обычно обнаруживаются с помощью проточной цитометрии. Большинство мутаций, вызывающих классический WAS, расположены в домене WH1 белка. [ 14 ] и эти мутации влияют на связывание с взаимодействующим белком WASp. [ 15 ] Мутации, локализованные в домене GBD, нарушают аутоингибирование и приводят к образованию развернутого белка, который становится конститутивно активным. В отличие от WAS и XLT, WASp в этом случае присутствует и активен. Активированный WASp приводит к ядерной локализации актиновых филаментов, что может привести к преждевременному апоптозу, анеуплоидии и неспособности подвергнуться цитокинезу. Это, в свою очередь, вызывает миелодисплазию и Х-сцепленную нейтропению.
Проспективная генная терапия синдрома Вискотта-Олдрича, OTL-103 , использует аутологичные CD34+ лимфоциты, которые трансфицируются лентивирусным вектором для получения функционального WASp. [ 16 ] По состоянию на 28 июня 2021 г. [update]OTL-103 проходил фазы I/II клинические испытания в больнице Сан-Раффаэле в Милане, Италия . [ 17 ]
Взаимодействия
[ редактировать ]Было показано, что белок синдрома Вискотта-Олдрича взаимодействует с:
- CDC42 , [ 18 ] [ 19 ] [ 20 ] [ 21 ]
- ЦРКЛ , [ 22 ]
- РЭФР , [ 23 ]
- ФГР , [ 24 ] [ 25 ] [ 26 ]
- ФИН , [ 24 ] [ 26 ] [ 27 ]
- Грб2 , [ 23 ] [ 24 ]
- ИТК [ 28 ] [ 29 ]
- ИТСН2 , [ 30 ]
- НКК1 , [ 26 ] [ 31 ] [ 32 ]
- ПИК3Р1 , [ 24 ]
- ПЛКГ1 , [ 24 ] [ 25 ]
- ПСТПИП1 , [ 33 ]
- СРК , [ 24 ] [ 25 ]
- ТРИП10 , [ 18 ] и
- ВИПФ1 . [ 34 ] [ 35 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000015285 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000031165 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Поллитт А.Ю., Инсолл Р.Х. (август 2009 г.). «Белки WASP и SCAR/WAVE: движущие силы сборки актина» . Журнал клеточной науки . 122 (Часть 15): 2575–8. дои : 10.1242/jcs.023879 . ПМЦ 2954249 . ПМИД 19625501 .
- ^ Бурьянек Л.Е., Содерлинг С.Х. (апрель 2013 г.). «Под замком: пространственно-временная регуляция белков семейства WASP координирует отдельные динамические клеточные процессы» . Семинары по клеточной биологии и биологии развития . 24 (4): 258–66. дои : 10.1016/j.semcdb.2012.12.005 . ПМК 3656410 . ПМИД 23291261 .
- ^ Ода А., Это К. (апрель 2013 г.). «WASP и WAVE: от молекулярной функции к физиологии кроветворных клеток». Семинары по клеточной биологии и биологии развития . Белки WASP/WAVE: расширение членов и функций и роль вариаций плоидности в клеточной адаптации. 24 (4): 308–13. дои : 10.1016/j.semcdb.2013.03.002 . ПМИД 23499790 .
- ^ Кабравала С., Циммер, доктор медицинских наук, Кампеллоне К.Г. (14 января 2020 г.). «WHIMP связывает механизм нуклеации актина с передачей сигналов киназ семейства Src во время выпячивания и подвижности» . bioRxiv : 2020.01.14.906784. дои : 10.1101/2020.01.14.906784 .
- ^ Хиггс Х.Н., Поллард Т.Д. (2001). «Регуляция формирования сети актиновых филаментов посредством комплекса ARP2/3: активация разнообразным набором белков». Ежегодный обзор биохимии . 70 (1): 649–76. doi : 10.1146/annurev.biochem.70.1.649 . ПМИД 11395419 .
- ^ Jump up to: а б с д и Прехода К.Е., Скотт Дж.А., Маллинз Р.Д., Лим В.А. (октябрь 2000 г.). «Интеграция нескольких сигналов посредством совместной регуляции комплекса N-WASP-Arp2/3». Наука . 290 (5492): 801–6. Бибкод : 2000Sci...290..801P . дои : 10.1126/science.290.5492.801 . ПМИД 11052943 .
- ^ Рохатги Р., Ма Л., Мики Х., Лопес М., Кирххаузен Т., Такенава Т., Киршнер М.В. (апрель 1999 г.). «Взаимодействие между N-WASP и комплексом Arp2/3 связывает Cdc42-зависимые сигналы со сборкой актина» . Клетка . 97 (2): 221–31. дои : 10.1016/S0092-8674(00)80732-1 . ПМИД 10219243 .
- ^ Трэшер Эй Джей, Бернс СО (март 2010 г.). «WASP: ключевой иммунологический многозадачник». Обзоры природы. Иммунология . 10 (3): 182–92. дои : 10.1038/nri2724 . ПМИД 20182458 . S2CID 20764637 .
- ^ «Ген Энтреза: синдром Вискотта-Олдрича (экзема-тромбоцитопения)» .
- ^ Раджмохан Р., Раода А., Вонг М.Х., Танабалу Т. (декабрь 2009 г.). «Характеристика мутантов синдрома Вискотта-Олдрича (WAS) с использованием Saccharomyces cerevisiae» . Исследование дрожжей FEMS . 9 (8): 1226–35. дои : 10.1111/j.1567-1364.2009.00581.x . ПМИД 19817875 .
- ^ Раджмохан Р., Мэн Л., Ю С., Танабалу Т. (апрель 2006 г.). «WASP подавляет дефект роста штамма Saccharomyces cerevisiae las17Delta в присутствии WIP». Связь с биохимическими и биофизическими исследованиями . 342 (2): 529–36. дои : 10.1016/j.bbrc.2006.01.160 . ПМИД 16488394 .
- ^ Orchard Therapeutics (Europe) Limited (29 июля 2019 г.). «Orchard Therapeutics объявляет о предоставлении FDA статуса передовой терапии регенеративной медицины (RMAT) для OTL-103 для лечения синдрома Вискотта-Олдрича» . Информационный центр GlobeNewswire . Проверено 28 июня 2021 г.
- ^ Номер клинического исследования NCT03837483 для «Открытого клинического исследования генной терапии гемопоэтических стволовых клеток с криоконсервированными аутологичными клетками CD34+, трансдуцированными кДНК, кодирующей лентивирусный вектор, у субъектов с синдромом Вискотта-Олдрича (WAS)» на ClinicalTrials.gov }
- ^ Jump up to: а б Тиан Л., Нельсон Д.Л., Стюарт Д.М. (март 2000 г.). «Взаимодействующий с Cdc42 белок 4 опосредует связывание белка синдрома Вискотта-Олдрича с микротрубочками» . Журнал биологической химии . 275 (11): 7854–61. дои : 10.1074/jbc.275.11.7854 . ПМИД 10713100 .
- ^ Ким А.С., Какалис Л.Т., Абдул-Манан Н., Лю Г.А., Розен М.К. (март 2000 г.). «Механизмы автоингибирования и активации белка синдрома Вискотта-Олдрича». Природа . 404 (6774): 151–8. Бибкод : 2000Natur.404..151K . дои : 10.1038/35004513 . ПМИД 10724160 . S2CID 4416185 .
- ^ Коллури Р., Толиас К.Ф., Карпентер К.Л., Розен Ф.С., Кирххаузен Т. (май 1996 г.). «Прямое взаимодействие белка синдрома Вискотта-Олдрича с ГТФазой Cdc42» . Труды Национальной академии наук Соединенных Штатов Америки . 93 (11): 5615–8. Бибкод : 1996PNAS...93.5615K . дои : 10.1073/pnas.93.11.5615 . ПМК 39296 . ПМИД 8643625 .
- ^ Саймонс М., Дерри Дж.М., Карлак Б., Цзян С., Лемахье В., Маккормик Ф., Франк У., Або А. (март 1996 г.). «Белок синдрома Вискотта-Олдрича, новый эффектор ГТФазы CDC42H, участвует в полимеризации актина» . Клетка . 84 (5): 723–34. дои : 10.1016/S0092-8674(00)81050-8 . ПМИД 8625410 .
- ^ Ода А., Окс Х.Д., Ласки Л.А., Спенсер С., Одзаки К., Фудзихара М., Ханда М., Икебучи К., Икеда Х. (май 2001 г.). «CrkL представляет собой адаптер для белка синдрома Вискотта-Олдрича и Syk» . Кровь . 97 (9): 2633–9. дои : 10.1182/blood.v97.9.2633 . ПМИД 11313252 .
- ^ Jump up to: а б Ше Х.И., Рокоу С., Тан Дж., Нишимура Р., Скольник Э.Ю., Чен М., Марголис Б., Ли В. (сентябрь 1997 г.). «Белок синдрома Вискотта-Олдрича связан с адаптерным белком Grb2 и рецептором эпидермального фактора роста в живых клетках» . Молекулярная биология клетки . 8 (9): 1709–21. дои : 10.1091/mbc.8.9.1709 . ПМК 305731 . ПМИД 9307968 .
- ^ Jump up to: а б с д и ж Банин С., Труонг О., Кац Д.Р., Уотерфилд, доктор медицинских наук, Брикелл П.М., Подагра I (август 1996 г.). «Белок синдрома Вискотта-Олдрича (WASp) является партнером по связыванию протеин-тирозинкиназ семейства c-Src» . Современная биология . 6 (8): 981–8. дои : 10.1016/s0960-9822(02)00642-5 . ПМИД 8805332 .
- ^ Jump up to: а б с Финан П.М., Сомс С.Дж., Уилсон Л., Нельсон Д.Л., Стюарт Д.М., Труонг О., Сюань Дж.Дж., Келли С. (октябрь 1996 г.). «Идентификация областей белка синдрома Вискотта-Олдрича, ответственных за ассоциацию с выбранными доменами гомологии Src 3» . Журнал биологической химии . 271 (42): 26291–5. дои : 10.1074/jbc.271.42.26291 . ПМИД 8824280 .
- ^ Jump up to: а б с Риверо-Лескано О.М., Марсилла А., Самешима Дж.Х., Роббинс К.К. (октябрь 1995 г.). «Белок синдрома Вискотта-Олдрича физически связан с Nck через 3 домена гомологии Src» . Молекулярная и клеточная биология . 15 (10): 5725–31. дои : 10.1128/MCB.15.10.5725 . ПМК 230823 . ПМИД 7565724 .
- ^ Банин С., Подагра И., Брикелл П. (август 1999 г.). «Взаимодействие между белком синдрома Вискотта-Олдрича (WASP) и протеинтирозинкиназой Fyn». Отчеты по молекулярной биологии . 26 (3): 173–7. дои : 10.1023/А:1006954206151 . ПМИД 10532312 . S2CID 36018089 .
- ^ Кори ГО, Маккарти-Моррог Л., Банин С., Подагра И., Брикелл П.М., Левинский Р.Дж., Киннон С., Ловеринг Р.С. (ноябрь 1996 г.). «Доказательства того, что белок синдрома Вискотта-Олдрича может участвовать в сигнальных путях лимфоидных клеток» . Журнал иммунологии . 157 (9): 3791–5. дои : 10.4049/jimmunol.157.9.3791 . ПМИД 8892607 .
- ^ Баннелл С.К., Генри П.А., Коллури Р., Кирххаузен Т., Риклс Р.Дж., Берг Л.Дж. (октябрь 1996 г.). «Идентификация 3-доменных лигандов гомологии Itk/Tsk Src» . Журнал биологической химии . 271 (41): 25646–56. дои : 10.1074/jbc.271.41.25646 . ПМИД 8810341 .
- ^ МакГэвин М.К., Бадур К., Харди Л.А., Кубисески Т.Дж., Чжан Дж., Симинович К.А. (декабрь 2001 г.). «Адаптер интерсектина 2 связывает опосредованную белком синдрома Вискотта-Олдрича (WASp) полимеризацию актина с эндоцитозом рецептора Т-клеточного антигена» . Журнал экспериментальной медицины . 194 (12): 1777–87. дои : 10.1084/jem.194.12.1777 . ПМК 2193569 . ПМИД 11748279 .
- ^ Краузе М., Сечи А.С., Конрадт М., Моннер Д., Гертлер Ф.Б., Веланд Дж. (апрель 2000 г.). «Fyn-связывающий белок (Fyb)/белок, ассоциированный с SLP-76 (SLAP), белки Ena/вазодилататор-стимулируемого фосфопротеина (VASP) и комплекс Arp2/3 связывают Т-клеточный рецептор (TCR), передающий сигнал актиновому цитоскелету» . Журнал клеточной биологии . 149 (1): 181–94. дои : 10.1083/jcb.149.1.181 . ПМК 2175102 . ПМИД 10747096 .
- ^ Окабе С., Фукуда С., Броксмейер Х.Э. (июль 2002 г.). «Активация белка синдрома Вискотта-Олдрича и его ассоциация с другими белками с помощью фактора-1 альфа, полученного из стромальных клеток, связана с миграцией клеток в линии Т-лимфоцитов» . Экспериментальная гематология . 30 (7): 761–6. дои : 10.1016/s0301-472x(02)00823-8 . ПМИД 12135674 .
- ^ Ву Ю, Спенсер С.Д., Ласки Л.А. (март 1998 г.). «Фосфорилирование тирозина регулирует SH3-опосредованное связывание белка синдрома Вискотта-Олдрича с PSTPIP, белком, связанным с цитоскелетом» . Журнал биологической химии . 273 (10): 5765–70. дои : 10.1074/jbc.273.10.5765 . ПМИД 9488710 .
- ^ Рамеш Н., Антон И.М., Хартвиг Дж.Х., Геха Р.С. (декабрь 1997 г.). «WIP, белок, связанный с белком синдрома Вискотта-Олдрича, индуцирует полимеризацию и перераспределение актина в лимфоидных клетках» . Труды Национальной академии наук Соединенных Штатов Америки . 94 (26): 14671–6. Бибкод : 1997PNAS...9414671R . дои : 10.1073/pnas.94.26.14671 . ПМК 25088 . ПМИД 9405671 .
- ^ Антон И.М., Лу В., Майер Б.Дж., Рамеш Н., Геха Р.С. (август 1998 г.). «Белок, взаимодействующий с белками синдрома Вискотта-Олдрича (WIP), связывается с адаптерным белком Nck» . Журнал биологической химии . 273 (33): 20992–5. дои : 10.1074/jbc.273.33.20992 . ПМИД 9694849 .
Дальнейшее чтение
[ редактировать ]- О'Салливан Э., Киннон С., Брикелл П. (1999). «Белок синдрома Вискотта-Олдрича, WASP». Международный журнал биохимии и клеточной биологии . 31 (3–4): 383–7. дои : 10.1016/S1357-2725(98)00118-6 . ПМИД 10224664 .
- Снаппер С.Б., Розен Ф.С. (1999). «Белок синдрома Вискотта-Олдрича (WASP): роль в передаче сигналов и организации цитоскелета». Ежегодный обзор иммунологии . 17 : 905–29. doi : 10.1146/annurev.immunol.17.1.905 . ПМИД 10358777 .
- Трэшер Эй Джей, Киннон С. (апрель 2000 г.). «Синдром Вискотта-Олдрича» . Клиническая и экспериментальная иммунология . 120 (1): 2–9. дои : 10.1046/j.1365-2249.2000.01193.x . ПМК 1905602 . ПМИД 10759756 .
Внешние ссылки
[ редактировать ]- Запись GeneReviews/NIH/NCBI/UW о расстройствах, связанных с WAS , включая синдром Вискотта-Олдрича (WAS), Х-сцепленную тромбоцитопению (XLT) и Х-сцепленную врожденную нейтропению (XLN)
- Онлайн-менделевское наследование у человека (OMIM): 300392
- Онлайн-менделевское наследование у человека (OMIM): 313900
- Вискотта-Олдрича + Синдром + Белок в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Обзор всей структурной информации, доступной в PDB для UniProt : P42768 (белок синдрома Вискотта-Олдрича) в PDBe-KB .