Земля

Почва , также обычно называемая землей или грязью , представляет собой смесь органических веществ , минералов , газов , жидкостей и организмов которые вместе поддерживают жизнь растений . и почвенных организмов , Некоторые научные определения отличают грязь от почвы , ограничивая первый термин конкретно перемещенной почвой.

Почва состоит из твердой фазы минералов и органических веществ (почвенный матрикс), а также пористой фазы, удерживающей газы (атмосфера почвы) и воду (почвенный раствор). [ 1 ] [ 2 ] Соответственно, почва представляет собой трехсоставную систему твердых тел, жидкостей и газов. [ 3 ] Почва является продуктом нескольких факторов: влияния климата , рельефа почвы (высота, ориентация и наклон местности), организмов и исходных материалов (исходных минералов), взаимодействующих с течением времени. [ 4 ] Он постоянно подвергается развитию посредством многочисленных физических, химических и биологических процессов, включая выветривание и связанную с ним эрозию . [ 5 ] Учитывая ее сложность и сильную внутреннюю связь , экологи считают почву экосистемой . [ 6 ]
Most soils have a dry bulk density (density of soil taking into account voids when dry) between 1.1 and 1.6 g/cm3, though the soil particle density is much higher, in the range of 2.6 to 2.7 g/cm3.[7] Little of the soil of planet Earth is older than the Pleistocene and none is older than the Cenozoic,[8] although fossilized soils are preserved from as far back as the Archean.[9]
Collectively the Earth's body of soil is called the pedosphere. The pedosphere interfaces with the lithosphere, the hydrosphere, the atmosphere, and the biosphere.[10] Soil has four important functions:
- as a medium for plant growth
- as a means of water storage, supply, and purification
- as a modifier of Earth's atmosphere
- as a habitat for organisms
All of these functions, in their turn, modify the soil and its properties.
Soil science has two basic branches of study: edaphology and pedology. Edaphology studies the influence of soils on living things.[11] Pedology focuses on the formation, description (morphology), and classification of soils in their natural environment.[12] In engineering terms, soil is included in the broader concept of regolith, which also includes other loose material that lies above the bedrock, as can be found on the Moon and other celestial objects.[13]
Processes
[edit]Soil is a major component of the Earth's ecosystem. The world's ecosystems are impacted in far-reaching ways by the processes carried out in the soil, with effects ranging from ozone depletion and global warming to rainforest destruction and water pollution. With respect to Earth's carbon cycle, soil acts as an important carbon reservoir,[14] and it is potentially one of the most reactive to human disturbance[15] and climate change.[16] As the planet warms, it has been predicted that soils will add carbon dioxide to the atmosphere due to increased biological activity at higher temperatures, a positive feedback (amplification).[17] This prediction has, however, been questioned on consideration of more recent knowledge on soil carbon turnover.[18]
Soil acts as an engineering medium, a habitat for soil organisms, a recycling system for nutrients and organic wastes, a regulator of water quality, a modifier of atmospheric composition, and a medium for plant growth, making it a critically important provider of ecosystem services.[19] Since soil has a tremendous range of available niches and habitats, it contains a prominent part of the Earth's genetic diversity. A gram of soil can contain billions of organisms, belonging to thousands of species, mostly microbial and largely still unexplored.[20][21] Soil has a mean prokaryotic density of roughly 108 organisms per gram,[22] whereas the ocean has no more than 107 prokaryotic organisms per milliliter (gram) of seawater.[23] Organic carbon held in soil is eventually returned to the atmosphere through the process of respiration carried out by heterotrophic organisms, but a substantial part is retained in the soil in the form of soil organic matter; tillage usually increases the rate of soil respiration, leading to the depletion of soil organic matter.[24] Since plant roots need oxygen, aeration is an important characteristic of soil. This ventilation can be accomplished via networks of interconnected soil pores, which also absorb and hold rainwater making it readily available for uptake by plants. Since plants require a nearly continuous supply of water, but most regions receive sporadic rainfall, the water-holding capacity of soils is vital for plant survival.[25]
Soils can effectively remove impurities,[26] kill disease agents,[27] and degrade contaminants, this latter property being called natural attenuation.[28] Typically, soils maintain a net absorption of oxygen and methane and undergo a net release of carbon dioxide and nitrous oxide.[29] Soils offer plants physical support, air, water, temperature moderation, nutrients, and protection from toxins.[30] Soils provide readily available nutrients to plants and animals by converting dead organic matter into various nutrient forms.[31]
Composition
[edit]
Components of a silt loam soil by percent volume
A typical soil is about 50% solids (45% mineral and 5% organic matter), and 50% voids (or pores) of which half is occupied by water and half by gas.[32] The percent soil mineral and organic content can be treated as a constant (in the short term), while the percent soil water and gas content is considered highly variable whereby a rise in one is simultaneously balanced by a reduction in the other.[33] The pore space allows for the infiltration and movement of air and water, both of which are critical for life existing in soil.[34] Compaction, a common problem with soils, reduces this space, preventing air and water from reaching plant roots and soil organisms.[35]
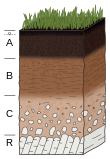
Given sufficient time, an undifferentiated soil will evolve a soil profile that consists of two or more layers, referred to as soil horizons. These differ in one or more properties such as in their texture, structure, density, porosity, consistency, temperature, color, and reactivity.[8] The horizons differ greatly in thickness and generally lack sharp boundaries; their development is dependent on the type of parent material, the processes that modify those parent materials, and the soil-forming factors that influence those processes. The biological influences on soil properties are strongest near the surface, though the geochemical influences on soil properties increase with depth. Mature soil profiles typically include three basic master horizons: A, B, and C. The solum normally includes the A and B horizons. The living component of the soil is largely confined to the solum, and is generally more prominent in the A horizon.[36] It has been suggested that the pedon, a column of soil extending vertically from the surface to the underlying parent material and large enough to show the characteristics of all its horizons, could be subdivided in the humipedon (the living part, where most soil organisms are dwelling, corresponding to the humus form), the copedon (in intermediary position, where most weathering of minerals takes place) and the lithopedon (in contact with the subsoil).[37]
The soil texture is determined by the relative proportions of the individual particles of sand, silt, and clay that make up the soil.

The interaction of the individual mineral particles with organic matter, water, gases via biotic and abiotic processes causes those particles to flocculate (stick together) to form aggregates or peds.[38] Where these aggregates can be identified, a soil can be said to be developed, and can be described further in terms of color, porosity, consistency, reaction (acidity), etc.
Water is a critical agent in soil development due to its involvement in the dissolution, precipitation, erosion, transport, and deposition of the materials of which a soil is composed.[39] The mixture of water and dissolved or suspended materials that occupy the soil pore space is called the soil solution. Since soil water is never pure water, but contains hundreds of dissolved organic and mineral substances, it may be more accurately called the soil solution. Water is central to the dissolution, precipitation and leaching of minerals from the soil profile. Finally, water affects the type of vegetation that grows in a soil, which in turn affects the development of the soil, a complex feedback which is exemplified in the dynamics of banded vegetation patterns in semi-arid regions.[40]
Soils supply plants with nutrients, most of which are held in place by particles of clay and organic matter (colloids)[41] The nutrients may be adsorbed on clay mineral surfaces, bound within clay minerals (absorbed), or bound within organic compounds as part of the living organisms or dead soil organic matter. These bound nutrients interact with soil water to buffer the soil solution composition (attenuate changes in the soil solution) as soils wet up or dry out, as plants take up nutrients, as salts are leached, or as acids or alkalis are added.[42]
Plant nutrient availability is affected by soil pH, which is a measure of the hydrogen ion activity in the soil solution. Soil pH is a function of many soil forming factors, and is generally lower (more acidic) where weathering is more advanced.[43]
Most plant nutrients, with the exception of nitrogen, originate from the minerals that make up the soil parent material. Some nitrogen originates from rain as dilute nitric acid and ammonia,[44] but most of the nitrogen is available in soils as a result of nitrogen fixation by bacteria. Once in the soil-plant system, most nutrients are recycled through living organisms, plant and microbial residues (soil organic matter), mineral-bound forms, and the soil solution. Both living soil organisms (microbes, animals and plant roots) and soil organic matter are of critical importance to this recycling, and thereby to soil formation and soil fertility.[45] Microbial soil enzymes may release nutrients from minerals or organic matter for use by plants and other microorganisms, sequester (incorporate) them into living cells, or cause their loss from the soil by volatilisation (loss to the atmosphere as gases) or leaching.[46]
Formation
[edit]Soil is said to be formed when organic matter has accumulated and colloids are washed downward, leaving deposits of clay, humus, iron oxide, carbonate, and gypsum, producing a distinct layer called the B horizon. This is a somewhat arbitrary definition as mixtures of sand, silt, clay and humus will support biological and agricultural activity before that time.[47] These constituents are moved from one level to another by water and animal activity. As a result, layers (horizons) form in the soil profile. The alteration and movement of materials within a soil causes the formation of distinctive soil horizons. However, more recent definitions of soil embrace soils without any organic matter, such as those regoliths that formed on Mars[48] and analogous conditions in planet Earth deserts.[49]
An example of the development of a soil would begin with the weathering of lava flow bedrock, which would produce the purely mineral-based parent material from which the soil texture forms. Soil development would proceed most rapidly from bare rock of recent flows in a warm climate, under heavy and frequent rainfall. Under such conditions, plants (in a first stage nitrogen-fixing lichens and cyanobacteria then epilithic higher plants) become established very quickly on basaltic lava, even though there is very little organic material.[50] Basaltic minerals commonly weather relatively quickly, according to the Goldich dissolution series.[51] The plants are supported by the porous rock as it is filled with nutrient-bearing water that carries minerals dissolved from the rocks. Crevasses and pockets, local topography of the rocks, would hold fine materials and harbour plant roots. The developing plant roots are associated with mineral-weathering mycorrhizal fungi[52] that assist in breaking up the porous lava, and by these means organic matter and a finer mineral soil accumulate with time. Such initial stages of soil development have been described on volcanoes,[53] inselbergs,[54] and glacial moraines.[55]
How soil formation proceeds is influenced by at least five classic factors that are intertwined in the evolution of a soil: parent material, climate, topography (relief), organisms, and time.[56] When reordered to climate, relief, organisms, parent material, and time, they form the acronym CROPT.[57]
Physical properties
[edit]The physical properties of soils, in order of decreasing importance for ecosystem services such as crop production, are texture, structure, bulk density, porosity, consistency, temperature, colour and resistivity.[58] Soil texture is determined by the relative proportion of the three kinds of soil mineral particles, called soil separates: sand, silt, and clay. At the next larger scale, soil structures called peds or more commonly soil aggregates are created from the soil separates when iron oxides, carbonates, clay, silica and humus, coat particles and cause them to adhere into larger, relatively stable secondary structures.[59] Soil bulk density, when determined at standardized moisture conditions, is an estimate of soil compaction.[60] Soil porosity consists of the void part of the soil volume and is occupied by gases or water. Soil consistency is the ability of soil materials to stick together. Soil temperature and colour are self-defining. Resistivity refers to the resistance to conduction of electric currents and affects the rate of corrosion of metal and concrete structures which are buried in soil.[61] These properties vary through the depth of a soil profile, i.e. through soil horizons. Most of these properties determine the aeration of the soil and the ability of water to infiltrate and to be held within the soil.[62]
Soil moisture
[edit]Soil water content can be measured as volume or weight. Soil moisture levels, in order of decreasing water content, are saturation, field capacity, wilting point, air dry, and oven dry. Field capacity describes a drained wet soil at the point water content reaches equilibrium with gravity. Irrigating soil above field capacity risks percolation losses. Wilting point describes the dry limit for growing plants. During growing season, soil moisture is unaffected by functional groups or specie richness.[63]
Available water capacity is the amount of water held in a soil profile available to plants. As water content drops, plants have to work against increasing forces of adhesion and sorptivity to withdraw water. Irrigation scheduling avoids moisture stress by replenishing depleted water before stress is induced.[64][65]
Capillary action is responsible for moving groundwater from wet regions of the soil to dry areas. Subirrigation designs (e.g., wicking beds, sub-irrigated planters) rely on capillarity to supply water to plant roots. Capillary action can result in an evaporative concentration of salts, causing land degradation through salination.
Soil moisture measurement—measuring the water content of the soil, as can be expressed in terms of volume or weight—can be based on in situ probes (e.g., capacitance probes, neutron probes), or remote sensing methods. Soil moisture measurement is an important factor in determining changes in soil activity.[63]
Soil gas
[edit]The atmosphere of soil, or soil gas, is very different from the atmosphere above. The consumption of oxygen by microbes and plant roots, and their release of carbon dioxide, decreases oxygen and increases carbon dioxide concentration. Atmospheric CO2 concentration is 0.04%, but in the soil pore space it may range from 10 to 100 times that level, thus potentially contributing to the inhibition of root respiration.[66] Calcareous soils regulate CO2 concentration by carbonate buffering, contrary to acid soils in which all CO2 respired accumulates in the soil pore system.[67] At extreme levels, CO2 is toxic.[68] This suggests a possible negative feedback control of soil CO2 concentration through its inhibitory effects on root and microbial respiration (also called soil respiration).[69] In addition, the soil voids are saturated with water vapour, at least until the point of maximal hygroscopicity, beyond which a vapour-pressure deficit occurs in the soil pore space.[34] Adequate porosity is necessary, not just to allow the penetration of water, but also to allow gases to diffuse in and out. Movement of gases is by diffusion from high concentrations to lower, the diffusion coefficient decreasing with soil compaction.[70] Oxygen from above atmosphere diffuses in the soil where it is consumed and levels of carbon dioxide in excess of above atmosphere diffuse out with other gases (including greenhouse gases) as well as water.[71] Soil texture and structure strongly affect soil porosity and gas diffusion. It is the total pore space (porosity) of soil, not the pore size, and the degree of pore interconnection (or conversely pore sealing), together with water content, air turbulence and temperature, that determine the rate of diffusion of gases into and out of soil.[72][71] Platy soil structure and soil compaction (low porosity) impede gas flow, and a deficiency of oxygen may encourage anaerobic bacteria to reduce (strip oxygen) from nitrate NO3 to the gases N2, N2O, and NO, which are then lost to the atmosphere, thereby depleting the soil of nitrogen, a detrimental process called denitrification.[73] Aerated soil is also a net sink of methane (CH4)[74] but a net producer of methane (a strong heat-absorbing greenhouse gas) when soils are depleted of oxygen and subject to elevated temperatures.[75]
Soil atmosphere is also the seat of emissions of volatiles other than carbon and nitrogen oxides from various soil organisms, e.g. roots,[76] bacteria,[77] fungi,[78] animals.[79] These volatiles are used as chemical cues, making soil atmosphere the seat of interaction networks[80][81] playing a decisive role in the stability, dynamics and evolution of soil ecosystems.[82] Biogenic soil volatile organic compounds are exchanged with the aboveground atmosphere, in which they are just 1–2 orders of magnitude lower than those from aboveground vegetation.[83]
Humans can get some idea of the soil atmosphere through the well-known 'after-the-rain' scent, when infiltering rainwater flushes out the whole soil atmosphere after a drought period, or when soil is excavated,[84] a bulk property attributed in a reductionist manner to particular biochemical compounds such as petrichor or geosmin.
Solid phase (soil matrix)
[edit]Soil particles can be classified by their chemical composition (mineralogy) as well as their size. The particle size distribution of a soil, its texture, determines many of the properties of that soil, in particular hydraulic conductivity and water potential,[85] but the mineralogy of those particles can strongly modify those properties. The mineralogy of the finest soil particles, clay, is especially important.[86]
Soil biodiversity
[edit]Large numbers of microbes, animals, plants and fungi are living in soil. However, biodiversity in soil is much harder to study as most of this life is invisible, hence estimates about soil biodiversity have been unsatisfactory. A recent study suggested that soil is likely home to 59 ± 15% of the species on Earth. Enchytraeidae (worms) have the greatest percentage of species in soil (98.6%), followed by fungi (90%), plants (85.5%), and termites (Isoptera) (84.2%). Many other groups of animals have substantial fractions of species living in soil, e.g. about 30% of insects, and close to 50% of arachnids.[87] While most vertebrates live above ground (ignoring aquatic species), many species are fossorial, that is, they live in soil, such as most blind snakes.
Chemistry
[edit]The chemistry of a soil determines its ability to supply available plant nutrients and affects its physical properties and the health of its living population. In addition, a soil's chemistry also determines its corrosivity, stability, and ability to absorb pollutants and to filter water. It is the surface chemistry of mineral and organic colloids that determines soil's chemical properties.[88] A colloid is a small, insoluble particle ranging in size from 1 nanometer to 1 micrometer, thus small enough to remain suspended by Brownian motion in a fluid medium without settling.[89] Most soils contain organic colloidal particles called humus as well as the inorganic colloidal particles of clays. The very high specific surface area of colloids and their net electrical charges give soil its ability to hold and release ions. Negatively charged sites on colloids attract and release cations in what is referred to as cation exchange. Cation-exchange capacity is the amount of exchangeable cations per unit weight of dry soil and is expressed in terms of milliequivalents of positively charged ions per 100 grams of soil (or centimoles of positive charge per kilogram of soil; cmolc/kg). Similarly, positively charged sites on colloids can attract and release anions in the soil, giving the soil anion exchange capacity.
Cation and anion exchange
[edit]The cation exchange, that takes place between colloids and soil water, buffers (moderates) soil pH, alters soil structure, and purifies percolating water by adsorbing cations of all types, both useful and harmful.
The negative or positive charges on colloid particles make them able to hold cations or anions, respectively, to their surfaces. The charges result from four sources.[90]
- Isomorphous substitution occurs in clay during its formation, when lower-valence cations substitute for higher-valence cations in the crystal structure.[91] Substitutions in the outermost layers are more effective than for the innermost layers, as the electric charge strength drops off as the square of the distance. The net result is oxygen atoms with net negative charge and the ability to attract cations.
- Edge-of-clay oxygen atoms are not in balance ionically as the tetrahedral and octahedral structures are incomplete.[92]
- Hydroxyls may substitute for oxygens of the silica layers, a process called hydroxylation. When the hydrogens of the clay hydroxyls are ionised into solution, they leave the oxygen with a negative charge (anionic clays).[93]
- Hydrogens of humus hydroxyl groups may also be ionised into solution, leaving, similarly to clay, an oxygen with a negative charge.[94]
Cations held to the negatively charged colloids resist being washed downward by water and are out of reach of plant roots, thereby preserving the soil fertility in areas of moderate rainfall and low temperatures.[95][96]
There is a hierarchy in the process of cation exchange on colloids, as cations differ in the strength of adsorption by the colloid and hence their ability to replace one another (ion exchange). If present in equal amounts in the soil water solution:
Al3+ replaces H+ replaces Ca2+ replaces Mg2+ replaces K+ same as NH+
4 replaces Na+[97]
If one cation is added in large amounts, it may replace the others by the sheer force of its numbers. This is called law of mass action. This is largely what occurs with the addition of cationic fertilisers (potash, lime).[98]
As the soil solution becomes more acidic (low pH, meaning an abundance of H+), the other cations more weakly bound to colloids are pushed into solution as hydrogen ions occupy exchange sites (protonation). A low pH may cause the hydrogen of hydroxyl groups to be pulled into solution, leaving charged sites on the colloid available to be occupied by other cations. This ionisation of hydroxy groups on the surface of soil colloids creates what is described as pH-dependent surface charges.[99] Unlike permanent charges developed by isomorphous substitution, pH-dependent charges are variable and increase with increasing pH.[100] Freed cations can be made available to plants but are also prone to be leached from the soil, possibly making the soil less fertile.[101] Plants are able to excrete H+ into the soil through the synthesis of organic acids and by that means, change the pH of the soil near the root and push cations off the colloids, thus making those available to the plant.[102]
Cation exchange capacity (CEC)
[edit]Cation exchange capacity is the soil's ability to remove cations from the soil water solution and sequester those to be exchanged later as the plant roots release hydrogen ions to the solution.[103] CEC is the amount of exchangeable hydrogen cation (H+) that will combine with 100 grams dry weight of soil and whose measure is one milliequivalents per 100 grams of soil (1 meq/100 g). Hydrogen ions have a single charge and one-thousandth of a gram of hydrogen ions per 100 grams dry soil gives a measure of one milliequivalent of hydrogen ion. Calcium, with an atomic weight 40 times that of hydrogen and with a valence of two, converts to (40 ÷ 2) × 1 milliequivalent = 20 milliequivalents of hydrogen ion per 100 grams of dry soil or 20 meq/100 g.[104] The modern measure of CEC is expressed as centimoles of positive charge per kilogram (cmol/kg) of oven-dry soil.
Most of the soil's CEC occurs on clay and humus colloids, and the lack of those in hot, humid, wet climates (such as tropical rainforests), due to leaching and decomposition, respectively, explains the apparent sterility of tropical soils.[105] Live plant roots also have some CEC, linked to their specific surface area.[106]
| Soil | State | CEC meq/100 g |
|---|---|---|
| Charlotte fine sand | Florida | 1.0 |
| Ruston fine sandy loam | Texas | 1.9 |
| Glouchester loam | New Jersey | 11.9 |
| Grundy silt loam | Illinois | 26.3 |
| Gleason clay loam | California | 31.6 |
| Susquehanna clay loam | Alabama | 34.3 |
| Davie mucky fine sand | Florida | 100.8 |
| Sands | — | 1–5 |
| Fine sandy loams | — | 5–10 |
| Loams and silt loams | — | 5–15 |
| Clay loams | — | 15–30 |
| Clays | — | over 30 |
| Sesquioxides | — | 0–3 |
| Kaolinite | — | 3–15 |
| Illite | — | 25–40 |
| Montmorillonite | — | 60–100 |
| Vermiculite (similar to illite) | — | 80–150 |
| Humus | — | 100–300 |
Anion exchange capacity (AEC)
[edit]Anion exchange capacity is the soil's ability to remove anions (such as nitrate, phosphate) from the soil water solution and sequester those for later exchange as the plant roots release carbonate anions to the soil water solution.[108] Those colloids which have low CEC tend to have some AEC. Amorphous and sesquioxide clays have the highest AEC,[109] followed by the iron oxides.[110] Levels of AEC are much lower than for CEC, because of the generally higher rate of positively (versus negatively) charged surfaces on soil colloids, to the exception of variable-charge soils.[111] Phosphates tend to be held at anion exchange sites.[112]
Iron and aluminum hydroxide clays are able to exchange their hydroxide anions (OH−) for other anions.[108] The order reflecting the strength of anion adhesion is as follows:
- H
2PO−
4 replaces SO2−
4 replaces NO−
3 replaces Cl−
The amount of exchangeable anions is of a magnitude of tenths to a few milliequivalents per 100 g dry soil.[107] As pH rises, there are relatively more hydroxyls, which will displace anions from the colloids and force them into solution and out of storage; hence AEC decreases with increasing pH (alkalinity).[113]
Reactivity (pH)
[edit]Soil reactivity is expressed in terms of pH and is a measure of the acidity or alkalinity of the soil. More precisely, it is a measure of hydronium concentration in an aqueous solution and ranges in values from 0 to 14 (acidic to basic) but practically speaking for soils, pH ranges from 3.5 to 9.5, as pH values beyond those extremes are toxic to life forms.[114]
At 25 °C an aqueous solution that has a pH of 3.5 has 10−3.5 moles H3O+ (hydronium ions) per litre of solution (and also 10−10.5 moles per litre OH−). A pH of 7, defined as neutral, has 10−7 moles of hydronium ions per litre of solution and also 10−7 moles of OH− per litre; since the two concentrations are equal, they are said to neutralise each other. A pH of 9.5 has 10−9.5 moles hydronium ions per litre of solution (and also 10−2.5 moles per litre OH−). A pH of 3.5 has one million times more hydronium ions per litre than a solution with pH of 9.5 (9.5 − 3.5 = 6 or 106) and is more acidic.[115]
The effect of pH on a soil is to remove from the soil or to make available certain ions. Soils with high acidity tend to have toxic amounts of aluminium and manganese.[116] As a result of a trade-off between toxicity and requirement most nutrients are better available to plants at moderate pH,[117] although most minerals are more soluble in acid soils. Soil organisms are hindered by high acidity, and most agricultural crops do best with mineral soils of pH 6.5 and organic soils of pH 5.5.[118] Given that at low pH toxic metals (e.g. cadmium, zinc, lead) are positively charged as cations and organic pollutants are in non-ionic form, thus both made more available to organisms,[119][120] it has been suggested that plants, animals and microbes commonly living in acid soils are pre-adapted to every kind of pollution, whether of natural or human origin.[121]
In high rainfall areas, soils tend to acidify as the basic cations are forced off the soil colloids by the mass action of hydronium ions from usual or unusual rain acidity against those attached to the colloids. High rainfall rates can then wash the nutrients out, leaving the soil inhabited only by those organisms which are particularly efficient to uptake nutrients in very acid conditions, like in tropical rainforests.[122] Once the colloids are saturated with H3O+, the addition of any more hydronium ions or aluminum hydroxyl cations drives the pH even lower (more acidic) as the soil has been left with no buffering capacity.[123] In areas of extreme rainfall and high temperatures, the clay and humus may be washed out, further reducing the buffering capacity of the soil.[124] In low rainfall areas, unleached calcium pushes pH to 8.5 and with the addition of exchangeable sodium, soils may reach pH 10.[125] Beyond a pH of 9, plant growth is reduced.[126] High pH results in low micro-nutrient mobility, but water-soluble chelates of those nutrients can correct the deficit.[127] Sodium can be reduced by the addition of gypsum (calcium sulphate) as calcium adheres to clay more tightly than does sodium causing sodium to be pushed into the soil water solution where it can be washed out by an abundance of water.[128][129]
Base saturation percentage
[edit]There are acid-forming cations (e.g. hydronium, aluminium, iron) and there are base-forming cations (e.g. calcium, magnesium, sodium). The fraction of the negatively-charged soil colloid exchange sites (CEC) that are occupied by base-forming cations is called base saturation. If a soil has a CEC of 20 meq and 5 meq are aluminium and hydronium cations (acid-forming), the remainder of positions on the colloids (20 − 5 = 15 meq) are assumed occupied by base-forming cations, so that the base saturation is 15 ÷ 20 × 100% = 75% (the compliment 25% is assumed acid-forming cations). Base saturation is almost in direct proportion to pH (it increases with increasing pH).[130] It is of use in calculating the amount of lime needed to neutralise an acid soil (lime requirement). The amount of lime needed to neutralize a soil must take account of the amount of acid forming ions on the colloids (exchangeable acidity), not just those in the soil water solution (free acidity).[131] The addition of enough lime to neutralize the soil water solution will be insufficient to change the pH, as the acid forming cations stored on the soil colloids will tend to restore the original pH condition as they are pushed off those colloids by the calcium of the added lime.[132]
Buffering
[edit]The resistance of soil to change in pH, as a result of the addition of acid or basic material, is a measure of the buffering capacity of a soil and (for a particular soil type) increases as the CEC increases. Hence, pure sand has almost no buffering ability, though soils high in colloids (whether mineral or organic) have high buffering capacity.[133] Buffering occurs by cation exchange and neutralisation. However, colloids are not the only regulators of soil pH. The role of carbonates should be underlined, too.[134] More generally, according to pH levels, several buffer systems take precedence over each other, from calcium carbonate buffer range to iron buffer range.[135]
The addition of a small amount of highly basic aqueous ammonia to a soil will cause the ammonium to displace hydronium ions from the colloids, and the end product is water and colloidally fixed ammonium, but little permanent change overall in soil pH.
The addition of a small amount of lime, Ca(OH)2, will displace hydronium ions from the soil colloids, causing the fixation of calcium to colloids and the evolution of CO2 and water, with little permanent change in soil pH.
The above are examples of the buffering of soil pH. The general principal is that an increase in a particular cation in the soil water solution will cause that cation to be fixed to colloids (buffered) and a decrease in solution of that cation will cause it to be withdrawn from the colloid and moved into solution (buffered). The degree of buffering is often related to the CEC of the soil; the greater the CEC, the greater the buffering capacity of the soil.[136]
Redox
[edit]Soil chemical reactions involve some combination of proton and electron transfer. Oxidation occurs if there is a loss of electrons in the transfer process while reduction occurs if there is a gain of electrons. Reduction potential is measured in volts or millivolts. Soil microbial communities develop along electron transport chains, forming electrically conductive biofilms, and developing networks of bacterial nanowires.
Redox factors in soil development, where formation of redoximorphic color features provides critical information for soil interpretation. Understanding the redox gradient is important to managing carbon sequestration, bioremediation, wetland delineation, and soil-based microbial fuel cells.
Nutrients
[edit]| Element | Symbol | Ion or molecule |
|---|---|---|
| Carbon | C | CO2 (mostly through leaves) |
| Hydrogen | H | H+, H2O (water) |
| Oxygen | O | O2−, OH−, CO2− 3, SO2− 4, CO2 |
| Phosphorus | P | H 2PO− 4, HPO2− 4 (phosphates) |
| Potassium | K | K+ |
| Nitrogen | N | NH+ 4, NO− 3 (ammonium, nitrate) |
| Sulfur | S | SO2− 4 |
| Calcium | Ca | Ca2+ |
| Iron | Fe | Fe2+, Fe3+ (ferrous, ferric) |
| Magnesium | Mg | Mg2+ |
| Boron | B | H3BO3, H 2BO− 3, B(OH)− 4 |
| Manganese | Mn | Mn2+ |
| Copper | Cu | Cu2+ |
| Zinc | Zn | Zn2+ |
| Molybdenum | Mo | MoO2− 4 (molybdate) |
| Chlorine | Cl | Cl− (chloride) |
Seventeen elements or nutrients are essential for plant growth and reproduction. They are carbon (C), hydrogen (H), oxygen (O), nitrogen (N), phosphorus (P), potassium (K), sulfur (S), calcium (Ca), magnesium (Mg), iron (Fe), boron (B), manganese (Mn), copper (Cu), zinc (Zn), molybdenum (Mo), nickel (Ni) and chlorine (Cl).[138][139][140] Nutrients required for plants to complete their life cycle are considered essential nutrients. Nutrients that enhance the growth of plants but are not necessary to complete the plant's life cycle are considered non-essential. With the exception of carbon, hydrogen and oxygen, which are supplied by carbon dioxide and water, and nitrogen, provided through nitrogen fixation,[140] the nutrients derive originally from the mineral component of the soil. The Law of the Minimum expresses that when the available form of a nutrient is not in enough proportion in the soil solution, then other nutrients cannot be taken up at an optimum rate by a plant.[141] A particular nutrient ratio of the soil solution is thus mandatory for optimizing plant growth, a value which might differ from nutrient ratios calculated from plant composition.[142]
Plant uptake of nutrients can only proceed when they are present in a plant-available form. In most situations, nutrients are absorbed in an ionic form from (or together with) soil water. Although minerals are the origin of most nutrients, and the bulk of most nutrient elements in the soil is held in crystalline form within primary and secondary minerals, they weather too slowly to support rapid plant growth. For example, the application of finely ground minerals, feldspar and apatite, to soil seldom provides the necessary amounts of potassium and phosphorus at a rate sufficient for good plant growth, as most of the nutrients remain bound in the crystals of those minerals.[143]
The nutrients adsorbed onto the surfaces of clay colloids and soil organic matter provide a more accessible reservoir of many plant nutrients (e.g. K, Ca, Mg, P, Zn). As plants absorb the nutrients from the soil water, the soluble pool is replenished from the surface-bound pool. The decomposition of soil organic matter by microorganisms is another mechanism whereby the soluble pool of nutrients is replenished – this is important for the supply of plant-available N, S, P, and B from soil.[144]
Gram for gram, the capacity of humus to hold nutrients and water is far greater than that of clay minerals, most of the soil cation exchange capacity arising from charged carboxylic groups on organic matter.[145] However, despite the great capacity of humus to retain water once water-soaked, its high hydrophobicity decreases its wettability once dry.[146] All in all, small amounts of humus may remarkably increase the soil's capacity to promote plant growth.[147][144]
Soil organic matter
[edit]This section may contain an excessive amount of intricate detail that may interest only a particular audience. Specifically, details could be moved into main article. (April 2021) |
The organic material in soil is made up of organic compounds and includes plant, animal and microbial material, both living and dead. A typical soil has a biomass composition of 70% microorganisms, 22% macrofauna, and 8% roots. The living component of an acre of soil may include 900 lb of earthworms, 2400 lb of fungi, 1500 lb of bacteria, 133 lb of protozoa and 890 lb of arthropods and algae.[148]
A few percent of the soil organic matter, with small residence time, consists of the microbial biomass and metabolites of bacteria, molds, and actinomycetes that work to break down the dead organic matter.[149][150] Were it not for the action of these micro-organisms, the entire carbon dioxide part of the atmosphere would be sequestered as organic matter in the soil. However, in the same time soil microbes contribute to carbon sequestration in the topsoil through the formation of stable humus.[151] In the aim to sequester more carbon in the soil for alleviating the greenhouse effect it would be more efficient in the long-term to stimulate humification than to decrease litter decomposition.[152]
The main part of soil organic matter is a complex assemblage of small organic molecules, collectively called humus or humic substances. The use of these terms, which do not rely on a clear chemical classification, has been considered as obsolete.[153] Other studies showed that the classical notion of molecule is not convenient for humus, which escaped most attempts done over two centuries to resolve it in unit components, but still is chemically distinct from polysaccharides, lignins and proteins.[154]
Most living things in soils, including plants, animals, bacteria, and fungi, are dependent on organic matter for nutrients and/or energy. Soils have organic compounds in varying degrees of decomposition which rate is dependent on temperature, soil moisture, and aeration. Bacteria and fungi feed on the raw organic matter, which are fed upon by protozoa, which in turn are fed upon by nematodes, annelids and arthropods, themselves able to consume and transform raw or humified organic matter. This has been called the soil food web, through which all organic matter is processed as in a digestive system.[155] Organic matter holds soils open, allowing the infiltration of air and water, and may hold as much as twice its weight in water. Many soils, including desert and rocky-gravel soils, have little or no organic matter. Soils that are all organic matter, such as peat (histosols), are infertile.[156] In its earliest stage of decomposition, the original organic material is often called raw organic matter. The final stage of decomposition is called humus.
In grassland, much of the organic matter added to the soil is from the deep, fibrous, grass root systems. By contrast, tree leaves falling on the forest floor are the principal source of soil organic matter in the forest. Another difference is the frequent occurrence in the grasslands of fires that destroy large amounts of aboveground material but stimulate even greater contributions from roots. Also, the much greater acidity under any forests inhibits the action of certain soil organisms that otherwise would mix much of the surface litter into the mineral soil. As a result, the soils under grasslands generally develop a thicker A horizon with a deeper distribution of organic matter than in comparable soils under forests, which characteristically store most of their organic matter in the forest floor (O horizon) and thin A horizon.[157]
Humus
[edit]Humus refers to organic matter that has been decomposed by soil microflora and fauna to the point where it is resistant to further breakdown. Humus usually constitutes only five percent of the soil or less by volume, but it is an essential source of nutrients and adds important textural qualities crucial to soil health and plant growth.[158] Humus also feeds arthropods, termites and earthworms which further improve the soil.[159] The end product, humus, is suspended in colloidal form in the soil solution and forms a weak acid that can attack silicate minerals by chelating their iron and aluminum atoms.[160] Humus has a high cation and anion exchange capacity that on a dry weight basis is many times greater than that of clay colloids. It also acts as a buffer, like clay, against changes in pH and soil moisture.[161]
Humic acids and fulvic acids, which begin as raw organic matter, are important constituents of humus. After the death of plants, animals, and microbes, microbes begin to feed on the residues through their production of extra-cellular soil enzymes, resulting finally in the formation of humus.[162] As the residues break down, only molecules made of aliphatic and aromatic hydrocarbons, assembled and stabilized by oxygen and hydrogen bonds, remain in the form of complex molecular assemblages collectively called humus.[154] Humus is never pure in the soil, because it reacts with metals and clays to form complexes which further contribute to its stability and to soil structure.[161] Although the structure of humus has in itself few nutrients (with the exception of constitutive metals such as calcium, iron and aluminum) it is able to attract and link, by weak bonds, cation and anion nutrients that can further be released into the soil solution in response to selective root uptake and changes in soil pH, a process of paramount importance for the maintenance of fertility in tropical soils.[163]
Lignin is resistant to breakdown and accumulates within the soil. It also reacts with proteins,[164] which further increases its resistance to decomposition, including enzymatic decomposition by microbes.[165] Fats and waxes from plant matter have still more resistance to decomposition and persist in soils for thousand years, hence their use as tracers of past vegetation in buried soil layers.[166] Clay soils often have higher organic contents that persist longer than soils without clay as the organic molecules adhere to and are stabilised by the clay.[167] Proteins normally decompose readily, to the exception of scleroproteins, but when bound to clay particles they become more resistant to decomposition.[168] As for other proteins clay particles absorb the enzymes exuded by microbes, decreasing enzyme activity while protecting extracellular enzymes from degradation.[169] The addition of organic matter to clay soils can render that organic matter and any added nutrients inaccessible to plants and microbes for many years.[170] A study showed increased soil fertility following the addition of mature compost to a clay soil.[171] High soil tannin content can cause nitrogen to be sequestered as resistant tannin-protein complexes.[172][173]
Humus formation is a process dependent on the amount of plant material added each year and the type of base soil. Both are affected by climate and the type of organisms present.[157] Soils with humus can vary in nitrogen content but typically have 3 to 6 percent nitrogen. Raw organic matter, as a reserve of nitrogen and phosphorus, is a vital component affecting soil fertility.[156] Humus also absorbs water, and expands and shrinks between dry and wet states to a higher extent than clay, increasing soil porosity.[174] Humus is less stable than the soil's mineral constituents, as it is reduced by microbial decomposition, and over time its concentration diminishes without the addition of new organic matter. However, humus in its most stable forms may persist over centuries if not millennia.[175] Charcoal is a source of highly stable humus, called black carbon,[176] which had been used traditionally to improve the fertility of nutrient-poor tropical soils. This very ancient practice, as ascertained in the genesis of Amazonian dark earths, has been renewed and became popular under the name of biochar. It has been suggested that biochar could be used to sequester more carbon in the fight against the greenhouse effect.[177]
Climatological influence
[edit]The production, accumulation and degradation of organic matter are greatly dependent on climate. For example, when a thawing event occurs, the flux of soil gases with atmospheric gases is significantly influenced.[178] Temperature, soil moisture and topography are the major factors affecting the accumulation of organic matter in soils. Organic matter tends to accumulate under wet or cold conditions where decomposer activity is impeded by low temperature[179] or excess moisture which results in anaerobic conditions.[180] Conversely, excessive rain and high temperatures of tropical climates enables rapid decomposition of organic matter and leaching of plant nutrients. Forest ecosystems on these soils rely on efficient recycling of nutrients and plant matter by the living plant and microbial biomass to maintain their productivity, a process which is disturbed by human activities.[181] Excessive slope, in particular in the presence of cultivation for the sake of agriculture, may encourage the erosion of the top layer of soil which holds most of the raw organic material that would otherwise eventually become humus.[182]
Plant residue
[edit]Typical types and percentages of plant residue components
Cellulose and hemicellulose undergo fast decomposition by fungi and bacteria, with a half-life of 12–18 days in a temperate climate.[183] Brown rot fungi can decompose the cellulose and hemicellulose, leaving the lignin and phenolic compounds behind. Starch, which is an energy storage system for plants, undergoes fast decomposition by bacteria and fungi. Lignin consists of polymers composed of 500 to 600 units with a highly branched, amorphous structure, linked to cellulose, hemicellulose and pectin in plant cell walls. Lignin undergoes very slow decomposition, mainly by white rot fungi and actinomycetes; its half-life under temperate conditions is about six months.[183]
Horizons
[edit]A horizontal layer of the soil, whose physical features, composition and age are distinct from those above and beneath, is referred to as a soil horizon. The naming of a horizon is based on the type of material of which it is composed. Those materials reflect the duration of specific processes of soil formation. They are labelled using a shorthand notation of letters and numbers which describe the horizon in terms of its colour, size, texture, structure, consistency, root quantity, pH, voids, boundary characteristics and presence of nodules or concretions.[184] No soil profile has all the major horizons. Some, called entisols, may have only one horizon or are currently considered as having no horizon, in particular incipient soils from unreclaimed mining waste deposits,[185] moraines,[186] volcanic cones[187] sand dunes or alluvial terraces.[188] Upper soil horizons may be lacking in truncated soils following wind or water ablation, with concomitant downslope burying of soil horizons, a natural process aggravated by agricultural practices such as tillage.[189] The growth of trees is another source of disturbance, creating a micro-scale heterogeneity which is still visible in soil horizons once trees have died.[190] By passing from a horizon to another, from the top to the bottom of the soil profile, one goes back in time, with past events registered in soil horizons like in sediment layers. Sampling pollen, testate amoebae and plant remains in soil horizons may help to reveal environmental changes (e.g. climate change, land use change) which occurred in the course of soil formation.[191] Soil horizons can be dated by several methods such as radiocarbon, using pieces of charcoal provided they are of enough size to escape pedoturbation by earthworm activity and other mechanical disturbances.[192] Fossil soil horizons from paleosols can be found within sedimentary rock sequences, allowing the study of past environments.[193]
The exposure of parent material to favourable conditions produces mineral soils that are marginally suitable for plant growth, as is the case in eroded soils.[194] The growth of vegetation results in the production of organic residues which fall on the ground as litter for plant aerial parts (leaf litter) or are directly produced belowground for subterranean plant organs (root litter), and then release dissolved organic matter.[195] The remaining surficial organic layer, called the O horizon, produces a more active soil due to the effect of the organisms that live within it. Organisms colonise and break down organic materials, making available nutrients upon which other plants and animals can live.[196] After sufficient time, humus moves downward and is deposited in a distinctive organic-mineral surface layer called the A horizon, in which organic matter is mixed with mineral matter through the activity of burrowing animals, a process called pedoturbation. This natural process does not go to completion in the presence of conditions detrimental to soil life such as strong acidity, cold climate or pollution, stemming in the accumulation of undecomposed organic matter within a single organic horizon overlying the mineral soil[197] and in the juxtaposition of humified organic matter and mineral particles, without intimate mixing, in the underlying mineral horizons.[198]
Classification
[edit]One of the first soil classification systems was developed by Russian scientist Vasily Dokuchaev around 1880.[199] It was modified a number of times by American and European researchers and was developed into the system commonly used until the 1960s. It was based on the idea that soils have a particular morphology based on the materials and factors that form them. In the 1960s, a different classification system began to emerge which focused on soil morphology instead of parental materials and soil-forming factors. Since then, it has undergone further modifications. The World Reference Base for Soil Resources[200] aims to establish an international reference base for soil classification.
Uses
[edit]Soil is used in agriculture, where it serves as the anchor and primary nutrient base for plants. The types of soil and available moisture determine the species of plants that can be cultivated. Agricultural soil science was the primeval domain of soil knowledge, long time before the advent of pedology in the 19th century. However, as demonstrated by aeroponics, aquaponics and hydroponics, soil material is not an absolute essential for agriculture, and soilless cropping systems have been claimed as the future of agriculture for an endless growing mankind.[201]
Soil material is also a critical component in mining, construction and landscape development industries.[202] Soil serves as a foundation for most construction projects. The movement of massive volumes of soil can be involved in surface mining, road building and dam construction. Earth sheltering is the architectural practice of using soil for external thermal mass against building walls. Many building materials are soil based. Loss of soil through urbanization is growing at a high rate in many areas and can be critical for the maintenance of subsistence agriculture.[203]
Soil resources are critical to the environment, as well as to food and fibre production, producing 98.8% of food consumed by humans.[204] Soil provides minerals and water to plants according to several processes involved in plant nutrition. Soil absorbs rainwater and releases it later, thus preventing floods and drought, flood regulation being one of the major ecosystem services provided by soil.[205] Soil cleans water as it percolates through it.[206] Soil is the habitat for many organisms: the major part of known and unknown biodiversity is in the soil, in the form of earthworms, woodlice, millipedes, centipedes, snails, slugs, mites, springtails, enchytraeids, nematodes, protists), bacteria, archaea, fungi and algae; and most organisms living above ground have part of them (plants) or spend part of their life cycle (insects) below-ground.[207] Above-ground and below-ground biodiversities are tightly interconnected,[157][208] making soil protection of paramount importance for any restoration or conservation plan.
The biological component of soil is an extremely important carbon sink since about 57% of the biotic content is carbon. Even in deserts, cyanobacteria, lichens and mosses form biological soil crusts which capture and sequester a significant amount of carbon by photosynthesis. Poor farming and grazing methods have degraded soils and released much of this sequestered carbon to the atmosphere. Restoring the world's soils could offset the effect of increases in greenhouse gas emissions and slow global warming, while improving crop yields and reducing water needs.[209][210][211]
Waste management often has a soil component. Septic drain fields treat septic tank effluent using aerobic soil processes. Land application of waste water relies on soil biology to aerobically treat BOD. Alternatively, landfills use soil for daily cover, isolating waste deposits from the atmosphere and preventing unpleasant smells. Composting is now widely used to treat aerobically solid domestic waste and dried effluents of settling basins. Although compost is not soil, biological processes taking place during composting are similar to those occurring during decomposition and humification of soil organic matter.[212]
Organic soils, especially peat, serve as a significant fuel and horticultural resource. Peat soils are also commonly used for the sake of agriculture in Nordic countries, because peatland sites, when drained, provide fertile soils for food production.[213] However, wide areas of peat production, such as rain-fed sphagnum bogs, also called blanket bogs or raised bogs, are now protected because of their patrimonial interest. As an example, Flow Country, covering 4,000 square kilometres of rolling expanse of blanket bogs in Scotland, is now candidate for being included in the World Heritage List. Under present-day global warming peat soils are thought to be involved in a self-reinforcing (positive feedback) process of increased emission of greenhouse gases (methane and carbon dioxide) and increased temperature,[214] a contention which is still under debate when replaced at field scale and including stimulated plant growth.[215]
Geophagy is the practice of eating soil-like substances. Both animals and humans occasionally consume soil for medicinal, recreational, or religious purposes.[216] It has been shown that some monkeys consume soil, together with their preferred food (tree foliage and fruits), in order to alleviate tannin toxicity.[217]
Soils filter and purify water and affect its chemistry. Rain water and pooled water from ponds, lakes and rivers percolate through the soil horizons and the upper rock strata, thus becoming groundwater. Pests (viruses) and pollutants, such as persistent organic pollutants (chlorinated pesticides, polychlorinated biphenyls), oils (hydrocarbons), heavy metals (lead, zinc, cadmium), and excess nutrients (nitrates, sulfates, phosphates) are filtered out by the soil.[218] Soil organisms metabolise them or immobilise them in their biomass and necromass,[219] thereby incorporating them into stable humus.[220] The physical integrity of soil is also a prerequisite for avoiding landslides in rugged landscapes.[221]
Degradation
[edit]Land degradation is a human-induced or natural process which impairs the capacity of land to function.[222] Soil degradation involves acidification, contamination, desertification, erosion or salination.[223]
Acidification
[edit]Soil acidification is beneficial in the case of alkaline soils, but it degrades land when it lowers crop productivity, soil biological activity and increases soil vulnerability to contamination and erosion. Soils are initially acid and remain such when their parent materials are low in basic cations (calcium, magnesium, potassium and sodium). On parent materials richer in weatherable minerals acidification occurs when basic cations are leached from the soil profile by rainfall or exported by the harvesting of forest or agricultural crops. Soil acidification is accelerated by the use of acid-forming nitrogenous fertilizers and by the effects of acid precipitation. Deforestation is another cause of soil acidification, mediated by increased leaching of soil nutrients in the absence of tree canopies.[224]
Contamination
[edit]Soil contamination at low levels is often within a soil's capacity to treat and assimilate waste material. Soil biota can treat waste by transforming it, mainly through microbial enzymatic activity.[225] Soil organic matter and soil minerals can adsorb the waste material and decrease its toxicity,[226] although when in colloidal form they may transport the adsorbed contaminants to subsurface environments.[227] Many waste treatment processes rely on this natural bioremediation capacity. Exceeding treatment capacity can damage soil biota and limit soil function. Derelict soils occur where industrial contamination or other development activity damages the soil to such a degree that the land cannot be used safely or productively. Remediation of derelict soil uses principles of geology, physics, chemistry and biology to degrade, attenuate, isolate or remove soil contaminants to restore soil functions and values. Techniques include leaching, air sparging, soil conditioners, phytoremediation, bioremediation and Monitored Natural Attenuation. An example of diffuse pollution with contaminants is copper accumulation in vineyards and orchards to which fungicides are repeatedly applied, even in organic farming.[228]
Microfibres from synthetic textiles are another type of plastic soil contamination, 100% of agricultural soil samples from southwestern China contained plastic particles, 92% of which were microfibres. Sources of microfibres likely included string or twine, as well as irrigation water in which clothes had been washed.[229]
The application of biosolids from sewage sludge and compost can introduce microplastics to soils. This adds to the burden of microplastics from other sources (e.g. the atmosphere). Approximately half the sewage sludge in Europe and North America is applied to agricultural land. In Europe it has been estimated that for every million inhabitants 113 to 770 tonnes of microplastics are added to agricultural soils each year.[229]
Desertification
[edit]
Desertification, an environmental process of ecosystem degradation in arid and semi-arid regions, is often caused by badly adapted human activities such as overgrazing or excess harvesting of firewood. It is a common misconception that drought causes desertification.[230] Droughts are common in arid and semiarid lands. Well-managed lands can recover from drought when the rains return. Soil management tools include maintaining soil nutrient and organic matter levels, reduced tillage and increased cover.[231] These practices help to control erosion and maintain productivity during periods when moisture is available. Continued land abuse during droughts, however, increases land degradation. Increased population and livestock pressure on marginal lands accelerates desertification.[232] It is now questioned whether present-day climate warming will favour or disfavour desertification, with contradictory reports about predicted rainfall trends associated with increased temperature, and strong discrepancies among regions, even in the same country.[233]
Erosion
[edit]
Erosion of soil is caused by water, wind, ice, and movement in response to gravity. More than one kind of erosion can occur simultaneously. Erosion is distinguished from weathering, since erosion also transports eroded soil away from its place of origin (soil in transit may be described as sediment). Erosion is an intrinsic natural process, but in many places it is greatly increased by human activity, especially unsuitable land use practices.[234] These include agricultural activities which leave the soil bare during times of heavy rain or strong winds, overgrazing, deforestation, and improper construction activity. Improved management can limit erosion. Soil conservation techniques which are employed include changes of land use (such as replacing erosion-prone crops with grass or other soil-binding plants), changes to the timing or type of agricultural operations, terrace building, use of erosion-suppressing cover materials (including cover crops and other plants), limiting disturbance during construction, and avoiding construction during erosion-prone periods and in erosion-prone places such as steep slopes.[235] Historically, one of the best examples of large-scale soil erosion due to unsuitable land-use practices is wind erosion (the so-called dust bowl) which ruined American and Canadian prairies during the 1930s, when immigrant farmers, encouraged by the federal government of both countries, settled and converted the original shortgrass prairie to agricultural crops and cattle ranching.
A serious and long-running water erosion problem occurs in China, on the middle reaches of the Yellow River and the upper reaches of the Yangtze River. From the Yellow River, over 1.6 billion tons of sediment flow each year into the ocean. The sediment originates primarily from water erosion (gully erosion) in the Loess Plateau region of northwest China.[236]
Soil piping is a particular form of soil erosion that occurs below the soil surface.[237] It causes levee and dam failure, as well as sink hole formation. Turbulent flow removes soil starting at the mouth of the seep flow and the subsoil erosion advances up-gradient.[238] The term sand boil is used to describe the appearance of the discharging end of an active soil pipe.[239]
Salination
[edit]Soil salination is the accumulation of free salts to such an extent that it leads to degradation of the agricultural value of soils and vegetation. Consequences include corrosion damage, reduced plant growth, erosion due to loss of plant cover and soil structure, and water quality problems due to sedimentation. Salination occurs due to a combination of natural and human-caused processes. Arid conditions favour salt accumulation. This is especially apparent when soil parent material is saline. Irrigation of arid lands is especially problematic.[240] All irrigation water has some level of salinity. Irrigation, especially when it involves leakage from canals and overirrigation in the field, often raises the underlying water table. Rapid salination occurs when the land surface is within the capillary fringe of saline groundwater. Soil salinity control involves watertable control and flushing with higher levels of applied water in combination with tile drainage or another form of subsurface drainage.[241][242]
Reclamation
[edit]Soils which contain high levels of particular clays with high swelling properties, such as smectites, are often very fertile. For example, the smectite-rich paddy soils of Thailand's Central Plains are among the most productive in the world. However, the overuse of mineral nitrogen fertilizers and pesticides in irrigated intensive rice production has endangered these soils, forcing farmers to implement integrated practices based on Cost Reduction Operating Principles.[243]
Many farmers in tropical areas, however, struggle to retain organic matter and clay in the soils they work. In recent years, for example, productivity has declined and soil erosion has increased in the low-clay soils of northern Thailand, following the abandonment of shifting cultivation for a more permanent land use.[244] Farmers initially responded by adding organic matter and clay from termite mound material, but this was unsustainable in the long-term because of rarefaction of termite mounds. Scientists experimented with adding bentonite, one of the smectite family of clays, to the soil. In field trials, conducted by scientists from the International Water Management Institute (IWMI) in cooperation with Khon Kaen University and local farmers, this had the effect of helping retain water and nutrients. Supplementing the farmer's usual practice with a single application of 200 kilograms per rai (1,300 kg/ha; 1,100 lb/acre) of bentonite resulted in an average yield increase of 73%.[245] Other studies showed that applying bentonite to degraded sandy soils reduced the risk of crop failure during drought years.[246]
In 2008, three years after the initial trials, IWMI scientists conducted a survey among 250 farmers in northeast Thailand, half of whom had applied bentonite to their fields. The average improvement for those using the clay addition was 18% higher than for non-clay users. Using the clay had enabled some farmers to switch to growing vegetables, which need more fertile soil. This helped to increase their income. The researchers estimated that 200 farmers in northeast Thailand and 400 in Cambodia had adopted the use of clays, and that a further 20,000 farmers were introduced to the new technique.[247]
If the soil is too high in clay or salts (e.g. saline sodic soil), adding gypsum, washed river sand and organic matter (e.g.municipal solid waste) will balance the composition.[248]
Adding organic matter, like ramial chipped wood or compost, to soil which is depleted in nutrients and too high in sand will boost its quality and improve production.[249][250]
Special mention must be made of the use of charcoal, and more generally biochar to improve nutrient-poor tropical soils, a process based on the higher fertility of anthropogenic pre-Columbian Amazonian Dark Earths, also called Terra Preta de Índio, due to interesting physical and chemical properties of soil black carbon as a source of stable humus.[251] However, the uncontrolled application of charred waste products of all kinds may endanger soil life and human health.[252]
History of studies and research
[edit]The history of the study of soil is intimately tied to humans' urgent need to provide food for themselves and forage for their animals. Throughout history, civilizations have prospered or declined as a function of the availability and productivity of their soils.[253]
Studies of soil fertility
[edit]The Greek historian Xenophon (450–355 BCE) was the first to expound upon the merits of green-manuring crops: 'But then whatever weeds are upon the ground, being turned into earth, enrich the soil as much as dung.'[254]
Columella's Of husbandry, circa 60 CE, advocated the use of lime and that clover and alfalfa (green manure) should be turned under,[255] and was used by 15 generations (450 years) under the Roman Empire until its collapse.[254][256] From the fall of Rome to the French Revolution, knowledge of soil and agriculture was passed on from parent to child and as a result, crop yields were low. During the European Middle Ages, Yahya Ibn al-'Awwam's handbook,[257] with its emphasis on irrigation, guided the people of North Africa, Spain and the Middle East; a translation of this work was finally carried to the southwest of the United States when under Spanish influence.[258] Olivier de Serres, considered the father of French agronomy, was the first to suggest the abandonment of fallowing and its replacement by hay meadows within crop rotations. He also highlighted the importance of soil (the French terroir) in the management of vineyards. His famous book Le Théâtre d'Agriculture et mesnage des champs[259] contributed to the rise of modern, sustainable agriculture and to the collapse of old agricultural practices such as soil amendment for crops by the lifting of forest litter and assarting, which ruined the soils of western Europe during the Middle Ages and even later on according to regions.[260]
Experiments into what made plants grow first led to the idea that the ash left behind when plant matter was burned was the essential element but overlooked the role of nitrogen, which is not left on the ground after combustion, a belief which prevailed until the 19th century.[261] In about 1635, the Flemish chemist Jan Baptist van Helmont thought he had proved water to be the essential element from his famous five years' experiment with a willow tree grown with only the addition of rainwater. His conclusion came from the fact that the increase in the plant's weight had apparently been produced only by the addition of water, with no reduction in the soil's weight.[262][263][264] John Woodward (d. 1728) experimented with various types of water ranging from clean to muddy and found muddy water the best, and so he concluded that earthy matter was the essential element. Others concluded it was humus in the soil that passed some essence to the growing plant. Still others held that the vital growth principal was something passed from dead plants or animals to the new plants. At the start of the 18th century, Jethro Tull demonstrated that it was beneficial to cultivate (stir) the soil, but his opinion that the stirring made the fine parts of soil available for plant absorption was erroneous.[263][265]
As chemistry developed, it was applied to the investigation of soil fertility. The French chemist Antoine Lavoisier showed in about 1778 that plants and animals must combust oxygen internally to live. He was able to deduce that most of the 165-pound (75 kg) weight of van Helmont's willow tree derived from air.[266] It was the French agriculturalist Jean-Baptiste Boussingault who by means of experimentation obtained evidence showing that the main sources of carbon, hydrogen and oxygen for plants were air and water, while nitrogen was taken from soil.[267] Justus von Liebig in his book Organic chemistry in its applications to agriculture and physiology (published 1840), asserted that the chemicals in plants must have come from the soil and air and that to maintain soil fertility, the used minerals must be replaced.[268] Liebig nevertheless believed the nitrogen was supplied from the air. The enrichment of soil with guano by the Incas was rediscovered in 1802, by Alexander von Humboldt. This led to its mining and that of Chilean nitrate and to its application to soil in the United States and Europe after 1840.[269]
The work of Liebig was a revolution for agriculture, and so other investigators started experimentation based on it. In England John Bennet Lawes and Joseph Henry Gilbert worked in the Rothamsted Experimental Station, founded by the former, and (re)discovered that plants took nitrogen from the soil, and that salts needed to be in an available state to be absorbed by plants. Their investigations also produced the superphosphate, consisting in the acid treatment of phosphate rock.[270] This led to the invention and use of salts of potassium (K) and nitrogen (N) as fertilizers. Ammonia generated by the production of coke was recovered and used as fertiliser.[271] Finally, the chemical basis of nutrients delivered to the soil in manure was understood and in the mid-19th century chemical fertilisers were applied. However, the dynamic interaction of soil and its life forms was still not understood.
In 1856, J. Thomas Way discovered that ammonia contained in fertilisers was transformed into nitrates,[272] and twenty years later Robert Warington proved that this transformation was done by living organisms.[273] In 1890 Sergei Winogradsky announced he had found the bacteria responsible for this transformation.[274]
It was known that certain legumes could take up nitrogen from the air and fix it to the soil but it took the development of bacteriology towards the end of the 19th century to lead to an understanding of the role played in nitrogen fixation by bacteria. The symbiosis of bacteria and leguminous roots, and the fixation of nitrogen by the bacteria, were simultaneously discovered by the German agronomist Hermann Hellriegel and the Dutch microbiologist Martinus Beijerinck.[270]
Crop rotation, mechanisation, chemical and natural fertilisers led to a doubling of wheat yields in western Europe between 1800 and 1900.[275]
Studies of soil formation
[edit]The scientists who studied the soil in connection with agricultural practices had considered it mainly as a static substrate. However, soil is the result of evolution from more ancient geological materials, under the action of biotic and abiotic processes. After studies of the improvement of the soil commenced, other researchers began to study soil genesis and as a result also soil types and classifications.
In 1860, while in Mississippi, Eugene W. Hilgard (1833–1916) studied the relationship between rock material, climate, vegetation, and the type of soils that were developed. He realised that the soils were dynamic, and considered the classification of soil types.[276] (See also at Project Gutenberg). His work was not continued. At about the same time, Friedrich Albert Fallou was describing soil profiles and relating soil characteristics to their formation as part of his professional work evaluating forest and farm land for the principality of Saxony. His 1857 book, Anfangsgründe der Bodenkunde (First principles of soil science), established modern soil science.[277] Contemporary with Fallou's work, and driven by the same need to accurately assess land for equitable taxation, Vasily Dokuchaev led a team of soil scientists in Russia who conducted an extensive survey of soils, observing that similar basic rocks, climate and vegetation types lead to similar soil layering and types, and established the concepts for soil classifications. Due to language barriers, the work of this team was not communicated to western Europe until 1914 through a publication in German by Konstantin Glinka, a member of the Russian team.[278]
Curtis F. Marbut, influenced by the work of the Russian team, translated Glinka's publication into English,[279] and, as he was placed in charge of the U.S. National Cooperative Soil Survey, applied it to a national soil classification system.[263]
See also
[edit]- Acid sulfate soil
- Agricultural science
- Agrophysics
- Crust
- Factors affecting permeability of soils
- Index of soil-related articles
- Lunar soil and martian soil
- Mycorrhizal fungi and soil carbon storage
- Red soil
- Shrink–swell capacity
- Soil biodiversity
- Soil liquefaction
- Soil moisture velocity equation
- Soil zoology
- Tillage erosion
- World Soil Museum
References
[edit]- ^ Voroney, R. Paul; Heck, Richard J. (2007). "The soil habitat". In Paul, Eldor A. (ed.). Soil microbiology, ecology and biochemistry (3rd ed.). Amsterdam, the Netherlands: Elsevier. pp. 25–49. doi:10.1016/B978-0-08-047514-1.50006-8. ISBN 978-0-12-546807-7. Archived (PDF) from the original on 10 July 2018. Retrieved 27 March 2022.
- ^ Taylor, Sterling A.; Ashcroft, Gaylen L. (1972). Physical edaphology: the physics of irrigated and nonirrigated soils. San Francisco, California: W.H. Freeman. ISBN 978-0-7167-0818-6.
- ^ McCarthy, David F. (2014). Essentials of soil mechanics and foundations: basic geotechnics (7th ed.). London, United Kingdom: Pearson. ISBN 9781292039398. Archived from the original on 16 October 2022. Retrieved 27 March 2022.
- ^ Gilluly, James; Waters, Aaron Clement; Woodford, Alfred Oswald (1975). Principles of geology (4th ed.). San Francisco, California: W.H. Freeman. ISBN 978-0-7167-0269-6.
- ^ Huggett, Richard John (2011). "What is geomorphology?". Fundamentals of geomorphology. Routledge Fundamentals of Physical Geography Series (3rd ed.). London, United Kingdom: Routledge. pp. 148–150. ISBN 978-0-203-86008-3. Retrieved 16 October 2022.[permanent dead link]
- ^ Ponge, Jean-François (2015). "The soil as an ecosystem". Biology and Fertility of Soils. 51 (6): 645–648. Bibcode:2015BioFS..51..645P. doi:10.1007/s00374-015-1016-1. S2CID 18251180. Retrieved 3 April 2022.
- ^ Yu, Charley; Kamboj, Sunita; Wang, Cheng; Cheng, Jing-Jy (2015). "Data collection handbook to support modeling impacts of radioactive material in soil and building structures" (PDF). Argonne National Laboratory. pp. 13–21. Archived (PDF) from the original on 4 August 2018. Retrieved 3 April 2022.
- ^ Jump up to: a b Buol, Stanley W.; Southard, Randal J.; Graham, Robert C.; McDaniel, Paul A. (2011). Soil genesis and classification (6th ed.). Ames, Iowa: Wiley-Blackwell. ISBN 978-0-470-96060-8. Archived from the original on 22 April 2023. Retrieved 3 April 2022.
- ^ Retallack, Gregory J.; Krinsley, David H.; Fischer, Robert; Razink, Joshua J.; Langworthy, Kurt A. (2016). "Archean coastal-plain paleosols and life on land" (PDF). Gondwana Research. 40: 1–20. Bibcode:2016GondR..40....1R. doi:10.1016/j.gr.2016.08.003. Archived (PDF) from the original on 13 November 2018. Retrieved 3 April 2022.
- ^ Chesworth, Ward, ed. (2008). Encyclopedia of soil science (1st ed.). Dordrecht, The Netherlands: Springer. ISBN 978-1-4020-3994-2. Archived (PDF) from the original on 5 September 2018. Retrieved 27 March 2022.
- ^ "Glossary of terms in soil science". Agriculture and Agri-Food Canada. 13 December 2013. Archived from the original on 27 October 2018. Retrieved 3 April 2022.
- ^ Amundson, Ronald. "Soil preservation and the future of pedology" (PDF). CiteSeerX 10.1.1.552.237. Archived from the original (PDF) on 12 June 2018.
- ^ Küppers, Michael; Vincent, Jean-Baptiste. "Impacts and formation of regolith". Max Planck Institute for Solar System Research. Archived from the original on 4 August 2018. Retrieved 3 April 2022.
- ^ Amelung, Wulf; Bossio, Deborah; De Vries, Wim; Kögel-Knabner, Ingrid; Lehmann, Johannes; Amundson, Ronald; Bol, Roland; Collins, Chris; Lal, Rattan; Leifeld, Jens; Minasny, Buniman; Pan, Gen-Xing; Paustian, Keith; Rumpel, Cornelia; Sanderman, Jonathan; Van Groeningen, Jan Willem; Mooney, Siân; Van Wesemael, Bas; Wander, Michelle; Chabbi, Abad (27 October 2020). "Towards a global-scale soil climate mitigation strategy" (PDF). Nature Communications. 11 (1): 5427. Bibcode:2020NatCo..11.5427A. doi:10.1038/s41467-020-18887-7. ISSN 2041-1723. PMC 7591914. PMID 33110065. Retrieved 3 April 2022.
- ^ Pouyat, Richard; Groffman, Peter; Yesilonis, Ian; Hernandez, Luis (2002). "Soil carbon pools and fluxes in urban ecosystems". Environmental Pollution. 116 (Supplement 1): S107–S118. doi:10.1016/S0269-7491(01)00263-9. PMID 11833898. Retrieved 3 April 2022.
Our analysis of pedon data from several disturbed soil profiles suggests that physical disturbances and anthropogenic inputs of various materials (direct effects) can greatly alter the amount of C stored in these human "made" soils.
- ^ Davidson, Eric A.; Janssens, Ivan A. (2006). "Temperature sensitivity of soil carbon decomposition and feedbacks to climate change" (PDF). Nature. 440 (9 March 2006): 165‒73. Bibcode:2006Natur.440..165D. doi:10.1038/nature04514. PMID 16525463. S2CID 4404915. Retrieved 3 April 2022.
- ^ Powlson, David (2005). "Will soil amplify climate change?". Nature. 433 (20 January 2005): 204‒05. Bibcode:2005Natur.433..204P. doi:10.1038/433204a. PMID 15662396. S2CID 35007042. Archived from the original on 22 September 2022. Retrieved 3 April 2022.
- ^ Bradford, Mark A.; Wieder, William R.; Bonan, Gordon B.; Fierer, Noah; Raymond, Peter A.; Crowther, Thomas W. (2016). "Managing uncertainty in soil carbon feedbacks to climate change" (PDF). Nature Climate Change. 6 (27 July 2016): 751–758. Bibcode:2016NatCC...6..751B. doi:10.1038/nclimate3071. hdl:20.500.11755/c1792dbf-ce96-4dc7-8851-1ca50a35e5e0. S2CID 43955196. Archived from the original (PDF) on 10 April 2017. Retrieved 3 April 2022.
- ^ Dominati, Estelle; Patterson, Murray; Mackay, Alec (2010). "A framework for classifying and quantifying the natural capital and ecosystem services of soils". Ecological Economics. 69 (9): 1858‒68. Bibcode:2010EcoEc..69.1858D. doi:10.1016/j.ecolecon.2010.05.002. Archived (PDF) from the original on 8 August 2017. Retrieved 10 April 2022.
- ^ Dykhuizen, Daniel E. (1998). "Santa Rosalia revisited: why are there so many species of bacteria?". Antonie van Leeuwenhoek. 73 (1): 25‒33. doi:10.1023/A:1000665216662. PMID 9602276. S2CID 17779069. Retrieved 10 April 2022.
- ^ Torsvik, Vigdis; Øvreås, Lise (2002). "Microbial diversity and function in soil: from genes to ecosystems". Current Opinion in Microbiology. 5 (3): 240‒45. doi:10.1016/S1369-5274(02)00324-7. PMID 12057676. Retrieved 10 April 2022.
- ^ Raynaud, Xavier; Nunan, Naoise (2014). "Spatial ecology of bacteria at the microscale in soil". PLOS ONE. 9 (1): e87217. Bibcode:2014PLoSO...987217R. doi:10.1371/journal.pone.0087217. PMC 3905020. PMID 24489873.
- ^ Whitman, William B.; Coleman, David C.; Wiebe, William J. (1998). "Prokaryotes: the unseen majority". Proceedings of the National Academy of Sciences of the USA. 95 (12): 6578‒83. Bibcode:1998PNAS...95.6578W. doi:10.1073/pnas.95.12.6578. PMC 33863. PMID 9618454.
- ^ Schlesinger, William H.; Andrews, Jeffrey A. (2000). "Soil respiration and the global carbon cycle". Biogeochemistry. 48 (1): 7‒20. doi:10.1023/A:1006247623877. S2CID 94252768. Retrieved 10 April 2022.
- ^ Denmead, Owen Thomas; Shaw, Robert Harold (1962). "Availability of soil water to plants as affected by soil moisture content and meteorological conditions". Agronomy Journal. 54 (5): 385‒90. Bibcode:1962AgrJ...54..385D. doi:10.2134/agronj1962.00021962005400050005x. Retrieved 10 April 2022.
- ^ House, Christopher H.; Bergmann, Ben A.; Stomp, Anne-Marie; Frederick, Douglas J. (1999). "Combining constructed wetlands and aquatic and soil filters for reclamation and reuse of water". Ecological Engineering. 12 (1–2): 27–38. Bibcode:1999EcEng..12...27H. doi:10.1016/S0925-8574(98)00052-4. Retrieved 10 April 2022.
- ^ Van Bruggen, Ariena H.C.; Semenov, Alexander M. (2000). "In search of biological indicators for soil health and disease suppression". Applied Soil Ecology. 15 (1): 13–24. Bibcode:2000AppSE..15...13V. doi:10.1016/S0929-1393(00)00068-8. Retrieved 10 April 2022.
- ^ "Community guide to monitored natural attenuation" (PDF). Retrieved 10 April 2022.
- ^ Linn, Daniel Myron; Doran, John W. (1984). "Effect of water-filled pore space on carbon dioxide and nitrous oxide production in tilled and nontilled soils". Soil Science Society of America Journal. 48 (6): 1267–1272. Bibcode:1984SSASJ..48.1267L. doi:10.2136/sssaj1984.03615995004800060013x. Archived from the original on 18 March 2023. Retrieved 10 April 2022.
- ^ Gregory, Peter J.; Nortcliff, Stephen (2013). Soil conditions and plant growth. Hoboken, New Jersey: Wiley-Blackwell. ISBN 9781405197700. Archived from the original on 22 April 2023. Retrieved 10 April 2022.
- ^ Bot, Alexandra; Benites, José (2005). The importance of soil organic matter: key to drought-resistant soil and sustained food and production (PDF). Rome: Food and Agriculture Organization of the United Nations. ISBN 978-92-5-105366-9. Retrieved 10 April 2022.
- ^ McClellan, Tai. "Soil composition". University of Hawaiʻi at Mānoa, College of Tropical Agriculture and Human Resources. Retrieved 18 April 2022.
- ^ "Arizona Master Gardener Manual". Cooperative Extension, College of Agriculture, University of Arizona. 9 November 2017. Archived from the original on 29 May 2016. Retrieved 17 December 2017.
- ^ Jump up to: a b Vannier, Guy (1987). "The porosphere as an ecological medium emphasized in Professor Ghilarov's work on soil animal adaptations" (PDF). Biology and Fertility of Soils. 3 (1): 39–44. doi:10.1007/BF00260577. S2CID 297400. Retrieved 18 April 2022.
- ^ Torbert, H. Allen; Wood, Wes (1992). "Effect of soil compaction and water-filled pore space on soil microbial activity and N losses". Communications in Soil Science and Plant Analysis. 23 (11): 1321‒31. Bibcode:1992CSSPA..23.1321T. doi:10.1080/00103629209368668. Retrieved 18 April 2022.
- ^ Simonson 1957, p. 17.
- ^ Zanella, Augusto; Katzensteiner, Klaus; Ponge, Jean-François; Jabiol, Bernard; Sartori, Giacomo; Kolb, Eckart; Le Bayon, Renée-Claire; Aubert, Michaël; Ascher-Jenull, Judith; Englisch, Michael; Hager, Herbert (June 2019). "TerrHum: an iOS App for classifying terrestrial humipedons and some considerations about soil classification". Soil Science Society of America Journal. 83 (S1): S42–S48. doi:10.2136/sssaj2018.07.0279. hdl:11577/3315165. S2CID 197555747. Retrieved 18 April 2022.
- ^ Bronick, Carol J.; Lal, Ratan (January 2005). "Soil structure and management: a review" (PDF). Geoderma. 124 (1–2): 3–22. Bibcode:2005Geode.124....3B. doi:10.1016/j.geoderma.2004.03.005. Retrieved 18 April 2022.
- ^ "Soil and water". Food and Agriculture Organization of the United Nations. Retrieved 18 April 2022.
- ^ Valentin, Christian; d'Herbès, Jean-Marc; Poesen, Jean (1999). "Soil and water components of banded vegetation patterns". Catena. 37 (1): 1‒24. Bibcode:1999Caten..37....1V. doi:10.1016/S0341-8162(99)00053-3. Retrieved 18 April 2022.
- ^ Brady, Nyle C.; Weil, Ray R. (2007). "The colloidal fraction: seat of soil chemical and physical activity". In Brady, Nyle C.; Weil, Ray R. (eds.). The nature and properties of soils (14th ed.). London, United Kingdom: Pearson. pp. 310–357. ISBN 978-0132279383. Retrieved 18 April 2022.
- ^ "Soil colloids: properties, nature, types and significance" (PDF). Tamil Nadu Agricultural University. Retrieved 18 April 2022.
- ^ Miller, Jarrod O. "Soil pH affects nutrient availability". Retrieved 18 April 2022.
- ^ Goulding, Keith W.T.; Bailey, Neal J.; Bradbury, Nicola J.; Hargreaves, Patrick; Howe, M.T.; Murphy, Daniel V.; Poulton, Paul R.; Willison, Toby W. (1998). "Nitrogen deposition and its contribution to nitrogen cycling and associated soil processes". New Phytologist. 139 (1): 49‒58. doi:10.1046/j.1469-8137.1998.00182.x.
- ^ Kononova, M.M. (2013). Soil organic matter: its nature, its role in soil formation and in soil fertility (2nd ed.). Amsterdam, the Netherlands: Elsevier. ISBN 978-1-4831-8568-2. Archived from the original on 22 March 2023. Retrieved 24 April 2022.
- ^ Burns, Richards G.; DeForest, Jared L.; Marxsen, Jürgen; Sinsabaugh, Robert L.; Stromberger, Mary E.; Wallenstein, Matthew D.; Weintraub, Michael N.; Zoppini, Annamaria (2013). "Soil enzymes in a changing environment: current knowledge and future directions". Soil Biology and Biochemistry. 58: 216‒34. Bibcode:2013SBiBi..58..216B. doi:10.1016/j.soilbio.2012.11.009. Retrieved 24 April 2022.
- ^ Sengupta, Aditi; Kushwaha, Priyanka; Jim, Antonia; Troch, Peter A.; Maier, Raina (2020). "New soil, old plants, and ubiquitous microbes: evaluating the potential of incipient basaltic soil to support native plant growth and influence belowground soil microbial community composition". Sustainability. 12 (10): 4209. doi:10.3390/su12104209.
- ^ Bishop, Janice L.; Murchie, Scott L.; Pieters, Carlé L.; Zent, Aaron P. (2002). "A model for formation of dust, soil, and rock coatings on Mars: physical and chemical processes on the Martian surface". Journal of Geophysical Research. 107 (E11): 7-1–7-17. Bibcode:2002JGRE..107.5097B. doi:10.1029/2001JE001581.
- ^ Navarro-González, Rafael; Rainey, Fred A.; Molina, Paola; Bagaley, Danielle R.; Hollen, Becky J.; de la Rosa, José; Small, Alanna M.; Quinn, Richard C.; Grunthaner, Frank J.; Cáceres, Luis; Gomez-Silva, Benito; McKay, Christopher P. (2003). "Mars-like soils in the Atacama desert, Chile, and the dry limit of microbial life". Science. 302 (5647): 1018–1021. Bibcode:2003Sci...302.1018N. doi:10.1126/science.1089143. PMID 14605363. S2CID 18220447. Retrieved 24 April 2022.
- ^ Guo, Yong; Fujimura, Reiko; Sato, Yoshinori; Suda, Wataru; Kim, Seok-won; Oshima, Kenshiro; Hattori, Masahira; Kamijo, Takashi; Narisawa, Kazuhiko; Ohta, Hiroyuki (2014). "Characterization of early microbial communities on volcanic deposits along a vegetation gradient on the island of Miyake, Japan". Microbes and Environments. 29 (1): 38–49. doi:10.1264/jsme2.ME13142. PMC 4041228. PMID 24463576.
- ^ Goldich, Samuel S. (1938). "A study in rock-weathering". The Journal of Geology. 46 (1): 17–58. Bibcode:1938JG.....46...17G. doi:10.1086/624619. ISSN 0022-1376. S2CID 128498195. Archived from the original on 27 March 2022. Retrieved 24 April 2022.
- ^ Van Schöll, Laura; Smits, Mark M.; Hoffland, Ellis (2006). "Ectomycorrhizal weathering of the soil minerals muscovite and hornblende". New Phytologist. 171 (4): 805–814. doi:10.1111/j.1469-8137.2006.01790.x. PMID 16918551.
- ^ Stretch, Rachelle C.; Viles, Heather A. (2002). "The nature and rate of weathering by lichens on lava flows on Lanzarote". Geomorphology. 47 (1): 87–94. Bibcode:2002Geomo..47...87S. doi:10.1016/S0169-555X(02)00143-5. Archived from the original on 22 April 2023. Retrieved 24 April 2022.
- ^ Dojani, Stephanie; Lakatos, Michael; Rascher, Uwe; Waneck, Wolfgang; Luettge, Ulrich; Büdel, Burkhard (2007). "Nitrogen input by cyanobacterial biofilms of an inselberg into a tropical rainforest in French Guiana". Flora. 202 (7): 521–529. Bibcode:2007FMDFE.202..521D. doi:10.1016/j.flora.2006.12.001. Retrieved 21 March 2021.
- ^ Кабала, Цезарь; Кубич, Юстина (2012). «Первоначальное развитие почвы и накопление углерода на моренах быстро отступающего ледника Вереншельда, юго-запад Шпицбергена, архипелаг Шпицберген» . Геодерма . 175–176: 9–20. Бибкод : 2012Geode.175....9K . doi : 10.1016/j.geoderma.2012.01.025 . Проверено 24 апреля 2022 г.
- ^ Дженни, Ганс (1941). Факторы почвообразования: система количественного почвоведения (PDF) . Нью-Йорк: МакГроу-Хилл . Архивировано (PDF) из оригинала 8 августа 2017 года . Проверено 24 апреля 2022 г.
- ^ Риттер, Майкл Э. «Физическая среда: введение в физическую географию» (PDF) . Проверено 24 апреля 2022 г.
- ^ Гарднер, Катриона МК; Лария, Кофи Буна; Унгер, Пол В. (1999). Физические ограничения почвы для роста растений и растениеводства (PDF) (первое издание). Рим, Италия: Продовольственная и сельскохозяйственная организация Объединенных Наций . Архивировано из оригинала (PDF) 8 августа 2017 года.
- ^ Шесть, Йохан; Паустиан, Кейт; Эллиотт, Эдвард Т.; Комбринк, Клэй (2000). «Структура почвы и органическое вещество. I. Распределение агрегатных классов и агрегатно-связанного углерода» . Журнал Американского общества почвоведения . 64 (2): 681–689. Бибкод : 2000SSASJ..64..681S . дои : 10.2136/sssaj2000.642681x . Проверено 7 августа 2022 г.
- ^ Хоканссон, Инге; Липец, Ежи (2000). «Обзор полезности значений относительной объемной плотности в исследованиях структуры и уплотнения почвы» . Исследования почвы и обработки почвы . 53 (2): 71–85. Бибкод : 2000STilR..53...71H . дои : 10.1016/S0167-1987(99)00095-1 . S2CID 30045538 . Архивировано (PDF) из оригинала 16 мая 2022 года . Проверено 26 октября 2023 г.
- ^ Швердтфегер, Уильям Дж. (1965). «Удельное сопротивление грунта в связи с подземной коррозией и катодной защитой» (PDF) . Журнал исследований Национального бюро стандартов . 69С (1): 71–77. дои : 10.6028/jres.069c.012 . Проверено 7 августа 2022 г.
- ^ Тамболи, Прабхакар Махадео (1961). Влияние объемной плотности и размера агрегатов на удержание влаги в почве . Эймс, Айова: Университет штата Айова . Проверено 7 августа 2022 г.
- ^ Перейти обратно: а б Спен, Ева М.; Джоши, Жасмин; Шмид, Бернхард; Алфей, Йорн; Кернер, Кристиан (2000). «Влияние разнообразия растений на гетеротрофную активность почвы в экспериментальных пастбищных экосистемах» . Растение и почва . 224 (2): 217–230. дои : 10.1023/А:1004891807664 . S2CID 25639544 .
- ^ «Влагоемкость» . Университет штата Орегон . 24 июня 2016 года . Проверено 9 октября 2022 г.
Ирригаторы должны знать легкодоступную влагоемкость, чтобы можно было подавать воду до того, как растениям придется тратить чрезмерную энергию для извлечения влаги.
- ^ «Основы планирования полива» . Расширение Университета Миннесоты . Проверено 9 октября 2022 г.
Только часть доступной водоудерживающей способности легко используется культурой до того, как у нее разовьется водный дефицит.
- ^ Ци, Джинген; Маршалл, Джон Д.; Мэттсон, Ким Г. (1994). «Высокие концентрации углекислого газа в почве подавляют корневое дыхание пихты Дугласа» . Новый фитолог . 128 (3): 435–442. дои : 10.1111/j.1469-8137.1994.tb02989.x . PMID 33874575 .
- ^ Карберг, Ной Дж.; Прегитцер, Курт С.; Кинг, Джон С.; Друг, Аарон Л.; Вуд, Джеймс Р. (2005). «Парциальное давление углекислого газа в почве и химия растворенных неорганических карбонатов в условиях повышенного содержания углекислого газа и озона» . Экология . 142 (2): 296–306. Бибкод : 2005Oecol.142..296K . дои : 10.1007/s00442-004-1665-5 . ПМИД 15378342 . S2CID 6161016 . Проверено 13 ноября 2022 г.
- ^ Чанг, ХТ; Лумис, Уолтер Э. (1945). «Влияние углекислого газа на поглощение корнями воды и питательных веществ» . Физиология растений . 20 (2): 221–232. дои : 10.1104/стр.20.2.221 . ПМК 437214 . ПМИД 16653979 .
- ^ Макдауэлл, Нейт Дж.; Маршалл, Джон Д.; Ци, Джинген; Мэттсон, Ким (1999). «Прямое ингибирование поддерживающего дыхания у корней болиголова западного, подвергшихся воздействию концентраций углекислого газа в почве» . Физиология дерева . 19 (9): 599–605. дои : 10.1093/treephys/19.9.599 . ПМИД 12651534 .
- ^ Сюй, Ся; Нибер, Джон Л.; Гупта, Сатиш К. (1992). «Влияние уплотнения на коэффициент газодиффузии в грунтах» . Журнал Американского общества почвоведения . 56 (6): 1743–1750. Бибкод : 1992SSASJ..56.1743X . дои : 10.2136/sssaj1992.03615995005600060014x . Проверено 13 ноября 2022 г.
- ^ Перейти обратно: а б Смит, Кейт А.; Болл, Том; Конен, Франц; Добби, Карен Э.; Масшедер, Джонатан; Рей, Ана (2003). «Обмен парниковых газов между почвой и атмосферой: взаимодействие почвенных физических факторов и биологических процессов» . Европейский журнал почвоведения . 54 (4): 779–791. Бибкод : 2003EuJSS..54..779S . дои : 10.1046/j.1351-0754.2003.0567.x . S2CID 18442559 . Проверено 13 ноября 2022 г.
- ^ Рассел 1957 , стр. 35–36.
- ^ Русер, Райнер; Флесса, Хайнер; Руссов, Рольф; Шмидт, Г.; Бюггер, Франц; Мунк, Дж. К. (2006). «Эмиссия N 2 O, N 2 и CO 2 из почвы, удобренной селитрой: влияние уплотнения, влажности почвы и переувлажнения» . Биология и биохимия почвы . 38 (2): 263–274. doi : 10.1016/j.soilbio.2005.05.005 .
- ^ Хартманн, Адриан А.; Бухманн, Нина; Никлаус, Паскаль А. (2011). «Исследование регулирования поглощения почвенного метана на двух лугах, подверженных засухе и азотным удобрениям» (PDF) . Растение и почва . 342 (1–2): 265–275. Бибкод : 2011PlSoi.342..265H . дои : 10.1007/s11104-010-0690-x . hdl : 20.500.11850/34759 . S2CID 25691034 . Проверено 13 ноября 2022 г.
- ^ Мур, Тим Р.; Далва, Моше (1993). «Влияние температуры и положения зеркала грунтовых вод на выбросы углекислого газа и метана из лабораторных колонок торфяных почв» . Журнал почвоведения . 44 (4): 651–664. дои : 10.1111/j.1365-2389.1993.tb02330.x . Проверено 13 ноября 2022 г.
- ^ Хилтпольд, Иван; Топфер, Стефан; Кульманн, Ульрих; Терлингс, Тед СиДжей (2010). «Как летучие вещества корня кукурузы влияют на эффективность энтомопатогенных нематод в борьбе с западным кукурузным жуком?» . Химиоэкология . 20 (2): 155–162. Бибкод : 2010Checo..20..155H . дои : 10.1007/s00049-009-0034-6 . S2CID 30214059 . Проверено 13 ноября 2022 г.
- ^ Рю, Чунг Мин; Фараг, Мохаммед А.; Ху, Цзя-Хуэй; Редди, Лав С.; Вэй, Хань-Сюнь; Паре, Пол В.; Клоппер, Джозеф В. (2003). «Бактериальные летучие вещества способствуют росту арабидопсиса» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (8): 4927–4932. Бибкод : 2003PNAS..100.4927R . дои : 10.1073/pnas.0730845100 . ПМЦ 153657 . ПМИД 12684534 .
- ^ Хунг, Ричард; Ли, Саманта; Беннетт, Джоан В. (2015). «Грибные летучие органические соединения и их роль в экосистемах» . Прикладная микробиология и биотехнология . 99 (8): 3395–3405. дои : 10.1007/s00253-015-6494-4 . ПМИД 25773975 . S2CID 14509047 . Проверено 13 ноября 2022 г.
- ^ Пуррингтон, Фостер Форбс; Кендалл, Парисия А.; Батер, Джон Э.; Стиннер, Бенджамин Р. (1991). «Феромон тревоги у стадного подуроморфа коллемболана (Collembola: Hypogastruridae)» . Энтомолог Великих озер . 24 (2): 75–78 . Проверено 13 ноября 2022 г.
- ^ Бадри, Даякар В.; Вейр, Тиффани Л.; Ван дер Лели, Дэниел; Виванко, Хорхе М (2009). «Химические диалоги ризосферы: взаимодействие растений и микробов» (PDF) . Современное мнение в области биотехнологии . 20 (6): 642–650. дои : 10.1016/j.copbio.2009.09.014 . ПМИД 19875278 . Архивировано из оригинала (PDF) 21 сентября 2022 года . Проверено 13 ноября 2022 г.
- ^ Лосось, Сандрин; Понг, Жан-Франсуа (2001). «Экскременты дождевых червей привлекают почвенных ногохвосток: лабораторные эксперименты на Heteromurus nitidus (Collembola: Entomobryidae)» . Биология и биохимия почвы . 33 (14): 1959–1969. Бибкод : 2001SBiBi..33.1959S . дои : 10.1016/S0038-0717(01)00129-8 . S2CID 26647480 . Проверено 13 ноября 2022 г.
- ^ Ламберс, Ганс; Мугель, Кристоф; Жайар, Бенуа; Хинсингер, Филипп (2009). «Взаимодействие растений, микробов и почвы в ризосфере: эволюционная перспектива» . Растение и почва . 321 (1–2): 83–115. Бибкод : 2009ПлСой.321...83Л . дои : 10.1007/s11104-009-0042-x . S2CID 6840457 . Проверено 13 ноября 2022 г.
- ^ Пенуэлас, Джозеф; Асенсио, Долорес; Толл, Доротея; Венке, Кэтрин; Розенкранц, Мэри; Пьечулла, Биргит; Шницлер, Джордж-Петтер (2014). «Биогенные летучие выбросы из почвы» . Растение, клетка и окружающая среда . 37 (8): 1866–1891. дои : 10.1111/шт.12340 . ПМИД 24689847 .
- ^ Бузулесиу, Сэмюэл А.; Крейн, Дерек П.; Паркер, Скотт Л. (2016). «Запах раскопанной почвы как обонятельный сигнал, используемый енотами для обнаружения гнезд черепах с ромбовидной спиной (Malaclemys terrapin)» (PDF) . Герпетологическая охрана и биология . 11 (3): 539–551 . Проверено 27 ноября 2022 г.
- ^ Сакстон, Кейт Э.; Роулз, Уолтер Дж. (2006). «Оценка характеристик почвенных вод по текстуре и органическому веществу для гидрологических растворов» (PDF) . Журнал Американского общества почвоведения . 70 (5): 1569–1578. Бибкод : 2006SSASJ..70.1569S . дои : 10.2136/sssaj2005.0117 . S2CID 16826314 . Архивировано (PDF) из оригинала 2 сентября 2018 г. Проверено 15 января 2023 г.
- ^ Колледж тропического сельского хозяйства и человеческих ресурсов . «Минералогия почвы» . Гавайский университет в Маноа . Проверено 15 января 2023 г.
- ^ Энтони, Марк А.; Бендер, С. Франц; ван дер Хейден, Марсель Г.А. (15 августа 2023 г.). «Подсчет биоразнообразия почвы» . Труды Национальной академии наук . 120 (33): e2304663120. Бибкод : 2023PNAS..12004663A . дои : 10.1073/pnas.2304663120 . ISSN 0027-8424 . ПМЦ 10437432 . ПМИД 37549278 .
- ^ Спозито, Гаррисон (1984). Поверхностная химия почв . Нью-Йорк: Издательство Оксфордского университета . Проверено 15 января 2023 г.
- ^ Винот, Кристофер. «Теория диффузии в коллоидных суспензиях» . Проверено 15 января 2023 г.
- ^ Донахью, Миллер и Шиклуна 1977 , стр. 103–106.
- ^ Спозито, гарнизон; Шкипер, Нил Т.; Саттон, Ребекка; Пак, Сон Хо; Сопер, Алан К.; Грейтхаус, Джеффри А. (1999). «Поверхностная геохимия глинистых минералов» . Труды Национальной академии наук Соединенных Штатов Америки . 96 (7): 3358–3364. Бибкод : 1999PNAS...96.3358S . дои : 10.1073/pnas.96.7.3358 . ПМК 34275 . ПМИД 10097044 .
- ^ Бикмор, Барри Р.; Россо, Кевин М.; Надь, Кэтрин Л.; Сайган, Рэндалл Т.; Таданье, Кристофер Дж. (2003). «Ab initio определение краевых поверхностных структур диоктаэдрических филлосиликатов 2: 1: значение кислотно-основной реакционной способности» (PDF) . Глины и глинистые минералы . 51 (4): 359–371. Бибкод : 2003CCM....51..359B . дои : 10.1346/CCMN.2003.0510401 . S2CID 97428106 . Проверено 15 января 2023 г.
- ^ Раджамати, Майкл; Томас, Грейс С.; Камат, П. Вишну (2001). «Множество способов изготовления анионных глин» . Журнал химических наук . 113 (5–6): 671–680. дои : 10.1007/BF02708799 . S2CID 97507578 . Проверено 15 января 2023 г.
- ^ Моайеди, Хосейн; Каземян, Сина (2012). «Дзета-потенциалы взвешенного гумуса в поливалентном катионном солевом растворе и его влияние на поведение электроосомоза» . Журнал дисперсионной науки и технологий . 34 (2): 283–294. дои : 10.1080/01932691.2011.646601 . S2CID 94333872 . Проверено 15 января 2023 г.
- ^ Петтит, Роберт Э. «Органические вещества, гумус, гумат, гуминовая кислота, фульвокислота и гумин: их значение для плодородия почвы и здоровья растений» (PDF) . Проверено 15 января 2023 г.
- ^ Даймонд, Сидни; Кинтер, Эрл Б. (1965). «Механизмы стабилизации почвы известью: интерпретационный обзор» (PDF) . Отчет о дорожных исследованиях . 92 : 83–102 . Проверено 15 января 2023 г.
- ^ Вудрафф, Кларенс М. (1955). «Энергии замещения кальция калием в почвах» (PDF) . Журнал Американского общества почвоведения . 19 (2): 167–171. Бибкод : 1955SSASJ..19..167W . дои : 10.2136/sssaj1955.03615995001900020014x . Проверено 15 января 2023 г.
- ^ Фроней, Стуре (1953). «О применении закона действующих масс к катионообменному равновесию» . Acta Chemica Scandinavica . 7 : 469–480. doi : 10.3891/acta.chem.scand.07-0469 .
- ^ Болланд, Майк Д.А.; Познер, Алан М.; Квирк, Джеймс П. (1980). «РН-независимые и рН-зависимые поверхностные заряды каолинита» . Глины и глинистые минералы . 28 (6): 412–418. Бибкод : 1980CCM....28..412B . дои : 10.1346/CCMN.1980.0280602 . S2CID 12462516 . Проверено 15 января 2023 г.
- ^ Чакраборти, Мегна (8 августа 2022 г.). «Что такое катионообменная емкость почв?» . Проверено 15 января 2023 г.
- ^ Зильбер, Авнер; Левкович, Ирит; Грабер, Эллен Р. (2010). «РН-зависимое высвобождение минералов и поверхностные свойства биоугля кукурузной соломы: агрономические последствия» . Экологические науки и технологии . 44 (24): 9318–23. Бибкод : 2010EnST...44.9318S . дои : 10.1021/es101283d . ПМИД 21090742 . Проверено 15 января 2023 г.
- ^ Дакора, Феликс Д.; Филлипс, Дональд Д. (2002). «Корневые экссудаты как медиаторы усвоения минералов в средах с низким содержанием питательных веществ» . Растение и почва . 245 : 35–47. дои : 10.1023/А:1020809400075 . S2CID 3330737 . Архивировано (PDF) из оригинала 19 августа 2019 года . Проверено 15 января 2023 г.
- ^ Браун, Джон К. (1978). «Механизм усвоения железа растениями» . Растение, клетка и окружающая среда . 1 (4): 249–257. дои : 10.1111/j.1365-3040.1978.tb02037.x . Проверено 29 января 2023 г. [ постоянная мертвая ссылка ]
- ^ Донахью, Миллер и Шиклуна 1977 , стр. 114.
- ^ Сингх, Джамуна Шаран; Рагубанши, Ахилеш Сингх; Сингх, Радж С.; Шривастава, Южная Каролина (1989). «Микробная биомасса выступает источником питательных веществ для растений в сухих тропических лесах и саванне» . Природа . 338 (6215): 499–500. Бибкод : 1989Natur.338..499S . дои : 10.1038/338499a0 . S2CID 4301023 . Проверено 29 января 2023 г.
- ^ Шатаник-Клоц, Алисия; Шеремент, Юстина; Юзефачук, Гжегож (2017). «Роль клеточных стенок и пектинов в катионном обмене и площади поверхности корней растений» . Журнал физиологии растений . 215 : 85–90. Бибкод : 2017JPPhy.215...85S . дои : 10.1016/j.jplph.2017.05.017 . ПМИД 28600926 . Проверено 29 января 2023 г. [ постоянная мертвая ссылка ]
- ^ Перейти обратно: а б Донахью, Миллер и Шиклуна 1977 , стр. 115–116.
- ^ Перейти обратно: а б Хинсингер, Филипп (2001). «Биодоступность неорганического фосфора почвы в ризосфере под влиянием химических изменений, вызванных корнями: обзор» . Растение и почва . 237 (2): 173–95. дои : 10.1023/А:1013351617532 . S2CID 8562338 . Проверено 29 января 2023 г.
- ^ Гу, Баохуа; Шульц, Роберт К. (1991). «Удержание анионов в почве: возможное применение для уменьшения миграции захороненного технеция и йода, обзор» . дои : 10.2172/5980032 . S2CID 91359494 . Проверено 29 января 2023 г.
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь ) - ^ Лауриненко, Михаил; Цзин, Дапенг; Баник, Чумки; Лэрд, Дэвид А. (2017). «Влияние предварительной обработки биомассы алюминием и железом на анионообменную способность биоугля» . Карбон . 118 : 422–30. Бибкод : 2017Carbo.118..422L . doi : 10.1016/j.carbon.2017.03.056 . Проверено 29 января 2023 г.
- ^ Соллинз, Филипп; Робертсон, Дж. Филип; Уэхара, Горо (1988). «Подвижность питательных веществ в почвах с переменным и постоянным зарядом» (PDF) . Биогеохимия . 6 (3): 181–99. Бибкод : 1988Biogc...6..181S . дои : 10.1007/BF02182995 . S2CID 4505438 . Проверено 29 января 2023 г.
- ^ Сандерс, WMH (1964). «Извлечение почвенных фосфатов анионообменной мембраной» . Новозеландский журнал сельскохозяйственных исследований . 7 (3): 427–31. Бибкод : 1964NZJAR...7..427S . дои : 10.1080/00288233.1964.10416423 .
- ^ Лауриненко, Майк; Лэрд, Дэвид А. (2015). «Анионообменная способность биоугля» . Зеленая химия . 17 (9): 4628–36. дои : 10.1039/C5GC00828J . S2CID 52972476 . Проверено 29 января 2023 г.
- ^ Робертсон, Брайан. «Требования к pH пресноводной флоры и фауны» (PDF) . Архивировано из оригинала (PDF) 8 мая 2021 года . Проверено 6 июня 2021 г.
- ^ Чанг, Раймонд, изд. (2010). Химия (12-е изд.). Нью-Йорк, Нью-Йорк: МакГроу-Хилл . п. 666. ИСБН 9780078021510 . Проверено 6 июня 2021 г.
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Синглтон, Питер Л.; Эдмидс, Дуг К.; Смарт, РЭ; Уилер, Дэвид М. (2001). «Множество способов изготовления анионных глин» . Журнал химических наук . 113 (5–6): 671–680. дои : 10.1007/BF02708799 . S2CID 97507578 .
- ^ Лаухли, Андре; Граттан, Стив Р. (2012). «Крайние значения pH почвы» . В Шабале, Сергей (ред.). Физиология стресса растений (1-е изд.). Уоллингфорд, Великобритания: CAB International . стр. 194–209. дои : 10.1079/9781845939953.0194 . ISBN 978-1845939953 . Проверено 13 июня 2021 г.
- ^ Донахью, Миллер и Шиклуна 1977 , стр. 116–117.
- ^ Кальмано, Вольфганг; Хун, Цзихуа; Фёрстнер, Ульрих (1993). «Связывание и мобилизация тяжелых металлов в загрязненных отложениях под влиянием pH и окислительно-восстановительного потенциала» . Водные науки и технологии . 28 (8–9): 223–235. дои : 10.2166/wst.1993.0622 . Проверено 13 июня 2021 г.
- ^ Рен, Сяоя; Цзэн, Гуанмин; Тан, Линь; Ван, Цзинцзин; Ван, Цзя; Лю, Яни; Ю, Цзянфан; Йи, Хуан; Йе, Шуцзин; Дэн, Жуй (2018). «Сорбция, транспорт и биоразложение: взгляд на биодоступность стойких органических загрязнителей в почве» (PDF) . Наука об общей окружающей среде . 610–611: 1154–1163. Бибкод : 2018ScTEn.610.1154R . doi : 10.1016/j.scitotenv.2017.08.089 . ПМИД 28847136 . Проверено 13 июня 2021 г.
- ^ Понг, Жан-Франсуа (2003). «Формы гумуса в наземных экосистемах: основа биоразнообразия» . Биология и биохимия почвы . 35 (7): 935–945. Бибкод : 2003SBiBi..35..935P . CiteSeerX 10.1.1.467.4937 . дои : 10.1016/S0038-0717(03)00149-4 . S2CID 44160220 . Проверено 13 июня 2021 г.
- ^ Фуджи, Кадзумичи (2003). «Закисление почвы и адаптации растений и микроорганизмов в тропических лесах Борнея» . Экологические исследования . 29 (3): 371–381. дои : 10.1007/s11284-014-1144-3 .
- ^ Кауппи, Пекка; Кямяри, Юха; Пош, Максимилиан; Кауппи, Леа (1986). «Подкисление лесных почв: разработка и применение модели для анализа воздействия кислотных выпадений в Европе» (PDF) . Экологическое моделирование . 33 (2–4): 231–253. Бибкод : 1986EcMod..33..231K . дои : 10.1016/0304-3800(86)90042-6 . Проверено 13 июня 2021 г.
- ^ Андрисс, Якобус Питер (1969). «Изучение среды обитания и особенностей тропических подзолов Саравака (Восточная Малайзия)» . Геодерма . 2 (3): 201–227. Бибкод : 1969Geode...2..201A . дои : 10.1016/0016-7061(69)90038-X . Проверено 13 июня 2021 г.
- ^ Ренгасами, Пичу (2006). «Мировое засоление с акцентом на Австралию» . Журнал экспериментальной ботаники . 57 (5): 1017–1023. дои : 10.1093/jxb/erj108 . ПМИД 16510516 .
- ^ Арнон, Дэниел И.; Джонсон, Кларенс М. (1942). «Влияние концентрации ионов водорода на рост высших растений в контролируемых условиях» . Физиология растений . 17 (4): 525–539. дои : 10.1104/стр.17.4.525 . ПМК 438054 . ПМИД 16653803 .
- ^ Чейни, Руфус Л.; Браун, Джон К.; Тиффин, Ли О. (1972). «Обязательное снижение содержания хелатов железа в усвоении железа соевыми бобами» . Физиология растений . 50 (2): 208–213. дои : 10.1104/стр.50.2.208 . ПМК 366111 . ПМИД 16658143 .
- ^ Донахью, Миллер и Шиклуна 1977 , стр. 116–119.
- ^ Ахмад, Сахир; Гафур, Абдул; Кадир, Мансур; Азиз, М. Аббас (2006). «Мелиорация известковой солончаковой почвы внесением гипса и различными севооборотами» . Международный журнал сельского хозяйства и биологии . 8 (2): 142–46 . Проверено 13 июня 2021 г.
- ^ Макфи, Уильям В.; Келли, Дж. Майкл; Бек, Роберт Х. (1977). «Влияние кислотных осадков на pH почвы и насыщенность обменных участков основаниями» . Загрязнение воды, воздуха и почвы . 7 (3): 4014–08. Бибкод : 1977WASP....7..401M . дои : 10.1007/BF00284134 .
- ^ Фарина, Мартин Патрик В.; Самнер, Малкольм Э.; Планк, К. Оуэн; Летч, В. Стивен (1980). «Обменный алюминий и pH как индикаторы потребности кукурузы в извести» . Журнал Американского общества почвоведения . 44 (5): 1036–1041. Бибкод : 1980SSASJ..44.1036F . дои : 10.2136/sssaj1980.03615995004400050033x . Проверено 20 июня 2021 г.
- ^ Донахью, Миллер и Шиклуна 1977 , стр. 119–120.
- ^ Спозито, гарнизон; Шкипер, Нил Т.; Саттон, Ребекка; Пак, Сун-Хо; Сопер, Алан К.; Грейтхаус, Джеффри А. (1999). «Поверхностная геохимия глинистых минералов» . Труды Национальной академии наук Соединенных Штатов Америки . 96 (7): 3358–3364. Бибкод : 1999PNAS...96.3358S . дои : 10.1073/pnas.96.7.3358 . ПМК 34275 . ПМИД 10097044 .
- ^ Спаркс, Дональд Л. «Кислые и основные почвы: буферизация» (PDF) . Дэвис, Калифорния: Калифорнийский университет, Дэвис , факультет земельных, воздушных и водных ресурсов . Проверено 20 июня 2021 г.
- ^ Ульрих, Бернхард (1983). «Кислотность почвы и ее связь с кислотными отложениями» (PDF) . У Ульриха, Бернхарда; Панкрат, Юрген (ред.). Эффекты накопления загрязнителей воздуха в лесных экосистемах (1-е изд.). Дордрехт, Нидерланды: Издательство D. Reidel . стр. 127–146. дои : 10.1007/978-94-009-6983-4_10 . ISBN 978-94-009-6985-8 . Проверено 21 июня 2021 г.
- ^ Донахью, Миллер и Шиклуна 1977 , стр. 120–121.
- ^ Донахью, Миллер и Шиклуна 1977 , стр. 125.
- ^ Дин 1957 , с. 80.
- ^ Рассел 1957 , стр. 123–125.
- ^ Перейти обратно: а б Вейл, Рэй Р.; Брэди, Найл К. (2016). Природа и свойства почв (15-е изд.). Река Аппер-Сэддл, Нью-Джерси: Пирсон . ISBN 978-0133254488 . Архивировано из оригинала 10 декабря 2023 года . Проверено 10 декабря 2023 г.
- ^ Ван дер Плог, Риенк Р.; Бём, Вольфганг; Киркхэм, Мэри Бет (1999). «О происхождении теории минерального питания растений и закона минимума» . Журнал Американского общества почвоведения . 63 (5): 1055–1062. Бибкод : 1999SSASJ..63.1055V . CiteSeerX 10.1.1.475.7392 . дои : 10.2136/sssaj1999.6351055x .
- ^ Кнехт, Магнус Ф.; Йоранссон, Андерс (2004). «Наземные растения требуют питательных веществ в аналогичных пропорциях» . Физиология дерева . 24 (4): 447–460. дои : 10.1093/treephys/24.4.447 . ПМИД 14757584 .
- ^ Дин 1957 , стр. 80–81.
- ^ Перейти обратно: а б Рой, Р.Н.; Финк, Арнольд; Блэр, Грэм Дж.; Тандон, Хари Лал Сингх (2006). «Плодородие почвы и растениеводство» (PDF) . Питание растений для продовольственной безопасности: руководство по комплексному управлению питательными веществами . Рим, Италия: Продовольственная и сельскохозяйственная организация Объединенных Наций . стр. 43–90. ISBN 978-92-5-105490-1 . Проверено 17 декабря 2023 г.
- ^ Парфитт, Роджер Л.; Гилтрап, Донна Дж.; Уиттон, Джо С. (1995). «Вклад органического вещества и глинистых минералов в катионообменную способность почвы» . Сообщения в области почвоведения и анализа растений . 26 (9–10): 1343–55. Бибкод : 1995CSSPA..26.1343P . дои : 10.1080/00103629509369376 . Проверено 17 декабря 2023 г.
- ^ Гайнос, Мечислав; Йозефачук, Гжегож; Соколовская, Зофья; Грайффенхаген, Андреас; Вессолек, Герд (2003). «Влагозапас, поверхностные и структурные свойства песчано-лесогумусовых горизонтов» . Журнал питания растений и почвоведения . 166 (5): 625–34. Бибкод : 2003JPNSS.166..625H . дои : 10.1002/jpln.200321161 . Проверено 17 декабря 2023 г.
- ^ Донахью, Миллер и Шиклуна 1977 , стр. 123–131.
- ^ Пиментел, Дэвид; Харви, Селия; Ресосудармо, Прадня; Синклер, К.; Курц, Д.; Макнейр, М.; Крист, С.; Шприц, Л.; Фиттон, Л.; Сафури, Р.; Блер, Р. (1995). «Экологические и экономические издержки эрозии почвы и природоохранные выгоды» . Наука . 267 (5201): 1117–23. Бибкод : 1995Sci...267.1117P . дои : 10.1126/science.267.5201.1117 . ПМИД 17789193 . S2CID 11936877 . Архивировано (PDF) из оригинала 13 декабря 2016 года . Проверено 4 июля 2021 г.
- ^ Шнюрер, Йохан; Клархольм, Марианна; Россволл, Томас (1985). «Микробная биомасса и активность в сельскохозяйственной почве с различным содержанием органического вещества» . Биология и биохимия почвы . 17 (5): 611–618. Бибкод : 1985SBiBi..17..611S . дои : 10.1016/0038-0717(85)90036-7 . Проверено 4 июля 2021 г.
- ^ Спарлинг, Грэм П. (1992). «Отношение углерода микробной биомассы к органическому углероду почвы как чувствительный индикатор изменений органического вещества почвы» . Австралийский журнал почвенных исследований . 30 (2): 195–207. дои : 10.1071/SR9920195 . Проверено 4 июля 2021 г.
- ^ Варадачари, Чандрика; Гош, Кунал (1984). «Об образовании гумуса» . Растение и почва . 77 (2): 305–313. Бибкод : 1984ПлСой..77..305В . дои : 10.1007/BF02182933 . S2CID 45102095 .
- ^ Прескотт, Синди Э. (2010). «Разложение подстилки: что контролирует его и как мы можем изменить его, чтобы изолировать больше углерода в лесных почвах?» . Биогеохимия . 101 (1): 133–q49. Бибкод : 2010Biogc.101..133P . дои : 10.1007/s10533-010-9439-0 . S2CID 93834812 .
- ^ Леманн, Йоханнес; Клебер, Маркус (2015). «Спорная природа органического вещества почвы» (PDF) . Природа . 528 (7580): 60–68. Бибкод : 2015Natur.528...60L . дои : 10.1038/nature16069 . ПМИД 26595271 . S2CID 205246638 . Проверено 4 июля 2021 г.
- ^ Перейти обратно: а б Пикколо, Алессандро (2002). «Супрамолекулярная структура гуминовых веществ: новое понимание химии гумуса и значение для почвоведения» . Достижения в агрономии . 75 : 57–134. дои : 10.1016/S0065-2113(02)75003-7 . ISBN 9780120007936 . Проверено 4 июля 2021 г.
- ^ Шеу, Стефан (2002). «Почвенная пищевая сеть: структура и перспективы» . Европейский журнал почвенной биологии . 38 (1): 11–20. Бибкод : 2002EJSB...38...11S . дои : 10.1016/S1164-5563(01)01117-7 . Проверено 4 июля 2021 г.
- ^ Перейти обратно: а б Фот, Генри Д. (1984). Основы почвоведения (PDF) (8-е изд.). Нью-Йорк, Нью-Йорк: Уайли. п. 139. ИСБН 978-0471522799 . Архивировано из оригинала (PDF) 12 ноября 2020 года . Проверено 4 июля 2021 г.
- ^ Перейти обратно: а б с Понг, Жан-Франсуа (2003). «Формы гумуса в наземных экосистемах: основа биоразнообразия» . Биология и биохимия почвы . 35 (7): 935–945. Бибкод : 2003SBiBi..35..935P . CiteSeerX 10.1.1.467.4937 . дои : 10.1016/S0038-0717(03)00149-4 . S2CID 44160220 . Архивировано из оригинала 29 января 2016 года.
- ^ Петтит, Роберт Э. «Органические вещества, гумус, гумат, гуминовая кислота, фульвокислота и гумин: их значение для плодородия почвы и здоровья растений» (PDF) . Проверено 11 июля 2021 г.
- ^ Джи, Ронг; Капплер, Андреас; Брюн, Андреас (2000). «Превращение и минерализация синтетических 14 C-меченные гуминовые модельные соединения термитов, питающихся почвой». Soil Biology and Biochemistry . 32 (8–9): 1281–1291. CiteSeerX 10.1.1.476.9400 . doi : 10.1016/S0038-0717(00)00046-8 .
- ^ Древер, Джеймс И.; Вэнс, Джордж Ф. (1994). «Роль почвенных органических кислот в процессах выветривания минералов» (PDF) . В Питтмане, Эдвард Д.; Леван, Майкл Д. (ред.). Органические кислоты в геологических процессах . Берлин, Германия: Springer . стр. 138–161. дои : 10.1007/978-3-642-78356-2_6 . ISBN 978-3-642-78356-2 . Проверено 11 июля 2021 г.
- ^ Перейти обратно: а б Пикколо, Алессандро (1996). «Гумус и охрана почвы» . В Пикколо, Алессандро (ред.). Гуминовые вещества в наземных экосистемах . Амстердам, Нидерланды: Elsevier . стр. 225–264. дои : 10.1016/B978-044481516-3/50006-2 . ISBN 978-0-444-81516-3 . Проверено 11 июля 2021 г.
- ^ Варадачари, Чандрика; Гош, Кунал (1984). «Об образовании гумуса» . Растение и почва . 77 (2): 305–313. Бибкод : 1984ПлСой..77..305В . дои : 10.1007/BF02182933 . S2CID 45102095 . Проверено 11 июля 2021 г.
- ^ Мендонса, Эдуардо С.; Роуэлл, Дэвид Л. (1996). «Минеральные и органические фракции двух оксисолов и их влияние на эффективную катионообменную емкость» . Журнал Американского общества почвоведения . 60 (6): 1888–1892. Бибкод : 1996SSASJ..60.1888M . дои : 10.2136/sssaj1996.03615995006000060038x . Проверено 11 июля 2021 г.
- ^ Черт возьми, Тобиас; Фаччо, Грета; Рихтер, Майкл; Тони-Мейер, Линда (2013). «Сшивка белков, катализируемая ферментами» . Прикладная микробиология и биотехнология . 97 (2): 461–475. дои : 10.1007/s00253-012-4569-z . ПМЦ 3546294 . ПМИД 23179622 . Проверено 11 июля 2021 г.
- ^ Линч, Д.Л.; Линч, CC (1958). «Устойчивость белково-лигниновых комплексов, лигнинов и гуминовых кислот к микробному воздействию» (PDF) . Природа . 181 (4621): 1478–1479. Бибкод : 1958Natur.181.1478L . дои : 10.1038/1811478a0 . ПМИД 13552710 . S2CID 4193782 . Проверено 11 июля 2021 г.
- ^ Доусон, Лорна А.; Хиллер, Стивен (2010). «Измерение характеристик почвы для судебно-медицинской экспертизы» (PDF) . Анализ поверхности и интерфейса . 42 (5): 363–377. дои : 10.1002/sia.3315 . S2CID 54213404 . Архивировано из оригинала (PDF) 8 мая 2021 года . Проверено 18 июля 2021 г.
- ^ Манджайя, КМ; Кумар, Сарвендра; Сачдев, М.С.; Сачдев, П.; Датта, Южная Каролина (2010). «Изучение глинисто-органических комплексов» . Современная наука . 98 (7): 915–921 . Проверено 18 июля 2021 г.
- ^ Тенг, Бенни К.Г. (1982). «Взаимодействие глины и полимера: итоги и перспективы». Глины и глинистые минералы . 30 (1): 1–10. Бибкод : 1982CCM....30....1T . CiteSeerX 10.1.1.608.2942 . дои : 10.1346/CCMN.1982.0300101 . S2CID 98176725 .
- ^ Титджен, Тодд; Ветцель, Роберт Г. (2003). «Внеклеточные ферментно-глиняные минеральные комплексы: адсорбция ферментов, изменение активности ферментов и защита от фотодеградации» (PDF) . Водная экология . 37 (4): 331–339. Бибкод : 2003AqEco..37..331T . doi : 10.1023/B:AECO.0000007044.52801.6b . S2CID 6930871 . Проверено 18 июля 2021 г.
- ^ Тахир, Шермин; Маршнер, Петра (2017). «Добавка глины к песчаной почве: влияние типа и размера глины на доступность питательных веществ в песчаных почвах, дополненных остатками с различным соотношением C/N» . Педосфера . 27 (2): 293–305. Бибкод : 2017Pedos..27..293T . дои : 10.1016/S1002-0160(17)60317-5 . Проверено 18 июля 2021 г.
- ^ Мелеро, Себастьяна; Мадехон, Энграсия; Руис, Хуан Карлос; Эренсия, Хуан Франциско (2007). «Химические и биохимические свойства глинистой почвы в условиях засушливого земледелия под влиянием органических удобрений» . Европейский журнал агрономии . 26 (3): 327–334. Бибкод : 2007EuJAg..26..327M . дои : 10.1016/j.eja.2006.11.004 . Проверено 18 июля 2021 г.
- ^ Жоанисс, Жиль Д.; Брэдли, Роберт Л.; Престон, Кэролайн М.; Изгиб, Гэри Д. (2009). «Секвестрация почвенного азота в виде танинно-белковых комплексов может повысить конкурентоспособность лавра овечьего (Kalmia angustifolia) по сравнению с елью черной (Picea mariana)» . Новый фитолог . 181 (1): 187–198. дои : 10.1111/j.1469-8137.2008.02622.x . ПМИД 18811620 .
- ^ Фирер, Ной; Шимель, Джошуа П.; Кейтс, Рекс Г.; Цзоу, Цзипин (2001). «Влияние дубильных фракций тополя бальзамического на динамику углерода и азота в пойменных почвах тайги Аляски» . Биология и биохимия почвы . 33 (12–13): 1827–1839. Бибкод : 2001SBiBi..33.1827F . дои : 10.1016/S0038-0717(01)00111-0 . Проверено 18 июля 2021 г.
- ^ Пэн, Синьхуа; Хорн, Райнер (2007). «Анизотропная усадка и набухание некоторых органических и неорганических грунтов» . Европейский журнал почвоведения . 58 (1): 98–107. Бибкод : 2007EuJSS..58...98P . дои : 10.1111/j.1365-2389.2006.00808.x .
- ^ Ван, Ян; Амундсон, Рональд; Трамбмор, Сьюзен (1996). «Радиоуглеродное датирование органического вещества почвы» (PDF) . Четвертичные исследования . 45 (3): 282–288. Бибкод : 1996QuRes..45..282W . дои : 10.1006/qres.1996.0029 . S2CID 73640995 . Проверено 18 июля 2021 г.
- ^ Бродовски, Соня; Амелунг, Вульф; Хаумайер, Людвиг; Зех, Вольфганг (2007). «Вклад черного углерода в стабильный гумус в пахотных почвах Германии» . Геодерма . 139 (1–2): 220–228. Бибкод : 2007Geode.139..220B . doi : 10.1016/j.geoderma.2007.02.004 . Проверено 18 июля 2021 г.
- ^ Крискуоли, Ирен; Альберти, Джорджо; Баронти, Сильвия; Фавилли, Филиппо; Мартинес, Кристина; Кальцолари, Костанца; Пушедду, Эмануэла; Румпель, Корнелия; Виола, Роберто; Миглиетта, Франко (2014). «Связывание углерода и плодородие после столетнего внесения древесного угля в почву» . ПЛОС ОДИН . 9 (3): е91114. Бибкод : 2014PLoSO...991114C . дои : 10.1371/journal.pone.0091114 . ПМЦ 3948733 . ПМИД 24614647 .
- ^ Ким, Донг Джим; Варгас, Родриго; Бонд-Ламберти, Бен; Турецкий, Мерритт Р. (2012). «Влияние повторного увлажнения и оттаивания почвы на потоки почвенных газов: обзор современной литературы и предложения для будущих исследований» . Биогеонауки . 9 (7): 2459–2483. Бибкод : 2012BGeo....9.2459K . дои : 10.5194/bg-9-2459-2012 . Проверено 3 октября 2021 г.
- ^ Вагай, Рота; Майер, Лоуренс М.; Китаяма, Канехиро; Никер, Хайке (2008). «Климат и контроль исходного материала за хранением органических веществ в поверхностных почвах: трехбазовый подход с разделением по плотности» . Геодерма . 147 (1–2): 23–33. Бибкод : 2008Geode.147...23W . doi : 10.1016/j.geoderma.2008.07.010 . hdl : 10261/82461 . Проверено 25 июля 2021 г.
- ^ Минаева Татьяна Юрьевна; Трофимов Сергей Я.; Чичагова Ольга А.; Дорофеева Е.И.; Сирин, Андрей А.; Глушков Игорь Владимирович; Михайлов, Н.Д.; Кромер, Бернд (2008). «Накопление углерода в почвах лесных и болотных экосистем южного Валдая в голоцене» . Биологический вестник . 35 (5): 524–532. Бибкод : 2008BioBu..35..524M . дои : 10.1134/S1062359008050142 . S2CID 40927739 . Проверено 25 июля 2021 г.
- ^ Витоусек, Питер М.; Сэнфорд, Роберт Л. (1986). «Круговорот питательных веществ во влажном тропическом лесу» . Ежегодный обзор экологии и систематики . 17 : 137–167. doi : 10.1146/annurev.es.17.110186.001033 . S2CID 55212899 . Проверено 25 июля 2021 г.
- ^ Румпель, Корнелия; Шаплот, Винсент; Планшон, Оливье; Бернаду, Дж.; Валентин, Кристиан; Мариотти, Андре (2006). «Преимущественная эрозия черного углерода на крутых склонах при подсечно-огневом земледелии» . Катена . 65 (1): 30–40. Бибкод : 2006Caten..65...30R . дои : 10.1016/j.catena.2005.09.005 . Проверено 25 июля 2021 г.
- ^ Перейти обратно: а б Пол, Элдор А.; Паустиан, Кейт Х.; Эллиотт, ET; Коул, К. Вернон (1997). Органическое вещество почвы в агроэкосистемах умеренного пояса: долгосрочные эксперименты в Северной Америке . Бока-Ратон, Флорида: CRC Press . п. 80. ИСБН 978-0-8493-2802-2 .
- ^ «Горизонты» . Почвы Канады . Архивировано из оригинала 22 сентября 2019 года . Проверено 1 августа 2021 г.
- ^ Фроуз, Ян; Прах, Карел; Пизль, Вацлав; Ханель, Ладислав; Старый, Йозеф; Таёвский, Карел; Матерна, Ян; Балик, Владимир; Кальчик, Иржи; Ржехоункова, Клара (2008). «Взаимодействие между развитием почвы, растительностью и почвенной фауной во время спонтанной сукцессии на участках после добычи полезных ископаемых» . Европейский журнал почвенной биологии . 44 (1): 109–121. Бибкод : 2008EJSB...44..109F . дои : 10.1016/j.ejsobi.2007.09.002 . Проверено 1 августа 2021 г.
- ^ Кабала, Цезари; Запарт, Юстина (2012). «Первоначальное развитие почвы и накопление углерода на моренах быстро отступающего ледника Вереншельда, юго-запад Шпицбергена, архипелаг Шпицберген» . Геодерма . 175–176: 9–20. Бибкод : 2012Geode.175....9K . doi : 10.1016/j.geoderma.2012.01.025 . Проверено 1 августа 2021 г.
- ^ Уголини, Фиоренцо К.; Дальгрен, Рэнди А. (2002). «Освоение почвы в вулканическом пепле» (PDF) . Глобальные экологические исследования . 6 (2): 69–81 . Проверено 1 августа 2021 г.
- ^ Хаггетт, Ричард Дж. (1998). «Почвенные хронопоследовательности, развитие почв и эволюция почв: критический обзор» . Катена . 32 (3): 155–172. Бибкод : 1998Caten..32..155H . дои : 10.1016/S0341-8162(98)00053-8 . Проверено 1 августа 2021 г.
- ^ Де Альба, Сатурнио; Линдстрем, Майкл; Шумахер, Томас Э.; Мало, Дуглас Д. (2004). «Эволюция почвенного ландшафта за счет перераспределения почвы при обработке почвы: новая концептуальная модель эволюции почвенных катен в сельскохозяйственных ландшафтах» . Катена . 58 (1): 77–100. Бибкод : 2004Caten..58...77D . дои : 10.1016/j.catena.2003.12.004 . Проверено 1 августа 2021 г.
- ^ Филлипс, Джонатан Д.; Мэрион, Дэниел А. (2004). «Педологическая память в освоении лесных почв» (PDF) . Лесная экология и управление . 188 (1): 363–380. Бибкод : 2004ForEM.188..363P . дои : 10.1016/j.foreco.2003.08.007 . Проверено 1 августа 2021 г.
- ^ Митчелл, Эдвард А.Д.; Ван дер Кнаап, Виллем О.; Ван Леувен, Жаклин Ф.Н.; Баттлер, Александр; Уорнер, Барри Г.; Гоба, Жан-Мишель (2001). «Палеоэкологическая история болота Праз-Родет (Швейцарская Юра) на основе пыльцы, макрофоссилий растений и раковинных амеб (простейших)» . Голоцен . 11 (1): 65–80. Бибкод : 2001Holoc..11...65M . дои : 10.1191/095968301671777798 . S2CID 131032169 . Проверено 1 августа 2021 г.
- ^ Каркайе, Кристофер (2001). «Свидетельства AMS о переработке частиц почвы 14 Датирование угля C» . Comptes Rendus de l'Académie des Sciences, Série IIA . 332 (1): 21–28. Бибкод : 2001CRASE.332...21C . doi : 10.1016/S1251-8050(00)014-3 Проверено 1 августа 2021 г.
- ^ Реталлак, Грегори Дж. (1991). «Распутывание последствий изменения захоронений и древнего почвообразования» . Ежегодный обзор наук о Земле и планетах . 19 (1): 183–206. Бибкод : 1991AREPS..19..183R . doi : 10.1146/annurev.ea.19.050191.001151 . Проверено 1 августа 2021 г.
- ^ Баккер, Марта М.; Говерс, Джерард; Джонс, Роберт А.; Раунсвелл, Марк Д.А. (2007). «Влияние эрозии почвы на урожайность сельскохозяйственных культур в Европе» . Экосистемы . 10 (7): 1209–1219. Бибкод : 2007Ecosy..10.1209B . дои : 10.1007/s10021-007-9090-3 .
- ^ Усельман, Шона М.; Куоллс, Роберт Г.; Лилиенфейн, Джулиана (2007). «Вклад корневого и листового опада в выщелачивание растворенного органического углерода через почву» . Журнал Американского общества почвоведения . 71 (5): 1555–1563. Бибкод : 2007SSASJ..71.1555U . дои : 10.2136/sssaj2006.0386 . Проверено 8 августа 2021 г.
- ^ Шульц, Стефани; Бранкачк, Роберт; Дюмиг, Александр; Кёгель-Кнабнер, Ингрид; Шлотер, Майкл; Зейер, Йозеф (2013). «Роль микроорганизмов на разных стадиях развития экосистемы в почвообразовании» . Биогеонауки . 10 (6): 3983–3996. Бибкод : 2013BGeo...10.3983S . дои : 10.5194/bg-10-3983-2013 .
- ^ Жилле, Серван; Понг, Жан-Франсуа (2002). «Гумусовые образования и загрязнение почвы металлами» . Европейский журнал почвоведения . 53 (4): 529–539. Бибкод : 2002EuJSS..53..529G . дои : 10.1046/j.1365-2389.2002.00479.x . S2CID 94900982 . Проверено 8 августа 2021 г.
- ^ Барди, Мэрион; Фрич, Эммануэль; Деренн, Сильви; Аллард, Тьерри; ду Насименту, Надя Регина; Буэно, Гильерме (2008). «Микроморфология и спектроскопические характеристики органического вещества в заболоченных подзолах верхней части бассейна Амазонки». Геодерма . 145 (3): 222–230. Бибкод : 2008Geode.145..222B . CiteSeerX 10.1.1.455.4179 . doi : 10.1016/j.geoderma.2008.03.008 .
- ^ Докучаев, Василий Васильевич (1967). «Русский Чернозем» . Иерусалим, Израиль: Израильская программа научных переводов . Проверено 15 августа 2021 г.
- ^ Рабочая группа IUSS WRB (2022 г.). «Всемирная справочная база почвенных ресурсов, 4-е издание» . IUSS, Вена.
- ^ Самбо, Паоло; Николетто, Карло; Джиро, Андреа; Пий, Юрий; Валентинуцци, Фабио; Миммо, Таня; Лугли, Паоло; Орзес, Гвидо; Маццетто, Фабрицио; Астольфи, Стефания; Терцано, Роберто; Ческо, Стефано (2019). «Гидропонные решения для беспочвенных производственных систем: проблемы и возможности с точки зрения умного сельского хозяйства» . Границы в науке о растениях . 10 (123): 923. doi : 10.3389/fpls.2019.00923 . ПМК 6668597 . ПМИД 31396245 .
- ^ Лик, Саймон; Хаге, Эльке (2014). Грунты для ландшафтного развития: выбор, спецификация и обоснование . Клейтон, Виктория, Австралия: CSIRO Publishing . ISBN 978-0643109650 .
- ^ Пан, Сянь-Чжан; Чжао, Ци-Го (2007). «Измерение процесса урбанизации и потери рисовых почв в городе Исин, Китай, в период с 1949 по 2000 год» (PDF) . Катена . 69 (1): 65–73. Бибкод : 2007Caten..69...65P . дои : 10.1016/j.catena.2006.04.016 . Проверено 15 августа 2021 г.
- ^ Копиттке, Питер М.; Мензис, Нил В.; Ван, Пэн; Маккенна, Бриджит А.; Ломби, Энцо (2019). «Почва и интенсификация сельского хозяйства для глобальной продовольственной безопасности» . Интернационал окружающей среды . 132 : 105078. Бибкод : 2019EnInt.13205078K . дои : 10.1016/j.envint.2019.105078 . ISSN 0160-4120 . ПМИД 31400601 .
- ^ Штюрк, Юлия; Поортинга, Ате; Вербург, Питер Х. (2014). «Картирование экосистемных услуг: спрос и предложение услуг по регулированию наводнений в Европе» (PDF) . Экологические показатели . 38 : 198–211. Бибкод : 2014EcInd..38..198S . дои : 10.1016/j.ecolind.2013.11.010 . Архивировано из оригинала (PDF) 14 августа 2021 года . Проверено 15 августа 2021 г.
- ^ Ван Кейк, Шейла; Зигрист, Роберт; Логан, Эндрю; Массон, Сара; Фишер, Элизабет; Фигероа, Линда (2001). «Гидравлическое и очистительное поведение и их взаимодействие при очистке сточных вод в системах инфильтрации почвы» . Исследования воды . 35 (4): 953–964. Бибкод : 2001WatRe..35..953V . дои : 10.1016/S0043-1354(00)00349-3 . ПМИД 11235891 . Проверено 15 августа 2021 г.
- ^ Джеффри, Саймон; Гарди, Чиро; Арвин, Джонс (2010). Европейский атлас почвенного биоразнообразия . Люксембург, Люксембург: Издательское бюро Европейского Союза. дои : 10.2788/94222 . ISBN 978-92-79-15806-3 . Проверено 15 августа 2021 г.
- ^ Де Дейн, Герлинде Б.; Ван дер Путтен, Вим Х. (2005). «Объединение надземного и подземного разнообразия» . Тенденции экологии и эволюции . 20 (11): 625–633. дои : 10.1016/j.tree.2005.08.009 . ПМИД 16701446 . Проверено 15 августа 2021 г.
- ^ Хансен, Джеймс; Сато, Макико; Хареча, Пушкир; Бирлинг, Дэвид; Бернер, Роберт; Массон-Дельмотт, Валери; Пагани, Марк; Раймо, Морин; Ройер, Дана Л.; Зачос, Джеймс К. (2008). «Цель содержания CO 2 в атмосфере : куда следует стремиться человечеству?» (PDF) . Открытый журнал атмосферных наук . 2 (1): 217–231. arXiv : 0804.1126 . Бибкод : 2008OASJ....2..217H . дои : 10.2174/1874282300802010217 . S2CID 14890013 . Проверено 22 августа 2021 г.
- ^ Лал, Ротанг (11 июня 2004 г.). «Связывание углерода почвой влияет на глобальное изменение климата и продовольственную безопасность» (PDF) . Наука . 304 (5677): 1623–1627. Бибкод : 2004Sci...304.1623L . дои : 10.1126/science.1097396 . ПМИД 15192216 . S2CID 8574723 . Проверено 22 августа 2021 г.
- ^ Блейксли, Томас (24 февраля 2010 г.). «Озеленение пустынь ради углеродных кредитов» . Орландо, Флорида, США: Мир возобновляемых источников энергии . Архивировано из оригинала 1 ноября 2012 года . Проверено 22 августа 2021 г.
- ^ Мондини, Клаудио; Контин, Марко; Лейта, Ливиана; Де Нобили, Мария (2002). «Реакция микробной биомассы на высыхание на воздухе и повторное увлажнение почвы и компоста» . Геодерма . 105 (1–2): 111–124. Бибкод : 2002Геоде.105..111М . дои : 10.1016/S0016-7061(01)00095-7 . Проверено 22 августа 2021 г.
- ^ «Торфяники и земледелие» . Стоунли, Соединенное Королевство: Национальный союз фермеров Англии и Уэльса . 6 июля 2020 г. Проверено 22 августа 2021 г.
- ^ ван Винден, Джулия Ф.; Райхарт, Герт-Ян; Макнамара, Найл П.; Бентьен, Альберт; Синнингхе Дамсте, Яап С. (2012). «Вызванное температурой увеличение выделения метана из торфяников: эксперимент на мезокосме» . ПЛОС ОДИН . 7 (6): e39614. Бибкод : 2012PLoSO...739614V . дои : 10.1371/journal.pone.0039614 . ПМЦ 3387254 . ПМИД 22768100 .
- ^ Дэвидсон, Эрик А.; Янссенс, Иван А. (2006). «Температурная чувствительность разложения углерода в почве и обратная связь с изменением климата» . Природа . 440 (7081): 165–173. Бибкод : 2006Natur.440..165D . дои : 10.1038/nature04514 . ПМИД 16525463 . S2CID 4404915 .
- ^ Абрахамс, Птер В. (1997). «Геофагия (потребление почвы) и добавки железа в Уганде» . Тропическая медицина и международное здравоохранение . 2 (7): 617–623. дои : 10.1046/j.1365-3156.1997.d01-348.x . ПМИД 9270729 . S2CID 19647911 .
- ^ Сетц, Элеонора Зулнара Фрейре; Энцвейлер, Хасинта; Сольферини, Вера Нисака; Миндаль, Моника Пеппер; Бертон, Роналду Севериано (1999). «Геофагия у златолицых саков (Pithecia pithecia chrysocephala) в Центральной Амазонке» . Журнал зоологии . 247 (1): 91–103. дои : 10.1111/j.1469-7998.1999.tb00196.x . Проверено 22 августа 2021 г.
- ^ Коне, Джон Максимилиан; Кёне, Сигрид; Симунек, Йирка (2009). «Обзор применения моделей для структурированных почв: а) Поток воды и перенос индикаторов» (PDF) . Журнал загрязняющей гидрологии . 104 (1–4): 4–35. Бибкод : 2009JCHyd.104....4K . CiteSeerX 10.1.1.468.9149 . дои : 10.1016/j.jconhyd.2008.10.002 . ПМИД 19012994 . Архивировано (PDF) из оригинала 7 ноября 2017 г. Проверено 22 августа 2021 г.
- ^ Диплок, Элизабет Э.; Мардлин, Дэйв П.; Киллхэм, Кеннет С.; Патон, Грэм Иэн (2009). «Прогнозирование биоремедиации углеводородов: от лаборатории до полевого масштаба» . Загрязнение окружающей среды . 157 (6): 1831–1840. Бибкод : 2009EPoll.157.1831D . дои : 10.1016/j.envpol.2009.01.022 . ПМИД 19232804 . Проверено 22 августа 2021 г.
- ^ Мёкель, Клаудия; Ниццетто, Лука; Ди Гуардо, Антонио; Стейннес, Эйлив; Фреппаз, Мишель; Филиппа, Джанлука; Кампорини, Паоло; Беннер, Джессика; Джонс, Кевин С. (2008). «Стойкие органические загрязнители в бореальных и горных почвенных профилях: распространение, свидетельства процессов и последствий для глобального круговорота» . Экологические науки и технологии . 42 (22): 8374–8380. Бибкод : 2008EnST...42.8374M . дои : 10.1021/es801703k . hdl : 11383/8693 . ПМИД 19068820 . Проверено 22 августа 2021 г.
- ^ Резаи, Халил; Гость, Бернард; Фридрих, Анке; Фаязи, Фарахолла; Нахаи, Мохамад; Агда, Сейед Махмуд Фатеми; Бейтоллахи, Али (2009). «Качество и состав почвы и отложений как факторы распределения ущерба при землетрясении в районе Бама 26 декабря 2003 г. на юго-востоке Ирана (M (s) = 6,6)» . Журнал почв и отложений . 9 (1): 23–32. Бибкод : 2009JSoSe...9...23R . дои : 10.1007/s11368-008-0046-9 . S2CID 129416733 . Проверено 22 августа 2021 г.
- ^ Джонсон, Дэн Л.; Эмброуз, Стэнли Х.; Бассетт, Томас Дж.; Боуэн, Мерл Л.; Крамми, Дональд Э.; Исааксон, Джон С.; Джонсон, Дэвид Н.; Лэмб, Питер; Саул, Махир; Винтер-Нельсон, Алекс Э. (1997). «Значения экологических терминов» . Журнал качества окружающей среды . 26 (3): 581–589. Бибкод : 1997JEnvQ..26..581J . дои : 10.2134/jeq1997.00472425002600030002x . Проверено 29 августа 2021 г.
- ^ Олдеман, Л. Роэл (1993). «Глобальные масштабы деградации почв» . Двухгодовой отчет ISRIC за 1991–1992 годы . Вагенинген, Нидерланды: Международный справочно-информационный центр по почвам (ISRIC). стр. 19–36 . Проверено 29 августа 2021 г.
- ^ Самнер, Малкольм Э.; Ноубл, Эндрю Д. (2003). «Закисление почвы: мировая история» (PDF) . В Ренгеле, Зденко (ред.). Справочник по кислотности почвы . Нью-Йорк, штат Нью-Йорк, США: Марсель Деккер . стр. 1–28. Архивировано из оригинала (PDF) 14 августа 2021 года . Проверено 29 августа 2021 г.
- ^ Карам, Жан; Найселл, Джеймс А. (1997). «Возможное применение ферментов в переработке отходов» . Журнал химической технологии и биотехнологии . 69 (2): 141–153. Бибкод : 1997JCTB...69..141K . doi : 10.1002/(SICI)1097-4660(199706)69:2<141::AID-JCTB694>3.0.CO;2-U . Проверено 5 сентября 2021 г.
- ^ Шэн, Гуанъяо; Джонстон, Клифф Т.; Теппен, Брайан Дж.; Бойд, Стивен А. (2001). «Потенциальный вклад смектитовых глин и органических веществ в удержание пестицидов в почвах» . Журнал сельскохозяйственной и пищевой химии . 49 (6): 2899–2907. дои : 10.1021/jf001485d . ПМИД 11409985 . Проверено 5 сентября 2021 г.
- ^ Спрэг, Лори А.; Герман, Джанет С.; Хорнбергер, Джордж М.; Миллс, Аарон Л. (2000). «Адсорбция атразина и транспорт, облегченный коллоидами, через ненасыщенную зону» (PDF) . Журнал качества окружающей среды . 29 (5): 1632–1641. Бибкод : 2000JEnvQ..29.1632S . дои : 10.2134/jeq2000.00472425002900050034x . Архивировано из оригинала (PDF) 14 августа 2021 года . Проверено 5 сентября 2021 г.
- ^ Баллабио, Криштиану; Панагос, Панос; Лугато, Эмануэле; Хуанг, Джен Хау; Орджацци, Альберто; Джонс, Арвин; Фернандес-Угальде, Оихане; Боррелли, Паскуале; Монтанарелла, Лука (15 сентября 2018 г.). «Распределение меди в верхних слоях почвы Европы: оценка на основе исследования почвы LUCAS» . Наука об общей окружающей среде . 636 : 282–298. Бибкод : 2018ScTEn.636..282B . doi : 10.1016/j.scitotenv.2018.04.268 . ISSN 0048-9697 . ПМИД 29709848 .
- ^ Перейти обратно: а б Окружающая среда, ООН (21 октября 2021 г.). «Утопление в пластике – жизненно важные графики морского мусора и пластиковых отходов» . ЮНЕП – Программа ООН по окружающей среде . Проверено 23 марта 2022 г.
- ^ Ле Уэру, Генри Н. (1996). «Изменение климата, засуха и опустынивание» (PDF) . Журнал засушливой среды . 34 (2): 133–185. Бибкод : 1996JArEn..34..133L . дои : 10.1006/jare.1996.0099 . Проверено 5 сентября 2021 г.
- ^ Ланлан; Ху, Чжан, Гомин ( Лю , Яньли, Пейцзюнь ; Лю , 2020 Го ) , . 10.3390/ . ISSN 2071-1050 su12083258
- ^ Кефи, Соня; Риткерк, Макс; Аладос, Консепсьон Л.; Пуэйо, Иоланда; Папанастасис, Василиос П.; Эль Айх, Ахмед; де Рюитер, Питер К. (2007). «Пространственные модели растительности и неминуемое опустынивание в засушливых экосистемах Средиземноморья» . Природы . 449 (7159): 213–217. Бибкод : 2007Natur.449..213K . дои : 10.1038/nature06111 . hdl : 1874/25682 . ПМИД 17851524 . S2CID 4411922 . Проверено 5 сентября 2021 г.
- ^ Ван, Сюньмин; Ян, И; Донг, Чжибао; Чжан, Цайся (2009). «Реакция активности дюн и опустынивания в Китае на глобальное потепление в двадцать первом веке» . Глобальные и планетарные изменения . 67 (3–4): 167–185. Бибкод : 2009GPC....67..167W . дои : 10.1016/j.gloplacha.2009.02.004 . Проверено 5 сентября 2021 г.
- ^ Ян, Давен; Канаэ, Синдзиро; Оки, Тайкан; Койке, Тосио; Мусиаке, Катуми (2003). «Глобальная потенциальная эрозия почвы в связи с землепользованием и изменением климата» (PDF) . Гидрологические процессы . 17 (14): 2913–28. Бибкод : 2003HyPr...17.2913Y . дои : 10.1002/hyp.1441 . S2CID 129355387 . Архивировано из оригинала (PDF) 18 августа 2021 года . Проверено 5 сентября 2021 г.
- ^ Шэн, Цзянь-ань; Ляо, Ань-чжун (1997). «Борьба с эрозией в Южном Китае» . Катена . 29 (2): 211–221. Бибкод : 1997Caten..29..211S . дои : 10.1016/S0341-8162(96)00057-4 . ISSN 0341-8162 . Проверено 5 сентября 2021 г.
- ^ Ран, Лишань; Лу, Си Си; Синь, Чжунбао (2014). «Вызванное эрозией массовое захоронение органического углерода и выбросы углерода в бассейне реки Хуанхэ, Китай» (PDF) . Биогеонауки . 11 (4): 945–959. Бибкод : 2014BGeo...11..945R . дои : 10.5194/bg-11-945-2014 . hdl : 10722/228184 . Проверено 5 сентября 2021 г.
- ^ Верахтерт, Элс; Ван ден Экхаут, Миет; Поэзен, Жан; Декерс, Йозеф (2010). «Факторы, контролирующие пространственное распределение эрозии почвенных труб на лессовых почвах: пример из центральной Бельгии» . Геоморфология . 118 (3): 339–348. Бибкод : 2010Геомо.118..339В . дои : 10.1016/j.geomorph.2010.02.001 . Проверено 5 сентября 2021 г.
- ^ Джонс, Энтони (1976). «Грунтовые трубопроводы и инициирование русловых каналов» . Исследования водных ресурсов . 7 (3): 602–610. Бибкод : 1971WRR.....7..602J . дои : 10.1029/WR007i003p00602 . Архивировано из оригинала 5 сентября 2021 года . Проверено 5 сентября 2021 г.
- ^ Дули, Алан (июнь 2006 г.). «Песочники 101: Корпус имеет опыт борьбы с распространенной опасностью наводнений» . Обновление инженера . Инженерный корпус армии США . Архивировано из оригинала 18 апреля 2008 года.
- ^ Остербан, Роланд Дж. (1988). «Эффективность и социальное/экологическое воздействие ирригационных проектов: критический обзор» (PDF) . Годовые отчеты Международного института мелиорации и улучшения земель (ILRI). Вагенинген, Нидерланды. стр. 18–34. Архивировано (PDF) из оригинала 19 февраля 2009 г. Проверено 5 сентября 2021 г.
- ^ Руководство по дренажу: руководство по интеграции взаимоотношений между растениями, почвой и водой при осушении орошаемых земель (PDF) . Вашингтон, округ Колумбия: Министерство внутренних дел США , Бюро мелиорации . 1993. ISBN 978-0-16-061623-5 . Проверено 5 сентября 2021 г.
- ^ Остербан, Роланд Дж. «Заболачивание, засоление почвы, орошение полей, рост растений, подземный дренаж, моделирование подземных вод, поверхностный сток, мелиорация земель и другие аспекты растениеводства и управления водными ресурсами» . Архивировано из оригинала 16 августа 2010 года . Проверено 5 сентября 2021 г.
- ^ Стюарт, Александр М.; Пейм, Энни Рут П.; Витхунджит, Дуангпорн; Вириангкура, Ладда; Питунчарурнлап, Джулмани; Меесанг, Ниса; Суксири, Прартхана; Синглтон, Грант Р.; Лампаян, Рубенито М. (2018). «Применение лучших практик управления повышает прибыльность и устойчивость выращивания риса на центральных равнинах Таиланда» . Исследования полевых культур . 220 : 78–87. Бибкод : 2018FCrRe.220...78S . дои : 10.1016/j.fcr.2017.02.005 . Проверено 12 сентября 2021 г.
- ^ Тёркельбум, Фрэнсис; Пуссен, Жан; Олер, Ильза; Ван Кир, Коэн; Онгпрасерт, Сомчай; Власак, Карел (1997). «Оценка скорости эрозии обработки почвы на крутых склонах северного Таиланда» . Катена . 29 (1): 29–44. Бибкод : 1997Caten..29...29T . дои : 10.1016/S0341-8162(96)00063-X . Проверено 12 сентября 2021 г.
- ^ Салет, Ратинасами Мария; Иносенсио, Арлин; Благородный, Эндрю; Руайсунгнерн, Саваенг (2009). «Экономические выгоды от улучшения плодородия почвы и водоудерживающей способности за счет применения глины: влияние исследований по восстановлению почвы на северо-востоке Таиланда» (PDF) . Журнал эффективности развития . 1 (3): 336–352. дои : 10.1080/19439340903105022 . S2CID 18049595 . Проверено 12 сентября 2021 г.
- ^ Семалулу, Онесмус; Магунда, Матиас; Мубиру, Дрейк Н. (2015). «Мелиорация песчаных почв в засушливых районах путем применения Са-бентонита» . Угандийский журнал сельскохозяйственных наук 16 (2): 195–205. дои : 10.4314/ujas.v16i2.5 . Получено 12 сентября.
- ^ Международный институт управления водными ресурсами (2010 г.). «Улучшение почв и повышение урожайности в Таиланде» (PDF) . Истории успеха (2). дои : 10.5337/2011.0031 . Архивировано (PDF) из оригинала 7 июня 2012 года . Проверено 12 сентября 2021 г.
- ^ Прапагар, Комати; Индраратне, Шримати П.; Преманандхараджа, Пунита (2012). «Влияние почвенных мелиораций на рекультивацию засоленно-натриевых почв» . Тропические сельскохозяйственные исследования . 23 (2): 168–176. дои : 10.4038/tar.v23i2.4648 . Проверено 12 сентября 2021 г.
- ^ Лемье, Жиль; Жермен, Дайан (декабрь 2000 г.). «Сколы радиальной древесины: ключ к устойчивой плодородной почве» (PDF) . Университет Лаваля , факультет лесоведения и лесоведения, Квебек, Канада. Архивировано из оригинала (PDF) 28 сентября 2021 года . Проверено 12 сентября 2021 г.
- ^ Артур, Эммануэль; Корнелис, Вим; Раззаги, Фатима (2012). «Компостная добавка в песчаную почву влияет на свойства почвы и урожайность томатов в теплице» . Наука и использование компоста . 20 (4): 215–221. Бибкод : 2012CScUt..20..215A . дои : 10.1080/1065657X.2012.10737051 . S2CID 96896374 . Проверено 12 сентября 2021 г.
- ^ Глейзер, Бруно; Хаумайер, Людвиг; Гуггенбергер, Георг; Зех, Вольфганг (2001). «Феномен Терра Прета: модель устойчивого сельского хозяйства во влажных тропиках» . Naturwissenschaften . 88 (1): 37–41. Бибкод : 2001NW.....88...37G . дои : 10.1007/s001140000193 . ПМИД 11302125 . S2CID 26608101 . Проверено 12 сентября 2021 г.
- ^ Кавита, Белури; Пуллагурала Венката Лакшма, Редди; Ким, Боджон; Ли, Сан Су; Панди, Судхир Кумар; Ким, Ки Хён (2018). «Преимущества и ограничения внесения биоугля в сельскохозяйственные почвы: обзор» . Журнал экологического менеджмента . 227 : 146–154. Бибкод : 2018JEnvM.227..146K . дои : 10.1016/j.jenvman.2018.08.082 . ПМИД 30176434 . S2CID 52168678 . Архивировано из оригинала 12 сентября 2021 года . Проверено 12 сентября 2021 г.
- ^ Гилель, Дэниел (1992). Вне Земли: цивилизация и жизнь почвы . Беркли, Калифорния: Издательство Калифорнийского университета . ISBN 978-0-520-08080-5 .
- ^ Перейти обратно: а б Донахью, Миллер и Шиклуна, 1977 , с. 4.
- ^ Колумелла, Луций Юний Модерат (1745). О земледелии в двенадцати книгах, а также его книга о деревьях с несколькими иллюстрациями Плиния, Катона, Варрона, Палладия и других древних и современных авторов, переведенная на английский язык . Лондон, Великобритания: Эндрю Миллар . Проверено 19 сентября 2021 г.
- ^ Келлог 1957 , с. 1.
- ^ Ибн аль-Аввам (1864 г.). Книга о сельском хозяйстве в переводе с арабского Жана-Жака Клемана-Мюле . Филаха.Английский. (на французском языке). Париж, Франция: Библиотека А. Франка . Проверено 19 сентября 2021 г.
- ^ Елинек, Лоуренс Дж. (1982). Империя урожая: история сельского хозяйства Калифорнии . Сан-Франциско, Калифорния: Бойд и Фрейзер. ISBN 978-0-87835-131-2 .
- ^ де Серр, Оливье (1600). Театр земледелия и уборки полей (на французском языке). Париж, Франция: Жаме Метайе . Проверено 19 сентября 2021 г.
- ^ Вирто, Иньиго; Имаз, Мария Хосе; Фернандес-Угальде, Оихане; Гарция-Бенгоэчеа, Нахия; Энрике, Альберто; Бесканса, Палома (2015). «Деградация почв и качество почв в Западной Европе: текущая ситуация и перспективы на будущее» . Устойчивость . 7 (1): 313–365. дои : 10.3390/su7010313 .
- ^ Ван дер Плог, Риенк Р.; Швайгерт, Питер; Бахманн, Йорг (2001). «Использование и неправильное использование азота в сельском хозяйстве: история Германии» . Научный мировой журнал . 1 (С2): 737–744. дои : 10.1100/tsw.2001.263 . ПМК 6084271 . ПМИД 12805882 .
- ^ «Опыты Ван Гельмонта по росту растений» . Всемирная служба Би-би-си . Проверено 19 сентября 2021 г.
- ^ Перейти обратно: а б с Брэди, Найл К. (1984). Природа и свойства почв (9-е изд.). Нью-Йорк, Нью-Йорк: Коллиер Макмиллан . ISBN 978-0-02-313340-4 . Проверено 19 сентября 2021 г.
- ^ Келлог 1957 , с. 3.
- ^ Келлог 1957 , с. 2.
- ^ Лавуазье, Антуан-Лоран (1777). «Память о сгорании в целом» (PDF) . Мемуары Королевской академии наук (на французском языке) . Проверено 19 сентября 2021 г.
- ^ Буссенго, Жан-Батист (1860–1874). Агрономия, сельскохозяйственная химия и физиология, тома 1–5 (на французском языке). Париж, Франция: Малле-Башелье . Проверено 19 сентября 2021 г.
- ^ фон Либих, Юстус (1840). Органическая химия в ее приложениях к сельскому хозяйству и физиологии . Лондон: Тейлор и Уолтон . Проверено 19 сентября 2021 г.
- ^ Уэй, Дж. Томас (1849). «О составе и денежной стоимости различных сортов гуано» . Журнал Королевского сельскохозяйственного общества Англии . 10 : 196–230 . Проверено 19 сентября 2021 г.
- ^ Перейти обратно: а б Келлог 1957 , с. 4.
- ^ Тандон, Хари Л.С. «Краткая история удобрений» . Организация по разработке и консультированию удобрений . Архивировано из оригинала 23 января 2017 года . Проверено 17 декабря 2017 г.
- ^ Уэй, Дж. Томас (1852). «О способности почв поглощать навоз» . Журнал Королевского сельскохозяйственного общества Англии . 13 : 123–143 . Проверено 19 сентября 2021 г.
- ^ Уорингтон, Роберт (1878). Примечание о появлении азотистой кислоты при испарении воды: отчет об опытах, произведенных в Ротамстедской лаборатории . Лондон, Великобритания: Харрисон и сыновья . Проверено 19 сентября 2021 г.
- ^ Виноградский, Сергей (1890). «Об организмах нитрификации» . Еженедельные отчеты сессий Академии наук (на французском языке). 110 (1): 1013–1016 . Проверено 19 сентября 2021 г.
- ^ Келлогг 1957 , стр. 1–4.
- ^ Хилгард, Юджин В. (1907). Почвы: их образование, свойства, состав и связь с климатом и ростом растений во влажных и засушливых регионах . Лондон, Великобритания: Компания Macmillan . Проверено 19 сентября 2021 г.
- ^ Фаллу, Фридрих Альберт (1857). Начало почвоведения (PDF) (на немецком языке). Дрезден, Германия: Книжный магазин Г. Шенфельда. Архивировано из оригинала (PDF) 15 декабря 2018 года . Проверено 15 декабря 2018 г.
- ^ Глинка, Константин Дмитриевич (1914). Типы почвообразования: их классификация и географическое распространение (на немецком языке). Берлин, Германия: Борнтрегер .
- ^ Глинка, Константин Дмитриевич (1927). Великие группы почв мира и их развитие . Анн-Арбор, Мичиган: Братья Эдвардс . Проверено 19 сентября 2021 г.
Источники
[ редактировать ]![]() В эту статью включен текст из бесплатного контента . Лицензия: Cc BY-SA 3.0 IGO ( лицензионное заявление/разрешение ). Текст взят из документа «Утопление в пластике – важные графики морского мусора и пластиковых отходов» , Программа ООН по окружающей среде.
В эту статью включен текст из бесплатного контента . Лицензия: Cc BY-SA 3.0 IGO ( лицензионное заявление/разрешение ). Текст взят из документа «Утопление в пластике – важные графики морского мусора и пластиковых отходов» , Программа ООН по окружающей среде.
Библиография
[ редактировать ]- Донахью, Рой Лютер; Миллер, Рэймонд В.; Шиклуна, Джон К. (1977). Почвы: введение в почвы и рост растений . Прентис-Холл . ISBN 978-0-13-821918-5 .
- «Мастер-садовник из Аризоны» . Расширение кооперативов, Сельскохозяйственный колледж, Университет Аризоны . Проверено 27 мая 2013 г.
- Штефферуд, Альфред, изд. (1957). Почва: Ежегодник сельского хозяйства, 1957 год . Министерство сельского хозяйства США. OCLC 704186906 .
- Келлог. « Мы ищем, мы учимся ». В Стефферуде (1957) .
- Симонсон. « Что такое почвы ». В Стефферуде (1957) .
- Рассел. « Физические свойства ». В Стефферуде (1957) .
- Дин. « Питание растений и плодородие почвы ». В Стефферуде (1957) .
- Рассел. « Бор и плодородие почвы ». В Стефферуде (1957) .
Дальнейшее чтение
[ редактировать ]- Soil-Net.com. Архивировано 10 июля 2008 г. на Wayback Machine. Бесплатный образовательный сайт для школьного возраста, рассказывающий о почве и ее важности.
- Адамс, Дж. А. 1986. Грязь . Колледж-Стейшн, Техас: Издательство Техасского университета A&M ISBN 0-89096-301-0
- Чертини Г., Скаленге Р. 2006. Почвы: основные концепции и будущие задачи. Cambridge Univ Press, Кембридж.
- Монтгомери, Дэвид Р. , Грязь: эрозия цивилизаций (U of California Press, 2007), ISBN 978-0-520-25806-8
- Фолкнер, Безумие Эдварда Х. Плаумана (Нью-Йорк, Гроссет и Данлэп, 1943). ISBN 0-933280-51-3
- LandIS Free Soilscapes Viewer Бесплатная интерактивная программа просмотра почв Англии и Уэльса
- Дженни, Ганс. 1941. Факторы почвообразования: система количественного почвообразования.
- Логан, В.Б. Грязь: экстатическая кожа земли (1995). ISBN 1-57322-004-3
- Манн, Чарльз К. Сентябрь 2008 г. Журнал National Geographic «Наша добрая земля».
Внешние ссылки
[ редактировать ]- «97 Потоп» . Геологическая служба США. Архивировано из оригинала 24 июня 2008 года . Проверено 8 июля 2008 года . Фотографии бурлящего песка.
- Сотрудники отдела почвенных изысканий. 1999. Руководство по обследованию почв . Служба охраны почвы. Справочник 18 Министерства сельского хозяйства США.
- Сотрудники почвообследования. 1975. Таксономия почвы: базовая система классификации почв для проведения и интерпретации почвенных исследований. Министерство сельского хозяйства США-SCS Сельское хозяйство. Handb. 436. Типография правительства США, Вашингтон, округ Колумбия.
- Почвы (Соответствие подходящих видов кормов типу почвы) , Университет штата Орегон.
- Гардинер, Дуэйн Т. «Лекция 1 Глава 1 Зачем изучать почвы?» . ENV320: Конспекты лекций по почвоведению . Техасский университет A&M в Кингсвилле. Архивировано из оригинала 9 февраля 2018 года . Проверено 7 января 2019 г.
- Яник, Жюль. 2002. Почвенные заметки , Университет Пердью.
- Данные о почвах LandIS для Англии и Уэльса. Архивировано 16 июля 2007 г. на Wayback Machine, платном источнике данных ГИС о почвах Англии и Уэльса, а также источнике данных о почвах; они взимают с исследователей плату за обработку.
- Короткое видео, объясняющее основы почвы
- Справочник по почвенным водам (объяснение датчиков содержания почвенной воды)
- Глобальное почвенное партнерство
- Почвенный портал ФАО
- Мировая справочная база почвенных ресурсов
- ISRIC – Мировая информация о почвах (Всемирный центр данных о почвах ICSU)
- Всемирная почвенная библиотека и карты
- Wossac - мировой архив и каталог исследований почв
- Канадское общество почвоведения
- Общество почвоведения Америки
- Интернет-обследование почв Министерства сельского хозяйства США-NRCS
- Европейский почвенный портал (вики)
- Национальный институт почвенных ресурсов Великобритании
- Электронная библиотека растениеводства и почвоведения
- Копии справочника «Почва: Ежегодник сельского хозяйства, 1957 год» в нескольких форматах.