Метионин
 Скелетная формула канонической формы метионина
| |||
| |||
| Имена | |||
|---|---|---|---|
| Имя IUPAC
Метионин
| |||
| Другие имена
2-амино-4- (метилтио) бутановая кислота
| |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| Сокращения | С, м | ||
| Чеби |
| ||
| Химический |
| ||
| Chemspider | |||
| Наркоман |
| ||
| Echa Infocard | 100.000.393 | ||
| ЕС номер |
| ||
| Кегг |
| ||
PubChem CID
|
|||
| НЕКОТОРЫЙ |
| ||
Comptox Dashboard ( EPA )
|
|||
| Характеристики [ 2 ] | |||
| C 5 H 11 N O 2 S | |||
| Молярная масса | 149.21 g·mol −1 | ||
| Появление | Белый кристаллический порошок | ||
| Плотность | 1,340 г/см 3 | ||
| Точка плавления | 281 ° C (538 ° F; 554 K) разлагается | ||
| Растворимый | |||
| Кислотность (p k a ) | 2.28 (карбоксил), 9,21 (амино) [ 1 ] | ||
| Фармакология | |||
| V03AB26 ( WHO ) QA05BA90 ( WHO ), QG04BA90 ( ВОЗ ) | |||
| Дополнительная страница данных | |||
| Метионин (страница данных) | |||
За исключением случаев, когда отмечены, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа).
| |||
Метионин (символ MET или M ) [ 3 ] ( / m ɪ θ aɪ a ː iː n / ) [ 4 ] это незаменимая аминокислота у людей.
В качестве предшественника других несущественных аминокислот, таких как цистеин и таурин , универсальные соединения, такие как SAM-E , и важный антиоксидант глутатион , метионин играет критическую роль в метаболизме и здоровье многих видов, включая людей. Метионин также участвует в ангиогенезе и различных процессах, связанных с транскрипцией ДНК, эпигенетической экспрессией и регуляцией генов.
Метионин был первым изолирован в 1921 году Джоном Ховардом Мюллером . [ 5 ] Это кодируется кодоном августа . Он был назван Satoru Odake в 1925 году как сокращение своего структурного описания 2-амино-4- ( Meth ylt Hio ) бутановой кислоты. [ 6 ]
Биохимические детали
[ редактировать ]Метионин (сокращается как Met или M ; кодируется кодоном AUG) является α- аминокислотой которая используется в биосинтезе белков , . Он содержит карбоксильную группу (которая находится в депротонированном − Форма в биологических условиях pH ), аминогруппа (которая находится в протонированном -NH +
3 формируют в биологических условиях pH), расположенных в α -позиции по отношению к карбоксильной группе, и -метилтиоэфирной боковой цепи , классифицируя ее как неполярную алифатическую S аминокислоту.
В ядерных генах эукариот и в археи метионин кодируется стартовым кодоном , что означает, что он указывает на начало кодирующей области и является первой аминокислотой, продуцируемой в зарождающемся полипептиде во время мРНК трансляции . [ 7 ]
Протеиногенная аминокислота
[ редактировать ]Цистеин и метионин являются двумя серы , содержащими протеиногенные аминокислоты . За исключением нескольких исключений, где метионин может действовать как окислительно -восстановительный датчик (например, метионин сульфоксид [ 8 ] ), остатки метионина не имеют каталитической роли. [ 9 ] Это в отличие от остатков цистеина, где тиоловая группа играет каталитическую роль во многих белках. [ 9 ] Однако тиоэфир внутри метионина играет незначительную структурную роль из-за эффекта стабильности S/π-взаимодействий между атомом серы боковой цепи и ароматическими аминокислотами в одной трети всех известных белковых структур. [ 9 ] Это отсутствие сильной роли отражается в экспериментах, где мало эффекта наблюдается в белках, где метионин заменяется норлецином , аминокислотой прямой углеводороды, которой не хватает тиоэфира. [ 10 ] Было предположительно, что норлецин присутствовал в ранних версиях генетического кода, но метионин вторгся в окончательную версию генетического кода из -за того, что он используется в кофакторе S -аденозилметионине (SAM -E). [ 11 ] Эта ситуация не является уникальной и, возможно, произошла с орнитином и аргинином . [ 12 ]
Кодирование
[ редактировать ]Метионин является одной из двух аминокислот, кодируемых одним кодоном (AUG) в стандартном генетическом коде ( триптофан , кодируемый UGG, является другим). В отражении эволюционного происхождения его кодона другие кодоны AUN кодируют изолецин , который также является гидрофобной аминокислотой. В митохондриальном геноме нескольких организмов, в том числе метазоа и дрожжей , кодон также кодирует метионин. В стандартном генетическом коде коды AUA для изолецина, а соответствующая тРНК ( ILEX в Escherichia coli ) использует необычный основание лизидин (бактерии) или агматидин (археа) для дискриминации по августу. [ 13 ] [ 14 ]
Метиониновый кодон AUG также является наиболее распространенным начальным кодоном. Кодон «Start» - это сообщение для рибосомы , которое сигнализирует о начале трансляции белка из мРНК, когда кодон AUG находится в консенсусной последовательности Козак . Как следствие, метионин часто включается в N -концевое положение белков у эукариот и археи во время трансляции, хотя его можно удалить путем посттрансляционной модификации . У бактерий производное n -формалметионин используется в качестве начальной аминокислоты.
Производные
[ редактировать ]S -аденозилметионин
[ редактировать ]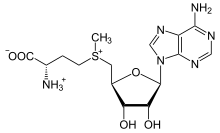
Метионино-производный S- аденозилметионин (SAM-E) является кофактором , который служит в основном в качестве донора метила . SAM-E состоит из аденозил-молекулы (через 5'-углерод), прикрепленной к серу метионина, поэтому делает его катион сульфония (т. Е. Три заместителя и положительный заряд). Сера действует как мягкая кислота Льюиса (то есть донор/электрофил), которая позволяет передавать S -метильную группу в кислород, азот или ароматическую систему, часто с помощью других кофакторов, таких как кобаламин (витамин В 12 в в люди). Некоторые ферменты используют SAM-E, чтобы инициировать радикальную реакцию; Они называются радикальными ферментами SAM-E . В результате переноса метильной группы S получается -аденозилхомоцистеин. У бактерий это либо регенерируется метилированием, либо спасается путем удаления аденина и гомоцистеина, оставляя соединение дигидроксипендионе, чтобы спонтанно преобразовать в аутоиндемист-2 , который выделяется в виде отходого продукта или сигнала кворума.
Биосинтез
[ редактировать ]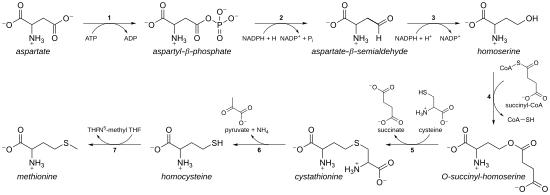
Как незаменимая аминокислота, метионин не синтезируется de novo у людей и других животных, которые должны принимать белки метионин или метионин. У растений и микроорганизмов биосинтез метионина принадлежит к семейству аспартатов , наряду с треонином и лизином (посредством диаминопимелата , но не через α-аминоадипат ). Основная основная цепь получена из аспарагиновой кислоты , в то время как сера может исходить из цистеина , метанетиола или сероводорода . [ 9 ]
- Во-первых, аспарагиновая кислота превращается через β-апартийский полуалдегид в гомосерин с двумя этапами восстановления терминальной карбоксильной группы (следовательно, гомосерин имеет γ-гидроксил, следовательно, гомо- серия). Полуалдегид промежуточного аспартата - это точка разветвления с биосинтетическим путем лизина, где он вместо этого конденсирован пируватом. Гомосерин - это точка ветвления с треониновым путем, где вместо этого он изомерируется после активации терминального гидроксила с фосфатом (также используется для биосинтеза метионина у растений). [ 9 ]
- Гомосерин затем активируется фосфатом, сукцинилом или ацетильной группой на гидроксиле.
- В растениях и, возможно, в некоторых бактериях, [ 9 ] фосфат используется. Этот шаг разделен с биосинтезом треонина. [ 9 ]
- В большинстве организмов ацетильная группа используется для активации гомосерин. Это может быть катализировано в бактериях ферментом, кодируемым Metx или Meta (не гомологами). [ 9 ]
- В энтеробактериях и ограниченном количестве других организмов используется сукцинат. Фермент, который катализирует реакцию, представляет собой мета, и специфичность для ацетил-КоА и сукцинил-КоА продиктовано одним остатком. [ 9 ] Физиологическая основа для предпочтения ацетил-КоА или сукцинил-КоА неизвестна, но такие альтернативные маршруты присутствуют в некоторых других путях ( например, биосинтез лизина и биосинтез аргинина).
- Группа активации гидроксила затем заменяется цистеином, метанатиолом или серо водорода. Реакция замены технически является γ- элиминацией , за которым следует вариант добавления Майкла . Все вовлеченные ферменты являются гомологами и членами семейства PLP-зависимых ферментов Cys/Met , которое является подмножеством PLP-зависимой клады типа I типа. Они используют кофактор PLP ( пиридоксальный фосфат ), который функционирует путем стабилизации промежуточных продуктов карбаниона. [ 9 ]
- Если он реагирует с цистеином, он продуцирует цистатион , который расщепляется для получения гомоцистеина . Ферментами вовлечены цистатион-γ-синтаза (кодируемая MetB в бактериях) и цистатион-β-линейза ( METC ). Цистатион связан по -разному в двух ферментах, позволяющих возникать β или γ -реакции. [ 9 ]
- Если он реагирует со свободным серо водорода, он производит гомоцистеин. Это катализируется о -ацетилхомосериновой аминокарбоксипропилтрансферазой (ранее известной как о -ацетиломозерин (тиол) -лаза. Он кодируется Mety или Metz в бактериях. [ 9 ]
- Если он реагирует с метанатиолом, он вызывает метионин напрямую. Метанатиол является побочным продуктом катаболического пути определенных соединений, поэтому этот путь более редкий. [ 9 ]
- Если продуцируется гомоцистеин, группа тиола метилируется, что дает метионин. Две метиониновые синтазы известны; Один зависит от кобаламина (витамина B 12 ), а один - независимый. [ 9 ]
Путь с использованием цистеина называется « пути трансульфурации », в то время как путь с использованием сероводорода (или метанетиола) называется «путь прямого сульфурилирования».
Цистеин аналогично продуцируется, а именно он может быть сделан из активированного серина и либо из гомоцистеина («пути обратного транссульфриляции»), либо из сероводорода («путь прямого сульфуриляции»); Активированный серин, как правило, представляет собой о -ацетилсерин (через Cysk или Cysm в E. coli ), но в Pernix Aeropyrum и в некоторых других архей -фосфосерин . [ 15 ] Cysk и Cysm являются гомологами, но принадлежат к кладе PLP Fold Type III.
Трансульфурилиционный путь
[ редактировать ]Ферменты, вовлеченные в трав транссольфурированную траурилирующую пультурированную .
- Аспартокиназа
- Аспартат-семиалдегиддегидрогеназа
- Гомомериндегидрогеназа
- Гомомерин o -транссуцинилаза
- Цистатион-γ-синтаза
- Цистатион-β-линейаза
- Метионинсинтаза (у млекопитающих этот этап выполняется гомоцистеинтетрансферазой или бетаиной -гомоцистеин S -метилтрансфераза .)
Другие биохимические пути
[ редактировать ]
Хотя млекопитающие не могут синтезировать метионин, они все равно могут использовать его в различных биохимических путях:
Катаболизм
[ редактировать ]Метионин превращается в S -аденозилметионин (SAM -E) с помощью (1) метиониновой аденозилтрансферазы .
SAM -E служит донором метила во многих (2) метилтрансферазной реакции и преобразуется в S -Аденозилхомоцистеин (SAH).
(3) Аденозилхомоцистеиназа цистеин.
Регенерация
[ редактировать ]Метионин может быть регенерирован из гомоцистеина через (4) метионинсинтазу в реакции, которая требует витамина В 12 в качестве кофактора .
Гомоцистеин также может быть повторнотилирован с использованием глицина бетаина ( N , N , N -триметилглицина, TMG) к метионину через фермент бетаин -гомоцистеин метилтрансфераза (EC2.1.1.5, BHMT). BHMT составляет до 1,5% всего растворимого белка печени, и недавние данные свидетельствуют о том, что он может оказывать большее влияние на гомеостаз метионина и гомоцистеина, чем метионин -синтаза.
Путь обратного трансльрилирования: преобразование в цистеин
[ редактировать ]Гомоцистеин может быть преобразован в цистеин.
- (5) цистатион-β-синтаза (фермент, который требует пиридоксальфосфата , активная форма витамина В6 ) сочетает в себе гомоцистеин и серин для продуцирования цистатиона . Вместо разложения цистатиона через цистатион-β-линейзу , как и в биосинтетическом пути, цистатион разбивается на цистеин и α-кетобутират через (6) цистатион-γ-эзазу .
- (7) Фермент α-кетоциддегидрогеназа преобразует α-кетобутират в пропионил-КоА , который метаболизируется в сукцинил-КоА в трехэтапном процессе (см. Пропионил-КоА для пути).
Этилен синтез
[ редактировать ]Эта аминокислота также используется растениями для синтеза этилена . Процесс известен как цикл Ян или цикл метионина.
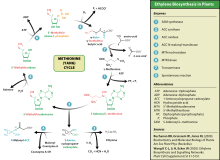
Метаболические заболевания
[ редактировать ]Разрушение метионина нарушается при следующих метаболических заболеваниях :
- Комбинированная малонная и метилмалоническая ациурия (cmamma)
- Гомоцистинурия
- Метилмалоновая ацидемия
- Пропионическая ацидемия
Химический синтез
[ редактировать ]Промышленный синтез сочетает в себе акролеин , метанатиол и цианид, который дает гидантоин . [ 16 ] Ракемический метионин также может быть синтезирован из фталимидомалоната диэтилового натрия путем алкилирования с хлорэтилметилсульфидом (CLCH 2 CH 2 SCH 3 ) с последующим гидролизом и декарбоксилированием. Также см. Метанол. [ 17 ]
Человеческое питание
[ редактировать ]Существуют неубедительные клинические данные о добавках метионина. [ 18 ] Диетическое ограничение метионина может привести к расстройствам, связанным с костями. [ 18 ]
Метиониновые добавки могут принести пользу тем, кто страдает от отравления меди . [ 19 ]
Переоходеление метионина, донора метильной группы при метилировании ДНК , связано с ростом рака в ряде исследований. [ 20 ] [ 21 ]
Требования
[ редактировать ]Совет по пищевым продуктам и питанию Медицинского института США рекомендовал диетические пособия (RDA) для незаменимых аминокислот в 2002 году. Для метионина в сочетании с цистеином для взрослых 19 лет и старше, 19 мг/кг массы тела/день. [ 22 ]
Это переводится на около 1,33 грамма в день для индивидуума 70 килограммов.
Диетические источники
[ редактировать ]| Еда | g/100 g |
|---|---|
| Яйцо , белое, сушеные, порошок, уменьшается глюкоза | 3.204 |
| Кунжутные семена мука (с низким содержанием жира) | 1.656 |
| Бразильские орехи | 1.124 |
| Сыр , пармезан, измельченный | 1.114 |
| конопля | 0.933 |
| Я концентрат белок | 0.814 |
| Курица , бройлеры или жарки, жареная | 0.801 |
| Рыба , тунец, свет, консервированный в воде, дренированные твердые вещества | 0.755 |
| Говядина , вылеченная, высушенная | 0.749 |
| Бекон | 0.593 |
| Семена чиа | 0.588 |
| Говядина , земля, 95% бессмысленное мясо / 5% жир, сырой | 0.565 |
| Свинина , земля, 96% наклоняется / 4% жир, сырой | 0.564 |
| Соевые бобы | 0.547 |
| Пшеница зародыш | 0.456 |
| Яйцо , целое, приготовленное, вкрутую вкрутую | 0.392 |
| Овсяной | 0.312 |
| Арахис | 0.309 |
| Нут | 0.253 |
| Кукуруза , желтая | 0.197 |
| Миндаль | 0.151 |
| Бобы, пинто, приготовлены | 0.117 |
| Чечевица , приготовленная | 0.077 |
| Рис , коричневый, средний зерен, приготовленный | 0.052 |
Высокий уровень метионина можно найти в яйцах, мясе и рыбе; семена кунжута, бразильские орехи и некоторые другие семена растений; и зерновые зерновые. Большинство фруктов и овощей содержат очень мало. Большинство бобовых , хотя и белки, плотные, низкие в метионине. Белки без адекватного метионина не считаются полными белками . [ 23 ] По этой причине рационин иногда добавляется в качестве ингредиента для кормов для домашних животных . [ 24 ]
Здоровье
[ редактировать ]Потеря метионина была связана с старением седой волос. Его отсутствие приводит к накоплению перекиси водорода в волосяных фолликулах , снижению эффективности тирозиназы и постепенной потере цвета волос. [ 25 ] Метионин повышает внутриклеточную концентрацию глутатиона , тем самым способствуя антиоксидантной защите клеток и окислительно-восстановительной регуляции. Он также защищает клетки от индуцированной дофамином потери нигрегальных клеток путем связывания окислительных метаболитов. [ 26 ]
Метионин является промежуточным в биосинтезе цистеина , карнитина , таурина , лецитина , фосфатидилхолина и других фосфолипидов . Неправильное преобразование метионина может привести к атеросклерозу [ 27 ] из -за накопления гомоцистеина .
Другое использование
[ редактировать ]DL -метионин иногда дается в качестве дополнения к собакам; Это помогает снизить шансы на камни почек у собак. Также известно, что метионин увеличивает экскрецию хинидина в моче за счет подкисления мочи. Аминогликозидные антибиотики, используемые для лечения инфекций мочевыводящих путей, лучше всего работают в щелочных условиях, а подкисление мочи от использования метионина может снизить его эффективность. Если собака находится на диете, которая подкисляет мочу, не следует использовать метионин. [ 28 ]
Метионин разрешен в качестве дополнения к органическому кормам птицы в рамках сертифицированной органической программы США. [ 29 ]
Метионин может использоваться в качестве нетоксичного варианта пестицидов против гигантских гусениц ласточка , которые являются серьезными вредителями апельсиновых культур. [ 30 ]
Смотрите также
[ редактировать ]- Аллантоин
- Формалметионин
- Окисление метионина
- Парацетамол отравление
- Фотореактивный метионин
- S -метилцистеин
Ссылки
[ редактировать ]- ^ Доусон Р.М., Эллиотт Д.К., Эллиотт В.Х., Джонс К.М. (1959). Данные для биохимических исследований . Оксфорд: Clarendon Press.
- ^ Weast, Robert C., ed. (1981). Справочник по химии и физике CRC (62 -е изд.). Boca Raton, FL: CRC Press. п. C-374. ISBN 0-8493-0462-8 . .
- ^ «Номенклатура и символика для аминокислот и пептидов» . Объединенная комиссия IUPAC-IUB по биохимической номенклатуре. 1983. Архивировано из оригинала 9 октября 2008 года . Получено 5 марта 2018 года .
- ^ «Метионин» . Издательство Оксфордского университета. Архивировано с оригинала 27 января 2018 года.
- ^ Pappenheimer AM (1987). «Биографические мемуары Джона Ховарда Мюллера» (PDF) . Вашингтон, округ Колумбия: Национальная академия наук.
- ^ Odake, Satoru (1925). «При возникновении аминокислоты, содержащей серо, содержащейся в дрожжах» . Бюллетень Сельскохозяйственного химического общества Японии . 1 (8): 87–89. doi : 10.1271/bbb1924.1.87 . ISSN 1881-1272 .
- ^ Guedes RL, Prosdocimi F, Fernandes GR, Moura LK, Ribeiro Ha, Ortega JM (декабрь 2011 г.). «Аминокислотные биосинтез и пути ассимиляции азота: большая геномная делеция во время эволюции эукариот» . BMC Genomics . 12 (Suppl 4): S2. doi : 10.1186/1471-2164-12-S4-S2 . PMC 3287585 . PMID 22369087 .
- ^ Бигелоу DJ, Squier TC (январь 2005 г.). «Окислительно -восстановительная модуляция клеточной передачи сигналов и метаболизма посредством обратимого окисления датчиков метионина в регуляторных белках кальция» . Biochimica et Biophysica Acta (BBA) - белки и протеомика (представленная рукопись). 1703 (2): 121–134. doi : 10.1016/j.bbapap.2004.09.012 . PMID 15680220 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не Ферла -депутат, Патрик Вм (август 2014 г.). «Бактериальный биосинтез метионина» . Микробиология . 160 (Pt 8): 1571–1584. doi : 10.1099/mic.0.077826-0 . PMID 24939187 .
- ^ Cirino PC, Tang Y, Takahashi K, Tirrell DA, Arnold FH (сентябрь 2003 г.). «Глобальное включение норлецина вместо метионина в гем-домене цитохрома P450 BM-3 увеличивает активность пероксигеназы». Биотехнология и биоинженерия . 83 (6): 729–734. doi : 10.1002/bit.10718 . PMID 12889037 . S2CID 11380413 .
- ^ Alvarez-Carreño C, Becerra A, Lazcano A (октябрь 2013 г.). «Норвалин и норлецин, возможно, были более распространенными белковыми компонентами на ранних стадиях эволюции клеток». Происхождение жизни и эволюции биосферы . 43 (4–5): 363–375. Bibcode : 2013oleb ... 43..363a . doi : 10.1007/s11084-013-9344-3 . PMID 24013929 . S2CID 17224537 .
- ^ Jukes Th (август 1973 г.). «Аргинин как эволюционный злоумышленник в синтез белка». Биохимическая и биофизическая исследовательская коммуникация . 53 (3): 709–714. doi : 10.1016/0006-291x (73) 90151-4 . PMID 4731949 .
- ^ Икеучи Ю., Кимура С., Нумата Т., Накамура Д., Йокогава Т., Огата Т., Вада Т, Сузуки Т., Сузуки Т (апрель 2010 г.). «Агматин-конъюгированный цитидин в антикодоне тРНК необходим для декодирования AUA в археи». Природная химическая биология . 6 (4): 277–282. doi : 10.1038/nchembio.323 . PMID 20139989 .
- ^ Muramatsu T, Nishikawa K, Nemoto F, Kuchino Y, Nishimura S, Miyazawa T, Yokoyama S (ноябрь 1988). «Кодон и аминокислотная специфичность РНК переноса преобразуется одним посттранскрипционным модификацией». Природа . 336 (6195): 179–181. Bibcode : 1988natr.336..179m . doi : 10.1038/336179A0 . PMID 3054566 . S2CID 4371485 .
- ^ Мино К, Ишикава К (сентябрь 2003 г.). «Новая реакция O -фосфори -сериновой сульфгидрилиции, катализируемой о -ацетилсерин сульфгидрилазой из Aeropyrum pernix K1» . Письма Febs . 551 (1–3): 133–138. doi : 10.1016/s0014-5793 (03) 00913-x . PMID 12965218 . S2CID 28360765 .
- ^ Карлхайнц Драуз; Ян Грейсон; Аксель Климанн; Ганс-Петер Криммер; Вольфганг Лейхтенбергер; Кристоф Векбекер (2006). Энциклопедия промышленной химии Уллмана . Вейнхайм: Wiley-VCH. Doi : 10.1002/14356007.a02_057.pub2 . ISBN 978-3527306732 .
- ^ Баргер G, Weichselbaum TE (1934). " DL -Methionine" . Органические синтезы . 14 : 58 ; Собранные объемы , вып. 2, с. 384 .
- ^ «Метионин» . Webmd .
- ^ Cavuoto P, Fenech MF (2012). «Обзор зависимости метионина и роль ограничения метионина в контроле роста рака и расширении жизни». Обзоры лечения рака . 38 (6): 726–736. doi : 10.1016/j.ctrv.2012.01.004 . PMID 22342103 .
- ^ Cellarier E, Durando X, Vasson MP, Farges MC, Demiden A, Maurizis JC, Madelmont JC, Chollet P (2003). «Метиониновая зависимость и лечение рака». Обзоры лечения рака . 29 (6): 489–499. doi : 10.1016/s0305-7372 (03) 00118-x . PMID 14585259 .
- ^ Институт медицины (2002). «Белок и аминокислоты» . Диетические эталонные потребления для энергии, углеводов, клетчатки, жира, жирных кислот, холестерина, белка и аминокислот . Вашингтон, округ Колумбия: Национальная академическая пресса. С. 589–768. doi : 10.17226/10490 . ISBN 978-0-309-08525-0 .
- ^ Finkelstein JD (май 1990). «Метаболизм метионина у млекопитающих». Журнал питательной биохимии . 1 (5): 228–237. doi : 10.1016/0955-2863 (90) 90070-2 . PMID 15539209 . S2CID 32264340 .
- ^ Палика Л. (1996). Гид потребителя по корму для собак: что в корме для собак, почему он есть и как выбрать лучшую еду для вашей собаки . Нью -Йорк: Книжный дом Хауэлла. ISBN 978-0-87605-467-3 .
- ^ Wood JM, Decker H, Hartmann H, Chavan B, Rokos H, Spencer JD, et al. (Июль 2009 г.). «Сенильные волосы с серыми: H2O2-опосредованный окислительный стресс влияет на цвет волос человека путем притупления метионинового сульфоксида» . FASEB Journal . 23 (7): 2065–75. Arxiv : 0706.4406 . doi : 10.1096/fj.08-125435 . HDL : 10454/6241 . PMID 19237503 . S2CID 16069417 .
- ^ Pinnen F, et al. (2009). «Codrugs, связывающие L -допа и серу -содержащие антиоксиданты: новые фармакологические инструменты против болезни Паркинсона». Журнал лекарственной химии . 52 (2): 559–63. doi : 10.1021/jm801266x . PMID 19093882 .
- ^ Refsum H, Uland PM, Nygård O, Vollset SE (1998). «Гомоцистеин и сердечно -сосудистые заболевания». Ежегодный обзор медицины . 49 (1): 31–62. doi : 10.1146/annure.w.49.1.31 . PMID 9509248 .
- ^ Гримшоу, Джейн (25 июля 2011 г.) Метионин для собак. Использование и побочные эффекты . твари360.com
- ^ «Правила и правила» . Федеральный реестр . 76 (49): 13501–13504. 14 марта 2011 г.
- ^ Льюис Д.С., Куда Дж.П., Стивенс Б.Р. (декабрь 2011 г.). «Новый биорациональный пестицид: эффективность метионина против гераклидов (папилио) Cresphontes , суррогат инвазивных Princeps (papilio) demoleus (lepidoptera: papilionidae)» . Журнал экономической энтомологии . 104 (6): 1986–1990. doi : 10.1603/ec11132 . PMID 22299361 . S2CID 45255198 .
Внешние ссылки
[ редактировать ]- Рудра М.Н., Чоудхури Л.М. (30 сентября 1950 г.). «Содержание метионина в зерновых и бобовых» . Природа . 166 (568): 568. Bibcode : 1950natur.166..568r . doi : 10.1038/166568a0 . PMID 14780151 . S2CID 3026278 .