Аквапорин
| Аквапорин | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Символ | Аквапорин | ||
| Пфам | PF00230 | ||
| ИнтерПро | IPR000425 | ||
| PROSITE | PDOC00193 | ||
| СКОП2 | 1fx8 / SCOPe / СУПФАМ | ||
| TCDB | 1.А.8 | ||
| Суперсемейство OPM | 7 | ||
| белок OPM | 2zz9 | ||
| |||
Аквапорины , также называемые водными каналами , представляют собой канальные белки из более крупного семейства основных внутренних белков , которые образуют поры в мембране биологических клеток , главным образом облегчая транспорт воды между клетками . [1] Клеточные мембраны множества различных бактерий , грибов , животных и растительных клеток содержат аквапорины, через которые вода может течь в клетку и из нее быстрее, чем путем диффузии через бислой фосфолипидов . [2] Аквапорины имеют шесть трансмембранных альфа-спиральных доменов с карбоксильными и аминоконцевыми концами на цитоплазматической стороне. Две гидрофобные петли содержат консервативный аспарагин - пролин - аланин («мотив NPA»), которые образуют бочонок, окружающий центральную пороподобную область, которая содержит дополнительную плотность белка. [3] Поскольку аквапорины обычно всегда открыты и преобладают практически во всех типах клеток, это приводит к неправильному представлению о том, что вода легко проходит через клеточную мембрану вниз по градиенту ее концентрации. Вода может проходить через клеточную мембрану посредством простой диффузии , поскольку это небольшая молекула, и посредством осмоса в тех случаях, когда концентрация воды снаружи клетки больше, чем внутри. Однако, поскольку вода является полярной молекулой, этот процесс простой диффузии происходит относительно медленно, и в тканях с высокой водопроницаемостью большая часть воды проходит через аквапорин. [4] [5]
2003 года Нобелевская премия по химии была присуждена совместно Питеру Агре за открытие аквапоринов. [6] и Родерика Маккиннона за работу по структуре и механизму калиевых каналов . [7]
Генетические дефекты, связанные с генами аквапоринов, связаны с несколькими заболеваниями человека, включая нефрогенный несахарный диабет и оптиконевромиелит . [8] [9] [10] [11]
История
[ редактировать ]Механизм облегченного транспорта воды и возможное существование водных пор привлекают исследователей с 1957 года. [12] В большинстве клеток вода поступает и выходит посредством осмоса через липидный компонент клеточных мембран. Из-за относительно высокой водопроницаемости некоторых эпителиальных клеток долгое время предполагалось, что должен существовать какой-то дополнительный механизм транспорта воды через мембраны. Соломон и его коллеги провели новаторскую работу по изучению проницаемости воды через клеточную мембрану в конце 1950-х годов. [13] [14] В середине 1960-х годов альтернативная гипотеза («модель распределения-диффузии») стремилась установить, что молекулы воды распределяются между водной фазой и липидной фазой, а затем диффундируют через мембрану, пересекая ее до следующей интерфазы, где они покидают мембрану. липид и возвращался в водную фазу. [15] [16] Исследования Паризи, Эдельмана, Карвуниса и др. акцентировалось не только на важности наличия водных каналов, но и на возможности регулирования их проницаемости. [17] [18] [19] В 1990 году эксперименты Веркмана продемонстрировали функциональную экспрессию водных каналов, что указывает на то, что водные каналы по сути являются белками. [20] [21]
Открытие
[ редактировать ]Лишь в 1992 году Питер Агре из Университета Джонса Хопкинса сообщил о первом аквапорине, «аквапорине-1» (первоначально известном как CHIP 28) . [22] В 1999 году вместе с другими исследовательскими группами Агре сообщил о первых изображениях трехмерной структуры аквапорина, а именно аквапорина-1, в высоком разрешении. [23] Дальнейшие исследования с использованием суперкомпьютерного моделирования определили путь воды при ее движении через канал и продемонстрировали, как пора может пропускать воду без прохождения небольших растворенных веществ. [24] Новаторское исследование и последующее открытие водных каналов Агре и его коллегами принесло Агре Нобелевскую премию по химии в 2003 году. [7] Агре сказал, что открыл аквапорины «по счастливой случайности». Он изучал группы крови Rh антигены и выделил молекулу Rh, но вторая молекула размером 28 килодальтон (и поэтому названная 28K) продолжала появляться. Сначала они подумали, что это фрагмент молекулы Rh или примесь, но оказалось, что это новый тип молекулы с неизвестной функцией. Он присутствовал в таких структурах, как почечные канальцы и эритроциты, и был связан с белками различного происхождения, например, в мозге плодовых мух , бактериях, хрусталике глаза и тканях растений. [23]
Однако первое сообщение о белково-опосредованном транспорте воды через мембраны было сделано Георге Бенгой и другими в 1986 году, до первой публикации Агре по этой теме. [25] [26] Это привело к разногласиям по поводу того, что работа Бенги не была должным образом признана ни Агре, ни Комитетом по Нобелевской премии. [27]
Функция
[ редактировать ]
Аквапорины – это «водопроводная система клеток». Вода перемещается через клетки организованным образом, наиболее быстро в тканях, имеющих аквапориновые водные каналы. [28] На протяжении многих лет учёные предполагали, что вода просачивается через клеточную мембрану, и некоторое количество воды происходит. Однако это не объясняло, как вода могла так быстро перемещаться через некоторые клетки. [28]
Аквапорины избирательно проводят воды молекулы в клетку и из нее, предотвращая при этом прохождение ионов и других растворенных веществ . Аквапорины, также известные как водные каналы, представляют собой интегральные белки мембранных пор. Некоторые из них, известные как акваглицеропорины , также транспортируют другие небольшие незаряженные растворенные молекулы, включая аммиак, CO 2 , глицерин и мочевину. Например, канал аквапорина 3 имеет ширину пор 8–10 ангстрем и позволяет проходить гидрофильным молекулам с молекулярной массой от 150 до 200 Да . Однако поры воды полностью блокируют ионы, включая протоны мембраны , что необходимо для сохранения разности электрохимических потенциалов . [29]
Молекулы воды проходят через поры канала гуськом. Наличие водных каналов увеличивает проницаемость мембраны для воды. Они также необходимы для системы водного транспорта растений. [30] и устойчивость к засухе и солевому стрессу. [31]
Структура
[ редактировать ]

Белки аквапоринов состоят из пучка шести трансмембранных α-спиралей . Они встроены в клеточную мембрану. Амино- и карбоксильный концы обращены внутрь клетки. Амино- и карбоксильная половинки похожи друг на друга, по-видимому, повторяя рисунок нуклеотидов. Возможно, это произошло в результате удвоения ранее половинного гена. Между спиралями находятся пять областей (A – E), которые входят в клеточную мембрану или выходят из нее, две из них гидрофобные (B, E) с аспарагин-пролин-аланиновым рисунком («мотив NPA»). Они создают характерную форму песочных часов, делая водный канал узким посередине и более широким на каждом конце. [29] [32]
Другое, еще более узкое место в канале AQP1 — это «селективный фильтр ar/R», кластер аминокислот, позволяющий аквапорину избирательно пропускать или блокировать прохождение различных молекул. [33]
Аквапорины образуют кластеры из четырех частей в клеточной мембране (тетрамеры), причем каждый из четырех мономеров действует как водный канал. Различные аквапорины имеют водные каналы разного размера, самые маленькие типы не пропускают ничего, кроме воды. [29]
Рентгеновские профили показывают, что аквапорины имеют два конических входа. Эта форма песочных часов может быть результатом процесса естественного отбора в сторону оптимальной проницаемости. [34] Было показано, что конические входы с подходящим углом раскрытия действительно могут обеспечить значительное увеличение гидродинамической проницаемости канала. [34]
мотив НПА
[ редактировать ]В симуляциях появляются каналы аквапорина, пропускающие только воду, поскольку молекулы фактически выстраиваются в очередь в один ряд. Управляемый локальным электрическим полем аквапорина, кислород в каждой молекуле воды при входе смотрит вперед, разворачивается на полпути и выходит, а кислород обращен назад. [35] Расположение противоположных электростатических потенциалов в двух половинах канала предотвращает поток протонов, но позволяет воде свободно проходить. [36]
селективный фильтр ar/R
[ редактировать ]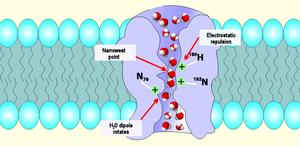
Селективный фильтр ароматического/ аргинина или «ar/R» представляет собой группу аминокислот , которые помогают связываться с молекулами воды и исключают другие молекулы, которые могут попытаться проникнуть в поры. Это механизм, с помощью которого аквапорин способен избирательно связывать молекулы воды и, таким образом, пропускать их и предотвращать проникновение других молекул. Фильтр ar/R состоит из двух аминокислотных групп из спиралей B (HB) и E (HE) и двух групп из петли E (LE1, LE2) с двух сторон мотива NPA. Его обычное положение составляет 8 Å на внешней стороне мотива NPA; обычно это самая узкая часть канала. Его узость ослабляет водородные связи между молекулами воды, позволяя аргининам, несущим положительный заряд, взаимодействовать с молекулами воды и отфильтровывать нежелательные протоны. [37]
Таксономическое распространение
[ редактировать ]У млекопитающих
[ редактировать ]У млекопитающих известно тринадцать типов аквапоринов; шесть из них расположены в почках, [38] но подозревается существование многих других. Наиболее изученные аквапорины сравниваются в следующей таблице:
| Тип | Расположение [39] | Функция [39] |
|---|---|---|
| Аквапорин 1 | Реабсорбция воды | |
| Аквапорин 2 | Реабсорбция воды в ответ на АДГ [40] | |
| Аквапорин 3 | Реабсорбция воды и проницаемость глицерина | |
| Аквапорин 4 | Реабсорбция воды |
В растениях
[ редактировать ]У растений вода забирается из почвы через корни, где она поступает из коры в проводящие ткани. Существует три пути движения воды в этих тканях: апопластический, симпластический и трансклеточный пути. В частности, аквапорины обнаружены в вакуолярной мембране, помимо плазматической мембраны растений; трансклеточный путь включает транспорт воды через плазму и вакуолярные мембраны. [41] Когда корни растений подвергаются воздействию хлорида ртути , который, как известно, ингибирует аквапорины, поток воды значительно уменьшается, а поток ионов - нет, что подтверждает мнение о том, что существует механизм транспорта воды, независимый от транспорта ионов: аквапорины. . [42] Аквапорины могут играть важную роль в росте растений, обеспечивая приток воды в расширяющиеся клетки — процесс, необходимый для поддержания развития растений. [41] Аквапорины растений важны для минерального питания и детоксикации ионов; оба они необходимы для гомеостаза минералов, таких как бор. [43]
Аквапорины растений разделены на четыре основных гомологичных подсемейства или группы: [44]
- Внутренний белок плазматической мембраны (PIP) [45]
- Внутренний белок тонопласта (TIP) [46]
- Нодулин-26-подобный внутренний белок (NIP) [47]
- Малый базовый внутренний белок (SIP) [48]
Эти пять подсемейств позже были разделены на более мелкие эволюционные подгруппы на основе последовательности их ДНК. PIP группируются в две подгруппы: PIP1 и PIP2, тогда как TIP группируются в 5 подгрупп: TIP1, TIP2, TIP3, TIP4 и TIP5. Каждая подгруппа снова разделяется на изоформы , например PIP1;1, PIP1;2. Поскольку номенклатура изоформ исторически основана на функциональных параметрах, а не на эволюционных, в результате изучения эволюционных взаимоотношений между различными аквапоринами было выдвинуто несколько новых предложений относительно растительных аквапоринов. [49] Среди разнообразного набора изоформ аквапоринов в растениях также существуют уникальные закономерности клеточной и тканеспецифичной экспрессии. [41]
Когда растительные аквапорины заглушаются, гидравлическая проводимость и фотосинтез листа уменьшаются. [50] Когда происходит шлюзование растительных аквапоринов, оно прекращает поступление воды через поры белка. Это может произойти по разным причинам, например, когда растение содержит мало клеточной воды из-за засухи. [51] Закрытие аквапорина осуществляется за счет взаимодействия между воротным механизмом и аквапорином, что вызывает трехмерное изменение белка, так что он блокирует поры и, таким образом, препятствует потоку воды через пору. У растений существуют по крайней мере две формы шлюзования аквапоров: шлюзование путем дефосфорилирования определенных остатков серина в ответ на засуху и протонирование определенных гистидина остатков в ответ на затопление. Фосфорилирование аквапорина участвует в открытии и закрытии лепестков в ответ на температуру. [52] [53]
У гетероконтов
[ редактировать ]Особые аквапорины, называемые большими внутренними белками (LIP). [54] были обнаружены у гетероконтов , в том числе у диатомовых водорослей и бурых водорослей . LIP содержат NPM-мотив вместо второго консервативного NPA-мотива, типичного для большинства MIP.
В других организмах
[ редактировать ]Аквапорины обнаружены у грибов Saccharomyces cerevisiae (дрожжи), Dictyostelium , Candida и Ustilago , а также у простейших Trypanosoma и Plasmodium . [30]
Клиническое значение
[ редактировать ]Было два ярких примера заболеваний, возникших в результате мутаций аквапоринов: мутации в гене аквапорина-2 вызывают наследственный нефрогенный несахарный диабет у людей; [9] в то время как у мышей, гомозиготных по инактивирующим мутациям в гене аквапорина-0, развивается врожденная катаракта . [55] У небольшого числа людей был выявлен тяжелый или полный дефицит аквапорина-1. В целом они здоровы, но имеют дефект в способности концентрировать растворенные вещества в моче и сохранять воду при лишении питьевой воды. [56] [57] Мыши с целевыми делециями аквапорина-1 также демонстрируют дефицит сохранения воды из-за неспособности концентрировать растворенные вещества в мозговом веществе почек путем противоточного размножения . [58] Аквапорины играют ключевую роль в приобретенных формах нефрогенного несахарного диабета — расстройствах, вызывающих повышенное выделение мочи. [59] Аквапорин 2 регулируется вазопрессином, который при связывании с рецептором клеточной поверхности активирует сигнальный путь цАМФ. В результате везикулы, содержащие аквапорин-2, увеличивают поглощение воды и ее возврат в кровообращение. Мутация рецептора вазопрессина аквапорина 2 является причиной приобретенного несахарного диабета. У крыс приобретенный нефрогенный несахарный диабет может быть обусловлен нарушением регуляции аквапорина-2 вследствие введения солей лития , низкой концентрацией калия в крови ( гипокалиемия ) и высокой концентрацией кальция в крови ( гиперкальциемия ). [60] [61] [62] Аутоиммунные реакции против аквапорина 4 у человека вызывают болезнь Девича . [8] Если бы аквапорином можно было манипулировать, это потенциально могло бы решить такие медицинские проблемы, как задержка жидкости при болезнях сердца и отек мозга после инсульта. [28]
Ссылки
[ редактировать ]- ^ Агре П. (2006). «Аквапориновые водные каналы» . Proc Am Thorac Soc . 3 (1): 5–13. дои : 10.1513/pats.200510-109JH . ПМЦ 2658677 . ПМИД 16493146 .
- ^ Купер Дж. (2009). Клетка: молекулярный подход . Вашингтон, округ Колумбия: ASM PRESS. п. 544. ИСБН 978-0-87893-300-6 .
- ^ Веркман, А.С. (январь 2000 г.). «Структура и функции аквапориновых водных каналов». Am J Physiol Физиол почек . 278 (1): Ф13-28. дои : 10.1152/ajprenal.2000.278.1.F13 . ПМИД 10644652 .
- ^ Купер, Джеффри (2000). Клетка (2-е изд.). МА: Синауэр Ассошиэйтс . Проверено 23 апреля 2020 г.
- ^ Лодиш, Харви; Берк, Арнольд; Зипурский, С. Лоуренс (2000). Молекулярно-клеточная биология (4-е изд.). Нью-Йорк: WH Freeman. ISBN 9781464183393 . Проверено 20 мая 2020 г.
- ^ Кнеппер М.А., Нильсен С. (2004). «Питер Агре, лауреат Нобелевской премии по химии 2003 года» . Дж. Ам. Соц. Нефрол . 15 (4): 1093–5. дои : 10.1097/01.ASN.0000118814.47663.7D . ПМИД 15034115 .
- ^ Jump up to: а б «Нобелевская премия по химии 2003 г.» . Нобелевский фонд . Проверено 23 января 2008 г.
- ^ Jump up to: а б Леннон В.А., Крайзер Т.Дж., Питток С.Дж., Веркман А.С., Хинсон С.Р. (2005). «IgG-маркер рассеянного склероза зрительно-спинального мозга связывается с водным каналом аквапорина-4» . Дж. Эксп. Мед . 202 (4): 473–7. дои : 10.1084/jem.20050304 . ПМК 2212860 . ПМИД 16087714 .
- ^ Jump up to: а б Бише Д.Г. (2006). «Нефрогенный несахарный диабет» (PDF) . Adv Хроническая дисфункция почек . 13 (2): 96–104. дои : 10.1053/j.ackd.2006.01.006 . ПМИД 16580609 . Архивировано из оригинала (PDF) 18 июля 2018 г.
- ^ Агре П., Козоно Д. (2003). «Аквапориновые водные каналы: молекулярные механизмы заболеваний человека» . ФЭБС Летт . 555 (1): 72–8. дои : 10.1016/S0014-5793(03)01083-4 . ПМИД 14630322 . S2CID 35406097 .
- ^ Шриер Р.В. (2007). «Аквапорин-связанные нарушения водного гомеостаза». Перспектива новостей о наркотиках . 20 (7): 447–53. дои : 10.1358/dnp.2007.20.7.1138161 . ПМИД 17992267 .
- ^ Паризи М., Дорр Р.А., Озу М., Ториано Р. (декабрь 2007 г.). «От мембранных пор до аквапоринов: 50 лет измерения потоков воды» . J Biol Phys . 33 (5–6): 331–43. дои : 10.1007/s10867-008-9064-5 . ПМЦ 2565768 . ПМИД 19669522 .
- ^ Паганелли К.В., Соломон А.К. (ноябрь 1957 г.). «Скорость обмена тритированной воды через мембрану эритроцитов человека» . Дж. Генерал Физиол . 41 (2): 259–77. дои : 10.1085/jgp.41.2.259 . ПМК 2194835 . ПМИД 13475690 .
- ^ Гольдштейн Д.А.; Соломон А.К. (1960-09-01). «Определение эквивалентного радиуса пор эритроцитов человека путем измерения осмотического давления» . Журнал общей физиологии . 44 (1): 1–17. дои : 10.1085/jgp.44.1.1 . ПМК 2195086 . ПМИД 13706631 .
- ^ Дэйнти, Дж.; Хаус, Чехия (1 июля 1966 г.). «Исследование доказательств наличия мембранных пор в коже лягушки» . Журнал физиологии . 185 (1): 172–184. doi : 10.1113/jphysicalol.1966.sp007979 . ПМЦ 1395865 . ПМИД 5965891 .
- ^ Ханаи Т., Хейдон Д.А. (1 августа 1966 г.). «Проницаемость для воды бимолекулярных липидных мембран». Журнал теоретической биологии . 11 (3): 370–382. Бибкод : 1966JThBi..11..370H . дои : 10.1016/0022-5193(66)90099-3 . ПМИД 5967438 .
- ^ Паризи М., Бурге Ж (1 января 1984 г.). «Влияние клеточного закисления на АДГ-индуцированные агрегаты внутримембранных частиц». Американский журнал физиологии. Клеточная физиология . 246 (1): C157–C159. дои : 10.1152/ajpcell.1984.246.1.c157 . ISSN 0363-6143 . ПМИД 6320654 .
- ^ Эдельман, Исидор С. (25 мая 1965 г.). «Водородная зависимость антидиуретического действия вазопрессина, окситоцина и деаминоокситоцина». Biochimica et Biophysical Acta (BBA) - Биофизика, включая фотосинтез . 102 (1): 185–197. дои : 10.1016/0926-6585(65)90212-8 . PMID 5833400 – через Elsevier Science Direct.
- ^ Карвунис С.П., Левин С.Д., Хейс Р.М. (1 мая 1979 г.). «РН-зависимость транспорта воды и растворенных веществ в мочевом пузыре жабы» . Почки Интернешнл . 15 (5): 513–519. дои : 10.1038/ki.1979.66 . ISSN 0085-2538 . ПМИД 39188 .
- ^ Чжан, РБ; Логи, Калифорния; Веркман, А.С. (15 сентября 1990 г.). «Экспрессия мРНК, кодирующей водные каналы почек и эритроцитов в ооцитах Xenopus» . Журнал биологической химии . 265 (26): 15375–15378. дои : 10.1016/S0021-9258(18)55405-3 . ISSN 0021-9258 . ПМИД 2394728 .
- ^ Чжан, Р; Альпер, СЛ; Торенс, Б; Веркман, А.С. (1 ноября 1991 г.). «Свидетельства экспрессии ооцитов о том, что водный канал эритроцитов отличается от полосы 3 и транспортера глюкозы» . Журнал клинических исследований . 88 (5): 1553–1558. дои : 10.1172/JCI115466 . ПМК 295670 . ПМИД 1939644 .
- ^ Агре П., Престон ГМ, Смит Б.Л., Юнг Дж.С., Райна С., Мун С., Гуджино В.Б., Нильсен С. (1 октября 1993 г.). «Аквапориновый ЧИП: архетипический молекулярный водный канал». Являюсь. Дж. Физиол . 265 (4 ч. 2): F463–76. дои : 10.1152/ajprenal.1993.265.4.F463 . ПМИД 7694481 . S2CID 2685263 .
- ^ Jump up to: а б Мицуока К., Мурата К., Вальц Т., Хираи Т., Агре П., Хейманн Дж.Б., Энгель А., Фудзиеси Ю. (1999). «Структура аквапорина-1 при разрешении 4,5 А обнаруживает короткие альфа-спирали в центре мономера». Дж. Структ. Биол . 128 (1): 34–43. дои : 10.1006/jsbi.1999.4177 . ПМИД 10600556 . S2CID 1076256 .
- ^ де Гроот Б.Л., Грубмюллер Х (2005). «Динамика и энергетика водопроницаемости и вытеснения протонов в аквапоринах». Курс. Мнение. Структура. Биол . 15 (2): 176–83. дои : 10.1016/j.sbi.2005.02.003 . hdl : 11858/00-001M-0000-0012-E99D-E . ПМИД 15837176 .
- ^ Бенга Дж., Попеску О., Поп VI, Холмс Р.П. (1986). «Связывание п-(хлормеркури)бензолсульфоната мембранными белками и ингибирование транспорта воды в эритроцитах человека». Биохимия . 25 (7): 1535–8. дои : 10.1021/bi00355a011 . ПМИД 3011064 .
- ^ Кучел П.В. (2006). «История открытия аквапоринов: конвергентная эволюция идей - но кто пришел первым?». Клетка. Мол. Биол. (Шумный-ле-гранд) . 52 (7): 2–5. ПМИД 17543213 .
- ^ Бенга, Г. «Георге Бенга» . Ad Astra - Интернет-проект румынского научного сообщества. Архивировано из оригинала 25 декабря 2007 года . Проверено 5 апреля 2008 г.
- ^ Jump up to: а б с Разговор с Питером Агре: использование роли лидера, чтобы придать науке человеческое лицо , Клаудия Дрейфус , New York Times, 26 января 2009 г.
- ^ Jump up to: а б с Гонен Т., Уолц Т. (2006). «Строение аквапоринов». В. Преподобный Биофиз . 39 (4): 361–96. дои : 10.1017/S0033583506004458 . ПМИД 17156589 . S2CID 40235608 .
- ^ Jump up to: а б Крузе Э., Улейн Н., Кальденхофф Р. (2006). «Аквапорины» . Геном Биол . 7 (2): 206. doi : 10.1186/gb-2006-7-2-206 . ПМЦ 1431727 . ПМИД 16522221 .
- ^ Сюй Ю и др. (2014). «Ген бананового аквапорина» . Биология растений BMC . 14 (1): 59. дои : 10.1186/1471-2229-14-59 . ПМК 4015420 . ПМИД 24606771 .
- ^ Фу Д, Лу М (2007). «Структурные основы водопроницаемости и исключения протонов в аквапоринах (Обзор)» . Молекулярная мембранная биология . 24 (5–6): 366–74. дои : 10.1080/09687680701446965 . ПМИД 17710641 . S2CID 343461 .
- ^ Суй, Хайсинь; Хан, Бонг-Гюн; Ли, Джон К.; Валиан, Питер; Японец, Бинг К. (2001). «Структурная основа водного транспорта по водному каналу AQP1». Природа . 414 (6866): 872–878. дои : 10.1038/414872a . ПМИД 11780053 .
- ^ Jump up to: а б Гравель С., Жоли Л., Детчеверри Ф., Ибер С., Коттен-Бизон С., Боке Л. (2013). «Оптимизация водопроницаемости за счет формы аквапоринов в форме песочных часов» . ПНАС . 110 (41): 16367–16372. arXiv : 1310.4309 . Бибкод : 2013PNAS..11016367G . дои : 10.1073/pnas.1306447110 . ПМЦ 3799357 . ПМИД 24067650 .
- ^ де Гроот Б.Л., Грубмюллер Х (2001). «Проникновение воды через биологические мембраны: механизм и динамика аквапорина-1 и GlpF». Наука . 294 (5550): 2353–2357. Бибкод : 2001Sci...294.2353D . дои : 10.1126/science.1062459 . hdl : 11858/00-001M-0000-0014-61AF-6 . ПМИД 11743202 . S2CID 446498 .
- ^ Тайхоршид Э., Ноллерт П., Йенсен М.О, Мирке Л.Дж., О'Коннелл Дж., Страуд Р.М., Шультен К. (2002). «Контроль селективности семейства водных каналов аквапоринов путем глобальной ориентационной настройки». Наука . 296 (5567): 525–30. Бибкод : 2002Sci...296..525T . дои : 10.1126/science.1067778 . ПМИД 11964478 . S2CID 22410850 .
- ^ Суй Х, Хан Б.Г., Ли Дж.К., Валиан П., Япончик Б.К. (2001). «Структурная основа водного транспорта по водному каналу AQP1» . Природа . 414 (6866): 872–878. дои : 10.1038/414872a . ПМИД 11780053 . S2CID 4315108 .
- ^ Нильсен С., Фрёкиер Дж., Марплс Д., Квон Т.Х., Агре П., Кнеппер М.А. (2002). «Аквапорины в почках: от молекул к лекарству». Физиол. Преподобный . 82 (1): 205–44. doi : 10.1152/physrev.00024.2001 . ПМИД 11773613 .
- ^ Jump up to: а б Если в полях таблицы не указано иное, то ссылка равна: Уолтер Ф. Борон (2005). Медицинская физиология: клеточный и молекулярный подход . Эльзевир/Сондерс. ISBN 978-1-4160-2328-9 . Страница 842
- ^ Сэндс Дж. М. (2012). «Аквапорин 2: не только для перемещения воды» . Журнал Американского общества нефрологов . 23 (9): 1443–1444. дои : 10.1681/ASN.2012060613 . ПМЦ 3431422 . ПМИД 22797179 .
- ^ Jump up to: а б с Йоханссон, я; Карлссон, М; Йохансон, Ю; Ларссон, К; Кьельбом, П. (1 мая 2000 г.). «Роль аквапоринов в водном балансе клеток и всего растения» . Biochimica et Biophysical Acta (BBA) – Биомембраны . 1465 (1–2): 324–342. дои : 10.1016/S0005-2736(00)00147-4 . ПМИД 10748263 .
- ^ Шомон, Ф; Тайерман, С.Д. (1 апреля 2014 г.). «Аквапорины: строго регулируемые каналы, контролирующие водные отношения растений» . Физиология растений . 164 (4): 1600–1618. дои : 10.1104/стр.113.233791 . ПМЦ 3982727 . ПМИД 24449709 .
- ^ Порсель, Роза; Бустаманте, Антонио; Рос, Рок; Серрано, Рамон; Муле Салорт, Хосе М. (2018). «BvCOLD1: новый аквапорин из сахарной свеклы (Beta vulgaris L.), участвующий в гомеостазе бора и абиотическом стрессе». Растение, клетка и окружающая среда . 41 (12): 2844–2857. дои : 10.1111/шт.13416 . hdl : 10251/145984 . ПМИД 30103284 . S2CID 51974856 .
- ^ Кальденхофф Р. , Бертл А., Отто Б., Мошелион М., Улейн Н. (2007). «Характеристика растительных аквапоринов». Осмосенсорство и осмосигнализация . Методы энзимологии. Том. 428. стр. 505–31. дои : 10.1016/S0076-6879(07)28028-0 . ISBN 978-0-12-373921-6 . ПМИД 17875436 .
- ^ Каммерлохер В., Фишер Ю., Печоттка Г.П., Шеффнер А.Р. (1994). «Водные каналы в плазматической мембране растений, клонированные путем иммуноселекции из системы экспрессии млекопитающих» . Плант Дж . 6 (2): 187–99. дои : 10.1046/j.1365-313X.1994.6020187.x . ПМИД 7920711 .
- ^ Маэсима М (2001). «ТОНОПЛАСТ ТРАНСПОРТЕРЫ: Организация и функции». Annu Rev Plant Physiol Plant Mol Biol . 52 (1): 469–497. дои : 10.1146/annurev.arplant.52.1.469 . ПМИД 11337406 .
- ^ Уоллес И.С., Чой В.Г., Робертс Д.М. (2006). «Структура, функции и регуляция нодулин-26-подобного семейства внутренних белков растительных акваглицеропоринов» . Биохим. Биофиз. Акта . 1758 (8): 1165–75. дои : 10.1016/j.bbamem.2006.03.024 . ПМИД 16716251 .
- ^ Йохансон У, Густавссон С (2002). «Новое подсемейство основных внутренних белков растений» . Мол. Биол. Эвол . 19 (4): 456–61. doi : 10.1093/oxfordjournals.molbev.a004101 . ПМИД 11919287 .
- ^ Йохансон, Урбан; Карлссон, Мария; Йоханссон, Ингела; Густавссон, София; Шёвалл, Сара; Фрайсс, Лора; Вейг, Альфонс Р.; Кьельбом, Пер (2001). «Полный набор генов, кодирующих основные внутренние белки арабидопсиса, обеспечивает основу для новой номенклатуры основных внутренних белков растений» . Физиология растений . 126 (4): 1358–1369. дои : 10.1104/стр.126.4.1358 . ПМК 117137 . ПМИД 11500536 .
- ^ Сад, Н; Шатиль-Коэн, А; Аттия, З; Морель, К; Бурсиак, Ю; Келли, Дж; Гранот, Д; Яаран, А; Лернер, С (1 ноября 2014 г.). «Роль аквапоринов плазматической мембраны в регуляции континуума оболочка-мезофилл и гидравлики листа» . Физиология растений . 166 (3): 1609–1620. дои : 10.1104/стр.114.248633 . ПМК 4226360 . ПМИД 25266632 .
- ^ Кальденхофф Р. , Фишер М. (2006). «Аквапорины в растениях». Акта Физиол (Oxf) . 187 (1–2): 169–76. дои : 10.1111/j.1748-1716.2006.01563.x . ПМИД 16734753 . S2CID 35656554 .
- ^ Азад А.К., Сава Ю., Исикава Т., Сибата Х. (2004). «Фосфорилирование аквапорина плазматической мембраны регулирует температурно-зависимое раскрытие лепестков тюльпана» . Физиол растительной клетки . 45 (5): 608–17. дои : 10.1093/pcp/pch069 . ПМИД 15169943 .
- ^ Азад А.К., Кацухара М., Сава Ю., Исикава Т., Сибата Х. (2008). «Характеристика четырех аквапоринов плазматической мембраны в лепестках тюльпана: предполагаемый гомолог регулируется фосфорилированием» . Физиология растительной клетки . 49 (8): 1196–208. дои : 10.1093/pcp/pcn095 . ПМИД 18567892 .
- ^ Хабудаев К.В., Петрова Д.П., Грачев М.А., Лихошвей Ю.В. (2014). «Новое подсемейство LIP основных внутренних белков» . БМК Геномика . 15 (1): 1–7. дои : 10.1186/1471-2164-15-173 . ПМК 4022174 . ПМИД 24589353 .
- ^ Окамура Т., Миёси И., Такахаси К., Мототани Ю., Исигаки С., Кон Ю., Касаи Н. (2003). «Двусторонняя врожденная катаракта возникает в результате мутации усиления функции гена аквапорина-0 у мышей» . Геномика . 81 (4): 361–8. дои : 10.1016/S0888-7543(03)00029-6 . ПМИД 12676560 .
- ^ Радин, М. Джудит; Ю, Мин-Джюн; Стоедкильде, Лене; Миллер, Р. Лэнс; Хофферт, Джейсон Д.; Фрокиер, Йорген; Писиткун, Трайрак; Неппер, Марк А. (06 марта 2017 г.). «Регулирование аквапорина-2 в здоровье и болезнях» . Ветеринарная клиническая патология . 41 (4): 455–470. дои : 10.1111/j.1939-165x.2012.00488.x . ПМК 3562700 . ПМИД 23130944 .
- ^ Кинг, Лэндон С; Чой, Майкл; Фернандес, Педро С; Картрон, Жан-Пьер; Агре, Питер (19 июля 2001 г.). «Нарушение концентрационной способности мочи из-за полного дефицита аквапорина-1» . Медицинский журнал Новой Англии . 345 (3): 175–179. дои : 10.1056/NEJM200107193450304 . ПМИД 11463012 .
- ^ Шнерманн, Юрген; Чжоу, Чунг-Лин; Ма, Тунхуэй; Трейнор, Тимоти; Неппер, Марк А; Веркман, А.С. (4 августа 1998 г.). «Нарушение реабсорбции жидкости в проксимальных канальцах у трансгенных мышей с нулевым аквапорином-1» . Труды Национальной академии наук Соединенных Штатов Америки . 95 (16): 9660–9664. Бибкод : 1998PNAS...95.9660S . дои : 10.1073/pnas.95.16.9660 . ПМК 21395 . ПМИД 9689137 .
- ^ Ханна А. (2006). «Приобретенный нефрогенный несахарный диабет». Семин. Нефрол . 26 (3): 244–8. doi : 10.1016/j.semphanrol.2006.03.004 . ПМИД 16713497 .
- ^ Кристенсен, С; Кусано, Э; Юсуфи, АН; Мураяма, Н.; Доуса, Т.П. (1 июня 1985 г.). «Патогенез нефрогенного несахарного диабета, вызванного хроническим введением лития крысам» . Журнал клинических исследований . 75 (6): 1869–1879. дои : 10.1172/JCI111901 . ПМК 425543 . ПМИД 2989335 .
- ^ Марплс, Д; Фрёкиер, Дж; Доруп, Дж; Кнеппер, Массачусетс; Нильсен, С. (15 апреля 1996 г.). «Вызванное гипокалиемией снижение экспрессии водных каналов аквапорина-2 в мозговом и корковом веществе почек крыс» . Журнал клинических исследований . 97 (8): 1960–1968. дои : 10.1172/JCI118628 . ПМК 507266 . ПМИД 8621781 .
- ^ Марплс, Д; Кристенсен, С; Кристенсен, Э.И.; Оттосен, доктор медицинских наук; Нильсен, С. (1 апреля 1995 г.). «Вызванное литием снижение экспрессии водных каналов аквапорина-2 в мозговом веществе почек крысы» . Журнал клинических исследований . 95 (4): 1838–1845. дои : 10.1172/JCI117863 . ПМК 295720 . ПМИД 7535800 .
Внешние ссылки
[ редактировать ]- Аквапорины Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)
- Анимация ( MPEG на сайте nobel.se) файл
- Группа вычислительной биомолекулярной динамики. «Аквапориновые фильмы и картинки» . Институт Макса Планка. Архивировано из оригинала 25 апреля 2006 года . Проверено 23 января 2008 г.
- Группа теоретической и вычислительной биофизики. «Структура, динамика и функции аквапоринов» . Университет Иллинойса в Урбана-Шампейн . Проверено 23 января 2008 г.