Хлорид железа(III)
| |||
| |||
| Имена | |||
|---|---|---|---|
| ИЮПАК имена
Хлорид железа(III)
Трихлорид железа | |||
Другие имена
| |||
| Идентификаторы | |||
| |||
3D model ( JSmol )
|
|||
| КЭБ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.028.846 | ||
| Номер ЕС |
| ||
ПабХим CID
|
|||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ |
| ||
| Число |
| ||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| FeCl 3 | |||
| Молярная масса |
| ||
| Появление | Зелено-черный в отраженном свете; пурпурно-красный в проходящем свете; желтое твердое вещество в виде гексагидрата; коричневый в виде водного раствора | ||
| Запах | Незначительная HCl | ||
| Плотность |
| ||
| Температура плавления | 307,6 ° C (585,7 ° F; 580,8 К) (безводный) 37 ° C (99 ° F, 310 К) (гексагидрат) [ 1 ] | ||
| Точка кипения |
| ||
| 912 г/л (безводный или гексагидрат, 25 °C) [ 1 ] | |||
| Растворимость в |
| ||
| +13,450·10 −6 см 3 /моль [ 2 ] | |||
| Вязкость | 12 ц П (40% раствор) | ||
| Опасности [ 4 ] [ 5 ] [ Примечание 1 ] | |||
| СГС Маркировка : | |||
 
| |||
| Опасность | |||
| Х290 , Х302 , Х314 | |||
| P234 , P260 , P264 , P270 , P273 , P280 , P301+P312 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P321 , П363 , П390 , П405 , П406 , П501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | Невоспламеняющийся | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
РЕЛ (рекомендуется)
|
СВВ 1 мг/м 3 [ 3 ] | ||
| Паспорт безопасности (SDS) | КМГС | ||
| Родственные соединения | |||
Другие анионы
|
|||
Другие катионы
|
|||
Родственные коагулянты
|
|||
| Структура | |||
| Шестиугольный , hR24 | |||
| Р 3 , № 148 [ 7 ] | |||
а = 0,6065 нм, б = 0,6065 нм, с = 1,742 нм α = 90°, β = 90°, γ = 120°
| |||
Формульные единицы ( Z )
|
6 | ||
| Октаэдрический | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
Хлорид железа(III) описывает неорганические соединения формулой Fe Cl 3 (H 2 O) x . Эти соединения, также называемые хлоридом железа , являются одними из наиболее важных и распространенных соединений железа. Они доступны как в безводной, так и в гидратированной формах, которые гигроскопичны . Они содержат железо в степени окисления +3 . Безводное производное представляет собой кислоту Льюиса , при этом все формы являются мягкими окислителями. Используется как очиститель воды и травитель металлов .
Электронные и оптические свойства
[ редактировать ]
Все формы хлорида железа являются парамагнитными из-за наличия неспаренных электронов, находящихся на 3d-орбиталях. Хотя хлорид Fe(III) может быть октаэдрическим или тетраэдрическим (или и тем, и другим, см. раздел «Структура»), все эти формы имеют пять неспаренных электронов, по одному на d-орбиталь . Высокий спин d 5 Электронная конфигурация требует, чтобы dd-электронные переходы были запрещены по спину , помимо нарушения правила Лапорта . Эта двойная запретность приводит к тому, что ее решения имеют лишь бледный цвет. Или, выражаясь более технически, оптические переходы неинтенсивны. Водный сульфат железа и нитрат железа , которые содержат [Fe(H 2 O) 6 ] 3+ , почти бесцветны, тогда как растворы хлоридов имеют желтый цвет. Таким образом, хлоридные лиганды существенно влияют на оптические свойства железного центра. [ 8 ] [ 9 ]
Структура
[ редактировать ]Хлорид железа (III) может существовать в виде безводного вещества и ряда гидратов, что приводит к образованию различных структур.
безводный
[ редактировать ]Безводное соединение представляет собой гигроскопичное кристаллическое твердое вещество с температурой плавления 307,6 °C. Цвет зависит от угла обзора: в отраженном свете кристаллы кажутся темно-зелеными, а в проходящем свете — пурпурно-красными. Безводный хлорид железа(III) имеет BiI 3 Структура , с октаэдрическими центрами Fe(III), соединенными между собой двухкоординированными хлоридными лигандами . [ 7 ] [ 10 ]
Хлорид железа(III) имеет относительно низкую температуру плавления и кипит при температуре около 315 °C. Пар состоит из димера Fe 2 Cl 6 , очень похож на хлорид алюминия . Этот димер диссоциирует на мономерный FeCl 3 (с D 3h точечной группы молекулярной симметрией ) при более высоких температурах, конкурируя с его обратимым разложением с образованием хлорида железа (II) и газообразного хлора . [ 11 ]
Гидраты
[ редактировать ]Хлорид железа образует гидраты при воздействии воды, что отражает ее кислотность по Льюису. Все гидраты проявляют расплывание , то есть они становятся жидкими, поглощая влагу из воздуха. Гидратация неизменно дает производные аквакомплексов формулы [FeCl 2 (H 2 O) 4 ] + . Этот катион может принимать транс- или цис -стереохимию , что отражает относительное расположение хлоридных лигандов в октаэдрическом центре Fe. охарактеризованы четыре гидрата Методом рентгеновской кристаллографии : дигидрат FeCl 3 ·2H 2 O , дисквигидрат FeCl 3 ·2,5H 2 O , триполуторный гидрат FeCl 3 ·3,5H 2 O и, наконец, гексагидрат. FeCl 3 ·6H 2 O . Эти виды различаются по стереохимии октаэдрического катиона железа, идентичности анионов и наличию или отсутствию кристаллизационной воды . [ 9 ] Структурные формулы [ транс -FeCl 2 (H 2 O) 4 ][FeCl 4 ] , [ цис -FeCl 2 (H 2 O) 4 ][FeCl 4 ] · H 2 O , [ цис -FeCl 2 (H 2 O) 4 ][FeCl 4 ]·H 2 O и [ транс -FeCl 2 (H 2 O) 4 ]Cl·2H 2 O . Первые три члена этого ряда имеют тетраэдрический тетрахлорферрат ( [FeCl 4 ] − ) анион. [ 12 ]
Решение
[ редактировать ]
Водные растворы хлорида железа, как и твердые гидраты, также состоят из октаэдрических [FeCl 2 (H 2 O) 4 ] + неустановленной стереохимии. [ 9 ] Детальное определение водных растворов хлорида железа затруднено, поскольку отдельные компоненты не имеют отличительных спектроскопических признаков. Комплексы железа(III) с высоким спином d 5 конфигурация кинетически лабильна, что означает, что лиганды быстро диссоциируют и повторно связываются. Еще одна сложность состоит в том, что эти растворы являются сильнокислыми, как и ожидалось для аквакомплексов трикатионного металла. Аквокомплексы железа склонны к олатированию , образованию полимерных оксопроизводных . Разбавленные растворы хлорида железа образуют растворимые наночастицы с молекулярной массой 10. 4 , которые проявляют свойство «старения», т. е. структура меняется или развивается в течение суток. [ 13 ] Полимерные соединения, образующиеся в результате гидролиза хлоридов железа, являются ключом к использованию хлорида железа для очистки воды.
В отличие от сложного поведения его водных растворов, растворы хлорида железа(III) в диэтиловом эфире и тетрагидрофуране ведут себя хорошо. Оба эфира 1:2 образуют аддукты общей формулы FeCl 3 (эфир) 2 . В этих комплексах железо пятикоординировано. [ 14 ]
Подготовка
[ редактировать ]Ежегодно производится несколько сотен тысяч килограммов безводного хлорида железа(III). Основной метод, называемый прямым хлорированием , использует в качестве прекурсора железный лом: [ 10 ]
- 2 Fe + 3 Cl 2 → 2 FeCl 3
Реакцию проводят при температуре несколько сотен градусов, так что продукт становится газообразным. Использование избытка хлора гарантирует переход промежуточного хлорида железа в состояние трехвалентного железа. [ 10 ] Был также описан аналогичный процесс, но в лабораторном масштабе. [ 15 ] [ 16 ]
Водные растворы хлорида железа(III) также производятся в промышленности из ряда прекурсоров железа, в том числе оксидов железа:
- Fe 2 O 3 + 6 HCl + 9 H 2 O → 2 FeCl 3 (H 2 O) 6
Дополнительным путем металлическое железо можно окислить соляной кислотой с последующим хлорированием: [ 10 ]
- Fe + 2 HCl → FeCl 2 + H 2
- FeCl 2 + 0,5 Cl 2 + 6 H 2 O → FeCl 3 (H 2 O) 6
К этим процессам применим ряд переменных, включая окисление железа хлоридом железа и гидратацию промежуточных продуктов. [ 10 ] Гидраты хлорида железа (III) с трудом дают безводный хлорид железа. Попытка термической дегидратации дает соляную кислоту и оксихлорид железа . В лаборатории гидратированный хлорид железа(III) можно перевести в безводную форму обработкой тионилхлоридом . [ 17 ] или триметилсилилхлорид : [ 18 ]
- FeCl 3 6H 2 O + 12 (CH 3 ) 3 SiCl → FeCl 3 + 6 ((CH 3 ) 3 Si) 2 O + 12 HCl
- FeCl 3 6H 2 O + 6 SOCl 2 → FeCl 3 + 6 SO 2 + 12 HCl
Реакции
[ редактировать ]Будучи высоким спином d 5 Хлориды железа(III) с электронной конфигурацией лабильны , а это означает, что его лиганды Cl- и H 2 O быстро обмениваются со свободными хлоридами и водой. [ 9 ] [ 19 ] В отличие от своей кинетической лабильности, хлориды железа (III) термодинамически устойчивы, о чем свидетельствуют энергичные методы их синтеза, как описано выше.
Безводный FeCl 3
[ редактировать ]Помимо лабильности, которая свойственна безводным и гидратированным формам, реакционная способность безводного хлорида железа обнаруживает две тенденции: это кислота Льюиса и окислитель . [ 20 ]
Реакции безводного хлорида железа (III) отражают его описание как оксофильной и жесткой кислоты Льюиса . Известны многочисленные проявления оксофильности хлорида железа(III). При нагревании с оксидом железа(III) при 350 °C он реагирует с образованием оксихлорида железа : [ 21 ]
- FeCl 3 + Fe 2 O 3 → 3FeOCl
щелочных металлов Алкоксиды железа (III) реагируют с образованием комплексов алкоксидов . Эти продукты имеют более сложную структуру, чем безводный хлорид железа(III). [ 22 ] [ 23 ] В твердой фазе описано множество многоядерных комплексов с номинальной стехиометрической реакцией между FeCl 3 и этоксид натрия :
- FeCl 3 + 3 CH 3 CH 2 ONa → «Fe(OCH 2 CH 3 ) 3 » + 3 NaCl
1:2 Хлорид железа (III) образует аддукт с основаниями Льюиса, такими как оксид трифенилфосфина ; например, FeCl 3 (OP(C 6 H 5 ) 3 ) 2 . Родственный комплекс 1:2 FeCl 3 (OEt 2 ) 2 , где Et = C 2 H 5 ) , кристаллизовали из эфирного раствора. [ 14 ]
Хлорид железа (III) также реагирует с хлоридом тетраэтиламмония с образованием желтой соли тетрахлорферрат- иона ( (Et 4 N)[FeCl 4 ] ). Аналогично, соединение FeCl 3 с NaCl и KCl дает Na[FeCl 4 ] и K[FeCl 4 ] соответственно. [ 24 ]
В дополнение к этим простым стехиометрическим реакциям кислотность Льюиса хлорида железа позволяет использовать его в различных реакциях, катализируемых кислотами , как описано ниже в разделе, посвященном органической химии. [ 10 ]
Будучи окислителем, хлорид железа(III) окисляет железный порошок с образованием хлорида железа(II) посредством реакции сопропорционирования : [ 10 ]
- 2 FeCl 3 + Fe → 3 FeCl 2
Традиционный синтез безводного хлорида железа восстановление FeCl 3 хлорбензолом : представляет собой [ 25 ]
- 2 FeCl 3 + C 6 H 5 Cl → 2 FeCl 2 + C 6 H 4 Cl 2 + HCl
Хлорид железа(III) выделяет газообразный хлор при нагревании выше 160 °C, образуя хлорид железа : [ 16 ]
- 2FeCl 3 → 2FeCl 2 + Cl 2
Для подавления этой реакции получение хлорида железа(III) требует избытка хлорирующего агента, как обсуждалось выше. [ 16 ] [ 10 ]
Гидратированный FeCl 3
[ редактировать ]В отличие от безводного материала, гидратированное хлорид железа не является особенно сильной кислотой Льюиса, поскольку водные лиганды гасят кислотность Льюиса путем связывания с Fe (III).
Как и безводный материал, гидрат хлорида железа является оксофильным. Например, соли оксалата быстро реагируют с водным раствором хлорида железа (III) с образованием [Fe(C 2 O 4 ) 3 ] 3− , известный как ферриоксалат . Другие источники карбоксилатов , например цитрат и тартрат , также связываются с образованием карбоксилатных комплексов . Сродство железа(III) к кислородным лигандам послужило основой качественных исследований фенолов. заменяется спектроскопическими методами, Несмотря на то, что тест с хлоридом железа он является традиционным колориметрическим тестом. [ 26 ] Сродство железа(III) к фенолам используется в точечном тесте Триндера . [ 27 ]
Водный хлорид железа (III) служит одноэлектронным окислителем, о чем свидетельствует его реакция с хлоридом меди (I) с образованием хлорида меди (II) и хлорида железа (II).
- FeCl 3 + CuCl → FeCl 2 + CuCl 2
Эта фундаментальная реакция имеет отношение к использованию растворов хлорида железа при травлении меди.
Металлоорганическая химия
[ редактировать ]взаимодействие безводного хлорида железа(III) с литий- и магнийорганическими соединениями Часто исследуют . Эти исследования возможны благодаря растворимости FeCl 3 в эфирных растворителях, что позволяет избежать возможности гидролиза нуклеофильных алкилирующих агентов . Такие исследования могут иметь отношение к механизму FeCl 3 катализируемых реакций кросс-сочетания, . [ 28 ] Выделение железоорганических интермедиатов требует низкотемпературных реакций, чтобы [FeR 4 ] − промежуточные продукты деградируют. Использование метилмагнийбромида в качестве алкилирующего агента, соли Fe(CH 3 ) 4 ] − были изолированы. [ 29 ] Иллюстрируя чувствительность этих реакций, метиллитий LiCH 3 реагирует с хлоридом железа(III) с образованием тетрахлорферрата лития (II). Li 2 [FeCl 4 ] : [ 30 ]
- 2 FeCl 3 + LiCH 3 → FeCl 2 + Li[FeCl 4 ] + 0,5 CH 3 CH 3
- Li[FeCl 4 ] + LiCH 3 → Li 2 [FeCl 4 ] + 0,5 CH 3 CH 3
В значительной степени ацетилацетонат железа(III) и родственные ему бета-дикетонатные комплексы находят более широкое применение, чем FeCl 3 , в качестве эфирорастворимых источников ионов трехвалентного железа. [ 20 ] Преимуществом этих дикетонатных комплексов является то, что они не образуют гидратов, в отличие от хлорида железа (III), и более растворимы в соответствующих растворителях. [ 28 ] Циклопентадиенилмагний бромид вступает в сложную реакцию с хлоридом железа (III), в результате чего образуется ферроцен : [ 31 ]
- 3 C 5 H 5 MgBr + FeCl 3 → Fe(C 5 H 5 ) 2 + 1/n (C 5 H 5 ) n + 3 MgBrCl
Это преобразование, хотя и не имело практического значения, имело важное значение в истории металлоорганической химии , где ферроцен является символом этой области. [ 32 ]
Использование
[ редактировать ]Очистка воды
[ редактировать ]Наибольшее применение хлорид железа(III) находит в очистке сточных вод и производстве питьевой воды . Формируя высокодисперсные сети материалов, содержащих Fe-O-Fe, хлориды железа служат коагулянтами и флокулянтами. [ 33 ] В этом применении водный раствор FeCl 3 обрабатывают основанием с образованием хлопьев гидроксида железа (III) ( Fe(OH) 3 ), также формулируемый как FeO(OH) ( ферригидрит ). Этот флок способствует отделению взвешенных веществ, осветляя воду. [ 10 ]
Хлорид железа (III) также используется для удаления растворимых фосфатов из сточных вод. Фосфат железа(III) нерастворим и поэтому выпадает в осадок в виде твердого вещества. [ 34 ] Одним из потенциальных преимуществ его использования при очистке воды является то, что ионы железа окисляют (дезодорируют) сероводород . [ 35 ]
Травление и очистка металла
[ редактировать ]Его также используют в качестве выщелачивающего агента в хлоридной гидрометаллургии. [ 36 ] например, при производстве Si из FeSi (процесс Silgrain от Elkem ). [ 37 ]
В другом коммерческом применении раствор хлорида железа (III) полезен для травления меди в соответствии со следующим уравнением:
- 2 FeCl 3 + Cu → 2 FeCl 2 + CuCl 2
Растворимый хлорид меди(II) смывается, оставляя медный узор. Эта химия используется при производстве печатных плат (PCB). [ 19 ]
Хлорид железа(III) используется во многих других хобби, связанных с металлическими предметами. [ 38 ] [ 39 ] [ 40 ] [ 41 ] [ 42 ]
Органическая химия
[ редактировать ]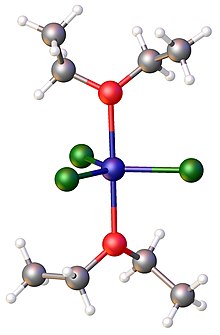
В промышленности хлорид железа(III) используется в качестве катализатора реакции этилена с хлором с образованием этилендихлорида ( 1,2-дихлорэтана ): [ 43 ]
- H 2 C=CH 2 + Cl 2 → ClCH 2 CH 2 Cl
Дихлорид этилена – товарный химикат , который в основном используется для промышленного производства винилхлорида , мономера для производства ПВХ . [ 44 ]
Иллюстрируя его использование в качестве кислоты Льюиса , хлорид железа (III) катализирует электрофильное ароматическое замещение и хлорирование . В этой роли его функция аналогична функции хлорида алюминия . В некоторых случаях используются смеси этих двух веществ. [ 45 ]
Исследования органического синтеза
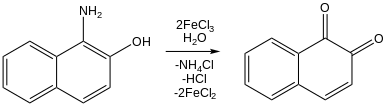
[ редактировать ]Хотя хлориды железа(III) редко используются в практическом органическом синтезе , они получили значительное внимание в качестве реагентов, поскольку они недороги, богаты землей и относительно нетоксичны. Многие эксперименты исследуют как его окислительно-восстановительную активность, так и кислотность по Льюису. [ 20 ] Например, хлорид железа(III) окисляет нафтолы до нафтохинонов: [ 20 ] [ 46 ] 3- Алкилтиофены полимеризуются в политиофены при обработке хлоридом железа. [ 47 ] Было показано, что хлорид железа (III) способствует реакции сочетания CC . [ 48 ]
Разработано несколько реагентов на основе нанесенного хлорида железа(III). На силикагеле безводная соль применялась для некоторых реакций дегидратации и перегруппировки типа пинакола . Аналогичный реагент, но увлажненный, вызывает гидролиза или эпимеризации . реакции [ 49 ] на оксиде алюминия Было показано, что хлорид железа ускоряет еновые реакции . [ 50 ]
При предварительной обработке гидридом натрия гидрида хлорид железа (III) дает восстановитель , который превращает алкены и кетоны в алканы и спирты соответственно. [ 51 ]
Гистология
[ редактировать ]Хлорид железа (III) является компонентом полезных красителей, таких как раствор Карнуа , гистологический фиксатор, имеющий множество применений. Кроме того, его используют для приготовления окраски Верховева . [ 52 ]
Естественное явление
[ редактировать ]Как и многие галогениды металлов, FeCl 3 в природе встречается в виде микроэлемента. Редкий минерал молизит обычно связан с вулканами и фумаролами . [ 53 ] [ 54 ]
Аэрозоли на основе FeCl 3 производятся в результате реакции между богатой железом пылью и соляной кислотой морской соли. Этот аэрозоль солей железа вызывает около 1–5% естественного окисления метана и, как полагают, оказывает ряд охлаждающих эффектов; таким образом, он был предложен в качестве катализатора удаления метана из атмосферы . [ 55 ]
облака Венеры содержат примерно 1% Предполагается, что FeCl 3 растворяют в серной кислоте . [ 56 ] [ 57 ]
Безопасность
[ редактировать ]Хлориды железа(III) широко используются при очистке питьевой воды . [ 10 ] поэтому они не представляют особых проблем как яды при низких концентрациях. [ неправильный синтез? ] Тем не менее, безводный хлорид железа(III), а также концентрированный Fe Cl 3 Водный раствор обладает высокой коррозионной активностью , поэтому при обращении с ним необходимо использовать соответствующие защитные средства. [ 20 ]
Примечания
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж Хейнс WM, изд. (2011). Справочник CRC по химии и физике (92-е изд.). Бока-Ратон, Флорида: CRC Press . п. 4.69. ISBN 1-4398-5511-0 .
- ^ Хейнс WM, изд. (2011). Справочник CRC по химии и физике (92-е изд.). Бока-Ратон, Флорида: CRC Press . п. 4.133. ISBN 1-4398-5511-0 .
- ^ Карманный справочник NIOSH по химическим опасностям. «#0346» . Национальный институт безопасности и гигиены труда (NIOSH).
- ^ Информационная база данных химической классификации HSNO , Управление по управлению экологическими рисками Новой Зеландии , получено 19 сентября 2010 г.
- ^ Различные поставщики , по данным Стоматологического колледжа Бэйлора Техасского университета A&M . (по состоянию на 19 сентября 2010 г.)
- ^ Классификация СГС — ID 831 , Межведомственный комитет СГС Японии, 2006 г. , дата обращения 19 сентября 2010 г.
- ^ Перейти обратно: а б Хасимото С., Форстер К., Мосс С.К. (1989). «Уточнение структуры кристалла FeCl 3 по образцу тонкой пластины». Дж. Прил. Кристаллогр. 22 (2): 173–180. Бибкод : 1989JApCr..22..173H . дои : 10.1107/S0021889888013913 .
- ^ Housecroft CE, Sharpe AG (2012). Неорганическая химия (4-е изд.). Прентис Холл. п. 747. ИСБН 978-0-273-74275-3 .
- ^ Перейти обратно: а б с д Саймон А. Коттон (2018). «Хлорид железа (III) и его координационная химия». Журнал координационной химии . 71 (21): 3415–3443. дои : 10.1080/00958972.2018.1519188 . S2CID 105925459 .
- ^ Перейти обратно: а б с д и ж г час я дж Вильдермут Э., Старк Х., Фридрих Г., Эбенхёх Ф.Л., Кюборт Б., Сильвер Дж., Ритупер Р. (2000). «Соединения железа». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a14_591 . ISBN 3527306730 .
- ^ Холлеман А.Ф., Виберг Э. (2001). Виберг Н. (ред.). Неорганическая химия . Сан-Диего: Академическая пресса. ISBN 978-0-12-352651-9 .
- ^ Линд, доктор медицинских наук (1967). «Кристаллическая структура гексагидрата хлорида железа» . Журнал химической физики . 47 (3): 990–993. Бибкод : 1967ЖЧФ..47..990Л . дои : 10.1063/1.1712067 .
- ^ Флинн СМ (1984). «Гидролиз неорганических солей железа (III)». Химические обзоры . 84 : 31–41. дои : 10.1021/cr00059a003 .
- ^ Перейти обратно: а б Спандл Дж., Куссеров М., Брюдгам И. (2003). «Алкоксосоединения трехвалентного железа: Синтез и характеристика [Fe2(Ot Bu )6], [Fe2Cl2(Ot Bu )4], [Fe2Cl4(Ot Bu )2] и [N(n Bu )4]2[Fe6OCl6 ( ОМе)12]" . Журнал неорганической и общей химии . 629 (6): 968–974. дои : 10.1002/zaac.200300008 .
- ^ Тарр Б.Р., Бут Х.С., Доланс А. (1950). «Безводный хлорид железа (III) (хлорид железа)». Неорганические синтезы . Том. 3. С. 191–194. дои : 10.1002/9780470132340.ch51 . ISBN 9780470131626 .
- ^ Перейти обратно: а б с Х. Люкс (1963). «Хлорид железа (III)». В Г. Брауэре (ред.). Справочник по препаративной неорганической химии, 2-е изд . Том. 2. Нью-Йорк, Нью-Йорк: Академик Пресс. п. 1492.
- ^ Молитесь А.Р., Хейтмиллер Р.Ф., Страйкер С. и др. (1990). «Безводные хлориды металлов». Неорганические синтезы . Том. 28. С. 321–323. дои : 10.1002/9780470132593.ch80 . ISBN 9780470132593 .
- ^ Буджук П., Со Дж.Х., Акерманн М.Н. и др. (1992). «Сольватированные и несольватированные безводные хлориды металлов из гидратов хлоридов металлов». Неорганические синтезы . Том. 29. С. 108–111. дои : 10.1002/9780470132609.ch26 . ISBN 9780470132609 .
- ^ Перейти обратно: а б Гринвуд Н.Н., Эрншоу А. (1997). Химия элементов (2-е изд.). Оксфорд: Баттерворт-Хайнеманн . п. 1084. ИСБН 9780750633659 .
- ^ Перейти обратно: а б с д и Уайт А.Д., Галлоу Ф (2006). «Хлорид железа (III)». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.ri054.pub2 . ISBN 0471936235 .
- ^ Киккава С., Канамару Ф., Коидзуми М. и др. (1984). «Слоистые интеркаляционные соединения». Ин Холт С.Л. младший (ред.). Неорганические синтезы . Том. 22. John Wiley & Sons, Inc., стр. 86–89. дои : 10.1002/9780470132531.ch17 . ISBN 9780470132531 .
- ^ Турова Н.Ю., Туревская Е.П., Кесслер В.Г. и др., ред. (2002). «12.22.1 Синтез». Химия алкоксидов металлов . Спрингер Наука. п. 481. ИСБН 0306476576 .
- ^ Брэдли, округ Колумбия, Мехротра Р.К., Ротвелл И. и др. (2001). «3.2.10. Алкоксиды поздних 3d-металлов» . Алкоксо- и арилоксопроизводные металлов . Сан-Диего: Академическая пресса. п. 69. ИСБН 9780121241407 . OCLC 162129468 .
- ^ Кук СМ-младший, Данн ВИ-младший (1961). «Реакция хлорида железа с хлоридами натрия и калия». Дж. Физ. Хим . 65 (9): 1505–1511. дои : 10.1021/j100905a008 .
- ^ П. Ковачич и NO Brace (1960). «Хлорид железа (II)». Неорганические синтезы . Том. 6. С. 172–173. дои : 10.1002/9780470132371.ch54 . ISBN 9780470132371 .
- ^ Фернисс Б.С., Ханнафорд А.Дж., Смит П.В. и др. (1989). Учебник практической органической химии Фогеля (5-е изд.). Нью-Йорк: Лонгман / Уайли . ISBN 9780582462366 .
- ^ Джеймс А. Кинг, Алан Б. Сторроу, Джефф А. Финкельштейн (1995). «Точечный тест мочи на триндере: быстрый салицилатный тест для отделения неотложной помощи». Анналы неотложной медицины . 26 (3): 330–333. дои : 10.1016/S0196-0644(95)70082-X . ПМИД 7661424 .
- ^ Перейти обратно: а б Мако Т.Л., Байерс Дж.А. (2016). «Последние достижения в реакциях перекрестного сочетания, катализируемых железом, и их механистическая основа». Границы неорганической химии . 3 (6): 766–790. дои : 10.1039/C5QI00295H .
- ^ Сирс Дж.Д., Муньос С.Б., Куэнка МК, Бреннессел В.В., Нейдиг М.Л. (2019). «Синтез и характеристика стерически обремененного гомолептического комплекса феррата тетраалкилжелеза (III)» . Многогранник . 158 : 91–96. дои : 10.1016/j.poly.2018.10.041 . ПМК 6481957 . ПМИД 31031511 . и ссылки в нем.
- ^ Бертольд Х.Дж., Шпигль Х.Дж. (1972). «Об образовании тетрахлорферрата(II) лития Li 2 FeCl 4 при взаимодействии хлорида железа(III) с метилом лития (1:1) в эфирном растворе». З. Анорг. Общая хим. (на немецком языке). 391 (3): 193–202. дои : 10.1002/zaac.19723910302 .
- ^ Кили Т.Дж., Паусон П.Л. (1951). «Новый тип железоорганических соединений». Природа . 168 (4285): 1040. Бибкод : 1951Natur.168.1039K . дои : 10.1038/1681039b0 . S2CID 4181383 .
- ^ Паусон П.Л. (2001). «Ферроцен — как все начиналось». Журнал металлоорганической химии . 637–639: 3–6. дои : 10.1016/S0022-328X(01)01126-3 .
- ^ Химикаты для очистки воды (PDF) . Базовые химикаты Akzo Nobel . 2007. Архивировано из оригинала (PDF) 13 августа 2010 года . Проверено 26 октября 2007 г.
- ^ «Технологии очистки и удаления фосфора» (PDF) . Агентство по контролю за загрязнением Миннесоты . Июнь 2006 года.
- ^ Пратна ТК, Шривастава А (2021). «Хлорид железа для контроля запаха: исследования на очистных сооружениях в Индии» . Водная практика и технологии . 16 (1): 35–41. дои : 10.2166/wpt.2020.111 . S2CID 229396639 .
- ^ Пак К.Х., Мохапатра Д., Редди БР (2006). «Исследование подкисленного хлорида железа выщелачивания сложного (Cu–Ni–Co–Fe) файнштейна». Технология разделения и очистки . 51 (3): 332–337. дои : 10.1016/j.seppur.2006.02.013 .
- ^ Дуэньяс Диес М., Фьелд М., Андерсен Э. и др. (2006). «Подтверждение модели баланса послойной популяции процесса промышленного выщелачивания: процесс Silgrain». хим. англ. наук. 61 (1): 229–245. Бибкод : 2006ЧЭнС..61..229Д . дои : 10.1016/j.ces.2005.01.047 .
- ^ Джон Дэвид Грэм. «Более безопасная печать — глубокая печать» . Университет Саскачевана . Проверено 5 февраля 2024 г.
- ^ Харрис П., Хартман Р., Хартман Дж. (1 ноября 2002 г.). «Офорт железных метеоритов» . Метеорит Таймс . Проверено 14 октября 2016 г.
- ^ Майк Локвуд, Карл Самбуто. «Сообщение о покраске и перекраске зеркал» . Локвуд Кастом Оптикс, Инк . Изготовленная на заказ оптика Локвуда . Проверено 5 февраля 2024 г.
- ^ CoinValueLookup (13 декабря 2023 г.). «Буффало-никель без даты: сколько он стоит сегодня?» . Поиск значения монеты . Проверено 5 февраля 2024 г.
- ^ Скотт Д., Шваб Р. (2019). «3.1.4. Офорт». Металлография в археологии и искусстве . Наука о культурном наследии. Спрингер. дои : 10.1007/978-3-030-11265-3 . ISBN 978-3-030-11265-3 . S2CID 201676001 .
- ^ Дреер Э.Л., Бойтель К.К., Майерс Дж.Д., Люббе Т., Кригер С., Поттенгер Л.Х. (2014). «Хлорэтаны и хлорэтилены». Энциклопедия промышленной химии Ульмана . стр. 1–81. дои : 10.1002/14356007.o06_o01.pub2 . ISBN 9783527306732 .
- ^ «Токсичные вещества – 1,2-Дихлорэтан» . АЦДР . Проверено 30 августа 2023 г.
- ^ Ридделл В.А., Ноллер Ч.Р. (1932). «Смешанный катализ в реакции Фриделя и Крафта. Выходы в типичных реакциях с использованием смесей хлорида железа и хлорида алюминия в качестве катализаторов». Дж. Ам. хим. Соц . 54 (1): 290–294. дои : 10.1021/ja01340a043 .
- ^ Луи Ф. Физер (1937). «1,2-Нафтохинон». Органические синтезы . 17:68 . дои : 10.15227/orgsyn.017.0068 .
- ^ Итак RC, Карреон-Асок AC (2019). «Молекулярный дизайн, синтетические стратегии и применение катионных политиофенов». Химические обзоры . 119 (21): 11442–11509. doi : 10.1021/acs.chemrev.8b00773 . ПМИД 31580649 . S2CID 206542971 .
- ^ Олбрайт Х., Дэвис А.Дж., Гомес-Лопес Дж.Л., Вонеш Х.Л., Куах П.К., Ламберт Т.Х., Шиндлер К.С. (2021). «Метатезис карбонил-олефинов» . Химические обзоры . 121 (15): 9359–9406. doi : 10.1021/acs.chemrev.0c01096 . ПМЦ 9008594 . ПМИД 34133136 .
- ^ Белый А.Д. (2001). «Хлорид железа (III)-силикагель». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.ri059 . ISBN 0471936235 .
- ^ Белый А.Д. (2001). «Хлорид железа(III)-глинозем». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.ri057 . ISBN 0471936235 .
- ^ Белый А.Д. (2001). «Хлорид железа (III)-гидрид натрия». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.ri060 . ISBN 0471936235 .
- ^ Мэллори, Шиэн, Храпчак (1990). «Эластичная окраска Верховева». В Карсоне Ф., Каппеллано CH (ред.). Гистотехнология – учебник для самообучения . Чикаго: ASCP Press . Проверено 2 января 2013 г. - через The Visible Mouse Project, Калифорнийский университет в Дэвисе .
- ^ «Молизит» . Mindat.org . Миндат . Проверено 5 февраля 2024 г.
- ^ «Список минералов IMA» . Международная минералогическая ассоциация . 21 марта 2011 года . Проверено 5 февраля 2024 г.
- ^ Оэсте Ф.Д., де Рихтер Р., Минг Т., Кайоль С. (13 января 2017 г.). «Климатическая инженерия путем имитации климат-контроля природной пыли: метод аэрозоля солей железа» . Динамика системы Земли . 8 (1): 1–54. Бибкод : 2017ESD.....8....1O . doi : 10.5194/esd-8-1-2017 – через esd.copernicus.org.
- ^ Краснопольский В.А., Паршев В.А. (1981). «Химический состав атмосферы Венеры». Природа . 292 (5824): 610–613. Бибкод : 1981Natur.292..610K . дои : 10.1038/292610a0 . S2CID 4369293 .
- ^ Краснопольский В.А. (2006). «Химический состав атмосферы и облаков Венеры: некоторые нерешенные проблемы». Планетарная и космическая наука . 54 (13–14): 1352–1359. Бибкод : 2006P&SS...54.1352K . дои : 10.1016/j.pss.2006.04.019 .
Дальнейшее чтение
[ редактировать ]- Лиде ДР, изд. (1990). Справочник CRC по химии и физике (71-е изд.). Анн-Арбор, Мичиган, США: CRC Press. ISBN 9780849304712 .
- Стечер П.Г., Финкель М.Дж., Зигмунд О.Х., ред. (1960). Индекс химических веществ и лекарств Merck (7-е изд.). Рэуэй, Нью-Джерси, США: Merck & Co.
- Николлс Д. (1974). Комплексы и переходные элементы первого ряда, Macmillan Press, Лондон, 1973 . Текст Макмиллана по химии. Лондон: Макмиллан Пресс. ISBN 9780333170885 .
- Уэллс А. Ф. (1984). Структурная неорганическая химия . Оксфордские научные публикации (5-е изд.). Оксфорд, Великобритания: Издательство Оксфордского университета. ISBN 9780198553700 .
- Райх HJ, Ригби HJ, ред. (1999). Кислотные и основные реагенты . Справочник реагентов для органического синтеза. John Wiley & Sons, Inc. Нью-Йорк: ISBN 9780471979258 .




