Синтетическая биология

| Часть серии статей о |
| Синтетическая биология |
|---|
| Синтетические биологические цепи |
| Редактирование генома |
| Искусственные клетки |
| Ксенобиология |
| Другие темы |
Синтетическая биология ( SynBio ) — это междисциплинарная область науки, которая фокусируется на живых системах и организмах и применяет инженерные принципы для разработки новых биологических частей, устройств и систем или для перепроектирования существующих систем, встречающихся в природе. [1]
Это отрасль науки, которая охватывает широкий спектр методологий из различных дисциплин, таких как биотехнология , биоматериалы , материаловедение/инженерия , генная инженерия , молекулярная биология , молекулярная инженерия , системная биология , мембранная наука , биофизика , химическая и биологическая инженерия . электротехника и вычислительная техника , техника управления и эволюционная биология .
Это включает в себя проектирование и создание биологических модулей , биологических систем и биологических машин или перепроектирование существующих биологических систем для полезных целей. [2]
Кроме того, это отрасль науки, которая фокусируется на новых способностях инженерии существующих организмов с целью перепроектирования их для полезных целей. [3]
Чтобы создать предсказуемые и надежные системы с новыми функциями, которые еще не существуют в природе, необходимо также применить инженерную парадигму проектирования систем к биологическим системам. По мнению Европейской комиссии , это, возможно, связано с молекулярным ассемблером, основанным на биомолекулярных системах, таких как рибосома . [4]
История [ править ]
1910: Первое заметное использование термина «синтетическая биология» в Стефана Ледюка публикации «Физико-химическая теория жизни и спонтанные поколения» . [5] Он также отметил этот термин в другой публикации La Biologie Synthétique в 1912 году. [6]
1944 : Канадско-американский учёный Освальд Эйвери показывает, что ДНК — это материал, из которого гены и хромосомы состоят . Это становится основой, на которой строятся все последующие генетические исследования. [7]
1953 : Фрэнсис Крик и Джеймс Уотсон публикуют структуру ДНК в природе .
1961 : Джейкоб и Моно постулируют клеточную регуляцию с помощью молекулярных сетей на основе исследования lac- оперона в E. coli и предвидят возможность собирать новые системы из молекулярных компонентов. [8]
1973 : Первое молекулярное клонирование и амплификация ДНК в плазмиде опубликовано в PNAS Коэном, Бойером и др. представляет собой рассвет синтетической биологии. [9]
1978 : Арбер , Натанс и Смит получают Нобелевскую премию по физиологии и медицине за открытие ферментов рестрикции , что побудило Шибальского сделать редакционный комментарий в журнале Gene :
Работа над нуклеазами рестрикции не только позволяет нам легко конструировать молекулы рекомбинантной ДНК и анализировать отдельные гены, но также привела нас в новую эру синтетической биологии, где не только описываются и анализируются существующие гены, но также могут быть созданы новые структуры генов. и оценено. [10]
1988 : Первая амплификация ДНК с помощью полимеразной цепной реакции (ПЦР) с использованием термостабильной ДНК-полимеразы опубликована в журнале Science Mullis et al. [11] Это позволило избежать добавления новой ДНК-полимеразы после каждого цикла ПЦР, что значительно упростило мутагенез и сборку ДНК.
2000 : В двух статьях в журнале Nature сообщается о синтетических биологических схемах , генетическом переключателе и биологических часах, созданных путем объединения генов в E. coli . клетках [12] [13]
2003 наиболее широко используемые стандартизированные части ДНК, плазмиды BioBrick изобрел : Том Найт . [14] Эти детали станут центральными в Международном конкурсе генно-инженерных машин (iGEM), основанном в Массачусетском технологическом институте в следующем году.
2003 : Исследователи разрабатывают путь предшественника артемизинина в E. coli . [15]
2004 : В Массачусетском технологическом институте проводится первая международная конференция по синтетической биологии Synthetic Biology 1.0 (SB1.0).
2005 : Исследователи разрабатывают светочувствительную схему в E. coli . [16] Другая группа разрабатывает схемы, способные формировать многоклеточные структуры. [17]
2006 : Исследователи разрабатывают синтетическую схему, которая способствует бактериальной инвазии в опухолевые клетки. [18]
2010 : Исследователи публикуют в журнале Science первый синтетический бактериальный геном под названием M. mycoides JCVI-syn1.0. [19] [20] Геном состоит из химически синтезированной ДНК с помощью рекомбинации дрожжей.
2011 : В дрожжах созданы функциональные синтетические плечи хромосом. [21]
2012 : Шарпантье и Дудна Лаборатории публикуют в журнале Science информацию о программировании бактериального иммунитета CRISPR-Cas9 для направленного расщепления ДНК. [22] Эта технология значительно упростила и расширила редактирование генов эукариот.
2019 : Ученые из ETH Zurich сообщают о создании первого бактериального генома под названием Caulobacter ethensis-2.0 , полностью созданного с помощью компьютера, хотя родственная жизнеспособная форма C. ethensis-2.0 пока не существует. [23] [24]
2019 : Исследователи сообщают о создании новой синтетической (возможно, искусственной ) формы жизнеспособной жизни , варианта бактерий Escherichia coli , путем сокращения естественного числа 64 кодонов в бактериальном геноме до 59 кодонов вместо этого, чтобы кодировать 20 аминокислот. кислоты . [25] [26]
2020 : Ученые создали первого ксенобота — программируемый синтетический организм, полученный из клеток лягушки и созданный искусственным интеллектом. [27]
2021 : Ученые сообщили, что ксеноботы способны самовоспроизводиться, собирая рыхлые клетки в окружающей среде и затем формируя новых ксеноботов. [28]
Перспективы [ править ]
Это область, масштабы которой расширяются с точки зрения системной интеграции, создания организмов и практических открытий. [1]
Инженеры рассматривают биологию как технологию (иными словами, данная система включает в себя биотехнологию или ее биологическую инженерию ). [29] Синтетическая биология включает в себя широкое переопределение и расширение биотехнологии с конечной целью создания возможности проектировать и создавать живые биологические системы, которые обрабатывают информацию, манипулируют химическими веществами, производят материалы и структуры, производят энергию, обеспечивают пищу, а также поддерживают и улучшают здоровье человека. , а также расширять фундаментальные знания о биологических системах и наша окружающая среда. [30]
Исследователи и компании, работающие в области синтетической биологии, используют силу природы для решения проблем в сельском хозяйстве, производстве и медицине. [3]
Благодаря более мощным возможностям генной инженерии и снижению затрат на синтез ДНК и секвенирование область синтетической биологии быстро растет. В 2016 году более 350 компаний в 40 странах активно занимались приложениями синтетической биологии; чистая стоимость всех этих компаний на мировом рынке оценивалась в 3,9 миллиарда долларов. [31] Синтетическая биология в настоящее время не имеет общепринятого определения. Вот несколько примеров:
Это наука о развитии генетической и физической инженерии для создания новых (и, следовательно, синтетических) форм жизни. Для разработки организмов с новыми или улучшенными характеристиками эта новая область исследований объединяет знания и методы биологии, инженерии и смежных дисциплин для создания химически синтезированной ДНК. [32] [33]
Биомолекулярная инженерия включает подходы, направленные на создание набора функциональных единиц, которые можно внедрить для реализации новых технологических функций в живых клетках. Генная инженерия включает подходы к созданию синтетических хромосом или минимальных организмов, таких как Mycoplasma Laboratorium .
Биомолекулярный дизайн относится к общей идее дизайна de novo и аддитивной комбинации биомолекулярных компонентов. Каждый из этих подходов преследует схожую задачу: разработать более синтетический объект на более высоком уровне сложности, изобретательно манипулируя более простой частью на предыдущем уровне. [34] [35] Оптимизация этих экзогенных путей в неестественных системах требует итеративной тонкой настройки отдельных биомолекулярных компонентов для выбора самых высоких концентраций желаемого продукта. [36]
С другой стороны, «переписчики» — это синтетические биологи, заинтересованные в проверке нередуцируемости биологических систем. Из-за сложности естественных биологических систем было бы проще восстановить представляющие интерес природные системы с нуля; предоставить инженерные суррогаты, которые легче понять, контролировать и манипулировать. [37] Рерайтеры черпают вдохновение в рефакторинге — процессе, который иногда используется для улучшения компьютерного программного обеспечения.
Категории [ править ]
Биоинженерия, синтетическая геномика, синтетическая биология протоклеток, нетрадиционная молекулярная биология и методы in silico — это пять категорий синтетической биологии. [38]
Необходимо рассмотреть различия и аналогии между категориями синтетической биологии для ее социальной и этической оценки, разграничить проблемы, затрагивающие всю область, и частные, относящиеся к конкретной. [38]
Биоинженерия [ править ]
Подобласть биоинженерии концентрируется на создании новых метаболических и регуляторных путей и в настоящее время, вероятно, привлекает внимание большинства исследователей и финансирование. В первую очередь это мотивировано желанием сделать биотехнологию законной инженерной дисциплиной. Говоря об этой области синтетической биологии, слово «биоинженерия» не следует путать с «традиционной генной инженерией», которая предполагает введение единственного трансгена в предполагаемый организм. Биоинженеры адаптировали синтетическую биологию, чтобы обеспечить существенно более комплексный взгляд на то, как изменять организмы или метаболические системы. [38]
Типичным примером одногенной генной инженерии является вставка человеческого гена инсулина в бактерии для создания трансгенных белков. Создание совершенно новых сигнальных путей, содержащих многочисленные гены и регуляторные компоненты (таких как колебательный контур, инициирующий периодическое производство зеленого флуоресцентного белка (GFP) в клетках млекопитающих), известно как биоинженерия как часть синтетической биологии. [38]
Используя упрощенные и абстрактные метаболические и регуляторные модули, а также другие стандартизированные части, которые можно свободно комбинировать для создания новых путей или существ, биоинженерия стремится создать инновационные биологические системы. Ожидается, что эта стратегия не только создаст безграничные возможности для новых приложений, но и сделает биоинженерию более предсказуемой и контролируемой, чем традиционная биотехнология. [38]
Синтетическая геномика [ править ]
Формирование животных с химически изготовленным (минимальным) геномом — еще один аспект синтетической биологии, который подчеркивается синтетической геномикой. Эта область синтетической биологии стала возможной благодаря постоянному развитию технологии синтеза ДНК, которая теперь позволяет производить молекулы ДНК с тысячами пар оснований по разумной цене. Цель состоит в том, чтобы объединить эти молекулы в полные геномы и трансплантировать их в живые клетки, заменив геном клетки-хозяина и перепрограммировав ее метаболизм для выполнения различных функций. [38]
Ученые ранее продемонстрировали потенциал этого подхода, создавая инфекционные вирусы путем синтеза геномов нескольких вирусов. Эти значительные достижения в области науки и техники вызвали первоначальную обеспокоенность общественности относительно рисков, связанных с этой технологией. [38]
Простой геном может также работать как «геном шасси», который можно быстро увеличить за счет включения генов, созданных для определенных задач. Такие «существа-шасси» больше подходят для внедрения новых функций, чем дикие организмы, поскольку у них будет меньше биологических путей, которые потенциально могут конфликтовать с новыми функциями, в дополнение к наличию определенных мест вставки. Синтетическая геномика стремится создать существ с новой «архитектурой», очень похожей на метод биоинженерии. Он принимает интегративный или целостный взгляд на организм. В этом случае целью является создание геномов шасси на основе необходимых генов и других необходимых последовательностей ДНК, а не разработка метаболических или регуляторных путей на основе абстрактных критериев. [38]
биология Синтетическая протоклеток
Генерация синтетических клеток in vitro является протоклеточной отраслью синтетической биологии. Липидные везикулы, которые имеют все необходимые компоненты для функционирования как целостной системы, могут быть использованы для создания таких искусственных клеток. В конце концов, эти синтетические клетки должны отвечать требованиям, позволяющим считаться живыми, а именно способности к самовоспроизведению, самоподдержанию и эволюции. Это конечная цель метода протоклеток, однако существуют и другие промежуточные шаги, которые не соответствуют всем критериям живой клетки. Для выполнения определенной функции эти липидные везикулы содержат клеточные экстракты или более специфические наборы биологических макромолекул и сложных структур, таких как ферменты, нуклеиновые кислоты или рибосомы. Например, липосомы могут осуществлять определенные полимеразные цепные реакции или синтезировать определенный белок. [38]
Синтетическая биология протоклеток приближает искусственную жизнь на шаг ближе к реальности, в конечном итоге синтезируя не только геном, но и каждый компонент клетки in vitro, в отличие от подхода синтетической геномики, который основан на принуждении естественной клетки выполнять инструкции, закодированные введенный синтетический геном. Синтетические биологи в этой области рассматривают свою работу как фундаментальное исследование условий, необходимых для существования жизни и ее происхождения, больше, чем любые другие методы. Однако метод протоклеток также хорошо пригоден для применения; Подобно другим побочным продуктам синтетической биологии, протоклетки можно использовать для производства биополимеров и лекарств. [38]
молекулярная Нетрадиционная биология
Целью стратегии «неестественной молекулярной биологии» является создание новых разновидностей жизни, основанных на другом виде молекулярной биологии, например, на новых типах нуклеиновых кислот или новом генетическом коде. Создание новых типов нуклеотидов, которые могут быть встроены в уникальные нуклеиновые кислоты, может быть достигнуто путем изменения определенных компонентов ДНК или РНК, таких как основания или сахара основной цепи. [38]
Нормальный генетический код изменяется путем вставки четверных кодонов или изменения некоторых кодонов для кодирования новых аминокислот, что впоследствии позволит использовать неприродные аминокислоты с уникальными характеристиками в производстве белка. Научная и технологическая проблема заключается в настройке ферментативного аппарата клетки для обоих подходов. [38]
Новый вид жизни будет сформирован организмами, геном которых будет построен на синтетических нуклеиновых кислотах или на совершенно новой системе кодирования синтетических аминокислот. Этот новый образ жизни будет иметь некоторые преимущества, но также и некоторые новые опасности. При выпуске в окружающую среду не будет горизонтального переноса генов или ауткроссинга генов с природными видами. Более того, подобные синтетические организмы могут быть созданы так, чтобы для синтеза белков или нуклеиновых кислот требовались неприродные материалы, что сделало бы их неспособными процветать в дикой природе, если бы они случайно сбежали. [38]
С другой стороны, если бы эти организмы в конечном итоге смогли выжить за пределами контролируемого космоса, они могли бы иметь особое преимущество перед природными организмами, поскольку были бы устойчивы к хищным живым организмам или природным вирусам, что могло бы привести к неуправляемому распространению синтетических организмов. организмы. [38]
В силиконовой технике [ править ]
Синтетическая биология in silico и различные стратегии взаимосвязаны. Разработка сложных конструкций, будь то метаболические пути, фундаментальные клеточные процессы или геномы шасси, является одной из основных трудностей, с которыми сталкиваются четыре метода синтетической биологии, изложенные выше. По этой причине синтетическая биология имеет мощную ветвь in silico, аналогичную системной биологии, целью которой является создание вычислительных моделей для проектирования общих биологических компонентов или синтетических схем, которые по сути являются симуляциями синтетических организмов. [38]
Практическое применение симуляций и моделей в биоинженерии или других областях синтетической биологии является долгосрочной целью синтетической биологии in silico. Многие из компьютерных моделей синтетических организмов, созданных до сих пор, практически не имеют прямой аналогии с живыми существами. В связи с этим синтетическая биология in silico выделена в данной статье в отдельную группу. [38]
Целесообразно объединить пять областей под эгидой синтетической биологии как единую область исследований. Несмотря на то, что они сосредоточены на различных аспектах жизни, таких как регуляция обмена веществ, основные элементы или биохимический состав, все эти пять стратегий направлены на одну и ту же цель: создание новых типов живых организмов. Кроме того, разнообразные методологии начинаются с многочисленных методологических подходов, что приводит к разнообразию подходов синтетической биологии. [38]
Синтетическая биология — это междисциплинарная область, основанная на множестве различных научных дисциплин, а не на какой-то одной области или методе. Все синтетические биологи преследуют одну и ту же основную цель — проектирование и создание новых форм жизни, несмотря на то, что они могут использовать различные методологии, методы и исследовательские инструменты. Любая оценка синтетической биологии, независимо от того, рассматривает ли она этические, юридические соображения или соображения безопасности, должна учитывать тот факт, что, хотя некоторые вопросы, риски и проблемы уникальны для каждого метода, в других обстоятельствах необходимо рассматривать синтетическую биологию в целом. во внимание. [38]
Четыре инженерных подхода [ править ]
Синтетическая биология традиционно делится на четыре различных инженерных подхода: сверху вниз, параллельно, ортогонально и снизу вверх. [39]
Чтобы воспроизвести возникающее поведение из естественной биологии и создать искусственную жизнь, используются неестественные химические вещества. Другой ищет взаимозаменяемые компоненты биологических систем, чтобы соединить их и создать системы, которые не работают естественным образом. В любом случае синтетическая цель вынуждает исследователей выходить в новую область, чтобы заняться и решить проблемы, которые не могут быть легко решены с помощью анализа. В связи с этим возникают новые парадигмы, которые не могут быть легко реализованы при анализе. Помимо оборудования, которое колеблется, ползет и играет в крестики-нолики, синтетическая биология создала диагностические инструменты, которые улучшают лечение пациентов с инфекционными заболеваниями. [40]
Нисходящий подход [ править ]
Он предполагает использование методов метаболической и генной инженерии для придания новых функций живым клеткам. [41] Сравнивая универсальные гены и исключая несущественные для создания базового генома, этот метод стремится уменьшить сложность существующих клеток. Эти инициативы основаны на гипотезе единого происхождения клеточной жизни, так называемого « Последнего универсального общего предка» , которая подтверждает наличие универсального минимального генома, давшего начало всем живым существам. Однако недавние исследования открывают возможность того, что эукариотические и прокариотические клетки, составляющие древо жизни, могли возникнуть из группы первичных клеток, а не из одной клетки. В результате, даже несмотря на то, что стремление к «минимальному геному», подобное Святому Граалю, стало неуловимым, исключение ряда несущественных функций ухудшает приспособленность организма и приводит к «хрупким» геномам. [39]
Подход «снизу вверх» [ править ]
Этот подход предполагает создание новых биологических систем in vitro путем объединения «неживых» биомолекулярных компонентов. [42] часто с целью создания искусственной клетки .
Воспроизведение, репликация и сборка — три важнейших принципа самоорганизации, которые принимаются во внимание для достижения этой цели. Клетки, состоящие из контейнера и метаболизма, считаются «аппаратным обеспечением» в определении воспроизводства, тогда как репликация происходит, когда система дублирует точную копию самой себя, как в случае с ДНК, которая считается «программным обеспечением». " Когда везикулы или контейнеры (такие как коацерваты Опарина) образуются из крошечных капель органических молекул, таких как липиды или липосомы, происходит агрегирование и сборка мембраноподобных структур, содержащих фосфолипиды. [39]
Изучение протоклеток существует наряду с другими инициативами в области синтетической биологии in vitro, которые направлены на производство минимальных клеток, метаболических путей или «нерожденных белков», а также на имитацию физиологических функций, включая деление и рост клеток. Улучшение синтетических путей in vitro действительно может оказать влияние на некоторые другие отрасли синтетической биологии, включая метаболическую инженерию, несмотря на то, что оно больше не классифицируется как исследования синтетической биологии. Это исследование, имеющее прежде всего важное значение, заслуживает должного признания как исследование синтетической биологии. [39]
Параллельный подход [ править ]
Параллельная инженерия также известна как биоинженерия. Базовый генетический код является основой для параллельных инженерных исследований, в которых обычные биомолекулы, такие как нуклеиновые кислоты и 20 аминокислот, используются для построения биологических систем. Для различных приложений в области биокомпьютеров, биоэнергетики, биотоплива, биоремедиации, оптогенетики и медицины он включает стандартизацию компонентов ДНК, разработку переключателей, биосенсоров, генетических схем, логических вентилей и операторов сотовой связи. Для управления экспрессией двух или более генов и/или белков большинство этих приложений часто основано на использовании одного или нескольких векторов (или плазмид). Небольшие кольцевые двухцепочечные единицы ДНК, известные как плазмиды, которые в основном обнаруживаются в прокариотических клетках, но иногда могут обнаруживаться и в эукариотических клетках, могут реплицироваться автономно хромосомной ДНК. [39]
подход Ортогональный
Это также известно как перпендикулярная инженерия. Эта стратегия, также называемая «химической синтетической биологией», главным образом направлена на изменение или расширение генетических кодов живых систем с использованием искусственных оснований ДНК и/или аминокислот. Это подразделение также связано с ксенобиологией , недавно разработанной областью, которая сочетает в себе системную химию, синтетическую биологию, экзобиологию и исследования происхождения жизни. В последние десятилетия исследователи создали соединения, структурно подобные каноническим основам ДНК, чтобы выяснить, могут ли эти «чужеродные» или ксеномолекулы (XNA) использоваться в качестве носителей генетической информации. Аналогично этому, неканонические фрагменты заняли место сахара ДНК ( дезоксирибозы ). [39] Чтобы выразить информацию, отличную от 20 обычных аминокислот белков, генетический код может быть изменен или расширен. Один метод включает включение определенной неприродной, неканонической или ксеноаминокислоты (ХАА) в один или несколько белков в одном или нескольких определенных местах с использованием ортогональных ферментов и адаптера транспортной РНК из другого организма. Используя «направленную эволюцию», которая влечет за собой повторяющиеся циклы мутагенеза генов (производство генотипического разнообразия), скрининга или отбора (специфического фенотипического признака) и амплификации лучшего варианта для следующего итерационного раунда, образуются ортогональные ферменты. был эффективно включен в белки более сложных существ, таких как черви и мухи, а также в бактерии, дрожжи и клеточные линии человека. В результате изменения канонических последовательностей ДНК направленная эволюция также позволяет развивать ортогональные рибосомы, которые облегчают включение XAA в белки или создают «зеркальную жизнь» или биологические системы, содержащие биомолекулы, состоящие из энантиомеров с различной хиральной ориентацией. [39]
Включающие технологии [ править ]
Несколько новых технологий сыграли решающую роль в успехе синтетической биологии. Концепции включают стандартизацию биологических частей и иерархическую абстракцию, позволяющую использовать эти части в синтетических системах. [43] ДНК служит руководством к тому, как должны функционировать биологические процессы, подобно партитуре сложной симфонии жизни. Наша способность понимать и проектировать биологические системы претерпела значительные изменения в результате достижений последних нескольких десятилетий как в чтении (секвенировании), так и в записи (синтезе) последовательностей ДНК. Эти разработки привели к появлению новаторских методов проектирования, сборки и модификации кодируемых ДНК генов, материалов, цепей и метаболических путей, что позволяет постоянно возрастать степень контроля над биологическими системами и даже целыми организмами. [44]
Базовые технологии включают чтение и запись ДНК (секвенирование и изготовление). Измерения в различных условиях необходимы для точного моделирования и автоматизированного проектирования (САПР).
ДНК и синтез генов [ править ]
Благодаря резкому снижению затрат на синтез олигонуклеотидов («олиго») и появлению ПЦР, размеры конструкций ДНК из олигонуклеотидов увеличились до геномного уровня. [45] размером 9,6 кб (кило пар оснований) В 2000 году исследователи сообщили о синтезе генома вируса гепатита С из химически синтезированных 60-80-меров. [46] В 2002 году исследователям из Университета Стоуни-Брук удалось синтезировать геном полиовируса длиной 7741 п.о. из его опубликованной последовательности, создав второй синтетический геном, продолжавшийся два года. [47] В 2003 году геном бактериофага Phi X 174 длиной 5386 п.н. был собран примерно за две недели. [48] В 2006 году та же команда из Института Дж. Крейга Вентера сконструировала и запатентовала синтетический геном новой минимальной бактерии Mycoplasma Laboratorium и работала над тем, чтобы заставить ее функционировать в живой клетке. [49] [50] [51]
В 2007 году сообщалось, что несколько компаний предлагали синтез генетических последовательностей длиной до 2000 пар оснований (п.н.) по цене около 1 доллара за п.н. и со сроком выполнения менее двух недель. [52] Олигонуклеотиды, полученные с фотолитографического или струйного изготовления ДНК-чипа в сочетании с ПЦР и коррекцией ошибок несоответствия ДНК, позволяют недорого осуществлять крупномасштабные изменения кодонов в генетических системах для улучшения экспрессии генов или включения новых аминокислот (см. работу Джорджа М. Черча ). и проекты синтетических клеток Энтони Форстера. [53] [54] ) . Это благоприятствует подходу синтеза с нуля.
Кроме того, система CRISPR/Cas стала многообещающим методом редактирования генов. Его охарактеризовали как «самую важную инновацию в области синтетической биологии почти за 30 лет». [55] В то время как другие методы требуют месяцев или лет для редактирования последовательностей генов, CRISPR ускоряет это время до недель. [55] Однако из-за простоты использования и доступности он вызвал этические проблемы, особенно в связи с его использованием в биохакинге . [56] [57] [58]
Секвенирование [ править ]
Секвенирование ДНК определяет порядок нуклеотидных оснований в молекуле ДНК. Синтетические биологи используют секвенирование ДНК в своей работе несколькими способами. Во-первых, крупномасштабные усилия по секвенированию генома продолжают предоставлять информацию о природных организмах. Эта информация обеспечивает богатую основу, из которой синтетические биологи могут конструировать детали и устройства. Во-вторых, секвенирование может подтвердить, что изготовленная система соответствует своему замыслу. В-третьих, быстрое, дешевое и надежное секвенирование может способствовать быстрому обнаружению и идентификации синтетических систем и организмов. [59]
Модульность [ править ]
Это способность системы или компонента работать без привязки к своему контексту. [60]
Наиболее используемый [61] : 22–23 стандартизированные части ДНК представляют собой плазмиды BioBrick , изобретенные Томом Найтом в 2003 году. [14] Биокирпичики хранятся в Реестре стандартных биологических частей в Кембридже, штат Массачусетс. Стандарт BioBrick использовался десятками тысяч студентов по всему миру в международном конкурсе генно-инженерных машин (iGEM). Стандарт сборки BioBrick 10 способствует модульности, позволяя сращивать и заменять кодирующие последовательности BioBrick с помощью ферментов рестрикции EcoRI или XbaI (префикс BioBrick), а также SpeI и PstI (суффикс BioBrick). [61] : 22–23
Перекрытие последовательностей между двумя генетическими элементами ( генами или кодирующими последовательностями ), называемое перекрывающимися генами , может предотвратить их индивидуальное манипулирование. [62] Для повышения модульности генома применяется практика рефакторинга генома или улучшения «внутренней структуры существующей системы для будущего использования при одновременном сохранении функций внешней системы». [63] был принят во всех дисциплинах синтетической биологии. [62] Некоторые примечательные примеры рефакторинга, включая кластер азотфиксации [64] и система секреции типа III [65] совместно с бактериофагами Т7 [63] и ΦX174. [66]
Хотя ДНК наиболее важна для хранения информации, большая часть клеточной деятельности осуществляется белками. Инструменты могут отправлять белки в определенные области клетки и связывать разные белки вместе. Сила взаимодействия между белками-партнерами должна регулироваться в диапазоне от нескольких секунд (желательно для динамических сигнальных событий) до необратимого взаимодействия (желательно для стабильности устройства или устойчивости к суровым условиям). Взаимодействия, такие как свернутые катушки , [67] домена SH3 с пептидом Связывание [68] или SpyTag/SpyCatcher [69] предложить такой контроль. Кроме того, необходимо регулировать белок-белковые взаимодействия в клетках, например, со светом (с использованием доменов, чувствительных к свету, кислороду и напряжению ) или проницаемыми для клеток небольшими молекулами путем химически индуцированной димеризации . [70]
В живой клетке молекулярные мотивы встроены в более крупную сеть с вышестоящими и нижестоящими компонентами. Эти компоненты могут изменить возможности сигнализации модуля моделирования. В случае сверхчувствительных модулей вклад чувствительности модуля может отличаться от чувствительности, которую модуль поддерживает изолированно. [71] [72]
Моделирование [ править ]
Модели служат основой для проектирования инженерных биологических систем, лучше предсказывая поведение системы до ее изготовления. Синтетическая биология извлекает выгоду из лучших моделей того, как биологические молекулы связывают субстраты и катализируют реакции, как ДНК кодирует информацию, необходимую для определения клетки, и как ведут себя многокомпонентные интегрированные системы. Многомасштабные модели сетей генной регуляции ориентированы на приложения синтетической биологии. Моделирование может моделировать все биомолекулярные взаимодействия в транскрипции , трансляции , регуляции и индукции генных регуляторных сетей. [73] [74] [75] [76]
Только обширное моделирование может позволить изучить динамическую экспрессию генов в форме, подходящей для исследований и проектирования, из-за большого количества задействованных видов и сложности их взаимоотношений. Динамическое моделирование всех биомолекулярных взаимосвязей, участвующих в регуляции, транспорте, транскрипции, индукции и трансляции, позволяет детализировать конструкции на молекулярном уровне. В отличие от моделирования искусственных сетей апостериорно, это контрастирует. [77]
Микрофлюидика [ править ]
Микрофлюидика , в частности капельная микрофлюидика, — это новый инструмент, используемый для создания новых компонентов, а также для их анализа и характеристики. [78] [79] Он широко используется в скрининговых анализах. [80]
факторы Синтетические транскрипции
Исследования рассмотрели компоненты механизма транскрипции ДНК . Одним из желаний ученых, создающих синтетические биологические схемы, является возможность контролировать транскрипцию синтетической ДНК в одноклеточных организмах ( прокариотах ) и в многоклеточных организмах ( эукариотах ). В одном исследовании проверялась регулируемость синтетических транскрипционных факторов (sTF) в областях транскрипционной продукции и кооперативной способности среди множества комплексов транскрипционных факторов. [81] Исследователи смогли мутировать функциональные области, называемые «цинковыми пальцами» , ДНК-специфический компонент sTF, чтобы уменьшить их сродство к конкретным сайтам последовательностей операторной ДНК и, таким образом, уменьшить связанную с этим сайт-специфическую активность sTF (обычно регуляцию транскрипции). Далее они использовали цинковые пальцы в качестве компонентов комплексообразующих sTF, которые являются механизмами трансляции эукариот . [81]
Приложения [ править ]
Инициативы в области синтетической биологии часто направлены на перепроектирование организмов, чтобы они могли создавать материалы, такие как лекарства или топливо, или приобретать новые функции, такие как способность чувствовать что-то в окружающей среде. Примеры того, что исследователи создают с помощью синтетической биологии, включают:
- Использование микроорганизмов для биоремедиации для удаления загрязнений из воды, почвы и воздуха.
- Производство сложных натуральных продуктов, которые обычно извлекаются из растений, но не могут быть получены в достаточных количествах, например, лекарств природного происхождения, таких как артемизинин и паклитаксел .
- Бета-каротин, вещество, обычно связанное с морковью и предотвращающее дефицит витамина А, вырабатывается модифицированным рисом. Ежегодно от 250 000 до 500 000 детей теряют зрение из-за дефицита витамина А, что также значительно повышает их вероятность умереть от инфекционных инфекций.
- В качестве устойчивой и экологически безопасной альтернативы свежим розам, которые парфюмеры используют для создания дорогих запахов, были созданы дрожжи для производства розового масла. [82]
Биосенсоры [ править ]
понимается Под биосенсором сконструированный организм, обычно бактерия, который способен сообщать о некоторых явлениях окружающей среды, таких как присутствие тяжелых металлов или токсинов. Одной из таких систем является оперон Lux Aliivibrio fischeri . [83] который кодирует фермент, являющийся источником бактериальной биолюминесценции , и может быть помещен после соответствующего промотора для экспрессии генов люминесценции в ответ на определенный стимул окружающей среды. [84] Один из таких созданных датчиков представлял собой биолюминесцентное бактериальное покрытие на светочувствительном компьютерном чипе, предназначенное для обнаружения определенных нефти загрязнителей . Когда бактерии чувствуют загрязняющее вещество, они люминесцируют. [85] Другим примером подобного механизма является обнаружение мин с помощью сконструированного репортерного штамма E.coli, способного обнаруживать TNT и его основной продукт деградации DNT и, следовательно, производить зеленый флуоресцентный белок ( GFP ). [86]
Модифицированные организмы могут воспринимать сигналы окружающей среды и посылать выходные сигналы, которые можно обнаружить и использовать в диагностических целях. Использовались когорты микробов. [87]
Биосенсоры также могут использоваться для обнаружения признаков патогенов, таких как SARS-CoV-2 , и могут быть носимыми . [88] [89]
С целью обнаружения и реагирования на различные временные факторы окружающей среды клетки разработали широкий спектр регуляторных цепей, от транскрипционных до посттрансляционных. Эти схемы состоят из модулей преобразователей, которые фильтруют сигналы и активируют биологический ответ, а также тщательно спроектированных чувствительных секций, которые присоединяют аналиты и регулируют пороги обнаружения сигналов. Модульность и селективность запрограммированы в биосенсорных цепях на транскрипционном, трансляционном и посттрансляционном уровнях для достижения тонкого баланса двух основных сенсорных модулей. [90]
Еда и напитки [ править ]
Однако не все синтетические продукты питания являются продуктами питания для животных – например, по состоянию на 2021 год существуют также продукты из синтетического кофе , которые, как сообщается, близки к коммерциализации. [98] [99] [100] Аналогичными областями исследований и производства, основанными на синтетической биологии, которые можно использовать для производства продуктов питания и напитков, являются:
- Генетически модифицированные микробные пищевые культуры (например, для белкового порошка на основе солнечной энергии) [101] [102]
- Бесклеточный искусственный синтез (например, синтетический крахмал ; [103] [104] )
Материалы [ править ]
Фотосинтезирующие микробные клетки использовались как шаг к синтетическому производству паучьего шелка . [105] [106]
Биологические компьютеры [ править ]
Биологический компьютер относится к инженерной биологической системе, которая может выполнять операции, подобные компьютеру, что является доминирующей парадигмой в синтетической биологии. Исследователи построили и охарактеризовали множество логических элементов у ряда организмов. [107] и продемонстрировал как аналоговые, так и цифровые вычисления в живых клетках. Они продемонстрировали, что бактерии можно спроектировать для выполнения как аналоговых, так и/или цифровых вычислений. [108] [109] В 2007 году исследования в клетках человека продемонстрировали универсальный логический процессор, работающий в клетках млекопитающих. [110] Впоследствии в 2011 году исследователи использовали эту парадигму для демонстрации экспериментальной терапии, которая использует биологические цифровые вычисления для обнаружения и уничтожения раковых клеток человека. [111] В 2016 году другая группа исследователей продемонстрировала, что принципы компьютерной инженерии можно использовать для автоматизации проектирования цифровых схем в бактериальных клетках. [112] В 2017 году исследователи продемонстрировали систему «булева логика и арифметика посредством вырезания ДНК» (BLADE) для создания цифровых вычислений в клетках человека. [113] В 2019 году исследователи внедрили персептрон в биологические системы, открыв путь машинному обучению в этих системах. [114]
Трансформация клеток [ править ]
Клетки используют взаимодействующие гены и белки, которые называются генными цепями, для реализации разнообразных функций, таких как реагирование на сигналы окружающей среды, принятие решений и общение. Задействованы три ключевых компонента: ДНК, РНК и синтетические биологи, разработанные генными цепями, которые могут контролировать экспрессию генов на нескольких уровнях, включая транскрипционный, посттранскрипционный и трансляционный уровни.
Традиционная метаболическая инженерия получила развитие за счет введения комбинаций чужеродных генов и оптимизации путем направленной эволюции. Это включает в себя разработку E. coli и дрожжей для коммерческого производства предшественника препарата противомалярийного Артемизинин . [115]
Целые организмы еще предстоит создать с нуля, хотя живые клетки можно трансформировать с помощью новой ДНК. Несколько способов позволяют создавать синтетические компоненты ДНК и даже целые синтетические геномы , но как только желаемый генетический код получен, он интегрируется в живую клетку, которая, как ожидается, будет проявлять желаемые новые способности или фенотипы во время роста и процветания. [116] Трансформация клеток используется для создания биологических цепей , которыми можно манипулировать для получения желаемых результатов. [12] [13]
Объединив синтетическую биологию с материаловедением , можно было бы использовать клетки в качестве микроскопических молекулярных фабрик для производства материалов, свойства которых были бы генетически закодированы. Реинжиниринг позволил создать волокна Керли, амилоидный компонент внеклеточного материала биопленок , в качестве платформы для программируемого наноматериала . Эти нановолокна были генетически сконструированы для выполнения определенных функций, включая адгезию к подложкам, создание шаблонов наночастиц и иммобилизацию белков. [117]
белки Разработанные

Природные белки могут быть сконструированы, например, путем направленной эволюции , могут быть созданы новые белковые структуры, которые соответствуют или улучшают функциональность существующих белков. Одна группа создала пучок спирали , который был способен связывать кислород со свойствами, подобными гемоглобину , но не связывал окись углерода . [119] Подобная белковая структура была создана для поддержки различных оксидоредуктазы . активностей [120] в то время как другой образовал структурно и последовательно новую АТФазу . [121] Другая группа создала семейство рецепторов, связанных с G-белком, которые могли быть активированы инертной небольшой молекулой N-оксида клозапина , но нечувствительны к нативному лиганду , ацетилхолину ; эти рецепторы известны как DREADD . [122] Новые функциональные возможности или специфичность белка также могут быть созданы с использованием вычислительных подходов. В одном исследовании удалось использовать два разных вычислительных метода: метод биоинформатики и молекулярного моделирования для анализа баз данных последовательностей и метод вычислительного проектирования ферментов для перепрограммирования специфичности фермента. Оба метода привели к созданию ферментов с более чем 100-кратной специфичностью для производства спиртов с более длинной цепью из сахара. [123]
Другое распространенное исследование — расширение природного набора из 20 аминокислот . Без учета стоп-кодонов 61 кодон идентифицирован , но в целом у всех организмов кодируется только 20 аминокислот. Определенные кодоны созданы для кодирования альтернативных аминокислот, включая: нестандартные аминокислоты, такие как O- метилтирозин ; или экзогенные аминокислоты, такие как 4-фторфенилаланин. Обычно в этих проектах используются перекодированные пары нонсенс-супрессор тРНК и аминоацил-тРНК-синтетаза из других организмов, хотя в большинстве случаев требуются серьезные инженерные разработки. [124]
Другие исследователи исследовали структуру и функцию белка, сокращая нормальный набор из 20 аминокислот. Ограниченные библиотеки последовательностей белков создаются путем создания белков, в которых группы аминокислот могут быть заменены одной аминокислотой. [125] Например, несколько неполярных аминокислот в белке можно заменить одной неполярной аминокислотой. [126] Один проект продемонстрировал, что сконструированная версия хоризматмутазы по -прежнему обладала каталитической активностью даже при использовании только девяти аминокислот. [127]
Исследователи и компании практикуют синтетическую биологию для синтеза промышленных ферментов с высокой активностью, оптимальным выходом и эффективностью. Эти синтезированные ферменты призваны улучшить такие продукты, как моющие средства и безлактозные молочные продукты, а также сделать их более экономически эффективными. [128] Усовершенствования метаболической инженерии с помощью синтетической биологии являются примером биотехнологического метода, используемого в промышленности для открытия фармацевтических препаратов и ферментирующих химикатов. Синтетическая биология может исследовать системы модульных путей в биохимическом производстве и повысить выход метаболического производства. Искусственная ферментативная активность и последующее влияние на скорость и выход метаболических реакций могут разработать «новые эффективные стратегии улучшения клеточных свойств... для промышленно важного биохимического производства». [129]
нуклеиновых Разработанные системы кислот
Ученые могут закодировать цифровую информацию в одной нити синтетической ДНК . В 2012 году Джордж М. Чёрч закодировал в ДНК одну из своих книг по синтетической биологии. Объем данных в 5,3 МБ был более чем в 1000 раз больше, чем предыдущий самый большой объем информации, хранившийся в синтезированной ДНК. [130] Похожий проект закодировал в ДНК полные сонеты Уильяма Шекспира . [131] В более общем плане такие алгоритмы, как NUPACK, [132] ВенаРНК, [133] Калькулятор сайта связывания рибосом, [134] Виолончель, [135] и калькулятор неповторяющихся деталей [136] позволяет создавать новые генетические системы.
Было разработано множество технологий включения неприродных нуклеотидов и аминокислот в нуклеиновые кислоты и белки как in vitro, так и in vivo. Например, в мае 2014 года исследователи объявили, что успешно внедрили в бактериальную ДНК два новых искусственных нуклеотида . Включив отдельные искусственные нуклеотиды в культуральную среду, они смогли заменить бактерии 24 раза; они не создали мРНК или белки, способные использовать искусственные нуклеотиды. [137] [138] [139]
Исследование космоса [ править ]
Синтетическая биология вызвала интерес НАСА , поскольку она может помочь производить ресурсы для астронавтов из ограниченного набора соединений, присылаемых с Земли. [140] [141] [142] На Марсе, в частности, синтетическая биология может привести к производственным процессам, основанным на местных ресурсах, что сделает ее мощным инструментом в развитии оккупированных аванпостов с меньшей зависимостью от Земли. [140] Работа была направлена на разработку штаммов растений, способных справиться с суровой марсианской средой, с использованием методов, аналогичных тем, которые используются для повышения устойчивости сельскохозяйственных культур к определенным факторам окружающей среды. [143]
Синтетическая жизнь [ править ]
Одной из важных тем синтетической биологии является синтетическая жизнь , которая касается гипотетических организмов, созданных in vitro из биомолекул и/или их химических аналогов . Эксперименты с синтетической жизнью пытаются либо исследовать происхождение жизни , изучить некоторые свойства жизни, либо, что более амбициозно, воссоздать жизнь из неживых ( абиотических ) компонентов. Синтетическая биология жизни пытается создать живые организмы, способные выполнять важные функции: от производства фармацевтических препаратов до детоксикации загрязненной земли и воды. [145] В медицине это открывает перспективы использования дизайнерских биологических частей в качестве отправной точки для новых классов методов лечения и диагностических инструментов. [145]
Живая «искусственная клетка» определяется как полностью синтетическая клетка, которая может улавливать энергию , поддерживать ионные градиенты , содержать макромолекулы , а также хранить информацию и обладать способностью мутировать . [146] Никто не смог создать такую клетку. [146]
Полностью синтетическая бактериальная хромосома была получена в 2010 году Крейгом Вентером , и его команда внедрила ее в опустошенные по геному бактериальные клетки-хозяева. [19] Клетки-хозяева были способны расти и размножаться. [147] [148] Лаборатория Микоплазмы — единственный живой организм с полностью модифицированным геномом.
Первый живой организм с «искусственным» расширенным кодом ДНК был представлен в 2014 году; команда использовала кишечную палочку , геном которой был извлечен и заменен хромосомой с расширенным генетическим кодом. нуклеозиды представляют Добавленные собой d5SICS и dNaM . [139]
В мае 2019 года исследователи сообщили о создании новой синтетической (возможно, искусственной ) формы жизнеспособной жизни , варианта бактерий Escherichia coli , путем сокращения естественного числа 64 кодонов в бактериальном геноме до 59 кодонов. , чтобы кодировать 20 аминокислот . [25] [26]
В 2017 году было начато международное Build-a-Cell по созданию синтетических живых клеток. крупномасштабное исследовательское сотрудничество с открытым исходным кодом [149] за ними следуют национальные организации по производству синтетических клеток в нескольких странах, включая FabriCell, [150] МаксСинБио [151] и БаСиК. [152] Европейские усилия по производству синтетических клеток были объединены в 2019 году в инициативу SynCellEU. [153]
В 2023 году исследователям удалось создать первые искусственно созданные человеческие эмбрионы, полученные из стволовых клеток. [154]
Платформы доставки лекарств [ править ]
В терапии синтетическая биология достигла значительных успехов в изменении и упрощении области терапии за относительно короткий период времени. Фактически, новые терапевтические платформы, от открытия механизмов заболеваний и мишеней лекарств до производства и транспортировки малых молекул, стали возможными благодаря логическому и модельно-ориентированному проектированию биологических компонентов. [60]
Устройства синтетической биологии были разработаны для использования в качестве методов терапевтического лечения. Можно контролировать полностью созданные вирусы и организмы, воздействуя на определенные патогены и пути развития заболеваний. Таким образом, в двух независимых исследованиях 91,92 исследователи использовали генетически модифицированные бактериофаги для борьбы с бактериями, устойчивыми к антибиотикам, придавая им генетические особенности, которые специально нацелены и препятствуют бактериальной защите от активности антибиотиков. [155]
В терапии рака , поскольку традиционные лекарства часто без разбора воздействуют на опухоли и нормальные ткани, могут быть полезны искусственно созданные вирусы и организмы, которые могут идентифицировать и связывать свое терапевтическое действие с патологическими сигналами. Например, активность пути р53 в клетках человека была введена в аденовирусы, чтобы контролировать их репликацию. [155]
основе бактерий Разработанная на платформа
Бактерии уже давно используются в лечении рака. Бифидобактерии и клостридии избирательно колонизируют опухоли и уменьшают их размеры. [156] Недавно синтетические биологи перепрограммировали бактерии, чтобы они чувствовали определенное раковое состояние и реагировали на него. Чаще всего бактерии используются для доставки терапевтической молекулы непосредственно к опухоли, чтобы минимизировать нецелевые эффекты. Чтобы нацелиться на опухолевые клетки, на поверхности бактерий были экспрессированы пептиды , которые могут специфически распознавать опухоль. Используемые пептиды включают молекулу аффитела , которая специфически нацелена на рецептор 2 эпидермального фактора роста человека. [157] и синтетический адгезин . [158] Другой способ — позволить бактериям чувствовать микроокружение опухоли , например, гипоксию, путем встраивания логического элемента И в бактерии. [159] Тогда бактерии высвобождают в опухоль целевые терапевтические молекулы только путем лизиса. [160] или система бактериальной секреции . [161] Преимущество лизиса состоит в том, что он может стимулировать иммунную систему и контролировать рост. Можно использовать несколько типов систем секреции, а также другие стратегии. Система индуцируется внешними сигналами. Индукторы включают химические вещества, электромагнитные или световые волны.
В этих методах лечения применяются несколько видов и штаммов. Наиболее часто используемыми бактериями являются Salmonella typhimurium , Escherichia coli , Bifidobacteria , Streptococcus , Lactobacillus , Listeria и Bacillus subtilis . Каждый из этих видов обладает своими свойствами и уникален для терапии рака с точки зрения колонизации тканей, взаимодействия с иммунной системой и простоты применения.
Разработанная платформа на основе дрожжей
Синтетические биологи разрабатывают генетически модифицированные живые дрожжи, которые могут доставлять терапевтические биологические лекарства. При пероральном приеме эти живые дрожжи действуют как микрофабрики и производят терапевтические молекулы непосредственно в желудочно-кишечном тракте. Поскольку дрожжи являются эукариотическими, их ключевым преимуществом является то, что их можно применять вместе с антибиотиками. Пробиотические дрожжи, экспрессирующие пуринергический рецептор человека P2Y2, подавляли воспаление кишечника на мышиных моделях воспалительного заболевания кишечника. [162] Были разработаны живые дрожжи S. boulardii, доставляющие тетраспецифичный антитоксин, который эффективно нейтрализует токсин A и токсин B Clostridioides difficile. Этот терапевтический антитоксин представляет собой смесь четырех однодоменных антител ( нанотел ), которые мощно и широко нейтрализуют два основных фактора вирулентности C. difficile в месте инфекции в доклинических моделях. [163] Первое клиническое испытание на людях искусственных живых дрожжей для лечения инфекции Clostridium difficile ожидается в 2024 году и будет спонсироваться разработчиком Fzata, Inc.
Платформа на основе сотовой связи [ править ]
Иммунная система играет важную роль в развитии рака и может быть использована для атаки раковых клеток. Клеточная терапия фокусируется на иммунотерапии , в основном с использованием Т-клеток .
Рецепторы Т-клеток были сконструированы и «обучены» обнаруживать эпитопы рака . Химерные антигенные рецепторы (CAR) состоят из фрагмента антитела, слитого с внутриклеточными сигнальными доменами Т-клеток, которые могут активировать и запускать пролиферацию клетки. FDA одобрило множество методов лечения второго поколения на основе CAR. [164]
Генные переключатели были разработаны для повышения безопасности лечения. Выключатели были разработаны для прекращения терапии в случае проявления у пациента серьезных побочных эффектов. [165] Механизмы могут более точно контролировать систему, останавливать и повторно активировать ее. [166] [167] Поскольку количество Т-клеток важно для устойчивости и тяжести терапии, рост Т-клеток также контролируется для определения эффективности и безопасности лечения. [168]
Хотя несколько механизмов могут улучшить безопасность и контроль, ограничения включают в себя сложность индукции больших цепей ДНК в клетки и риски, связанные с введением в клетки чужеродных компонентов, особенно белков.
Биотопливо, фармацевтика и биоматериалы [ править ]
Самым популярным биотопливом является этанол, получаемый из кукурузы или сахарного тростника, но этот метод производства биотоплива затруднителен и ограничен из-за высоких затрат на сельское хозяйство и неадекватных топливных характеристик этанола. Заменителем и потенциальным источником возобновляемой энергии являются микробы, метаболические пути которых были изменены, чтобы они могли более эффективно преобразовывать биомассу в биотопливо. Можно ожидать, что эти методы будут успешными только в том случае, если затраты на их производство будут соответствовать или даже превзойти затраты на нынешнее производство топлива. В связи с этим существует несколько лекарств, дорогостоящие процедуры производства которых не позволяют им иметь более широкий терапевтический диапазон. Создание новых материалов и микробиологическое производство биоматериалов существенно выиграют от новых инструментов искусственной биологии. [155]
CRISPR/Cas9 [ править ]
Система кластеризованных часто расположенных коротких палиндромных повторов (CRISPR)/CRISPR-ассоциированных (Cas) является мощным методом геномной инженерии целого ряда организмов благодаря своей простоте, модульности и масштабируемости. В этом методе направляющая РНК (гРНК) привлекает нуклеазу CRISPR Cas9 к определенному месту в геноме, вызывая двухцепочечный разрыв. Для достижения желаемого изменения генома (т.е. удаления или вставки гена) можно использовать несколько процессов репарации ДНК, включая рекомбинацию, направленную на гомологию, и соединение негомологических концов. Кроме того, dCas9 (мертвый Cas9 или Cas9 с дефицитом нуклеазы), двойной мутант Cas9 (H840A, D10A), использовался для контроля экспрессии генов в бактериях или когда он связан со стимуляцией сайта супрессии у дрожжей. [169]
Нормативные элементы [ править ]
Для построения и развития биологических систем решающее значение имеют регулирующие компоненты, включая регуляторы, участки связывания рибосом (RBS) и терминаторы. Несмотря на годы исследований, существует множество различных разновидностей и количества промоторов и терминаторов для Escherichia coli, но и для хорошо изученного модельного организма Saccharomyces cerevisiae, а также для других представляющих интерес организмов, эти инструменты довольно скудны. Чтобы преодолеть это ограничение, были изобретены многочисленные методы поиска и идентификации промоторов и терминаторов, включая интеллектуальный анализ генома, случайный мутагенез, гибридную инженерию, биофизическое моделирование, комбинаторный дизайн и рациональный дизайн. [169]
Органоиды [ править ]
Синтетическая биология использовалась для создания органоидов , которые представляют собой выращенные в лаборатории органы для применения в медицинских исследованиях и трансплантации. [170]
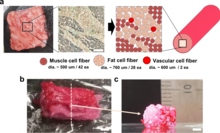
Биопечатные органы [ править ]
3D-биопечать можно использовать для реконструкции тканей из различных областей тела. Предшественником внедрения 3D-печати в здравоохранении стала серия испытаний, проведенных исследователями Бостонской детской больницы. Команда вручную изготовила запасные мочевые пузыри для семи пациентов, построив каркасы, а затем наложив на них слои клеток пациентов и позволив им расти. Испытания прошли успешно, поскольку пациенты оставались в добром здравии в течение 7 лет после имплантации, что побудило научного сотрудника по имени Энтони Атала, доктора медицинских наук, искать способы автоматизации процесса. [171] Пациентов с терминальной стадией заболевания мочевого пузыря теперь можно лечить с помощью биоинженерных тканей мочевого пузыря для восстановления поврежденного органа. [172] Эту технологию также потенциально можно применять к костям, коже, хрящам и мышечной ткани. [173] Однако одной из долгосрочных целей технологии 3D-биопечати является реконструкция целого органа, а также минимизация проблемы нехватки органов для трансплантации. [174] Биопечать полностью функциональных органов, например, печени, кожи, мениска или поджелудочной железы, не имела большого успеха. [175] [176] [177] В отличие от имплантируемых стентов, органы имеют сложную форму, и их значительно сложнее биопринтировать. Например, биопечатное сердце должно отвечать не только структурным требованиям, но также требованиям к васкуляризации, механической нагрузке и распространению электрического сигнала. [178] В 2022 году станет первым успешным клиническим испытанием 3D-биопечатного трансплантата, изготовленного из собственных клеток пациента, наружного уха для лечения микротии . [179] было сообщено. [180]
3D-биопечать способствует значительному прогрессу в медицинской области тканевой инженерии , позволяя проводить исследования инновационных материалов, называемых биоматериалами . Некоторые из наиболее известных биоинженерных веществ обычно прочнее обычных материалов тела, включая мягкие ткани и кости. Эти компоненты могут в будущем заменить или даже улучшить исходные материалы корпуса. Кроме того, Агентство по уменьшению угроз Министерства обороны стремится печатать мини-органы, такие как сердце, печень и легкие, что позволит более точно тестировать новые лекарства и, возможно, устранить необходимость испытаний на животных. [181]
трансплантаты и индуцированная регенерация Другие
Продолжаются исследования и разработки методов, основанных на синтетической биологии, для стимулирования регенерации у людей. [ соответствующий? ] а также создание трансплантируемых искусственных органов .
микрокапли Наночастицы искусственные клетки и ,
Синтетическая биология может быть использована для создания наночастиц, которые можно использовать для доставки лекарств , а также для других целей. [182] Дополняющие исследования и разработки направлены на создание синтетических клеток , имитирующих функции биологических клеток. Приложения включают в себя медицину, например, наночастицы дизайнерские , которые заставляют клетки крови разъедать изнутри наружу части атеросклеротических бляшек , которые вызывают сердечные приступы. [183] [184] [185] Синтетические микрокапли для клеток водорослей или синергетические водорослево-бактериальные многоклеточные сфероидные микробные реакторы , например, могут быть использованы для производства водорода в качестве экономии водорода . биотехнологии [186] [187]
Электрогенетика [ править ]
Дизайнерские клетки млекопитающих создаются людьми так, чтобы вести себя определенным образом, например, иммунные клетки, экспрессирующие синтетический рецептор, предназначенный для борьбы с конкретным заболеванием. [188] [189] Электрогенетика — это применение синтетической биологии, которое предполагает использование электрических полей для стимуляции реакции в сконструированных клетках. [190] Управлять дизайнерскими ячейками можно относительно легко с помощью обычных электронных устройств, таких как смартфоны. Кроме того, электрогенетика позволяет создавать устройства, которые намного меньше и компактнее, чем устройства, использующие другие стимулы за счет использования микроскопических электродов. [190] Одним из примеров того, как электрогенетика используется на благо общественного здравоохранения, является стимуляция дизайнерских клеток, которые способны производить/доставлять терапевтические средства. [191] Это было реализовано в ячейках Electro HEK, клетках, которые содержат электрочувствительные потенциалзависимые кальциевые каналы, а это означает, что ионный канал можно контролировать с помощью электропроводности между электродами и ячейками Electro HEK. [190] Было показано, что уровни экспрессии искусственного гена, который содержали эти клетки Electro HEK, можно контролировать путем изменения напряжения или длины электрического импульса. Дальнейшие исследования расширили эту надежную систему, одно из которых представляет собой систему линии бета-клеток, предназначенную для контроля высвобождения инсулина на основе электрических сигналов. [192]
Этика [ править ]
Этот раздел необходимо обновить . ( январь 2019 г. ) |
Создание новой жизни и изменение существующей жизни вызвали этические проблемы в области синтетической биологии и активно обсуждаются. [193] [194]
Общие этические вопросы включают в себя:
- Правомерно ли с моральной точки зрения вмешиваться в природу?
- Играет ли человек в Бога, создавая новую жизнь?
- Что произойдет, если синтетический организм случайно сбежит?
- Что, если человек злоупотребляет синтетической биологией и создает вредный объект (например, биологическое оружие)?
- Кто будет иметь контроль над продуктами синтетической биологии и доступ к ним?
- Кто выиграет от этих нововведений? Инвесторы? Медицинские пациенты? Промышленные фермеры?
- Разрешает ли патентная система патентовать живые организмы? А как насчет частей организмов, например генов устойчивости к ВИЧ у человека? [195]
- Что, если новое творение заслуживает морального или юридического статуса?
Этические аспекты синтетической биологии имеют три основные особенности: биобезопасность , биобезопасность и создание новых форм жизни. [196] Другие упомянутые этические вопросы включают регулирование новых творений, управление патентами на новые творения, распределение выгод и честность исследований. [197] [193]
Возникли этические проблемы в отношении технологий рекомбинантной ДНК и генетически модифицированных организмов (ГМО), а обширные правила генной инженерии во многих юрисдикциях действовали и исследований патогенов. Эми Гутманн , бывший глава президентской комиссии по биоэтике, утверждала, что нам следует избегать искушения чрезмерно регулировать синтетическую биологию в целом и генную инженерию в частности. По словам Гутмана, «экономия в регулировании особенно важна в новых технологиях... где особенно велик соблазн задушить инновации на основе неопределенности и страха перед неизвестным. Грубые инструменты законодательных и нормативных ограничений могут не только препятствовать распространению новых преимуществ, но может оказаться контрпродуктивным для безопасности и безопасности, не позволяя исследователям разработать эффективные меры защиты». [198]
«Сотворение» жизни [ править ]
Один этический вопрос заключается в том, приемлемо ли создание новых форм жизни, иногда называемых «игрой в Бога». В настоящее время создание новых форм жизни, отсутствующих в природе, происходит в небольших масштабах, потенциальные выгоды и опасности остаются неизвестными, а для большинства исследований обеспечивается тщательное рассмотрение и надзор. [193] Многие сторонники заявляют о огромной потенциальной ценности создания искусственных форм жизни – для сельского хозяйства, медицины и академических знаний, среди других областей. Создание новых объектов могло бы расширить научные знания далеко за пределы того, что известно в настоящее время при изучении природных явлений. Тем не менее, существует обеспокоенность тем, что искусственные формы жизни могут снизить «чистоту» природы (т.е. природа может быть каким-то образом испорчена вмешательством и манипуляциями человека) и потенциально повлиять на принятие принципов, более похожих на инженерные, вместо идеалов, ориентированных на биоразнообразие и природу. Некоторые также обеспокоены тем, что если искусственная форма жизни будет выпущена в природу, она может затруднить биоразнообразие, вытесняя естественные виды в плане ресурсов (подобно тому, как цветение водорослей убивает морские виды). Еще одна проблема связана с этическим обращением с вновь созданными существами, если они ощущают боль , разум и самовосприятие. Продолжаются споры о том, следует ли предоставить таким формам жизни моральные или юридические права, хотя не существует единого мнения относительно того, как эти права будут осуществляться или обеспечиваться.
биологии синтетической Этическая поддержка
Этические и моральные обоснования, которые поддерживают определенные применения синтетической биологии, включают их потенциальное смягчение существенных глобальных проблем пагубного воздействия на окружающую среду обычного сельского хозяйства (включая производство мяса ), благополучия животных , продовольственной безопасности и здоровья человека . [199] [200] [201] [202] а также потенциальное сокращение человеческих потребностей в рабочей силе и, посредством терапии заболеваний, уменьшение человеческих страданий и продление жизни.
и биосдерживание Биобезопасность
Что является наиболее этически приемлемым при рассмотрении мер биобезопасности? Как можно избежать случайного внедрения синтетической жизни в природную среду? Этим вопросам было уделено много этического внимания и критической мысли. Биобезопасность относится не только к биологическому сдерживанию; это также относится к шагам, предпринятым для защиты населения от потенциально опасных биологических агентов. Несмотря на то, что такие опасения важны и остаются без ответа, не все продукты синтетической биологии вызывают обеспокоенность по поводу биологической безопасности или негативных последствий для окружающей среды. Утверждается, что большинство синтетических технологий безвредны и неспособны процветать во внешнем мире из-за своих «неестественных» характеристик, поскольку еще не существует примера трансгенного микроба, обладающего преимуществом в приспособленности в дикой природе.
В целом существующие меры контроля опасностей , методологии оценки рисков и правила, разработанные для традиционных генетически модифицированных организмов (ГМО), считаются достаточными для синтетических организмов. «Внешние» методы биозащиты в лабораторных условиях включают физическое сдерживание с помощью боксов биологической безопасности и перчаточных боксов , а также средств индивидуальной защиты . В контексте сельского хозяйства они включают дистанцию изоляции и барьеры для пыльцы , аналогичные методам биологического сдерживания ГМО . Синтетические организмы могут обеспечить повышенный контроль опасности, поскольку они могут быть созданы с использованием «внутренних» методов биосдерживания, которые ограничивают их рост в неизолированной среде или предотвращают горизонтальную передачу генов природным организмам. Примеры внутреннего биосдерживания включают ауксотрофию , биологические переключатели уничтожения , неспособность организма реплицировать или передавать модифицированные или синтетические гены потомству, а также использование ксенобиологических организмов с использованием альтернативной биохимии, например, с использованием искусственных ксенонуклеиновые кислоты (XNA) вместо ДНК. [203] [204] Что касается ауксотрофии, бактерии и дрожжи могут быть созданы так, чтобы они не могли производить гистидин , важную аминокислоту для всей жизни. Таким образом, такие организмы можно выращивать только на средах, богатых гистидином, в лабораторных условиях, что сводит на нет опасения, что они могут распространиться в нежелательные области.
и биотерроризм Биобезопасность
Некоторые этические проблемы связаны с биобезопасностью, когда биосинтетические технологии могут быть намеренно использованы для нанесения вреда обществу и/или окружающей среде. Поскольку синтетическая биология поднимает этические проблемы и проблемы биобезопасности, человечество должно подумать и спланировать, как бороться с потенциально вредными созданиями и какие этические меры можно использовать для сдерживания гнусных биосинтетических технологий. За исключением регулирования компаний, занимающихся синтетической биологией и биотехнологиями, [205] [206] однако эти проблемы не считаются новыми, поскольку они были подняты во время более ранних дебатов о рекомбинантной ДНК и генетически модифицированных организмах (ГМО), а обширные правила генной инженерии и исследований патогенов. во многих юрисдикциях уже действуют [207]
Кроме того, развитие инструментов синтетической биологии облегчило людям с меньшим образованием, подготовкой и доступом к оборудованию модификацию и использование патогенных организмов в качестве биологического оружия. Это увеличивает угрозу биотерроризма , особенно когда террористические группы осознают значительные социальные, экономические и политические потрясения, вызванные такими пандемиями, как COVID-19 . По мере разработки новых методов в области синтетической биологии риск биотерроризма, вероятно, будет продолжать расти. [208] Хуан Сарате, который занимал должность заместителя советника национальной безопасности по борьбе с терроризмом с 2005 по 2009 год, отметил, что «тяжесть и крайние разрушительные последствия нового коронавируса, вероятно, подстегнут воображение самых творческих и опасных групп и отдельных лиц к пересмотру биотеррористических атак». [209]
Европейский Союз [ править ]
Европейским Союзом. Проект SYNBIOSAFE, финансируемый [210] выпустил доклады о том, как управлять синтетической биологией. В документе 2007 года были определены ключевые проблемы безопасности, этики и взаимодействия науки и общества, которые в проекте определены как общественное образование и постоянный диалог между учеными, бизнесом, правительством и специалистами по этике. [211] [212] Ключевые проблемы безопасности, выявленные SYNBIOSAFE, связаны с привлечением компаний, продающих синтетическую ДНК, и биохакерского сообщества биологов-любителей. Ключевые этические вопросы касались создания новых форм жизни.
Последующий доклад был посвящен биобезопасности, особенно проблеме так называемого двойного назначения . Например, хотя синтетическая биология может привести к более эффективному производству медицинских препаратов, она также может привести к синтезу или модификации вредных патогенов (например, оспы ). [213] Сообщество биохакеров остается источником особой обеспокоенности, поскольку распределенный и рассредоточенный характер биотехнологий с открытым исходным кодом затрудняет отслеживание, регулирование или смягчение потенциальных опасений по поводу биобезопасности и биозащищенности. [214]
COSY, еще одна европейская инициатива, фокусируется на общественном восприятии и коммуникации. [215] [216] [217] Чтобы лучше донести синтетическую биологию и ее социальные последствия до широкой публики, COSY и SYNBIOSAFE в октябре 2009 года опубликовали SYNBIOSAFE , 38-минутный документальный фильм. [210]
Международная ассоциация синтетической биологии предложила саморегулирование. [218] Это предлагает конкретные меры, которые должна реализовать индустрия синтетической биологии, особенно компании, занимающиеся синтезом ДНК. В 2007 году группа под руководством ученых из ведущих компаний, занимающихся синтезом ДНК, опубликовала «практический план по разработке эффективной системы надзора за отраслью синтеза ДНК». [205]
США [ править ]
В январе 2009 года Фонд Альфреда П. Слоана профинансировал Центр Вудро Вильсона , Центр Гастингса и Институт Дж. Крейга Вентера для изучения общественного восприятия, этики и политических последствий синтетической биологии. [219]
9–10 июля 2009 г. Комитет национальных академий науки, технологий и права созвал симпозиум на тему «Возможности и проблемы в новой области синтетической биологии». [220]
После публикации первого синтетического генома и сопутствующего освещения в СМИ создаваемой «жизни» президент Барак Обама учредил Президентскую комиссию по изучению биоэтических проблем для изучения синтетической биологии. [221] Комиссия созвала серию встреч и в декабре 2010 года опубликовала отчет под названием «Новые направления: этика синтетической биологии и новые технологии». Комиссия заявила, что «хотя достижения Вентера ознаменовали собой значительный технический прогресс в демонстрации того, что относительно большой геном может быть точно синтезирован и заменен другим, это не равносильно «созданию жизни». [222] Он отметил, что синтетическая биология является новой областью, которая создает потенциальные риски и выгоды. Комиссия не рекомендовала изменения в политике или надзоре и призвала к продолжению финансирования исследований и новому финансированию мониторинга, изучения возникающих этических проблем и просвещения общественности. [207]
Синтетическая биология, как главный инструмент биологических достижений, приводит к «потенциалу разработки биологического оружия, возможным непредвиденным негативным последствиям для здоровья человека... и любому потенциальному воздействию на окружающую среду». [223] Распространение таких технологий может также сделать производство биологического и химического оружия доступным для более широкого круга государственных и негосударственных субъектов . [224] Этих проблем безопасности можно избежать, регулируя использование биотехнологий в промышленности посредством политического законодательства. Федеральные руководящие принципы по генетическим манипуляциям предлагает «Президентская комиссия по биоэтике... в ответ на объявленное создание самовоспроизводящейся клетки из химически синтезированного генома выдвинула 18 рекомендаций не только для регулирования науки... для образования общественность». [223]
Оппозиция [ править ]
13 марта 2012 года более 100 экологических групп и групп гражданского общества, в том числе «Друзья Земли» , Международный центр оценки технологий и ETC Group , выпустили манифест «Принципы надзора за синтетической биологией» . Этот манифест призывает к всемирному мораторию на выпуск и коммерческое использование синтетических организмов до тех пор, пока не будут установлены более строгие правила и строгие меры биобезопасности. Группы конкретно призывают к полному запрету на использование синтетической биологии в отношении человеческого генома или человеческого микробиома . [225] [226] Ричард Левонтин писал, что некоторые принципы безопасности надзора, обсуждаемые в «Принципах надзора за синтетической биологией», разумны, но основная проблема с рекомендациями манифеста заключается в том, что «общественность в целом не имеет возможности добиться какой-либо значимой реализации». этих рекомендаций». [227]
Здоровье и безопасность [ править ]
Опасности синтетической биологии включают угрозы биобезопасности для работников и населения, опасности биобезопасности , возникающие в результате преднамеренной разработки организмов с целью причинения вреда, а также опасности для окружающей среды. Опасности для биобезопасности аналогичны опасностям, возникающим в существующих областях биотехнологии, в основном это воздействие патогенов и токсичных химикатов, хотя новые синтетические организмы могут нести новые риски. [203] Что касается биобезопасности, существуют опасения, что синтетические или модифицированные организмы теоретически могут быть использованы для биотерроризма . Потенциальные риски включают воссоздание известных патогенов с нуля, создание более опасных существующих патогенов и создание микробов для производства вредных биохимических веществ. [228] Наконец, экологические опасности включают неблагоприятное воздействие на биоразнообразие и экосистемные услуги , включая потенциальные изменения в землепользовании в результате использования синтетических организмов в сельском хозяйстве. [229] [230] Синтетическая биология является примером технологии двойного назначения , которую можно использовать таким образом, чтобы намеренно или непреднамеренно нанести вред людям и/или окружающей среде. Часто «ученые, принимающие их учреждения и финансирующие организации» рассматривают вопрос о том, может ли запланированное исследование быть использовано не по назначению, и иногда принимают меры для снижения вероятности неправомерного использования. [231]
Существующие системы анализа рисков для ГМО обычно считаются достаточными для синтетических организмов, хотя могут возникнуть трудности для организма, построенного «снизу вверх» из отдельных генетических последовательностей. [204] [232] Синтетическая биология обычно подпадает под действие существующих правил в отношении ГМО и биотехнологии в целом, а также любых правил, которые существуют для последующих коммерческих продуктов, хотя, как правило, ни в одной юрисдикции нет правил, специфичных для синтетической биологии. [233] [234]
См. также [ править ]
- ACS Synthetic Biology (журнал)
- Биоинженерия
- Биомимикрия
- Кривая Карлсона
- Концепция хиральной жизни
- Вычислительная биология
- Компьютерное биомоделирование
- Хранение цифровых данных ДНК
- Инженерная биология
- Международная генно-инженерная машина
- Неклеточная жизнь
- Открытая синтетическая биология
- Регенеративная медицина
- Синтетический интеллект
- Синтетическая морфология
- Синтетическая вирусология
- Системы и синтетическая биология (журнал)
- Тканевая инженерия
- Ксенобиология
- Протоклетка # Искусственные модели
- Дживану
- Гипотетические типы биохимии
- Игра в Бога (этика)
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б Ганчиц М.М. (май 2020 г.). «Инженерная жизнь: обзор синтетической биологии». Искусственная жизнь . 26 (2): 260–273. дои : 10.1162/artl_a_00318 . hdl : 11572/302757 . ISSN 1064-5462 . ПМИД 32271630 . S2CID 215550945 .
- ^ Накано Т., Экфорд А.В., Харагути Т. (12 сентября 2013 г.). Молекулярная связь . Издательство Кембриджского университета. ISBN 978-1-107-02308-6 .
- ↑ Перейти обратно: Перейти обратно: а б «Синтетическая биология» . Genome.gov . Проверено 03 января 2023 г.
- ^ «Продуктивные наносистемы: технологическая дорожная карта» (PDF) . Институт Форсайта . Архивировано из оригинала (PDF) 25 октября 2016 г. Проверено 2 мая 2020 г.
- ^ Герцог С. (26 октября 1910 г.). Физико-химическая теория жизни и самопроизвольного зарождения . А. Пуанат. OL 23348076M – через Открытую библиотеку.
- ^ Ледюк С. (1912). Пуйнат А (ред.). Синтетическая биология, изучение биофизики . Архивировано из оригинала 27 сентября 2016 г. Проверено 23 января 2011 г.
- ^ Кэри, Несса (2019). Взлом кода жизни . Лондон: Книги об иконах. стр. Страница=12. ISBN 978-178578-497-2 .
- ^ Джейкоб, F.ß. И Моно, Дж. О регуляции активности генов. Холодный источник Харб. Симп. Квант. Биол. 26, 193–211 (1961).
- ^ Коэн С.Н., Чанг А.С., Бойер Х.В., Хеллинг Р.Б. (1973). «Конструирование биологически функциональных бактериальных плазмид in vitro» . Учеб. Натл. акад. наук. США . 70 (11): 3240–3244. Бибкод : 1973PNAS...70.3240C . дои : 10.1073/pnas.70.11.3240 . ПМК 427208 . ПМИД 4594039 .
- ^ Шибальский В., Скалка А. (ноябрь 1978 г.). «Нобелевские премии и ферменты рестрикции». Джин . 4 (3): 181–2. дои : 10.1016/0378-1119(78)90016-1 . ПМИД 744485 .
- ^ Сайки Р.К., Гельфанд Д.Х., Стоффель С., Шарф С.Дж., Хигучи Р., Хорн Г.Т., Муллис К.Б., Эрлих Х.А. (1988). «Праймер-направленная ферментативная амплификация ДНК с помощью термостабильной ДНК-полимеразы». Наука . 239 (4839): 487–491. дои : 10.1126/science.239.4839.487 . ПМИД 2448875 .
- ↑ Перейти обратно: Перейти обратно: а б Еловиц М.Б., Лейблер С. (январь 2000 г.). «Синтетическая колебательная сеть регуляторов транскрипции». Природа . 403 (6767): 335–8. Бибкод : 2000Natur.403..335E . дои : 10.1038/35002125 . ПМИД 10659856 . S2CID 41632754 .
- ↑ Перейти обратно: Перейти обратно: а б Гарднер Т.С., Кантор Ч.Р., Коллинз Дж.Дж. (январь 2000 г.). «Создание генетического тумблера в Escherichia coli». Природа . 403 (6767): 339–42. Бибкод : 2000Natur.403..339G . дои : 10.1038/35002131 . ПМИД 10659857 . S2CID 345059 .
- ↑ Перейти обратно: Перейти обратно: а б Найт Т. (2003). Идемпотентный векторный дизайн для стандартной сборки биокирпичей (отчет). Лаборатория искусственного интеллекта Массачусетского технологического института. hdl : 1721.1/21168 .
- ^ Мартин В.Дж., Питера Дж., Уизерс С.Т., Ньюман Дж.Д., Кислинг Дж.Д. (июль 2003 г.). «Разработка мевалонатного пути в Escherichia coli для производства терпеноидов». Природная биотехнология . 21 (7): 796–802. дои : 10.1038/nbt833 . ПМИД 12778056 . S2CID 17214504 .
- ^ Левская А., Шевалье А.А., Табор Дж.Дж., Симпсон З.Б., Лавери Л.А., Леви М. и др. (ноябрь 2005 г.). «Синтетическая биология: инженерия Escherichia coli, чтобы увидеть свет». Природа . 438 (7067): 441–442. Бибкод : 2005Natur.438..441L . дои : 10.1038/nature04405 . ПМИД 16306980 . S2CID 4428475 .
- ^ Басу С., Герчман Ю., Коллинз Ч.Х., Арнольд Ф.Х., Вайс Р. (апрель 2005 г.). «Синтетическая многоклеточная система для формирования запрограммированных образов» . Природа . 434 (7037): 1130–4. Бибкод : 2005Natur.434.1130B . дои : 10.1038/nature03461 . ПМИД 15858574 . S2CID 4370309 .
- ^ Андерсон Дж.К., Кларк Э.Дж., Аркин А.П., Фойгт Калифорния (январь 2006 г.). «Контролируемое окружающей средой вторжение в раковые клетки искусственно созданными бактериями». Журнал молекулярной биологии . 355 (4): 619–627. дои : 10.1016/j.jmb.2005.10.076 . ПМИД 16330045 .
- ↑ Перейти обратно: Перейти обратно: а б Гибсон Д.Г., Гласс Дж.И., Лартиг С., Носков В.Н., Чуанг Р.Ю., Алжир М.А., Бендерс Г.А., Монтегю М.Г., Ма Л., Муди М.М., Мерриман С., Ваши С., Кришнакумар Р., Асад-Гарсия Н., Эндрюс-Пфанкох С., Денисова Э.А., Янг Л., Ци ЗК, Сегалл-Шапиро Т.Х., Калви Ч., Пармар П.П., Хатчисон К.А., Смит Х.О., Вентер Дж.К. (июль 2010 г.). «Создание бактериальной клетки, управляемой химически синтезированным геномом». Наука . 329 (5987): 52–6. Бибкод : 2010Sci...329...52G . дои : 10.1126/science.1190719 . ПМИД 20488990 .
- ^ «Американский учёный, создавший искусственную жизнь, отрицает «игру в Бога» » . Телеграф . Май 2010 г. Архивировано из оригинала 12 января 2022 г.
- ^ Даймонд Дж.С., Ричардсон С.М., Кумбс С.Э., Бабац Т., Мюллер Х., Анналуру Н. и др. (сентябрь 2011 г.). «Синтетические плечи хромосом функционируют у дрожжей и задумано создают фенотипическое разнообразие» . Природа . 477 (7365): 471–476. Бибкод : 2011Natur.477..471D . дои : 10.1038/nature10403 . ПМЦ 3774833 . ПМИД 21918511 .
- ^ Джинек М., Чилински К., Фонфара И., Хауэр М., Дудна Дж.А., Шарпантье Э. (2012). «Программируемая ДНК-эндонуклеаза, управляемая двойной РНК, в адаптивном бактериальном иммунитете» . Наука . 337 (6096): 816–821. Бибкод : 2012Sci...337..816J . дои : 10.1126/science.1225829 . ПМК 6286148 . ПМИД 22745249 .
- ^ ETH Цюрих (1 апреля 2019 г.). «Первый бактериальный геном, полностью созданный с помощью компьютера» . ЭврекАлерт! . Проверено 2 апреля 2019 г.
- ^ Венец Дж.Э., Дель Медико Л., Вольфле А., Шехле П., Бухер Ю., Апперт Д. и др. (апрель 2019 г.). «Химический синтез: переписывание бактериального генома для достижения гибкости дизайна и биологической функциональности» . Труды Национальной академии наук Соединенных Штатов Америки . 116 (16): 8070–8079. Бибкод : 2019PNAS..116.8070V . дои : 10.1073/pnas.1818259116 . ПМК 6475421 . ПМИД 30936302 .
- ↑ Перейти обратно: Перейти обратно: а б Циммер С (15 мая 2019 г.). «Ученые создали бактерии с синтетическим геномом. Это искусственная жизнь? Это важная веха для синтетической биологии: колонии кишечной палочки процветают благодаря ДНК, созданной с нуля людьми, а не природой» . Нью-Йорк Таймс . Проверено 16 мая 2019 г.
- ↑ Перейти обратно: Перейти обратно: а б Фреденс Дж., Ван К., де ла Торре Д., Функе Л.Ф., Робертсон В.Е., Христова Ю. и др. (май 2019 г.). «Тотальный синтез Escherichia coli с перекодированным геномом» . Природа . 569 (7757): 514–518. Бибкод : 2019Natur.569..514F . дои : 10.1038/s41586-019-1192-5 . ПМК 7039709 . ПМИД 31092918 .
- ^ Сокол Ю (03.04.2020). «Знакомьтесь, ксеноботы: ожившие виртуальные существа» . Нью-Йорк Таймс .
- ^ Кригман С., Блэкистон Д., Левин М., Бонгард Дж. (декабрь 2021 г.). «Кинематическая самовоспроизведение в реконфигурируемых организмах» . Труды Национальной академии наук Соединенных Штатов Америки . 118 (49). Бибкод : 2021PNAS..11812672K . дои : 10.1073/pnas.2112672118 . ПМЦ 8670470 . ПМИД 34845026 .
- ^ Цзэн Дж. «О концепции системной биоинженерии». Сотрудничество по трансгенным животным, июнь 1994 г., CAS, КНР . 6 .
- ^ Чопра П., Камма А. «Инженерная жизнь посредством синтетической биологии». В кремниевой биологии . 6 .
- ^ Флорес Буэсо Ю., Тэнгни М. (май 2017 г.). «Синтетическая биология у руля биоэкономики». Тенденции в биотехнологии . 35 (5): 373–378. дои : 10.1016/j.tibtech.2017.02.002 . ПМИД 28249675 .
- ^ Хантер Д. (октябрь 2013 г.). «Как на основе справедливости возражать против радикально новых технологий: случай синтетической биологии». Биоэтика . 27 (8): 426–434. дои : 10.1111/bioe.12049 . ПМИД 24010854 . S2CID 23895514 .
- ^ Гутманн А (2011). «Этика синтетической биологии: руководящие принципы для новых технологий». Отчет Гастингсского центра . 41 (4): 17–22. дои : 10.1002/j.1552-146x.2011.tb00118.x . ПМИД 21845917 . S2CID 20662786 .
- ^ Ченнон К., Бромли Э.Х., Вульфсон Д.Н. (август 2008 г.). «Синтетическая биология посредством биомолекулярного дизайна и инженерии». Современное мнение в области структурной биологии . 18 (4): 491–498. дои : 10.1016/j.sbi.2008.06.006 . ПМИД 18644449 .
- ^ Дюран-Небреда С., Пла Х., Видиелла Б., Пиньеро Х., Конде-Пуэйо Н., Соле Р. (февраль 2021 г.). «Синтетическое латеральное ингибирование в периодическом формировании микробных колоний» . ACS Синтетическая биология . 10 (2): 277–285. doi : 10.1021/acsynbio.0c00318 . ПМЦ 8486170 . ПМИД 33449631 . S2CID 231624252 .
- ^ ван Вармердам Т. (25 декабря 2021 г.). «Изучение биотехнологических достижений в экзогенном биологическом производстве промышленных малых молекул и фармацевтических препаратов» . ВашBioHelper.com .
- ^ Стоун М (2006). «Жизнь, переработанная с учетом требований инженеров» (PDF) . Микроб . 1 (12): 566–570. S2CID 7171812 . Архивировано из оригинала (PDF) 12 июня 2018 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к л м н тот п д р Деплазес, Анна (май 2009 г.). «Собираем головоломку: изложение синтетической биологии» . Отчеты ЭМБО . 10 (5): 428–432. дои : 10.1038/embor.2009.76 . ISSN 1469-221X . ПМК 2680885 . ПМИД 19415076 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г Асеведо-Роча, Карлос Г. (2016), Хаген, Кристин; Энгельхард, Маргрет; Топфер, Георг (ред.), «Синтетическая природа биологии» , Амбивалентность создания жизни: социальные и философские аспекты синтетической биологии , Этика оценки науки и технологий, том. 45, Чам: Springer International Publishing, стр. 9–53, номер номера : 10.1007/978-3-319-21088-9_2 , ISBN. 978-3-319-21088-9 , PMC 7123144 , получено 23 января 2023 г.
- ^ Беннер С.А., Сисмур А.М. (июль 2005 г.). «Синтетическая биология» . Обзоры природы. Генетика . 6 (7): 533–543. дои : 10.1038/nrg1637 . ПМК 7097405 . ПМИД 15995697 .
- ^ Швилле, Петра (2 сентября 2011 г.). «Синтетическая биология снизу вверх: инженерия в мире ремесленников» . Наука . 333 (6047): 1252–1254. Бибкод : 2011Sci...333.1252S . дои : 10.1126/science.1211701 . ISSN 0036-8075 . ПМИД 21885774 . S2CID 43354332 .
- ^ Швилле П. (сентябрь 2011 г.). «Синтетическая биология снизу вверх: инженерия в мире мастеров». Наука . 333 (6047): 1252–4. Бибкод : 2011Sci...333.1252S . дои : 10.1126/science.1211701 . ПМИД 21885774 . S2CID 43354332 .
- ^ Бейкер Д., Черч Дж., Коллинз Дж., Энди Д., Джейкобсон Дж., Кислинг Дж. и др. (июнь 2006 г.). «Инженерная жизнь: строительство фабрики по биологии». Научный американец . 294 (6): 44–51. Бибкод : 2006SciAm.294f..44B . doi : 10.1038/scientificamerican0606-44 . ПМИД 16711359 .
- ^ Хьюз Р.А., Эллингтон AD (январь 2017 г.). «Синтез и сборка синтетической ДНК: использование синтетического в синтетической биологии» . Перспективы Колд-Спринг-Харбор в биологии . 9 (1): а023812. doi : 10.1101/cshperspect.a023812 . ПМК 5204324 . ПМИД 28049645 .
- ^ Косури С., генеральный директор Церкви (май 2014 г.). «Крупномасштабный синтез ДНК de novo: технологии и приложения» . Природные методы . 11 (5): 499–507. дои : 10.1038/nmeth.2918 . ПМК 7098426 . ПМИД 24781323 .
- ^ Блайт К.Дж., Колыхалов А.А., Райс К.М. (декабрь 2000 г.). «Эффективное инициирование репликации РНК ВГС в культуре клеток». Наука . 290 (5498): 1972–4. Бибкод : 2000Sci...290.1972B . дои : 10.1126/science.290.5498.1972 . ПМИД 11110665 .
- ^ Кузин Дж. (июль 2002 г.). «Вирусология. Активный полиовирус, испеченный с нуля». Наука . 297 (5579): 174–5. дои : 10.1126/science.297.5579.174b . ПМИД 12114601 . S2CID 83531627 .
- ^ Смит Х.О., Хатчисон К.А., Пфанкох К., Вентер Дж.К. (декабрь 2003 г.). «Создание синтетического генома путем сборки всего генома: бактериофаг phiX174 из синтетических олигонуклеотидов» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (26): 15440–5. Бибкод : 2003PNAS..10015440S . дои : 10.1073/pnas.2237126100 . ПМК 307586 . ПМИД 14657399 .
- ^ Уэйд Н (29 июня 2007 г.). «Ученые трансплантируют геном бактерий» . Нью-Йорк Таймс . ISSN 0362-4331 . Проверено 28 декабря 2007 г.
- ^ Гибсон Д.Г., Бендерс Г.А., Эндрюс-Пфанкох С., Денисова Е.А., Баден-Тилсон Х., Завери Дж., Стоквелл Т.Б., Браунли А., Томас Д.В., Алжир М.А., Мерриман С., Янг Л., Носков В.Н., Гласс Дж.И., Вентер Дж.К., Хатчисон Калифорния, Смит Х.О. (февраль 2008 г.). «Полный химический синтез, сборка и клонирование генома Mycoplasmaogenicium». Наука . 319 (5867): 1215–20. Бибкод : 2008Sci...319.1215G . дои : 10.1126/science.1151721 . ПМИД 18218864 . S2CID 8190996 .
- ^ Болл П (2016). «Сделано человеком: история синтетической жизни» . Дистилляции . 2 (1): 15–23 . Проверено 22 марта 2018 г.
- ^ Поллак А (12 сентября 2007 г.). «Как вам ваши гены? Биофаббы принимают заказы» . Нью-Йорк Таймс . ISSN 0362-4331 . Проверено 28 декабря 2007 г.
- ^ «Проекты синтетической биологии» . arep.med.harvard.edu . Проверено 17 февраля 2018 г.
- ^ Форстер AC, генеральный директор Черча (22 августа 2006 г.). «На пути к синтезу минимальной клетки» . Молекулярная системная биология . 2 (1): 45. дои : 10.1038/msb4100090 . ПМК 1681520 . ПМИД 16924266 .
- ↑ Перейти обратно: Перейти обратно: а б Басульто Д. (4 ноября 2015 г.). «Все, что вам нужно знать о том, почему CRISPR является такой популярной технологией» . Вашингтон Пост . Проверено 5 декабря 2015 г.
- ^ Кан Дж. (9 ноября 2015 г.). «Загадка Криспра» . Нью-Йорк Таймс . Проверено 5 декабря 2015 г.
- ^ Ледфорд Х (3 июня 2015 г.). «CRISPR, разрушитель» . Природа . 522 (7554): 20–4. Бибкод : 2015Natur.522...20L . дои : 10.1038/522020a . ПМИД 26040877 .
{{cite journal}}: Неизвестный параметр|agency=игнорируется ( помогите ) - ^ Хиггинботэм С. (4 декабря 2015 г.). «Ведущие венчурные капиталисты говорят, что редактирование генов более рискованно, чем искусственный интеллект» . Удача . Проверено 5 декабря 2015 г.
- ^ Ролли; и др. (2012). «Проектирование биологических систем: системная инженерия встречается с синтетической биологией». Химико-техническая наука . 69 (1): 1–29. Бибкод : 2012ЧЭнС..69....1Р . дои : 10.1016/j.ces.2011.10.068 .
- ↑ Перейти обратно: Перейти обратно: а б Халил А.С., Коллинз Дж.Дж. (май 2010 г.). «Синтетическая биология: приложения достигают совершеннолетия» . Обзоры природы. Генетика . 11 (5): 367–379. дои : 10.1038/nrg2775 . ПМК 2896386 . ПМИД 20395970 .
- ↑ Перейти обратно: Перейти обратно: а б Фримонт П.С., Китни Т.И. (2012). Учебник Синтетическая биология . . Всемирная научная. дои : 10.1142/p837 . ISBN 978-1-84816-863-3 .
- ↑ Перейти обратно: Перейти обратно: а б Райт Б.В., Моллой, член парламента, Яшке П.Р. (март 2022 г.). «Перекрывающиеся гены в природных и искусственно созданных геномах» . Обзоры природы. Генетика . 23 (3): 154–168. дои : 10.1038/s41576-021-00417-w . ПМЦ 8490965 . ПМИД 34611352 .
- ↑ Перейти обратно: Перейти обратно: а б Чан Л.И., Косури С., Энди Д. (2005). «Рефакторинг бактериофага Т7» . Молекулярная системная биология . 1 :2005.0018. дои : 10.1038/msb4100025 . ПМК 1681472 . ПМИД 16729053 .
- ^ Темме К., Чжао Д., Фойгт Калифорния (май 2012 г.). «Рефакторинг кластера генов азотфиксации Klebsiella oxytoca» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (18): 7085–7090. Бибкод : 2012PNAS..109.7085T . дои : 10.1073/pnas.1120788109 . ПМК 3345007 . ПМИД 22509035 .
- ^ Сонг М., Сукович Д.Д., Сиссарелли Л., Майр Дж., Фернандес-Родригес Дж., Мирский Е.А. и др. (май 2017 г.). «Контроль секреции белка типа III с использованием минимальной генетической системы» . Природные коммуникации . 8 (1): 14737. Бибкод : 2017NatCo...814737S . дои : 10.1038/ncomms14737 . ПМК 5436071 . ПМИД 28485369 .
- ^ Яшке П.Р., Либерман Э.К., Родригес Дж., Сьерра А., Энди Д. (декабрь 2012 г.). «Полностью декомпрессированный геном синтетического бактериофага øX174, собранный и заархивированный в дрожжах» . Вирусология . 434 (2): 278–284. дои : 10.1016/j.virol.2012.09.020 . ПМИД 23079106 .
- ^ Вульфсон Д.Н., Бартлетт Г.Дж., Брюнинг М., Томсон А.Р. (август 2012 г.). «Новая валюта за старый канат: от витых узлов до α-спиральных стволов». Современное мнение в области структурной биологии . 22 (4): 432–41. дои : 10.1016/j.sbi.2012.03.002 . ПМИД 22445228 .
- ^ Дубер Дж.Э., Ву Г.К., Малмирчегини Г.Р., Мун Т.С., Петцольд С.Дж., Уллал А.В., Пратер К.Л., Кислинг Дж.Д. (август 2009 г.). «Синтетические белковые каркасы обеспечивают модульный контроль над метаболическим потоком». Природная биотехнология . 27 (8): 753–9. дои : 10.1038/nbt.1557 . ПМИД 19648908 . S2CID 2756476 .
- ^ Реддингтон СК, Ховарт М. (декабрь 2015 г.). «Секреты ковалентного взаимодействия биоматериалов и биотехнологий: SpyTag и SpyCatcher» . Современное мнение в области химической биологии . 29 : 94–9. дои : 10.1016/j.cbpa.2015.10.002 . ПМИД 26517567 .
- ^ Бэйл Дж. Х., Гримли Дж. С., Станкунас К., Гествицки Дж. Э., Уэндлесс Т. Дж., Крэбтри Г. Р. (январь 2006 г.). «Аналоги рапамицина с дифференциальной специфичностью связывания позволяют осуществлять ортогональный контроль активности белка» . Химия и биология . 13 (1): 99–107. doi : 10.1016/j.chembiol.2005.10.017 . ПМИД 16426976 .
- ^ Альтшилер Э., Вентура А., Колман-Лернер А., Черноморец А. (октябрь 2014 г.). «Влияние ограничений восходящего и нисходящего потока на сверхчувствительность модуля сигнализации» . Физическая биология . 11 (6): 066003. Бибкод : 2014PhBio..11f6003A . дои : 10.1088/1478-3975/11/6/066003 . ПМЦ 4233326 . ПМИД 25313165 .
- ^ Альтшилер Э., Вентура А.С., Колман-Лернер А., Черноморец А. (2017). «Возврат к сверхчувствительности в сигнальных каскадах: объединение оценок локальной и глобальной сверхчувствительности» . ПЛОС ОДИН . 12 (6): e0180083. arXiv : 1608.08007 . Бибкод : 2017PLoSO..1280083A . дои : 10.1371/journal.pone.0180083 . ПМЦ 5491127 . ПМИД 28662096 .
- ^ Карбонелл-Баллестеро М., Дюран-Небреда С., Монтаньес Р., Соле Р., Масия Х., Родригес-Касо С. (декабрь 2014 г.). «Характеристика передаточных функций снизу вверх для проектов синтетической биологии: уроки энзимологии» . Исследования нуклеиновых кислот . 42 (22): 14060–14069. дои : 10.1093/nar/gku964 . ПМК 4267673 . ПМИД 25404136 .
- ^ Казнессис Ю.Н. (ноябрь 2007 г.). «Модели для синтетической биологии» . Системная биология BMC . 1 (1): 47. дои : 10.1186/1752-0509-1-47 . ПМК 2194732 . ПМИД 17986347 .
- ^ Туза З.А., Сингхал В., Ким Дж., Мюррей Р.М. (декабрь 2013 г.). «Набор инструментов моделирования in silico для быстрого прототипирования схем в биомолекулярной «макетной» системе». 52-я конференция IEEE по принятию решений и управлению . дои : 10.1109/CDC.2013.6760079 .
- ^ ЛаФлер Т.Л., Хоссейн А., Салис Х.М. (сентябрь 2022 г.). «Автоматизированный модельно-прогностический дизайн синтетических промоторов для контроля профилей транскрипции у бактерий» . Природные коммуникации . 13 (1): 5159. Бибкод : 2022NatCo..13.5159L . дои : 10.1038/s41467-022-32829-5 . ПМК 9440211 . ПМИД 36056029 .
- ^ Казнессис, Яннис Н (2007). «Модели для синтетической биологии» . Системная биология BMC . 1 (1): 47. дои : 10.1186/1752-0509-1-47 . ISSN 1752-0509 . ПМК 2194732 . ПМИД 17986347 .
- ^ Элани Ю. (июнь 2016 г.). «Создание мембраносвязанных искусственных клеток с использованием микрофлюидики: новый рубеж в восходящей синтетической биологии» . Труды Биохимического общества . 44 (3): 723–30. дои : 10.1042/BST20160052 . ПМЦ 4900754 . ПМИД 27284034 .
- ^ Гач ПК, Иваи К., Ким П.В., Хиллсон Н.Дж., Сингх А.К. (октябрь 2017 г.). «Капельная микрофлюидика для синтетической биологии» (PDF) . Лаборатория на чипе . 17 (20): 3388–3400. дои : 10.1039/C7LC00576H . ОСТИ 1421856 . ПМИД 28820204 . S2CID 206094816 .
- ^ Винуселви П., Пак С., Ким М., Пак Дж.М., Ким Т., Ли С.К. (3 июня 2011 г.). «Микрофлюидные технологии для синтетической биологии» . Международный журнал молекулярных наук . 12 (6): 3576–93. дои : 10.3390/ijms12063576 . ПМЦ 3131579 . ПМИД 21747695 .
- ↑ Перейти обратно: Перейти обратно: а б Халил А.С., Лу Т.К., Башор С.Дж., Рамирес К.Л., Пайенсон Н.С., Йонг Дж.К., Коллинз Дж.Дж. (август 2012 г.). «Система синтетической биологии для программирования функций транскрипции эукариот» . Клетка . 150 (3): 647–58. дои : 10.1016/j.cell.2012.05.045 . ПМЦ 3653585 . ПМИД 22863014 .
- ^ «Синтетическая биология» . Genome.gov . Проверено 23 января 2023 г.
- ^ де Алмейда П.Е., ван Раппард-младший, Ву Дж.К. (сентябрь 2011 г.). «Биолюминесценция in vivo для отслеживания судьбы и функции клеток» . Американский журнал физиологии. Физиология сердца и кровообращения . 301 (3): H663–71. дои : 10.1152/ajpheart.00337.2011 . ПМК 3191083 . ПМИД 21666118 .
- ^ Клоуз Д.М., Сюй Т., Сэйлер Г.С., Рипп С. (2011). «Биолюминесцентная визуализация in vivo (BLI): неинвазивная визуализация и исследование биологических процессов у живых животных» . Датчики . 11 (1): 180–206. дои : 10.3390/s110100180 . ПМК 3274065 . ПМИД 22346573 .
- ^ Гиббс WW (1997). «Звери на чипе» . Научный американец . Проверено 2 марта 2009 г.
- ^ Белкин С., Ягур-Кролл С., Кабесса Ю., Корума В., Септон Т., Анати Ю. и др. (апрель 2017 г.). «Дистанционное обнаружение заглубленных мин с помощью бактериального сенсора». Природная биотехнология . 35 (4): 308–310. дои : 10.1038/nbt.3791 . ПМИД 28398330 . S2CID 3645230 .
- ^ Данино Т., Приндл А., Квонг Г.А., Скалак М., Ли Х., Аллен К., Хасти Дж., Бхатия С.Н. (май 2015 г.). «Программируемые пробиотики для выявления рака в моче» . Наука трансляционной медицины . 7 (289): 289ра84. doi : 10.1126/scitranslmed.aaa3519 . ПМЦ 4511399 . ПМИД 26019220 .
- ^ «Маски для лица, которые позволяют диагностировать COVID-19» . www.medicalxpress.com . Проверено 11 июля 2021 г.
- ^ Нгуен П.К., Соенксен Л.Р., Донгиа Н.М., Ангенент-Мари Н.М., де Пуч Х., Хуанг А. и др. (ноябрь 2021 г.). «Носимые материалы со встроенными сенсорами синтетической биологии для обнаружения биомолекул» . Природная биотехнология . 39 (11): 1366–1374. дои : 10.1038/s41587-021-00950-3 . hdl : 1721.1/131278 . ПМИД 34183860 . S2CID 235673261 .
- ^ Халил, Ахмад С.; Коллинз, Джеймс Дж. (май 2010 г.). «Синтетическая биология: приложения достигают совершеннолетия» . Обзоры природы Генетика . 11 (5): 367–379. дои : 10.1038/nrg2775 . ISSN 1471-0064 . ПМК 2896386 . ПМИД 20395970 .
- ^ «Более пристальный взгляд на клеточное сельское хозяйство и определяющие его процессы — AgFunderNews» . 05.07.2016 . Проверено 5 августа 2016 г.
- ^ Брайант, Кристофер Дж. (3 августа 2020 г.). «Культура, мясо и культивированное мясо» . Журнал зоотехники . 98 (8): скаа172. дои : 10.1093/jas/skaa172 . ISSN 0021-8812 . ПМЦ 7398566 . ПМИД 32745186 .
- ^ Хон, Тэ Гён; Шин, Донг-Мин; Чхве, Джунхёк; До, Чон Тэ; Хан, Сунг Гу (май 2021 г.). «Актуальные проблемы и технические достижения в производстве культивированного мяса: AReview» . Пищевая наука о животных ресурсах . 41 (3): 355–372. дои : 10.5851/kosfa.2021.e14 . ISSN 2636-0772 . ПМЦ 8112310 . ПМИД 34017947 .
- ^ Трайх, Николас (1 мая 2021 г.). «Культурное мясо: перспективы и вызовы» . Экономика окружающей среды и ресурсов . 79 (1): 33–61. дои : 10.1007/s10640-021-00551-3 . ISSN 1573-1502 . ПМЦ 7977488 . ПМИД 33758465 .
- ^ Мэттик, CS (январь 2018 г.). «Клеточное сельское хозяйство: грядущая революция в производстве продуктов питания». Бюллетень ученых-атомщиков . 74 (1): 32–35. Бибкод : 2018БуАтС..74а..32М . дои : 10.1080/00963402.2017.1413059 . S2CID 149404346 .
- ^ «Японские учёные впервые напечатали на 3D-принтере мраморную говядину вагю » Новый Атлас . 25 августа 2021 г. Проверено 21 сентября 2021 г.
- ^ Кан Д.Х., Луис Ф., Лю Х., Симода Х., Нисияма Ю., Нодзава Х. и др. (август 2021 г.). «Создана цельная мясоподобная ткань путем сборки клеточных волокон с использованием биопечати, интегрированной в сухожильный гель» . Природные коммуникации . 12 (1): 5059. Бибкод : 2021NatCo..12.5059K . дои : 10.1038/s41467-021-25236-9 . ПМК 8385070 . ПМИД 34429413 .
- ^ Лаварс Н. (20 сентября 2021 г.). «Кофе, выращенный в лаборатории, сокращает количество бобов и вырубку лесов» . Новый Атлас . Проверено 18 октября 2021 г.
- ^ «Экологически чистый, выращенный в лаборатории кофе уже в пути, но у него есть одна загвоздка» . Хранитель . 16 октября 2021 г. Проверено 26 октября 2021 г.
- ^ «Экологичный кофе, выращенный в Финляндии» . Новости ВТТ . 15 сентября 2021 г. Проверено 18 октября 2021 г.
- ^ «Выращивание продуктов питания с помощью воздуха и солнечной энергии: более эффективно, чем посадка сельскохозяйственных культур» . физ.орг . Проверено 11 июля 2021 г.
- ^ Леже Д., Матасса С., Нур Э., Шепон А., Майло Р., Бар-Эвен А. (июнь 2021 г.). «Производство микробного белка с помощью фотоэлектрической энергии может использовать землю и солнечный свет более эффективно, чем традиционные культуры» . Труды Национальной академии наук Соединенных Штатов Америки . 118 (26): e2015025118. Бибкод : 2021PNAS..11815025L . дои : 10.1073/pnas.2015025118 . ПМЦ 8255800 . ПМИД 34155098 . S2CID 235595143 .
- ^ «Первый в мире искусственный синтез крахмала из CO2 превосходит природный» . Новый Атлас . 28 сентября 2021 г. Проверено 18 октября 2021 г.
- ^ Цай Т., Сунь Х., Цяо Дж., Чжу Л., Чжан Ф., Чжан Дж. и др. (сентябрь 2021 г.). «Бесклеточный химиоферментативный синтез крахмала из углекислого газа» . Наука . 373 (6562): 1523–1527. Бибкод : 2021Sci...373.1523C . дои : 10.1126/science.abh4049 . ПМИД 34554807 . S2CID 237615280 .
- ^ «Паучий шелк, созданный фотосинтезирующими бактериями» . физ.орг . Архивировано из оригинала 7 августа 2020 года . Проверено 16 августа 2020 г. .
- ^ Фунг С.П., Хигучи-Такеучи М., Малай А.Д., Октавиани Н.А., Тагун С., Нумата К. (июль 2020 г.). «Фабрика морских фотосинтетических микробных клеток как платформа для производства паучьего шелка» . Коммуникационная биология . 3 (1). Springer Science and Business Media LLC: 357. doi : 10.1038/s42003-020-1099-6 . ПМЦ 7343832 . ПМИД 32641733 .
- ^ Сингх В. (декабрь 2014 г.). «Последние достижения и возможности в области разработки синтетических логических вентилей в живых клетках» . Системы и синтетическая биология . 8 (4): 271–82. дои : 10.1007/s11693-014-9154-6 . ПМЦ 4571725 . ПМИД 26396651 .
- ^ Перселл О, Лу Т.К. (октябрь 2014 г.). «Синтетические аналоговые и цифровые схемы для клеточных вычислений и памяти» . Современное мнение в области биотехнологии . Клеточная и дорожная инженерия. 29 : 146–55. дои : 10.1016/j.copbio.2014.04.009 . ПМК 4237220 . ПМИД 24794536 .
- ^ Дэниел Р., Рубенс-младший, Сарпешкар Р., Лу Т.К. (май 2013 г.). «Синтетические аналоговые вычисления в живых клетках». Природа . 497 (7451): 619–23. Бибкод : 2013Natur.497..619D . дои : 10.1038/nature12148 . ПМИД 23676681 . S2CID 4358570 .
- ^ Ринаудо К., Блерис Л., Маддамсетти Р., Субраманиан С., Вайс Р., Бененсон Ю. (июль 2007 г.). «Универсальный логический оценщик на основе РНКи, работающий в клетках млекопитающих». Природная биотехнология . 25 (7): 795–801. дои : 10.1038/nbt1307 . ПМИД 17515909 . S2CID 280451 .
- ^ Се З, Вроблевска Л, Прохазка Л, Вайс Р, Бененсон Ю (сентябрь 2011 г.). «Многовходовая логическая схема на основе РНКи для идентификации специфических раковых клеток» . Наука . 333 (6047): 1307–11. Бибкод : 2011Sci...333.1307X . дои : 10.1126/science.1205527 . ПМИД 21885784 . S2CID 13743291 .
- ^ Нильсен А.А., Дер Б.С., Шин Дж., Вайдьянатан П., Параланов В., Стричалски Е.А., Росс Д., Денсмор Д., Фойгт К.А. (апрель 2016 г.). «Автоматизация проектирования генетических схем» . Наука . 352 (6281): аас7341. дои : 10.1126/science.aac7341 . ПМИД 27034378 .
- ^ Вайнберг Б.Х., Фам Н.Т., Карабальо Л.Д., Лозаноски Т., Энгель А., Бхатия С., Вонг В.В. (май 2017 г.). «Крупномасштабное проектирование надежных генетических цепей с множеством входов и выходов для клеток млекопитающих» . Природная биотехнология . 35 (5): 453–462. дои : 10.1038/nbt.3805 . ПМЦ 5423837 . ПМИД 28346402 .
- ^ Панди А., Кох М., Войводик П.Л., Судье П., Бонне Дж., Кушваха М., Фаулон Дж.Л. (август 2019 г.). «Метаболические перцептроны для нейронных вычислений в биологических системах» . Природные коммуникации . 10 (1): 3880. Бибкод : 2019NatCo..10.3880P . дои : 10.1038/s41467-019-11889-0 . ПМК 6713752 . ПМИД 31462649 .
- ^ Вестфолл П.Дж., Питера Дж., Ленихан Дж.Р., Энг Д., Вулард FX, Регентин Р., Хорнинг Т., Цурута Х., Мелис Дж.Д., Оуэнс А., Фикес С., Диола Д., Бенджамин К.Р., Кислинг Дж.Д., Ливелл М.Д., Макфи DJ, Реннингер Н.С. , Ньюман Джей Ди, Пэддон Си Джей (январь 2012 г.). «Производство аморфадиена в дрожжах и его превращение в дигидроартемизиновую кислоту, предшественник противомалярийного агента артемизинина» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (3): E111–8. Бибкод : 2012PNAS..109E.111W . дои : 10.1073/pnas.1110740109 . ПМК 3271868 . ПМИД 22247290 .
- ^ Коннор С. (28 марта 2014 г.). «Эврика! Ученые совершили гигантский скачок к синтетической жизни» . Независимый . Архивировано из оригинала 26 мая 2022 г. Проверено 6 августа 2015 г.
- ^ Нгуен П.К., Ботянски З., Тай П.К., Джоши Н.С. (сентябрь 2014 г.). «Программируемые материалы на основе биопленок из инженерных нановолокон Curli» . Природные коммуникации . 5 : 4945. Бибкод : 2014NatCo...5.4945N . дои : 10.1038/ncomms5945 . ПМИД 25229329 .
- ^ Кульман Б., Дантас Дж., Иретон Г.К., Варани Г., Стоддард Б.Л., Бейкер Д. (ноябрь 2003 г.). «Разработка новой складки глобулярного белка с точностью на атомном уровне» . Наука . 302 (5649): 1364–8. Бибкод : 2003Sci...302.1364K . дои : 10.1126/science.1089427 . ПМИД 14631033 . S2CID 1939390 .
- ^ Кодер Р.Л., Андерсон Дж.Л., Соломон Л.А., Редди К.С., Мозер CC, Даттон П.Л. (март 2009 г.). «Проектирование и разработка белка-транспортера O (2)» . Природа . 458 (7236): 305–309. Бибкод : 2009Natur.458..305K . дои : 10.1038/nature07841 . ПМЦ 3539743 . ПМИД 19295603 .
- ^ Фарид Т.А., Кодали Г., Соломон Л.А., Лихтенштейн Б.Р., Шихан М.М., Фрай Б.А. и др. (декабрь 2013 г.). «Дизайн элементарного тетраспирального белка для разнообразных функций оксидоредуктазы» . Химическая биология природы . 9 (12): 826–833. дои : 10.1038/следующий.1362 . ПМК 4034760 . ПМИД 24121554 .
- ^ Ван М.С., Хехт М.Х. (сентябрь 2020 г.). «Полностью АТФаза De Novo из комбинаторного дизайна белков». Журнал Американского химического общества . 142 (36): 15230–15234. дои : 10.1021/jacs.0c02954 . ПМИД 32833456 . S2CID 221308093 .
- ^ Армбрустер Б.Н., Ли Х, Пауш М.Х., Херлитце С., Рот Б.Л. (март 2007 г.). «Развитие замка так, чтобы он соответствовал ключу, для создания семейства рецепторов, связанных с G-белком, мощно активируемых инертным лигандом» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (12): 5163–5168. Бибкод : 2007PNAS..104.5163A . дои : 10.1073/pnas.0700293104 . ПМЦ 1829280 . ПМИД 17360345 .
- ^ Мак В.С., Тран С., Маркески Р., Бертолани С., Томпсон Дж., Бейкер Д. и др. (ноябрь 2015 г.). «Интегративный геномный анализ функций ферментов, позволяющий разработать неприродный путь биосинтеза» . Природные коммуникации . 6 : 10005. Бибкод : 2015NatCo...610005M . дои : 10.1038/ncomms10005 . ПМЦ 4673503 . ПМИД 26598135 .
- ^ Ван Ц, Пэрриш А.Р., Ван Л. (март 2009 г.). «Расширение генетического кода для биологических исследований» . Химия и биология . 16 (3): 323–36. doi : 10.1016/j.chembiol.2009.03.001 . ПМК 2696486 . ПМИД 19318213 .
- ^ Дэвидсон А.Р., Ламб К.Дж., Зауэр Р.Т. (октябрь 1995 г.). «Кооперативно свернутые белки в библиотеках случайных последовательностей». Структурная биология природы . 2 (10): 856–864. дои : 10.1038/nsb1095-856 . ПМИД 7552709 . S2CID 31781262 .
- ^ Камтекар С., Шиффер Дж.М., Сюн Х., Бабик Дж.М., Хехт М.Х. (декабрь 1993 г.). «Дизайн белка путем бинарного формирования паттерна полярных и неполярных аминокислот». Наука . 262 (5140): 1680–1685. Бибкод : 1993Sci...262.1680K . дои : 10.1126/science.8259512 . ПМИД 8259512 .
- ^ Уолтер К.У., Вамвача К., Хилверт Д. (ноябрь 2005 г.). «Активный фермент, построенный на основе алфавита из 9 аминокислот» . Журнал биологической химии . 280 (45): 37742–37746. дои : 10.1074/jbc.M507210200 . ПМИД 16144843 .
- ^ «Приложения синтетической биологии» . www.thermofisher.com . Проверено 12 ноября 2015 г.
- ^ Лю Ю, Шин Х.Д., Ли Дж., Лю Л. (февраль 2015 г.). «На пути к метаболической инженерии в контексте системной биологии и синтетической биологии: достижения и перспективы». Прикладная микробиология и биотехнология . 99 (3): 1109–18. дои : 10.1007/s00253-014-6298-y . ПМИД 25547833 . S2CID 954858 .
- ^ ГМ Черча, Гао Ю, Косури С (сентябрь 2012 г.). «Цифровое хранилище информации нового поколения в ДНК» . Наука . 337 (6102): 1628. Бибкод : 2012Sci...337.1628C . дои : 10.1126/science.1226355 . ПМИД 22903519 . S2CID 934617 .
- ^ «Огромные объемы данных могут храниться в ДНК» . Небесные новости. 23 января 2013 г. Архивировано из оригинала 31 мая 2016 г. Проверено 24 января 2013 г.
- ^ Заде Дж.Н., Стинберг С.Д., Буа Дж.С., Вулф Б.Р., Пирс М.Б., Хан А.Р. и др. (январь 2011 г.). «НУПАК: Анализ и дизайн систем нуклеиновых кислот» . Журнал вычислительной химии . 32 (1): 170–173. дои : 10.1002/jcc.21596 . ПМИД 20645303 . S2CID 33709556 .
- ^ Лоренц Р., Бернхарт С.Х., Хёнер Цу Зидердиссен С., Тафер Х., Фламм С., Стадлер П.Ф., Хофакер И.Л. (ноябрь 2011 г.). «Пакет ВенскойРНК 2.0» . Алгоритмы молекулярной биологии . 6 (1): 26. дои : 10.1186/1748-7188-6-26 . ПМЦ 3319429 . ПМИД 22115189 .
- ^ Салис Х.М., Мирский Е.А., Фойгт К.А. (октябрь 2009 г.). «Автоматизированный дизайн сайтов связывания синтетических рибосом для контроля экспрессии белка» . Природная биотехнология . 27 (10): 946–950. дои : 10.1038/nbt.1568 . ПМЦ 2782888 . ПМИД 19801975 .
- ^ Нильсен А.А., Дер Б.С., Шин Дж., Вайдьянатан П., Параланов В., Стрыхальский Е.А. и др. (апрель 2016 г.). «Автоматизация проектирования генетических схем» . Наука . 352 (6281): аас7341. дои : 10.1126/science.aac7341 . ПМИД 27034378 .
- ^ Хоссейн А., Лопес Е., Халпер С.М., Цетнар Д.П., Рейс А.С., Стрикланд Д. и др. (декабрь 2020 г.). «Автоматическое проектирование тысяч неповторяющихся деталей для создания стабильных генетических систем» . Природная биотехнология . 38 (12): 1466–1475. дои : 10.1038/s41587-020-0584-2 . ПМИД 32661437 . S2CID 220506228 .
- ^ Поллак А (7 мая 2014 г.). «Исследователи сообщают о прорыве в создании искусственного генетического кода» . Нью-Йорк Таймс . Проверено 7 мая 2014 г.
- ^ Каллауэй Э (7 мая 2014 г.). «Первая жизнь с «чужой» ДНК» . Природа . дои : 10.1038/nature.2014.15179 . S2CID 86967999 . Проверено 7 мая 2014 г.
- ↑ Перейти обратно: Перейти обратно: а б Малышев Д.А., Дхами К., Лавернь Т., Чен Т., Дай Н., Фостер Дж.М., Корреа И.Р., Ромесберг Ф.Е. (май 2014 г.). «Полусинтетический организм с расширенным генетическим алфавитом» . Природа . 509 (7500): 385–8. Бибкод : 2014Natur.509..385M . дои : 10.1038/nature13314 . ПМК 4058825 . ПМИД 24805238 .
- ↑ Перейти обратно: Перейти обратно: а б Версе CN, Паулино-Лима И.Г., Баке М., Билли Д., Ротшильд Л.Дж. (2016). «Синтетическая биология для освоения космоса: перспективы и социальные последствия». Амбивалентности создания жизни . Этика оценки науки и технологий. Том. 45. Шпрингер-Верлаг. стр. 73–100. дои : 10.1007/978-3-319-21088-9_4 . ISBN 978-3-319-21087-2 .
- ^ Менезес А.А., Камберс Дж., Хоган Дж.А., Аркин А.П. (январь 2015 г.). «К синтетическим биологическим подходам к использованию ресурсов в космических полетах» . Журнал Королевского общества, Интерфейс . 12 (102): 20140715. doi : 10.1098/rsif.2014.0715 . ПМК 4277073 . ПМИД 25376875 .
- ^ Монтегю М., МакАртур Г.Х., Кокелл К.С., Хелд Дж., Маршалл В., Шерман Л.А. и др. (декабрь 2012 г.). «Роль синтетической биологии в использовании ресурсов in situ (ISRU)». Астробиология . 12 (12): 1135–1142. Бибкод : 2012AsBio..12.1135M . дои : 10.1089/ast.2012.0829 . ПМИД 23140229 .
- ^ Штайгервальд Б. «НАСА – дизайнерские растения на Марсе» . www.nasa.gov . Проверено 29 мая 2020 г.
- ^ Хатчисон К.А., Чуанг Р.Ю., Носков В.Н., Асад-Гарсия Н., Диринк Т.Дж., Эллисман М.Х., Гилл Дж., Каннан К., Карас Б.Дж., Ма Л., Пеллетье Дж.Ф., Ци ZQ, Рихтер Р.А., Стричалски Э.А., Сан Л., Сузуки Ю., Цветанова Б., Уайз К.С., Смит Х.О., Гласс Дж.И., Мерриман С., Гибсон Д.Г., Вентер Дж.К. (март 2016 г.). «Дизайн и синтез минимального бактериального генома» . Наука . 351 (6280): аад6253. Бибкод : 2016Sci...351.....H . дои : 10.1126/science.aad6253 . ПМИД 27013737 .
- ↑ Перейти обратно: Перейти обратно: а б Коннор С. (1 декабря 2014 г.). «Крупный прорыв в области синтетической жизни: ученые создали первые искусственные ферменты» . Независимый . Лондон. Архивировано из оригинала 26 мая 2022 г. Проверено 6 августа 2015 г.
- ↑ Перейти обратно: Перейти обратно: а б Димер Д. (июль 2005 г.). «Гигантский шаг к искусственной жизни?». Тенденции в биотехнологии . 23 (7): 336–338. дои : 10.1016/j.tibtech.2005.05.008 . ПМИД 15935500 .
- ^ «Ученые достигли важной вехи на пути к искусственной жизни» . ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР . 20 мая 2010 г. Проверено 9 июня 2010 г.
- ^ Вентер Дж.К. (25 января 2017 г.). «От проектирования жизни к продлению здоровой жизни» . Ютуб . Телевидение Калифорнийского университета (UCTV). Архивировано из оригинала 21 декабря 2021 г. Проверено 1 февраля 2017 г.
- ^ «Построй ячейку» . Проверено 4 декабря 2019 г.
- ^ «ФабриСелл» . Проверено 8 декабря 2019 г.
- ^ «MaxSynBio - Исследовательская сеть Макса Планка в области синтетической биологии» . Проверено 8 декабря 2019 г.
- ^ «БаСик» . Проверено 8 декабря 2019 г.
- ^ «СинСелл ЕС» . Проверено 8 декабря 2019 г.
- ^ Девлин, Ханна; корреспондент Ханна Девлин Science (14 июня 2023 г.). «Синтетические человеческие эмбрионы, созданные с помощью революционных достижений» . Хранитель . ISSN 0261-3077 . Проверено 30 ноября 2023 г.
- ↑ Перейти обратно: Перейти обратно: а б с Халил, Ахмад С.; Коллинз, Джеймс Дж. (май 2010 г.). «Синтетическая биология: приложения достигают совершеннолетия» . Обзоры природы Генетика . 11 (5): 367–379. дои : 10.1038/nrg2775 . ISSN 1471-0056 . ПМК 2896386 . ПМИД 20395970 . S2CID 2926016 .
- ^ Цзу С, Ван Дж (август 2014 г.). «Бактерии, колонизирующие опухоль: потенциальная терапия, нацеленная на опухоль». Критические обзоры по микробиологии . 40 (3): 225–235. дои : 10.3109/1040841X.2013.776511 . ПМИД 23964706 . S2CID 26498221 .
- ^ Гуджрати В., Ким С., Ким Ш., Мин Джей Джей, Чой Х.Э., Ким С.К., Джон С. (февраль 2014 г.). «Биоинженерные бактериальные везикулы наружной мембраны как клеточно-специфические средства доставки лекарств для терапии рака». АСУ Нано . 8 (2): 1525–1537. дои : 10.1021/nn405724x . ПМИД 24410085 .
- ^ Пиньеро-Ламбеа К., Боделлон Г., Фернандес-Перианес Р., Куэста А.М., Альварес-Валлина Л., Фернандес Ла (апрель 2015 г.). «Программирование контролируемой адгезии E. coli к целевым поверхностям, клеткам и опухолям с помощью синтетических адгезинов» . ACS Синтетическая биология . 4 (4): 463–473. дои : 10.1021/sb500252a . ПМЦ 4410913 . ПМИД 25045780 .
- ^ Дейнеко И.В., Касниц Н., Лешнер С., Вайс С. (2016). «Составление специфического для опухоли бактериального промотора» . ПЛОС ОДИН . 11 (5): e0155338. Бибкод : 2016PLoSO..1155338D . дои : 10.1371/journal.pone.0155338 . ПМЦ 4865170 . ПМИД 27171245 .
- ^ Райс К.К., Бэйлс К.В. (март 2008 г.). «Молекулярный контроль гибели и лизиса бактерий» . Обзоры микробиологии и молекулярной биологии . 72 (1): 85–109, оглавление. дои : 10.1128/mmbr.00030-07 . ПМК 2268280 . ПМИД 18322035 .
- ^ Ганай С., Аренас РБ, Forbes NS (ноябрь 2009 г.). «Нацеленная на опухоль доставка TRAIL с использованием Salmonella typhimurium повышает выживаемость при раке молочной железы у мышей» . Британский журнал рака . 101 (10): 1683–1691. дои : 10.1038/sj.bjc.6605403 . ПМЦ 2778534 . ПМИД 19861961 .
- ^ Скотт, Бенджамин М.; Гутьеррес-Васкес, Кристина; Санмарко, Лилиана М.; да Силва Перейра, Джессика А.; Ли, Чжаорун; Пласенсия, Агустин; Хьюсон, Патрик; Кокс, Лаура М.; О'Брайен, Мэдлинн; Чен, Стивен К.; Мораес-Виейра, Педро М.; Чанг, Белинда С.В.; Пейсайович, Серджио Г.; Кинтана, Франсиско Дж. (июль 2021 г.). «Самонастраиваемые дрожжевые пробиотики для лечения воспалительных заболеваний кишечника». Природная медицина . 27 (7): 1212–1222. дои : 10.1038/s41591-021-01390-x . ISSN 1546-170Х . ПМИД 34183837 . S2CID 235673499 .
- ^ Чен, Кевин; Чжу, Исюань; Чжан, Юнгронг; Хамза, Терва; Ю, Хуа; Сен-Флер, Эшли; Гален, Джеймс; Ян, Чжиюн; Фэн, Ханьпин (28 октября 2020 г.). «Пробиотическая дрожжевая иммунотерапия против инфекции Clostridioides difficile» . Наука трансляционной медицины . 12 (567): eaax4905. doi : 10.1126/scitranslmed.aax4905 . ISSN 1946-6234 . ПМЦ 7692727 . ПМИД 33115949 .
- ^ Чен, И-Джу; Абила, Бамс; Мостафа Камель, Ясир (2023). «CAR-T: Что дальше?» . Раки . 15 (3): 663. doi : 10.3390/cancers15030663 . ISSN 2072-6694 . ПМЦ 9913679 . ПМИД 36765623 .
- ^ Джонс, Б.С., Лэмб, Л.С., Гольдман, Ф. и Ди Стази, А. Повышение безопасности продуктов клеточной терапии путем переноса генов-самоубийц. Передний. Фармакол. 5, 254 (2014).
- ^ Вэй П., Вонг В.В., Парк Дж.С., Коркоран Э.Э., Пейзайович С.Г., Онуффер Дж.Дж. и др. (август 2012 г.). «Бактериальные белки вирулентности как инструменты для перестройки киназных путей в дрожжах и иммунных клетках» . Природа . 488 (7411): 384–388. Бибкод : 2012Natur.488..384W . дои : 10.1038/nature11259 . ПМЦ 3422413 . ПМИД 22820255 .
- ^ Данино Т., Мондрагон-Паломино О., Цимринг Л., Хасти Дж. (январь 2010 г.). «Синхронизированный кворум генетических часов» . Природа . 463 (7279): 326–330. Бибкод : 2010Natur.463..326D . дои : 10.1038/nature08753 . ПМЦ 2838179 . ПМИД 20090747 .
- ^ Чен YY, Jensen MC, Smolke CD (май 2010 г.). «Генетический контроль пролиферации Т-клеток млекопитающих с помощью систем регуляции синтетической РНК» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (19): 8531–8536. Бибкод : 2010PNAS..107.8531C . дои : 10.1073/pnas.1001721107 . ПМЦ 2889348 . ПМИД 20421500 .
- ↑ Перейти обратно: Перейти обратно: а б Кац, Леонард; Чен, Ивонн Ю; Гонсалес, Рамон; Петерсон, Тодд С; Чжао, Хуэйминь; Бальц, Ричард Х (01 июля 2018 г.). «Достижения и применение синтетической биологии в биотехнологической промышленности: перспективы» . Журнал промышленной микробиологии и биотехнологии . 45 (7): 449–461. дои : 10.1007/s10295-018-2056-y . ISSN 1476-5535 . ПМИД 29915997 . S2CID 49296740 .
- ^ Хофер М., Лютольф, депутат парламента (май 2021 г.). «Инженерные органоиды» . Обзоры природы. Материалы . 6 (5): 402–420. Бибкод : 2021NatRM...6..402H . дои : 10.1038/s41578-021-00279-y . ПМЦ 7893133 . ПМИД 33623712 .
- ^ Уитакер, Мэтью (июль 2014 г.). «История 3D-печати в здравоохранении» . Бюллетень Королевского колледжа хирургов Англии . 96 (7): 228–229. дои : 10.1308/147363514X13990346756481 . ISSN 1473-6357 .
- ^ Атала А., Бауэр С.Б., Сокер С., Ю Дж.Дж., Ретик А.Б. (апрель 2006 г.). «Тканеинженерные аутологичные мочевые пузыри для пациентов, нуждающихся в цистопластике» . Ланцет . 367 (9518): 1241–6. дои : 10.1016/S0140-6736(06)68438-9 . ПМИД 16631879 . S2CID 17892321 .
- ^ Хонг Н., Ян Г.Х., Ли Дж., Ким Дж. (январь 2018 г.). «3D-биопечать и ее применение in vivo» . Журнал исследований биомедицинских материалов. Часть B: Прикладные биоматериалы . 106 (1): 444–459. дои : 10.1002/jbm.b.33826 . ПМИД 28106947 .
- ^ Шинкар, Кальяни; Род, Кавал (1 августа 2022 г.). «Может ли 3D-экструзионная биопечать стать реальной альтернативой трансплантации органов в будущем?» . Анналы 3D-печатной медицины . 7 : 100066. doi : 10.1016/j.stlm.2022.100066 . ISSN 2666-9641 . S2CID 249083907 .
- ^ «90-OR: 3D-биопечать бионической поджелудочной железы с сосудистой системой — результаты трансплантации крупным животным» . Сайт диабетических журналов . Проверено 26 октября 2023 г.
- ^ Зоммер AC, Блюменталь EZ (сентябрь 2019 г.). «Внедрение 3D-печати в офтальмологии». Архив клинической и экспериментальной офтальмологии Грефе . 257 (9): 1815–1822. дои : 10.1007/s00417-019-04312-3 . ПМИД 30993457 . S2CID 116884575 .
- ^ Клак, Марта; Бринярский, Томаш; Ковальска, Патриция; Гомолка, Магдалена; Тимицкий, Гжегож; Косовская, Катажина; Цивонюк, Петр; Добжанский, Томаш; Туровский, Павел; Вшола, Михал (30 июня 2020 г.). «Новые стратегии в разработке искусственных органов: каково будущее медицины?» . Микромашины . 11 (7): 646. дои : 10,3390/ми11070646 . ISSN 2072-666X . ПМК 7408042 . ПМИД 32629779 .
- ^ Цуй Х, Мяо С, Эсуорси Т, Чжоу X, Ли SJ, Лю С, Ю ZX, Фишер Дж. П., Мохиуддин М, Чжан Л. Г. (июль 2018 г.). «3D-биопечать для регенерации сердечно-сосудистой системы и фармакологии» . Обзоры расширенной доставки лекарств . 132 : 252–269. дои : 10.1016/j.addr.2018.07.014 . ПМК 6226324 . ПМИД 30053441 .
- ^ «Многоцентровое, одностороннее, проспективное, открытое, поэтапное исследование безопасности и эффективности конструкции AuriNovo для реконструкции предсердия у субъектов с односторонней микротией» . www.clinicaltrials.gov. 15 октября 2021 г. Проверено 19 июля 2022 г.
- ^ Рабин, Рони Кэрин (2 июня 2022 г.). «Врачи пересаживают ухо человеческие клетки, сделанные на 3D-принтере» . Нью-Йорк Таймс . Проверено 19 июля 2022 г.
- ^ Купер-Уайт М (1 марта 2015 г.). «Как 3D-печать может положить конец смертельной нехватке донорских органов» . Хаффпост Наука . TheHuffingtonPost.com, Inc. Проверено 17 февраля 2016 г.
- ^ Эдмундсон MC, Кейпнесс М, Хорсфолл Л (декабрь 2014 г.). «Исследование потенциала металлических наночастиц в синтетической биологии» . Новая биотехнология . 31 (6): 572–578. дои : 10.1016/j.nbt.2014.03.004 . hdl : 20.500.11820/5cd4fa26-dee8-4862-86af-cf6a79546a13 . ПМИД 24681407 . S2CID 15790244 .
- ^ «Наночастицы уничтожают бляшки, вызывающие сердечные приступы» . Мичиганский государственный университет. 27 января 2020 года. Архивировано из оригинала 29 января 2020 года . Проверено 31 января 2020 г.
- ^ «Наночастицы помогают разъедать смертельные артериальные бляшки» . Новый Атлас . 28 января 2020 года. Архивировано из оригинала 1 марта 2020 года . Проверено 13 апреля 2020 г. .
- ^ Флорес А.М., Хоссейни-Нассаб Н., Джарр К.У., Йе Дж., Чжу X, Вирка Р. и др. (февраль 2020 г.). «Проэффероцитарные наночастицы специфически поглощаются повреждающими макрофагами и предотвращают атеросклероз» . Природные нанотехнологии . 15 (2): 154–161. Бибкод : 2020NatNa..15..154F . дои : 10.1038/s41565-019-0619-3 . ПМЦ 7254969 . ПМИД 31988506 .
- ^ «Исследования создают живые капли, производящие водород, прокладывая путь к альтернативному источнику энергии будущего» . физ.орг . Архивировано из оригинала 16 декабря 2020 года . Проверено 9 декабря 2020 г.
- ^ Сюй З, Ван С., Чжао С., Ли С., Лю Икс, Ван Л. и др. (ноябрь 2020 г.). «Фотосинтетическое производство водорода капельными микробными микрореакторами в аэробных условиях» . Природные коммуникации . 11 (1): 5985. Бибкод : 2020NatCo..11.5985X . дои : 10.1038/s41467-020-19823-5 . ПМЦ 7689460 . ПМИД 33239636 .
- ^ Се, Минци; Фюссенеггер, Мартин (июль 2015 г.). «Дизайнерские клетки млекопитающих: инженерные принципы и биомедицинские применения» . Биотехнологический журнал . 10 (7): 1005–1018. дои : 10.1002/biot.201400642 . ISSN 1860-6768 . ПМИД 26010998 . S2CID 11838264 .
- ^ Academic.oup.com https://academic.oup.com/proteincell/article/13/7/476/6747017 . Проверено 31 января 2024 г.
{{cite web}}: Отсутствует или пусто|title=( помощь ) - ↑ Перейти обратно: Перейти обратно: а б с Мансури, Майсам; Фюссенеггер, Мартин (01 июня 2022 г.). «Электрогенетика: соединение синтетической биологии и электроники для дистанционного управления поведением дизайнерских клеток млекопитающих» . Современное мнение в области химической биологии . 68 : 102151. дои : 10.1016/j.cbpa.2022.102151 . hdl : 20.500.11850/547194 . ISSN 1367-5931 . ПМИД 35483127 .
- ^ Кравчик, Кшиштоф; Сюэ, Шуай; Бухманн, Питер; Шарпен-Эль-Хамри, Гислен; Саксена, Пратик; Юшерр, Мари-Дидье; Шао, Цзявэй; Да, Хайфэн; Се, Минци; Фюссенеггер, Мартин (29 мая 2020 г.). «Электрогенетическое клеточное высвобождение инсулина для контроля гликемии в реальном времени у мышей с диабетом 1 типа» . Наука . 368 (6494): 993–1001. дои : 10.1126/science.aau7187 . hdl : 20.500.11850/418642 . ISSN 0036-8075 . ПМИД 32467389 . S2CID 218984797 .
- ^ Маккласки, Джейн Т.; Хамид, Мухаджир; Го-Парке, Хун; МакКленаган, Невилл Х.; Гомис, Рамон; Флэтт, Питер Р. (24 июня 2011 г.). «Разработка и функциональная характеристика линий бета-клеток поджелудочной железы человека, высвобождающих инсулин, полученных методом электрослияния *» . Журнал биологической химии . 286 (25): 21982–21992. дои : 10.1074/jbc.M111.226795 . ISSN 0021-9258 . ПМК 3121343 . ПМИД 21515691 .
- ↑ Перейти обратно: Перейти обратно: а б с Ньюсон Эй Джей (2015). «Синтетическая биология: этика, исключительность и ожидания» . Юридический журнал Маккуори . 15:45 .
- ^ «Границы 2018/19: новые экологические проблемы» . Программа ООН по окружающей среде . 04.03.2019 . Проверено 03 января 2021 г.
- ^ «Первые в мире дети с отредактированными генами созданы в Китае, - утверждает ученый» . Хранитель . Ноябрь 2018.
- ^ Хяйри М (апрель 2017 г.). «Синтетическая биология и этика: прошлое, настоящее и будущее». Кембриджский ежеквартальный журнал по этике здравоохранения . 26 (2): 186–205. дои : 10.1017/S0963180116000803 . ПМИД 28361718 . S2CID 29992939 .
- ^ Джин С., Кларк Б., Кузнесоф С., Лин Икс, Фруэр Л.Дж. (сентябрь 2019 г.). «Синтетическая биология, применяемая в агропродовольственном секторе: общественное восприятие, отношение и значение для будущих исследований». Тенденции в пищевой науке и технологиях . 91 : 454–466. дои : 10.1016/j.tifs.2019.07.025 . S2CID 199632852 .
- ^ Гутманн А (2012). «Этика синтетической биологии: руководящие принципы для новых технологий». Отчет Гастингсского центра . 41 (4): 17–22. дои : 10.1002/j.1552-146X.2011.tb00118.x . ПМИД 21845917 . S2CID 20662786 .
- ^ Брайант CJ (август 2020 г.). «Культура, мясо и культивированное мясо» . Журнал зоотехники . 98 (8): скаа172. дои : 10.1093/jas/skaa172 . ПМЦ 7398566 . ПМИД 32745186 .
- ^ Хонг Т.К., Шин Д.М., Чой Дж., До Дж.Т., Хан С.Г. (май 2021 г.). «Актуальные проблемы и технические достижения в производстве культивированного мяса: обзор» . Пищевая наука о животных ресурсах . 41 (3): 355–372. дои : 10.5851/kosfa.2021.e14 . ПМЦ 8112310 . ПМИД 34017947 .
- ^ Трейх Н. (1 мая 2021 г.). «Культурное мясо: перспективы и вызовы» . Экономика окружающей среды и ресурсов . 79 (1): 33–61. дои : 10.1007/s10640-021-00551-3 . ПМЦ 7977488 . ПМИД 33758465 .
- ^ Трейх Н. (май 2021 г.). «Культурное мясо: перспективы и вызовы» . Экономика окружающей среды и ресурсов . 79 (1): 33–61. дои : 10.1007/s10640-021-00551-3 . ПМЦ 7977488 . ПМИД 33758465 .
- ↑ Перейти обратно: Перейти обратно: а б Ховард Дж., Мурашов В., Шульте П. (март 2017 г.). «Синтетическая биология и профессиональный риск». Журнал гигиены труда и окружающей среды . 14 (3): 224–236. дои : 10.1080/15459624.2016.1237031 . ПМИД 27754800 . S2CID 205893358 .
- ↑ Перейти обратно: Перейти обратно: а б Европейская комиссия. Генеральный директорат по делам потребителей медицинских товаров (12 февраля 2016 г.). Мнение о синтетической биологии II: Методологии оценки рисков и аспекты безопасности . Офис публикаций. дои : 10.2772/63529 . ISBN 9789279439162 .
{{cite book}}:|website=игнорируется ( помогите ) - ↑ Перейти обратно: Перейти обратно: а б Бюгль Х., Даннер Дж.П., Молинари Р.Дж., Маллиган Дж.Т., Парк Х.О., Райхерт Б., Рот Д.А., Вагнер Р., Будоул Б., Скрипп Р.М., Смит Дж.А., Стил С.Дж., Черч Дж., Энди Д. (июнь 2007 г.). «Синтез ДНК и биологическая безопасность». Природная биотехнология . 25 (6): 627–629. дои : 10.1038/nbt0607-627 . ПМИД 17557094 . S2CID 7776829 .
- ^ «Этические проблемы синтетической биологии: обзор дебатов» (PDF) .
- ↑ Перейти обратно: Перейти обратно: а б Президентская комиссия по изучению проблем биоэтики, декабрь 2010 г. НОВЫЕ НАПРАВЛЕНИЯ Этика синтетической биологии и новых технологий. Архивировано 18 января 2017 г. на Wayback Machine . Проверено 14 апреля 2012 г.
- ^ Хаммель К. (31 августа 2020 г.). «Инженерные патогены и неестественное биологическое оружие: будущая угроза синтетической биологии» . Центр по борьбе с терроризмом в Вест-Пойнте . Проверено 5 января 2023 г.
- ^ Хаммель К (29 июня 2020 г.). «Взгляд из окопа CT: виртуальный круглый стол по вопросам COVID-19 и борьбы с терроризмом с Одри Курт Кронин, генерал-лейтенантом (в отставке) Майклом Нагатой, Магнусом Рансторпом, Али Суфаном и Хуаном Сарате» . Центр по борьбе с терроризмом в Вест-Пойнте . Проверено 5 января 2023 г.
- ↑ Перейти обратно: Перейти обратно: а б «Синбиосейф» . Синбиосейф .
- ^ Шмидт М., Гангули-Митра А., Торгерсен Х., Келле А., Деплазес А., Биллер-Андорно Н. (декабрь 2009 г.). «Приоритетный документ по социальным и этическим аспектам синтетической биологии» (PDF) . Системы и синтетическая биология . 3 (1–4): 3–7. дои : 10.1007/s11693-009-9034-7 . ПМЦ 2759426 . ПМИД 19816794 .
- ^ Шмидт М. Келле А. Гангули А., де Вриенд Х. (ред.) 2009. «Синтетическая биология. Технонаука и ее социальные последствия». Академическое издательство Спрингера.
- ^ Келле А. (декабрь 2009 г.). «Обеспечение безопасности синтетической биологии – к стратегии управления 5P» . Системы и синтетическая биология . 3 (1–4): 85–90. дои : 10.1007/s11693-009-9041-8 . ПМЦ 2759433 . ПМИД 19816803 .
- ^ Шмидт М. (июнь 2008 г.). «Распространение синтетической биологии: вызов биобезопасности» (PDF) . Системы и синтетическая биология . 2 (1–2): 1–6. дои : 10.1007/s11693-008-9018-z . ПМК 2671588 . ПМИД 19003431 .
- ^ COSY: Общение по синтетической биологии
- ^ Кронбергер Н., Хольц П., Кербе В., Штрассер Э., Вагнер В. (декабрь 2009 г.). «Информация о синтетической биологии: из лаборатории через средства массовой информации к широкой публике» . Системы и синтетическая биология . 3 (1–4): 19–26. дои : 10.1007/s11693-009-9031-x . ПМЦ 2759424 . ПМИД 19816796 .
- ^ Церер А., Зейрингер А. (декабрь 2009 г.). «Картины синтетической биологии: рефлексивное обсуждение репрезентации синтетической биологии (SB) в немецкоязычных СМИ и экспертами SB» . Системы и синтетическая биология . 3 (1–4): 27–35. дои : 10.1007/s11693-009-9038-3 . ПМЦ 2759430 . ПМИД 19816797 .
- ^ Отчет IASB «Технические решения для биобезопасности в синтетической биологии». Архивировано 19 июля 2011 г., в Wayback Machine , Мюнхен, 2008 г.
- ^ Паренс Э., Джонстон Дж., Мозес Дж. Этические проблемы в синтетической биологии. 2009.
- ^ «Политика и глобальные дела в национальных академиях» . сайты.nationalacademies.org .
- ^ Президентская комиссия по изучению вопросов биоэтики, декабрь 2010 г. Часто задаваемые вопросы. Архивировано 24 декабря 2015 г. на Wayback Machine.
- ^ «Часто задаваемые вопросы по синтетической биологии | Президентская комиссия по изучению проблем биоэтики» . Архивировано из оригинала 24 декабря 2015 г. Проверено 11 октября 2014 г.
- ↑ Перейти обратно: Перейти обратно: а б Эриксон Б., Сингх Р., Уинтерс П. (сентябрь 2011 г.). «Синтетическая биология: регулирование промышленного использования новых биотехнологий». Наука . 333 (6047): 1254–6. Бибкод : 2011Sci...333.1254E . дои : 10.1126/science.1211066 . ПМИД 21885775 . S2CID 1568198 .
- ^ Сэйлер К.М. (8 июня 2021 г.). Учебник по обороне: новые технологии (PDF) (отчет). Исследовательская служба Конгресса . Проверено 22 июля 2021 г.
- ^ Кэтрин Сюэ для журнала Harvard Magazine. Сентябрь – октябрь 2014 г. Новый зверинец синтетической биологии
- ↑ Йоджана Шарма для Scidev.net, 15 марта 2012 г. НПО призывают к международному регулированию синтетической биологии.
- ^ Новая синтетическая биология: кто выиграет? (2014-05-08), Ричард К. Левонтин , New York Review of Books
- ^ Национальные академии наук; Отдел исследований земной жизни; Совет по наукам о жизни; Совет по технологиям химических наук; Комитет по стратегиям выявления потенциальных уязвимостей биозащиты, создаваемых синтетической биологией (19 июня 2018 г.). Биозащита в эпоху синтетической биологии . Национальные академии наук, техники и медицины . дои : 10.17226/24890 . ISBN 9780309465182 . ПМИД 30629396 . S2CID 90767286 .
- ^ «Краткая информация о будущем: синтетическая биология и биоразнообразие» . Европейская комиссия . Сентябрь 2016. стр. 14–15 . Проверено 14 января 2019 г.
- ^ Заключительное мнение о синтетической биологии III: Риски для окружающей среды и биоразнообразия, связанные с синтетической биологией и приоритетами исследований в области синтетической биологии . Европейская комиссия. 04.04.2016. стр. 8, 27. ISBN. 9789279549731 . Проверено 14 января 2019 г.
{{cite book}}:|website=игнорируется ( помогите ) - ^ Эль Каруи М., Ойос-Флайт М., Флетчер Л. (2019). «Будущие тенденции в синтетической биологии – отчет» . Границы биоинженерии и биотехнологии . 7 : 175. дои : 10.3389/fbioe.2019.00175 . ПМК 6692427 . ПМИД 31448268 .
- ^ Бэйли С., Меткалф Х., Крук Б. (2012). «Синтетическая биология: обзор технологии, а также текущих и будущих потребностей нормативно-правовой базы Великобритании» (PDF) . Исполнительный директор Великобритании по охране труда и технике безопасности . Проверено 29 ноября 2018 г.
- ^ Пей Л., Бар-Ям С., Байерс-Корбин Дж., Касагранде Р., Эйхлер Ф., Лин А. и др. (2012). «Регуляторная база синтетической биологии». Синтетическая биология . John Wiley & Sons, Ltd., стр. 157–226. дои : 10.1002/9783527659296.ch5 . ISBN 9783527659296 .
- ^ Трамп Б.Д. (ноябрь 2017 г.). «Регулирование и управление синтетической биологией: уроки TAPIC для США, Европейского Союза и Сингапура» . Политика здравоохранения . 121 (11): 1139–1146. doi : 10.1016/j.healthpol.2017.07.010 . ПМИД 28807332 .
Библиография [ править ]
- Черч G, Реджис Э (2012). Регенезис: как синтетическая биология заново изобретет природу и нас самих . Нью-Йорк, штат Нью-Йорк: Основные книги . ISBN 978-0465021758 .
- Синтетическая биология и биоразнообразие; Наука для экологической политики (PDF) . Краткое описание будущего 15. Подготовлено для Генерального директората Европейской комиссии по окружающей среде Отделом научных коммуникаций UWE, Бристоль (Отчет). Европейская комиссия. 2016.
- Вентер С (2013). Жизнь со скоростью света: двойная спираль и заря цифровой жизни . Нью-Йорк, штат Нью-Йорк: Penguin Books. ISBN 978-0670025404 . OCLC 834432832 .
- Резерфорд, Адам (2014). Сотворение: как наука заново изобретает саму жизнь . Текущий. ISBN 9781617230110 . ОСЛК 880230551 .
Внешние ссылки [ править ]
- Искусственные патогены и неестественное биологическое оружие: будущая угроза синтетической биологии . Угрозы и соображения
- Книги по синтетической биологии, научно-популярные книги и учебники
- Вводное резюме синтетической биологии. Архивировано 2 апреля 2018 г. в Wayback Machine . Краткий обзор концепций, разработок и приложений синтетической биологии.
- Совместная обзорная статья по синтетической биологии
- Спорный стартап ДНК хочет позволить клиентам создавать существ (03 января 2015 г.), San Francisco Chronicle
- Он жив, но это жизнь: синтетическая биология и будущее творения (28 сентября 2016 г.), Всемирный фестиваль науки
