Молекулярная биология
| Часть серии о |
| Биология |
|---|
Молекулярная биология / m ə ˈ l ɛ k j ʊ l ər / — это раздел биологии , который стремится понять молекулярные основы биологической активности внутри и между клетками , включая биомолекулярный синтез, модификацию, механизмы и взаимодействия. [1] [2] [3]
Хотя клетки и другие микроскопические структуры наблюдались в живых организмах еще в 18 веке, детальное понимание механизмов и взаимодействий, управляющих их поведением, не возникло до 20 века, когда технологии, используемые в физике и химии, продвинулись достаточно далеко, чтобы позволить их применение в биологических науках. Термин «молекулярная биология» впервые был использован в 1945 году английским физиком Уильямом Эстбери , который описал его как подход, направленный на выяснение основ биологических явлений, т.е. раскрытие физических и химических структур и свойств биологических молекул, а также их взаимодействия с другими молекулами и то, как эти взаимодействия объясняют наблюдения так называемой классической биологии, которая вместо этого изучает биологические процессы в более крупных масштабах и на более высоких уровнях организации. [4] В 1953 году Фрэнсис Крик , Джеймс Уотсон , Розалинда Франклин и их коллеги из Отделения Совета медицинских исследований Кавендишской лаборатории первыми описали модель двойной спирали химической структуры дезоксирибонуклеиновой кислоты (ДНК), которую часто считают знаковой. событие для зарождающейся области, поскольку оно предоставило физико-химическую основу для понимания ранее туманной идеи о нуклеиновых кислотах как первичном веществе биологической наследственности. Они предложили эту структуру на основе предыдущих исследований Франклина, которые им передали Морис Уилкинс и Макс Перуц . [5] Их работа привела к открытию ДНК у других микроорганизмов, растений и животных. [6]
Область молекулярной биологии включает методы, которые позволяют ученым изучать молекулярные процессы. [7] Эти методы используются для эффективного поиска новых лекарств, диагностики заболеваний и лучшего понимания физиологии клеток. [8] Некоторые клинические исследования и медицинские методы лечения, основанные на молекулярной биологии, охватываются генной терапией , тогда как использование молекулярной биологии или молекулярно-клеточной биологии в медицине теперь называется молекулярной медициной .
История молекулярной биологии
[ редактировать ]

Молекулярная биология находится на стыке биохимии и генетики ; По мере того как эти научные дисциплины возникли и развивались в 20 веке, стало ясно, что обе они стремятся определить молекулярные механизмы, лежащие в основе жизненно важных клеточных функций. [9] Достижения молекулярной биологии тесно связаны с разработкой новых технологий и их оптимизацией. [10] Молекулярная биология была объяснена работами многих ученых, и поэтому история этой области зависит от понимания этих ученых и их экспериментов. [ нужна ссылка ]
Область генетики возникла в результате попыток понять набор правил, лежащих в основе воспроизводства и наследственности , а также природу гипотетических единиц наследственности, известных как гены . Грегор Мендель начал эту работу в 1866 году, когда он впервые описал законы наследственности, которые он наблюдал в своих исследованиях скрещивания растений гороха. [11] Одним из таких законов генетического наследования является закон сегрегации , который гласит, что диплоидные особи с двумя аллелями определенного гена передадут одну из этих аллелей своему потомству. [12] Из-за его критической работы изучение генетической наследственности обычно называют менделевской генетикой . [13]
Важнейшей вехой в молекулярной биологии стало открытие структуры ДНК . Эта работа началась в 1869 году Фридрихом Мишером , швейцарским биохимиком, который первым предложил структуру, называемую нуклеином , которая, как мы теперь знаем, представляет собой (дезоксирибонуклеиновую кислоту) или ДНК. [14] Это уникальное вещество он открыл, изучая компоненты гнойных повязок и отметив уникальные свойства «фосфорсодержащих веществ». [15] Другим заметным автором модели ДНК был Феб Левен , который предложил «полинуклеотидную модель» ДНК в 1919 году в результате своих биохимических экспериментов на дрожжах. [16] В 1950 году Эрвин Чаргафф расширил работу Левена и выяснил несколько важнейших свойств нуклеиновых кислот: во-первых, последовательность нуклеиновых кислот варьируется у разных видов. [17] Во-вторых, суммарная концентрация пуринов (аденина и гуанина) всегда равна суммарной концентрации пиримидинов (цистеина и тимина). [14] Это теперь известно как правило Чаргаффа. В 1953 году Джеймс Уотсон и Фрэнсис Крик опубликовали двойную спиральную структуру ДНК. [18] основаны на работах по рентгеновской кристаллографии, выполненных Розалиндой Франклин, которые были переданы им Морисом Уилкинсом и Максом Перуцем . [5] Уотсон и Крик описали структуру ДНК и высказали предположения о значении этой уникальной структуры для возможных механизмов репликации ДНК. [18] Уотсон и Крик были удостоены Нобелевской премии по физиологии и медицине в 1962 году вместе с Уилкинсом за предложение модели структуры ДНК. [6]
В 1961 году было продемонстрировано, что когда ген кодирует белок , три последовательных основания ДНК гена определяют каждую последующую аминокислоту белка. [19] Таким образом, генетический код представляет собой триплетный код, где каждый триплет (называемый кодоном ) определяет определенную аминокислоту. Кроме того, было показано, что кодоны не перекрываются друг с другом в последовательности ДНК, кодирующей белок, и что каждая последовательность считывается с фиксированной начальной точки.В 1962–1964 гг. за счет использования условно летальных мутантов бактериального вируса [20] Фундаментальные успехи были достигнуты в нашем понимании функций и взаимодействий белков, участвующих в механизме репликации ДНК , репарации ДНК , рекомбинации ДНК и сборке молекулярных структур. [21]
Эксперимент Гриффита
[ редактировать ]
В 1928 году Фредерик Гриффит обнаружил свойство вирулентности бактерий пневмококка , которое убивало лабораторных крыс. По мнению Менделя, распространенному в то время, передача генов могла происходить только от родительских клеток к дочерним. Гриффит выдвинул другую теорию, заявив, что перенос генов, происходящий у представителей одного поколения, известен как горизонтальный перенос генов (HGT). Это явление теперь называется генетической трансформацией. [22]
Эксперимент Гриффита касался бактерий пневмококка, у которых было два разных штамма: один вирулентный и гладкий, а другой авирулентный и шероховатый. Гладкий штамм имел блестящий внешний вид благодаря наличию особого типа полисахарида – капсулы полимера глюкозы и глюкуроновой кислоты. Из-за этого полисахаридного слоя бактерий иммунная система хозяина не может распознать бактерии и убивает хозяина. Другой, авирулентный, шероховатый штамм лишен этой полисахаридной капсулы и имеет тусклый, шероховатый вид. [ нужна ссылка ]
Известно, что наличие или отсутствие капсулы у штамма генетически детерминировано. Гладкие и шероховатые деформации встречаются в нескольких различных типах, таких как SI, S-II, S-III и т. д. и RI, R-II, R-III и т. д. соответственно. Все эти подтипы бактерий S и R отличаются друг от друга типом продуцируемого ими антигена. [6]
Эксперимент Эйвери-Маклауда-Маккарти
[ редактировать ]Эксперимент Эйвери-Маклауда-Маккарти стал знаковым исследованием, проведенным в 1944 году и продемонстрировавшим, что ДНК, а не белок, как считалось ранее, несет генетическую информацию у бактерий. Освальд Эйвери , Колин Манро Маклауд и Маклин Маккарти использовали экстракт штамма пневмококка , который мог вызвать пневмонию у мышей. Они показали, что генетическую трансформацию бактерий можно осуществить, вводя им очищенную ДНК из экстракта. Они обнаружили, что когда переваривалась ДНК в экстракте ДНКазой , трансформация безвредных бактерий в вирулентные терялась. Это предоставило убедительные доказательства того, что ДНК является генетическим материалом, бросив вызов преобладающему мнению о том, что за это ответственны белки. Это заложило основу для последующего открытия его структуры Уотсоном и Криком.
Эксперимент Херши-Чейза
[ редактировать ]
Подтверждение того, что ДНК является генетическим материалом, вызывающим инфекцию, было получено в эксперименте Херши-Чейза . они использовали кишечную палочку Для эксперимента и бактериофаг. Этот эксперимент также известен как эксперимент с блендером, поскольку кухонный блендер использовался в качестве основного прибора. Альфред Херши и Марта Чейз продемонстрировали, что ДНК, введенная фаговой частицей в бактерию, содержит всю информацию, необходимую для синтеза фаговых частиц-потомков. Они использовали радиоактивность, чтобы пометить белковую оболочку бактериофага радиоактивной серой и ДНК радиоактивным фосфором в двух разных пробирках соответственно. После смешивания бактериофага и E.coli в пробирке начинается инкубационный период, в течение которого фаг трансформирует генетический материал в клетках E.coli . Затем смесь смешивают или взбалтывают, что отделяет фаг от клеток E.coli . Всю смесь центрифугировали, осадок, содержащий клетки E.coli , проверяли и супернатант отбрасывали. палочка кишечная в клетках был обнаружен радиоактивный фосфор, что указывало на то, что трансформированный материал представлял собой ДНК, а не белковую оболочку.
Трансформированная ДНК прикрепляется к ДНК E.coli , и радиоактивность наблюдается только на ДНК бактериофага. Эта мутировавшая ДНК может быть передана следующему поколению, и появилась теория трансдукции. Трансдукция — это процесс, при котором бактериальная ДНК переносит фрагмент бактериофага и передает его следующему поколению. Это также тип горизонтального переноса генов. [6]
Эксперимент Мезельсона – Сталя
[ редактировать ]
Эксперимент Мезельсона-Шталя стал знаковым экспериментом в молекулярной биологии, который предоставил доказательства полуконсервативной репликации ДНК. Проведенный в 1958 году Мэтью Мезельсоном и Франклином Сталем эксперимент включал выращивание бактерий E. coli в среде, содержащей тяжелый изотоп азота ( 15 Н) на протяжении нескольких поколений. Это привело к тому, что вся вновь синтезированная бактериальная ДНК оказалась включенной в состав тяжелого изотопа.
После предоставления бактериям возможности размножаться в среде, содержащей нормальный азот ( 14 N) пробы были взяты в различные моменты времени. Затем эти образцы подвергали центрифугированию в градиенте плотности, в результате чего молекулы ДНК разделялись в зависимости от их плотности.
Результаты показали, что после одного поколения репликации в 14 N, ДНК образовывала полосу промежуточной плотности между плотностью чистой 15 N ДНК и чистый 14 Н ДНК. Это поддержало полуконсервативную репликацию ДНК, предложенную Уотсоном и Криком, где каждая цепь родительской молекулы ДНК служит матрицей для синтеза новой комплементарной цепи, в результате чего образуются две дочерние молекулы ДНК, каждая из которых состоит из одной родительской и одной вновь синтезированной цепи. .
Эксперимент Мезельсона-Сталя предоставил убедительные доказательства полуконсервативной репликации ДНК, которая имеет фундаментальное значение для понимания генетики и молекулярной биологии.
Современная молекулярная биология
[ редактировать ]В начале 2020-х годов молекулярная биология вступила в золотой век, определяемый как вертикальным, так и горизонтальным техническим развитием. В вертикальном плане новые технологии позволяют в режиме реального времени отслеживать биологические процессы на атомном уровне. [23] Молекулярные биологи сегодня имеют доступ к все более доступным данным секвенирования на все более глубоких глубинах, что облегчает разработку новых методов генетических манипуляций с новыми немодельными организмами. Аналогичным образом, специалисты по синтетической молекулярной биологии будут стимулировать промышленное производство малых и макромолекул путем введения экзогенных метаболических путей в различные линии прокариотических и эукариотических клеток. [24]
Горизонтально данные секвенирования становятся все более доступными и используются во многих различных научных областях. Это будет способствовать развитию промышленности в развивающихся странах и увеличит доступность для отдельных исследователей. Аналогичным образом, эксперименты по редактированию генов CRISPR-Cas9 теперь могут быть задуманы и реализованы отдельными лицами менее чем за 10 000 долларов США на новых организмах, что будет способствовать развитию промышленных и медицинских приложений. [25]
Связь с другими биологическими науками
[ редактировать ]
В следующем списке описывается точка зрения на междисциплинарные отношения между молекулярной биологией и другими смежными областями. [26]
- Молекулярная биология — это изучение молекулярных основ биологических явлений с упором на молекулярный синтез, модификацию, механизмы и взаимодействия.
- Биохимия — наука о химических веществах и процессах жизнедеятельности, происходящих в живых организмах . Биохимики уделяют большое внимание роли, функциям и структуре биомолекул, таких как белки , липиды , углеводы и нуклеиновые кислоты . [27]
- Генетика – это наука о том, как генетические различия влияют на организмы. Генетика пытается предсказать, как мутации , отдельные гены и генетические взаимодействия могут повлиять на выражение фенотипа . [28]
Хотя исследователи практикуют методы, специфичные для молекулярной биологии, обычно они комбинируются с методами генетики и биохимии . Большая часть молекулярной биологии носит количественный характер, и в последнее время значительный объем работы был выполнен с использованием таких методов информатики, как биоинформатика и вычислительная биология . Молекулярная генетика , изучение структуры и функции генов, была одной из наиболее известных областей молекулярной биологии с начала 2000-х годов. Другие разделы биологии получают информацию от молекулярной биологии, либо напрямую изучая взаимодействия молекул сами по себе, например, в клеточной биологии и биологии развития , либо косвенно, когда молекулярные методы используются для вывода об исторических атрибутах популяций или видов , как в области эволюционной биологии, такие как популяционная генетика и филогенетика . также существует давняя традиция изучения биомолекул «с нуля», или молекулярно В биофизике . [29]
Методы молекулярной биологии
[ редактировать ]
Молекулярное клонирование
[ редактировать ]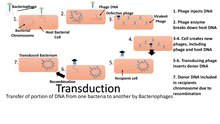
Молекулярное клонирование используется для выделения и последующего переноса интересующей последовательности ДНК в плазмидный вектор. [30] Эта технология рекомбинантной ДНК была впервые разработана в 1960-х годах. [31] В этом методе последовательность ДНК , кодирующая интересующий белок, клонируется с помощью полимеразной цепной реакции (ПЦР) и/или ферментов рестрикции в плазмиду ( вектор экспрессии ). Плазмидный вектор обычно имеет как минимум три отличительные особенности: начало репликации, сайт множественного клонирования (MCS) и селективный маркер (обычно устойчивость к антибиотикам ). Кроме того, выше MCS находятся области промотора и сайт начала транскрипции , которые регулируют экспрессию клонированного гена.
Эту плазмиду можно вставлять как в бактериальные, так и в животные клетки. Введение ДНК в бактериальные клетки может быть осуществлено путем трансформации путем поглощения голой ДНК, конъюгации посредством межклеточного контакта или трансдукции с помощью вирусного вектора. Введение ДНК в эукариотические клетки, например клетки животных, физическими или химическими средствами называется трансфекцией . Доступно несколько различных методов трансфекции, таких как трансфекция фосфатом кальция, электропорация , микроинъекция и трансфекция липосом . Плазмида может быть интегрирована в геном , что приводит к стабильной трансфекции, или может оставаться независимой от генома и временно экспрессироваться, что называется временной трансфекцией. [32] [33]
ДНК, кодирующая интересующий белок, теперь находится внутри клетки, и теперь этот белок можно экспрессировать. Доступны различные системы, такие как индуцибельные промоторы и специфические клеточные сигнальные факторы, которые помогают экспрессировать интересующий белок на высоких уровнях. Затем из бактериальной или эукариотической клетки можно экстрагировать большие количества белка. Белок можно проверить на ферментативную активность в различных ситуациях, белок можно кристаллизовать для изучения его третичной структуры или, в фармацевтической промышленности, можно изучить активность новых лекарств против белка. [34]
Полимеразная цепная реакция
[ редактировать ]Полимеразная цепная реакция (ПЦР) — чрезвычайно универсальный метод копирования ДНК. определенную последовательность ДНК Короче говоря, ПЦР позволяет копировать или модифицировать заранее определенным образом. Реакция чрезвычайно мощная и в идеальных условиях может амплифицировать одну молекулу ДНК до 1,07 миллиарда молекул менее чем за два часа. ПЦР имеет множество применений, включая изучение экспрессии генов, обнаружение патогенных микроорганизмов, обнаружение генетических мутаций и введение мутаций в ДНК. [35] Метод ПЦР можно использовать для введения сайтов рестриктаз на концы молекул ДНК или для мутации определенных оснований ДНК; последний метод называется сайт-направленным мутагенезом . ПЦР также можно использовать для определения того, обнаружен ли конкретный фрагмент ДНК в библиотеке кДНК . ПЦР имеет множество разновидностей, таких как ПЦР с обратной транскрипцией ( ОТ-ПЦР ) для амплификации РНК и, в последнее время, количественная ПЦР , которая позволяет количественно измерять молекулы ДНК или РНК. [36] [37]

Гель-электрофорез
[ редактировать ]
Гель-электрофорез — это метод разделения молекул по размеру с использованием агарозного или полиакриламидного геля. [38] Этот метод является одним из основных инструментов молекулярной биологии. Основной принцип заключается в том, что фрагменты ДНК можно разделить, пропуская через гель электрический ток: поскольку основная цепь ДНК содержит отрицательно заряженные фосфатные группы, ДНК будет мигрировать через агарозный гель в направлении положительного конца тока. [38] Белки также можно разделить по размеру с помощью геля SDS-PAGE или по размеру и их электрическому заряду с помощью так называемого 2D-гель-электрофореза . [39]

Белковый анализ Брэдфорда
[ редактировать ]Анализ Брэдфорда — это метод молекулярной биологии, который позволяет быстро и точно определить количество белковых молекул, используя уникальные свойства красителя Coomassie Brilliant Blue G-250. [40] Кумасси синий претерпевает видимый сдвиг цвета от красновато-коричневого до ярко-синего при связывании с белком. [40] В нестабильном катионном состоянии кумасси синий имеет фоновую длину волны 465 нм и имеет красновато-коричневый цвет. [41] Когда кумасси синий связывается с белком в кислом растворе, длина волны фона смещается до 595 нм, и краситель приобретает ярко-синий цвет. [41] Белки, участвующие в анализе, связываются с кумасси синим примерно за 2 минуты, а комплекс белок-краситель стабилен в течение примерно часа, хотя рекомендуется измерять поглощение в течение 5–20 минут после начала реакции. [40] Концентрацию белка в анализе Брэдфорда можно затем измерить с помощью спектрофотометра видимого света , поэтому для этого не требуется обширное оборудование. [41]
Этот метод был разработан в 1975 году Мэрион М. Брэдфорд и позволил значительно быстрее и точнее проводить количественный анализ белка по сравнению с предыдущими методами: процедурой Лоури и биуретовым анализом. [40] В отличие от предыдущих методов, анализ Брэдфорда не подвержен влиянию нескольких небелковых молекул, включая этанол, хлорид натрия и хлорид магния. [40] Однако он подвержен влиянию сильных щелочных буферных агентов, таких как додецилсульфат натрия (SDS). [40]
Блоттинг и зондирование макромолекул
[ редактировать ]Термины нозерн- , вестерн- и восточный блоттинг произошли от того, что первоначально было шуткой молекулярной биологии, которая разыграла термин Саузерн-блоттинг после метода, описанного Эдвином Саузерн для гибридизации блоттинга ДНК. Патрисия Томас, разработчик РНК-блоттинга, который затем стал известен как нозерн-блоттинг , на самом деле не использовала этот термин. [42]
Саузерн-блоттинг
[ редактировать ]Названный в честь своего изобретателя, биолога Эдвина Саузерна , Саузерн-блоттинг представляет собой метод исследования наличия определенной последовательности ДНК в образце ДНК. Образцы ДНК до или после расщепления ферментом рестрикции (рестрикционной эндонуклеазой) разделяются с помощью гель-электрофореза, а затем переносятся на мембрану путем блоттинга посредством капиллярного действия . Затем мембрану подвергают воздействию меченого ДНК-зонда, который имеет последовательность оснований, комплементарную последовательности интересующей ДНК. [43] Саузерн-блоттинг реже используется в лабораторных исследованиях из-за способности других методов, таких как ПЦР , обнаруживать определенные последовательности ДНК в образцах ДНК. Однако эти блоты все еще используются для некоторых приложений, таких как измерение количества копий трансгена у трансгенных мышей или при конструировании с нокаутом генов линий эмбриональных стволовых клеток . [29]
Нозерн-блоттинг
[ редактировать ]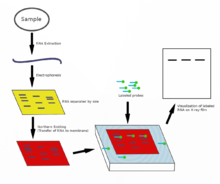
Нозерн-блоттинг используется для изучения присутствия специфических молекул РНК в качестве относительного сравнения между набором различных образцов РНК. По сути, это комбинация денатурирующего гель-электрофореза РНК и блоттинга . В этом процессе РНК разделяется по размеру, а затем переносится на мембрану, которая затем исследуется меченым комплементом интересующей последовательности. Результаты можно визуализировать различными способами в зависимости от используемой метки; однако большинство из них приводит к обнаружению полос, отражающих размеры РНК, обнаруженной в образце. Интенсивность этих полос связана с количеством целевой РНК в анализируемых образцах. Эта процедура обычно используется для изучения того, когда и в каком объеме происходит экспрессия генов, путем измерения того, сколько этой РНК присутствует в различных образцах, при условии, что посттранскрипционная регуляция не происходит и что уровни мРНК отражают пропорциональные уровни соответствующего белка, находящегося в организме. произведено. Это один из основных инструментов для определения того, в какое время и при каких условиях определенные гены экспрессируются в живых тканях. [44] [45]
Вестерн-блоттинг
[ редактировать ]Вестерн-блоттинг — это метод, с помощью которого можно обнаружить определенные белки из смеси белков. [46] Вестерн-блоттинг можно использовать для определения размера выделенных белков, а также для количественной оценки их экспрессии. [47] При вестерн-блоттинге белки сначала разделяются по размеру в тонком геле, зажатом между двумя стеклянными пластинами, с помощью метода, известного как SDS-PAGE . Белки в геле затем переносятся на поливинилиденфторид (ПВДФ), нитроцеллюлозу, нейлон или другую опорную мембрану. Эту мембрану затем можно исследовать растворами антител . Антитела, которые специфически связываются с интересующим белком, затем можно визуализировать с помощью различных методов, включая цветные продукты, хемилюминесценцию или авторадиографию . Часто антитела метят ферментами. Когда хемилюминесцентный субстрат подвергается воздействию фермента, это позволяет его обнаружить. Использование методов вестерн-блоттинга позволяет не только обнаруживать, но и проводить количественный анализ. Методы, аналогичные вестерн-блоттингу, можно использовать для прямого окрашивания специфических белков в живых клетках или тканей . срезах [46] [48]
Восточный блоттинг
[ редактировать ]Метод восточного блоттинга используется для обнаружения посттрансляционной модификации белков. Белки, нанесенные на мембрану из ПВДФ или нитроцеллюлозы, исследуются на наличие модификаций с использованием определенных субстратов. [49]
Микрочипы
[ редактировать ]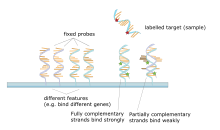
Микрочип ДНК представляет собой совокупность пятен, прикрепленных к твердой основе, такой как предметное стекло микроскопа , где каждое пятно содержит один или несколько фрагментов одноцепочечных олигонуклеотидов ДНК . Массивы позволяют наносить большое количество очень маленьких (диаметром 100 микрометров) пятен на одно предметное стекло. Каждое пятно содержит молекулу фрагмента ДНК, комплементарную одной последовательности ДНК . Вариант этого метода позволяет оценить экспрессию генов организма на определенной стадии развития ( профилирование экспрессии ). В этом методе РНК в ткани выделяется и преобразуется в меченую комплементарную ДНК (кДНК). Затем эта кДНК гибридизуется с фрагментами матрицы, и можно провести визуализацию гибридизации. Поскольку можно создать несколько массивов с одинаковым положением фрагментов, они особенно полезны для сравнения экспрессии генов в двух разных тканях, таких как здоровая и раковая ткань. Кроме того, можно измерить, какие гены экспрессируются и как эта экспрессия меняется со временем или под воздействием других факторов.Существует много разных способов изготовления микрочипов; наиболее распространенными являются кремниевые чипы, предметные стекла с пятнами диаметром около 100 микрометров, индивидуальные матрицы и матрицы с более крупными пятнами на пористых мембранах (макрочипы). В одном массиве может быть от 100 до более 10 000 мест. Массивы также можно создавать с использованием других молекул, помимо ДНК. [50] [51] [52] [53]
Аллель-специфический олигонуклеотид
[ редактировать ]Аллель-специфический олигонуклеотид (АСО) — это метод, который позволяет обнаруживать мутации одного основания без необходимости ПЦР или гель-электрофореза. Короткие (длиной 20–25 нуклеотидов) меченые зонды подвергаются воздействию нефрагментированной целевой ДНК, гибридизация происходит с высокой специфичностью из-за короткой длины зондов, и даже изменение одного основания будет препятствовать гибридизации. Затем целевую ДНК промывают и удаляют меченые зонды, которые не гибридизовались. Затем целевую ДНК анализируют на наличие зонда с помощью радиоактивности или флуоресценции. В этом эксперименте, как и в большинстве методов молекулярной биологии, необходимо использовать контроль, чтобы обеспечить успешное экспериментирование. [54] [55]
В молекулярной биологии процедуры и технологии постоянно развиваются, а старые технологии отказываются от них. Например, до появления гель-электрофореза ДНК ( агарозы или полиакриламида ) размер молекул ДНК обычно определялся по скорости седиментации в градиентах сахарозы - медленный и трудоемкий метод, требующий дорогостоящего оборудования; до градиентов сахарозы вискозиметрию использовали . Помимо исторического интереса, часто стоит знать и о старых технологиях, поскольку иногда бывает полезно решить другую новую проблему, для которой новая техника непригодна. [56]
См. также
[ редактировать ]- Астробиология
- Центральная догма молекулярной биологии
- Генетический код
- Анализатор Geniom RT , прибор для диагностического тестирования
- Геном
- Институты молекулярной биологии
- Молекулярная инженерия
- Молекулярное моделирование
- Прогнозирование взаимодействия белков
- Прогнозирование структуры белка
- Протеом
- Клеточная биология
Ссылки
[ редактировать ]- ^ Альбертс Б., Джонсон А., Льюис Дж., Морган Д., Рафф М., Робертс К., Уолтер П. (2014). Молекулярная биология клетки, шестое издание . Гирляндная наука. стр. 1–10. ISBN 978-1-317-56375-4 .
- ^ Гэннон Ф (февраль 2002 г.). «Молекулярная биология — что в названии?» . Отчеты ЭМБО . 3 (2): 101. doi : 10.1093/embo-reports/kvf039 . ПМЦ 1083977 . ПМИД 11839687 .
- ^ «Молекулярная биология – Последние исследования и новости | Природа» . Nature.com . Проверено 7 ноября 2021 г.
- ^ Эстбери, WT (июнь 1961 г.). «Молекулярная биология или ультраструктурная биология?» . Природа . 190 (4781): 1124. Бибкод : 1961Natur.190.1124A . дои : 10.1038/1901124a0 . ISSN 1476-4687 . ПМИД 13684868 . S2CID 4172248 .
- ^ Перейти обратно: а б «Розалинда Франклин: решающий вклад» . Nature.com .
- ^ Перейти обратно: а б с д Верма, PS (2004). Клеточная биология, генетика, молекулярная биология, эволюция и экология . С. Чанд и компания. ISBN 81-219-2442-1 . OCLC 1045495545 . [ нужна страница ]
- ^ Моранж, Мишель (2016). «История молекулярной биологии». Энциклопедия наук о жизни . стр. 1–8. дои : 10.1002/9780470015902.a0003079.pub3 . ISBN 978-0-470-01617-6 .
- ^ Белло, Элизабет А.; Швинн, Дебра А. (1 декабря 1996 г.). «Молекулярная биология и медицина: учебник для клинициста» . Анестезиология . 85 (6): 1462–1478. дои : 10.1097/00000542-199612000-00029 . ISSN 0003-3022 . ПМИД 8968195 . S2CID 29581630 .
- ^ Моранж, Мишель (июнь 2021 г.). История биологии . Издательство Принстонского университета. ISBN 978-0-691-18878-2 . OCLC 1184123419 . [ нужна страница ]
- ^ Филдс, Стэнли (28 августа 2001 г.). «Взаимодействие биологии и технологии» . Труды Национальной академии наук . 98 (18): 10051–10054. дои : 10.1073/pnas.191380098 . ISSN 0027-8424 . ПМК 56913 . ПМИД 11517346 .
- ^ Эллис, Т. Х. Ноэль; Хофер, Джули М.И.; Тиммерман-Вон, Гейл М.; Койн, Кларис Дж.; Хелленс, Роджер П. (ноябрь 2011 г.). «Мендель, 150 лет спустя». Тенденции в науке о растениях . 16 (11): 590–596. Бибкод : 2011TPS....16..590E . doi : 10.1016/j.tplants.2011.06.006 . ПМИД 21775188 .
- ^ «12.3C: Закон сегрегации Менделя» . Свободные тексты по биологии . 12 июля 2018 г. Проверено 18 ноября 2021 г.
- ^ «Менделевское наследование» . Genome.gov . Проверено 18 ноября 2021 г.
- ^ Перейти обратно: а б Молись, Л (2008). «Открытие структуры и функции ДНК: Уотсон и Крик» . Природное образование . 1 (1):100 . Проверено 21 июня 2024 г.
- ^ Джордж., Вольф (2003). Фридрих Мишер: человек, открывший ДНК . OCLC 907773747 . [ нужна страница ]
- ^ Левен, Пенсильвания (1919). «Строение нуклеиновой кислоты дрожжей» . Журнал биологической химии . 43 (2): 379–382. дои : 10.1016/s0021-9258(18)86289-5 . ISSN 0021-9258 .
- ^ Чаргафф, Эрвин (июнь 1950 г.). «Химическая специфичность нуклеиновых кислот и механизм их ферментативной деградации». Эксперименты . 6 (6): 201–209. дои : 10.1007/bf02173653 . ПМИД 15421335 . S2CID 2522535 .
- ^ Перейти обратно: а б Уотсон, доктор медицинских наук ; Крик, FHC (апрель 1953 г.). «Молекулярная структура нуклеиновых кислот: структура нуклеиновой кислоты дезоксирибозы» . Природа . 171 (4356): 737–738. Бибкод : 1953Natur.171..737W . дои : 10.1038/171737a0 . ISSN 1476-4687 . ПМИД 13054692 . S2CID 4253007 .
- ^ Крик, ФХК; Барнетт, Лесли; Бреннер, С.; Уоттс-Тобин, Р.Дж. (1961). «Общая природа генетического кода белков». Природа . 192 (4809). ООО «Спрингер Сайенс энд Бизнес Медиа»: 1227–1232. Бибкод : 1961Natur.192.1227C . дои : 10.1038/1921227a0 . ISSN 0028-0836 . ПМИД 13882203 . S2CID 4276146 .
- ^ Эпштейн, Р.Х.; Болле, А.; Стейнберг, CM; Келленбергер, Э.; Бой де ла Тур, Э.; и др. (1 января 1963 г.). «Физиологические исследования условно-летальных мутантов бактериофага T4D». Симпозиумы Колд-Спринг-Харбор по количественной биологии . 28 . Лаборатория Колд-Спринг-Харбор: 375–394. дои : 10.1101/sqb.1963.028.01.053 . ISSN 0091-7451 .
- ^ Эдгар, Боб (1 октября 2004 г.). «Геном бактериофага Т4» . Генетика . 168 (2): 575–582. дои : 10.1093/генетика/168.2.575 . ISSN 1943-2631 . ПМЦ 1448817 . ПМИД 15514035 .
- ^ Рэйвенхолл, Мэтт; Шкунка, Нивес; Лассаль, Флоран; Дессимо, Кристоф (май 2015 г.). «Вывод о горизонтальном переносе генов» . PLOS Вычислительная биология . 11 (5): e1004095. Бибкод : 2015PLSCB..11E4095R . дои : 10.1371/journal.pcbi.1004095 . ПМЦ 4462595 . ПМИД 26020646 .
- ^ Моджири, Сохейл; Исбанер, Себастьян; Мюле, Штеффен; Чан, Хончже; Бэ, Альберт Иоганн; Грегор, Инго; Голами, Азам; Голами, Азам; Эндерляйн, Йорг (01 июня 2021 г.). «Быстрая многоплоскостная фазово-контрастная микроскопия выявляет крутильную динамику при движении жгутиков» . Биомедицинская оптика Экспресс . 12 (6): 3169–3180. дои : 10.1364/BOE.419099 . ISSN 2156-7085 . ПМК 8221972 . ПМИД 34221652 .
- ^ ван Вармердам, Т. «Ресурсы лаборатории молекулярной биологии» . Вашбиохелпер.com .
- ^ ван Вармердам, Т. «Ресурсы лаборатории молекулярной биологии» . Вашбиохелпер.com .
- ^ Лодиш Х., Берк А., Зипурски С.Л., Мацудайра П., Балтимор Д., Дарнелл Дж. (2000). Молекулярно-клеточная биология (4-е изд.). Нью-Йорк: Книги Scientific American. ISBN 978-0-7167-3136-8 .
- ^ Берг, Джереми (2002). Биохимия . Тимочко, Джон Л.; Страйер, Люберт (5-е изд.). Нью-Йорк: WH Freeman. ISBN 0-7167-3051-0 . OCLC 48055706 .
- ^ Справочник, Дом генетики. «Помогите мне понять генетику» . Домашний справочник по генетике . Проверено 31 декабря 2016 г.
- ^ Перейти обратно: а б Тянь Дж, изд. (2013). Молекулярная визуализация: основы и приложения . Springer-Verlag Berlin & Heidelberg GmbH & Co. K. p. 542. ИСБН 9783642343032 . Проверено 8 июля 2019 г.
- ^ «Основы молекулярного клонирования – прошлое, настоящее и будущее | NEB» . www.neb.com . Проверено 25 ноября 2021 г.
- ^ «Основы молекулярного клонирования – прошлое, настоящее и будущее | NEB» . www.neb.com . Проверено 4 ноября 2021 г.
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. Выделение, клонирование и секвенирование ДНК . Проверено 31 декабря 2016 г.
- ^ Лессард, Джулиана К. (1 января 2013 г.). «Молекулярное клонирование». Лабораторные методы в энзимологии: ДНК . Том. 529. стр. 85–98. дои : 10.1016/B978-0-12-418687-3.00007-0 . ISBN 978-0-12-418687-3 . ISSN 1557-7988 . ПМИД 24011038 .
- ^ Кокате С., Джалалпур СС, Хуракадле П.Дж. (2016). Учебник фармацевтической биотехнологии . Клонирование выражений. Эльзевир. п. 125. ИСБН 9788131239872 . Проверено 8 июля 2019 г.
- ^ Ленстра, Дж. А. (июль 1995 г.). «Применение полимеразной цепной реакции в науках о жизни» . Клеточная и молекулярная биология (Нуази-Ле-Гран, Франция) . 41 (5): 603–614. ISSN 0145-5680 . ПМИД 7580841 .
- ^ «Полимеразная цепная реакция (ПЦР)» . Национальный центр биотехнологической информации . Национальная медицинская библиотека США . Проверено 31 декабря 2016 г.
- ^ «Информационный бюллетень о полимеразной цепной реакции (ПЦР)» . Национальный институт исследования генома человека (NHGRI) . Проверено 31 декабря 2016 г.
- ^ Перейти обратно: а б Ли, Пей Юн; Костумбрадо, Джон; Сюй, Чжи-Юань; Ким, Ён Хун (20 апреля 2012 г.). «Электрофорез в агарозном геле для разделения фрагментов ДНК» . Журнал визуализированных экспериментов (62): 3923. doi : 10.3791/3923 . ISSN 1940-087X . ПМЦ 4846332 . ПМИД 22546956 .
- ^ Ли П.Ю., Костумбрадо Дж., Сюй С.И., Ким Ю.Х. (апрель 2012 г.). «Электрофорез в агарозном геле для разделения фрагментов ДНК» . Журнал визуализированных экспериментов (62). дои : 10.3791/3923 . ПМЦ 4846332 . ПМИД 22546956 .
- ^ Перейти обратно: а б с д и ж Брэдфорд, Мэрион М. (май 1976 г.). «Быстрый и чувствительный метод количественного определения микрограммов белка, использующий принцип связывания белка с красителем». Аналитическая биохимия . 72 (1–2): 248–254. дои : 10.1016/0003-2697(76)90527-3 . ПМИД 942051 . S2CID 4359292 .
- ^ Перейти обратно: а б с «Определение белка по методу Брэдфорда» . www.ruf.rice.edu . Проверено 8 ноября 2021 г.
- ^ Томас П.С. (сентябрь 1980 г.). «Гибридизация денатурированной РНК и небольших фрагментов ДНК, перенесенных на нитроцеллюлозу» . Труды Национальной академии наук Соединенных Штатов Америки . 77 (9): 5201–5. Бибкод : 1980PNAS...77.5201T . дои : 10.1073/pnas.77.9.5201 . ПМК 350025 . ПМИД 6159641 .
- ^ Браун, Терри (1993). «Южный блоттинг». Современные протоколы в иммунологии . 6 : Блок 10.6А. дои : 10.1002/0471142735.im1006as06 . ПМИД 18432697 .
- ^ Йозефсен, Кнуд; Нильсен, Хенрик (2011). «Нозерн-блоттинг-анализ». РНК . Методы молекулярной биологии. Том. 703. С. 87–105. дои : 10.1007/978-1-59745-248-9_7 . ISBN 978-1-58829-913-0 . ПМИД 21125485 .
- ^ Он С.Л., Грин Р. (1 января 2013 г.). «Нозерн-блоттинг». Лабораторные методы в энзимологии: РНК . Том. 530. стр. 75–87. дои : 10.1016/B978-0-12-420037-1.00003-8 . ISBN 978-0-12-420037-1 . ПМК 4287216 . ПМИД 24034315 .
- ^ Перейти обратно: а б Махмуд Т., Ян ПК (сентябрь 2012 г.). «Вестерн-блоттинг: техника, теория и устранение неполадок» . Североамериканский журнал медицинских наук . 4 (9): 429–34. дои : 10.4103/1947-2714.100998 . ПМЦ 3456489 . ПМИД 23050259 .
- ^ «Вестерн-блоттинг | Изучайте науку в Scitable» . www.nature.com . Проверено 25 ноября 2021 г.
- ^ Куриен Б.Т., Скофилд Р.Х. (апрель 2006 г.). «Вестерн-блоттинг». Методы . 38 (4): 283–93. дои : 10.1016/j.ymeth.2005.11.007 . ПМИД 16483794 .
- ^ Томас С., Тирумалапура Н., Кроссли Э.К., Исмаил Н., Уокер Д.Х. (июнь 2009 г.). «Модификации антигенных белков при эрлихиях» . Иммунология паразитов . 31 (6): 296–303. дои : 10.1111/j.1365-3024.2009.01099.x . ПМЦ 2731653 . ПМИД 19493209 .
- ^ «Микроматрицы» . Национальный центр биотехнологической информации . Национальная медицинская библиотека США . Проверено 31 декабря 2016 г.
- ^ Бамгарнер, Роджер (2013). «Обзор ДНК-микрочипов: типы, применение и их будущее» . Современные протоколы молекулярной биологии . 101 : Блок 22.1. дои : 10.1002/0471142727.mb2201s101 . ПМК 4011503 . ПМИД 23288464 .
- ^ Говиндараджан Р., Дурайян Дж., Калияппан К., Паланисами М. (август 2012 г.). «Микрочип и его применение» . Журнал фармации и биологических наук . 4 (Приложение 2): S310-2. дои : 10.4103/0975-7406.100283 . ПМЦ 3467903 . ПМИД 23066278 .
- ^ Тарка А.Л., Ромеро Р., Драгичи С. (август 2006 г.). «Анализ экспериментов на микрочипах по профилированию экспрессии генов» . Американский журнал акушерства и гинекологии . 195 (2): 373–88. дои : 10.1016/j.ajog.2006.07.001 . ПМЦ 2435252 . ПМИД 16890548 .
- ^ Ченг Л., Чжан Д.И., ред. (2008). Молекулярно-генетическая патология . Тотова, Нью-Джерси: Хумана. п. 96. ИСБН 978-1-59745-405-6 . Проверено 31 декабря 2016 г.
- ^ Леонард Д.Г. (2016). Молекулярная патология в клинической практике . Спрингер. п. 31. ISBN 978-3-319-19674-9 . Проверено 31 декабря 2016 г.
- ^ Тянь Дж, изд. (2013). Молекулярная визуализация: основы и приложения . Springer-Verlag Berlin & Heidelberg GmbH & Co.K. стр. 550, 552. ISBN. 9783642343032 . Проверено 8 июля 2019 г.
Дальнейшее чтение
[ редактировать ]- Коэн С.Н., Чанг А.С., Бойер Х.В., Хеллинг Р.Б. (ноябрь 1973 г.). «Конструирование биологически функциональных бактериальных плазмид in vitro» . Труды Национальной академии наук Соединенных Штатов Америки . 70 (11): 3240–4. Бибкод : 1973PNAS...70.3240C . дои : 10.1073/pnas.70.11.3240 . ПМК 427208 . ПМИД 4594039 .
- Роджерс М. (июнь 1975 г.). «Конгресс ящика Пандоры». Роллинг Стоун . Том. 189. стр. 37–77.
- Робертс К., Рафф М., Альбертс Б., Уолтер П., Льюис Дж., Джонсон А. (2002). Молекулярная биология клетки . Гирляндная наука. ISBN 978-0-8153-3218-3 .
Внешние ссылки
[ редактировать ] СМИ, связанные с молекулярной биологией, на Викискладе?
СМИ, связанные с молекулярной биологией, на Викискладе? - Биохимия и молекулярная биология в Керли
