Суперантиген



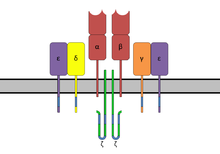
Суперантигены ( SAgs ) представляют собой класс антигенов , которые приводят к чрезмерной активации иммунной системы . В частности, они вызывают неспецифическую активацию Т-клеток , что приводит к поликлональной активации Т-клеток и массивному высвобождению цитокинов . Суперантигены действуют путем связывания с белками MHC на антигенпрезентирующих клетках (APC) и с TCR на соседних с ними хелперных Т-клетках, объединяя сигнальные молекулы и, таким образом, приводя к активации Т-клеток независимо от пептида. отображается на молекуле MHC. [ 1 ] САг вырабатываются некоторыми патогенными вирусами и бактериями, скорее всего, в качестве защитного механизма против иммунной системы. [ 2 ] По сравнению с обычным антиген -индуцированным Т-клеточным ответом, при котором активируются 0,0001–0,001% Т-клеток организма, эти САг способны активировать до 20% Т-клеток организма. [ 3 ] Более того, против CD3 и против CD28 антитела ( CD28-SuperMAB ) также оказались высокоэффективными суперантигенами (и могут активировать до 100% Т-клеток).
Большое количество активированных Т-клеток генерирует массивный иммунный ответ, который не является специфичным для какого-либо конкретного эпитопа SAg, тем самым подрывая одну из фундаментальных сильных сторон адаптивной иммунной системы , а именно ее способность нацеливаться на антигены с высокой специфичностью. Что еще более важно, большое количество активированных Т-клеток секретируют большое количество цитокинов , наиболее важным из которых является интерферон гамма . Это избыточное количество ИФН-гамма, в свою очередь, активирует макрофаги . Активированные макрофаги, в свою очередь, производят избыточное количество провоспалительных цитокинов, таких как IL-1 , IL-6 и TNF-альфа . TNF-альфа особенно важен как часть воспалительной реакции организма. В нормальных условиях он высвобождается локально в небольших количествах и помогает иммунной системе победить патогены. Однако, когда он системно высвобождается в кровь и в больших количествах (из-за массовой активации Т-клеток в результате связывания SAg), он может вызывать серьезные и опасные для жизни симптомы, включая септический шок и полиорганную недостаточность. .
Структура
[ редактировать ]САг продуцируются внутриклеточно бактериями и высвобождаются при инфекции в виде внеклеточных зрелых токсинов. [ 4 ]
Последовательности этих бактериальных токсинов относительно консервативны среди различных подгрупп. Что более важно, чем гомология последовательностей, 3D-структура очень схожа у разных SAg, что приводит к сходным функциональным эффектам в разных группах. [ 5 ] [ 6 ] Существует по крайней мере 5 групп суперантигенов с разными предпочтениями связывания. [ 7 ]
Кристаллические структуры энтеротоксинов показывают, что они представляют собой компактные эллипсоидные белки, имеющие характерную структуру двухдоменной складки , включающую NH2-концевой домен β-бочонка глобулярный , известный как складка олигосахарида / олигонуклеотида , длинную α-спираль , которая по диагонали охватывает центр молекула и СООН-концевой глобулярный домен. [ 5 ]
Домены имеют области связывания для главного комплекса гистосовместимости класса II ( MHC класс II ) и рецептора Т-клеток (TCR) соответственно. Соединяя эти два фактора вместе, SAg вызывает неспецифическую активацию. [ 8 ]
Связывание
[ редактировать ]Суперантигены сначала связываются с MHC класса II, а затем координируются с вариабельной альфа- или бета-цепью рецепторов Т-клеток (TCR). [ 6 ] [ 9 ] [ 10 ]
МХК Класс II
[ редактировать ]SAgs отдают предпочтение HLA-DQ . форме молекулы [ 10 ] Связывание с α-цепью помещает SAg в подходящее положение для координации с TCR.
Реже SAg прикрепляются к полиморфной β-цепи MHC класса II во взаимодействии, опосредованном координационным комплексом ионов цинка между тремя остатками SAg и высококонсервативной областью β-цепи HLA-DR . [ 6 ] Использование иона цинка при связывании приводит к более высокому сродству взаимодействия. [ 5 ] Некоторые стафилококковые SAg способны сшивать молекулы MHC путем связывания как с α-, так и с β-цепями. [ 5 ] [ 6 ] Этот механизм стимулирует экспрессию и высвобождение цитокинов в антигенпредставляющих клетках, а также индуцирует выработку костимулирующих молекул, которые позволяют клетке более эффективно связываться с Т-клетками и активировать их. [ 6 ]
Т-клеточный рецептор
[ редактировать ]Область связывания Т-клеток SAg взаимодействует с вариабельной областью бета-цепи (область Vβ) рецептора Т-клеток. Данный SAg может активировать большую часть популяции Т-клеток, поскольку репертуар Т-клеток человека включает только около 50 типов элементов Vβ, а некоторые SAg способны связываться с несколькими типами областей Vβ. Это взаимодействие незначительно различается среди разных групп SAg. [ 8 ] Вариабельность среди разных людей типов преобладающих регионов Т-клеток объясняет, почему некоторые люди более сильно реагируют на определенные САг. САг группы I связываются с Vβ в CDR2 и каркасной области молекулы. [ 11 ] [ 12 ] САг группы II взаимодействуют с областью Vβ по конформационно -зависимым механизмам. Эти взаимодействия по большей части не зависят от конкретных боковых цепей аминокислот Vβ. Было показано, что САг группы IV задействуют все три петли CDR определенных форм Vβ. [ 11 ] [ 12 ] Взаимодействие происходит в щели между малым и большим доменами SAg и позволяет SAg действовать как клин между TCR и MHC. Это вытесняет антигенный пептид из TCR и нарушает нормальный механизм активации Т-клеток. [ 6 ] [ 13 ]
Биологическая сила SAg (его способность стимулировать) определяется его сродством к TCR. SAgs с самым высоким сродством к TCR вызывают самый сильный ответ. [ 14 ] СПМЭЗ-2 — самый мощный из обнаруженных на сегодняшний день SAg. [ 14 ]
Передача сигналов Т-клеток
[ редактировать ]SAg перекрестно связывает MHC и TCR, индуцируя сигнальный путь, который приводит к пролиферации клеток и продукции цитокинов. Это происходит потому, что родственный антиген активирует Т-клетку не из-за своей структуры как таковой , а потому, что его аффинность позволяет ему связываться с TCR в течение достаточно длительного периода времени, и SAg имитирует это временное связывание. Низкие уровни Zap-70 были обнаружены в Т-клетках, активированных SAg, что указывает на нарушение нормального сигнального пути активации Т-клеток. [ 15 ]
Предполагается, что Fyn, а не Lck активирует тирозинкиназа , что приводит к адаптивной индукции анергии. [ 16 ]
Активируются как путь протеинкиназы C, так и пути протеинтирозинкиназы, что приводит к усилению выработки провоспалительных цитокинов. [ 17 ]
Этот альтернативный сигнальный путь слегка ослабляет пути кальция/кальциневрина и Ras/MAPкиназы. [ 16 ] но позволяет вызвать целенаправленную воспалительную реакцию.
Эффекты
[ редактировать ]Прямые эффекты
[ редактировать ]Стимуляция SAg антигенпрезентирующих клеток и Т-клеток вызывает преимущественно воспалительную реакцию, ориентированную на действие Th1 Т-хелперных клеток. Некоторыми из основных продуктов являются IL-1 , IL-2 , IL-6 , TNF-α , гамма-интерферон (IFN-γ), макрофагальный воспалительный белок 1α (MIP-1α), MIP-1β и моноцитарный хемоаттрактантный белок 1 ( МКП-1 ). [ 17 ]
Чрезмерное нескоординированное высвобождение цитокинов (особенно TNF-α) перегружает организм и приводит к сыпи, лихорадке и может привести к полиорганной недостаточности, коме и смерти. [ 10 ] [ 12 ]
Делеция или анергия активированных Т-клеток следует за инфекцией. Это является результатом выработки IL-4 и IL-10 в результате длительного воздействия токсина. IL-4 и IL-10 подавляют выработку IFN-гамма, MHC класса II и костимулирующих молекул на поверхности APC. Эти эффекты производят клетки памяти, которые не реагируют на стимуляцию антигеном. [ 18 ] [ 19 ]
Один из механизмов, благодаря которому это возможно, включает цитокин-опосредованное подавление Т-клеток. Сшивка MHC также активирует сигнальный путь, который подавляет гемопоэз и усиливает Fas-опосредованный апоптоз . [ 20 ]
IFN-α является еще одним продуктом длительного воздействия SAg. Этот цитокин тесно связан с индукцией аутоиммунитета. [ 21 ] а аутоиммунное заболевание, болезнь Кавасаки , как известно, вызывается SAg-инфекцией. [ 14 ]
Активация SAg в Т-клетках приводит к выработке лиганда CD40 , который активирует переключение изотипа в В-клетках на IgG , IgM и IgE . [ 22 ]
Подводя итог, можно сказать, что Т-клетки стимулируются и производят избыточное количество цитокинов, что приводит к опосредованному цитокинами подавлению Т-клеток и удалению активированных клеток по мере того, как организм возвращается к гомеостазу. Токсическое воздействие микроба и SAg также повреждает ткани и системы органов — состояние, известное как синдром токсического шока . [ 22 ]
Если первоначальное воспаление сохраняется, клетки-хозяева становятся анергичными или удаляются, что приводит к серьезному нарушению иммунной системы.
Независимые от суперантигенности (косвенные) эффекты
[ редактировать ]Помимо своей митогенной активности, САг способны вызывать симптомы, характерные для инфекции. [ 2 ]
Одним из таких эффектов является рвота . Этот эффект ощущается при пищевых отравлениях , когда бактерии, продуцирующие SAg, выделяют токсин, обладающий высокой устойчивостью к нагреванию. Существует отдельная область молекулы, которая активна в индукции желудочно-кишечной токсичности. [ 2 ] Эта активность также очень эффективна : даже небольшие количества 20-35 мкг SAg способны вызвать рвоту. [ 10 ]
САг способны стимулировать привлечение нейтрофилов к месту инфекции независимо от стимуляции Т-клеток. Этот эффект обусловлен способностью САг активировать моноцитарные клетки, стимулируя высвобождение цитокина TNF-α, что приводит к усилению экспрессии молекул адгезии, которые рекрутируют лейкоциты в инфицированные регионы. бактерии Это вызывает воспаление в легких, тканях кишечника и в любом месте, где колонизировались . [ 23 ] Хотя небольшое воспаление является естественным и полезным, чрезмерное воспаление может привести к разрушению тканей.
Одним из наиболее опасных косвенных эффектов инфекции SAg является способность SAg усиливать действие эндотоксинов в организме. Это достигается за счет снижения порога эндотоксичности. Шливерт продемонстрировал, что при совместном применении эффекты SAg и эндотоксина усиливаются в 50 000 раз. [ 9 ] Это может быть связано со снижением эффективности иммунной системы, вызванным инфекцией SAg. Помимо синергетического взаимодействия между эндотоксином и SAg, эффект «двойного удара» активности эндотоксина и SAg приводит к более вредным последствиям, чем те, которые наблюдаются при типичной бактериальной инфекции. Это также указывает на участие САг в прогрессировании сепсиса у пациентов с бактериальными инфекциями. [ 22 ]
Заболевания, связанные с продукцией суперантигена
[ редактировать ]- Сахарный диабет
- Экзема
- Каплевидный псориаз
- болезнь Кавасаки
- Носовые полипы [ 24 ]
- Ревматическая лихорадка
- Ревматоидный артрит
- Скарлатина [ 10 ]
- Синдром токсического шока
- Инфекционный эндокардит [ 25 ]
Уход
[ редактировать ]Основными целями медикаментозного лечения являются гемодинамическая стабилизация пациента и, если он присутствует, уничтожение микроба, продуцирующего САг. Это достигается за счет использования вазопрессоров , инфузионной терапии и антибиотиков . [ 2 ]
Организм естественным образом вырабатывает антитела к некоторым SAg, и этот эффект можно усилить, стимулируя В-клетками . выработку этих антител [ 26 ]
Пулы иммуноглобулинов способны нейтрализовать специфические антитела и предотвратить активацию Т-клеток. Были созданы синтетические антитела и пептиды, имитирующие SAg-связывающие области MHC класса II, блокирующие взаимодействие и предотвращающие активацию Т-клеток. [ 2 ]
Иммунодепрессанты также используются для предотвращения активации Т-клеток и высвобождения цитокинов. Кортикостероиды используются для уменьшения воспалительных эффектов. [ 22 ]
Эволюция производства суперантигенов
[ редактировать ]Производство SAg эффективно разрушает иммунный ответ, позволяя микробу, секретирующему SAg, беспрепятственно переноситься и передаваться. Одним из механизмов, с помощью которого это происходит, является индукция анергии Т-клеток на антигены и САг. [ 15 ] [ 18 ] Луссов и Макдональд продемонстрировали это, систематически подвергая животных воздействию стрептококкового антигена. Они обнаружили, что воздействие других антигенов после заражения SAg не вызвало иммунного ответа. [ 18 ] В другом эксперименте Уотсон и Ли обнаружили, что Т-клетки памяти, созданные в результате нормальной антигенной стимуляции, были анергическими к стимуляции SAg, а Т-клетки памяти, созданные после инфекции SAg, были анергическими ко всей антигенной стимуляции. Механизм, посредством которого это произошло, не был определен. [ 15 ] Гены, которые регулируют экспрессию SAg, также регулируют механизмы уклонения от иммунитета, такие как экспрессия белка M и бактериальных капсул , что подтверждает гипотезу о том, что продукция SAg развивалась в первую очередь как механизм уклонения от иммунитета. [ 27 ]
Когда структуру отдельных доменов SAg сравнили с другими иммуноглобулин-связывающими стрептококковыми белками (такими как токсины, продуцируемые E. coli ), было обнаружено, что эти домены по отдельности напоминают членов этих семейств. Эта гомология предполагает, что SAgs возникли посредством рекомбинации двух меньших мотивов β-цепи. [ 28 ]
«Стафилококковые суперантигеноподобные» (SSL) токсины представляют собой группу секретируемых белков, структурно сходных с SAgs. Вместо связывания с MHC и TCR они нацелены на различные компоненты врожденного иммунитета, такие как комплемент , рецепторы Fc и миелоидные клетки . Одним из способов воздействия SSL на миелоидные клетки является связывание сиаллактозамингликана с поверхностными гликопротеинами. [ 29 ] В 2017 году было обнаружено, что суперантиген также обладает способностью связывать гликаны. [ 30 ]
Эндогенные и вирусные САг
[ редактировать ]Минорные лимфоцитстимулирующие (Mls; P03319 ) экзотоксины были первоначально обнаружены в тимуса стромальных клетках мышей. Эти токсины кодируются генами SAg, которые были включены в геном мыши из вируса опухоли молочной железы мышей (MMTV). Присутствие этих генов в геноме мыши позволяет мыши экспрессировать антиген в тимусе как средство отрицательного отбора лимфоцитов с вариабельной бета-областью, которая чувствительна к стимуляции вирусным SAg. В результате эти мыши становятся невосприимчивыми к заражению вирусом в более позднем возрасте. [ 2 ]
Подобный эндогенный SAg-зависимый отбор еще не идентифицирован в геноме человека, но эндогенные SAg были обнаружены и предположительно играют важную роль в вирусной инфекции. Например, известно, что заражение вирусом Эпштейна-Барра вызывает выработку SAg в инфицированных клетках, однако в геноме вируса не обнаружено гена токсина. Вирус манипулирует инфицированной клеткой, чтобы экспрессировать свои собственные гены SAg, и это помогает ей уклоняться от иммунной системы хозяина. Аналогичные результаты были получены при бешенстве , цитомегаловирусе и ВИЧ . [ 2 ] В 2001 году было обнаружено, что EBV фактически трансактивирует суперантиген, кодируемый геном env ( O42043 ) HERV-K18 . В 2006 году было обнаружено, что EBV делает это путем стыковки с CD2 . [ 31 ]
Два вирусных суперантигена не гомологичны вышеупомянутым бактериальным суперантигенам и не гомологичны друг другу.
Ссылки
[ редактировать ]- ^ Левинсон, Уоррен (2020). Обзор медицинской микробиологии и иммунологии (16-е изд.). США: McGraw-Hill Education. п. 530. ИСБН 9781260116717 .
- ^ Jump up to: а б с д и ж г Ллевелин М., Коэн Дж. (март 2002 г.). «Суперантигены: микробные агенты, поражающие иммунитет». Ланцет Инфекционный Дис . 2 (3): 156–62. дои : 10.1016/S1473-3099(02)00222-0 . ПМИД 11944185 .
- ^ Ли Х., Ллера А., Мальчиоди Э.Л., Мариуцца Р.А. Структурная основа активации Т-клеток суперантигенами. Год. Преподобный. Иммунол. 1999;17:435–466. doi: 10.1146/annurev.immunol.17.1.435.
- ^ Шрискандан С., Фолкнер Л., Хопкинс П. (2007). «Streptococcus pyogenes: понимание функции стрептококковых суперантигенов». Межд. Дж. Биохим. Клеточная Биол . 39 (1): 12–9. doi : 10.1016/j.biocel.2006.08.009 . ПМИД 17029999 .
- ^ Jump up to: а б с д Петерссон К., Форсберг Г., Уолс Б. (апрель 2004 г.). «Взаимодействие суперантигенов и иммунорецепторов» . Скан. Дж. Иммунол . 59 (4): 345–55. дои : 10.1111/j.0300-9475.2004.01404.x . ПМИД 15049778 .
- ^ Jump up to: а б с д и ж Мехиндате К., Тибодо Дж., Долстен М., Калланд Т., Секали Р.П., Мурад В. (ноябрь 1995 г.). «Сшивание молекул главного комплекса гистосовместимости класса II суперантигеном стафилококкового энтеротоксина А является необходимым условием для экспрессии генов воспалительных цитокинов» . Дж. Эксп. Мед . 182 (5): 1573–7. дои : 10.1084/jem.182.5.1573 . ПМК 2192187 . ПМИД 7595227 .
- ^ Сундберг, Эрик Дж.; Дэн, Лу; Мариуцца, Рой А. (август 2007 г.). «Распознавание TCR комплексов пептид/MHC класса II и суперантигенов» . Семинары по иммунологии . 19 (4): 262–271. дои : 10.1016/j.smim.2007.04.006 . ПМЦ 2949352 . ПМИД 17560120 .
- ^ Jump up to: а б Папагеоргиу А.С., Трантер Х.С., Ачарья К.Р. (март 1998 г.). «Кристаллическая структура микробного суперантигена стафилококкового энтеротоксина B с разрешением 1,5 А: значение для распознавания суперантигена молекулами MHC класса II и рецепторами Т-клеток». Дж. Мол. Биол . 277 (1): 61–79. дои : 10.1006/jmbi.1997.1577 . ПМИД 9514739 .
- ^ Jump up to: а б Шливерт П.М. (апрель 1982 г.). «Повышение восприимчивости хозяина к летальному эндотоксиновому шоку стафилококковым пирогенным экзотоксином типа C» . Заразить. Иммунитет . 36 (1): 123–8. дои : 10.1128/IAI.36.1.123-128.1982 . ПМЦ 351193 . ПМИД 7042568 .
- ^ Jump up to: а б с д и Алуф Дж. Э., Мюллер-Алуф Х. (февраль 2003 г.). «Стафилококковые и стрептококковые суперантигены: молекулярные, биологические и клинические аспекты». Межд. Дж. Мед. Микробиол . 292 (7–8): 429–40. дои : 10.1078/1438-4221-00232 . ПМИД 12635926 .
- ^ Jump up to: а б Бруйяр Ж.Н., Гюнтер С., Варма А.К. и др. (апрель 2007 г.). «Кристаллическая структура стрептококкового суперантигена SpeI и функциональная роль нового петлевого домена в активации Т-клеток суперантигенами группы V». Дж. Мол. Биол . 367 (4): 925–34. дои : 10.1016/j.jmb.2007.01.024 . ПМИД 17303163 .
- ^ Jump up to: а б с Буонпане Р.А., Моза Б., Сундберг Э.Дж., Кранц Д.М. (октябрь 2005 г.). «Характеристика Т-клеточных рецепторов, обладающих высоким сродством к токсину-1 синдрома токсического шока». Дж. Мол. Биол . 353 (2): 308–21. дои : 10.1016/j.jmb.2005.08.041 . ПМИД 16171815 .
- ^ Ли Х., Ллера А., Цучия Д. и др. (декабрь 1998 г.). «Трехмерная структура комплекса между бета-цепью рецептора Т-клеток и суперантигеном стафилококкового энтеротоксина B» . Иммунитет . 9 (6): 807–16. дои : 10.1016/S1074-7613(00)80646-9 . ПМИД 9881971 .
- ^ Jump up to: а б с Аркус В.Л., Профт Т., Сигрелл Дж.А., Бейкер Х.М., Фрейзер Дж.Д., Бейкер Э.Н. (май 2000 г.). «Консервация и изменение структуры и активности суперантигена, подчеркнутые трехмерными структурами двух новых суперантигенов Streptococcus pyogenes». Дж. Мол. Биол . 299 (1): 157–68. дои : 10.1006/jmbi.2000.3725 . ПМИД 10860729 .
- ^ Jump up to: а б с Уотсон А.Р., Ли В.Т. (август 2006 г.). «Передача сигнала, опосредованная дефектным Т-клеточным рецептором, в CD4 Т-лимфоцитах памяти, подвергшихся воздействию суперантигена или антител к Т-клеточному рецептору» . Клетка. Иммунол . 242 (2): 80–90. дои : 10.1016/j.cellimm.2006.09.008 . ПМК 1829409 . ПМИД 17083922 .
- ^ Jump up to: а б Чой С., Шварц Р.Х. (июнь 2007 г.). «Молекулярные механизмы адаптивной толерантности и другие модели анергии Т-клеток» . Семин. Иммунол . 19 (3): 140–52. дои : 10.1016/j.smim.2007.02.005 . ПМК 2045643 . ПМИД 17400472 .
- ^ Jump up to: а б Стайлз Б.Г., Кракауэр (2005). «Стафилококковые энтеротоксины: обзор очищающего опыта, часть I». Информационный бюллетень по клинической микробиологии . 27 (23): 23. doi : 10.1016/j.clinmicnews.2005.11.001 .
- ^ Jump up to: а б с Луссов А.Р., Макдональд Х.Р. (февраль 1994 г.). «Дифференциальные эффекты «анергии», индуцированной суперантигеном, на прайминговую и эффекторную стадии Т-клеточно-зависимого гуморального ответа». Евро. Дж. Иммунол . 24 (2): 445–9. дои : 10.1002/eji.1830240227 . ПМИД 8299694 . S2CID 6208425 .
- ^ Миллер С., Рагеб Дж.А., Шварц Р.Х. (июль 1999 г.). «Анергия и цитокин-опосредованное подавление как особые механизмы толерантности, индуцированные суперантигеном, in vivo» . Дж. Эксп. Мед . 190 (1): 53–64. дои : 10.1084/jem.190.1.53 . ПМК 2195559 . ПМИД 10429670 .
- ^ Ямагучи М., Надлер С., Ли Дж.В., Диг Х.Дж. (сентябрь 1999 г.). «Индукция негативных регуляторов кроветворения в клетках костного мозга человека путем сшивания HLA-DR». Транспл. Иммунол . 7 (3): 159–68. дои : 10.1016/S0966-3274(99)80035-5 . ПМИД 10608299 .
- ^ Стауффер Ю., Маргерат С., Мейлан Ф. и др. (октябрь 2001 г.). «Эндогенный суперантиген, индуцированный интерфероном-альфа. Модель, связывающая окружающую среду и аутоиммунитет» . Иммунитет . 15 (4): 591–601. дои : 10.1016/S1074-7613(01)00212-6 . ПМИД 11672541 .
- ^ Jump up to: а б с д Джабара Х.Х., Геха Р.С. (октябрь 1996 г.). «Суперантигенный токсин-1 синдрома токсического шока индуцирует экспрессию лиганда CD40 и модулирует переключение изотипа IgE» . Межд. Иммунол . 8 (10): 1503–10. дои : 10.1093/интимм/8.10.1503 . ПМИД 8921429 .
- ^ Динер К., Тессье П., Фрейзер Дж., Кёнтген Ф., МакКолл С.Р. (июнь 1998 г.). «Индукция острого воспаления in vivo стафилококковыми суперантигенами I: рекрутирование лейкоцитов происходит независимо от Т-лимфоцитов и молекул класса II главного комплекса гистосовместимости». Лаб. Инвестируйте . 78 (6): 647–56. ПМИД 9645755 .
- ^ Ван Каувенберг П., Геверт П., Ван Хекке Х., Ван Зеле Т., Бахерт С. (2005). «Новый взгляд на патологию полипоза носа: роль суперантигенов и IgE». Верх К. Акад. Генескд, Бельг . 67 (5–28): 5–28, обсуждение 29–32. ПМИД 15828304 .
- ^ Сальгадо-Пабон В. и др. (2013) Суперантигены имеют решающее значение для инфекционного эндокардита, сепсиса и острого повреждения почек, вызванного Staphylococcus aureus. МБио 4: e00494-00413.
- ^ Эрландссон Э., Андерссон К., Каваллин А., Нильссон А. и др. (2003). «Идентификация антигенных эпитопов стафилококковых энтеротоксинов А и Е и разработка суперантигена для терапии рака человека». Дж. Мол. Биол . 333 (5): 893–905. дои : 10.1016/j.jmb.2003.09.009 . ПМИД 14583188 .
- ^ Клири П.П., МакЛэндсборо Л., Икеда Л., Кью Д., Кравчак Дж., Лам Х. (апрель 1998 г.). «Высокочастотная внутриклеточная инфекция и экспрессия эритрогенного токсина А претерпевают фазовые изменения у стрептококков группы А М1» . Мол. Микробиол . 28 (1): 157–67. дои : 10.1046/j.1365-2958.1998.00786.x . ПМИД 9593304 .
- ^ Бахерт С., Геверт П., ван Каувенберг П. (июнь 2002 г.). « Энтеротоксины золотистого стафилококка : ключ к заболеванию дыхательных путей?» . Аллергия . 57 (6): 480–7. дои : 10.1034/j.1398-9995.2002.02156.x . ПМИД 12028112 .
- ^ Херманс, С.Дж.; Бейкер, HM; Секейра, РП; Лэнгли, Р.Дж.; Бейкер, EN; Фрейзер, доктор медицинских наук (ноябрь 2012 г.). «Структурные и функциональные свойства стафилококкового суперантигеноподобного белка 4» . Инфекция и иммунитет . 80 (11): 4004–13. дои : 10.1128/IAI.00764-12 . ПМЦ 3486064 . ПМИД 22949551 .
- ^ Лэнгли, Р.Дж.; Тинг, Ю.Т.; Клоу, Ф; Янг, PG; Рэдклифф, Ф.Дж.; Чой, Дж. М.; Секейра, РП; Холтфретер, С; Бейкер, Х; Фрейзер, доктор медицинских наук (сентябрь 2017 г.). «Стафилококковый энтеротоксин-подобный X (SElX) представляет собой уникальный суперантиген с функциональными особенностями двух основных семейств стафилококковых факторов вирулентности» . ПЛОС Патогены . 13 (9): e1006549. дои : 10.1371/journal.ppat.1006549 . ПМЦ 5589262 . ПМИД 28880913 .
- ^ Сяо, Фрэнсис К.; Линь, Мяо; Тай, Альберт; Чен, Банда; Хубер, Бриджит Т. (15 августа 2006 г.). «Авангард: вирус Эпштейна-Барра трансактивирует суперантиген HERV-K18 путем стыковки с рецептором человеческого комплемента 2 (CD21) на первичных B-клетках» . Журнал иммунологии . 177 (4): 2056–2060. doi : 10.4049/jimmunol.177.4.2056 . ПМИД 16887963 .
Расули Р., До П. и Хернлем Б. (2011)Аутопрезентация стафилококкового энтеротоксина А мышиными CD4+ Т-клетками. Открытый журнал иммунологии, 1, 8-14.
Дальнейшее чтение
[ редактировать ]- Веб-база данных Superantigen в Биркбеке, Лондонский университет
- Список белков-суперантигенов от UniProt
- Суперантигены Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)
Внешние ссылки
[ редактировать ] СМИ, связанные с суперантигенами, на Викискладе?
СМИ, связанные с суперантигенами, на Викискладе?