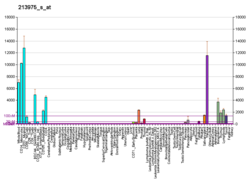
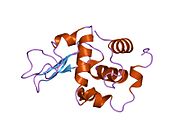
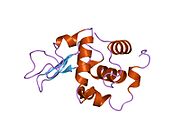
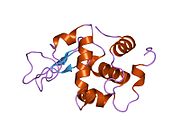
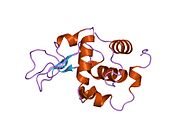
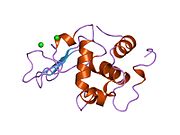
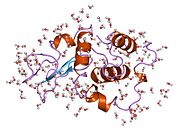
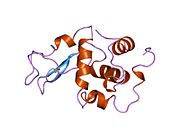
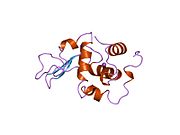
Лизоцим
| Лизоцим | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 3.2.1.17 | ||
| Номер CAS. | 9001-63-2 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| Гликозидгидролаза, семейство 22, лизоцим | |
|---|---|
 Кристаллы лизоцима, окрашенные метиленовым синим . | |
| Идентификаторы | |
| Символ | ? |
| ИнтерПро | IPR000974 |
Лизоцим ( EC 3.2.1.17 , мурамидаза, N -ацетилмурамидгликангидролаза ; систематическое название пептидогликан N -ацетилмурамоилгидролаза ) представляет собой противомикробный фермент, вырабатываемый животными, который является частью врожденной иммунной системы . Это гликозидгидролаза , катализирующая следующий процесс:
- Гидролиз (1→4)-β-связей между N -ацетилмурамовой кислотой и остатками N -ацетил- D -глюкозамина в пептидогликане и между N -ацетил- D -глюкозамина в хитодекстринах остатками
Пептидогликан является основным компонентом клеточной стенки грамположительных бактерий . [ 1 ] Этот гидролиз, в свою очередь, нарушает целостность клеточных стенок бактерий, вызывая лизис бактерий.
Лизоцим содержится в большом количестве в секретах , включая слезы , слюну , грудное молоко и слизь . Он также присутствует в цитоплазматических гранулах макрофагов и полиморфно -ядерных нейтрофилов (ПМН). Большое количество лизоцима содержится в яичном белке . Лизозимы C-типа тесно связаны с α-лактальбумином по последовательности и структуре, что делает их частью одного и того же семейства гликозидгидролаз 22 . [ 2 ] У человека фермент лизоцим С-типа кодируется геном LYZ . [ 3 ] [ 4 ]
Лизоцим куриного яичного белка термически стабилен, его температура плавления достигает 72 °C при pH 5,0. [ 5 ] Однако при такой температуре лизоцим в грудном молоке очень быстро теряет активность. [ 6 ] Лизоцим белка куриного яйца сохраняет свою активность в широком диапазоне pH (6–9). [ 7 ] Его изоэлектрическая точка — 11,35. [ 8 ] Изоэлектрическая точка лизоцима женского молока составляет 10,5–11. [ 9 ]
Функция и механизм
[ редактировать ]Фермент в действует путем гидролиза гликозидных связей пептидогликанах . Фермент также может разрывать гликозидные связи в хитине , хотя и не так эффективно, как истинные хитиназы . [ 10 ]

Активный центр лизоцима связывает молекулу пептидогликана в заметной щели между двумя его доменами. Он атакует пептидогликаны (обнаруженные в клеточных стенках бактерий, особенно грамположительных бактерий ), свой природный субстрат , находящийся между N -ацетилмурамовой кислотой (NAM) и четвертым атомом углерода N-ацетилглюкозамина (NAG). [ нужна ссылка ]
Более короткие сахариды , такие как тетрасахарид, также оказались жизнеспособными субстратами, но через промежуточное соединение с более длинной цепью. [ 11 ] Также было показано, что хитин является жизнеспособным субстратом лизоцима. Искусственные субстраты также были разработаны и использованы в лизоциме. [ 12 ]
Механизм
[ редактировать ]Филлипс
[ редактировать ]Механизм Филлипса предположил, что каталитическая сила фермента обусловлена как стерическим напряжением связанного субстрата, так и электростатической стабилизацией промежуточного оксо-карбения . На основании данных рентгеновской кристаллографии Филлипс предположил активный центр фермента, с которым связывается гексасахарид. Лизоцим искажает четвертый сахар (в субсайте D или -1) гексасахарида в конформацию полукресла. В этом напряженном состоянии гликозидная связь легче разрывается. [ 13 ] ионный промежуточный продукт, содержащий оксокарбений . В результате разрыва гликозидной связи образуется [ 14 ] Таким образом, искажение, заставляющее молекулу субстрата принять напряженную конформацию, аналогичную переходному состоянию, снизит энергетический барьер реакции. [ 15 ]
в 1978 году предположил, что предлагаемый оксо-карбониевый промежуточный продукт электростатически стабилизируется остатками аспартата и глутамата в активном центре. Арье Варшел Аргумент электростатической стабилизации был основан на сравнении с объемной водой: переориентация диполей воды может компенсировать стабилизирующую энергию. зарядовое взаимодействие. В модели Уоршеля фермент действует как суперрастворитель, который фиксирует ориентацию ионных пар и обеспечивает суперсольватацию ( очень хорошую стабилизацию ионных пар), а особенно снижает энергию, когда два иона находятся близко друг к другу. [ 16 ]
Стадия , определяющая скорость (RDS) в этом механизме, связана с образованием оксо-карбениевого интермедиата. Были некоторые противоречивые результаты, указывающие на точный RDS. Прослеживая образование продукта ( п-нитрофенола ), было обнаружено, что RDS может меняться при разных температурах, что и стало причиной столь противоречивых результатов. При более высокой температуре РДС представляет собой образование промежуточного гликозилового фермента, а при более низкой температуре - распад этого промежуточного продукта. [ 17 ]

Ковалентный механизм
[ редактировать ]
В первых дебатах в 1969 году Далквист предложил ковалентный механизм лизоцима, основанный на кинетическом изотопном эффекте . [ 14 ] но долгое время более приемлемым был ионный механизм. В 2001 году Вокадло предложил пересмотренный механизм через ковалентное, но не ионное промежуточное соединение. Данные ESI - MS- анализа показали ковалентное промежуточное соединение. 2-фторзамещенный субстрат использовали для снижения скорости реакции и накопления промежуточного продукта для характеристики. [ 19 ] Было обнаружено, что боковые цепи аминокислот глутаминовая кислота 35 (Glu35) и аспартат 52 (Asp52) имеют решающее значение для активности этого фермента. Glu35 действует как донор протонов гликозидной связи, расщепляя связь CO в субстрате, тогда как Asp52 действует как нуклеофил , генерируя промежуточный гликозильный фермент. Glu35 реагирует с водой с образованием гидроксильного иона, более сильного нуклеофила , чем вода, который затем атакует гликозильный промежуточный продукт фермента, образуя продукт гидролиза и оставляя фермент неизменным. [ 20 ] Этот тип ковалентного механизма ферментативного катализа был впервые предложен Кошландом . [ 21 ]
Совсем недавно в молекулярно-динамическом моделировании квантовой механики/молекулярной механики (QM/MM) использовался кристалл HEWL, и они предсказывали существование ковалентного промежуточного соединения. [ 22 ] Данные ESI-MS и рентгеновских структур указывают на существование ковалентного промежуточного соединения, но в первую очередь полагаются на использование менее активного мутантного или ненативного субстрата. Таким образом, молекулярная динамика QM/MM предоставляет уникальную возможность напрямую исследовать механизм HEWL дикого типа и нативного субстрата. Расчеты показали, что ковалентный интермедиат ковалентного механизма на ~30 ккал/моль более стабилен, чем ионный интермедиат механизма Филлипса. [ 22 ] Эти расчеты показывают, что ионный интермедиат крайне энергетически невыгоден, а ковалентные интермедиаты, наблюдаемые в экспериментах с использованием менее активных мутантных или ненативных субстратов, дают полезную информацию о механизме HEWL дикого типа. [ нужна ссылка ]

Торможение
[ редактировать ]Производные имидазола могут образовывать комплекс с переносом заряда с некоторыми остатками (в активном центре или за его пределами) для достижения конкурентного ингибирования лизоцима. [ 23 ] У грамотрицательных бактерий действует липополисахарид как неконкурентный ингибитор за счет предпочтительного связывания с лизоцимом. [ 24 ]
Неферментативное действие
[ редактировать ]Несмотря на то, что предполагалось, что мурамидазная активность лизоцима играет ключевую роль в его антибактериальных свойствах, сообщалось также о его неферментативном действии. Например, блокирование каталитической активности лизоцима путем мутации критической аминокислоты в активном центре (52- Asp -> 52- Ser ) не устраняет его антимикробную активность. [ 25 ] О лектиноподобной способности лизоцима узнавать бактериальный углеводный антиген без литической активности сообщалось для тетрасахарида, родственного липополисахариду Klebsiella pneumoniae . [ 26 ] Также лизоцим взаимодействует с антителами и рецепторами Т-клеток . [ 27 ]
Изменения конформации фермента
[ редактировать ]Лизоцим имеет две конформации: открытое активное состояние и закрытое неактивное состояние. Каталитическая значимость была исследована с помощью с одностенными углеродными нанотрубками (SWCN), где единственный лизоцим был связан с SWCN FET. полевых транзисторов (FET) [ 28 ] Электронный мониторинг лизоцима показал две конформации: открытый активный сайт и закрытый неактивный сайт. В активном состоянии лизоцим способен процессивно гидролизовать свой субстрат, разрывая в среднем 100 связей со скоростью 15 в секунду. Чтобы связать новый субстрат и перейти из закрытого неактивного состояния в открытое активное состояние, требуется два этапа изменения конформации, тогда как для инактивации требуется один этап. [ нужна ссылка ]
Суперсемья
[ редактировать ]Обычный лизоцим C-типа является частью более крупной группы структурно и механически родственных ферментов, называемых лизоцимов суперсемейством . Это семейство объединяет лизоцимы C-типа GH22 («куриные») с растительной хитиназой GH19 G-типа («гусиным») , лизоцимом GH23 V-типа («вирусным») , лизоцимом GH24 и семействами хитозаназ GH46 . Номенклатура типов лизоцима отражает только источник, из которого первоначально был выделен тип, и не полностью отражает таксономическое распространение. [ 29 ] Например, люди и многие другие млекопитающие имеют два гена лизоцима G-типа: LYG1 и LYG2 . [ 30 ]
Роль в болезни и терапии
[ редактировать ]| ЛИЗ | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | LYZ , LZM, LYZF1, лизоцим | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 153450 ; МГИ : 96902 ; Гомологен : 121490 ; GeneCards : LYZ ; ОМА : LYZ - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Лизоцим является частью врожденной иммунной системы. Снижение уровня лизоцима связано с бронхолегочной дисплазией у новорожденных. [ 35 ] Поросята, которых кормят человеческим лизоцимным молоком, могут быстрее выздороветь от диарейного заболевания, вызванного кишечной палочкой . Концентрация лизоцима в грудном молоке в 1600–3000 раз превышает его концентрацию в молоке крупного рогатого скота. Человеческий лизоцим более активен, чем лизоцим белка куриного яйца. Трансгенная которой звали «Артемида») была выведена для производства молока с человеческим лизоцимом, чтобы защитить детей от диареи , линия коз ( основателя если они не могут получить преимущества грудного вскармливания человека. [ 36 ] [ 37 ]
Поскольку лизоцим является естественной формой защиты от грамположительных патогенов, таких как Bacillus и Streptococcus , [ 38 ] он играет важную роль в иммунологии детей грудного возраста при вскармливании грудным молоком. [ 39 ] В то время как кожа является защитным барьером из-за ее сухости и кислотности, конъюнктива (мембрана, покрывающая глаз) вместо этого защищена секретируемыми ферментами, главным образом лизоцимом и дефензином . Однако когда эти защитные барьеры выходят из строя, возникает конъюнктивит . [ нужна ссылка ]
При некоторых видах рака (особенно миеломоноцитарном лейкозе) чрезмерное производство лизоцима раковыми клетками может привести к токсическим уровням лизоцима в крови. Высокий уровень лизоцима в крови может привести к почечной недостаточности и низкому уровню калия в крови, состояниям, которые могут улучшиться или исчезнуть при лечении первичного злокачественного новообразования. [ нужна ссылка ]
Сывороточный лизоцим гораздо менее специфичен для диагностики саркоидоза, чем сывороточный ангиотензинпревращающий фермент; однако, поскольку он более чувствителен, он используется в качестве маркера активности саркоидоза и подходит для мониторинга заболевания в доказанных случаях. [ 40 ]
Химический синтез
[ редактировать ]Первый химический синтез белка-лизоцима был предпринят профессором Джорджем Кеннером и его группой в Ливерпульском университете в Англии. [ 41 ] Наконец, в 2007 году этого удалось добиться Томасу Дуреку в лаборатории Стива Кента в Чикагском университете, который создал синтетическую функциональную молекулу лизоцима. [ 42 ]
Другие приложения
[ редактировать ]Кристаллы лизоцима использовались для выращивания других функциональных материалов для катализа и биомедицинских применений. [ 43 ] [ 44 ] [ 45 ] Лизоцим — широко используемый фермент для лизиса грамположительных бактерий. [ 46 ] Из-за уникальной функции лизоцима, заключающейся в том, что он может расщеплять клеточную стенку и вызывать осмотический шок (взрыв клетки из-за внезапного изменения концентрации растворенного вещества вокруг клетки и, следовательно, осмотического давления ), лизоцим обычно используется в лабораторных условиях для высвобождения белков из бактерий. периплазмы , в то время как внутренняя мембрана остается запечатанной в виде пузырьков, называемых сферопластами . [ 47 ] [ 48 ]
Например, кишечную палочку можно лизировать с помощью лизоцима, чтобы освободить содержимое периплазматического пространства . Это особенно полезно в лабораторных условиях при попытке собрать содержимое периплазмы. [ 1 ] Обработка лизоцимом оптимальна при определенных температурах, диапазонах pH и концентрациях солей. Активность лизоцима возрастает с повышением температуры, до 60 градусов Цельсия, при диапазоне рН 6,0-7,0. Присутствующие соли также влияют на обработку лизоцимом, при этом некоторые из них оказывают ингибирующее действие, а другие способствуют лизису посредством обработки лизоцимом. Хлорид натрия индуцирует лизис, но в высоких концентрациях он является активным ингибитором лизиса. Подобные наблюдения наблюдались и при использовании солей калия. Незначительные вариации присутствуют из-за различий в бактериальных штаммах. [ 49 ] Следствием использования лизоцима при экстракции рекомбинантных белков для кристаллизации белков является то, что кристалл может быть загрязнен единицами лизоцима, образуя физиологически нерелевантную комбинацию. Фактически, некоторые белки просто не могут кристаллизоваться без такого загрязнения. [ 50 ] [ 51 ]
Кроме того, лизоцим может служить инструментом экспрессии токсичных рекомбинантных белков. Экспрессия рекомбинантных белков в штаммах BL21(DE3) обычно осуществляется с помощью Т7-РНК-полимеразы. Посредством индукции IPTG репрессор UV-5 ингибируется, что приводит к транскрипции T7-РНК-полимеразы и, следовательно, интересующего белка. Тем не менее, базальный уровень Т7-РНК-полимеразы наблюдается даже без индукции. Лизоцим Т7 действует как ингибитор Т7-РНК-полимеразы. Недавно изобретенные штаммы, содержащие хелперную плазмиду (pLysS), конститутивно совместно экспрессируют низкие уровни лизоцима Т7, обеспечивая высокую строгость и постоянную экспрессию токсичного рекомбинантного белка. [ 52 ]
История
[ редактировать ]Антибактериальные свойства белка куриного яйца, обусловленные содержащимся в нем лизоцимом, впервые были обнаружены Лащенко в 1909 году. [ 53 ] Убивающая бактерии активность носовой слизи была продемонстрирована в 1922 году Александром Флемингом , первооткрывателем пенициллина , который ввел термин «лизоцим». [ 54 ] Сообщается, что он сказал: «Поскольку это вещество имеет свойства, схожие со свойствами ферментов, я назвал его «лизоцимом». [ 55 ] Далее Флеминг показал, что ферментное вещество присутствует в самых разных выделениях и способно быстро лизировать (т. е. растворять) различные бактерии, особенно желтый «кокк», который он изучал». [ 56 ]
Лизоцим был впервые кристаллизован Эдвардом Абрахамом описать трехмерную структуру лизоцима белка куриного яйца в 1937 году, что позволило Дэвиду Чилтону Филлипсу в 1965 году, когда он получил первую 2 ангстрема (200 пм модель с разрешением ) с помощью рентгеновской кристаллографии. . [ 57 ] [ 58 ] Структура была публично представлена на лекции Королевского института в 1965 году. [ 59 ] Лизоцим был второй белковой структурой и первой структурой фермента, которую удалось решить с помощью методов рентгеновской дифракции, а также первым полностью секвенированным ферментом, содержащим все двадцать общих аминокислот. [ 60 ] В результате выяснения Филлипсом структуры лизоцима это был также первый фермент, для которого был предложен подробный и специфический механизм каталитического действия. [ 61 ] [ 62 ] [ 63 ] Эта работа побудила Филлипса дать объяснение тому, как ферменты ускоряют химическую реакцию, с точки зрения ее физической структуры. Первоначальный механизм, предложенный Филлипсом, был недавно пересмотрен. [ 19 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Манченко Г.П. (1994). «Лизоцим» . Справочник по обнаружению ферментов на электрофоретических гелях . Бока-Ратон, Флорида: CRC Press. п. 223 . ISBN 978-0-8493-8935-1 .
- ^ Уильямс С., Вокадло Д. «Семейство гликозидгидролаз 22» . Казипедия . Проверено 11 апреля 2017 г.
- ^ Ёсимура К., Тойбана А., Накахама К. (январь 1988 г.). «Человеческий лизоцим: секвенирование кДНК, а также экспрессия и секреция Saccharomyces cerevisiae». Связь с биохимическими и биофизическими исследованиями . 150 (2): 794–801. дои : 10.1016/0006-291X(88)90461-5 . ПМИД 2829884 .
- ^ Петерс К.В., Крузе У., Поллвейн Р., Гжещик К.Х., Сиппель А.Е. (июль 1989 г.). «Ген лизоцима человека. Организация последовательности и хромосомная локализация» . Европейский журнал биохимии . 182 (3): 507–516. дои : 10.1111/j.1432-1033.1989.tb14857.x . ПМИД 2546758 .
- ^ Венкатарамани С., Трунцер Дж., Коулман Д.Р. (апрель 2013 г.). «Термическая стабильность лизоцима с высокой концентрацией при изменении pH: инфракрасное исследование с преобразованием Фурье» . Журнал фармации и биологических наук . 5 (2): 148–153. дои : 10.4103/0975-7406.111821 . ПМК 3697194 . ПМИД 23833521 .
- ^ Чандан Р.К., Шахани К.М., Холли Р.Г. (октябрь 1964 г.). «Содержание лизоцима в грудном молоке». Природа . 204 (4953): 76–77. Бибкод : 1964Natur.204...76C . дои : 10.1038/204076a0 . ПМИД 14240122 . S2CID 4215401 .
- ^ «Лизоцим, информация о продукте» (PDF) . Сигма-Олдрич.
- ^ «Лизоцим, информация о продукте» (PDF) . Сигма-Олдрич.
- ^ Парри Р.М., Чандан Р.К., Шахани К.М. (март 1969 г.). «Выделение и характеристика лизоцима женского молока» . Архив биохимии и биофизики . 130 (1): 59–65. дои : 10.1016/0003-9861(69)90009-5 . ПМИД 5778672 .
- ^ Скуиньсь Ю., Пуките А., Макларен А.Д. (декабрь 1973 г.). «Адсорбция и реакции хитиназы и лизоцима на хитине». Молекулярная и клеточная биохимия . 2 (2): 221–228. дои : 10.1007/BF01795475 . ПМИД 4359167 . S2CID 27906558 .
- ^ Шэрон Н. (апрель 1967 г.). «Химическая структура субстратов лизоцима и их расщепление ферментом». Труды Лондонского королевского общества. Серия Б, Биологические науки . 167 (1009): 402–415. Бибкод : 1967РСПСБ.167..402С . дои : 10.1098/rspb.1967.0037 . ПМИД 4382803 . S2CID 31794497 .
- ^ СП «Хёлтье» (1 января 1996 г.). «Лизоцимные субстраты». Лизоцимы: модельные ферменты в биохимии и биологии . Дополнительный опыт. Том. 75. С. 105–110. doi : 10.1007/978-3-0348-9225-4_7 (неактивен 4 апреля 2024 г.). ISBN 978-3-0348-9952-9 . PMID 8765297 .
{{cite book}}: CS1 maint: DOI неактивен по состоянию на апрель 2024 г. ( ссылка ) - ^ Блейк CC, Джонсон Л.Н., Мэйр Г.А., Норт AC, Филлипс, округ Колумбия, Сарма В.Р. (апрель 1967 г.). «Кристаллографические исследования активности лизоцима куриного белка». Труды Лондонского королевского общества. Серия Б, Биологические науки . 167 (1009): 378–388. Бибкод : 1967РСПСБ.167..378Б . дои : 10.1098/rspb.1967.0035 . ПМИД 4382801 . S2CID 35094695 .
- ^ Jump up to: а б Далквист Ф.В., Рэнд-Меир Т., Рафтери М.А. (октябрь 1969 г.). «Применение вторичных кинетических изотопных эффектов α-дейтерия к исследованию ферментативного катализа. Гидролиз гликозидов лизоцимом и β-глюкозидазой». Биохимия . 8 (10): 4214–4221. дои : 10.1021/bi00838a045 . ПМИД 5388150 .
- ^ Маккензи Х.А., Уайт Ф.Х. (1991). «Лизоцим и α-лактальбумин: структура, функции и взаимосвязи». Достижения в области химии белков . 41 : 173–315. дои : 10.1016/s0065-3233(08)60198-9 . ISBN 978-0-12-034241-9 . ПМИД 2069076 .
- ^ Варшел А. (ноябрь 1978 г.). «Энергетика ферментативного катализа» . Труды Национальной академии наук Соединенных Штатов Америки . 75 (11): 5250–5254. Бибкод : 1978PNAS...75.5250W . дои : 10.1073/pnas.75.11.5250 . ПМК 392938 . ПМИД 281676 .
- ^ Вебер Дж. П., Финк А. Л. (октябрь 1980 г.). «Температурно-зависимое изменение на стадии ограничения скорости катализа β-глюкозидазой» . Журнал биологической химии . 255 (19): 9030–9032. дои : 10.1016/S0021-9258(19)70521-3 . ПМИД 6773958 .
- ^ «Куриный яичный белок (HEW) Лизоцим - Протеопедия, жизнь в 3D» .
- ^ Jump up to: а б Vocadlo DJ, Дэвис Дж.Дж., Лэйн Р., Уизерс С.Г. (август 2001 г.). «Катализ лизоцимом куриного яичного белка протекает через ковалентное промежуточное соединение» (PDF) . Природа . 412 (6849): 835–838. Бибкод : 2001Natur.412..835V . дои : 10.1038/35090602 . ПМИД 11518970 . S2CID 205020153 .
- ^ Гришэм К.М., Гаррет Р.Х. (2007). «Глава 14: Механизм действия ферментов» . Биохимия . Австралия: Томсон Брукс/Коул. стр. 467–9. ISBN 978-0-495-11912-8 .
- ^ Кошланд Д.Э. (ноябрь 1953 г.). «Стереохимия и механизм ферментативных реакций» . Биологические обзоры . 28 (4): 416–436. дои : 10.1111/j.1469-185X.1953.tb01386.x . S2CID 86709302 .
- ^ Jump up to: а б Боуман А.Л., Грант И.М., Малхолланд А.Дж. (октябрь 2008 г.). «Моделирование QM / MM предсказывает ковалентное промежуточное соединение в реакции лизоцима белка куриного яйца с его естественным субстратом». Химические коммуникации (37): 4425–4427. дои : 10.1039/b810099c . ПМИД 18802578 .
- ^ Лебединый идентификатор (март 1972 г.). «Ингибирование лизоцима куриного белка производными имидазола и индола». Журнал молекулярной биологии . 65 (1): 59–62. дои : 10.1016/0022-2836(72)90491-3 . ПМИД 5063023 .
- ^ Оно Н., Моррисон, округ Колумбия (март 1989 г.). «Взаимодействие липополисахарида с лизоцимом. Связывание липополисахарида с лизоцимом и ингибирование ферментативной активности лизоцима» . Журнал биологической химии . 264 (8): 4434–4441. дои : 10.1016/S0021-9258(18)83761-9 . ПМИД 2647736 .
- ^ Ибрагим Х.Р., Мацузаки Т., Аоки Т. (сентябрь 2001 г.). «Генетические доказательства того, что антибактериальная активность лизоцима не зависит от его каталитической функции» . Письма ФЭБС . 506 (1): 27–32. дои : 10.1016/S0014-5793(01)02872-1 . ПМИД 11591365 . S2CID 21593262 .
- ^ Чжан Р., Ву Л., Экерт Т., Бург-Родерфельд М., Рохас-Масиас М.А., Люттеке Т. и др. (январь 2017 г.). «Свойства лизоцима, подобные лектинам, облегчают его функцию иммунной защиты» . Ежеквартальные обзоры биофизики . 50 : е9. дои : 10.1017/S0033583517000075 . ПМИД 29233221 .
- ^ Гривел Дж.К., Смит-Гилл С.Дж. (1996). Лизоцим: Антигенная структура, определяемая ответами антител и Т-клеток . ЦРК Пресс. стр. 91–144. ISBN 978-0-8493-9225-2 .
- ^ Чой И., Муди И.С., Симс ПК, Хант С.Р., Корсо Б.Л., Перес И. и др. (январь 2012 г.). «Динамика одномолекулярного лизоцима, контролируемая электронной схемой» . Наука . 335 (6066): 319–324. Бибкод : 2012Sci...335..319C . дои : 10.1126/science.1214824 . ПМЦ 3914775 . ПМИД 22267809 .
- ^ Волкениг А., Хуэт Дж., Луз Ю., Винтйенс Р. (9 ноября 2010 г.). «Структурные взаимоотношения в суперсемействе лизоцимов: существенные доказательства наличия характерных мотивов гликозидгидролазы» . ПЛОС ОДИН . 5 (11): e15388. Бибкод : 2010PLoSO...515388W . дои : 10.1371/journal.pone.0015388 . ПМЦ 2976769 . ПМИД 21085702 .
- ^ Ирвин Д.М. (декабрь 2014 г.). «Эволюция семейства генов лизоцима позвоночных гусей» . Эволюционная биология BMC . 14 (1): 188. Бибкод : 2014BMCEE..14..188I . дои : 10.1186/s12862-014-0188-x . ПМЦ 4243810 . ПМИД 25167808 .
- ^ Jump up to: а б с GRCh38: Ensembl выпуск 89: ENSG00000090382 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000069515 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Ревенис М.Э., Калинер М.А. (август 1992 г.). «Дефицит лактоферрина и лизоцима в секрете дыхательных путей: связь с развитием бронхолегочной дисплазии» . Журнал педиатрии . 121 (2): 262–270. дои : 10.1016/S0022-3476(05)81201-6 . ПМИД 1640295 .
- ^ Купер К.А., Гарас Клобас Л.К., Мага Э.А., Мюррей Дж.Д. (2013). «Употребление трансгенного козьего молока, содержащего противомикробный белок лизоцим, помогает устранить диарею у молодых свиней» . ПЛОС ОДИН . 8 (3): e58409. Бибкод : 2013PLoSO...858409C . дои : 10.1371/journal.pone.0058409 . ПМЦ 3596375 . ПМИД 23516474 .
- ^ Молтени М (30 июня 2016 г.). «Пролитое молоко» . Тематические исследования: Особенности новостей . Андердарк: Истина, Красота, Наука . Проверено 12 января 2017 г.
- ^ Нестер Э.В., Андерсон Д.Г., Робертс К.Э., Нестер М.Т. (2007). Микробиология: человеческий взгляд (5-е изд.). Бостон, Массачусетс: Высшее образование Макгроу-Хилла. ISBN 978-0-07-110706-8 .
- ^ Чандра РК (сентябрь 1978 г.). «Иммунологические аспекты женского молока». Обзоры питания . 36 (9): 265–272. дои : 10.1111/j.1753-4887.1978.tb07393.x . ПМИД 362248 .
- ^ Томита Х., Сато С., Мацуда Р., Сугиура Ю., Кавагути Х., Ниими Т. и др. (1999). «Уровни лизоцима в сыворотке и клинические особенности саркоидоза». Легкое . 177 (3): 161–167. дои : 10.1007/pl00007637 . ПМИД 10192763 . S2CID 3999327 .
- ^ Кеннер Г.В. (июнь 1977 г.). «Бекеровская лекция. На пути к синтезу белков». Труды Лондонского королевского общества. Серия Б, Биологические науки . 197 (1128): 237–253. Бибкод : 1977РСПСБ.197..237К . дои : 10.1098/rspb.1977.0068 . ПМИД 19745 . S2CID 170906912 .
- ^ Дурек Т., Торбеев В.Ю., Кент С.Б. (март 2007 г.). «Конвергентный химический синтез и рентгеновская структура человеческого лизоцима высокого разрешения» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (12): 4846–4851. Бибкод : 2007PNAS..104.4846D . дои : 10.1073/pnas.0610630104 . ПМЦ 1829227 . ПМИД 17360367 .
- ^ Вэй Х., Ван З., Чжан Дж., Хаус С., Гао Ю.Г., Ян Л. и др. (февраль 2011 г.). «Зависимый от времени, белково-направленный рост наночастиц золота внутри монокристалла лизоцима». Природные нанотехнологии . 6 (2): 93–97. Бибкод : 2011NatNa...6...93W . дои : 10.1038/nnano.2010.280 . ПМИД 21278750 .
- ^ Сангамитра, Нью-Джерси, Уэно Т. (май 2013 г.). «Расширение координационной химии от белка к сборке белка». Химические коммуникации . 49 (39): 4114–4126. дои : 10.1039/C2CC36935D . ПМИД 23211931 .
- ^ Уэно Т (июль 2013 г.). «Пористые белковые кристаллы как реакционные сосуды». Химия: Европейский журнал . 19 (28): 9096–9102. дои : 10.1002/chem.201300250 . ПМИД 23813903 .
- ^ Репаске Р. (октябрь 1956 г.). «Лизис грамотрицательных бактерий лизоцимом». Биохимика и биофизика Acta . 22 (1): 189–191. дои : 10.1016/0006-3002(56)90240-2 . ПМИД 13373865 .
- ^ Гантон Дж., Ширяев А., Пэган Д.Л. (2007). Конденсация белков: кинетические пути кристаллизации и заболеваний . Кембридж: Издательство Кембриджского университета. стр. 156–158 . ISBN 978-0-511-53532-1 .
- ^ Нинфа А., Баллу Д., Бенор М. (2010). Фундаментальные лабораторные подходы к биохимии и биотехнологии . Джон Уайли. ISBN 978-0-470-08766-4 .
- ^ Солтон М.Р. (июнь 1957 г.). «Свойства лизоцима и его действие на микроорганизмы» . Бактериологические обзоры . 21 (2): 82–100. дои : 10.1128/ММБР.21.2.82-100.1957 . ПМК 180888 . ПМИД 13436356 .
- ^ Лю В., МакГрат С.М., Колеске А.Дж., Боггон Т.Дж. (февраль 2012 г.). «Загрязнение лизоцимом облегчает кристаллизацию гетеротримерного комплекса кортактин-Arg-лизоцим» . Акта Кристаллографика. Раздел F. Структурная биология и кристаллизационные связи . 68 (Часть 2): 154–158. дои : 10.1107/S1744309111056132 . ПМЦ 3274391 . ПМИД 22297987 .
- ^ Кинканнон В.М., Зан М., Клэр Р., Ласти Бич Дж., Ромберг А., Ларсон Дж. и др. (март 2022 г.). «Биохимическая и структурная характеристика диоксигеназы, гидроксилирующей ароматическое кольцо, для катаболизма терефталевой кислоты» . Труды Национальной академии наук Соединенных Штатов Америки . 119 (13): e2121426119. Бибкод : 2022PNAS..11921426K . дои : 10.1073/pnas.2121426119 . ПМК 9060491 . ПМИД 35312352 .
- ^ Пан Ш., Малкольм Б.А. (декабрь 2000 г.). «Снижение фоновой экспрессии и улучшение стабильности плазмиды с векторами pET в BL21 (DE3)» . БиоТехники . 29 (6): 1234–1238. дои : 10.2144/00296st03 . ПМИД 11126126 .
- ^ Лащенко П. (1909). «О бактерицидном и ингибирующем рост эффекте альбумина куриного яйца». Журнал гигиены и инфекционных заболеваний (на немецком языке). 64 : 419–427. дои : 10.1007/BF02216170 . S2CID 456259 .
- ^ Дакетт С. (декабрь 1999 г.). «Эрнест Дюшен и концепция терапии грибковыми антибиотиками». Ланцет . 354 (9195): 2068–2071. дои : 10.1016/S0140-6736(99)03162-1 . PMID 10636385 . S2CID 206011471 .
- ^ Флеминг А. (май 1922 г.). «О замечательном бактериолитическом элементе, обнаруженном в тканях и секретах» . Труды Королевского общества Б. 93 (653): 306–317. Бибкод : 1922РСПСБ..93..306Ф . дои : 10.1098/rspb.1922.0023 . JSTOR 80959 .
- ^ Достижения в области химии белков . Академическая пресса. 13 июня 1991 г., стр. 176–. ISBN 978-0-08-058214-6 .
- ^ Блейк CC, Кениг Д.Ф., Майр Г.А., Норт AC, Филлипс, округ Колумбия, Сарма В.Р. (май 1965 г.). «Структура лизоцима куриного яичного белка. Трехмерный синтез Фурье с разрешением 2 Ангстрем». Природа . 206 (4986): 757–761. дои : 10.1038/206757a0 . ПМИД 5891407 . S2CID 4161467 .
- ^ Джонсон Л.Н., Филлипс, округ Колумбия (май 1965 г.). «Структура некоторых кристаллических комплексов лизоцим-ингибитор, определенная методом рентгеновского анализа с разрешением 6 ангстрем». Природа . 206 (4986): 761–763. дои : 10.1038/206761a0 . ПМИД 5840126 . S2CID 10234792 .
- ^ Джонсон Л.Н. (ноябрь 1998 г.). «Ранняя история лизоцима». Структурная биология природы . 5 (11): 942–944. дои : 10.1038/2917 . ПМИД 9808036 . S2CID 2629199 .
- ^ Кэнфилд RE (август 1963 г.). «Аминокислотная последовательность лизоцима яичного белка» . Журнал биологической химии . 238 (8): 2698–2707. дои : 10.1016/S0021-9258(18)67888-3 . ПМИД 14063294 .
- ^ Вернон, Калифорния (апрель 1967 г.). «Механизмы гидролиза гликозидов и их связь [sic] с реакциями, катализируемыми ферментами». Труды Лондонского королевского общества. Серия Б, Биологические науки . 167 (1009): 389–401. Бибкод : 1967РСПСБ.167..389В . дои : 10.1098/rspb.1967.0036 . JSTOR 75680 . ПМИД 4382802 . S2CID 12870128 .
- ^ Рупли Дж. А. (апрель 1967 г.). «Связывание и расщепление лизоцимом олигосахаридов N-ацетилглюкозамина». Труды Лондонского королевского общества. Серия Б, Биологические науки . 167 (1009): 416–428. Бибкод : 1967РСПСБ.167..416Р . дои : 10.1098/rspb.1967.0038 . JSTOR 75682 . ПМИД 4382804 . S2CID 33906706 .
- ^ Шэрон Н. (апрель 1967 г.). «Химическая структура субстратов лизоцима и их расщепление ферментом». Труды Лондонского королевского общества. Серия Б, Биологические науки . 167 (1009): 402–415. Бибкод : 1967РСПСБ.167..402С . дои : 10.1098/rspb.1967.0037 . JSTOR 75681 . ПМИД 4382803 . S2CID 31794497 .
Внешние ссылки
[ редактировать ]- Мурамидаза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Proteopedia.org HEW Лизоцим
- PDBe-KB предоставляет обзор всей информации о структуре, доступной в PDB для человеческого лизоцима C.
- PDBe-KB предоставляет обзор всей информации о структуре, доступной в PDB для белка куриного яйца, лизоцима C.