Pancreatic cancer
| Pancreatic cancer | |
|---|---|
 | |
| Diagram showing the position of the pancreas, behind the stomach (which is transparent in this schematic). | |
| Specialty | |
| Symptoms |
|
| Usual onset | 40+ years of age[2] |
| Risk factors |
|
| Diagnostic method |
|
| Prevention | Not smoking, low alcohol intake, maintaining a healthy weight, low red meat diet[5] |
| Treatment | |
| Prognosis | Five year survival rate 13%[6] |
| Frequency | 393,800 (2015)[7] |
| Deaths | 411,600 (2015)[8] |
Pancreatic cancer arises when cells in the pancreas, a glandular organ behind the stomach, begin to multiply out of control and form a mass. These cancerous cells have the ability to invade other parts of the body.[9] A number of types of pancreatic cancer are known.[10]
The most common, pancreatic adenocarcinoma, accounts for about 90% of cases,[11] and the term "pancreatic cancer" is sometimes used to refer only to that type.[10] These adenocarcinomas start within the part of the pancreas that makes digestive enzymes.[10] Several other types of cancer, which collectively represent the majority of the non-adenocarcinomas, can also arise from these cells.[10]
About 1–2% of cases of pancreatic cancer are neuroendocrine tumors, which arise from the hormone-producing cells of the pancreas.[10] These are generally less aggressive than pancreatic adenocarcinoma.[10]
Signs and symptoms of the most-common form of pancreatic cancer may include yellow skin, abdominal or back pain, unexplained weight loss, light-colored stools, dark urine, and loss of appetite.[1] Usually, no symptoms are seen in the disease's early stages, and symptoms that are specific enough to suggest pancreatic cancer typically do not develop until the disease has reached an advanced stage.[1][2] By the time of diagnosis, pancreatic cancer has often spread to other parts of the body.[10][12]
Pancreatic cancer rarely occurs before the age of 40, and more than half of cases of pancreatic adenocarcinoma occur in those over 70.[2] Risk factors for pancreatic cancer include tobacco smoking, obesity, diabetes, and certain rare genetic conditions.[2] About 25% of cases are linked to smoking,[3] and 5–10% are linked to inherited genes.[2]
Pancreatic cancer is usually diagnosed by a combination of medical imaging techniques such as ultrasound or computed tomography, blood tests, and examination of tissue samples (biopsy).[3][4] The disease is divided into stages, from early (stage I) to late (stage IV).[12] Screening the general population has not been found to be effective.[13]
The risk of developing pancreatic cancer is lower among non-smokers, and people who maintain a healthy weight and limit their consumption of red or processed meat;[5] the risk is greater for men, smokers, and those with diabetes.[14] There is some evidence that links high levels of red meat consumption to increased risk of pancreatic cancer. [15][16][17] Smokers' risk of developing the disease decreases immediately upon quitting, and almost returns to that of the rest of the population after 20 years.[10] Pancreatic cancer can be treated with surgery, radiotherapy, chemotherapy, palliative care, or a combination of these.[1] Treatment options are partly based on the cancer stage.[1] Surgery is the only treatment that can cure pancreatic adenocarcinoma,[12] and may also be done to improve quality of life without the potential for cure.[1][12] Pain management and medications to improve digestion are sometimes needed.[12] Early palliative care is recommended even for those receiving treatment that aims for a cure.[18]
Pancreatic cancer is among the most deadly forms of cancer globally, with one of the lowest survival rates. In 2015, pancreatic cancers of all types resulted in 411,600 deaths globally.[8] Pancreatic cancer is the fifth-most-common cause of death from cancer in the United Kingdom,[19] and the third most-common in the United States.[20] The disease occurs most often in the developed world, where about 70% of the new cases in 2012 originated.[10] Pancreatic adenocarcinoma typically has a very poor prognosis; after diagnosis, 25% of people survive one year and 12% live for five years.[6][10] For cancers diagnosed early, the five-year survival rate rises to about 20%.[21] Neuroendocrine cancers have better outcomes; at five years from diagnosis, 65% of those diagnosed are living, though survival considerably varies depending on the type of tumor.[10]
Types
[edit]

The many types of pancreatic cancer can be divided into two general groups. The vast majority of cases (about 95%) occur in the part of the pancreas that produces digestive enzymes, known as the exocrine component. Several subtypes of exocrine pancreatic cancers are described, but their diagnosis and treatment have much in common.
The small minority of cancers that arise in the hormone-producing (endocrine) tissue of the pancreas have different clinical characteristics and are called pancreatic neuroendocrine tumors, sometimes abbreviated as "PanNETs". Both groups occur mainly (but not exclusively) in people over 40, and are slightly more common in men, but some rare subtypes mainly occur in women or children.[23][24]
Exocrine cancers
[edit]The exocrine group is dominated by pancreatic adenocarcinoma (variations of this name may add "invasive" and "ductal"), which is by far the most common type, representing about 85% of all pancreatic cancers.[2] Nearly all these start in the ducts of the pancreas, as pancreatic ductal adenocarcinoma (PDAC).[25] This is despite the fact that the tissue from which it arises – the pancreatic ductal epithelium – represents less than 10% of the pancreas by cell volume, because it constitutes only the ducts (an extensive but capillary-like duct-system fanning out) within the pancreas.[26] This cancer originates in the ducts that carry secretions (such as enzymes and bicarbonate) away from the pancreas. About 60–70% of adenocarcinomas occur in the head of the pancreas.[2]
The next-most common type, acinar cell carcinoma of the pancreas, arises in the clusters of cells that produce these enzymes, and represents 5% of exocrine pancreas cancers.[27] Like the 'functioning' endocrine cancers described below, acinar cell carcinomas may cause over-production of certain molecules, in this case digestive enzymes, which may cause symptoms such as skin rashes and joint pain.
Cystadenocarcinomas account for 1% of pancreatic cancers, and they have a better prognosis than the other exocrine types.[27]
Pancreatoblastoma is a rare form, mostly occurring in childhood, and with a relatively good prognosis. Other exocrine cancers include adenosquamous carcinomas, signet ring cell carcinomas, hepatoid carcinomas, colloid carcinomas, undifferentiated carcinomas, and undifferentiated carcinomas with osteoclast-like giant cells. Solid pseudopapillary tumor is a rare low-grade neoplasm that mainly affects younger women, and generally has a very good prognosis.[2][28]
Pancreatic mucinous cystic neoplasms are a broad group of pancreas tumors that have varying malignant potential. They are being detected at a greatly increased rate as CT scans become more powerful and common, and discussion continues as how best to assess and treat them, given that many are benign.[29]
Neuroendocrine
[edit]The small minority of tumors that arise elsewhere in the pancreas are mainly pancreatic neuroendocrine tumors (PanNETs).[30] Neuroendocrine tumors (NETs) are a diverse group of benign or malignant tumors that arise from the body's neuroendocrine cells, which are responsible for integrating the nervous and endocrine systems. NETs can start in most organs of the body, including the pancreas, where the various malignant types are all considered to be rare. PanNETs are grouped into 'functioning' and 'nonfunctioning' types, depending on the degree to which they produce hormones. The functioning types secrete hormones such as insulin, gastrin, and glucagon into the bloodstream, often in large quantities, giving rise to serious symptoms such as low blood sugar, but also favoring relatively early detection. The most common functioning PanNETs are insulinomas and gastrinomas, named after the hormones they secrete. The nonfunctioning types do not secrete hormones in a sufficient quantity to give rise to overt clinical symptoms, so nonfunctioning PanNETs are often diagnosed only after the cancer has spread to other parts of the body.[31]
As with other neuroendocrine tumors, the history of the terminology and classification of PanNETs is complex.[30] PanNETs are sometimes called "islet cell cancers",[32] though they are now known to not actually arise from islet cells as previously thought.[31]
Signs and symptoms
[edit]
Since pancreatic cancer usually does not cause recognizable symptoms in its early stages, the disease is typically not diagnosed until it has spread beyond the pancreas itself.[4] This is one of the main reasons for the generally poor survival rates. Exceptions to this are the functioning PanNETs, where over-production of various active hormones can give rise to symptoms (which depend on the type of hormone).[33]
Common presenting symptoms of pancreatic adenocarcinoma include:
- Pain in the upper abdomen or back, often spreading from around the stomach to the back. The location of the pain can indicate the part of the pancreas where a tumor is located. The pain may be worse at night and may increase over time to become severe and unremitting.[27] It may be slightly relieved by bending forward. In the UK, about half of new cases of pancreatic cancer are diagnosed following a visit to a hospital emergency department for pain or jaundice. In up to two-thirds of people, abdominal pain is the main symptom, for 46% of the total accompanied by jaundice, with 13% having jaundice without pain.[12]
- Jaundice, a yellow tint to the whites of the eyes or skin, with or without pain, and possibly in combination with darkened urine, results when a cancer in the head of the pancreas obstructs the common bile duct as it runs through the pancreas.[34]
- Unexplained weight loss, either from loss of appetite, or loss of exocrine function resulting in poor digestion.[12]
- The tumor may compress neighboring organs, disrupting digestive processes and making it difficult for the stomach to empty, which may cause nausea and a feeling of fullness. The undigested fat leads to foul-smelling, fatty feces that are difficult to flush away.[12] Constipation is also common.[35]
- At least 50% of people with pancreatic adenocarcinoma have diabetes at the time of diagnosis.[2] While long-standing diabetes is a known risk factor for pancreatic cancer (see Risk factors), the cancer can itself cause diabetes, in which case recent onset of diabetes could be considered an early sign of the disease.[36] People over 50 who develop diabetes have eight times the usual risk of developing pancreatic adenocarcinoma within three years, after which the relative risk declines.[12]
Other findings
[edit]- Trousseau's syndrome – in which blood clots form spontaneously in the portal blood vessels (portal vein thrombosis), the deep veins of the extremities (deep vein thrombosis), or the superficial veins (superficial vein thrombosis) anywhere on the body – may be associated with pancreatic cancer, and is found in about 10% of cases.[3]
- Clinical depression has been reported in association with pancreatic cancer in some 10–20% of cases, and can be a hindrance to optimal management. The depression sometimes appears before the diagnosis of cancer, suggesting that it may be brought on by the biology of the disease.[3]
Other common manifestations of the disease include weakness and tiring easily, dry mouth, sleep problems, and a palpable abdominal mass.[35]
Symptoms of spread
[edit]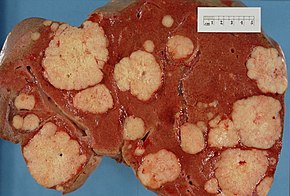
The spread of pancreatic cancer to other organs (metastasis) may also cause symptoms. Typically, pancreatic adenocarcinoma first spreads to nearby lymph nodes, and later to the liver or to the peritoneal cavity, large intestine, or lungs.[3] Uncommonly, it spreads to the bones or brain.[37]
Cancers in the pancreas may also be secondary cancers that have spread from other parts of the body. This is uncommon, found in only about 2% of cases of pancreatic cancer. Kidney cancer is by far the most common cancer to spread to the pancreas, followed by colorectal cancer, and then cancers of the skin, breast, and lung. Surgery may be performed on the pancreas in such cases, whether in hope of a cure or to alleviate symptoms.[38]
Risk factors
[edit]Risk factors for pancreatic adenocarcinoma include:[2][10][12][39][40][excessive citations]
- Age, sex, and ethnicity – the risk of developing pancreatic cancer increases with age. Most cases occur after age 65,[10] while cases before age 40 are uncommon. The disease is slightly more common in men than in women.[10] In the United States, it is over 1.5 times more common in African Americans, though incidence in Africa is low.[10]
- Cigarette smoking is the best-established avoidable risk factor for pancreatic cancer, approximately doubling risk among long-term smokers, the risk increasing with the number of cigarettes smoked and the years of smoking. The risk declines slowly after smoking cessation, taking some 20 years to return to almost that of nonsmokers.[41]
- Obesity – a body mass index greater than 35 increases relative risk by about half.[12][42]
- Family history – 5–10% of pancreatic cancer cases have an inherited component, where people have a family history of pancreatic cancer.[2][43] The risk escalates greatly if more than one first-degree relative had the disease, and more modestly if they developed it before the age of 50.[4] Most of the genes involved have not been identified.[2][44] Hereditary pancreatitis gives a greatly increased lifetime risk of pancreatic cancer of 30–40% to the age of 70.[3] Screening for early pancreatic cancer may be offered to individuals with hereditary pancreatitis on a research basis.[45] Some people may choose to have their pancreas surgically removed to prevent cancer from developing in the future.[3]
- Pancreatic cancer has been associated with these other rare hereditary syndromes: Peutz–Jeghers syndrome due to mutations in the STK11 tumor suppressor gene (very rare, but a very strong risk factor); dysplastic nevus syndrome (or familial atypical multiple mole and melanoma syndrome, FAMMM-PC) due to mutations in the CDKN2A tumor suppressor gene; autosomal recessive ataxia-telangiectasia and autosomal dominantly inherited mutations in the BRCA2 and PALB2 genes; hereditary non-polyposis colon cancer (Lynch syndrome); and familial adenomatous polyposis. PanNETs have been associated with multiple endocrine neoplasia type 1 (MEN1) and von Hippel Lindau syndromes.[2][3][4]
- Chronic pancreatitis appears to almost triple risk, and as with diabetes, new-onset pancreatitis may be a symptom of a tumor.[3] The risk of pancreatic cancer in individuals with familial pancreatitis is particularly high.[3][44]
- Diabetes mellitus is a risk factor for pancreatic cancer and (as noted in the Signs and symptoms section) new-onset diabetes may also be an early sign of the disease. People who have been diagnosed with type 2 diabetes for longer than 10 years may have a 50% increased risk, as compared with individuals without diabetes.[3] In 2021, Venturi reported that the pancreas is able to absorb in great quantity radioactive cesium (Cs-134 and Cs-137) causing chronic pancreatitis and probably pancreatic cancer with damage of pancreatic islands, causing type 3c (pancreatogenic) diabetes.[46] Chronic pancreatitis, pancreatic cancer and diabetes mellitus increased in contaminated populations, particularly children and adolescents, after Fukushima and Chernobyl nuclear incidents. At the same time, worldwide pancreatic diseases, diabetes and environmental radiocesium are increasing.
- Specific types of food (as distinct from obesity) have not been clearly shown to increase the risk of pancreatic cancer.[2][47] Dietary factors for which some evidence shows slightly increased risk include processed meat, red meat, and meat cooked at very high temperatures (e.g. by frying, broiling, or grilling).[47][48]
Alcohol
[edit]Drinking alcohol excessively is a major cause of chronic pancreatitis, which in turn predisposes to pancreatic cancer, but considerable research has failed to firmly establish alcohol consumption as a direct risk factor for pancreatic cancer. Overall, the association is consistently weak and the majority of studies have found no association, with smoking a strong confounding factor. The evidence is stronger for a link with heavy drinking, of at least six drinks per day.[3][49]
Pathophysiology
[edit]
Precancer
[edit]

Exocrine cancers are thought to arise from several types of precancerous lesions within the pancreas, but these lesions do not always progress to cancer, and the increased numbers detected as a byproduct of the increasing use of CT scans for other reasons are not all treated.[3] Apart from pancreatic serous cystadenomas, which are almost always benign, four types of precancerous lesion are recognized.
The first is pancreatic intraepithelial neoplasia (PanIN). These lesions are microscopic abnormalities in the pancreas and are often found in autopsies of people with no diagnosed cancer. These lesions may progress from low to high grade and then to a tumor. More than 90% of cases at all grades carry a faulty KRAS gene, while in grades 2 and 3, damage to three further genes – CDKN2A (p16), p53, and SMAD4 – are increasingly often found.[2]
A second type is the intraductal papillary mucinous neoplasm (IPMN). These are macroscopic lesions, which are found in about 2% of all adults. This rate rises to about 10% by age 70. These lesions have about a 25% risk of developing into invasive cancer. They may have KRAS gene mutations (40–65% of cases) and in the GNAS Gs alpha subunit and RNF43, affecting the Wnt signaling pathway.[2] Even if removed surgically, a considerably increased risk remains of pancreatic cancer developing subsequently.[3]
The third type, pancreatic mucinous cystic neoplasm (MCN), mainly occurs in women, and may remain benign or progress to cancer.[51] If these lesions become large, cause symptoms, or have suspicious features, they can usually be successfully removed by surgery.[3]
A fourth type of cancer that arises in the pancreas is the intraductal tubulopapillary neoplasm. This type was recognised by the WHO in 2010 and constitutes about 1–3% of all pancreatic neoplasms. Mean age at diagnosis is 61 years (range 35–78 years). About 50% of these lesions become invasive. Diagnosis depends on histology, as these lesions are very difficult to differentiate from other lesions on either clinical or radiological grounds.[52]
Invasive cancer
[edit]The genetic events found in ductal adenocarcinoma have been well characterized, and complete exome sequencing has been done for the common types of tumor. Four genes have each been found to be mutated in the majority of adenocarcinomas: KRAS (in 95% of cases), CDKN2A (also in 95%), TP53 (75%), and SMAD4 (55%). The last of these is especially associated with a poor prognosis.[3] SWI/SNF mutations/deletions occur in about 10–15% of the adenocarcinomas.[2] The genetic alterations in several other types of pancreatic cancer and precancerous lesions have also been researched.[3] Transcriptomics analyses and mRNA sequencing for the common forms of pancreatic cancer have found that 75% of human genes are expressed in the tumors, with some 200 genes more specifically expressed in pancreatic cancer as compared to other tumor types.[53][54]
PanNETs
[edit]The genes often found mutated in pancreatic neuroendocrine tumors (PanNETs) are different from those in exocrine pancreatic cancer.[55] For example, KRAS mutation is normally absent. Instead, hereditary MEN1 gene mutations give risk to MEN1 syndrome, in which primary tumors occur in two or more endocrine glands. About 40–70% of people born with a MEN1 mutation eventually develop a PanNet.[56] Other genes that are frequently mutated include DAXX, mTOR, and ATRX.[31]
Diagnosis
[edit]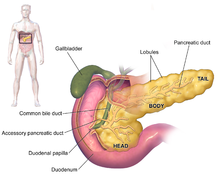

The symptoms of pancreatic adenocarcinoma do not usually appear in the disease's early stages, and they are not individually distinctive to the disease.[3][12][34] The symptoms at diagnosis vary according to the location of the cancer in the pancreas, which anatomists divide (from left to right on most diagrams) into the thick head, the neck, and the tapering body, ending in the tail.
Regardless of a tumor's location, the most common symptom is unexplained weight loss, which may be considerable. A large minority (between 35% and 47%) of people diagnosed with the disease will have had nausea, vomiting, or a feeling of weakness. Tumors in the head of the pancreas typically also cause jaundice, pain, loss of appetite, dark urine, and light-colored stools. Tumors in the body and tail typically also cause pain.[34]
People sometimes have recent onset of atypical type 2 diabetes that is difficult to control, a history of recent but unexplained blood vessel inflammation caused by blood clots (thrombophlebitis) known as Trousseau sign, or a previous attack of pancreatitis.[34] A doctor may suspect pancreatic cancer when the onset of diabetes in someone over 50 years old is accompanied by typical symptoms such as unexplained weight loss, persistent abdominal or back pain, indigestion, vomiting, or fatty feces.[12] Jaundice accompanied by a painlessly swollen gallbladder (known as Courvoisier's sign) may also raise suspicion, and can help differentiate pancreatic cancer from gallstones.[57]
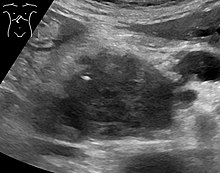
Medical imaging techniques, such as computed tomography (CT scan) and endoscopic ultrasound (EUS) are used both to confirm the diagnosis and to help decide whether the tumor can be surgically removed (its "resectability").[12] On contrast CT scan, pancreatic cancer typically shows a gradually increasing radiocontrast uptake, rather than a fast washout as seen in a normal pancreas or a delayed washout as seen in chronic pancreatitis.[58] Magnetic resonance imaging and positron emission tomography may also be used,[2] and magnetic resonance cholangiopancreatography may be useful in some cases.[34] Abdominal ultrasound is less sensitive and will miss small tumors, but can identify cancers that have spread to the liver and build-up of fluid in the peritoneal cavity (ascites).[12] It may be used for a quick and cheap first examination before other techniques.[59]

A biopsy by fine needle aspiration, often guided by endoscopic ultrasound, may be used where there is uncertainty over the diagnosis, but a histologic diagnosis is not usually required for removal of the tumor by surgery to go ahead.[12]
Liver function tests can show a combination of results indicative of bile duct obstruction (raised conjugated bilirubin, γ-glutamyl transpeptidase and alkaline phosphatase levels). CA19-9 (carbohydrate antigen 19.9) is a tumor marker that is frequently elevated in pancreatic cancer. However, it lacks sensitivity and specificity, not least because 5% of people lack the Lewis (a) antigen and cannot produce CA19-9. It has a sensitivity of 80% and specificity of 73% in detecting pancreatic adenocarcinoma, and is used for following known cases rather than diagnosis.[2][12]
Histopathology
[edit]The most common form of pancreatic cancer (adenocarcinoma) is typically characterized by moderately to poorly differentiated glandular structures on microscopic examination. There is typically considerable desmoplasia or formation of a dense fibrous stroma or structural tissue consisting of a range of cell types (including myofibroblasts, macrophages, lymphocytes and mast cells) and deposited material (such as type I collagen and hyaluronic acid). This creates a tumor microenvironment that is short of blood vessels (hypovascular) and so of oxygen (tumor hypoxia).[2] It is thought that this prevents many chemotherapy drugs from reaching the tumor, as one factor making the cancer especially hard to treat.[2][3]
| Cancer type | Relative incidence[11] | Microscopy findings[11] | Micrograph | Immunohistochemistry markers[11] | Genetic alterations[11] |
|---|---|---|---|---|---|
| Pancreatic ductal adenocarcinoma (PDAC) | 90% | Glands and desmoplasia | 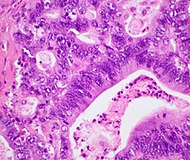 |
||
| Pancreatic acinar cell carcinoma (ACC) | 1% to 2% | Granular appearance | 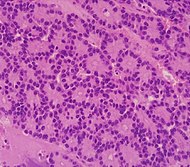
|
||
| Solid pseudopapillary tumor | Discohesive tumor nests surrounded by thin fibrous bands. |  Low and high magnification[60] |
|||
| Adenosquamous carcinoma | 1% to 4%[61] | Combination of gland-like cells and squamous epithelial cells. |  |
Positive for:
Negative for: |
|
| Pancreatic neuroendocrine tumor | 5% | Multiple nests of tumor cells | 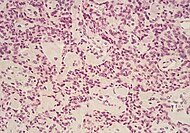 |
||
| Pre-cancer below for comparison: | |||||
| Precancer: Intraductal papillary mucinous neoplasm (IPMN) |
3% | Mucinous epithelial cells.[62] Growth within the pancreatic ducts.[63] | 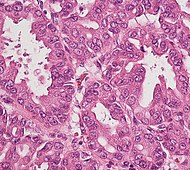
|
||
Staging
[edit]Exocrine cancers
[edit]Pancreatic cancer is usually staged following a CT scan.[34] The most widely used cancer staging system for pancreatic cancer is the one formulated by the American Joint Committee on Cancer (AJCC) together with the Union for International Cancer Control (UICC). The AJCC-UICC staging system designates four main overall stages, ranging from early to advanced disease, based on TNM classification of Tumor size, spread to lymph Nodes, and Metastasis.[64]
To help decide treatment, the tumors are also divided into three broader categories based on whether surgical removal seems possible: in this way, tumors are judged to be "resectable", "borderline resectable", or "unresectable".[65] When the disease is still in an early stage (AJCC-UICC stages I and II), without spread to large blood vessels or distant organs such as the liver or lungs, surgical resection of the tumor can normally be performed, if the patient is willing to undergo this major operation and is thought to be sufficiently fit.[12]
The AJCC-UICC staging system allows distinction between stage III tumors that are judged to be "borderline resectable" (where surgery is technically feasible because the celiac axis and superior mesenteric artery are still free) and those that are "unresectable" (due to more locally advanced disease); in terms of the more detailed TNM classification, these two groups correspond to T3 and T4 respectively.[3]
- Pancreatic cancer staging (TNM classification)
-
Stage T1 pancreatic cancer
-
Stage T2 pancreatic cancer
-
Stage T3 pancreatic cancer
-
Stage T4 pancreatic cancer
-
Pancreatic cancer in nearby lymph nodes – Stage N1

Locally advanced adenocarcinomas have spread into neighboring organs, which may be any of the following (in roughly decreasing order of frequency): the duodenum, stomach, transverse colon, spleen, adrenal gland, or kidney. Very often they also spread to the important blood or lymphatic vessels and nerves that run close to the pancreas, making surgery far more difficult. Typical sites for metastatic spread (stage IV disease) are the liver, peritoneal cavity and lungs, all of which occur in 50% or more of fully advanced cases.[66]
PanNETs
[edit]The 2010 WHO classification of tumors of the digestive system grades all the pancreatic neuroendocrine tumors (PanNETs) into three categories, based on their degree of cellular differentiation (from "NET G1" through to the poorly differentiated "NET G3").[24] The U.S. National Comprehensive Cancer Network recommends use of the same AJCC-UICC staging system as pancreatic adenocarcinoma.[67]: 52 Using this scheme, the stage-by-stage outcomes for PanNETs are dissimilar to those of the exocrine cancers.[68] A different TNM system for PanNETs has been proposed by the European Neuroendocrine Tumor Society.[24]
Prevention and screening
[edit]Apart from not smoking, the American Cancer Society recommends keeping a healthy weight, and increasing consumption of fruits, vegetables, and whole grains, while decreasing consumption of red and processed meat, although there is no consistent evidence this will prevent or reduce pancreatic cancer specifically.[69] A 2014 review of research concluded that there was evidence that consumption of citrus fruits and curcumin reduced risk of pancreatic cancer, while there was possibly a beneficial effect from whole grains, folate, selenium, and non-fried fish.[49]
In the general population, screening of large groups is not considered effective and may be harmful as of 2019,[70] although newer techniques, and the screening of tightly targeted groups, are being evaluated.[71][72] Nevertheless, regular screening with endoscopic ultrasound and MRI/CT imaging is recommended for those at high risk from inherited genetics.[4][59][72][73]
A 2019 meta-analysis found that use of aspirin might be negatively associated with the incidence risk of pancreatic cancer, but found no significant relationship with pancreatic cancer mortality.[74]
Management
[edit]Exocrine cancer
[edit]A key assessment that is made after diagnosis is whether surgical removal of the tumor is possible (see Staging), as this is the only cure for this cancer. Whether or not surgical resection can be offered depends on how much the cancer has spread. The exact location of the tumor is also a significant factor, and CT can show how it relates to the major blood vessels passing close to the pancreas. The general health of the person must also be assessed, though age in itself is not an obstacle to surgery.[3]
Chemotherapy and, to a lesser extent, radiotherapy are likely to be offered to most people, whether or not surgery is possible. Specialists advise that the management of pancreatic cancer should be in the hands of a multidisciplinary team including specialists in several aspects of oncology, and is, therefore, best conducted in larger centers.[2][3]
Surgery
[edit]
Surgery with the intention of a cure is only possible in around one-fifth (20%) of new cases.[12] Although CT scans help, in practice it can be difficult to determine whether the tumor can be fully removed (its "resectability"), and it may only become apparent during surgery that it is not possible to successfully remove the tumor without damaging other vital tissues. Whether or not surgical resection can be offered depends on various factors, including the precise extent of local anatomical adjacency to, or involvement of, the venous or arterial blood vessels,[2] as well as surgical expertise and a careful consideration of projected post-operative recovery.[75][76] The age of the person is not in itself a reason not to operate, but their general performance status needs to be adequate for a major operation.[12]
One particular feature that is evaluated is the encouraging presence, or discouraging absence, of a clear layer or plane of fat creating a barrier between the tumor and the vessels.[3] Traditionally, an assessment is made of the tumor's proximity to major venous or arterial vessels, in terms of "abutment" (defined as the tumor touching no more than half a blood vessel's circumference without any fat to separate it), "encasement" (when the tumor encloses most of the vessel's circumference), or full vessel involvement.[77]: 22 A resection that includes encased sections of blood vessels may be possible in some cases,[78][79] particularly if preliminary neoadjuvant therapy is feasible,[80][81][82] using chemotherapy[76][77]: 36 [83] and/or radiotherapy.[77]: 29–30
Even when the operation appears to have been successful, cancerous cells are often found around the edges ("margins") of the removed tissue, when a pathologist examines them microscopically (this will always be done), indicating the cancer has not been entirely removed.[2] Furthermore, cancer stem cells are usually not evident microscopically, and if they are present they may continue to develop and spread.[84][85] An exploratory laparoscopy (a small, camera-guided surgical procedure) may therefore be performed to gain a clearer idea of the outcome of a full operation.[86]

For cancers involving the head of the pancreas, the Whipple procedure is the most commonly attempted curative surgical treatment. This is a major operation which involves removing the pancreatic head and the curve of the duodenum together ("pancreato-duodenectomy"), making a bypass for food from the stomach to the jejunum ("gastro-jejunostomy") and attaching a loop of jejunum to the cystic duct to drain bile ("cholecysto-jejunostomy"). It can be performed only if the person is likely to survive major surgery and if the cancer is localized without invading local structures or metastasizing. It can, therefore, be performed only in a minority of cases. Cancers of the tail of the pancreas can be resected using a procedure known as a distal pancreatectomy, which often also entails removal of the spleen.[2][3] Nowadays, this can often be done using minimally invasive surgery.[2][3]
Although curative surgery no longer entails the very high death rates that occurred until the 1980s, a high proportion of people (about 30–45%) still have to be treated for a post-operative sickness that is not caused by the cancer itself. The most common complication of surgery is difficulty in emptying the stomach.[3] Certain more limited surgical procedures may also be used to ease symptoms (see Palliative care): for instance, if the cancer is invading or compressing the duodenum or colon. In such cases, bypass surgery might overcome the obstruction and improve quality of life but is not intended as a cure.[12]
Chemotherapy
[edit]После операции может быть предложена адъювантная химиотерапия гемцитабином или 5-FU , если человек достаточно подходит , после периода восстановления от одного до двух месяцев. [4][59] In people not suitable for curative surgery, chemotherapy may be used to extend life or improve its quality.[3] Перед операцией неоадъювантная химиотерапия или химиолучекатерапия могут использоваться в случаях, которые считаются «пограничными повторными» (см. Постановку ), чтобы снизить рак до уровня, где операция может быть полезной. В других случаях неоадъювантная терапия остается спорной, потому что она задерживает операцию. [ 3 ] [ 4 ] [ 87 ]
США Гемцитабин был одобрен Управлением по контролю за продуктами и лекарствами (FDA) в 1997 году, после того как в клиническом исследовании сообщалось об улучшении качества жизни и пятинедельном улучшении средней продолжительности выживаемости у людей с развитым раком поджелудочной железы. [ 88 ] Это было первое химиотерапевтическое лекарство, одобренное FDA, в первую очередь для конечной точки клинического испытания, не предпринимаемого. [ 89 ] Химиотерапия с использованием только гемцитабина была стандартом в течение примерно десяти лет, поскольку ряд испытаний проверял его в сочетании с другими лекарствами, не смогли продемонстрировать значительно лучшие результаты. Тем не менее, было обнаружено, что комбинация гемцитабина с эрлотинибом скромно увеличивается, а Erlotinib был лицензирован FDA для использования при раке поджелудочной железы в 2005 году. [ 90 ]
Режим Folfirinox химиотерапии с использованием четырех лекарств был обнаружен более эффективным, чем гемцитабин, но с существенными побочными эффектами, и, таким образом, подходит только для людей с хорошим состоянием производительности. Это также относится к белковому паклитакселу (Nab-Paclitaxel), который был лицензирован FDA в 2013 году для использования с гемцитабином при раке поджелудочной железы. [ 91 ] К концу 2013 года как Folfirinox, так и Nab-Paclitaxel с гемцитабином считались хорошим выбором для тех, кто способен терпеть побочные эффекты, и гемцитабин оставался эффективным вариантом для тех, кто не был. Ожидается испытания между двумя новыми вариантами, и испытания, расследование других вариаций, продолжаются. Тем не менее, изменения в последние несколько лет увеличились только на несколько месяцев. [ 88 ] Клинические испытания часто проводятся для новой адъювантной терапии. [ 4 ]
Лучевая терапия
[ редактировать ]Роль лучевой терапии как вспомогательного (адъювантного) лечения после потенциально лечебной операции была спорной с 1980 -х годов. [ 3 ] В начале 2000 -х европейскую исследовательскую группу исследований рака поджелудочной железы ( ESPAC ) показала прогностическое превосходство адъювантной химиотерапии по поводу химиолузиотерапии. [ 92 ] [ 93 ] [ 4 ] Европейское общество медицинской онкологии рекомендует, чтобы адъювантная лучевая терапия была использована только для людей, включенных в клинические испытания. [ 59 ] Тем не менее, в США продолжается постоянная тенденция быть более готовыми к использованию адъювантной лучевой терапии, чем в Европе. Многие клинические испытания протестировали различные комбинации лечения с 1980 -х годов, но не смогли урегулировать этот вопрос. [ 3 ] [ 4 ]
Радиотерапия может стать частью лечения, чтобы попытаться сократить опухоль в резекруемое состояние, но ее использование неоперабельных опухолей остается спорным, поскольку существуют противоречивые результаты клинических испытаний. Предварительные результаты одного испытания, представленные в 2013 году, «заметно уменьшали энтузиазм» для его использования на местном расширенном опухолях. [ 2 ]
Паннеты
[ редактировать ]Обработка паннетов, включая менее распространенные злокачественные типы, может включать ряд подходов. [ 67 ] [ 94 ] [ 95 ] [ 96 ] Некоторые небольшие опухоли менее 1 см. которые идентифицируются случайно, например, на КТ, выполненном для других целей, могут сопровождаться бдительным ожиданием . [ 67 ] Это зависит от оценочного риска хирургии, на которое влияет место опухоли и наличие других медицинских проблем . [ 67 ] Опухоли только в поджелудочной железе (локализованные опухоли) или с ограниченными метастазами, например, в печень, могут быть удалены операцией. Тип хирургии зависит от местоположения опухоли и степени распространения на лимфатические узлы. [ 24 ]
Для локализованных опухолей хирургическая процедура может быть гораздо менее обширной, чем типы хирургии, используемые для лечения аденокарциномы поджелудочной железы, описанной выше, но в остальном хирургические процедуры аналогичны экзокринным опухолям. Диапазон возможных результатов сильно варьируется; Некоторые типы имеют очень высокий уровень выживаемости после операции, в то время как другие имеют плохой взгляд. Поскольку вся эта группа редко, в руководящих принципах подчеркивается, что лечение должно проводиться в специализированном центре. [ 24 ] [ 31 ] Использование трансплантации печени может рассматриваться в некоторых случаях метастазирования печени. [ 97 ]
Для функционирующих опухолей, соматостатина аналоговый класс лекарств , таких как октреотид , может снизить чрезмерную продукцию гормонов. [ 24 ] Ланреотид может замедлить рост опухоли. [ 98 ] Если опухоль не поддается хирургическому удалению и вызывает симптомы, целевая терапия эверолимусом сунитинибом или может уменьшить симптомы и медленное прогрессирование заболевания. [ 31 ] [ 99 ] [ 100 ] Стандартная цитотоксическая химиотерапия, как правило, не очень эффективна для паннетов, но может использоваться, когда другие методы лечения лекарств не предотвращают прогрессирование заболевания, [ 31 ] или при плохо дифференцированном раке паннет. [ 101 ]
Облученная терапия иногда используется, если есть боль из -за анатомического расширения, например, метастазирования в кость. Некоторые паннеты поглощают специфические пептиды или гормоны, и эти паннеты могут реагировать на ядерной медициной терапию с помощью радиоактивно-меченных пептидов или гормонов, таких как iobenguane (йод-131-мибг). [ 102 ] [ 103 ] [ 104 ] [ 105 ] Радиочастотная абляция (RFA), криоабляция и эмболизация печеночной артерии также могут использоваться. [ 106 ] [ 107 ]
Паллиативная помощь
[ редактировать ]Паллиативная помощь - это медицинская помощь, которая фокусируется на лечении симптомов серьезных заболеваний, таких как рак и улучшение качества жизни. [ 108 ] Поскольку аденокарцинома поджелудочной железы обычно диагностируется после того, как она прогрессирует на продвинутую стадию, паллиативная помощь как лечение симптомов часто является единственным возможным лечением. [ 109 ]
Паллиативная помощь фокусируется не на лечении основного рака, а на лечении таких симптомов, как боль или тошнота, и может помочь в принятии решений, в том числе когда и если хосписная помощь будет полезна. [ 110 ] Боль может управляться с помощью таких лекарств, как опиоиды или процедурное вмешательство, с помощью нервного блока на целиакии (CPB). Это изменяет или, в зависимости от используемой техники, разрушает нервы, которые передают боль от живота. CPB является безопасным и эффективным способом уменьшения боли, что обычно уменьшает необходимость использования опиоидных обезболивающих, которые имеют значительные негативные побочные эффекты. [ 3 ] [ 111 ]
Другими симптомами или осложнениями, которые можно лечить с помощью паллиативной хирургии, являются обструкция путем опухоли кишечника или желчных протоков . небольшая металлическая трубка, называемая стентом, может быть вставлена Для последнего, которое происходит в более чем половине случаев, эндоскоп чтобы поддерживать протоки истощения. [ 34 ] Паллиативная помощь также может помочь лечить депрессию, которая часто сопровождается диагнозом рака поджелудочной железы. [ 3 ]
Как хирургические, так и усовершенствованные опухоли часто приводят к расстройствам пищеварительной системы из -за отсутствия экзокринных продуктов поджелудочной железы (экзокринная недостаточность). С ними можно лечить путем принятия панкреатина , который содержит промышленные ферменты поджелудочной железы, и лучше всего воспринимается с едой. [ 12 ] Сложность в опорожении желудка (задержка опорожнения желудка) распространена и может быть серьезной проблемой, связанной с госпитализацией. Лечение может включать в себя различные подходы, в том числе истощение желудка с помощью назогастральной аспирации и лекарств, называемых ингибиторами протона насоса или H 2 антагонистам , которые уменьшают выработку желудочной кислоты . [ 12 ] Препараты, такие как метаклопрамид, также могут использоваться для очистки содержимого желудка.
Результаты
[ редактировать ]| Клиническая стадия | Пятилетняя выживаемость США (%) на 1992–1998 гг. Диагностики | |
|---|---|---|
| Экзокринный рак поджелудочной железы | Нейроэндокринный лечение операцией | |
| Это / я | 14 | 61 |
| Одинокий | 12 | |
| Изображения / II | 7 | 52 |
| IIB | 5 | |
| Iii | 3 | 41 |
| IV | 1 | 16 |
Аденокарцинома поджелудочной железы и другие менее распространенные экзокринные раковые заболевания имеют очень плохой прогноз , так как они обычно диагностируются на поздней стадии, когда рак уже продвинулся на местном уровне или распространяется на другие части организма. [ 2 ] Результаты намного лучше для паннетов: многие из них являются доброкачественными и полностью без клинических симптомов, и даже те случаи, не поддающиеся лечению операцией с [ 65 ] Хотя перспективы значительно варьируются в зависимости от типа. [ 33 ]
Для локально продвинутых и метастатических аденокарцином поджелудочной железы, которые вместе составляют более 80% случаев, многочисленные испытания, сравнивающие режимы химиотерапии, показали увеличение времени выживания, но не более чем на один год. [ 2 ] [ 88 ] Общая пятилетняя выживаемость рака поджелудочной железы в США улучшилась с 2% в случаях, диагностированных в 1975–1977 годах, и 4% в 1987–1989 годах до 6% в 2003–2009 годах. [ 112 ] В менее 20% случаев аденокарциномы поджелудочной железы с диагнозом локализованного и небольшого ракового роста (менее 2 см на стадии T1), около 20% американцев выживают до пяти лет. [ 21 ]
Около 1500 генов связаны с результатами при аденокарциноме поджелудочной железы. Они включают в себя как неблагоприятные гены, где высокая экспрессия связана с плохим исходом, например, C-MET и MUC-1 , так и благоприятные гены, где высокая экспрессия связана с лучшей выживаемостью, например, транскрипционного фактора PELP1 . [ 53 ] [ 54 ]
Распределение
[ редактировать ]
В 2015 году рак поджелудочной железы всех типов привел к 411 600 смерти во всем мире. [ 8 ] В 2014 году, по оценкам, 46 000 человек в США, как ожидается, поставили диагноз рак поджелудочной железы и 40 000, чтобы умереть от него. [ 2 ] Хотя на него приходится всего 2,5% новых случаев, рак поджелудочной железы отвечает за 6% смертей от рака в год. [ 113 ] Это седьмая по величине причина смерти от рака во всем мире. [ 10 ] Рак поджелудочной железы является пятой наиболее широкой причиной смерти от рака в Соединенном Королевстве, [ 19 ] и третий самый обществен в Соединенных Штатах. [ 20 ]
Во всем мире рак поджелудочной железы является 11-м самым распространенным раком у женщин и 12-й наиболее крупной у мужчин. [ 10 ] Большинство зарегистрированных случаев встречаются в развитых странах . [ 10 ] Люди из Соединенных Штатов имеют средний риск жизни около 1 на 67 (или 1,5%) развития заболевания, [ 114 ] немного выше, чем фигура для Великобритании. [ 115 ] Болезнь чаще встречается у мужчин, чем у женщин, [ 2 ] [ 10 ] Хотя разница в показателях сузилась в течение последних десятилетий, вероятно, отражает более раннее увеличение курения женщин. В Соединенных Штатах риск для афроамериканцев более 50% выше, чем для белых , но показатели в Африке и Восточной Азии намного ниже, чем в Северной Америке или Европе. Соединенные Штаты, Центральная и Восточная Европа, а также Аргентина и Уругвай имеют высокий уровень. [ 10 ]
Паннеты
[ редактировать ]Ежегодная заболеваемость клинически признанных нейроэндокринных опухолей поджелудочной железы (паннеты) низкая (около 5 на миллион человек-лет) и преобладает не функционирующими типами. [ 28 ] Считается, что где-то между 45% и 90% паннетов относится к нефункциональным типам. [ 24 ] [ 31 ] Исследования вскрытия довольно часто обнаруживали распространенность небольшие паннеты, что позволяет предположить, что опухолей , которые остаются инертными и бессимптомными, может быть относительно высокой. [ 31 ] Считается, что общие паннеты составляют от 1 до 2% всех опухолей поджелудочной железы. [ 28 ] Определение и классификация паннетов с течением времени изменились, влияя на то, что известно об их эпидемиологии и клинической значимости. [ 55 ]
История
[ редактировать ]Распознавание и диагноз
[ редактировать ]Самое раннее признание рака поджелудочной железы было приписано итальянскому ученым 18-го века Джованни Баттиста Морганьи , историческому отцу современной анатомической патологии , который утверждал, что проследил несколько случаев рака в поджелудочной железе. Многие врачи 18-го и 19-го века скептически относились к существованию заболевания, учитывая аналогичный вид панкреатита. Некоторые отчеты о случаях были опубликованы в 1820 -х и 1830 -х годах, а подлинная гистопатологическая диагноз в конечном итоге был зарегистрирован американским врачом Джейкобом Мендом Да Коста , который также сомневался в надежности интерпретаций Моргагни. К началу 20-го века рак главы поджелудочной железы стал устоявшимся диагнозом. [ 116 ]
Что касается распознавания паннетов, вероятность рака островковых клеток была первоначально предложена в 1888 году. Первый случай гиперинсулинизма из-за опухоли этого типа был зарегистрирован в 1927 году. Признание неинсулинского типа PANNET, как правило Приписано американским хирургам Р. М. Золлингеру и Э. Х. Эллисону, которые дали свои названия синдрому Золлингер-Эллисон , после постулирования существования гастриновой опухоли поджелудочной железы в отчете о двух случаях необычайно тяжелых язв , опубликованных в 1955 году. [ 116 ] В 2010 году ВОЗ рекомендовал назвать паннеты как «нейроэндокринные», а не «эндокринные» опухоли. [ 30 ]
Небольшие предраковые новообразования для многих раковых заболеваний поджелудочной железы обнаруживаются с значительно повышенными показателями при современной медицинской визуализации. Один тип, внутрипроводящая папиллярная муциновая новообразование (IPMN) была впервые описана японскими исследователями в 1982 году. В 2010 году было отмечено, что: «В течение следующего десятилетия в этом отчете было уделено мало внимания; однако в течение последующих 15 лет там там был виртуальным взрывом в распознавании этой опухоли ». [ 66 ]
Операция
[ редактировать ]Первый зарегистрированный частичная панкреатодуоденэктомия была выполнена итальянским хирургом Алессандро Кодивилья в 1898 году, но пациент выжил только за 18 дней, прежде чем поддаться осложнениям. Ранние операции были скомпрометированы отчасти из -за ошибочных убеждений, что люди умрут, если их двенадцатиперстная кишка будет удалена, а также сначала, если поток соков поджелудочной железы прекратился. Позже считалось, что также ошибочно, что проток поджелудочной железы можно просто связать без серьезных неблагоприятных последствий; На самом деле, это очень часто протекает позже. В 1907–1908 годах, после некоторых более неудачных операций других хирургов, французские хирурги пробовали экспериментальные процедуры. [ 117 ]
В 1912 году немецкий хирург Уолтер Кауш был первым, кто удалил большую часть двенадцатиперстной кишки и поджелудочной железы вместе ( en bloc ). Это было в Бреслау, теперь Вроцлав , в Польше. В 1918 году было продемонстрировано, что в операциях на собаках можно выжить даже после полного удаления двенадцатиперстной кишки, но такого результата не сообщалось о человеческой хирургии до 1935 года, когда американский хирург Аллен Олд -оттенок Уиппл опубликовал результаты серии из трех операций в Пресвитерианской больнице Колумбии в Нью -Йорке. Только один из пациентов полностью удалил двенадцатиперстную силу, но он выжил в течение двух лет, прежде чем умирать от метастазирования в печень.
Первая операция была незапланированной, так как рак был обнаружен только в операционной. Успех Уиппла показал путь на будущее, но операция оставалась сложной и опасной до последних десятилетий. Он опубликовал несколько уточнений в своей процедуре, включая первое полное удаление двенадцатиперстной кишки в 1940 году, но он выполнил всего 37 операций. [ 117 ]
Открытие в конце 1930-х годов о том, что витамин К предотвращал кровотечение с помощью желтухи и развитие переливания крови в качестве повседневного процесса, оба улучшили послеоперационную выживаемость, [ 117 ] Но около 25% людей никогда не покидали больницу живой еще в 1970 -х годах. [ 118 ] В 1970 -х годах группа американских хирургов писала, побуждая, что процедура была слишком опасной и должна быть заброшена. С тех пор результаты в более крупных центрах значительно улучшились, а смертность от операции часто составляет менее 4%. [ 26 ]
В 2006 году был опубликован отчет о серии из 1000 последовательных панкреатико-дюоденэктомий, выполненных одним хирургом из больницы Джона Хопкинса в период с 1969 по 2003 год. Уровень этих операций неуклонно увеличивался в течение этого периода, и только три из них до 1980 года, и и. Среднее время работы сократилось с 8,8 часов в 1970 -х годах до 5,5 часов в 2000 -х годах, а смертность в течение 30 дней или в больнице составила всего 1%. [ 117 ] [ 118 ] Другая серия из 2050 операций в Массачусетской больнице общего профиля между 1941 и 2011 годами показала аналогичную картину улучшения. [ 119 ]
Направления исследований
[ редактировать ]Этот раздел должен быть обновлен . ( Май 2023 г. ) |
На ранней стадии исследования рака поджелудочной железы включают исследования генетики и раннего обнаружения, лечение на разных стадиях рака, хирургические стратегии и целевую терапию , такие как ингибирование факторов роста , иммунная терапия и вакцины . [ 44 ] [ 120 ] [ 121 ] [ 122 ] [ 123 ] Билевые кислоты могут играть роль в канцерогенезе рака поджелудочной железы. [ 124 ] [ 125 ]
Ключевым вопросом является время событий по мере развития и прогрессирования заболевания, особенно роль диабета , [ 120 ] [ 36 ] и как и когда болезнь распространяется. [ 126 ] Знание того, что новое начало диабета может быть ранним признаком заболевания, может способствовать своевременной диагностике и профилактике, если может быть разработана работоспособная стратегия скрининга. [ 120 ] [ 36 ] [ 127 ] Европейское исследование наследственного панкреатита и семейного рака поджелудочной железы (Europac) стремится определить, подходит ли регулярный скрининг для людей с семейным анамнезом заболевания. [ 128 ]
хирургия замочной скважины ( лапароскопия ), а не процедура Уиппла , особенно с точки зрения времени восстановления. Оценивается [ 129 ] Необратимая электропорация является относительно новой методикой абляции с потенциалом для понижения и продления выживаемости у людей с локально распространенным заболеванием, особенно для опухолей в близости к пери-панкреатической сосудам без риска сосудистой травмы. [ 130 ] [ 131 ]
Предпринимаются усилия по разработке новых лекарств, в том числе те, которые нацелены на молекулярные механизмы для начала рака, [ 132 ] [ 133 ] стволовые клетки , [ 85 ] и пролиферация клеток . [ 133 ] [ 134 ] Дальнейший подход включает использование иммунотерапии , такой как онколитические вирусы . [ 135 ] Галектин -специфические механизмы микроокружения опухоли изучаются. [ 136 ]
Наночастицы помогают в устойчивом и целенаправленном высвобождении режима лекарственного средства для участков рака/опухоли, а не влияют на здоровые клетки, что приводит к незначительной или без токсичности. [ 137 ]
Смотрите также
[ редактировать ]- Желудочно -кишечный рак
- Сеть действия рака поджелудочной железы (организация в США)
- Lustgarten Foundation для исследований рака поджелудочной железы (организация в США)
- Список людей с диагнозом рак поджелудочной железы
Ссылки
[ редактировать ]- ^ Jump up to: а беременный в дюймовый и фон глин «Версия пациента с раком поджелудочной железы (PDQ®)» . Национальный институт рака. Национальные институты здравоохранения. 17 апреля 2014 года. Архивировано с оригинала 5 июля 2014 года . Получено 8 июня 2014 года .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. ведущий с Т в v В х и С аа Аб и объявление Но из Ryan DP, 2014 Bardeance N (сентябрь 2014 г.). Полем Новый английский журнал медицины 371 (11): 1039–4 doi : 10.1056/ nejmra1 PMID 2520767 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. ведущий с Т в v В х и С аа Аб и объявление Но из в Вольфганг К.Л., Герман Дж. М., Лахеру Д.А., Кляйн А.П., Эрдек М.А., Фишман Эк и др. (Сентябрь 2013 г.). «Недавний прогресс в раке поджелудочной железы» . CA: Журнал рака для клиницистов . 63 (5): 318–48. doi : 10.3322/caac.21190 . PMC 3769458 . PMID 23856911 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k Винсент А., Герман Дж., Шулик Р., Хрубан Р.Х., Гоггинс М. (август 2011 г.). «Рак поджелудочной железы» (PDF) . Лансет . 378 (9791): 607–20. doi : 10.1016/s0140-6736 (10) 62307-0 . PMC 3062508 . PMID 21620466 . Архивировано из оригинала (PDF) 12 января 2015 года.
- ^ Jump up to: а беременный "Можно ли предотвратить рак поджелудочной железы?" Полем Американское онкологическое общество. 11 июня 2014 года. Архивировано с оригинала 13 ноября 2014 года . Получено 13 ноября 2014 года .
- ^ Jump up to: а беременный «Пятилетняя выживаемость рака поджелудочной железы увеличивается до 12%» . Панкан . 2023. Архивировано с оригинала 4 марта 2023 года . Получено 3 марта 2023 года .
- ^ Vos T, Allen C, Arora M, Barber RM, Bhutta Za, Brown A, et al. (GBD 2015 заболевания и заболеваемость и распространенность сотрудников) (октябрь 2016 г.). «Глобальная, региональная и национальная заболеваемость, распространенность и годы жили с инвалидностью для 310 заболеваний и травм, 1990–2015 гг.: Систематический анализ глобального исследования болезни 2015 года» . Lancet . 388 (10053): 1545–1602. doi : 10.1016/s0140-6736 (16) 31678-6 . PMC 5055577 . PMID 27733282 .
- ^ Jump up to: а беременный в Ван Х., Нагхави М., Аллен С., Барбер Р.М., Бхутта З.А., Картер А. и др. (GBD 2015 Смертность и причины смерти сотрудников) (октябрь 2016 г.). «Глобальная, региональная и национальная продолжительность жизни, смертность от всех причин и конкретная смертность по причине 249 причин смерти, 1980–2015 гг.: Систематический анализ глобального исследования болезни 2015 года» . Lancet . 388 (10053): 1459–1544. doi : 10.1016/s0140-6736 (16) 31012-1 . PMC 5388903 . PMID 27733281 .
- ^ «Что такое рак? Определение рака» . Национальный институт рака, Национальный институт здравоохранения. 7 марта 2014 года. Архивировано с оригинала 25 июня 2014 года . Получено 5 декабря 2014 года .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. ведущий с Т Мировой отчет о раке . Всемирная организация здравоохранения. 2014. Глава 5.7. ISBN 978-92-832-0429-9 .
- ^ Jump up to: а беременный в дюймовый и Если иное не указано в коробках, ссылка: Pishvaian MJ, Brody Jr (март 2017 г.). «Терапевтические последствия молекулярного подтипирования для рака поджелудочной железы» . Онкология . 31 (3): 159–66, 168. PMID 28299752 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. ведущий с Т в v В Бонд-Смит Г., Банга Н., Хаммонд Т.М., Имбер С.Дж. (май 2012 г.). «Аденокарцинома поджелудочной железы». BMJ . 344 (май16 1): E2476. doi : 10.1136/bmj.e2476 . PMID 22592847 . S2CID 206894869 .
- ^ «Заявление о рекомендации проекта: Рак поджелудочной железы: скрининг» . Целевая группа по профилактическим услугам США . Получено 11 февраля 2019 года .
- ^ Амри Ф., Белхайат С., Йезано А., Кулали Х, Джаби Р., Зазур А. и др. (Сентябрь 2023 г.). «Связь между раком поджелудочной железы и диабетом: понимание ретроспективного когортного исследования» . BMC Рак . 23 (1): 856. DOI : 10.1186/S12885-023-11344-W . PMC 10496157 . PMID 37697301 .
- ^ Sun Y, He x, Sun Y (27 сентября 2023 г.). «Красный и обработанный риск рака мяса и поджелудочной железы: метаанализ» . Границы в питании . 10 : 1249407. DOI : 10.3389/fnut.2023.1249407 . PMC 10565855 . PMID 37829734 .
- ^ Larsson SC, Wolk A (январь 2012 г.). «Красное и обработанное потребление мяса и риск развития рака поджелудочной железы: метаанализ проспективных исследований» . Британский журнал рака . 106 (3): 603–607. doi : 10.1038/bjc.2011.585 . PMC 3273353 . PMID 22240790 .
- ^ Rohrmann S, Linseisen J, Nöthlings U, Overvad K, Egeberg R, Tjønneland A, et al. (Февраль 2013 г.). «Потребление мяса и рыбы и риск рака поджелудочной железы: результаты европейского проспективного исследования рака и питания» . Международный журнал рака . 132 (3): 617–624. doi : 10.1002/ijc.27637 . PMID 22610753 . S2CID 2613568 .
- ^ Барду М, Ле Рэй I (декабрь 2013 г.). «Лечение рака поджелудочной железы: повествовательный обзор исследований экономической эффективности». Лучшая практика и исследования. Клиническая гастроэнтерология . 27 (6): 881–892. doi : 10.1016/j.bpg.2013.09.006 . PMID 24182608 .
- ^ Jump up to: а беременный «Факты и цифры рака - почему мы существуем» . Фонд исследований рака поджелудочной железы . Получено 5 апреля 2019 года .
- ^ Jump up to: а беременный «Рак поджелудочной железы - факты по статистике рака» . Провидец . Получено 4 апреля 2019 года .
- ^ Jump up to: а беременный «Правообразовательная версия для лечения рака поджелудочной железы (PDQ®)» . Национальный институт рака. Национальные институты здравоохранения. 21 февраля 2014 года. Архивировано с оригинала 22 октября 2014 года . Получено 24 ноября 2014 года . "Самая высокая скорость излечения происходит, если опухоль действительно локализована в поджелудочной железе; однако, эта стадия заболевания составляет менее 20% случаев. И нет расширения за пределами капсулы поджелудочной железы, полная хирургическая резекция по-прежнему связана с низкой актуарной пятилетней выживаемостью от 18% до 24% ».
- ^ Wang Y, Miller FH, Chen Ze, Merrick L, Mortele KJ, Hoff FL, et al. (2011). «Диффузионное взвешенное МР-визуализация твердых и кистозных поражений поджелудочной железы». Рентгенография . 31 (3): E47 - E64. doi : 10.1148/rg.313105174 . PMID 21721197 .
- ^ Харрис Р.Е. (2013). «Эпидемиология рака поджелудочной железы» . Эпидемиология хронического заболевания . Джонс и Бартлетт. С. 181–190. ISBN 978-0-7637-8047-0 Полем Архивировано с оригинала 24 июня 2016 года.
- ^ Jump up to: а беременный в дюймовый и фон глин Öberg K, Knigge U, Kwekkeboom D, Perren A, et al. (Руководящие принципы ESMO) (Рабочая группа ESMO) (октябрь 2012 г.). «Нейроэндокринная желудочная панкреатическая опухоли: рекомендации по клинической практике ESMO для диагностики, лечения и последующего наблюдения» . Анналы онкологии . 23 Suppl 7 (Suppl 7): VII124 - VII130. doi : 10.1093/annonc/mds295 . PMID 22997445 . ( В таблице 5 изложена предложенная система постановки TNM для паннетов.)
- ^ Справочник по раку поджелудочной железы . Нью -Йорк: Спрингер. 2009. с. 288. ISBN 978-0-387-77497-8 Полем Архивировано с оригинала 10 сентября 2017 года . Получено 12 июня 2016 года .
- ^ Jump up to: а беременный Говиндан Р. (2011). Девита, Хеллман и Рак Розенберга: Рак: принципы и практика онкологии (9 -е изд.). Липпинкотт Уильямс и Уилкинс. Глава 35: Рак поджелудочной железы: хирургическое лечение. ISBN 978-1-4511-0545-2 Полем Онлайн -издание, с обновлениями до 2014 года
- ^ Jump up to: а беременный в Tobias JS, Hochhauser D (2014). Рак и его лечение (7 -е изд.). Джон Уайли и сыновья. п. 297. ISBN 978-1-118-46871-5 .
- ^ Jump up to: а беременный в «Типы опухолей поджелудочной железы» . Sol Goldman Pancreas Range Research Center . Джонс Хопкинс Медицина. 2012. Архивировано с оригинала 8 октября 2014 года . Получено 18 ноября 2014 года .
- ^ Фаррелл Дж.Дж., Фернандес-дель Кастильо С (июнь 2013 г.). «Кистовые новообразования поджелудочной железы: вопросы управления и без ответа». Гастроэнтерология . 144 (6): 1303–15. doi : 10.1053/j.gastro.2013.01.073 . PMID 23622140 .
- ^ Jump up to: а беременный в Деноминация паннет соответствует руководящим принципам ВОЗ для классификации опухолей пищеварительной системы «Кто классификация опухолей пищеварительной системы - NLM Catalog - NCBI» . Архивировано с оригинала 9 сентября 2017 года . Получено 7 сентября 2017 года . Опубликовано в 2010 году. Исторически паннеты также упоминались различными терминами и все еще обычно называют «эндокринные опухоли поджелудочной железы». Видеть: Klimstra DS, Modlin IR, Coppola D, Lloyd RV, Suster S (август 2010 г.). «Патологическая классификация нейроэндокринных опухолей: обзор систем номенклатуры, оценки и постановки» . Поджелудочная железа . 39 (6): 707–12. doi : 10.1097/mpa.0b013e3181ec124e . PMID 20664470 . S2CID 3735444 .
- ^ Jump up to: а беременный в дюймовый и фон глин час Бернс В.Р., Эдил Б.Х. (март 2012 г.). «Нейроэндокринная опухоли поджелудочной железы: руководящие принципы для управления и обновления». Текущие варианты лечения в онкологии . 13 (1): 24–34. doi : 10.1007/s11864-011-0172-2 . PMID 22198808 . S2CID 7329783 .
- ^ Система индексации медицинских заголовков относится к «островкому клеточному раку», которая подразделяется на гастриному, глюкагонома , соматостатиному и Vipoma . См.: Сетчатое дерево 2014 года в «Неоплазмах поджелудочной железы [C04.588.322.475]» Архивировано 19 марта 2016 года на машине Wayback 16 октября 2014 г.
- ^ Jump up to: а беременный «Опухоли островковых клеток поджелудочной железы / эндокринные новообразования поджелудочной железы» . Sol Goldman Pancreas Range Research Center . Джонс Хопкинс Медицина. 2012. Архивировано из оригинала 5 января 2015 года . Получено 5 января 2015 года .
- ^ Jump up to: а беременный в дюймовый и фон глин De la Cruz MS, Young AP, Ruffin Mt (апрель 2014 г.). «Диагностика и лечение рака поджелудочной железы». Американский семейный врач . 89 (8): 626–32. PMID 24784121 .
- ^ Jump up to: а беременный Альбертс С.Р., Голдберг Р.М. (2009). «Глава 9: рак желудочно -кишечного тракта» . В Casciato Da, Territo MC (ред.). Руководство по клинической онкологии . Липпинкотт Уильямс и Уилкинс. С. 188–236 . ISBN 978-0-7817-6884-9 .
- ^ Jump up to: а беременный в Pannala R, Basu A, Petersen GM, Chari St (январь 2009 г.). «Новый диабет: потенциальный ключ к ранней диагностике рака поджелудочной железы» . Lancet. Онкология . 10 (1): 88–95. doi : 10.1016/s1470-2045 (08) 70337-1 . PMC 2795483 . PMID 19111249 .
- ^ «Глава 15; поджелудочная железа» (PDF) . Руководство для постановки рака (2 -е изд.). Американский совместный комитет по раку. С. 95–98. Архивировано (PDF) из оригинала 29 ноября 2014 года. См. С. 95 для цитирования, касающейся «... меньшей степени участия костей, мозга и других анатомических мест».
- ^ Sperti C, Moletta L, Patanè G (октябрь 2014 г.). «Метастатические опухоли в поджелудочную железу: роль хирургии» . Всемирный журнал желудочно -кишечной онкологии . 6 (10): 381–92. doi : 10.4251/wjgo.v6.i10.381 . PMC 4197429 . PMID 25320654 .
- ^ «Причины рака поджелудочной железы» . Выбор NHS . Национальная служба здравоохранения, Англия. 7 октября 2014 года. Архивировано с оригинала 6 ноября 2014 года . Получено 5 декабря 2014 года .
- ^ Андерсон Л.Н., Коттерчио М., Галлингер С (август 2009 г.). «Образ жизни, диета и факторы истории болезни, связанные с риском рака поджелудочной железы в Онтарио, Канада» . Рак причины и контроль . 20 (6): 825–834. doi : 10.1007/s10552-009-9303-5 . PMC 3907069 . PMID 19194662 .
- ^ Bosetti C, Lucenteforte E, Silverman DT, Petersen G, Bracci PM, Ji Bt, et al. (Июль 2012 г.). «Курение сигарет и рак поджелудочной железы: анализ Международного консорциума рака поджелудочной железы (PANC4)» . Анналы онкологии . 23 (7): 1880–88. doi : 10.1093/annonc/mdr541 . PMC 3387822 . PMID 22104574 .
- ^ De Rubeis V, Cotterchio M, Smith BT, Griffith LE, Borgida A, Gallinger S, et al. (Сентябрь 2019). «Траектории индекса массы тела, от подросткового до старшего возраста и риска рака поджелудочной железы; популяционное исследование случай-контроль в Онтарио, Канада» . Рак причины и контроль . 30 (9): 955–966. doi : 10.1007/s10552-019-01197-9 . PMC 6685923 . PMID 31230151 .
- ^ Peters ML, Tseng JF, Miksad RA (июль 2016 г.). «Генетическое тестирование при аденокарциноме протоков поджелудочной железы: последствия для профилактики и лечения» . Клиническая терапия . 38 (7): 1622–35. doi : 10.1016/j.clinthera.2016.03.006 . PMID 27041411 .
- ^ Jump up to: а беременный в Резник Р., Хендифар А.Е., Тули Р. (2014). «Генетические детерминанты и потенциальные терапевтические мишени для аденокарциномы поджелудочной железы» . Границы в физиологии . 5 : 87. doi : 10.3389/fphys.2014.00087 . PMC 3939680 . PMID 24624093 .
- ^ Greenhalf W, Grocock C, Harcus M, Neoptolemos J (май 2009 г.). «Скрининг семей с высоким риском на предмет рака поджелудочной железы». Панкреатология . 9 (3): 215–22. doi : 10.1159/000210262 . PMID 19349734 . S2CID 29100310 .
- ^ Вентури (август 2021 г.). «Цезиум в биологии, раке поджелудочной железы и споров в высоких и низких радиационных повреждениях. Удооценки, экологические, геополитические и экономические аспекты» . Международный журнал экологических исследований и общественного здравоохранения . 18 (17): 8934. DOI : 10.3390/ijerph18178934 . PMC 8431133 . PMID 34501532 .
 Текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Jump up to: а беременный «Факты и цифры рака 2014» (PDF) . Американское онкологическое общество . Архивировано (PDF) из оригинала 18 декабря 2014 года . Получено 5 января 2015 года . , с. 19, «Хотя доказательства все еще накапливаются, потребление красного или обработанного мяса или мясо, приготовленное при очень высоких температурах, могут немного увеличить риск».
- ^ Larsson SC, Wolk A (январь 2012 г.). «Красное и обработанное потребление мяса и риск развития рака поджелудочной железы: метаанализ проспективных исследований» . Британский журнал рака . 106 (3): 603–07. doi : 10.1038/bjc.2011.585 . PMC 3273353 . PMID 22240790 .
- ^ Jump up to: а беременный Перикул М., Росси Р.Е., Мандайр Д., Уай и Т., Каплин М.Е. (январь 2014 г.). «Питание и рак поджелудочной железы». Противоопухолевые исследования . 34 (1): 9–21. PMID 24403441 .
- ^ Hackeng Wm, Hruban RH, Soperhaus GJ, Brosens LA (июнь 2016 г.). «Хирургическая и молекулярная патология новообразований поджелудочной железы» . Диагностическая патология . 11 (1): 47. doi : 10.1186/s13000-016-0497-z . PMC 4897815 . PMID 27267993 . (Распределено в соответствии с Условиями Атрибуции Creative Commons Attribution 4.0 Международная лицензия ( http://creativecommons.org/licenses/by/4.0/ )), Название и оптимизация изображения: Микаэль Häggström, MD
- ^ Delpu Y, Hanoun N, Lulka H, Sicard F, Swerves J, Buscail L, et al. (Март 2011 г.). «Генетические и эпигенетические изменения в канцерогенезе поджелудочной железы» . Текущая геномика . 12 (1): 15–24. doi : 10.2174/138920211794520132 . PMC 3129039 . PMID 21886451 .
- ^ Руни Сл, Ши Дж (октябрь 2016 г.). «Недооплазм внутрипроцесс -тубулопапиллярных поджелудочной железы: обновление с точки зрения патолога» . Архив патологии и лабораторной медицины . 140 (10): 1068–73. doi : 10.5858/arpa.2016-0207-ra . PMID 27684978 .
- ^ Jump up to: а беременный «Протеом патологии человека при раке поджелудочной железы - атлас белка человека» . www.proteinatlas.org . Получено 28 сентября 2017 года .
- ^ Jump up to: а беременный Улен М., Чжан С., Ли С., Шестедт Е., Фагерберг Л., Бидхори Г. и др. (Август 2017). «Атлас патологии транскриптома рака человека» . Наука . 357 (6352): EAAN2507. doi : 10.1126/science.aan2507 . PMID 28818916 .
- ^ Jump up to: а беременный Льюис Ма, Яо Дж.С. (февраль 2014 г.). «Молекулярная патология и генетика желудочно -кишечных нейроэндокринных опухолей». Современное мнение о эндокринологии, диабете и ожирении . 21 (1): 22–27. doi : 10.1097/med.0000000000000033 . PMID 24310147 . S2CID 31094880 .
- ^ Thakker RV, Newey PJ, Walls GV, Bilezikian J, Dralle H, Ebeling PR, et al. (Сентябрь 2012 г.). «Руководство по клинической практике для множественной эндокринной неоплазии типа 1 (MEN1)» . Журнал клинической эндокринологии и метаболизма . 97 (9): 2990–3011. doi : 10.1210/jc.2012-1230 . PMID 22723327 .
- ^ Fitzgerald JE, White MJ, Lobo DN (апрель 2009 г.). «Галлевой пузырь Курвойзера: Закон или знак?». Мировой журнал хирургии . 33 (4): 886–91. doi : 10.1007/s00268-008-9908-y . PMID 19190960 . S2CID 21799234 .
- ^ Piraka C, Scheiman JM (сентябрь 2011 г.). «Новые методы диагностической визуализации при заболевании поджелудочной железы». Текущее мнение в гастроэнтерологии . 27 (5): 475–80. doi : 10.1097/mog.0b013e328349e30c . PMID 21743318 . S2CID 38963685 .
- ^ Jump up to: а беременный в дюймовый Seufferlein T, Bachet JB, Van Cutsem E, Rougier P (октябрь 2012 г.). «Аденокарцинома поджелудочной железы: рекомендации по клинической практике ESMO-ESDO для диагностики, лечения и последующего наблюдения» . Анналы онкологии . 23 (Suppl 7): VII33–40. doi : 10.1093/annonc/mds224 . PMID 22997452 .
- ^ Jump up to: а беременный в дюймовый Изображение Микаэля Хёггстрем, MD.
Ссылка на функции: Navale P, Sairari O, Tomashefski JR JF, Vyas M. «Твердое псевдопапиллярное новообразование» . Последний автор обновление: 4 марта 2022 года - ^ Skafida E, Grammatoglou X, Glava C, Zissis D, Paschalidis N, Katsamagkou E, et al. (Февраль 2010 г.). «Аденосоквамозная карцинома поджелудочной железы: отчет о случаях» . Дела журнал . 3 (1): 41. doi : 10.1186/1757-1626-3-41 . PMC 2825199 . PMID 20205828 .
- ^ Agostini-Vvulaj D. "Поджелудочная железа-экзокринные опухоли / карциномы-внутрипротоковое папиллярное муциновое новообразование (IPMN)" . Патология . Тема завершена: 1 июля 2018 года. Пересмотрено: 9 марта 2020 г.
- ^ Adsay V, Mino-Kenudson M, Furukawa T, Basturk O, Zamboni G, Marchegiani G, et al. (Январь 2016). «Патологическая оценка и сообщения о внутрипротоковых папиллярных слизистых новообразованиях поджелудочной железы и других опухолевых внутриэпителиальных новообразований поджелудочных трактов: рекомендации консенсусного собрания Вероны» . Анналы хирургии . 263 (1): 162–77. doi : 10.1097/sla.000000000000001173 . PMC 4568174 . PMID 25775066 .
- ^ Cascinu S, Falconi M, Valentini V, Jelic S (май 2010). «Рак поджелудочной железы: рекомендации по клинической практике ESMO для диагностики, лечения и последующего наблюдения» . Анналы онкологии . 21 Suppl 5 (Дополнение 5): V55–58. doi : 10.1093/annonc/mdq165 . PMID 20555103 .
- ^ Jump up to: а беременный в «Постановка рака поджелудочной железы» . Американское онкологическое общество . 11 июня 2014 года. Архивировано с оригинала 10 августа 2020 года . Получено 29 сентября 2014 года .
- ^ Jump up to: а беременный Zyromski NJ, Nakeeb A, Lillemoe KD (2010). «Глава 35: Рак поджелудочной железы: хирургическое лечение». В Silberman H, Silberman Aw (Eds.). Принципы и практика хирургической онкологии: междисциплинарный подход к сложным проблемам (онлайн -ред.). Филадельфия: Wolters Kluwer/Lippincott Williams & Wilkins. ISBN 978-0-7817-6546-6 Полем Архивировано из оригинала 6 февраля 2015 года . Получено 3 ноября 2014 года .
- ^ Jump up to: а беременный в дюймовый «Нейроэндокринные опухоли, руководящие принципы NCCN версии 1.2015» (PDF) . National Completresse Cancer Network, Inc. NCCN). 11 ноября 2014 года . Получено 25 декабря 2014 года .
- ^ Национальный институт рака. Нейроэндокринные опухоли поджелудочной железы (опухоли островков) Лечение (PDQ®) Частота и смертность «Поджелудочные нейроэндокринные опухоли (опухоли островков) лечение (PDQ®) - Профессиональная версия Health» . Архивировано с оригинала 4 января 2015 года . Получено 29 декабря 2014 года .
- ^ «Диета и факторы активности, которые влияют на риск для определенных видов рака: раздел рака поджелудочной железы» . Американское онкологическое общество . 20 августа 2012 года. Архивировано с оригинала 4 ноября 2014 года . Получено 4 ноября 2014 года .
- ^ Оуэнс Д.К., Дэвидсон К.В., Крист А.Х., Барри М.Дж., Кабана М., Коухи А.Б. и др. (Август 2019). «Скрининг на рак поджелудочной железы: Заявление о рекомендации по профилактическим услугам США по профилактике» . Джама . 322 (5): 438–44. doi : 10.1001/Jama.2019.10232 . PMID 31386141 .
- ^ Он XY, Юань Юз (август 2014 г.). «Достижения в области исследований рака поджелудочной железы: движение к раннему обнаружению» . Всемирный журнал гастроэнтерологии . 20 (32): 11241–48. doi : 10.3748/wjg.v20.i32.11241 . PMC 4145762 . PMID 25170208 .
- ^ Jump up to: а беременный Okano K, Suzuki Y (август 2014 г.). «Стратегии для раннего выявления резектабируемого рака поджелудочной железы» . Всемирный журнал гастроэнтерологии . 20 (32): 11230–40. doi : 10.3748/wjg.v20.i32.11230 . PMC 4145761 . PMID 25170207 .
- ^ Goggins M, Overbeek KA, Brand R, Syngal S, Del Chioro M, Bartsch DK, et al. (Январь 2020 г.). «Лечение пациентов с повышенным риском развития семейного рака поджелудочной железы: обновленные рекомендации от международного рака консорциума скрининга поджелудочной железы (CAPS)» . Кишечник 69 (1): 7–17. doi : 10.1136/gutjnl-2019-319352 . PMC 7295005 . PMID 31672839 .
- ^ Sun J, Li Y, Liu L, Jiang Z, Liu G (декабрь 2019 г.). «Использование аспирина и риск рака поджелудочной железы: систематический обзор наблюдательных исследований» . Лекарство . 98 (51): E18033. doi : 10.1097/md.0000000000018033 . PMC 6940047 . PMID 31860953 .
- ^ Gurusamy KS, Kumar S, Davidson BR, Fusai G (февраль 2014 г.). «Резекция против других методов лечения рака поджелудочной железы в местном уровне» . Кокрановская база данных систематических обзоров . 2014 (2): CD010244. doi : 10.1002/14651858.cd010244.pub2 . PMC 11095847 . PMID 24578248 .
- ^ Jump up to: а беременный Mollberg N, Rahbari NN, Koch M, Hartwig W, Hoeger Y, Büchler MW, et al. (Декабрь 2011 г.). «Артериальная резекция во время панкреатэктомии при раке поджелудочной железы: систематический обзор и метаанализ». Анналы хирургии . 254 (6): 882–93. doi : 10.1097/sla.0b013e31823ac299 . PMID 22064622 . S2CID 42685174 .
- ^ Jump up to: а беременный в «Аденокарцинома поджелудочной железы. Руководящие принципы NCCN Версия 1.2015» (PDF) . Руководящие принципы NCCN . National Complossess Cancer Network, Inc. 4 декабря 2014 года . Получено 26 декабря 2014 года .
- ^ Аламо Дж. М., Марин Л.М., Суарес Г., Бернал С., Серрано Дж., Баррера Л. и др. (Октябрь 2014). «Улучшение результатов при раке поджелудочной железы: ключевые моменты в периоперационном лечении» . Всемирный журнал гастроэнтерологии . 20 (39): 14237–45. doi : 10.3748/wjg.v20.i39.14237 . PMC 4202352 . PMID 25339810 .
- ^ Lopez NE, Prendergast C, Lowy Am (август 2014 г.). «Пограничный резекруемый рак поджелудочной железы: определения и лечение» . Всемирный журнал гастроэнтерологии . 20 (31): 10740–51. doi : 10.3748/wjg.v20.i31.10740 . PMC 4138454 . PMID 25152577 .
- ^ Polistina F, Di Natale G, Bonciarelli G, Ambrosino G, Frego M (июль 2014 г.). «Неадъювантные стратегии для рака поджелудочной железы» . Всемирный журнал гастроэнтерологии . 20 (28): 9374–83. doi : 10.3748/wjg.v20.i28.9374 (неактивный 12 сентября 2024 г.). PMC 4110569 . PMID 25071332 .
{{cite journal}}: CS1 Maint: doi неактивен по состоянию на сентябрь 2024 года ( ссылка ) - ^ Гиллен С., Шустер Т., Мейер Зум Бюшенфельде С., Фрисс Х, Клефф Дж (апрель 2010 г.). «Предоперационная/неоадъювантная терапия при раке поджелудочной железы: систематический обзор и метаанализ процента ответа и резекции» . PLOS Medicine . 7 (4): E1000267. doi : 10.1371/journal.pmed.1000267 . PMC 2857873 . PMID 20422030 .
- ^ Христиане К.К., Эванс Д.Б. (июнь 2015 г.). «Дополнительная поддержка неоадъювантной терапии в лечении рака поджелудочной железы» . Анналы хирургической онкологии . 22 (6): 1755–58. doi : 10.1245/s10434-014-4307-0 . PMID 25519932 .
- ^ Tsvetkova EV, Asmis TR (август 2014 г.). «Роль неоадъювантной терапии в лечении рака поджелудочной железы: является ли эра терапии, направленной на биомаркер, здесь?» Полем Текущая онкология . 21 (4): E650–7. doi : 10.3747/co.21.2006 . PMC 4117630 . PMID 25089113 .
- ^ Zhan HX, Xu JW, Wu D, Zhang TP, Hu Sy (февраль 2015 г.). «Стволовые клетки рака поджелудочной железы: новое понимание упрямой болезни». Раковые письма . 357 (2): 429–37. doi : 10.1016/j.canlet.2014.12.004 . PMID 25499079 .
- ^ Jump up to: а беременный Tanase CP, Neague AI, Necula LG, Mambet C, Enciu AM, Calenic B, et al. (Август 2014). «Стволовые клетки рака: участие в патогенезе рака поджелудочной железы и перспективы терапии рака» . Всемирный журнал гастроэнтерологии . 20 (31): 10790–801. doi : 10.3748/wjg.v20.i31.10790 . PMC 4138459 . PMID 25152582 .
- ^ Allen VB, Gurusamy KS, Takwoingi Y, Kalia A, Davidson BR (июль 2016 г.). «Диагностическая точность лапароскопии после компьютерной томографии (КТ) сканирования для оценки резекточности с лечебным намерением при раке поджелудочной железы и периампулларного рака» . Кокрановская база данных систематических обзоров . 2016 (7): CD009323. doi : 10.1002/14651858.cd009323.pub3 . PMC 6458011 . PMID 27383694 .
- ^ Heinemann V, Haas M, Boeck S (октябрь 2013 г.). «Неоадъювантное лечение пограничного резекруемого и неретируемого рака поджелудочной железы» . Анналы онкологии . 24 (10): 2484–92. doi : 10.1093/annonc/mdt239 . PMID 23852311 .
- ^ Jump up to: а беременный в Thota R, Pauff JM, Berlin JD (январь 2014 г.). «Лечение метастатической аденокарциномы поджелудочной железы: обзор». Онкология . 28 (1): 70–74. PMID 24683721 .
- ^ Райан Д.П. (8 июля 2014 г.). «Химиотерапия для продвинутого экзокринного рака поджелудочной железы: тема 2475, версия 46.0» (требуется подписка) . До настоящего времени . Wolters Kluwer Health . Архивировано с оригинала 8 декабря 2014 года . Получено 18 ноября 2014 года .
- ^ «Информация о лекарственном раке: одобрение FDA для гидрохлорида эрлотиниба» . Национальный институт рака . Национальные институты здравоохранения. 3 июля 2013 года. Архивировано с оригинала 29 ноября 2014 года . Получено 5 декабря 2014 года .
- ^ Боранчи Е., фон Хофф Д.Д. (сентябрь 2014 г.). «Наб-паклитаксел и гемцитабин для лечения пациентов с метастатическим раком поджелудочной железы». Экспертный обзор гастроэнтерологии и гепатологии . 8 (7): 739–47. doi : 10.1586/17474124.2014.925799 . PMID 24882381 . S2CID 31633898 .
- ^ Neoptolemos JP, Dunn JA, Stocken DD, Almond J, Link K, Beger H, et al. (Ноябрь 2001 г.). «Адъювантная химиолучевая терапия и химиотерапия при резекруемом раке поджелудочной железы: рандомизированное контролируемое исследование». Лансет . 358 (9293): 1576–1585. doi : 10.1016/s0140-6736 (01) 06651-x . PMID 11716884 . S2CID 23803289 .
- ^ Neoptolemos JP, Stocken DD, Friess H, Bassi C, Dunn JA, Hickey H, et al. (Март 2004 г.). «Рандомизированное исследование химиолучевой терапии и химиотерапии после резекции рака поджелудочной железы» . Новая Англия Журнал медицины . 350 (12): 1200–1210. doi : 10.1056/nejmoa032295 . PMID 15028824 .
- ^ Falconi M, Bartsch DK, Eriksson B, Klöppel G, Lopes JM, O'Connor JM, et al. (2012). «Руководство по консенсусу для лечения пациентов с пищеварительными нейроэндокринными новообразованиями пищеварительной системы: хорошо дифференцированные нефункциональные опухоли поджелудочной железы». Нейроэндокринология . 95 (2): 120–34. doi : 10.1159/0003355587 . PMID 22261872 . S2CID 6985904 .
- ^ Jensen RT, Cadiot G, Brandi ML, De Herder WW, Kaltsas G, Komminoth P, et al. (2012). «Рекомендации по консенсусу для лечения пациентов с пищеварительными нейроэндокринными новообразованиями: функциональные эндокринные синдромы опухоли поджелудочной железы» . Нейроэндокринология . 95 (2): 98–119. doi : 10.1159/000335591 . PMC 3701449 . PMID 22261919 .
- ^ Павел М., Боудин Е., Куэллард А., Креннинг Е., Оберг К., Стейнмюллер Т. и др. (2012). «Руководство по консенсусу для лечения пациентов с печени и другими отдаленными метастазами из нейроэндокринных новообразований передней, средней кишки, задней кишки и неизвестной первичной». Нейроэндокринология . 95 (2): 157–76. doi : 10.1159/000335597 . PMID 22262022 . S2CID 2097604 .
- ^ Rossi RE, Massironi S, Conte D, Peracchi M (январь 2014 г.). «Терапия метастатических нейроэндокринных опухолей поджелудочной железы» . Анналы трансляционной медицины . 2 (1): 8. doi : 10.3978/j.issn.2305-5839.2013.03.01 . PMC 4200651 . PMID 25332984 .
- ^ Mulcahy N (17 декабря 2014 г.). «FDA одобряет ланреотид для нейроэндокринных опухолей» . Medscape Medical News . Webmd LLC. Архивировано с оригинала 18 января 2015 года . Получено 25 декабря 2014 года .
- ^ Эверолимус одобрен для нейроэндокринных опухолей поджелудочной железы, архивировав 16 июля 2016 года на машине Wayback The Asco Post . 15 мая 2011 г., том 2, выпуск 8
- ^ Национальный институт рака. Информация о лекарствах от рака. Одобрение FDA для сунитиниба Малат Архивировало 5 января 2015 года на машине Wayback . Поджелудочная нейроэндокринная опухоли
- ^ Текст доступен в электронном виде (но может потребовать бесплатной регистрации) см.: Бенсон А.Б., Майерсон Р.Дж., Сассон А.Р. (2010). Поджелудочная железа, нейроэндокринный GI и рак надпочечников. Управление раком: междисциплинарный подход (13 -е изд.). UBM Medica. ISBN 978-0-615-41824-7 Полем Архивировано из оригинала 15 мая 2011 года.
- ^ Гулчин К.Ю., Яо Х, Аса С.Л., Сингх С., Закон (май 2012 г.). «Радионуклидная терапия в нейроэндокринных опухолях: систематический обзор». Клиническая онкология . 24 (4): 294–308. doi : 10.1016/j.clon.2011.12.003 . PMID 22221516 .
- ^ Vinik AI (ноябрь 2014 г.). «Достижения в диагностике и лечении нейроэндокринных опухолей поджелудочной железы». Эндокринная практика . 20 (11): 1222–30. doi : 10.4158/ep14373.ra . PMID 25297671 .
- ^ Cweek Tree DJ, The Herer WW, Ejck CH, Kam BL, из Essen M, Teunsis JJ, et al. (Март 2010 г.). «Пептидный рецепт радионунуклеидов в патентах Бело-дистатурационные тропы нейроэндокриновых опухолей опухолей» . Семинары в ядерной медицине . 40 (2): 78–88. doi : 10,1053/j.semnullmed.2009.004 . PMID 20113677 .
- ^ Bodei L, Cremonesi M, Kidd M, Grana CM, Severi S, Modlin IM, et al. (Август 2014). «Пептид -рецептор -радионуклидная терапия при распространенных нейроэндокринных опухолях». Клиники грудной хирургии . 24 (3): 333–49. doi : 10.1016/j.thorsurg.2014.04.005 . HDL : 11392/2378236 . PMID 25065935 .
- ^ Кастеллано Д., Гранде Э., Валле Дж., Капдевила Дж., Рейди-Лагун Д., О'Коннор Дж. М. и др. (Июнь 2015 г.). «Экспертный консенсус по поводу лечения передовых или метастатических панкреатических нейроэндокринных и карциноидных опухолей». Химиотерапия рака и фармакология . 75 (6): 1099–114. doi : 10.1007/s00280-014-2642-2 . PMID 25480314 . S2CID 39434924 .
- ^ Сингх С., Дей С., Кеннеке Х., Коча В., Марун Дж., Метракос П. и др. (Август 2015). «Консенсусные рекомендации по диагностике и лечению нейроэндокринных опухолей поджелудочной железы: руководящие принципы из канадской национальной экспертной группы». Анналы хирургической онкологии . 22 (8): 2685–99. doi : 10.1245/s10434-014-4145-0 . PMID 25366583 . S2CID 8129133 .
- ^ «Паллиативная или поддерживающая помощь» . Американское онкологическое общество. 2014. Архивировано из оригинала 21 августа 2014 года . Получено 20 августа 2014 года .
- ^ Buanes TA (август 2014 г.). «Поджелудочный рак, улучшенный уход за раком» . Всемирный журнал гастроэнтерологии . 20 (30): 10405–18. doi : 10.3748/wjg.v20.i30.10405 . PMC 4130847 . PMID 25132756 .
- ^ «Если лечение от рака поджелудочной железы перестает работать» . Американское онкологическое общество. 11 июня 2014 года. Архивировано с оригинала 22 октября 2014 года . Получено 20 августа 2014 года .
- ^ Arcidiacono PG, Calori G, Carrara S, McNicol ED, Testoni PA (март 2011 г.). Arcidiacono Pg (ред.). «Цельейное сплетение блок для боли рака поджелудочной железы у взрослых» . Кокрановская база данных систематических обзоров . 2019 (3): CD007519. doi : 10.1002/14651858.cd007519.pub2 . PMC 6464722 . PMID 21412903 .
- ^ «Факты и цифры рака 2014» (PDF) . Американское онкологическое общество . Архивировано (PDF) из оригинала 18 декабря 2014 года . Получено 5 января 2015 года . , Таблица, с. 18, ставки, скорректированные с учетом нормальной продолжительности жизни
- ^ Джемал А., Сигель Р., Уорд Е., Мюррей Т., Сюй Дж., Тун М.Дж. (2007). «Статистика рака, 2007» . CA: Журнал рака для клиницистов . 57 (1): 43–66. doi : 10.3322/canjclin.57.1.43 . PMID 17237035 . S2CID 22305510 .
- ^ "Какова ключевая статистика о раке поджелудочной железы?" Полем Американское онкологическое общество . 11 июня 2014 года. Архивировано с оригинала 11 ноября 2014 года . Получено 11 ноября 2014 года .
- ^ «Статистика рака поджелудочной железы» . Рак исследований Великобритания . Архивировано из оригинала 18 декабря 2014 года . Получено 18 декабря 2014 года . ; «В 2010 году в Великобритании пожизненный риск развития рака поджелудочной железы составляет 1 из 73 для мужчин и 1 на 74 для женщин», отметив «риск жизни ... был рассчитан ... с использованием метода« текущая вероятность » ;
- ^ Jump up to: а беременный Busnardo AC, Didio LJ, Tidrick RT, Thomford NR (ноябрь 1983 г.). «История поджелудочной железы» . Американский журнал хирургии . 146 (5): 539–50. doi : 10.1016/0002-9610 (83) 90286-6 . PMID 6356946 .
- ^ Jump up to: а беременный в дюймовый C, Dhir M, Ravipati L (июнь 2011 г.). «История панкреатодуоденэктомии: ранние заблуждения, первоначальные вехи и пионеры» . HPB . 13 (6): 377–84. doi : 10.1111/j.1477-2574.2011.00305.x . PMC 3103093 . PMID 21609369 .
- ^ Jump up to: а беременный Кэмерон Дж. Л., Риалл Т.С., Коулман Дж., Белчер Ка (июль 2006 г.). «Одна тысяча последовательных панкреатодуоденэктомий» . Анналы хирургии . 244 (1): 10–5. doi : 10.1097/01.sla.0000217673.04165.ea . PMC 1570590 . PMID 16794383 .
- ^ Fernández-Del Castillo C, Morales-Oyarvide V, McGrath D, Wargo JA, Ferrone CR, Thayer SP, et al. (Сентябрь 2012 г.). «Эволюция процедуры Whipple в Массачусетской больнице общего профиля» . Операция . 152 (3 Suppl 1): S56-63. doi : 10.1016/j.surg.2012.05.022 . PMC 3806095 . PMID 22770961 .
- ^ Jump up to: а беременный в "Что нового в исследованиях и лечении рака поджелудочной железы?" Полем Американское онкологическое общество . 2019 . Получено 2 мая 2019 года .
- ^ «Исследование рака поджелудочной железы» . Рак исследований Великобритания . Архивировано из оригинала 18 февраля 2014 года . Получено 17 июля 2014 года .
- ^ «Австралийская инициатива генома поджелудочной железы» . Гарван Институт. Архивировано с оригинала 26 июля 2014 года . Получено 17 июля 2014 года .
- ^ Biankin AV, Waddell N, Kassahn KS, Gingras MC, Muthuswamy LB, Johns AL, et al. (Ноябрь 2012). «Геномы рака поджелудочной железы выявляют аберрации в генах пути наведения аксонов» . Природа . 491 (7424): 399–405. Bibcode : 2012natur.491..399. Полем doi : 10.1038/nature11547 . PMC 3530898 . PMID 23103869 .
- ^ Feng Hy, Chen YC (сентябрь 2016 г.). «Роль желчных кислот в канцерогенезе рака поджелудочной железы: старая тема с новой перспективой» . Всемирный журнал гастроэнтерологии . 22 (33): 7463–7477. doi : 10.3748/wjg.v22.i33.7463 . PMC 5011662 . PMID 27672269 .
- ^ Sharma B, Twelker K, Nguyen C, Ellis S, Bhatia ND, Kushner Z, et al. (Июнь 2024 г.). «Желчные кислоты в канцерогенезе поджелудочной железы» . Метаболиты . 14 (7): 348. doi : 10.3390/metabo14070348 . PMC 11278541 . PMID 39057671 .
- ^ Грэм Дж. С., Джеймисон Н.Б., Рулач Р., Гриммонд С.М., Чанг Д.К., Бианкин А.В. (сентябрь 2015 г.). «Геномика рака поджелудочной железы: куда нас может взять науку?». Клиническая генетика . 88 (3): 213–9. doi : 10.1111/cge.12536 . PMID 25388820 . S2CID 26414866 .
- ^ Bruenderman EH, Martin RC (март 2015 г.). «Популяция высокого риска при спорадической аденокарциноме поджелудочной железы: руководящие принципы для скрининга» . Журнал хирургических исследований . 194 (1): 212–9. doi : 10.1016/j.jss.2014.06.046 . PMC 4559279 . PMID 25479908 .
- ^ "О Europac" . Европейский реестр наследственного панкреатита и семейного рака поджелудочной железы (Europac) . Университет Ливерпуля. Архивировано с оригинала 26 июля 2014 года . Получено 17 июля 2014 года .
- ^ Subar D, Gobardhan PD, Goyet B (февраль 2014 г.). «Лапароскопическая хирургия поджелудочной железы: обзор литературы и опыта одного центра». Лучшая практика и исследования. Клиническая гастроэнтерология . 28 (1): 123–32. doi : 10.1016/j.bpg.2013.11.011 . PMID 24485260 .
- ^ Weiss MJ, Wolfgang CL (2013). «Необратимая электропорация: новая терапия рака поджелудочной железы». Современные проблемы в раке . 37 (5): 262–5. doi : 10.1016/j.currproblcancer.2013.10.002 . PMID 24331180 . S2CID 3137300 .
- ^ Moir J, White SA, French JJ, Littler P, Manas DM (декабрь 2014 г.). «Систематический обзор необратимой электропорации при лечении развитого рака поджелудочной железы». Европейский журнал хирургической онкологии . 40 (12): 1598–604. doi : 10.1016/j.ejso.2014.08.480 . PMID 25307210 .
- ^ Kleger A, Perkhofer L, Seufferlein T (июль 2014 г.). «Умные препараты, появляющиеся в терапии рака поджелудочной железы» . Анналы онкологии . 25 (7): 1260–1270. doi : 10.1093/annonc/mdu013 . PMID 24631947 .
- ^ Jump up to: а беременный Tang SC, Chen YC (август 2014 г.). «Новые терапевтические цели при раке поджелудочной железы» . Всемирный журнал гастроэнтерологии . 20 (31): 10825–44. doi : 10.3748/wjg.v20.i31.10825 . PMC 4138462 . PMID 25152585 .
- ^ Росси М.Л., Рехман А.А., Гонди К.С. (август 2014 г.). «Терапевтические варианты лечения рака поджелудочной железы» . Всемирный журнал гастроэнтерологии . 20 (32): 11142–59. doi : 10.3748/wjg.v20.i32.11142 . PMC 4145755 . PMID 25170201 .
- ^ Ady JW, Heffner J, Klein E, Fong Y (2014). «Онколитическая вирусная терапия при раке поджелудочной железы: текущие исследования и будущие направления» . Онколитическая виротерапия . 3 : 35–46. doi : 10.2147/ov.s53858 . PMC 4918362 . PMID 27512661 .
- ^ Ren B, Cui M, Yang G, Wang H, Feng M, You L, et al. (Июль 2018). «Опухолевая микроокружение участвует в метастазировании рака поджелудочной железы» . Молекулярный рак . 17 (1): 108. doi : 10.1186/s12943-018-0858-1 . PMC 6065152 . PMID 30060755 .
- ^ Дас С.С., Дубей А.К., Сингх Н., Верма П.Р., Сингх С.К., Сингх С.К. (9 января 2023 г.). «Лечение рака поджелудочной железы с использованием терагностических наночастиц» . В Rahman M, Almalki HW, Alrobaian M, Beg S, Alharbi KS (Eds.). Гормональный рак механистичен и наномедицины . Сингапур: Спрингер. С. 149–168. doi : 10.1007/978-981-19-5558-7_8 . ISBN 978-981-19-5557-0 .




