Кальциевый канал L-типа


Кальциевый канал L-типа (также известный как дигидропиридиновый канал или канал DHP ) является частью семейства потенциалзависимых кальциевых каналов, активируемых высоким напряжением . [2] «L» означает длительный, что означает продолжительность активации. Этот канал имеет четыре изоформы: Cav1.1 , Cav1.2 , Cav1.3 и Cav1.4 .
Кальциевые каналы L-типа отвечают за сопряжение возбуждения- сокращения , скелетных гладких , сердечных мышц , а также за секрецию альдостерона в эндокринных клетках коры надпочечников . [1] Они также обнаруживаются в нейронах и с помощью кальциевых каналов L-типа в эндокринных клетках регулируют выработку нейрогормонов и нейротрансмиттеров . Также было замечено, что они играют роль в экспрессии генов, стабильности мРНК , выживании нейронов, ишемически-индуцированном повреждении аксонов, синаптической эффективности, а также активации и деактивации других ионных каналов. [3]
В кардиомиоцитах кальциевый канал L-типа проходит внутрь Ca 2+ ток (I CaL ) и запускает высвобождение кальция из саркоплазматического ретикулума путем активации рианодинового рецептора 2 (RyR2) (кальций-индуцированное высвобождение кальция). [4] Фосфорилирование этих каналов увеличивает их проницаемость для кальция и увеличивает сократимость соответствующих кардиомиоцитов.
L-типа Блокаторы кальциевых каналов используются в качестве сердечных антиаритмических или антигипертензивных средств , в зависимости от того, имеют ли препараты более высокое сродство к сердцу ( фенилалкиламины , такие как верапамил ) или к кровеносным сосудам ( дигидропиридины , такие как нифедипин ). [5]
В скелетных мышцах очень высокая концентрация кальциевых каналов L-типа, расположенных в Т-трубочках . Деполяризация мышц приводит к большим токам управления, но аномально низкому потоку кальция, что сейчас объясняется очень медленной активацией ионных токов. По этой причине мало или совсем нет Ca 2+ проходит через мембрану Т-канальцев за один потенциал действия.
История
[ редактировать ]В 1953 году Пол Фатт и Бернард Кац обнаружили потенциалзависимые кальциевые каналы в мышцах ракообразных. Каналы демонстрировали различные напряжения активации и свойства проводимости кальция и, таким образом, были разделены на каналы активации высокого напряжения (HVA) и каналы активации низкого напряжения (LVA). После дальнейших экспериментов было обнаружено, что каналы HVA блокируются производными 1,4-дигидропиридина (DHP). [6] С помощью DHP было обнаружено, что каналы HVA специфичны для определенных тканей и реагируют по-разному, что привело к дальнейшей категоризации каналов HVA на L-тип, P-тип и N-тип . [3] Кальциевые каналы L-типа были секвенированы пептидами, и было обнаружено, что существует 4 типа кальциевых каналов L-типа: α 1 S (скелетные мышцы), α 1 C (сердечные), α 1 D (обнаружены в мозге) и α 1 F (обнаружен в сетчатке). [6] В 2000 году, после того, как были проведены дополнительные исследования субъединиц α 1 в потенциалзависимых кальциевых каналах, была использована новая номенклатура, которая назвала кальциевые каналы L-типа CaV1, а его субъединицы были названы CaV1.1 , Cav1.2 , CaV1.3 и CaV1. КаВ1.4 . [3] Исследования субъединиц CaV1 продолжают раскрывать больше информации об их структуре, функциях и фармацевтическом применении. [7]
Структура
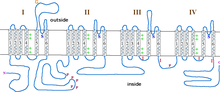
[ редактировать ]Кальциевые каналы L-типа содержат 5 различных субъединиц: субъединицы α1 (170–240 кДа), α2 (150 кДа), δ (17–25 кДа), β (50–78 кДа) и γ (32 кДа). [8] Субъединицы α2, δ и β нековалентно связаны с субъединицей α1 и модулируют транспорт ионов и биофизические свойства субъединицы α1. Субъединицы α2 и δ находятся во внеклеточном пространстве, а субъединицы β и γ — в цитозольном пространстве. [8]
Субъединица α1 представляет собой гетеротетрамер, который имеет четыре трансмембранные области , известные как домены I-IV, которые шесть раз пересекают плазму в виде α-спиралей и называются S0-S6 (S0 и S1 вместе пересекают мембрану один раз). [3] Субъединица α1 в целом содержит потенциалчувствительный домен, проводящую пору и вентильный аппарат. [9] Как и большинство потенциал-управляемых ионных каналов , α-субъединица состоит из 4 субъединиц. Каждая субъединица образована 6 альфа-спиральными трансмембранными доменами, которые пересекают мембрану (пронумерованы S1-S6). Субблоки S1-S4 составляют датчик напряжения, а субблоки S5-S6 составляют селективный фильтр. [10] Чтобы определить напряжение клетки, спирали S1-S3 содержат множество отрицательно заряженных аминокислот, в то время как спирали S4 содержат в основном положительно заряженные аминокислоты с P-петлей , соединяющей спирали S4 и S5. После доменов S1-6 идут шесть доменов C, которые состоят из двух мотивов EF-hand (C1-2 и C3-4), а также домена Pre-IQ (C5) и домена IQ (C6). также имеются два мотива EF-руки На N-конце . И N-конец, и С-конец находятся в цитозольном пространстве, причем С-конец намного длиннее N-конца. [11]
Известно, что субъединица β имеет четыре изоформы (β1-β4), регулирующие функции канала, и связана с α1 через линкер α1 I и II в цитозоле в кармане связывания β α1 (ABP). [7] [12] Каждая изоформа содержит домен 3 гомологии src (SH3) и гуанилат-киназоподобный домен (GK), которые разделены доменом HOOK, а также три неструктурированные области. [12]
Субъединицы α2 и δ соединены между собой дисульфидными связями (иногда называемыми субъединицей α2δ) и взаимодействуют с α1. [7] они имеют четыре известные изоформы, называемые от α2δ-1 до α2δ-2, и содержат домен фон Виллебранда A (VWA) и домен Cache . Область α2 находится во внеклеточном пространстве, тогда как область δ находится в клеточной мембране и, как было замечено, закреплена с помощью гликозилфосфатидилинозитолового (GPI) якоря. [12]
Субъединица γ имеет восемь изоформ (γ1-γ8), связана с субъединицей α1 и обнаружена только в мышечных клетках в каналах CaV1.1 и CaV1.2. [12] О субъединице γ известно немного, но она связана с взаимодействиями гидрофобных сил. [3]
Механизм
[ редактировать ]Открытие поры в кальциевых каналах L-типа происходит в субъединице α1. Когда мембрана деполяризуется, спираль S4 перемещается через линкеры S4 и S5 к цитоплазматическим концам спиралей S5 и S6. Это открывает активационные ворота , образованные внутренней стороной спиралей S6 в субъединице α1. [11]
Наиболее преобладающим способом аутоингибирования кальциевых каналов L-типа является Что 2+ /Камерный комплекс. [11] Когда пора открывается и вызывает приток кальция, кальций связывается с кальмодулином , а затем взаимодействует с петлей, соединяющей соседние мотивы EF-рука , и вызывает конформационные изменения в мотиве EF-рука, поэтому он взаимодействует с порой, вызывая быстрое торможение. в канале. [6] До сих пор ведутся споры о том, где и как взаимодействуют поры и EF-рука. Гидрофобные карманы в Что 2+ Комплекс /Cam также будет связываться с тремя участками домена IQ, известными как «ароматические якоря». [11] Что 2+ Комплекс /Cam обладает высоким сродством к кальциевым каналам L-типа, что позволяет им блокироваться, даже если в клетке присутствует небольшое количество кальция. Пора в конечном итоге закрывается, когда клетка реполяризуется и вызывает конформационные изменения в канале, переводящие его в закрытую конформацию.
Торможение и модуляция
[ редактировать ]Одной из наиболее известных характеристик кальциевых каналов L-типа является их уникальная чувствительность к 1,4-дигидропиридинам (ДГП) . [3] В отличие от других потенциалзависимых кальциевых каналов, кальциевые каналы L-типа устойчивы к препаратам, ингибирующим ⍵-CT X (GVIA) и ⍵-AG A (IVA). [3]
Хорошо наблюдаемая форма модуляции обусловлена альтернативным сплайсингом . Распространенной формой модуляции альтернативного сплайсинга является С-концевой модулятор (СТМ). Он имеет положительно заряженную α-спираль на C-конце, называемую DCRD, и отрицательно заряженную спираль сразу после мотива IQ (сайт взаимодействия CaM), называемую PCRD. Две спирали могут образовывать структуру, которая конкурентно связывается с CaM, чтобы уменьшить вероятность открытого состояния и снизить кальций-зависимое ингибирование (CDI). [7]
Альтернативный сплайсинг также наблюдается на β-субъединицах для создания различных изоформ, придающих каналам разные свойства из-за пальмитоилирования. [6] и редактирование РНК . [7] Другие формы модуляции субъединицы β включают увеличение или уменьшение экспрессии субъединицы. Это связано с тем, что β-субъединицы повышают вероятность открытия канала, активность в плазматической мембране и противодействуют убиквитинированию канала . [6]
Кальциевые каналы L-типа также модулируются рецепторами, связанными с G-белком , и адренергической нервной системой . [6] Протеинкиназа А (PKA), активированная каскадом рецепторов, связанных с G-белком, может фосфорилировать кальциевые каналы L-типа после того, как каналы образуют сигнальный комплекс с белками, закрепляющими A-киназы (AKAP) , для увеличения тока кальция через канал, увеличивая вероятность открытого состояния и ускоренный период восстановления. Активированная фосфолипаза C (PLC) из рецепторов, связанных с G-белком, может расщеплять полифосфоинозитиды, уменьшая ток кальция в канале на 20–30%. [7]
Было замечено, что адренергическая нервная система модулирует кальциевые каналы L-типа путем расщепления C-концевого фрагмента, когда β-адренергический рецептор стимулируется для увеличения активации каналов. [6]
Гены
[ редактировать ]См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Фелисола С.Дж., Маэкава Т., Накамура Й., Сато Ф., Оно Й., Кикучи К. и др. (октябрь 2014 г.). «Потенциал-управляемые кальциевые каналы в надпочечниках человека и первичный альдостеронизм». Журнал биохимии стероидов и молекулярной биологии . 144 Pt B (часть B): 410–416. дои : 10.1016/j.jsbmb.2014.08.012 . ПМИД 25151951 . S2CID 23622821 .
- ^ Россье МФ (2016). «Кальциевый канал Т-типа: привилегированные ворота для входа кальция и контроля надпочечникового стероидогенеза» . Границы эндокринологии . 7 : 43. дои : 10.3389/fendo.2016.00043 . ПМЦ 4873500 . ПМИД 27242667 .
- ^ Jump up to: а б с д и ж г Липскомб Д., Хелтон Т.Д., Сюй В. (ноябрь 2004 г.). «Кальцевые каналы L-типа: снизу». Журнал нейрофизиологии . 92 (5): 2633–2641. дои : 10.1152/jn.00486.2004 . ПМИД 15486420 .
- ^ Ямакаге М., Намики А. (февраль 2002 г.). «Кальциевые каналы - основные аспекты их структуры, функции и кодирования генов; анестезирующее действие на каналы - обзор» . Канадский журнал анестезии . 49 (2): 151–164. дои : 10.1007/BF03020488 . ПМИД 11823393 .
- ^ Хьюз А. (2017). «Блокаторы кальциевых каналов». В Бакрис Г., Соррентино М. (ред.). Гипертония: спутник болезни сердца Браунвальда (Третье изд.). Филадельфия, Пенсильвания: Elsevier Health Sciences. стр. 242–253. ISBN 9780323508766 . OCLC 967938982 .
- ^ Jump up to: а б с д и ж г Дельфин АС (октябрь 2018 г.). «Напряженно-управляемые кальциевые каналы: их открытие, функции и значение в качестве мишени для лекарств» . Достижения в области мозга и нейробиологии . 2 : 2398212818794805. doi : 10.1177/2398212818794805 . ПМК 6179141 . ПМИД 30320224 .
- ^ Jump up to: а б с д и ж Стрессниг Дж., Пинггера А., Каур Г., Бок Г., Тулук П. (март 2014 г.). «L-тип Ca 2+ каналы в сердце и мозге» . Междисциплинарные обзоры Wiley. Мембранный транспорт и передача сигналов . 3 (2): 15–38. : 10.1002 /wmts.102 . PMC 3968275. doi PMID 24683526 .
- ^ Jump up to: а б Боди И., Микала Г., Кох С.Е., Ахтер С.А., Шварц А. (декабрь 2005 г.). «Кальцевый канал L-типа в сердце: ритм продолжается» . Журнал клинических исследований . 115 (12): 3306–3317. дои : 10.1172/JCI27167 . ПМЦ 1297268 . ПМИД 16322774 .
- ^ «Потенциал-управляемые кальциевые каналы | Введение | Руководство BPS / IUPHAR по ФАРМАКОЛОГИИ» . www.guidetopharmacology.org . Проверено 28 ноября 2019 г.
- ^ Каттералл В.А., Перес-Рейес Э., Снутч Т.П., Стрессниг Дж. (декабрь 2005 г.). «Международный союз фармакологии. XLVIII. Номенклатура и структурно-функциональные связи потенциалзависимых кальциевых каналов». Фармакологические обзоры . 57 (4): 411–425. дои : 10.1124/пр.57.4.5 . ПМИД 16382099 . S2CID 10386627 .
- ^ Jump up to: а б с д Валь-Шотт С., Бауманн Л., Куни Х., Эккерт С., Грисмайер К., Биль М. (октябрь 2006 г.). «Выключение кальций-зависимой инактивации в кальциевых каналах L-типа с помощью аутоингибирующего домена» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (42): 15657–15662. Бибкод : 2006PNAS..10315657W . дои : 10.1073/pnas.0604621103 . ПМЦ 1622877 . ПМИД 17028172 .
- ^ Jump up to: а б с д Шоу Р.М., Colecraft HM (май 2013 г.). «Нацеливание на кальциевые каналы L-типа и локальная передача сигналов в кардиомиоцитах» . Сердечно-сосудистые исследования . 98 (2): 177–186. дои : 10.1093/cvr/cvt021 . ПМЦ 3633156 . ПМИД 23417040 .
Дальнейшее чтение
[ редактировать ]- Такахаси К., Хаяси С., Миядзима М., Омори М., Ван Дж., Кайхара К. и др. (май 2019 г.). «Кальцевый канал L-типа модулирует механочувствительность клеточной линии кардиомиоцитов H9c2» . Клеточный кальций . 79 : 68–74. дои : 10.1016/j.ceca.2019.02.008 . ПМИД 30836292 .
Эта статья включает текст из Национальной медицинской библиотеки США , который находится в свободном доступе .
Внешние ссылки
[ редактировать ]- «Кальциевые каналы, управляемые напряжением» . База данных IUPHAR по рецепторам и ионным каналам . Международный союз фундаментальной и клинической фармакологии.
- L-тип+кальций+канал в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
