Вирус
| Вирус | |
|---|---|
 | |
| SARS-CoV-2 , представитель подсемейства Coronavirinae. | |
| Классификация вирусов | |
| (без рейтинга): | Вирус |
| Realms | |
Вирус , — субмикроскопический инфекционный агент только внутри живых клеток организма . который размножается [1] Вирусы заражают все формы жизни , от животных и растений до микроорганизмов , включая бактерии и археи . [2] [3] Вирусы встречаются практически во всех экосистемах Земли и являются самым многочисленным типом биологических объектов. [4] [5] Со времени статьи Дмитрия Ивановского 1892 года, описывающей небактериальный патоген, поражающий растения табака, и открытия вируса табачной мозаики Мартинусом Бейеринком в 1898 году, [6] : 4 более 11 000 из миллионов видов вирусов . подробно описано [7] [8] Изучение вирусов известно как вирусология , раздел микробиологии .
При заражении клетка-хозяин часто вынуждена быстро производить тысячи копий исходного вируса. Находясь вне инфицированной клетки или в процессе заражения клетки, вирусы существуют в виде независимых вирусных частиц, или вирионов , состоящих из (i) генетического материала . е. длинных молекул ДНК , т или РНК , кодирующих структуру белки, с помощью которых действует вирус; (ii) белковая оболочка, капсид , которая окружает и защищает генетический материал; и в некоторых случаях (iii) внешняя оболочка из липидов . Формы этих вирусных частиц варьируются от простых спиральных и икосаэдрических форм до более сложных структур. У большинства видов вирусов вирионы слишком малы, чтобы их можно было увидеть в оптический микроскоп , и они составляют одну сотую размера большинства бактерий.
The origins of viruses in the evolutionary history of life are still unclear. Some viruses may have evolved from plasmids, which are pieces of DNA that can move between cells. Other viruses may have evolved from bacteria. In evolution, viruses are an important means of horizontal gene transfer, which increases genetic diversity in a way analogous to sexual reproduction.[9] Viruses are considered by some biologists to be a life form, because they carry genetic material, reproduce, and evolve through natural selection, although they lack the key characteristics, such as cell structure, that are generally considered necessary criteria for defining life. Because they possess some but not all such qualities, viruses have been described as "organisms at the edge of life"[10] and as replicators.[11]
Viruses spread in many ways. One transmission pathway is through disease-bearing organisms known as vectors: for example, viruses are often transmitted from plant to plant by insects that feed on plant sap, such as aphids; and viruses in animals can be carried by blood-sucking insects. Many viruses spread in the air by coughing and sneezing, including influenza viruses, SARS-CoV-2, chickenpox, smallpox, and measles. Norovirus and rotavirus, common causes of viral gastroenteritis, are transmitted by the faecal–oral route, passed by hand-to-mouth contact or in food or water. The infectious dose of norovirus required to produce infection in humans is fewer than 100 particles.[12] HIV is one of several viruses transmitted through sexual contact and by exposure to infected blood. The variety of host cells that a virus can infect is called its host range: this is narrow for viruses specialized to infect only a few species, or broad for viruses capable of infecting many.[13]: 123–124
Viral infections in animals provoke an immune response that usually eliminates the infecting virus. Immune responses can also be produced by vaccines, which confer an artificially acquired immunity to the specific viral infection. Some viruses, including those that cause HIV/AIDS, HPV infection, and viral hepatitis, evade these immune responses and result in chronic infections. Several classes of antiviral drugs have been developed.
Etymology
The English word "virus" comes from the Latin vīrus, which refers to poison and other noxious liquids. Vīrus comes from the same Indo-European root as Sanskrit viṣa, Avestan vīša, and Ancient Greek ἰός (iós), which all mean "poison". The first attested use of "virus" in English appeared in 1398 in John Trevisa's translation of Bartholomeus Anglicus's De Proprietatibus Rerum.[14][15] Virulent, from Latin virulentus ('poisonous'), dates to c. 1400.[16][17] A meaning of 'agent that causes infectious disease' is first recorded in 1728,[15] long before the discovery of viruses by Dmitri Ivanovsky in 1892. The English plural is viruses (sometimes also vira),[18] whereas the Latin word is a mass noun, which has no classically attested plural (vīra is used in Neo-Latin[19]). The adjective viral dates to 1948.[20] The term virion (plural virions), which dates from 1959,[21] is also used to refer to a single viral particle that is released from the cell and is capable of infecting other cells of the same type.[22]
Origins
Viruses are found wherever there is life and have probably existed since living cells first evolved.[23] The origin of viruses is unclear because they do not form fossils, so molecular techniques are used to infer how they arose.[24] In addition, viral genetic material occasionally integrates into the germline of the host organisms, by which they can be passed on vertically to the offspring of the host for many generations. This provides an invaluable source of information for paleovirologists to trace back ancient viruses that existed as far back as millions of years ago.
There are three main hypotheses that aim to explain the origins of viruses:[25]
- Regressive hypothesis
- Viruses may have once been small cells that parasitised larger cells. Over time, genes not required by their parasitism were lost. The bacteria rickettsia and chlamydia are living cells that, like viruses, can reproduce only inside host cells. They lend support to this hypothesis, as their dependence on parasitism is likely to have caused the loss of genes that enabled them to survive outside a cell. This is also called the "degeneracy hypothesis",[6]: 16 [26]: 11 or "reduction hypothesis".[27]: 24
- Cellular origin hypothesis
- Some viruses may have evolved from bits of DNA or RNA that "escaped" from the genes of a larger organism. The escaped DNA could have come from plasmids (pieces of naked DNA that can move between cells) or transposons (molecules of DNA that replicate and move around to different positions within the genes of the cell).[13]: 810 Once called "jumping genes", transposons are examples of mobile genetic elements and could be the origin of some viruses. They were discovered in maize by Barbara McClintock in 1950.[28] This is sometimes called the "vagrancy hypothesis",[6]: 16 [26]: 11–12 or the "escape hypothesis".[27]: 24
- Co-evolution hypothesis
- This is also called the "virus-first hypothesis"[27]: 24 and proposes that viruses may have evolved from complex molecules of protein and nucleic acid at the same time that cells first appeared on Earth and would have been dependent on cellular life for billions of years. Viroids are molecules of RNA that are not classified as viruses because they lack a protein coat. They have characteristics that are common to several viruses and are often called subviral agents.[6]: 55 Viroids are important pathogens of plants.[13]: 791 They do not code for proteins but interact with the host cell and use the host machinery for their replication.[29] The hepatitis delta virus of humans has an RNA genome similar to viroids but has a protein coat derived from hepatitis B virus and cannot produce one of its own. It is, therefore, a defective virus. Although hepatitis delta virus genome may replicate independently once inside a host cell, it requires the help of hepatitis B virus to provide a protein coat so that it can be transmitted to new cells.[13]: 460 In similar manner, the sputnik virophage is dependent on mimivirus, which infects the protozoan Acanthamoeba castellanii.[30] These viruses, which are dependent on the presence of other virus species in the host cell, are called "satellites" and may represent evolutionary intermediates of viroids and viruses.[26]: 777 >[6]: 55–57
In the past, there were problems with all of these hypotheses: the regressive hypothesis did not explain why even the smallest of cellular parasites do not resemble viruses in any way. The escape hypothesis did not explain the complex capsids and other structures on virus particles. The virus-first hypothesis contravened the definition of viruses in that they require host cells.[27]: 24 Viruses are now recognised as ancient and as having origins that pre-date the divergence of life into the three domains.[27]: 28 This discovery has led modern virologists to reconsider and re-evaluate these three classical hypotheses.[27]: 28
The evidence for an ancestral world of RNA cells[27]: 26 and computer analysis of viral and host DNA sequences give a better understanding of the evolutionary relationships between different viruses and may help identify the ancestors of modern viruses. To date, such analyses have not proved which of these hypotheses is correct.[27]: 26 It seems unlikely that all currently known viruses have a common ancestor, and viruses have probably arisen numerous times in the past by one or more mechanisms.[31]
Microbiology
Discovery
The first evidence of the existence of viruses came from experiments with filters that had pores small enough to retain bacteria. In 1892, Dmitri Ivanovsky used one of these filters to show that sap from a diseased tobacco plant remained infectious to healthy tobacco plants despite having been filtered. Martinus Beijerinck called the filtered, infectious substance a "virus" and this discovery is considered to be the beginning of virology.The subsequent discovery and partial characterization of bacteriophages by Frederick Twort and Félix d'Herelle further catalyzed the field, and by the early 20th century many viruses had been discovered. In 1926, Thomas Milton Rivers defined viruses as obligate parasites. Viruses were demonstrated to be particles, rather than a fluid, by Wendell Meredith Stanley, and the invention of the electron microscope in 1931 allowed their complex structures to be visualised.[32]
Life properties
Scientific opinions differ on whether viruses are a form of life or organic structures that interact with living organisms.[11] They have been described as "organisms at the edge of life",[10] since they resemble organisms in that they possess genes, evolve by natural selection,[33] and reproduce by creating multiple copies of themselves through self-assembly. Although they have genes, they do not have a cellular structure, which is often seen as the basic unit of life. Viruses do not have their own metabolism and require a host cell to make new products. They therefore cannot naturally reproduce outside a host cell[34]—although some bacteria such as rickettsia and chlamydia are considered living organisms despite the same limitation.[35][36] Accepted forms of life use cell division to reproduce, whereas viruses spontaneously assemble within cells. They differ from autonomous growth of crystals as they inherit genetic mutations while being subject to natural selection. Virus self-assembly within host cells has implications for the study of the origin of life, as it lends further credence to the hypothesis that life could have started as self-assembling organic molecules.[2] The virocell model first proposed by Patrick Forterre considers the infected cell to be the "living form" of viruses and that virus particles (virions) are analogous to spores.[37] Although the living versus non-living debate continues, the virocell model has gained some acceptance.[38]
Structure
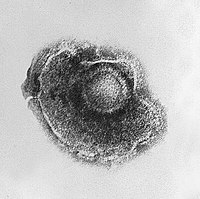
Viruses display a wide diversity of sizes and shapes, called 'morphologies'. In general, viruses are much smaller than bacteria and more than a thousand bacteriophage viruses would fit inside an Escherichia coli bacterium's cell.[39]: 98 Many viruses that have been studied are spherical and have a diameter between 20 and 300 nanometres. Some filoviruses, which are filaments, have a total length of up to 1400 nm; their diameters are only about 80 nm.[26]: 33–55 Most viruses cannot be seen with an optical microscope, so scanning and transmission electron microscopes are used to visualise them.[26]: 33–37 To increase the contrast between viruses and the background, electron-dense "stains" are used. These are solutions of salts of heavy metals, such as tungsten, that scatter the electrons from regions covered with the stain. When virions are coated with stain (positive staining), fine detail is obscured. Negative staining overcomes this problem by staining the background only.[40]
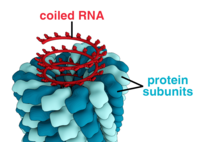
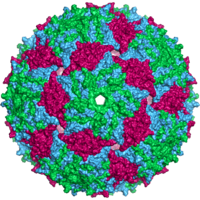
A complete virus particle, known as a virion, consists of nucleic acid surrounded by a protective coat of protein called a capsid. These are formed from protein subunits called capsomeres.[26]: 40 Viruses can have a lipid "envelope" derived from the host cell membrane. The capsid is made from proteins encoded by the viral genome and its shape serves as the basis for morphological distinction.[41][42] Virally-coded protein subunits will self-assemble to form a capsid, in general requiring the presence of the virus genome. Complex viruses code for proteins that assist in the construction of their capsid. Proteins associated with nucleic acid are known as nucleoproteins, and the association of viral capsid proteins with viral nucleic acid is called a nucleocapsid. The capsid and entire virus structure can be mechanically (physically) probed through atomic force microscopy.[43][44] In general, there are five main morphological virus types:
- Helical
- These viruses are composed of a single type of capsomere stacked around a central axis to form a helical structure, which may have a central cavity, or tube. This arrangement results in virions which can be short and highly rigid rods, or long and very flexible filaments. The genetic material (typically single-stranded RNA, but single-stranded DNA in some cases) is bound into the protein helix by interactions between the negatively charged nucleic acid and positive charges on the protein. Overall, the length of a helical capsid is related to the length of the nucleic acid contained within it, and the diameter is dependent on the size and arrangement of capsomeres. The well-studied tobacco mosaic virus[26]: 37 and inovirus[45] are examples of helical viruses.
- Icosahedral
- Most animal viruses are icosahedral or near-spherical with chiral icosahedral symmetry. A regular icosahedron is the optimum way of forming a closed shell from identical subunits. The minimum number of capsomeres required for each triangular face is 3, which gives 60 for the icosahedron. Many viruses, such as rotavirus, have more than 60 capsomers and appear spherical but they retain this symmetry. To achieve this, the capsomeres at the apices are surrounded by five other capsomeres and are called pentons. Capsomeres on the triangular faces are surrounded by six others and are called hexons.[26]: 40, 42 Hexons are in essence flat and pentons, which form the 12 vertices, are curved. The same protein may act as the subunit of both the pentamers and hexamers or they may be composed of different proteins.[46]
- Prolate
- This is an icosahedron elongated along the fivefold axis and is a common arrangement of the heads of bacteriophages. This structure is composed of a cylinder with a cap at either end.[47]
- Enveloped
- Some species of virus envelop themselves in a modified form of one of the cell membranes, either the outer membrane surrounding an infected host cell or internal membranes such as a nuclear membrane or endoplasmic reticulum, thus gaining an outer lipid bilayer known as a viral envelope. This membrane is studded with proteins coded for by the viral genome and host genome; the lipid membrane itself and any carbohydrates present originate entirely from the host. Influenza virus, HIV (which causes AIDS), and severe acute respiratory syndrome coronavirus 2 (which causes COVID-19)[48] use this strategy. Most enveloped viruses are dependent on the envelope for their infectivity.[26]: 42–43
- Complex
- These viruses possess a capsid that is neither purely helical nor purely icosahedral, and that may possess extra structures such as protein tails or a complex outer wall. Some bacteriophages, such as Enterobacteria phage T4, have a complex structure consisting of an icosahedral head bound to a helical tail, which may have a hexagonal base plate with protruding protein tail fibres. This tail structure acts like a molecular syringe, attaching to the bacterial host and then injecting the viral genome into the cell.[49]
The poxviruses are large, complex viruses that have an unusual morphology. The viral genome is associated with proteins within a central disc structure known as a nucleoid. The nucleoid is surrounded by a membrane and two lateral bodies of unknown function. The virus has an outer envelope with a thick layer of protein studded over its surface. The whole virion is slightly pleomorphic, ranging from ovoid to brick-shaped.[50]
Giant viruses
Mimivirus is one of the largest characterised viruses, with a capsid diameter of 400 nm. Protein filaments measuring 100 nm project from the surface. The capsid appears hexagonal under an electron microscope, therefore the capsid is probably icosahedral.[51] In 2011, researchers discovered the largest then known virus in samples of water collected from the ocean floor off the coast of Las Cruces, Chile. Provisionally named Megavirus chilensis, it can be seen with a basic optical microscope.[52] In 2013, the Pandoravirus genus was discovered in Chile and Australia, and has genomes about twice as large as Megavirus and Mimivirus.[53] All giant viruses have dsDNA genomes and they are classified into several families: Mimiviridae, Pithoviridae, Pandoraviridae, Phycodnaviridae, and the Mollivirus genus.[54]
Some viruses that infect Archaea have complex structures unrelated to any other form of virus, with a wide variety of unusual shapes, ranging from spindle-shaped structures to viruses that resemble hooked rods, teardrops or even bottles. Other archaeal viruses resemble the tailed bacteriophages, and can have multiple tail structures.[55]
Genome
| Property | Parameters |
|---|---|
| Nucleic acid |
|
| Shape |
|
| Strandedness |
|
| Sense |
|
An enormous variety of genomic structures can be seen among viral species; as a group, they contain more structural genomic diversity than plants, animals, archaea, or bacteria. There are millions of different types of viruses,[8] although fewer than 7,000 types have been described in detail.[6]: 49 As of January 2021, the NCBI Virus genome database has more than 193,000 complete genome sequences,[56] but there are doubtlessly many more to be discovered.[57][58]
A virus has either a DNA or an RNA genome and is called a DNA virus or an RNA virus, respectively. Most viruses have RNA genomes. Plant viruses tend to have single-stranded RNA genomes and bacteriophages tend to have double-stranded DNA genomes.[26]: 96–99
Viral genomes are circular, as in the polyomaviruses, or linear, as in the adenoviruses. The type of nucleic acid is irrelevant to the shape of the genome. Among RNA viruses and certain DNA viruses, the genome is often divided into separate parts, in which case it is called segmented. For RNA viruses, each segment often codes for only one protein and they are usually found together in one capsid. All segments are not required to be in the same virion for the virus to be infectious, as demonstrated by brome mosaic virus and several other plant viruses.[26]: 33–35
A viral genome, irrespective of nucleic acid type, is almost always either single-stranded (ss) or double-stranded (ds). Single-stranded genomes consist of an unpaired nucleic acid, analogous to one-half of a ladder split down the middle. Double-stranded genomes consist of two complementary paired nucleic acids, analogous to a ladder. The virus particles of some virus families, such as those belonging to the Hepadnaviridae, contain a genome that is partially double-stranded and partially single-stranded.[26]: 96–99
For most viruses with RNA genomes and some with single-stranded DNA (ssDNA) genomes, the single strands are said to be either positive-sense (called the 'plus-strand') or negative-sense (called the 'minus-strand'), depending on if they are complementary to the viral messenger RNA (mRNA). Positive-sense viral RNA is in the same sense as viral mRNA and thus at least a part of it can be immediately translated by the host cell. Negative-sense viral RNA is complementary to mRNA and thus must be converted to positive-sense RNA by an RNA-dependent RNA polymerase before translation. DNA nomenclature for viruses with genomic ssDNA is similar to RNA nomenclature, in that positive-strand viral ssDNA is identical in sequence to the viral mRNA and is thus a coding strand, while negative-sense viral ssDNA is complementary to the viral mRNA and is thus a template strand.[26]: 96–99 Several types of ssDNA and ssRNA viruses have genomes that are ambisense in that transcription can occur off both strands in a double-stranded replicative intermediate. Examples include geminiviruses, which are ssDNA plant viruses and arenaviruses, which are ssRNA viruses of animals.[59]
Genome size
Genome size varies greatly between species. The smallest—the ssDNA circoviruses, family Circoviridae—code for only two proteins and have a genome size of only two kilobases;[60] the largest—the pandoraviruses—have genome sizes of around two megabases which code for about 2500 proteins.[53] Virus genes rarely have introns and often are arranged in the genome so that they overlap.[61]
In general, RNA viruses have smaller genome sizes than DNA viruses because of a higher error-rate when replicating, and have a maximum upper size limit.[24] Beyond this, errors when replicating render the virus useless or uncompetitive. To compensate, RNA viruses often have segmented genomes—the genome is split into smaller molecules—thus reducing the chance that an error in a single-component genome will incapacitate the entire genome. In contrast, DNA viruses generally have larger genomes because of the high fidelity of their replication enzymes.[62] Single-strand DNA viruses are an exception to this rule, as mutation rates for these genomes can approach the extreme of the ssRNA virus case.[63]
Genetic mutation and recombination

Viruses undergo genetic change by several mechanisms. These include a process called antigenic drift where individual bases in the DNA or RNA mutate to other bases. Most of these point mutations are "silent"—they do not change the protein that the gene encodes—but others can confer evolutionary advantages such as resistance to antiviral drugs.[64][65] Antigenic shift occurs when there is a major change in the genome of the virus. This can be a result of recombination or reassortment. The Influenza A virus is highly prone to reassortment; occasionally this has resulted in novel strains which have caused pandemics.[66] RNA viruses often exist as quasispecies or swarms of viruses of the same species but with slightly different genome nucleoside sequences. Such quasispecies are a prime target for natural selection.[67]
Segmented genomes confer evolutionary advantages; different strains of a virus with a segmented genome can shuffle and combine genes and produce progeny viruses (or offspring) that have unique characteristics. This is called reassortment or 'viral sex'.[68]
Genetic recombination is a process by which a strand of DNA (or RNA) is broken and then joined to the end of a different DNA (or RNA) molecule. This can occur when viruses infect cells simultaneously and studies of viral evolution have shown that recombination has been rampant in the species studied.[69] Recombination is common to both RNA and DNA viruses.[70][71]
Coronaviruses have a single-strand positive-sense RNA genome. Replication of the genome is catalyzed by an RNA-dependent RNA polymerase. The mechanism of recombination used by coronaviruses likely involves template switching by the polymerase during genome replication.[72] This process appears to be an adaptation for coping with genome damage.[73]
Replication cycle


Viral populations do not grow through cell division, because they are acellular. Instead, they use the machinery and metabolism of a host cell to produce multiple copies of themselves, and they assemble in the cell.[74] When infected, the host cell is forced to rapidly produce thousands of copies of the original virus.[75]
Their life cycle differs greatly between species, but there are six basic stages in their life cycle:[26]: 75–91
Attachment is a specific binding between viral capsid proteins and specific receptors on the host cellular surface. This specificity determines the host range and type of host cell of a virus. For example, HIV infects a limited range of human leucocytes. This is because its surface protein, gp120, specifically interacts with the CD4 molecule—a chemokine receptor—which is most commonly found on the surface of CD4+ T-Cells. This mechanism has evolved to favour those viruses that infect only cells in which they are capable of replication. Attachment to the receptor can induce the viral envelope protein to undergo changes that result in the fusion of viral and cellular membranes, or changes of non-enveloped virus surface proteins that allow the virus to enter.[76]
Penetration or viral entry follows attachment: Virions enter the host cell through receptor-mediated endocytosis or membrane fusion. The infection of plant and fungal cells is different from that of animal cells. Plants have a rigid cell wall made of cellulose, and fungi one of chitin, so most viruses can get inside these cells only after trauma to the cell wall.[6]: 70 Nearly all plant viruses (such as tobacco mosaic virus) can also move directly from cell to cell, in the form of single-stranded nucleoprotein complexes, through pores called plasmodesmata.[77] Bacteria, like plants, have strong cell walls that a virus must breach to infect the cell. Given that bacterial cell walls are much thinner than plant cell walls due to their much smaller size, some viruses have evolved mechanisms that inject their genome into the bacterial cell across the cell wall, while the viral capsid remains outside.[6]: 71
Uncoating is a process in which the viral capsid is removed: This may be by degradation by viral enzymes or host enzymes or by simple dissociation; the end-result is the releasing of the viral genomic nucleic acid.[78]
Replication of viruses involves primarily multiplication of the genome. Replication involves the synthesis of viral messenger RNA (mRNA) from "early" genes (with exceptions for positive-sense RNA viruses), viral protein synthesis, possible assembly of viral proteins, then viral genome replication mediated by early or regulatory protein expression. This may be followed, for complex viruses with larger genomes, by one or more further rounds of mRNA synthesis: "late" gene expression is, in general, of structural or virion proteins.[79]
Assembly – Following the structure-mediated self-assembly of the virus particles, some modification of the proteins often occurs. In viruses such as HIV, this modification (sometimes called maturation) occurs after the virus has been released from the host cell.[80]
Release – Viruses can be released from the host cell by lysis, a process that kills the cell by bursting its membrane and cell wall if present: this is a feature of many bacterial and some animal viruses. Some viruses undergo a lysogenic cycle where the viral genome is incorporated by genetic recombination into a specific place in the host's chromosome. The viral genome is then known as a "provirus" or, in the case of bacteriophages a "prophage".[13]: 836 Whenever the host divides, the viral genome is also replicated. The viral genome is mostly silent within the host. At some point, the provirus or prophage may give rise to the active virus, which may lyse the host cells.[6]: 243–259 Enveloped viruses (e.g., HIV) typically are released from the host cell by budding. During this process, the virus acquires its envelope, which is a modified piece of the host's plasma or other, internal membrane.[6]: 185–187
Genome replication
The genetic material within virus particles, and the method by which the material is replicated, varies considerably between different types of viruses.
- DNA viruses
- The genome replication of most DNA viruses takes place in the cell's nucleus. If the cell has the appropriate receptor on its surface, these viruses enter the cell either by direct fusion with the cell membrane (e.g., herpesviruses) or—more usually—by receptor-mediated endocytosis. Most DNA viruses are entirely dependent on the host cell's DNA and RNA synthesising machinery and RNA processing machinery. Viruses with larger genomes may encode much of this machinery themselves. In eukaryotes, the viral genome must cross the cell's nuclear membrane to access this machinery, while in bacteria it need only enter the cell.[13]: 118 [26]: 78
- RNA viruses
- Replication of RNA viruses usually takes place in the cytoplasm. RNA viruses can be placed into four different groups depending on their modes of replication. The polarity (whether or not it can be used directly by ribosomes to make proteins) of single-stranded RNA viruses largely determines the replicative mechanism; the other major criterion is whether the genetic material is single-stranded or double-stranded. All RNA viruses use their own RNA replicase enzymes to create copies of their genomes.[26]: 79
- Reverse transcribing viruses
- Reverse transcribing viruses have ssRNA (Retroviridae, Metaviridae, Pseudoviridae) or dsDNA (Caulimoviridae, and Hepadnaviridae) in their particles. Reverse transcribing viruses with RNA genomes (retroviruses) use a DNA intermediate to replicate, whereas those with DNA genomes (pararetroviruses) use an RNA intermediate during genome replication. Both types use a reverse transcriptase, or RNA-dependent DNA polymerase enzyme, to carry out the nucleic acid conversion. Retroviruses integrate the DNA produced by reverse transcription into the host genome as a provirus as a part of the replication process; pararetroviruses do not, although integrated genome copies of especially plant pararetroviruses can give rise to infectious virus.[81] They are susceptible to antiviral drugs that inhibit the reverse transcriptase enzyme, e.g. zidovudine and lamivudine. An example of the first type is HIV, which is a retrovirus. Examples of the second type are the Hepadnaviridae, which includes Hepatitis B virus.[26]: 88–89
Cytopathic effects on the host cell
The range of structural and biochemical effects that viruses have on the host cell is extensive.[26]: 115–146 These are called 'cytopathic effects'.[26]: 115 Most virus infections eventually result in the death of the host cell. The causes of death include cell lysis, alterations to the cell's surface membrane and apoptosis.[82] Often cell death is caused by cessation of its normal activities because of suppression by virus-specific proteins, not all of which are components of the virus particle.[83] The distinction between cytopathic and harmless is gradual. Some viruses, such as Epstein–Barr virus, can cause cells to proliferate without causing malignancy,[84] while others, such as papillomaviruses, are established causes of cancer.[85]
Dormant and latent infections
Some viruses cause no apparent changes to the infected cell. Cells in which the virus is latent and inactive show few signs of infection and often function normally.[86] This causes persistent infections and the virus is often dormant for many months or years. This is often the case with herpes viruses.[87][88]
Host range
Viruses are by far the most abundant biological entities on Earth and they outnumber all the others put together.[89] They infect all types of cellular life including animals, plants, bacteria and fungi.[6]: 49 Different types of viruses can infect only a limited range of hosts and many are species-specific. Some, such as smallpox virus for example, can infect only one species—in this case humans,[13]: 643 and are said to have a narrow host range. Other viruses, such as rabies virus, can infect different species of mammals and are said to have a broad range.[13]: 631 The viruses that infect plants are harmless to animals, and most viruses that infect other animals are harmless to humans.[6]: 272 The host range of some bacteriophages is limited to a single strain of bacteria and they can be used to trace the source of outbreaks of infections by a method called phage typing.[90] The complete set of viruses in an organism or habitat is called the virome; for example, all human viruses constitute the human virome.[91]
Novel viruses
A novel virus is one that has not previously been recorded. It can be a virus that is isolated from its natural reservoir or isolated as the result of spread to an animal or human host where the virus had not been identified before. It can be an emergent virus, one that represents a new virus, but it can also be an extant virus that has not been previously identified.[92] The SARS-CoV-2 coronavirus that caused the COVID-19 pandemic is an example of a novel virus.[93]
Classification
Classification seeks to describe the diversity of viruses by naming and grouping them on the basis of similarities. In 1962, André Lwoff, Robert Horne, and Paul Tournier were the first to develop a means of virus classification, based on the Linnaean hierarchical system.[94] This system based classification on phylum, class, order, family, genus, and species. Viruses were grouped according to their shared properties (not those of their hosts) and the type of nucleic acid forming their genomes.[95] In 1966, the International Committee on Taxonomy of Viruses (ICTV) was formed. The system proposed by Lwoff, Horne and Tournier was initially not accepted by the ICTV because the small genome size of viruses and their high rate of mutation made it difficult to determine their ancestry beyond order. As such, the Baltimore classification system has come to be used to supplement the more traditional hierarchy.[96] Starting in 2018, the ICTV began to acknowledge deeper evolutionary relationships between viruses that have been discovered over time and adopted a 15-rank classification system ranging from realm to species.[97] Additionally, some species within the same genus are grouped into a genogroup.[98][99]
ICTV classification
The ICTV developed the current classification system and wrote guidelines that put a greater weight on certain virus properties to maintain family uniformity. A unified taxonomy (a universal system for classifying viruses) has been established.[100] Only a small part of the total diversity of viruses has been studied.[101] As of 2022, 6 realms, 10 kingdoms, 17 phyla, 2 subphyla, 40 classes, 72 orders, 8 suborders, 264 families, 182 subfamilies, 2,818 genera, 84 subgenera, and 11,273 species of viruses have been defined by the ICTV.[7]
The general taxonomic structure of taxon ranges and the suffixes used in taxonomic names are shown hereafter. As of 2022, the ranks of subrealm, subkingdom, and subclass are unused, whereas all other ranks are in use.[7]
- Realm (-viria)
Baltimore classification

The Nobel Prize-winning biologist David Baltimore devised the Baltimore classification system.[102][103] The ICTV classification system is used in conjunction with the Baltimore classification system in modern virus classification.[104][105][106]
The Baltimore classification of viruses is based on the mechanism of mRNA production. Viruses must generate mRNAs from their genomes to produce proteins and replicate themselves, but different mechanisms are used to achieve this in each virus family. Viral genomes may be single-stranded (ss) or double-stranded (ds), RNA or DNA, and may or may not use reverse transcriptase (RT). In addition, ssRNA viruses may be either sense (+) or antisense (−). This classification places viruses into seven groups:
- I: dsDNA viruses (e.g. Adenoviruses, Herpesviruses, Poxviruses)
- II: ssDNA viruses (+ strand or "sense") DNA (e.g. Parvoviruses)
- III: dsRNA viruses (e.g. Reoviruses)
- IV:(+)ssRNA viruses (+ strand or sense) RNA (e.g. Coronaviruses, Picornaviruses, Togaviruses)
- V: (−)ssRNA viruses (− strand or antisense) RNA (e.g. Orthomyxoviruses, Rhabdoviruses)
- VI: ssRNA-RT viruses (+ strand or sense) RNA with DNA intermediate in life-cycle (e.g. Retroviruses)
- VII: dsDNA-RT viruses DNA with RNA intermediate in life-cycle (e.g. Hepadnaviruses)
Role in human disease

Examples of common human diseases caused by viruses include the common cold, influenza, chickenpox, and cold sores. Many serious diseases such as rabies, Ebola virus disease, AIDS (HIV), avian influenza, and SARS are caused by viruses. The relative ability of viruses to cause disease is described in terms of virulence. Other diseases are under investigation to discover if they have a virus as the causative agent, such as the possible connection between human herpesvirus 6 (HHV6) and neurological diseases such as multiple sclerosis and chronic fatigue syndrome.[108] There is controversy over whether the bornavirus, previously thought to cause neurological diseases in horses, could be responsible for psychiatric illnesses in humans.[109]
Viruses have different mechanisms by which they produce disease in an organism, which depends largely on the viral species. Mechanisms at the cellular level primarily include cell lysis, the breaking open and subsequent death of the cell. In multicellular organisms, if enough cells die, the whole organism will start to suffer the effects. Although viruses cause disruption of healthy homeostasis, resulting in disease, they may exist relatively harmlessly within an organism. An example would include the ability of the herpes simplex virus, which causes cold sores, to remain in a dormant state within the human body. This is called latency[110] and is a characteristic of the herpes viruses, including Epstein–Barr virus, which causes glandular fever, and varicella zoster virus, which causes chickenpox and shingles. Most people have been infected with at least one of these types of herpes virus.[111] These latent viruses might sometimes be beneficial, as the presence of the virus can increase immunity against bacterial pathogens, such as Yersinia pestis.[112]
Some viruses can cause lifelong or chronic infections, where the viruses continue to replicate in the body despite the host's defence mechanisms.[113] This is common in hepatitis B virus and hepatitis C virus infections. People chronically infected are known as carriers, as they serve as reservoirs of infectious virus.[114] In populations with a high proportion of carriers, the disease is said to be endemic.[115]
Epidemiology
Viral epidemiology is the branch of medical science that deals with the transmission and control of virus infections in humans. Transmission of viruses can be vertical, which means from mother to child, or horizontal, which means from person to person. Examples of vertical transmission include hepatitis B virus and HIV, where the baby is born already infected with the virus.[116] Another, more rare, example is the varicella zoster virus, which, although causing relatively mild infections in children and adults, can be fatal to the foetus and newborn baby.[117]
Horizontal transmission is the most common mechanism of spread of viruses in populations.[118] Horizontal transmission can occur when body fluids are exchanged during sexual activity, by exchange of saliva or when contaminated food or water is ingested. It can also occur when aerosols containing viruses are inhaled or by insect vectors such as when infected mosquitoes penetrate the skin of a host.[118] Most types of viruses are restricted to just one or two of these mechanisms and they are referred to as "respiratory viruses" or "enteric viruses" and so forth. The rate or speed of transmission of viral infections depends on factors that include population density, the number of susceptible individuals, (i.e., those not immune),[119] the quality of healthcare and the weather.[120]
Epidemiology is used to break the chain of infection in populations during outbreaks of viral diseases.[13]: 264 Control measures are used that are based on knowledge of how the virus is transmitted. It is important to find the source, or sources, of the outbreak and to identify the virus. Once the virus has been identified, the chain of transmission can sometimes be broken by vaccines. When vaccines are not available, sanitation and disinfection can be effective. Often, infected people are isolated from the rest of the community, and those that have been exposed to the virus are placed in quarantine.[13]: 894 To control the outbreak of foot-and-mouth disease in cattle in Britain in 2001, thousands of cattle were slaughtered.[121] Most viral infections of humans and other animals have incubation periods during which the infection causes no signs or symptoms.[13]: 170 Incubation periods for viral diseases range from a few days to weeks, but are known for most infections.[13]: 170–172 Somewhat overlapping, but mainly following the incubation period, there is a period of communicability—a time when an infected individual or animal is contagious and can infect another person or animal.[13]: 170–172 This, too, is known for many viral infections, and knowledge of the length of both periods is important in the control of outbreaks.[13]: 272 When outbreaks cause an unusually high proportion of cases in a population, community, or region, they are called epidemics. If outbreaks spread worldwide, they are called pandemics.[13]: 891
Epidemics and pandemics
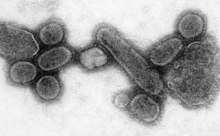
A pandemic is a worldwide epidemic. The 1918 flu pandemic, which lasted until 1919, was a category 5 influenza pandemic caused by an unusually severe and deadly influenza A virus. The victims were often healthy young adults, in contrast to most influenza outbreaks, which predominantly affect juvenile, elderly, or otherwise-weakened patients.[26]: 409–415 Older estimates say it killed 40–50 million people,[122] while more recent research suggests that it may have killed as many as 100 million people, or 5% of the world's population in 1918.[123]
Although viral pandemics are rare events, HIV—which evolved from viruses found in monkeys and chimpanzees—has been pandemic since at least the 1980s.[124] During the 20th century there were four pandemics caused by influenza virus and those that occurred in 1918, 1957 and 1968 were severe.[125] Most researchers believe that HIV originated in sub-Saharan Africa during the 20th century;[126] it is now a pandemic, with an estimated 37.9 million people now living with the disease worldwide.[127] There were about 770,000 deaths from AIDS in 2018.[128] The Joint United Nations Programme on HIV/AIDS (UNAIDS) and the World Health Organization (WHO) estimate that AIDS has killed more than 25 million people since it was first recognised on 5 June 1981, making it one of the most destructive epidemics in recorded history.[129] In 2007 there were 2.7 million new HIV infections and 2 million HIV-related deaths.[130]
Several highly lethal viral pathogens are members of the Filoviridae. Filoviruses are filament-like viruses that cause viral hemorrhagic fever, and include ebolaviruses and marburgviruses. Marburg virus, first discovered in 1967, attracted widespread press attention in April 2005 for an outbreak in Angola.[131] Ebola virus disease has also caused intermittent outbreaks with high mortality rates since 1976 when it was first identified. The worst and most recent one is the 2013–2016 West Africa epidemic.[132]
Except for smallpox, most pandemics are caused by newly evolved viruses. These "emergent" viruses are usually mutants of less harmful viruses that have circulated previously either in humans or other animals.[133]
Severe acute respiratory syndrome (SARS) and Middle East respiratory syndrome (MERS) are caused by new types of coronaviruses. Other coronaviruses are known to cause mild infections in humans,[134] so the virulence and rapid spread of SARS infections—that by July 2003 had caused around 8,000 cases and 800 deaths—was unexpected and most countries were not prepared.[135]
A related coronavirus, severe acute respiratory syndrome coronavirus 2 (SARS-Cov-2), thought to have originated in bats, emerged in Wuhan, China in November 2019 and spread rapidly around the world. Infections with the virus caused the COVID-19 pandemic that started in 2020.[93][136][137] Unprecedented restrictions in peacetime were placed on international travel,[138] and curfews were imposed in several major cities worldwide in response to the pandemic.[139]
Cancer
Viruses are an established cause of cancer in humans and other species. Viral cancers occur only in a minority of infected persons (or animals). Cancer viruses come from a range of virus families, including both RNA and DNA viruses, and so there is no single type of "oncovirus" (an obsolete term originally used for acutely transforming retroviruses). The development of cancer is determined by a variety of factors such as host immunity[140] and mutations in the host.[141] Viruses accepted to cause human cancers include some genotypes of human papillomavirus, hepatitis B virus, hepatitis C virus, Epstein–Barr virus, Kaposi's sarcoma-associated herpesvirus and human T-lymphotropic virus. The most recently discovered human cancer virus is a polyomavirus (Merkel cell polyomavirus) that causes most cases of a rare form of skin cancer called Merkel cell carcinoma.[142]Hepatitis viruses can develop into a chronic viral infection that leads to liver cancer.[143][144] Infection by human T-lymphotropic virus can lead to tropical spastic paraparesis and adult T-cell leukaemia.[145] Human papillomaviruses are an established cause of cancers of cervix, skin, anus, and penis.[146] Within the Herpesviridae, Kaposi's sarcoma-associated herpesvirus causes Kaposi's sarcoma and body-cavity lymphoma, and Epstein–Barr virus causes Burkitt's lymphoma, Hodgkin's lymphoma, B lymphoproliferative disorder, and nasopharyngeal carcinoma.[147] Merkel cell polyomavirus closely related to SV40 and mouse polyomaviruses that have been used as animal models for cancer viruses for over 50 years.[148]
Host defence mechanisms
The body's first line of defence against viruses is the innate immune system. This comprises cells and other mechanisms that defend the host from infection in a non-specific manner. This means that the cells of the innate system recognise, and respond to, pathogens in a generic way, but, unlike the adaptive immune system, it does not confer long-lasting or protective immunity to the host.[149]
RNA interference is an important innate defence against viruses.[150] Many viruses have a replication strategy that involves double-stranded RNA (dsRNA). When such a virus infects a cell, it releases its RNA molecule or molecules, which immediately bind to a protein complex called a dicer that cuts the RNA into smaller pieces. A biochemical pathway—the RISC complex—is activated, which ensures cell survival by degrading the viral mRNA. Rotaviruses have evolved to avoid this defence mechanism by not uncoating fully inside the cell, and releasing newly produced mRNA through pores in the particle's inner capsid. Their genomic dsRNA remains protected inside the core of the virion.[151] [152]
Когда адаптивная иммунная система позвоночного сталкивается с вирусом, она вырабатывает специфические антитела , которые связываются с вирусом и часто делают его неинфекционным. Это называется гуморальным иммунитетом . Важны два типа антител. Первый, называемый IgM , очень эффективен при нейтрализации вирусов, но вырабатывается клетками иммунной системы лишь в течение нескольких недель. Второй, называемый IgG , вырабатывается неопределенно долго. Присутствие IgM в крови хозяина используется для проверки острой инфекции, тогда как IgG указывает на инфекцию когда-то в прошлом. [153] Антитела IgG измеряются при тестов на иммунитет . проведении [154]
Антитела могут продолжать оставаться эффективным защитным механизмом даже после того, как вирусам удалось проникнуть в клетку-хозяина. Белок, находящийся в клетках, называемый TRIM21 , может прикрепляться к антителам на поверхности вирусной частицы. системы клетки Это запускает последующее разрушение вируса ферментами протеосомной . [155]

Вторая защита позвоночных животных от вирусов называется клеточным иммунитетом и включает в себя иммунные клетки, известные как Т-клетки . Клетки организма постоянно отображают короткие фрагменты своих белков на поверхности клетки, и, если Т-клетка распознает там подозрительный вирусный фрагмент, клетка-хозяин разрушается «Т-клетками-киллерами», и вирус-специфичные Т-клетки размножаются. Такие клетки, как макрофаги, являются специалистами в презентации этого антигена . [156] Производство интерферона является важным защитным механизмом хозяина. Это гормон, вырабатываемый организмом при наличии вирусов. Его роль в иммунитете сложна; в конечном итоге он останавливает размножение вирусов, убивая инфицированную клетку и ее ближайших соседей. [157]
Не все вирусные инфекции вызывают такой защитный иммунный ответ. ВИЧ уклоняется от иммунной системы, постоянно изменяя аминокислотную последовательность белков на поверхности вириона. Это известно как «мутация ускользания», поскольку вирусные эпитопы ускользают от распознавания иммунным ответом хозяина. Эти стойкие вирусы уклоняются от иммунного контроля путем секвестрации, блокады презентации антигена , устойчивости к цитокинам , уклонения от активности естественных клеток-киллеров , выхода из апоптоза и антигенного сдвига . [158] Другие вирусы, называемые « нейротропными вирусами », распространяются путем нейронного распространения, когда иммунная система может быть не в состоянии достичь их из-за иммунных привилегий . [159]
Профилактика и лечение
Поскольку для репликации вирусы используют жизненно важные метаболические пути внутри клеток-хозяев, их трудно уничтожить без использования лекарств, которые оказывают токсическое воздействие на клетки-хозяева в целом. Наиболее эффективными медицинскими подходами к вирусным заболеваниям являются вакцинация для обеспечения иммунитета к инфекции и противовирусные препараты, избирательно препятствующие репликации вируса.
Вакцина
Вакцинация – дешевый и эффективный способ предотвращения заражения вирусами. Вакцины использовались для предотвращения вирусных инфекций задолго до открытия самих вирусов. Их использование привело к резкому снижению заболеваемости (заболеваний) и смертности (смертности), связанных с вирусными инфекциями, такими как полиомиелит , корь , эпидемический паротит и краснуха . [160] Инфекция оспы ликвидирована. [161] Доступны вакцины для предотвращения более тринадцати вирусных инфекций человека. [162] и другие используются для профилактики вирусных инфекций животных. [163] Вакцины могут состоять из живых ослабленных или убитых вирусов, вирусных белков ( антигенов ) или РНК . [164] [165] Живые вакцины содержат ослабленные формы вируса, которые не вызывают заболевания, но тем не менее придают иммунитет. Такие вирусы называются аттенуированными. Живые вакцины могут быть опасны при введении людям со слабым иммунитетом (которых называют людьми с ослабленным иммунитетом ), поскольку у этих людей ослабленный вирус может вызвать исходное заболевание. [166] Для производства субъединичных вакцин используются методы биотехнологии и генной инженерии. В этих вакцинах используются только капсидные белки вируса. Вакцина против гепатита B является примером вакцины этого типа. [167] Субъединичные вакцины безопасны для пациентов с ослабленным иммунитетом , поскольку они не могут вызвать заболевание. [168] Вакцина против вируса желтой лихорадки , живой аттенуированный штамм под названием 17D, вероятно, является самой безопасной и эффективной вакциной, когда-либо созданной. [169]
Противовирусные препараты
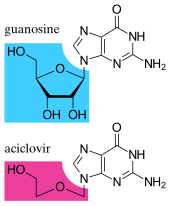
Противовирусные препараты часто представляют собой аналоги нуклеозидов (поддельные строительные блоки ДНК), которые вирусы ошибочно включают в свои геномы во время репликации. [170] Жизненный цикл вируса затем останавливается, поскольку вновь синтезированная ДНК становится неактивной. Это связано с тем, что в этих аналогах отсутствуют гидроксильные группы, которые вместе с атомами фосфора соединяются вместе, образуя прочный «остов» молекулы ДНК. Это называется терминацией цепи ДНК . [171] Примерами аналогов нуклеозидов являются ацикловир при инфекциях, вызванных вирусом простого герпеса, и ламивудин при инфекциях, вызванных вирусом ВИЧ и гепатита В. Ацикловир – один из старейших и наиболее часто назначаемых противовирусных препаратов. [172] Другие используемые противовирусные препараты нацелены на разные стадии жизненного цикла вируса. ВИЧ зависит от протеолитического фермента, называемого протеазой ВИЧ-1 Чтобы стать полностью заразным, . Существует большой класс препаратов, называемых ингибиторами протеазы , которые инактивируют этот фермент. [173] Существует около тринадцати классов противовирусных препаратов, каждый из которых нацелен на разные вирусы или стадии репликации вируса. [170]
Гепатит С вызывается РНК-вирусом. У 80% инфицированных заболевание носит хронический характер, и без лечения они остаются инфицированными на всю оставшуюся жизнь. Существуют эффективные методы лечения, в которых используются противовирусные препараты прямого действия . [174] Лечение хронических носителей вируса гепатита В также было разработано с использованием аналогичных стратегий, включающих ламивудин и другие противовирусные препараты. [175]
Инфекция у других видов
Вирусы заражают всю клеточную жизнь, и, хотя вирусы встречаются повсеместно, каждый вид клеток имеет свой собственный определенный диапазон, который часто заражает только этот вид. [6] : 3 Некоторые вирусы, называемые сателлитами , могут размножаться только внутри клеток, уже зараженных другим вирусом. [30]
Вирусы животных
Вирусы являются важными патогенами домашнего скота. Такие заболевания, как ящур и блютанг , вызываются вирусами. [176] Животные-компаньоны, такие как кошки, собаки и лошади, если не вакцинированы, восприимчивы к серьезным вирусным инфекциям. Собачий парвовирус вызывается небольшим ДНК-вирусом, и инфекции часто приводят к летальному исходу у щенков. [177] Как и все беспозвоночные , медоносная пчела восприимчива ко многим вирусным инфекциям. [178] Большинство вирусов безвредно сосуществуют со своим хозяином и не вызывают никаких признаков или симптомов заболевания. [6] : 4
Вирусы растений

Существует много типов вирусов растений, но зачастую они вызывают лишь потерю урожая , и бороться с ними экономически нецелесообразно. Вирусы растений часто передаются от растения к растению организмами, известными как переносчики . Обычно это насекомые, но переносчиками являются некоторые грибы, нематоды , одноклеточные организмы и растения-паразиты. [179] Когда борьба с вирусными инфекциями растений считается экономичной (например, в отношении многолетних фруктов), усилия концентрируются на уничтожении переносчиков и удалении альтернативных хозяев, таких как сорняки. [13] : 802 Вирусы растений не могут заразить человека и других животных, поскольку могут размножаться только в живых растительных клетках. [13] : 799–807
Родом из Перу, картофель стал основной культурой во всем мире. [180] Картофельный вирус Y вызывает заболевание картофеля и родственных ему видов, включая томаты и перец. В 1980-х годах этот вирус приобрел экономическое значение, когда оказалось, что с ним трудно бороться в посевах семенного картофеля. Передаваемый тлей , этот вирус может снизить урожайность сельскохозяйственных культур до 80 процентов, вызывая значительные потери урожая картофеля. [181]
Растения обладают сложными и эффективными механизмами защиты от вирусов. Одним из наиболее эффективных является наличие так называемых генов устойчивости (R). Каждый ген R придает устойчивость к определенному вирусу, вызывая локализованные области гибели клеток вокруг инфицированной клетки, которые часто можно увидеть невооруженным глазом в виде больших пятен. Это останавливает распространение инфекции. [182] РНК-интерференция также является эффективной защитой растений. [13] : 809 > При заражении растения часто производят естественные дезинфицирующие средства, убивающие вирусы, такие как салициловая кислота , оксид азота и активные молекулы кислорода . [183]
Частицы растительного вируса или вирусоподобные частицы (VLP) находят применение как в биотехнологии, так и в нанотехнологиях . Капсиды большинства растительных вирусов представляют собой простые и надежные структуры и могут производиться в больших количествах либо путем заражения растений, либо путем экспрессии в различных гетерологичных системах. Частицы растительного вируса могут быть модифицированы генетически и химически для инкапсуляции инородного материала и могут быть включены в супрамолекулярные структуры для использования в биотехнологии. [184]
Бактериальные вирусы

Бактериофаги представляют собой распространенную и разнообразную группу вирусов и являются наиболее распространенным биологическим объектом в водной среде: в океанах этих вирусов до десяти раз больше, чем бактерий. [185] достижение уровня 250 000 000 бактериофагов на миллилитр морской воды. [186] Эти вирусы заражают определенные бактерии, связываясь с поверхностными молекулами рецепторов , а затем проникая в клетку. За короткий промежуток времени, в некоторых случаях всего за несколько минут, бактериальная полимераза начинает транслировать вирусную мРНК в белок. Эти белки впоследствии становятся либо новыми вирионами внутри клетки, либо белками-помощниками, которые помогают сборке новых вирионов, либо белками, участвующими в лизисе клеток. Вирусные ферменты способствуют разрушению клеточной мембраны, и, в случае фага Т4 , всего за двадцать минут после инъекции может быть высвобождено более трехсот фагов. [13] : 834–835
Основным способом защиты бактерий от бактериофагов является выработка ферментов, разрушающих чужеродную ДНК. Эти ферменты, называемые эндонуклеазами рестрикции , разрезают вирусную ДНК, которую бактериофаги вводят в бактериальные клетки. [187] Бактерии также содержат систему, которая использует последовательности CRISPR для сохранения фрагментов геномов вирусов, с которыми бактерии ранее контактировали, что позволяет им блокировать репликацию вируса посредством формы РНК-интерференции . [188] [189] Эта генетическая система обеспечивает бактериям приобретенный иммунитет к инфекции. [190]
Некоторые бактериофаги называются « умеренными », поскольку они вызывают латентные инфекции и не сразу уничтожают клетки-хозяева. Вместо этого их ДНК включается в клетку-хозяина в виде профага . Эти скрытые инфекции становятся продуктивными, когда ДНК профага активируется такими стимулами, как изменения в окружающей среде. [191] В кишечнике животных, в том числе человека, содержатся умеренные бактериофаги, которые активируются различными раздражителями, включая изменения в диете и антибиотики. [192] Хотя впервые это было обнаружено у бактериофагов, известно, что многие другие вирусы образуют провирусы , включая ВИЧ. [191] [193]
Архейные вирусы
Некоторые вирусы размножаются внутри архей : это ДНК-вирусы необычной, а иногда и уникальной формы. [4] [55] Наиболее подробно эти вирусы изучены на термофильных археях, в частности на порядках Sulfolobales и Thermoproteales . [194] Защита от этих вирусов включает вмешательство РНК из повторяющихся последовательностей ДНК в геномах архей, которые связаны с генами вирусов. [195] [196] Большинство архей имеют системы CRISPR-Cas в качестве адаптивной защиты от вирусов. Это позволяет археям сохранять участки вирусной ДНК, которые затем используются для нацеливания и устранения последующих заражений вирусом, используя процесс, аналогичный РНК-интерференции. [197]
Роль в водных экосистемах
Вирусы являются наиболее распространенным биологическим объектом в водной среде. [2] В чайной ложке морской воды их около десяти миллионов. [198] Большинство этих вирусов представляют собой бактериофаги, инфицирующие гетеротрофные бактерии, и цианофаги, инфицирующие цианобактерии, и они необходимы для регуляции морских и пресноводных экосистем. [199] Бактериофаги безвредны для растений и животных и необходимы для регуляции морских и пресноводных экосистем. [200] являются важными агентами смертности фитопланктона , основы пищевой цепи в водной среде. [201] Они заражают и уничтожают бактерии в водных микробных сообществах и являются одним из наиболее важных механизмов переработки углерода и круговорота питательных веществ в морской среде. Органические молекулы, высвобождаемые из мертвых бактериальных клеток, стимулируют рост новых бактерий и водорослей в процессе, известном как вирусный шунт . [202] В частности, было показано, что лизис бактерий вирусами усиливает круговорот азота и стимулирует рост фитопланктона. [203] Вирусная активность может также влиять на биологический насос — процесс, посредством которого в глубинах углерод улавливается океана. [204]
Микроорганизмы составляют более 90% биомассы моря. По оценкам, вирусы убивают примерно 20% этой биомассы каждый день, а в океанах вирусов в 10–15 раз больше, чем бактерий и архей. [205] Вирусы также являются основными агентами, ответственными за разрушение фитопланктона , включая вредоносное цветение водорослей . [206] Число вирусов в океанах уменьшается по мере удаления от берега и глубже в воду, где меньше организмов-хозяев. [204]
В январе 2018 года ученые сообщили, что 800 миллионов вирусов, преимущественно морского происхождения, ежедневно оседают из Земли . атмосферы на каждый квадратный метр поверхности планеты в результате глобального атмосферного потока вирусов, циркулирующих над погодной системой но ниже высоты обычного авиаперелета, распространяя вирусы по планете. [207] [208]
Как любой организм, морские млекопитающие восприимчивы к вирусным инфекциям. В 1988 и 2002 годах тысячи тюленей погибли в Европе от вируса чумы чумы . [209] Многие другие вирусы, в том числе калицивирусы , герпесвирусы , аденовирусы и парвовирусы , циркулируют в популяциях морских млекопитающих. [204]
В декабре 2022 года ученые сообщили о первом наблюдении вироворы в ходе эксперимента с прудовой водой, содержащей хлорвирус , который обычно заражает зеленые водоросли в пресноводной среде. Когда все другие источники микробной пищи были удалены из воды, численность инфузорий Halteria увеличилась из-за активного потребления хлоровируса в качестве источника пищи вместо типичного для них бактериоядного рациона. [210] [211]
Роль в эволюции
Вирусы являются важным естественным средством передачи генов между различными видами, что увеличивает генетическое разнообразие и стимулирует эволюцию. [9] [212] [213] Считается, что вирусы играли центральную роль в ранней эволюции, до того, как последний универсальный предок превратился в бактерии, археи и эукариоты. [214] Вирусы по-прежнему являются одним из крупнейших резервуаров неизведанного генетического разнообразия на Земле. [204]
Приложения
Науки о жизни и медицина

Вирусы важны для изучения молекулярной и клеточной биологии , поскольку они представляют собой простые системы, которые можно использовать для манипулирования клетками и исследования их функций. [26] : 8 Изучение и использование вирусов предоставили ценную информацию об аспектах клеточной биологии. [215] Например, вирусы были полезны при изучении генетики и помогли нам понять основные механизмы молекулярной генетики , такие как репликация ДНК , транскрипция , процессинг РНК , трансляция , транспорт белков и иммунология .
Генетики часто используют вирусы в качестве векторов для введения генов в изучаемые клетки. Это полезно для того, чтобы заставить клетку производить чужеродное вещество или изучить эффект от введения нового гена в геном. Точно так же виротерапия использует вирусы в качестве векторов для лечения различных заболеваний, поскольку они могут специфически воздействовать на клетки и ДНК. Он показывает многообещающее применение в лечении рака и в генной терапии . Восточноевропейские ученые уже некоторое время используют фаготерапию в качестве альтернативы антибиотикам, и интерес к этому подходу растет из-за высокого уровня устойчивости к антибиотикам, обнаруженного в настоящее время у некоторых патогенных бактерий. [216] Экспрессия гетерологичных белков вирусами лежит в основе нескольких производственных процессов, которые в настоящее время используются для производства различных белков, таких как вакцинные антигены и антитела. Недавно были разработаны промышленные процессы с использованием вирусных векторов, а несколько фармацевтических белков в настоящее время проходят доклинические и клинические испытания. [217]
Виротерапия
Виротерапия предполагает использование генетически модифицированных вирусов для лечения заболеваний. [218] Ученые модифицировали вирусы, чтобы они размножались в раковых клетках и уничтожали их, но не заражали здоровые клетки. Talimogene laherparepvec (T-VEC), например, представляет собой модифицированный вирус простого герпеса , в котором ген, необходимый вирусам для репликации в здоровых клетках, удален и заменен человеческим геном ( GM-CSF ), который стимулирует иммунитет. Когда этот вирус заражает раковые клетки, он уничтожает их, и при этом наличие гена GM-CSF привлекает дендритные клетки из окружающих тканей организма. Дендритные клетки перерабатывают мертвые раковые клетки и передают их компоненты другим клеткам иммунной системы . [219] После успешных клинических испытаний вирус получил одобрение для лечения меланомы в конце 2015 года. [220] Вирусы, перепрограммированные для уничтожения раковых клеток, называются онколитическими вирусами . [221]
Материаловедение и нанотехнологии
С точки зрения материаловеда, вирусы можно рассматривать как органические наночастицы . [222] На их поверхности имеются специальные инструменты, которые позволяют им преодолевать барьеры клеток-хозяев. Точно определены размеры и форма вирусов, количество и характер функциональных групп на их поверхности. Таким образом, вирусы обычно используются в материаловедении в качестве каркасов для ковалентно связанных модификаций поверхности. Особое качество вирусов заключается в том, что их можно адаптировать путем направленной эволюции. Мощные методы, разработанные науками о жизни, становятся основой инженерных подходов к наноматериалам, открывая широкий спектр приложений, выходящих далеко за рамки биологии и медицины. [223] Благодаря своему размеру, форме и четко определенной химической структуре вирусы использовались в качестве шаблонов для организации материалов на наноуровне. Примеры включают работу в Военно-морской исследовательской лаборатории в Вашингтоне, округ Колумбия, по использованию частиц вируса мозаики вигны (CPMV) для усиления сигналов в датчиках на основе микрочипов ДНК . В этом приложении вирусные частицы отделяют флуоресцентные красители, используемые для передачи сигналов, чтобы предотвратить образование нефлуоресцентных димеров , которые действуют как тушители . [224] Другим примером является использование CPMV в качестве наноразмерного макета для молекулярной электроники. [225]
Синтетические вирусы
Многие вирусы могут быть синтезированы de novo («с нуля»). Первый синтетический вирус был создан в 2002 году. [226] Хотя это некоторое заблуждение, синтезируется не сам вирус, а скорее его ДНК-геном (в случае ДНК-вируса) или кДНК- копия его генома (в случае РНК-вирусов). Для многих семейств вирусов обнаженная синтетическая ДНК или РНК (после ферментативного преобразования обратно из синтетической кДНК) является заразной при введении в клетку. То есть они содержат всю необходимую информацию для создания новых вирусов. Эта технология сейчас используется для исследования новых стратегий вакцинации. [227] Способность синтезировать вирусы имеет далеко идущие последствия, поскольку вирусы больше нельзя считать вымершими, пока известна информация о последовательности их генома и пермиссивные доступны клетки. По состоянию на июнь 2021 года полноразмерные последовательности генома 11 464 различных вирусов, включая оспу, общедоступны в онлайн-базе данных, поддерживаемой Национальными институтами здравоохранения . [228]
Оружие
Способность вирусов вызывать разрушительные эпидемии в человеческом обществе привела к опасениям, что вирусы могут быть использованы в качестве оружия для биологической войны . Дополнительную обеспокоенность вызвало успешное воссоздание гриппа 1918 года . в лаборатории печально известного вируса [229] Вирус оспы опустошал множество обществ на протяжении всей истории, прежде чем был искоренен. В мире есть только два центра, уполномоченных ВОЗ хранить запасы вируса оспы: Государственный научный центр вирусологии и биотехнологии «ВЕКТОР» в России и Центры по контролю и профилактике заболеваний в США. [230] Его можно использовать как оружие, [230] поскольку вакцина от оспы иногда вызывала серьезные побочные эффекты, она больше не используется на регулярной основе ни в одной стране. Таким образом, большая часть современного человечества почти не имеет устойчивой устойчивости к оспе и будет уязвима для этого вируса. [230]
См. также
- Межвидовая передача
- Глоссарий вирусологии
- Закон снижения вирулентности – Опровергнутая гипотеза эпидемиолога Теобальда Смита
- Неклеточная жизнь
- Агент переноса генов
- Ретрозим
- Наименьшие организмы
- Теория вирулентности - теория биолога Пола В. Эвальда.
- Вирусная метагеномика
- Вироплазма
- Зооноз
Ссылки
- ^ Ву К.Дж. (15 апреля 2020 г.). «Во Вселенной больше вирусов, чем звезд. Почему нас заражают лишь некоторые из них? – На Земле существует более квадриллиона квадриллионов отдельных вирусов, но большинство из них не готовы проникнуть в человека. Сможем ли мы найти те, которые есть?» . Национальное географическое общество . Архивировано из оригинала 15 апреля 2020 года . Проверено 18 мая 2020 г.
- ^ Перейти обратно: а б с Кунин Е.В., Сенкевич Т.Г., Доля В.В. (сентябрь 2006 г.). «Древний мир вирусов и эволюция клеток» . Биология Директ . 1 (1): 29. дои : 10.1186/1745-6150-1-29 . ПМК 1594570 . ПМИД 16984643 .
- ^ Циммер С (26 февраля 2021 г.). «Тайная жизнь коронавируса. Маслянистый пузырь генов шириной 100 нанометров убил более двух миллионов человек и изменил мир. Ученые не совсем знают, что с этим делать» . Нью-Йорк Таймс . Архивировано из оригинала 28 декабря 2021 года . Проверено 28 февраля 2021 г.
- ^ Перейти обратно: а б Лоуренс CM, Менон С., Эйлерс Б.Дж., Ботнер Б., Хаят Р., Дуглас Т. и др. (май 2009 г.). «Структурно-функциональные исследования архейных вирусов» . Журнал биологической химии . 284 (19): 12599–603. дои : 10.1074/jbc.R800078200 . ПМК 2675988 . ПМИД 19158076 .
- ^ Эдвардс Р.А., Ровер Ф. (июнь 2005 г.). «Вирусная метагеномика». Обзоры природы. Микробиология . 3 (6): 504–10. дои : 10.1038/nrmicro1163 . ПМИД 15886693 . S2CID 8059643 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н Диммок, Нью-Джерси, Истон А.Дж., Леппард К. (2007). Введение в современную вирусологию (6-е изд.). Издательство Блэквелл. ISBN 978-1-4051-3645-7 .
- ^ Перейти обратно: а б с «Таксономия вирусов: выпуск 2022 г.» . talk.ictvonline.org . Международный комитет по таксономии вирусов . Проверено 27 апреля 2023 г.
- ^ Перейти обратно: а б Брейтбарт М. , Ровер Ф. (июнь 2005 г.). «Тут вирус, там вирус, везде один и тот же вирус?». Тенденции в микробиологии . 13 (6): 278–84. дои : 10.1016/j.tim.2005.04.003 . ПМИД 15936660 .
- ^ Перейти обратно: а б Канчая С., Фурнус Г., Чибани-Шеннуфи С., Диллманн М.Л., Брюссов Х. (август 2003 г.). «Фаг как агент латерального переноса генов». Современное мнение в микробиологии . 6 (4): 417–24. дои : 10.1016/S1369-5274(03)00086-9 . ПМИД 12941415 .
- ^ Перейти обратно: а б Рыбицкий Е.П. (1990). «Классификация организмов на пороге жизни, или Проблемы вирусной систематики». Южноафриканский научный журнал . 86 : 182–86.
- ^ Перейти обратно: а б Кунин Е.В., Старокадомский П. (октябрь 2016 г.). «Живы ли вирусы? Парадигма репликатора проливает решающий свет на старый, но ошибочный вопрос» . Исследования по истории и философии биологических и биомедицинских наук . 59 : 125–34. дои : 10.1016/j.shpsc.2016.02.016 . ПМК 5406846 . ПМИД 26965225 .
- ^ Робилотти Э., Дерезинский С., Пинский Б.А. (январь 2015 г.). «Норовирус» . Обзоры клинической микробиологии . 28 (1): 134–64. дои : 10.1128/CMR.00075-14 . ПМЦ 4284304 . ПМИД 25567225 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с Шорс Т (2017). Понимание вирусов . Издательство Джонс и Бартлетт. ISBN 978-1-284-02592-7 .
- ^ «Вирус, н.». ОЭД онлайн . Издательство Оксфордского университета. Март 2015.
- ^ Перейти обратно: а б Харпер Д. (2011). "вирус" . Интернет-словарь этимологии . Проверено 19 декабря 2014 г.
- ^ «Яростный, прил.». ОЭД онлайн . Издательство Оксфордского университета. Март 2015.
- ^ Харпер Д. (2011). «вирулентный» . Интернет-словарь этимологии . Проверено 19 декабря 2014 г.
- ^ Бушард К., Тон Р. (2003). «Модели животных с диабетом». В Хау Дж., Ван Хузьер-младший Г.Л. (ред.). Справочник по лабораторным зоотехникам . Модели животных. Том. II (2-е изд.). ЦРК Пресс. стр. 163, 166.
- ^ Уильям Т. Стерн: Ботаническая латынь. История, грамматика, синтаксис, терминология и словарный запас. Дэвид и Чарльз, 3-е изд., 1983. Цитата: «Вирус: вирус (SN II), gen. Sing. Viri, nom. pl. vira, gen. pl. vīrorum (отличать от virorum , мужчин)».
- ^ Харпер Д. (2011). "популярный" . Интернет-словарь этимологии . Проверено 19 декабря 2014 г.
- ^ Харпер Д. (2011). «вирион» . Интернет-словарь этимологии . Проверено 19 декабря 2014 г.
- ^ Касьенс С (2010). Махи Б.В., Ван Регенмортель М.Х. (ред.). Настольная энциклопедия общей вирусологии . Бостон: Академическая пресса. п. 167. ИСБН 978-0-12-375146-1 .
- ^ Айер Л.М., Баладжи С., Кунин Е.В., Аравинд Л. (апрель 2006 г.). «Эволюционная геномика ядерно-цитоплазматических крупных ДНК-вирусов» . Вирусные исследования . 117 (1): 156–84. doi : 10.1016/j.virusres.2006.01.009 . ПМИД 16494962 .
- ^ Перейти обратно: а б Санхуан Р., Небот М.Р., Кирико Н., Мански Л.М., Белшоу Р. (октябрь 2010 г.). «Темпы вирусных мутаций» . Журнал вирусологии . 84 (19): 9733–9748. дои : 10.1128/JVI.00694-10 . ПМЦ 2937809 . ПМИД 20660197 .
- ^ Крупович М., Доля В.В., Кунин Е.В. (июль 2019 г.). «Происхождение вирусов: первичные репликаторы, рекрутирующие капсиды от хозяев» (PDF) . Обзоры природы. Микробиология . 17 (7): 449–58. дои : 10.1038/s41579-019-0205-6 . ПМИД 31142823 . S2CID 256744818 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в Коллиер Л., Балоуз А., Сассман М. (1998). Мэхи Б., Коллиер Л.А. (ред.). Микробиология и микробные инфекции Топли и Уилсона . Вирусология. Том. 1 (9-е изд.). ISBN 0-340-66316-2 .
- ^ Перейти обратно: а б с д и ж г час Мэхи У.Дж., Регенмортель М.Х., ред. (2009). Настольная энциклопедия общей вирусологии . Оксфорд: Академическая пресса. ISBN 978-0-12-375146-1 .
- ^ МакКлинток Б. (июнь 1950 г.). «Происхождение и поведение мутабельных локусов кукурузы» . Труды Национальной академии наук Соединенных Штатов Америки . 36 (6): 344–55. Бибкод : 1950ПНАС...36..344М . дои : 10.1073/pnas.36.6.344 . ПМЦ 1063197 . ПМИД 15430309 .
- ^ Цагрис Э.М., Мартинес де Альба А.Е., Гозманова М., Калантидис К. (ноябрь 2008 г.). «Вироиды» . Клеточная микробиология . 10 (11): 2168–79. дои : 10.1111/j.1462-5822.2008.01231.x . ПМИД 18764915 . S2CID 221581424 .
- ^ Перейти обратно: а б Ла Скола Б., Десню С., Панье И., Робер С., Баррасси Л., Фурнус Г. и др. (сентябрь 2008 г.). «Вирофаг как уникальный паразит гигантского мимивируса». Природа . 455 (7209): 100–04. Бибкод : 2008Natur.455..100L . дои : 10.1038/nature07218 . ПМИД 18690211 . S2CID 4422249 .
- ^ Диммок, стр. 15–16.
- ^ Зербини FM, Китадзима EW (сентябрь 2022 г.). «От Contagium vivum Liquidum до Рибовирии: Вирус-центричная история таксономии вирусов табачной мозаики» . Биомолекулы . 12 (10): 1363. doi : 10.3390/biom12101363 . ПМК 9599303 . ПМИД 36291572 .
- ^ Холмс ЕС (октябрь 2007 г.). «Эволюция вирусов в эпоху генома» . ПЛОС Биология . 5 (10): е278. doi : 10.1371/journal.pbio.0050278 . ЧВК 1994994 . ПМИД 17914905 .
- ^ Виммер Э., Мюллер С., Тумпей Т.М., Таубенбергер Дж.К. (декабрь 2009 г.). «Синтетические вирусы: новая возможность понять и предотвратить вирусные заболевания» . Природная биотехнология . 27 (12): 1163–72. дои : 10.1038/nbt.1593 . ПМК 2819212 . ПМИД 20010599 .
- ^ Хорн М (2008). «Хламидии как симбионты у эукариот». Ежегодный обзор микробиологии . 62 : 113–31. дои : 10.1146/annurev.micro.62.081307.162818 . ПМИД 18473699 .
- ^ Аммерман, Северная Каролина, Бейер-Секстон М., Азад А.Ф. (ноябрь 2008 г.). «Лабораторное содержание Rickettsia rickettsii» . Современные протоколы в микробиологии . 11 (1): 3А.5.1–3А.5.21. дои : 10.1002/9780471729259.mc03a05s11 . ISBN 978-0471729259 . ПМЦ 2725428 . ПМИД 19016440 .
- ^ Фортер, П. Концепция вироцелл и микробиология окружающей среды. ISME J 7, 233–236 (2013). https://doi.org/10.1038/ismej.2012.110
- ^ ДеЛонг Дж.П., Аль-Саммак М.А., Аль-Амели З.Т., Дуниган Д.Д., Эдвардс К.Ф., Фурманн Дж.Дж. и др. (февраль 2022 г.). «К интегративному взгляду на фенотипы вирусов». Обзоры природы. Микробиология . 20 (2): 83–94. дои : 10.1038/s41579-021-00612-w . ПМИД 34522049 .
- ^ Краснер Р. (2014). Микробная проблема: взгляд на общественное здравоохранение . Берлингтон, Массачусетс: Jones & Bartlett Learning. ISBN 978-1-4496-7375-8 . OCLC 794228026 .
- ^ Киселев Н.А., Шерман М.Б., Цупрун В.Л. (1990). «Отрицательное окрашивание белков». Обзоры электронной микроскопии . 3 (1): 43–72. дои : 10.1016/0892-0354(90)90013-I . ПМИД 1715774 .
- ^ Каспар Д.Л., Клюг А. (1962). «Физические принципы построения обычных вирусов». Симпозиумы Колд-Спринг-Харбор по количественной биологии . 27 : 1–24. дои : 10.1101/sqb.1962.027.001.005 . ПМИД 14019094 .
- ^ Крик Ф.Х., Уотсон JD (март 1956 г.). «Строение малых вирусов». Природа . 177 (4506): 473–75. Бибкод : 1956Natur.177..473C . дои : 10.1038/177473a0 . ПМИД 13309339 . S2CID 5740221 .
- ^ Фальво М.Р., Уошберн С., Суперфайн Р., Финч М., Брукс Ф.П., Чи В. и др. (март 1997 г.). «Манипуляции с отдельными вирусами: трение и механические свойства» . Биофизический журнал . 72 (3): 1396–403. Бибкод : 1997BpJ....72.1396F . дои : 10.1016/S0006-3495(97)78786-1 . ПМК 1184522 . ПМИД 9138585 .
- ^ Кузнецов Ю.Г., Малкин А.Дж., Лукас Р.В., Пломп М., Макферсон А. (сентябрь 2001 г.). «Изображение вирусов методом атомно-силовой микроскопии» . Журнал общей вирусологии . 82 (Часть 9): 2025–34. дои : 10.1099/0022-1317-82-9-2025 . ПМИД 11514711 .
- ^ Штраус С.К., Бо Х.Э. (2018). «Белки и сборка нитевидных бактериофагов». Вирусные белки и нуклеопротеиновые комплексы . Субклеточная биохимия. Том. 88. стр. 261–79. дои : 10.1007/978-981-10-8456-0_12 . ISBN 978-981-10-8455-3 . ПМИД 29900501 .
- ^ Уилсон Д.П. (2016). «Выступающие элементы вирусных капсидов сгруппированы на больших икосаэдрических кругах» . ПЛОС ОДИН . 11 (4): e0152319. Бибкод : 2016PLoSO..1152319W . дои : 10.1371/journal.pone.0152319 . ПМЦ 4821576 . ПМИД 27045511 .
- ^ Казенс С. (2009). Настольная энциклопедия общей вирусологии . Бостон: Академическая пресса. стр. 167–74. ISBN 978-0-12-375146-1 .
- ^ Дхама К., Хан С., Тивари Р., Сиркар С., Бхат С., Малик Ю.С. и др. (сентябрь 2020 г.). «Коронавирусная болезнь 2019-COVID-19» . Обзоры клинической микробиологии . 33 (4). дои : 10.1128/CMR.00028-20 . ПМЦ 7405836 . ПМИД 32580969 .
- ^ Россманн М.Г., Месянжинов В.В., Арисака Ф., Лейман П.Г. (апрель 2004 г.). «Машина для инъекции ДНК бактериофага Т4». Современное мнение в области структурной биологии . 14 (2): 171–80. дои : 10.1016/j.sbi.2004.02.001 . ПМИД 15093831 .
- ^ Лонг Г.В., Нобель Дж., Мерфи Ф.А., Херрманн К.Л., Лури Б. (сентябрь 1970 г.). «Опыт применения электронной микроскопии в дифференциальной диагностике оспы» . Прикладная микробиология . 20 (3): 497–504. дои : 10.1128/АЕМ.20.3.497-504.1970 . ПМК 376966 . ПМИД 4322005 .
- ^ Сюзан-Монти М., Ла Скола Б., Рауль Д. (апрель 2006 г.). «Геномные и эволюционные аспекты мимивируса». Вирусные исследования . 117 (1): 145–55. doi : 10.1016/j.virusres.2005.07.011 . ПМИД 16181700 .
- ^ Арслан Д., Лежандр М., Зельцер В., Абергель С., Клавери Дж. М. (октябрь 2011 г.). «Отдаленный родственник мимивируса с более крупным геномом подчеркивает фундаментальные особенности мегавирусов» . Труды Национальной академии наук Соединенных Штатов Америки . 108 (42): 17486–91. Бибкод : 2011PNAS..10817486A . дои : 10.1073/pnas.1110889108 . ПМК 3198346 . ПМИД 21987820 .
- ^ Перейти обратно: а б Филипп Н., Лежандр М., Дутр Дж., Куте Ю., Пуаро О., Леско М. и др. (июль 2013 г.). «Пандоравирусы: амеба-вирусы с геномами до 2,5 МБ, достигающими генома паразитических эукариот» (PDF) . Наука . 341 (6143): 281–86. Бибкод : 2013Sci...341..281P . дои : 10.1126/science.1239181 . ПМИД 23869018 . S2CID 16877147 .
- ^ Брандес Н., Линиал М. (апрель 2019 г.). «Гигантские вирусы – большие сюрпризы» . Вирусы . 11 (5): 404. дои : 10.3390/v11050404 . ПМК 6563228 . ПМИД 31052218 .
- ^ Перейти обратно: а б Прангишвили Д., Фортер П., Гаррет Р.А. (ноябрь 2006 г.). «Вирусы архей: объединяющий взгляд». Обзоры природы. Микробиология . 4 (11): 837–48. дои : 10.1038/nrmicro1527 . ПМИД 17041631 . S2CID 9915859 .
- ^ «База данных вирусных геномов NCBI» . ncbi.nlm.nih.gov . Проверено 15 января 2017 г.
- ^ Пенниси Э (март 2011 г.). «Микробиология. Виральность: изучение роли вирусов в нашем организме». Наука . 331 (6024): 1513. Бибкод : 2011Sci...331.1513P . дои : 10.1126/science.331.6024.1513 . ПМИД 21436418 .
- ^ Ши М., Линь XD, Тянь Дж.Х., Чен Л.Дж., Чен X, Ли CX и др. (декабрь 2016 г.). «Переопределение виросферы РНК беспозвоночных». Природа . 540 (7634): 539–43. Бибкод : 2016Natur.540..539S . дои : 10.1038/nature20167 . ПМИД 27880757 . S2CID 1198891 .
- ^ Сондерс В.А., Картер Дж. (2007). Вирусология: принципы и приложения . Чичестер: Джон Уайли и сыновья. п. 72. ИСБН 978-0-470-02387-7 .
- ^ Белый В.А., Левин А.Дж., Скалка А.М. (декабрь 2010 г.). «Последовательности предковых одноцепочечных ДНК-вирусов в геномах позвоночных: парвовирусам и цирковирусам более 40–50 миллионов лет» . Журнал вирусологии . 84 (23): 12458–62. дои : 10.1128/JVI.01789-10 . ПМЦ 2976387 . ПМИД 20861255 .
- ^ Брандес Н., Линиал М. (май 2016 г.). «Перекрытие генов и ограничения размера в вирусном мире» . Биология Директ . 11 (1): 26. дои : 10.1186/s13062-016-0128-3 . ПМЦ 4875738 . ПМИД 27209091 .
- ^ Нажатие J, Рианни, округ Колумбия (1984). «Разделенные геномы и внутренний шум» . Журнал молекулярной эволюции . 20 (2): 135–46. Бибкод : 1984JMolE..20..135P . дои : 10.1007/BF02257374 . ПМЦ 7087551 . ПМИД 6433032 .
- ^ Даффи С., Холмс ЕС (июнь 2009 г.). «Подтверждение высоких показателей нуклеотидных замен в геминивирусах: филогенетические данные восточноафриканских вирусов мозаики маниоки» . Журнал общей вирусологии . 90 (Часть 6): 1539–47. дои : 10.1099/vir.0.009266-0 . ПМК 4091138 . ПМИД 19264617 .
- ^ Сандбулте М.Р., Вестгест К.Б., Гао Дж., Сюй X, Климов А.И., Рассел К.А. и др. (декабрь 2011 г.). «Диссонансный антигенный дрейф нейраминидазы и гемагглютинина у вирусов гриппа H1N1 и H3N2» . Труды Национальной академии наук Соединенных Штатов Америки . 108 (51): 20748–53. Бибкод : 2011PNAS..10820748S . дои : 10.1073/pnas.1113801108 . ПМК 3251064 . ПМИД 22143798 .
- ^ Мосс Р.Б., Дэйви Р.Т., Стейгбигель Р.Т., Фанг Ф. (июнь 2010 г.). «Нацеленность на пандемический грипп: введение в противовирусные препараты против гриппа и лекарственную устойчивость» . Журнал антимикробной химиотерапии . 65 (6): 1086–93. дои : 10.1093/jac/dkq100 . ПМИД 20375034 .
- ^ Хэмпсон А.В., Маккензи Дж.С. (ноябрь 2006 г.). «Вирусы гриппа». Медицинский журнал Австралии . 185 (С10): С39–43. дои : 10.5694/j.1326-5377.2006.tb00705.x . ПМИД 17115950 . S2CID 17069567 .
- ^ Мецнер К.Дж. (декабрь 2006 г.). «Обнаружение и значение квазивидов меньшинства лекарственно-устойчивого ВИЧ-1». Журнал терапии ВИЧ . 11 (4): 74–81. ПМИД 17578210 .
- ^ Гаудсмит, Яап. Вирусный секс . Издательство Оксфордского университета, 1998. ISBN 978-0-19-512496-5
- ^ Воробей М., Холмс ЕС (октябрь 1999 г.). «Эволюционные аспекты рекомбинации РНК-вирусов» . Журнал общей вирусологии . 80 (10): 2535–43. дои : 10.1099/0022-1317-80-10-2535 . ПМИД 10573145 .
- ^ Лукашев А.Н. (2005). «Роль рекомбинации в эволюции энтеровирусов». Обзоры по медицинской вирусологии . 15 (3): 157–67. дои : 10.1002/rmv.457 . ПМИД 15578739 . S2CID 26000112 .
- ^ Умене К. (июль 1999 г.). «Механизм и применение генетической рекомбинации у герпесвирусов». Обзоры по медицинской вирусологии . 9 (3): 171–82. doi : 10.1002/(SICI)1099-1654(199907/09)9:3<171::AID-RMV243>3.0.CO;2-A . ПМИД 10479778 . S2CID 43110533 .
- ^ Су С., Вонг Г., Ши В., Лю Дж., Лай А.С., Чжоу Дж. и др. (июнь 2016 г.). «Эпидемиология, генетическая рекомбинация и патогенез коронавирусов» . Тенденции в микробиологии . 24 (6): 490–502. дои : 10.1016/j.tim.2016.03.003 . ПМК 7125511 . ПМИД 27012512 .
- ^ Барр Дж. Н., Фернс Р. (июнь 2010 г.). «Как РНК-вирусы сохраняют целостность своего генома». Журнал общей вирусологии . 91 (Часть 6): 1373–87. дои : 10.1099/vir.0.020818-0 . ПМИД 20335491 .
- ^ Фрид Э.О. (август 2015 г.). «Сборка, высвобождение и созревание ВИЧ-1» . Обзоры природы. Микробиология . 13 (8): 484–96. дои : 10.1038/nrmicro3490 . ПМК 6936268 . ПМИД 26119571 .
- ^ Инь Дж., Редович Дж. (июнь 2018 г.). «Кинетическое моделирование роста вирусов в клетках» . Обзоры микробиологии и молекулярной биологии . 82 (2). дои : 10.1128/MMBR.00066-17 . ПМЦ 5968458 . ПМИД 29592895 .
- ^ Мас В., Мелеро Х.А. (2013). «Вход вирусов с оболочкой в клетки-хозяева: слияние мембран». Структура и физика вирусов . Субклеточная биохимия. Том. 68. стр. 467–87. дои : 10.1007/978-94-007-6552-8_16 . ISBN 978-94-007-6551-1 . ПМК 7121288 . ПМИД 23737062 .
- ^ Боевинк П., Опарка К.Дж. (август 2005 г.). «Взаимодействие вируса с хозяином в процессах перемещения» . Физиология растений . 138 (4): 1815–21. дои : 10.1104/стр.105.066761 . ПМЦ 1183373 . ПМИД 16172094 .
- ^ Блаас Д. (май 2016 г.). «Пути проникновения вирусов: на примере вирусов простуды» . Wiener Medizinische Wochenschrift . 166 (7–8): 211–26. дои : 10.1007/s10354-016-0461-2 . ПМЦ 4871925 . ПМИД 27174165 .
- ^ Исомура Х, Стински М.Ф. (февраль 2013 г.). «Координация поздней транскрипции гена цитомегаловируса человека с синтезом вирусной ДНК: рекомбинантные вирусы как потенциальные кандидаты на терапевтические вакцины». Мнение экспертов о терапевтических целях . 17 (2): 157–66. дои : 10.1517/14728222.2013.740460 . ПМИД 23231449 . S2CID 11448687 .
- ^ Барман С., Али А., Хуэй Е.К., Адхикари Л., Наяк Д.П. (сентябрь 2001 г.). «Транспорт вирусных белков к апикальным мембранам и взаимодействие матриксного белка с гликопротеинами при сборке вирусов гриппа». Вирусные исследования . 77 (1): 61–69. дои : 10.1016/S0168-1702(01)00266-0 . ПМИД 11451488 .
- ^ Стагиннус С, Рихерт-Пёггелер КР (октябрь 2006 г.). «Эндогенные параретровирусы: двуличные путешественники в геноме растений». Тенденции в науке о растениях . 11 (10): 485–91. Бибкод : 2006TPS....11..485S . doi : 10.1016/j.tplants.2006.08.008 . ПМИД 16949329 .
- ^ Роулстон А., Марселлус Р.К., Брэнтон П.Е. (1999). «Вирусы и апоптоз». Ежегодный обзор микробиологии . 53 : 577–628. дои : 10.1146/аннурев.микро.53.1.577 . ПМИД 10547702 .
- ^ Алвин Дж. К. (2008). «Модуляция стрессовых реакций клеток-хозяев с помощью цитомегаловируса человека». Цитомегаловирус человека . Актуальные темы микробиологии и иммунологии. Том. 325. стр. 263–79. дои : 10.1007/978-3-540-77349-8_15 . ISBN 978-3-540-77348-1 . ПМИД 18637511 .
- ^ Бароцци П., Потенца Л., Рива Г., Валлерини Д., Квадрелли С., Боско Р. и др. (декабрь 2007 г.). «В-клетки и герпесвирусы: модель лимфопролиферации». Обзоры аутоиммунитета . 7 (2): 132–36. дои : 10.1016/j.autrev.2007.02.018 . ПМИД 18035323 .
- ^ Субраманья Д., Гривас П.Д. (ноябрь 2008 г.). «ВПЧ и рак шейки матки: обновленная информация об установившихся отношениях». Последипломное образование по медицине . 120 (4): 7–13. doi : 10.3810/pgm.2008.11.1928 . ПМИД 19020360 . S2CID 1399003 .
- ^ Синклер Дж. (март 2008 г.). «Цитомегаловирус человека: латентный период и реактивация миелоидного ряда». Журнал клинической вирусологии . 41 (3): 180–85. дои : 10.1016/j.jcv.2007.11.014 . ПМИД 18164651 .
- ^ Джордан MC, Джордан Г.В., Стивенс Дж.Г., Миллер Дж. (июнь 1984 г.). «Латентные герпесвирусы человека». Анналы внутренней медицины . 100 (6): 866–80. дои : 10.7326/0003-4819-100-6-866 . ПМИД 6326635 .
- ^ Сиссонс Дж.Г., Бэйн М., Уиллс М.Р. (февраль 2002 г.). «Латентность и реактивация цитомегаловируса человека». Журнал инфекции . 44 (2): 73–77. дои : 10.1053/jinf.2001.0948 . ПМИД 12076064 .
- ^ Кроуфорд Д.Х. (2011). «Глава 2: Вирусы повсюду» . Вирусы: очень краткое введение . Издательство Оксфордского университета, США. п. 16 . ISBN 978-0-19-957485-8 .
- ^ Баггесен Д.Л., Соренсен Г., Нильсен Э.М., Вегенер Х.К. (январь 2010 г.). «Фаготипирование Salmonella Typhimurium – остается ли оно полезным инструментом для надзора и расследования вспышек?» . Евронаблюдение . 15 (4): 19471. PMID 20122382 . Проверено 19 декабря 2014 г.
- ^ Паркер М.Т. (сентябрь 2016 г.). «Экологическая основа человеческого вирома обеспечивает классификацию текущих знаний и определяет области предстоящих открытий» . Йельский журнал биологии и медицины . 89 (3): 339–51. ПМК 5045143 . ПМИД 27698618 .
- ^ Вулхаус М., Скотт Ф., Хадсон З., Хоуи Р., Чейз-Топпинг М. (октябрь 2012 г.). «Человеческие вирусы: открытие и возникновение» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 367 (1604): 2864–71. дои : 10.1098/rstb.2011.0354 . ПМЦ 3427559 . ПМИД 22966141 .
- ^ Перейти обратно: а б Ашур Х.М., Эльхатиб В.Ф., Рахман М.М., Эльшабрави Х.А. (март 2020 г.). «Информация о недавнем новом коронавирусе 2019 года (SARS-CoV-2) в свете прошлых вспышек коронавируса среди людей» . Патогены . 9 (3): 186. doi : 10.3390/pathogens9030186 . ПМК 7157630 . ПМИД 32143502 .
- ^ Львофф А., Хорн Р.В., Турнье П. (июнь 1962 г.). «[Вирусная система]». Еженедельные отчеты сессий Академии наук (на французском языке). 254 :4225–27. ПМИД 14467544 .
- ^ Львофф А., Хорн Р., Турнье П. (1962). «Система вирусов». Симпозиумы Колд-Спринг-Харбор по количественной биологии . 27 : 51–55. дои : 10.1101/sqb.1962.027.001.008 . ПМИД 13931895 .
- ^ Фоке СМ, Фаржетт Д (август 2005 г.). «Международный комитет по таксономии вирусов и 3142 неустановленных видов» . Вирусологический журнал . 2:64 . дои : 10.1186/1743-422X-2-64 . ПМК 1208960 . ПМИД 16105179 .
- ^ Исполнительный комитет Международного комитета по таксономии вирусов (май 2020 г.). «Новая сфера таксономии вирусов: разделение виросферы на 15 иерархических рангов» . Нат Микробиол . 5 (5): 668–74. дои : 10.1038/s41564-020-0709-x . ПМК 7186216 . ПМИД 32341570 .
- ^ Хан МК, Алам ММ (июль 2021 г.). «Вспышки норовирусного гастроэнтерита, геномное разнообразие и эволюция: обзор». Медицинский журнал Майменсингха . 30 (3): 863–73. ПМИД 34226482 .
- ^ Эберле Дж., Гюртлер Л. (2012). «Типы, группы, подтипы и рекомбинантные формы ВИЧ: ошибки репликации, давление отбора и квазивиды» . Интервирусология . 55 (2): 79–83. дои : 10.1159/000331993 . ПМИД 22286874 . S2CID 5642060 .
- ^ Исполнительный комитет Международного комитета по таксономии вирусов (май 2020 г.). «Новая сфера таксономии вирусов: разделение виросферы на 15 иерархических рангов» . Природная микробиология . 5 (5): 668–674. дои : 10.1038/s41564-020-0709-x . ПМК 7186216 . ПМИД 32341570 .
- ^ Делварт Э.Л. (2007). «Вирусная метагеномика» . Обзоры по медицинской вирусологии . 17 (2): 115–131. дои : 10.1002/rmv.532 . ПМК 7169062 . ПМИД 17295196 .
- ^ Темин Х.М., Балтимор Д. (1972). «РНК-направленный синтез ДНК и РНК-опухолевые вирусы». Достижения в области исследования вирусов . 17 : 129–86. дои : 10.1016/S0065-3527(08)60749-6 . ISBN 978-0120398171 . ПМИД 4348509 .
- ^ Балтимор Д. (1974). «Стратегия РНК-вирусов». Лекции Харви . 70 серия. 70 серия: 57–74. ПМИД 4377923 .
- ^ ван Регенмортель М.Х., Махи Б.В. (январь 2004 г.). «Новые проблемы систематики вирусов» . Новые инфекционные заболевания . 10 (1): 8–13. дои : 10.3201/eid1001.030279 . ПМЦ 3322749 . ПМИД 15078590 .
- ^ Мэйо, Массачусетс (1999). «Достижения в таксономии вирусов растений с момента публикации 6-го отчета ICTV. Международный комитет по таксономии вирусов» . Архив вирусологии . 144 (8): 1659–66. дои : 10.1007/s007050050620 . ПМИД 10486120 . S2CID 33422303 .
- ^ де Вильерс Э.М., Фоке С., Брокер Т.Р., Бернар Х.У., Цур Хаузен Х. (июнь 2004 г.). «Классификация папилломавирусов». Вирусология . 324 (1): 17–27. дои : 10.1016/j.virol.2004.03.033 . ПМИД 15183049 .
- ^ Фишер Б., Харви Р.П., Чамп ПК (2007). «Глава 33 (Краткое описание болезней)». Иллюстрированные обзоры Липпинкотта: Микробиология . Серия иллюстрированных обзоров Липпинкотта. Хагерствон, доктор медицины: Липпинкотт Уильямс и Уилкинс. стр. 367–392. ISBN 978-0-7817-8215-9 .
- ^ Комаров А.Л. (декабрь 2006 г.). «Является ли вирус герпеса человека-6 триггером синдрома хронической усталости?». Журнал клинической вирусологии . 37 (Приложение 1): S39–46. дои : 10.1016/S1386-6532(06)70010-5 . ПМИД 17276367 .
- ^ Чен Ч., Чиу Ю.Л., Вэй Ф.К., Кунг Ф.Дж., Лю Х.К., Шоу С.К. и др. (январь 1999 г.). «Высокая распространенность вирусной инфекции Борна среди больных шизофренией, членов их семей и работников психиатрической службы на Тайване» . Молекулярная психиатрия . 4 (1): 33–38. дои : 10.1038/sj.mp.4000484 . ПМИД 10089006 . S2CID 19830976 .
- ^ Марголис Т.П., Эльфман Ф.Л., Лейб Д., Пакпур Н., Апакупакул К., Имаи Ю. и др. (октябрь 2007 г.). «Спонтанная реактивация вируса простого герпеса типа 1 в латентно инфицированных сенсорных ганглиях мышей» . Журнал вирусологии . 81 (20): 11069–74. дои : 10.1128/JVI.00243-07 . ПМК 2045564 . ПМИД 17686862 .
- ^ Уитли Р.Дж., Ройзман Б. (май 2001 г.). «Инфекции, вызванные вирусом простого герпеса». Ланцет . 357 (9267): 1513–18. дои : 10.1016/S0140-6736(00)04638-9 . ПМИД 11377626 . S2CID 9854903 .
- ^ Бартон Э.С., Уайт Д.В., Кэтлин Дж.С., Бретт-Макклеллан К.А., Энгл М., Даймонд М.С. и др. (май 2007 г.). «Латентность вируса герпеса обеспечивает симбиотическую защиту от бактериальной инфекции». Природа . 447 (7142): 326–29. Бибкод : 2007Natur.447..326B . дои : 10.1038/nature05762 . ПМИД 17507983 . S2CID 4425405 .
- ^ Бертолетти А., Геринг А. (октябрь 2007 г.). «Иммунный ответ и толерантность при хронической инфекции вируса гепатита В». Гепатологические исследования . 37 (Приложение 3): S331–38. дои : 10.1111/j.1872-034X.2007.00221.x . ПМИД 17931183 . S2CID 13386004 .
- ^ Родригес С., Дешмук М., Джейкоб Т., Нукала Р., Менон С., Мехта А. (2001). «Значение ДНК ВГВ с помощью ПЦР по сравнению с серологическими маркерами ВГВ у острых и хронических пациентов». Индийский журнал медицинской микробиологии . 19 (3): 141–44. ПМИД 17664817 .
- ^ Нгуен В.Т., Маклоуз М.Л., Доре Дж.Дж. (декабрь 2007 г.). «Высокоэндемичная инфекция гепатита В в сельских районах Вьетнама». Журнал гастроэнтерологии и гепатологии . 22 (12): 2093–100. дои : 10.1111/j.1440-1746.2007.05010.x . ПМИД 17645465 . S2CID 29885790 .
- ^ Фаулер М.Г., Лампе М.А., Джеймисон Д.Д., Куртис А.П., Роджерс М.Ф. (сентябрь 2007 г.). «Снижение риска передачи вируса иммунодефицита человека от матери к ребенку: прошлые успехи, текущий прогресс и проблемы, а также будущие направления» . Американский журнал акушерства и гинекологии . 197 (3 приложения): С3–9. дои : 10.1016/j.ajog.2007.06.048 . ПМИД 17825648 .
- ^ Зауэрбрей А., Вутцлер П. (декабрь 2000 г.). «Синдром врожденной ветряной оспы». Журнал перинатологии . 20 (8, часть 1): 548–54. дои : 10.1038/sj.jp.7200457 . ПМИД 11190597 . S2CID 7973561 .
- ^ Перейти обратно: а б Антонович Дж., Уилсон А.Дж., Форбс М.Р., Хауффе Х.К., Каллио Э.Р., Леггетт Х.К. и др. (май 2017 г.). «Эволюция способа передачи» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 372 (1719). дои : 10.1098/rstb.2016.0083 . ПМК 5352810 . ПМИД 28289251 .
- ^ Гарнетт GP (февраль 2005 г.). «Роль коллективного иммунитета в определении эффекта вакцин против болезней, передающихся половым путем» . Журнал инфекционных болезней . 191 (Приложение 1): S97–106. дои : 10.1086/425271 . ПМИД 15627236 .
- ^ Платонов А.Е. (2006). «[Влияние погодных условий на эпидемиологию трансмиссивных болезней на примере лихорадки Западного Нила в России]». Вестник Российской академии медицинских наук (на русском языке) (2): 25–29. ПМИД 16544901 .
- ^ Джуэлл С.П., Килинг М.Дж., Робертс Г.О. (декабрь 2009 г.). «Прогнозирование необнаруженных инфекций во время вспышки ящура в 2007 году» . Журнал Королевского общества, Интерфейс . 6 (41): 1145–51. дои : 10.1098/rsif.2008.0433 . ПМК 2817150 . ПМИД 19091686 .
- ^ Паттерсон К.Д., Пайл Г.Ф. (1991). «География и смертность от пандемии гриппа 1918 года». Бюллетень истории медицины . 65 (1): 4–21. ПМИД 2021692 .
- ^ Джонсон Н.П., Мюллер Дж. (2002). «Обновление отчетов: глобальная смертность от пандемии «испанского» гриппа 1918-1920 годов». Бюллетень истории медицины . 76 (1): 105–15. дои : 10.1353/bhm.2002.0022 . ПМИД 11875246 . S2CID 22974230 .
- ^ Эйзингер Р.В., Фаучи А.С. (март 2018 г.). «1» . Новые инфекционные заболевания . 24 (3): 413–16. дои : 10.3201/eid2403.171797 . ПМК 5823353 . ПМИД 29460740 .
- ^ , Ли XQ, Чжэн Д.Д., Пэн З.Б. и др. (август 2018 г.) «[История пандемий гриппа в Китае за последнее столетие]». Цинь Ю, Чжао М.Ю., Тан Ю. Люсинбинсюэ Зажи (на китайском языке) 39 (8): 1028–31. doi : 10.3760/cma.j.issn.0254-6450.2018.08.003 . PMID 30180422 .
- ^ Гао Ф., Бэйлз Э., Робертсон Д.Л., Чен Ю., Роденбург К.М., Майкл С.Ф. и др. (февраль 1999 г.). «Происхождение ВИЧ-1 у шимпанзе Pan troglodytes troglodytes» . Природа . 397 (6718): 436–41. Бибкод : 1999Natur.397..436G . дои : 10.1038/17130 . ПМИД 9989410 . S2CID 4432185 .
- ^ «Информационный бюллетень» (PDF) . ЮНЭЙДС.орг . 2018 . Проверено 12 декабря 2019 г.
- ^ «ДАННЫЕ ООН ПО СПИДУ 2019» . ЮНЭЙДС.орг . 2019 . Проверено 5 декабря 2019 г.
- ^ Мавар Н., Саха С., Пандит А., Махаджан У (декабрь 2005 г.). «Третья фаза пандемии ВИЧ: социальные последствия стигмы и дискриминации ВИЧ/СПИДа и будущие потребности» (PDF) . Индийский журнал медицинских исследований . 122 (6): 471–84. ПМИД 16517997 . Архивировано из оригинала (PDF) 4 марта 2016 года . Проверено 19 декабря 2014 г.
- ^ «Состояние глобальной эпидемии ВИЧ» (PDF) . ЮНЭЙДС. 2008. Архивировано из оригинала (PDF) 22 ноября 2015 года . Проверено 19 декабря 2014 г.
- ^ Таунер Дж.С., Христова М.Л., Сили Т.К., Винсент М.Дж., Эриксон Б.Р., Бавец Д.А. и др. (июль 2006 г.). «Геномика марбургвируса и связь с крупной вспышкой геморрагической лихорадки в Анголе» . Журнал вирусологии . 80 (13): 6497–516. дои : 10.1128/JVI.00069-06 . ПМЦ 1488971 . ПМИД 16775337 .
- ^ «Отчет Всемирной организации здравоохранения, 24 сентября 2014 г.» (PDF) .
- ^ «Вирусологический журнал» . Вирусологический журнал .
- ^ Вайс С.Р., Лейбовиц Дж.Л. (2011). Патогенез коронавируса . Достижения в области исследования вирусов. Том. 81. С. 85–164. дои : 10.1016/B978-0-12-385885-6.00009-2 . ISBN 978-0-12-385885-6 . ПМК 7149603 . ПМИД 22094080 .
- ^ Вонг А.Т., Чен Х., Лю Ш., Сюй Е.К., Лук К.С., Лай К.К. и др. (май 2017 г.). «От атипичной пневмонии к обеспечению готовности к птичьему гриппу в Гонконге» . Клинические инфекционные болезни . 64 (дополнение_2): S98–S104. дои : 10.1093/cid/cix123 . ПМИД 28475794 .
- ^ Дэн SQ, Пэн HJ (февраль 2020 г.). «Характеристики и ответные меры общественного здравоохранения на вспышку коронавирусной болезни в Китае в 2019 году» . Журнал клинической медицины . 9 (2): 575. дои : 10.3390/jcm9020575 . ПМК 7074453 . ПМИД 32093211 .
- ^ Хан Кью, Линь Кью, Джин С., Ю Л (апрель 2020 г.). «Коронавирус 2019-nCoV: краткий взгляд с передовой» . Журнал инфекции . 80 (4): 373–77. дои : 10.1016/j.jinf.2020.02.010 . ПМК 7102581 . ПМИД 32109444 .
- ^ Лондоньо Э, Ортис А (16 марта 2020 г.). «Ограничения на поездки из-за коронавируса по всему миру» . Нью-Йорк Таймс .
- ^ «США предпринимают более масштабные шаги по реагированию на пандемию; в Европе растет число случаев Covid-19» . ЦИДРАП . 15 марта 2020 г.
- ^ Эйнштейн М.Х., Шиллер Дж.Т., Вициди Р.П., Стриклер Х.Д., Курсаже П., Тан Т. и др. (июнь 2009 г.). «Руководство для клиницистов по иммунологии вируса папилломы человека: известное и неизвестное». «Ланцет». Инфекционные болезни . 9 (6): 347–56. дои : 10.1016/S1473-3099(09)70108-2 . ПМИД 19467474 .
- ^ Шуда М., Фенг Х., Квун Х.Дж., Розен С.Т., Гьёруп О., Мур П.С. и др. (октябрь 2008 г.). «Мутации Т-антигена являются опухолеспецифическим признаком полиомавируса клеток Меркеля у человека» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (42): 16272–77. Бибкод : 2008PNAS..10516272S . дои : 10.1073/pnas.0806526105 . ПМЦ 2551627 . ПМИД 18812503 .
- ^ Пулитцеровский член парламента, Амин Б.Д., Бусам К.Дж. (май 2009 г.). «Рак из клеток Меркеля: обзор». Достижения анатомической патологии . 16 (3): 135–44. дои : 10.1097/PAP.0b013e3181a12f5a . ПМИД 19395876 . S2CID 36110778 .
- ^ Койке К. (июнь 2007 г.). «Вирус гепатита С способствует гепатоканцерогенезу путем модуляции метаболических и внутриклеточных сигнальных путей». Журнал гастроэнтерологии и гепатологии . 22 (Приложение 1): S108–11. дои : 10.1111/j.1440-1746.2006.04669.x . ПМИД 17567457 . S2CID 25399220 .
- ^ Ху Дж., Ладгейт Л. (2007). «Коинфекция ВИЧ-ВГВ и ВИЧ-ВГС и развитие рака печени». Вирусный онкогенез, ассоциированный со СПИДом . Лечение и исследования рака. Том. 133. стр. 241–52. дои : 10.1007/978-0-387-46816-7_9 . ISBN 978-0-387-46804-4 . ПМИД 17672044 .
- ^ Беллон М., Никот С. (2007). «Теломераза: решающий игрок в Т-клеточном лейкозе человека, вызванном HTLV-I». Геномика и протеомика рака . 4 (1): 21–25. ПМИД 17726237 .
- ^ Шиффман М., Касл П.Е., Джеронимо Дж., Родригес А.С., Вахолдер С. (сентябрь 2007 г.). «Вирус папилломы человека и рак шейки матки». Ланцет . 370 (9590): 890–907. дои : 10.1016/S0140-6736(07)61416-0 . ПМИД 17826171 . S2CID 20196938 .
- ^ Кляйн Э., Кис Л.Л., Кляйн Г. (февраль 2007 г.). «Вирусная инфекция Эпштейна-Барра у человека: от безобидных до опасных для жизни взаимодействий вируса и лимфоцитов» . Онкоген . 26 (9): 1297–305. дои : 10.1038/sj.onc.1210240 . ПМИД 17322915 .
- ^ Цур Хаузен Х (июль 2008 г.). «Новые полиомавирусы человека – возрождение хорошо известного семейства вирусов как возможных канцерогенов для человека» . Международный журнал рака . 123 (2): 247–50. дои : 10.1002/ijc.23620 . ПМИД 18449881 . S2CID 9482506 .
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтерс П. (2002). Молекулярная биология клетки (4-е изд.). Нью-Йорк и Лондон: Garland Science. ISBN 0-8153-3218-1 .
- ^ Дин С.В., Войннет О (август 2007 г.). «Противовирусный иммунитет, управляемый малыми РНК» . Клетка . 130 (3): 413–26. дои : 10.1016/j.cell.2007.07.039 . ПМК 2703654 . ПМИД 17693253 .
- ^ Паттон Дж.Т., Васкес-Дель Карпио Р., Спенсер Э. (2004). «Репликация и транскрипция генома ротавируса». Текущий фармацевтический дизайн . 10 (30): 3769–77. дои : 10.2174/1381612043382620 . ПМИД 15579070 .
- ^ Джаярам Х., Эстес М.К., Прасад Б.В. (апрель 2004 г.). «Новые темы проникновения в клетки ротавируса, организации генома, транскрипции и репликации». Вирусные исследования . 101 (1): 67–81. doi : 10.1016/j.virusres.2003.12.007 . ПМИД 15010218 .
- ^ Грир С., Александр Г.Дж. (декабрь 1995 г.). «Вирусная серология и обнаружение». Клиническая гастроэнтерология Байера . 9 (4): 689–721. дои : 10.1016/0950-3528(95)90057-8 . ПМИД 8903801 .
- ^ Материя Л., Когельшац К., Германн Д. (апрель 1997 г.). «Уровни антител к вирусу краснухи в сыворотке, указывающие на иммунитет: ответ на вакцинацию субъектов с низкими или неопределяемыми концентрациями антител» . Журнал инфекционных болезней . 175 (4): 749–55. дои : 10.1086/513967 . ПМИД 9086126 .
- ^ Маллери Д.Л., Макьюэн В.А., Бидгуд С.Р., Тауэрс Дж.Дж., Джонсон К.М., Джеймс Л.К. (ноябрь 2010 г.). «Антитела опосредуют внутриклеточный иммунитет через трехчастный мотив, содержащий 21 (TRIM21)» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (46): 19985–90. Бибкод : 2010PNAS..10719985M . дои : 10.1073/pnas.1014074107 . ПМЦ 2993423 . ПМИД 21045130 .
- ^ Каскальо М., Платт Дж.Л. (2007). «Новые функции B-клеток». Критические обзоры по иммунологии . 27 (2): 141–51. doi : 10.1615/critrevimmunol.v27.i2.20 . ПМИД 17725500 .
- ^ Ле Пейдж С., Женен П., Бейнс М.Г., Хискотт Дж. (2000). «Активация интерферона и врожденный иммунитет». Обзоры в разделе Иммуногенетика . 2 (3): 374–86. ПМИД 11256746 .
- ^ Хиллеман М.Р. (октябрь 2004 г.). «Стратегии и механизмы выживания хозяина и возбудителя при острых и персистирующих вирусных инфекциях» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (Приложение 2): 14560–66. Бибкод : 2004PNAS..10114560H . дои : 10.1073/pnas.0404758101 . ПМК 521982 . ПМИД 15297608 .
- ^ Либби Дж. Э., Фудзинами Р. С. (2014). «Адаптивный иммунный ответ на вирусные инфекции в центральной нервной системе». Нейровирусология . Справочник по клинической неврологии. Том. 123. С. 225–47. дои : 10.1016/B978-0-444-53488-0.00010-9 . ISBN 978-0444534880 . ПМК 4370180 . ПМИД 25015488 .
- ^ Асария П., МакМахон Э. (октябрь 2006 г.). «Корь в Соединенном Королевстве: сможем ли мы искоренить ее к 2010 году?» . БМЖ . 333 (7574): 890–95. дои : 10.1136/bmj.38989.445845.7C . ПМЦ 1626346 . ПМИД 17068034 .
- ^ Лейн Дж. М. (2006). «Массовая вакцинация и надзор/сдерживание в целях искоренения оспы». Массовая вакцинация: глобальные аспекты — прогресс и препятствия . Актуальные темы микробиологии и иммунологии. Том. 304. стр. 17–29. дои : 10.1007/3-540-36583-4_2 . ISBN 978-3-540-29382-8 . ПМК 7120753 . ПМИД 16989262 .
- ^ Арвин А.М., Гринберг Х.Б. (январь 2006 г.). «Новые вирусные вакцины» . Вирусология . 344 (1): 240–49. дои : 10.1016/j.virol.2005.09.057 . ПМИД 16364754 .
- ^ Пасторет П.П., Шудель А.А., Ломбард М. (август 2007 г.). «Выводы - будущие тенденции в ветеринарной вакцинологии». Revue Scientifique et Technique . 26 (2): 489–94, 495–501, 503–09. дои : 10.20506/rst.26.2.1759 . ПМИД 17892169 .
- ^ Палезе П. (январь 2006 г.). «Создание более качественных вакцин против вируса гриппа?» . Новые инфекционные заболевания . 12 (1): 61–65. дои : 10.3201/eid1201.051043 . ПМК 3291403 . ПМИД 16494719 .
- ^ Ананд П., вице-президент Stahel (май 2021 г.). «Обзор безопасности мРНК-вакцин против Covid-19: обзор» . Безопасность пациентов в хирургии . 15 (1): 20. дои : 10.1186/s13037-021-00291-9 . ПМЦ 8087878 . ПМИД 33933145 .
- ^ Томссен Р. (1975). «Живые аттенуированные и убитые вирусные вакцины». Монографии по аллергии . 9 : 155–76. ПМИД 1090805 .
- ^ Маклин А.А. (1986). «Разработка вакцин против гепатита А и гепатита В». Обзоры инфекционных болезней . 8 (4): 591–98. дои : 10.1093/clinids/8.4.591 . ПМИД 3018891 .
- ^ Кассуолл Т.Х., Фишлер Б. (октябрь 2005 г.). «Вакцинация ребенка с ослабленным иммунитетом». Экспертная оценка вакцин . 4 (5): 725–38. дои : 10.1586/14760584.4.5.725 . ПМИД 16221073 . S2CID 40821818 .
- ^ Барнетт Э.Д., Уайлдер-Смит А., Уилсон М.Э. (июль 2008 г.). «Вакцины против желтой лихорадки и международные путешественники». Экспертная оценка вакцин . 7 (5): 579–87. дои : 10.1586/14760584.7.5.579 . ПМИД 18564013 . S2CID 19352868 .
- ^ Перейти обратно: а б Де Клерк Э., Ли Г (июль 2016 г.). «Утвержденные противовирусные препараты за последние 50 лет» . Обзоры клинической микробиологии . 29 (3): 695–747. дои : 10.1128/CMR.00102-15 . ПМЦ 4978613 . ПМИД 27281742 .
- ^ Магден Дж., Кяарияйнен Л., Ахола Т. (март 2005 г.). «Ингибиторы репликации вирусов: последние разработки и перспективы» . Прикладная микробиология и биотехнология . 66 (6): 612–21. дои : 10.1007/s00253-004-1783-3 . ПМК 7082807 . ПМИД 15592828 .
- ^ Миндель А., Сазерленд С. (сентябрь 1983 г.). «Генитальный герпес – заболевание и его лечение, включая внутривенное введение ацикловира». Журнал антимикробной химиотерапии . 12 (Приложение Б): 51–59. дои : 10.1093/jac/12.suppl_b.51 . ПМИД 6355051 .
- ^ Пальмизано Л., Велла С. (2011). «Краткая история антиретровирусной терапии ВИЧ-инфекции: успехи и проблемы». Анналы Istituto Superiore di Sanità . 47 (1): 44–48. дои : 10.4415/ANN_11_01_10 . ПМИД 21430338 .
- ^ Фаладе-Нвулия О, Суарес-Куэрво С, Нельсон Д.Р., Фрид М.В., Сигал Дж.Б., Сулковски М.С. (май 2017 г.). «Поральная терапия агентами прямого действия при инфекции вируса гепатита С: систематический обзор» . Анналы внутренней медицины . 166 (9): 637–48. дои : 10.7326/M16-2575 . ПМЦ 5486987 . ПМИД 28319996 .
- ^ Нгуен М.Х., Вонг Дж., Гейн Э., Као Дж.Х., Душейко Г. (март 2020 г.). «Вирус гепатита В: достижения в профилактике, диагностике и терапии» . Обзоры клинической микробиологии . 33 (2). дои : 10.1128/CMR.00046-19 . ПМК 7048015 . ПМИД 32102898 .
- ^ Горис Н., Ванденбуше Ф., Де Клерк К. (апрель 2008 г.). «Возможности противовирусной терапии и профилактики для борьбы с РНК-вирусными инфекциями домашнего скота». Противовирусные исследования . 78 (1): 170–78. doi : 10.1016/j.antiviral.2007.10.003 . ПМИД 18035428 .
- ^ Кармайкл Л.Е. (2005). «Аннотированный исторический отчет о собачьем парвовирусе». Журнал ветеринарной медицины. Б. Инфекционные болезни и ветеринарное здравоохранение . 52 (7–8): 303–11. дои : 10.1111/j.1439-0450.2005.00868.x . ПМИД 16316389 .
- ^ Чен Ю, Чжао Ю, Хаммонд Дж, Сюй Х.Т., Эванс Дж, Фельдлауфер М (октябрь – ноябрь 2004 г.). «Множественные вирусные инфекции у медоносных пчел и дивергенция геномов вирусов медоносных пчел» . Журнал патологии беспозвоночных . 87 (2–3): 84–93. Бибкод : 2004JInvP..87...84C . дои : 10.1016/j.jip.2004.07.005 . ПМИД 15579317 .
- ^ Халл Р. (2002). «Глава 12: Передача 2: Механическая, семенная, пыльцевая и эпидемиология» . Вирусология растений Мэтьюза (4-е изд.). Академическая пресса. стр. 555–56. ISBN 978-0123611604 . Проверено 21 февраля 2022 г.
- ^ Захир К., Ахтар М.Х. (2016). «Производство, использование и питание картофеля – обзор». Критические обзоры в области пищевой науки и питания . 56 (5): 711–21. дои : 10.1080/10408398.2012.724479 . ПМИД 24925679 . S2CID 33074838 .
- ^ Фуэнтес С., Джонс Р.А., Мацуока Х., Осима К., Кройце Дж., Гиббс А.Дж. (июль 2019 г.). «Картофельный вирус Y; связь с Андами» . Эволюция вирусов . 5 (2): vez037. дои : 10.1093/ve/vez037 . ПМК 6755682 . ПМИД 31559020 .
- ^ Динеш-Кумар С.П., Там В.Х., Бейкер Б.Дж. (декабрь 2000 г.). «Структурно-функциональный анализ гена N устойчивости к вирусу табачной мозаики» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (26): 14789–94. Бибкод : 2000PNAS...9714789D . дои : 10.1073/pnas.97.26.14789 . ЧВК 18997 . ПМИД 11121079 .
- ^ Соосаар Дж.Л., Берч-Смит Т.М., Динеш-Кумар С.П. (октябрь 2005 г.). «Механизмы устойчивости растений к вирусам». Обзоры природы. Микробиология . 3 (10): 789–98. дои : 10.1038/nrmicro1239 . ПМИД 16132037 . S2CID 27311732 .
- ^ Ломоносов ГП (2011). «Вирусные частицы и использование таких частиц в био- и нанотехнологиях». Последние достижения в вирусологии растений . Кайстер Академик Пресс . ISBN 978-1-904455-75-2 .
- ^ Уоммак К.Е., Колвелл Р.Р. (март 2000 г.). «Вириопланктон: вирусы в водных экосистемах» . Обзоры микробиологии и молекулярной биологии . 64 (1): 69–114. дои : 10.1128/ММБР.64.1.69-114.2000 . ПМК 98987 . ПМИД 10704475 .
- ^ Берг О., Борсхайм К.Ю., Братбак Г., Хелдал М. (август 1989 г.). «Высокое количество вирусов обнаружено в водной среде». Природа . 340 (6233): 467–68. Бибкод : 1989Natur.340..467B . дои : 10.1038/340467a0 . ПМИД 2755508 . S2CID 4271861 .
- ^ Бикл Т.А., Крюгер Д.Х. (июнь 1993 г.). «Биология рестрикции ДНК» . Микробиологические обзоры . 57 (2): 434–50. дои : 10.1128/MMBR.57.2.434-450.1993 . ПМК 372918 . ПМИД 8336674 .
- ^ Баррангу Р., Фремо С., Дево Х., Ричардс М., Бояваль П., Муано С. и др. (март 2007 г.). «CRISPR обеспечивает приобретенную устойчивость прокариот к вирусам». Наука . 315 (5819): 1709–12. Бибкод : 2007Sci...315.1709B . дои : 10.1126/science.1138140 . hdl : 20.500.11794/38902 . ПМИД 17379808 . S2CID 3888761 .
- ^ Браунс С.Дж., Джор М.М., Лундгрен М., Вестра Э.Р., Слиджхуис Р.Дж., Снейдерс А.П. и др. (август 2008 г.). «Маленькие РНК CRISPR обеспечивают противовирусную защиту прокариот» . Наука . 321 (5891): 960–64. Стартовый код : 2008Sci...321..960B . дои : 10.1126/science.1159689 . ПМЦ 5898235 . ПМИД 18703739 .
- ^ Мохика Ф.Д., Родригес-Валера Ф. (сентябрь 2016 г.). «Открытие CRISPR у архей и бактерий». Журнал ФЭБС . 283 (17): 3162–69. дои : 10.1111/февраль 13766 . hdl : 10045/57676 . ПМИД 27234458 . S2CID 42827598 .
- ^ Перейти обратно: а б Вайс Р.А. (2017). «Обмен генетическими последовательностями между вирусами и хозяевами». Вирусы, гены и рак . Актуальные темы микробиологии и иммунологии. Том. 407. стр. 1–29. дои : 10.1007/82_2017_21 . ISBN 978-3-319-61803-6 . ПМИД 28550453 .
- ^ Ху Дж, Е Х, Ван С, Ван Дж, Хан Д (2021). «Активация профагов в кишечнике: понимание функций и возможных применений» . Границы микробиологии . 12 : 785634. doi : 10.3389/fmicb.2021.785634 . ПМЦ 8710666 . ПМИД 34966370 .
- ^ Расс Э., Иорданский С. (январь 2023 г.). «Эндогенные ретровирусы как модуляторы врожденного иммунитета» . Патогены (Базель, Швейцария) . 12 (2): 162. doi : 10.3390/pathogens12020162 . ПМЦ 9963469 . ПМИД 36839434 .
- ^ Прангишвили Д., Гаррет Р.А. (апрель 2004 г.). «Исключительно разнообразные морфотипы и геномы кренархейных гипертермофильных вирусов» (PDF) . Труды Биохимического общества . 32 (Часть 2): 204–08. дои : 10.1042/BST0320204 . ПМИД 15046572 . S2CID 20018642 .
- ^ Мохика Ф.Х., Диес-Вильясеньор К., Гарсиа-Мартинес Х., Сория Э. (февраль 2005 г.). «Промежуточные последовательности прокариотических повторов с регулярными интервалами происходят от чужеродных генетических элементов». Журнал молекулярной эволюции . 60 (2): 174–82. Бибкод : 2005JMolE..60..174M . дои : 10.1007/s00239-004-0046-3 . ПМИД 15791728 . S2CID 27481111 .
- ^ Макарова К.С., Гришин Н.В., Шабалина С.А., Вольф Ю.И., Кунин Е.В. (март 2006 г.). «Предполагаемая иммунная система прокариот, основанная на РНК-интерференции: вычислительный анализ предсказанного ферментативного механизма, функциональные аналогии с эукариотическими РНКи и гипотетические механизмы действия» . Биология Директ . 1 :7. дои : 10.1186/1745-6150-1-7 . ПМК 1462988 . ПМИД 16545108 .
- ^ ван дер Оост Дж., Вестра Э.Р., Джексон Р.Н., Виденхефт Б. (июль 2014 г.). «Раскрытие структурной и механистической основы систем CRISPR-Cas» . Обзоры природы. Микробиология . 12 (7): 479–92. дои : 10.1038/nrmicro3279 . ПМЦ 4225775 . ПМИД 24909109 .
- ^ Давила-Рамос С., Кастелан-Санчес Х.Г., Мартинес-Авила Л., Санчес-Карбенте М.Д., Перальта Р., Эрнандес-Мендоса А. и др. (2019). «Обзор вирусной метагеномики в экстремальных условиях» . Границы микробиологии . 10 : 2403. дои : 10.3389/fmicb.2019.02403 . ПМК 6842933 . ПМИД 31749771 .
- ^ Чжан Ци, Гуй Дж. Ф. (декабрь 2018 г.). «Разнообразие, эволюционный вклад и экологическая роль водных вирусов». Наука Китай Науки о жизни . 61 (12): 1486–1502. дои : 10.1007/s11427-018-9414-7 . ПМИД 30443861 . S2CID 53564176 .
- ^ Вайц Дж.С., Вильгельм С.В. (2013). «Океан вирусов» . Ученый . 27 (7): 35–39.
- ^ Саттл, Калифорния (сентябрь 2005 г.). «Вирусы в море». Природа . 437 (7057): 356–61. Бибкод : 2005Natur.437..356S . дои : 10.1038/nature04160 . ПМИД 16163346 . S2CID 4370363 .
- ^ Вильгельм С.В., Саттл, Калифорния (1999). «Вирусы и циклы питательных веществ в море: вирусы играют решающую роль в структуре и функциях водных пищевых сетей» . Бионаука . 49 (10): 781–88. дои : 10.2307/1313569 . JSTOR 1313569 .
- ^ Шелфорд Э.Дж., Саттл, Калифорния (2018). «Вирус-опосредованный перенос азота от гетеротрофных бактерий к фитопланктону» . Биогеонауки . 15 (3): 809–15. Бибкод : 2018BGeo...15..809S . дои : 10.5194/bg-15-809-2018 .
- ^ Перейти обратно: а б с д Саттл, Калифорния (октябрь 2007 г.). «Морские вирусы – основные игроки глобальной экосистемы». Обзоры природы. Микробиология . 5 (10): 801–12. дои : 10.1038/nrmicro1750 . ПМИД 17853907 . S2CID 4658457 .
- ^ Вигингтон Ч., Зондереггер Д., Бруссаард К.П., Бьюкен А., Финке Дж.Ф., Фурман Дж.А. и др. (январь 2016 г.). «Повторное исследование взаимосвязи между численностью морских вирусов и микробных клеток» (PDF) . Природная микробиология . 1 (15024): 15024. doi : 10.1038/nmicrobiol.2015.24 . ПМИД 27572161 . S2CID 52829633 .
- ^ Брюссаард КП (2004). «Вирусный контроль популяций фитопланктона – обзор». Журнал эукариотической микробиологии . 51 (2): 125–38. дои : 10.1111/j.1550-7408.2004.tb00537.x . ПМИД 15134247 . S2CID 21017882 .
- ^ Роббинс Дж. (13 апреля 2018 г.). «Триллионы и триллионы вирусов падают с неба каждый день» . Нью-Йорк Таймс . Проверено 14 апреля 2018 г.
- ^ Рече И., Д'Орта Г., Младенов Н., Вингет Д.М., Саттл, Калифорния (апрель 2018 г.). «Скорость осаждения вирусов и бактерий над пограничным слоем атмосферы» . Журнал ISME . 12 (4): 1154–62. Бибкод : 2018ISMEJ..12.1154R . дои : 10.1038/s41396-017-0042-4 . ПМК 5864199 . ПМИД 29379178 .
- ^ Холл А.Дж., Джепсон П.Д., Гудман С.Дж., Харконен Т. (2006). «Вирус чумки чумы в Северном и Европейском морях – данные и модели, природа и воспитание». Биологическая консервация . 131 (2): 221–29. Бибкод : 2006BCons.131..221H . doi : 10.1016/j.biocon.2006.04.008 .
- ^ ДеЛонг Дж.П., Ван Эттен Дж.Л., Аль-Амели З., Агаркова И.В., Дуниган Д.Д. (январь 2023 г.). «Потребление вирусов возвращает энергию в пищевые цепи» . Труды Национальной академии наук Соединенных Штатов Америки . 120 (1): e2215000120. Бибкод : 2023PNAS..12015000D . дои : 10.1073/pnas.2215000120 . ПМЦ 9910503 . ПМИД 36574690 . S2CID 255219850 .
- ^ Ирвинг М. (28 декабря 2022 г.). «Первое открытие «вировора»: организм, питающийся вирусами» . Новый Атлас. Архивировано из оригинала 29 декабря 2022 года . Проверено 29 декабря 2022 г.
- ^ Брокер Ф., Мёллинг К. (2019). «Что вирусы говорят нам об эволюции и иммунитете: помимо Дарвина?» . Анналы Нью-Йоркской академии наук . 1447 (1): 53–68. Бибкод : 2019NYASA1447...53B . дои : 10.1111/nyas.14097 . ПМК 6850104 . ПМИД 31032941 .
- ^ Лауэр, А. (2021). Вирусы – недооцененные факторы экологии и эволюции жизни. В: Херст, CJ (ред.) Микробы: краеугольный камень биосферы. Достижения в экологической микробиологии, том 8. Springer, Cham. https://doi.org/10.1007/978-3-030-63512-1_28
- ^ Фортер П., Филипп Х (июнь 1999 г.). «Последний универсальный общий предок (LUCA), простой или сложный?». Биологический вестник . 196 (3): 373–75, обсуждение 375–77. дои : 10.2307/1542973 . JSTOR 1542973 . ПМИД 11536914 .
- ^ Лодиш Х., Берк А., Зипурски С.Л., Мацудайра П., Балтимор Д., Дарнелл Дж. (2000). «Вирусы: структура, функции и использование» . Молекулярно-клеточная биология (4-е изд.). Нью-Йорк: WH Freeman.
- ^ Мацузаки С., Рашель М., Утияма Дж., Сакураи С., Удзихара Т., Курода М. и др. (октябрь 2005 г.). «Бактериофаготерапия: обновленная терапия против бактериальных инфекционных заболеваний». Журнал инфекции и химиотерапии . 11 (5): 211–19. дои : 10.1007/s10156-005-0408-9 . ПМИД 16258815 . S2CID 8107934 .
- ^ Глеба Ю.Ю., Гирич А (2011). «Растительные вирусные векторы для экспрессии белков». Последние достижения в вирусологии растений . Кайстер Академик Пресс. ISBN 978-1-904455-75-2 .
- ^ Джефферсон А., Кадет В.Е., Хильшер А. (сентябрь 2015 г.). «Механизмы использования генетически модифицированных вирусов коровьей оспы для лечения рака». Критические обзоры по онкологии/гематологии . 95 (3): 407–16. doi : 10.1016/j.critrevonc.2015.04.001 . ПМИД 25900073 .
- ^ Каримхани С., Гонсалес Р., Деллавалле Р.П. (август 2014 г.). «Обзор новых методов лечения меланомы». Американский журнал клинической дерматологии . 15 (4): 323–37. дои : 10.1007/s40257-014-0083-7 . ПМИД 24928310 . S2CID 38864550 .
- ^ «FDA одобряет инъекционную иммунотерапию меланомы от Amgen» . Рейтер . 27 октября 2015 г. Проверено 24 января 2020 г.
- ^ Берк Дж., Ниева Дж., Борад М.Дж., Брейтбах К.Дж. (август 2015 г.). «Онколитические вирусы: перспективы клинического развития». Современное мнение в вирусологии . 13 :55–60. дои : 10.1016/j.coviro.2015.03.020 . ПМИД 25989094 .
- ^ Догич З (2016). «Нитевидные фаги как модельная система в физике мягких веществ» . Границы микробиологии . 7 : 1013. дои : 10.3389/fmicb.2016.01013 . ПМЦ 4927585 . ПМИД 27446051 .
- ^ Фишлехнер М., Донат Э. (2007). «Вирусы как строительные блоки материалов и устройств». Ангеванде Хеми . 46 (18): 3184–93. дои : 10.1002/anie.200603445 . ПМИД 17348058 .
- ^ Сото С.М., Блюм А.С., Вора Г.Дж., Лебедев Н., Мидор С.Э., Вон А.П. и др. (апрель 2006 г.). «Усиление флуоресцентного сигнала карбоцианиновых красителей с использованием сконструированных вирусных наночастиц» . Журнал Американского химического общества . 128 (15): 5184–89. дои : 10.1021/ja058574x . ПМИД 16608355 .
- ^ Блюм А.С., Сото К.М., Уилсон К.Д., Брауэр Т.Л., Поллак С.К., Шулл Т.Л. и др. (июль 2005 г.). «Спроектированный вирус как каркас для трехмерной самосборки в наномасштабе». Маленький . 1 (7): 702–06. дои : 10.1002/smll.200500021 . ПМИД 17193509 .
- ^ Виолончель Дж., Пол А.В., Виммер Э. (август 2002 г.). «Химический синтез кДНК полиовируса: генерация инфекционного вируса в отсутствие естественной матрицы» . Наука . 297 (5583): 1016–18. Бибкод : 2002Sci...297.1016C . дои : 10.1126/science.1072266 . ПМИД 12114528 . S2CID 5810309 .
- ^ Коулман-младший, Папамихайль Д., Скиена С., Футчер Б., Виммер Э., Мюллер С. (июнь 2008 г.). «Аттенуация вируса за счет изменений в масштабе генома в смещении пары кодонов» . Наука . 320 (5884): 1784–87. Бибкод : 2008Sci...320.1784C . дои : 10.1126/science.1155761 . ПМК 2754401 . ПМИД 18583614 .
- ^ «База данных вирусных геномов Национального института здравоохранения» . Ncbi.nlm.nih.gov . Проверено 28 июня 2021 г.
- ^ Жилинскас Р.А. (август 2017 г.). «Краткая история программ биологического оружия и использования патогенов животных в качестве боевых биологических агентов». Revue Scientifique et Technique (Международное бюро эпизоотий) . 36 (2): 415–22. дои : 10.20506/rst.36.2.2662 . ПМИД 30152475 .
- ^ Перейти обратно: а б с Артенштейн А.В., Грабенштайн Дж.Д. (октябрь 2008 г.). «Вакцины от оспы для биозащиты: необходимость и осуществимость» . Экспертная оценка вакцин . 7 (8): 1225–37. дои : 10.1586/14760584.7.8.1225 . ПМК 9709930 . ПМИД 18844596 . S2CID 33855724 .