Дупилумаб
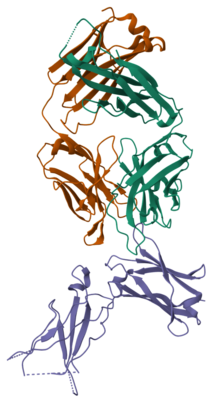 Антигенсвязывающий фрагмент дупилумаба (оранжевый и зеленый), связанный с альфа-рецептором человеческого IL-4 (фиолетовый) | |
| Моноклональное антитело | |
|---|---|
| Тип | Цельное антитело |
| Источник | Человек |
| Цель | Рецептор интерлейкина 4 (IL4) альфа |
| Клинические данные | |
| Произношение | / d u ˈ p ɪ l j u m æ b / doo- PIL -yoo-mab |
| Торговые названия | Дюписент |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а617021 |
| Данные лицензии | |
| Беременность категория |
|
| Маршруты администрация | Подкожный |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Идентификаторы | |
| Номер CAS | |
| Лекарственный Банк | |
| ХимическийПаук |
|
| НЕКОТОРЫЙ | |
| КЕГГ | |
| Химические и физические данные | |
| Формула | С 6512 Х 10066 Н 1730 О 2052 С 46 |
| Молярная масса | 146 898 .98 g·mol −1 |
Дупилумаб , продаваемый под торговой маркой Dupixent , представляет собой моноклональные антитела, блокирующие интерлейкин 4 и интерлейкин 13 , используемые при аллергических заболеваниях, таких как атопический дерматит (экзема), астма и полипы носа , которые приводят к хроническому синуситу . [6] [7] [8] [4] Он также используется для лечения эозинофильного эзофагита. [9] и узловатое пруриго . [10]
Наиболее распространенные побочные эффекты, о которых сообщает Управление по контролю за продуктами и лекарствами США (FDA), включают реакции в месте инъекции, инфекции верхних дыхательных путей, боли в суставах и герпесвирусные инфекции. [9] Наиболее распространенные побочные эффекты, о которых сообщает Европейское агентство по лекарственным средствам (EMA), включают реакции в месте инъекции (такие как покраснение, отек, в том числе из-за скопления жидкости, зуд и боль), конъюнктивит (покраснение и дискомфорт в глазах), включая конъюнктивит, вызванный к аллергии, боли в суставах, герпесу и повышению уровня в крови лейкоцитов, называемых эозинофилами. [5] Его разработали компании Regeneron Pharmaceuticals и Sanofi Genzyme . [11] [12] США Он получил одобрение Управления по контролю за продуктами и лекарствами (FDA) для лечения атопического дерматита средней и тяжелой степени в 2017 году. [7] и по астме в 2018 году. [4] FDA считает его первым в своем классе лекарством . [13]
Дупилумаб — первый препарат для лечения эозинофильного эзофагита, одобренный Управлением по контролю за продуктами и лекарствами США (FDA). [9] Эозинофильный эзофагит — хроническое воспалительное заболевание, при котором в ткани пищевода обнаруживаются эозинофилы (тип лейкоцитов). [9] У взрослых и подростков с эозинофильным эзофагитом общие симптомы включают затруднение глотания, затруднение приема пищи и застревание пищи в пищеводе. [9] Дупилумаб представляет собой моноклональное антитело, которое ингибирует часть воспалительного пути. [9] Дупилумаб — первый препарат для лечения узловатой пруриго, одобренный FDA. [10] Узловое пруриго — редкое кожное заболевание, при котором на коже образуются твердые зудящие шишки (узлы). [10]
Медицинское использование
[ редактировать ]
Дупилумаб показан для лечения атопического дерматита средней и тяжелой степени , астмы средней и тяжелой степени, а также для лечения хронического риносинусита с полипами в носу (ХРСнНП). [4] [5] [14] [15] [9] Было показано, что он эффективен при лечении респираторного заболевания, обостряющегося аспирином (AERD), обычно трудно поддающегося лечению состояния, когда у пациентов с непереносимостью аспирина наблюдаются как CRSwNP, так и астма. [16] [17]
В мае 2022 года показания к применению дупилумаба были обновлены и теперь включают лечение эозинофильного эзофагита у людей в возрасте двенадцати лет и старше с массой тела не менее 40 кг (88 фунтов). [9]
В сентябре 2022 г. показания к применению дупилумаба были обновлены и теперь включают лечение взрослых с узловатой пруриго (УП). [10]
В марте 2023 года EMA одобрило дупилумаб для лечения тяжелого атопического дерматита у детей в возрасте от шести месяцев до пяти лет, являющихся кандидатами на системную терапию . [18] [19]
Побочные эффекты
[ редактировать ]Реакции в месте инъекции , такие как покраснение и боль, встречаются примерно в 11,4% случаев. [20] Дупилумаб может вызывать аллергические реакции, конъюнктивит и кератит , а из-за его иммунодепрессивного действия - реактивацию герпеса . [7] В клинических исследованиях у людей, получавших дупилумаб, наблюдалось снижение уровня Т-хелперов . [21]
Фармакология
[ редактировать ]Механизм действия
[ редактировать ]Дупилумаб связывается с альфа-субъединицей рецептора интерлейкина-4 (IL-4Rα), что делает его антагонистом рецептора . [22] Путем блокады IL-4Rα дупилумаб модулирует передачу сигналов как по путям интерлейкина 4 , так и по пути интерлейкина 13 . [21]
Фармакокинетика
[ редактировать ]Дупилумаб демонстрирует нелинейную скорость достижения цели. [21] Сообщается также, что биодоступность дупилумаба составляет 64%, при этом средняя концентрация достигается через неделю после инъекции. [21]
История
[ редактировать ]Regeneron Pharmaceuticals и Sanofi Genzyme совместно разработали дупилумаб. [23] последняя из которых предоставила Regeneron 130 миллионов долларов на исследования и разработки моноклональных антител. [24] Исследования фазы II по лечению астмы показали улучшение функции легких с увеличением объема форсированного выдоха у пациентов. [21]
В октябре 2016 года компания Regeneron завершила исследование III фазы, сравнивающее дупилумаб с местными кортикостероидами , в ходе которого у пациентов наблюдалось большее уменьшение симптомов как при приеме дупилумаба, так и при местном применении стероидов, чем при приеме только стероидов. [25] В этих исследованиях 38% и 36% пациентов соответственно достигли основной цели исследования по эффективности по сравнению с 8% и 10% в группе плацебо. [21]
США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) удовлетворило заявку на приоритетное рассмотрение дупилумаба. [26] [27] а в марте 2017 года FDA одобрило инъекции дупилумаба для лечения взрослых с экземой средней и тяжелой степени. [7]
Эффективность и безопасность дупилумаба при эозинофильном эзофагите изучали в рандомизированном двойном слепом многоцентровом плацебо-контролируемом исследовании в параллельных группах, которое включало два 24-недельных периода лечения (Часть А и Часть Б), которые проводились независимо в отдельные группы участников. [9] В Части A и Части B участники получали либо плацебо, либо 300 миллиграммов дупилумаба каждую неделю. [9] Двумя основными показателями эффективности были доля участников, которые достигли определенного уровня снижения эозинофилов в пищеводе на 24 неделе, что определялось путем оценки ткани пищевода участников под микроскопом, и изменение в опроснике по симптомам дисфагии, о котором сообщали участники (( DSQ) от исходного уровня до 24-й недели. [9] DSQ представляет собой опросник, предназначенный для измерения затруднений при глотании, связанных с эозинофильным эзофагитом, с общим количеством баллов от 0 до 84; более высокие баллы DSQ указывают на ухудшение симптомов. [9]
Эффективность и безопасность дупилумаба для лечения узловатой пруриго у взрослых оценивались в двух клинических исследованиях: EFC16459 (PRIME) и EFC16460 (PRIME2). [10] В каждом исследовании оценивалось применение 300 мг дупилумаба каждые 2 недели после начальной дозы 600 мг. [10] Лечение продолжалось 24 недели. [10] Эффективность в основном оценивалась по доле субъектов, у которых кожный зуд (зуд) уменьшился более чем на четыре балла по числовой шкале наихудшего зуда, доле субъектов, достигших 0 или 1 балла по шкале PN-стадии глобальной оценки исследователя ( эквивалентно узлам 0–5), а также долю субъектов, достигших ответа по обеим шкалам на 24 неделе. [10]
Исследовать
[ редактировать ]Дупилумаб исследуется для лечения хронической обструктивной болезни легких . [28] [29]
Ссылки
[ редактировать ]- ^ Jump up to: а б «АусПАР: Дупилумаб» . Управление терапевтических товаров (TGA) . 4 мая 2022 г. Проверено 4 мая 2022 г.
- ^ «Краткий обзор нормативных решений для Dupixent» . Портал лекарств и товаров для здоровья . 14 апреля 2023 г. Проверено 2 апреля 2024 г.
- ^ «Здоровье кожи» . Здоровье Канады . 9 мая 2018 года . Проверено 13 апреля 2024 г.
- ^ Jump up to: а б с д «Дупиксент-дупилумаб для инъекций, раствор» . ДейлиМед . 25 июня 2020 года. Архивировано из оригинала 24 марта 2021 года . Проверено 17 сентября 2020 г.
- ^ Jump up to: а б с «Дюпиксент ЭПАР» . Европейское агентство лекарственных средств (EMA) . 17 сентября 2018 г. Архивировано из оригинала 28 декабря 2021 г. Проверено 23 сентября 2021 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ «Заявление о непатентованном названии, принятом Советом USAN - Дупилумаб». Архивировано 21 мая 2021 года в Wayback Machine , Американская медицинская ассоциация .
- ^ Jump up to: а б с д «FDA одобрило новый препарат от экземы Dupixent» . США Управление по контролю за продуктами и лекарствами (FDA). 10 сентября 2019 года. Архивировано из оригинала 28 марта 2017 года . Проверено 29 марта 2017 г.
- ^ «FDA одобрило первое лечение хронического риносинусита с полипами в носу» . США Управление по контролю за продуктами и лекарствами (FDA). 26 июня 2019 года. Архивировано из оригинала 29 декабря 2020 года . Проверено 27 июня 2019 г.
- ^ Jump up to: а б с д и ж г час я дж к л «FDA одобрило первое лечение эозинофильного эзофагита, хронического иммунного заболевания» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 20 мая 2022 года. Архивировано из оригинала 5 августа 2022 года . Проверено 20 мая 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Jump up to: а б с д и ж г час «FDA одобрило первое лечение узловатой пруриго» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 29 сентября 2022 года. Архивировано из оригинала 29 сентября 2022 года . Проверено 30 сентября 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «Санофи – Коммерческое сотрудничество» . Санофи. Архивировано из оригинала 8 ноября 2017 года . Проверено 9 марта 2017 г.
- ^ «Мощный двигатель исследований и разработок» . www.regeneron.com. Архивировано из оригинала 30 апреля 2019 года . Проверено 9 марта 2017 г.
- ^ Утверждения новой лекарственной терапии, 2017 г. (PDF) (отчет). США Управление по контролю за продуктами и лекарствами (FDA). Январь 2018. Архивировано из оригинала 23 октября 2020 года . Проверено 16 сентября 2020 г.
- ^ Крафт М., Червь М. (апрель 2017 г.). «Дупилумаб в лечении атопического дерматита средней и тяжелой степени». Экспертное обозрение клинической иммунологии . 13 (4): 301–310. дои : 10.1080/1744666X.2017.1292134 . ПМИД 28165826 . S2CID 3404484 .
- ^ Умберт М., Буссе В., Ханания Н.А. (январь 2018 г.). «Противоречие и возможности при тяжелой астме». Современное мнение в области легочной медицины . 24 (1): 83–93. дои : 10.1097/MCP.0000000000000438 . ПМИД 29059087 . S2CID 4433743 .
- ^ Буххейт К.М., Сохаил А., Хакер Дж., Маурер Р., Гакпо Д., Бенско Дж.К. и др. (август 2022 г.). «Быстрое и устойчивое влияние дупилумаба на клинические и механические результаты респираторных заболеваний, обостряющихся приемом аспирина» . Журнал аллергии и клинической иммунологии . 150 (2): 415–424. дои : 10.1016/j.jaci.2022.04.007 . ПМЦ 9378638 . ПМИД 35460728 .
- ^ Ойхман П., Парамо Ф.А., Буске Дж., Кеннеди Д.В., Бриньярделло-Петерсен Р., Чу Д.К. (апрель 2022 г.). «Сравнительная эффективность и безопасность моноклональных антител и десенсибилизации аспирином при хроническом риносинусите с полипозом носа: систематический обзор и сетевой метаанализ» . Журнал аллергии и клинической иммунологии . 149 (4): 1286–1295. дои : 10.1016/j.jaci.2021.09.009 . ПМИД 34543652 .
- ^ EMA (17 сентября 2018 г.). «Дюпиксент» . Европейское агентство по лекарственным средствам . Проверено 22 марта 2023 г.
- ^ Деварасетти Х (22 марта 2023 г.). «Sanofi Dupixent получает одобрение ЕС для лечения атопического дерматита» . Фармацевтическая технология . Проверено 22 марта 2023 г.
- ^ Ким П.Дж., Лансанг Р.П., Вендер Р. (июль 2023 г.). «Систематический обзор и метаанализ реакций в месте инъекции в рандомизированно-контролируемых исследованиях биологических инъекций» . Журнал кожной медицины и хирургии . 27 (4): 358–367. дои : 10.1177/12034754231188444 . ПМЦ 10486173 . ПМИД 37533141 .
- ^ Jump up to: а б с д и ж Ширли М. (июль 2017 г.). «Дупилумаб: первое глобальное одобрение». Наркотики . 77 (10): 1115–1121. дои : 10.1007/s40265-017-0768-3 . ПМИД 28547386 . S2CID 207489287 .
- ^ Венцель С., Форд Л., Перлман Д., Спектор С., Шер Л., Скобьеранда Ф. и др. (июнь 2013 г.). «Дупилумаб при персистирующей астме с повышенным уровнем эозинофилов» . Медицинский журнал Новой Англии . 368 (26): 2455–66. дои : 10.1056/NEJMoa1304048 . ПМИД 23688323 .
- ^ Спенсер Д. (8 марта 2020 г.). «Руководитель Sanofi Genzyme о невероятном успехе уникального продукта Dupixent» . Фармаконференция . Архивировано из оригинала 18 мая 2021 года . Проверено 18 мая 2021 г.
- ^ «Регенерон SEC 10-Q» . SEC.gov . 30 июня 2017 года. Архивировано из оригинала 21 октября 2017 года . Проверено 20 октября 2017 г.
- ^ Гамильтон Дж.Д., Унгар Б., Гуттман-Ясский Э. (2015). «Обзор оценки препарата: дупилумаб при атопическом дерматите». Иммунотерапия . 7 (10): 1043–58. дои : 10.2217/imt.15.69 . ПМИД 26598956 .
- ^ «Новый биологический препарат дупилумаб улучшает симптомы экземы» . Октябрь 2016. Архивировано из оригинала 11 марта 2017 года . Проверено 30 октября 2017 г.
- ^ Уокер Дж. (30 мая 2016 г.). «Скоро могут появиться новые методы лечения экземы» . Уолл Стрит Джорнал . ISSN 0099-9660 . Архивировано из оригинала 5 января 2018 года . Проверено 31 мая 2016 г.
- ^ Номер клинического исследования NCT03930732 для «Рандомизированного, двойного слепого, плацебо-контролируемого, 52-недельного основного исследования в параллельных группах для оценки эффективности, безопасности и переносимости дупилумаба у пациентов с хронической обструктивной болезнью легких (ХОБЛ) средней и тяжелой степени». ) с воспалением 2 типа» на сайте ClinicalTrials.gov.
- ^ «Dupixent демонстрирует потенциал стать первым биологическим препаратом для лечения ХОБЛ, продемонстрировав значительное снижение обострений в ходе основного исследования» . Globe Newswire (Пресс-релиз) . Проверено 14 мая 2023 г.