Тирозингидроксилаза
| ТД | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | TH , Th, DYT14, DYT5b, TYH, тирозингидроксилаза, тирозингидроксилаза | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 191290 ; МГИ : 98735 ; Гомологен : 307 ; GeneCards : TH ; ОМА : TH – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
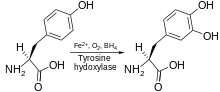
Тирозингидроксилаза или тирозин-3-монооксигеназа — это фермент, ответственный за катализацию превращения аминокислоты L - тирозин в L -3,4-дигидроксифенилаланин ( L -ДОФА). [ 5 ] [ 6 ] Для этого он использует молекулярный кислород (O 2 ), а также железо (Fe 2+ ) и тетрагидробиоптерин в качестве кофакторов . L -ДОФА является предшественником дофамина , который, в свою очередь, является предшественником важных нейромедиаторов норадреналина (норадреналина) и адреналина (адреналина). Тирозингидроксилаза катализирует стадию, лимитирующую скорость синтеза катехоламинов . У человека тирозингидроксилаза кодируется TH геном . [ 6 ] Фермент присутствует в центральной нервной системе (ЦНС), периферических симпатических нейронах и мозговом веществе надпочечников . [ 6 ] Тирозингидроксилаза, фенилаланингидроксилаза и триптофангидроксилаза вместе составляют семейство гидроксилаз ароматических аминокислот (AAAH).
Реакция
[ редактировать ]| тирозин-3-монооксигеназа | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Номер ЕС. | 1.14.16.2 | ||
| Номер CAS. | 9036-22-0 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
Тирозингидроксилаза катализирует реакцию, в которой L -тирозин гидроксилируется в мета- положении с получением L -3,4-дигидроксифенилаланина ( L -ДОФА). Фермент является оксигеназой , что означает, что он использует молекулярный кислород для гидроксилирования своих субстратов. Один из атомов кислорода в O 2 используется для гидроксилирования молекулы тирозина с получением L -ДОФА, а другой — для гидроксилирования кофактора. Как и другие гидроксилазы ароматических аминокислот (AAAH), тирозингидроксилаза в нормальных условиях использует кофактор тетрагидробиоптерин (BH 4 ), хотя другие подобные молекулы также могут работать в качестве кофактора тирозингидроксилазы. [ 7 ]
AAAH превращает кофактор 5,6,7,8-тетрагидробиоптерин (BH 4 ) в тетрагидробиоптерин-4a-карбиноламин (4a-BH 4 ). В физиологических условиях 4a-BH 4 дегидратируется 2 до хиноноид-дигидробиоптерина (q-BH ) под действием фермента птерин-4а-карбиноламиндегидразы (PCD), и в этой реакции высвобождается молекула воды. [ 8 ] [ 9 ] Затем NAD(P)H-зависимый фермент дигидроптеридинредуктаза (DHPR) превращает q-BH 2 обратно в BH 4 . [ 8 ] Каждая из четырех субъединиц тирозингидроксилазы координирована с атомом железа (II), присутствующим в активном центре. Степень окисления этого атома железа важна для каталитического оборота в ферментативной реакции. Если железо окисляется до Fe(III), фермент инактивируется. [ 10 ]
Продукт ферментативной реакции L -ДОФА может быть преобразован в дофамин с помощью фермента ДОФА-декарбоксилазы . Дофамин может быть преобразован в норадреналин с помощью фермента дофамин-β-гидроксилазы , который может быть дополнительно модифицирован ферментом фенилэтанол-N-метилтрансферазой для получения адреналина. [ 11 ] Поскольку L -ДОФА является предшественником нейромедиаторов дофамина, норадреналина и адреналина, тирозингидроксилаза обнаруживается в цитозоле всех клеток, содержащих эти катехоламины . Было показано, что эта начальная реакция, катализируемая тирозингидроксилазой, является стадией, лимитирующей скорость продукции катехоламинов. [ 11 ]
Фермент высокоспецифичен, не воспринимает производные индола , что необычно, как и многие другие ферменты, участвующие в выработке катехоламинов. Триптофан является плохим субстратом для тирозингидроксилазы, однако он может гидроксилировать L -фенилаланин с образованием L -тирозина и небольших количеств 3-гидроксифенилаланина. [ 7 ] [ 12 ] [ 13 ] Затем фермент может дополнительно катализировать L -тирозин с образованием L -ДОФА. Тирозингидроксилаза также может участвовать в других реакциях, таких как окисление L -ДОФА с образованием 5-S-цистеинил-ДОФА или других производных L -ДОФА. [ 7 ] [ 14 ]
Структура
[ редактировать ]

|
Тирозингидроксилаза представляет собой тетрамер из четырех идентичных субъединиц ( гомотетрамер ). Каждая субъединица состоит из трех доменов . На карбоксильном конце пептидной цепи имеется короткий домен альфа-спирали , который обеспечивает тетрамеризацию. [ 15 ] Центральные ~300 аминокислот составляют каталитическое ядро, в котором расположены все необходимые для катализа остатки, а также нековалентно связанный атом железа. [ 12 ] Железо удерживается двумя остатками гистидина и одним остатком глутамата , что делает его негемовым, нежелезо-серным железосодержащим ферментом. [ 16 ] Аминоконцевые активному ~150 аминокислот составляют регуляторный домен, который, как полагают, контролирует доступ субстратов к центру . [ 17 ] Считается, что у человека существует четыре различных версии этого регуляторного домена и, следовательно, четыре версии фермента, в зависимости от альтернативного сплайсинга . [ 18 ] хотя ни одна из их структур еще не определена должным образом. [ 19 ] Было высказано предположение, что этот домен может представлять собой неструктурированный по своей природе белок , который не имеет четко определенной третичной структуры , но до сих пор не было представлено никаких доказательств, подтверждающих это утверждение. [ 19 ] Однако было показано, что в домене мало вторичных структур , что не ослабляет подозрений в его неупорядоченной общей структуре. [ 20 ] Что касается тетрамеризационного и каталитического доменов, то их структура была установлена с помощью крысиной тирозингидроксилазы с помощью рентгеновской кристаллографии . [ 21 ] [ 22 ] Это показало, что его структура очень похожа на структуру фенилаланингидроксилазы и триптофангидроксилазы ; вместе они составляют семейство гомологичных гидроксилаз ароматических аминокислот . [ 23 ] [ 24 ]
Регулирование
[ редактировать ]
Активность тирозингидроксилазы кратковременно увеличивается за счет фосфорилирования . Регуляторный домен тирозингидроксилазы содержит несколько остатков серина (Ser), включая Ser8, Ser19, Ser31 и Ser40, которые фосфорилируются различными протеинкиназами . [ 12 ] [ 25 ] Ser40 фосфорилируется цАМФ-зависимой протеинкиназой . [ 26 ] Ser19 (и Ser40 в меньшей степени) фосфорилируется кальций-кальмодулин-зависимой протеинкиназой . [ 27 ] MAPKAPK2 (протеинкиназа, активирующая митоген-активируемую протеинкиназу) отдает предпочтение Ser40, но также фосфорилирует Ser19 примерно в два раза медленнее, чем Ser40. [ 28 ] [ 29 ] Ser31 фосфорилируется ERK1 и ERK2 ( внеклеточно регулируемые киназы 1 и 2), [ 30 ] и повышает активность фермента в меньшей степени, чем при фосфорилировании Ser40. [ 28 ] Фосфорилирование Ser19 и Ser8 не оказывает прямого влияния на активность тирозингидроксилазы. Но фосфорилирование Ser19 увеличивает скорость фосфорилирования Ser40, что приводит к увеличению активности фермента. Фосфорилирование Ser19 вызывает двукратное увеличение активности за счет механизма, который требует наличия белков 14-3-3 . [ 31 ] Фосфорилирование Ser31 вызывает небольшое повышение активности, и здесь механизм неизвестен. Тирозингидроксилаза в некоторой степени стабилизируется к тепловой инактивации, когда регуляторные серины фосфорилируются. [ 28 ] [ 32 ]
Тирозингидроксилаза в основном присутствует в цитозоле, хотя в некоторой степени она обнаруживается и в плазматической мембране. [ 33 ] Мембранная ассоциация может быть связана с упаковкой катехоламинов в везикулах и их экспортом через синаптическую мембрану. [ 33 ] Связывание тирозингидроксилазы с мембранами включает N-концевую область фермента и может регулироваться трехсторонним взаимодействием между белками 14-3-3, N-концевой областью тирозингидроксилазы и отрицательно заряженными мембранами. [ 34 ]
Тирозингидроксилазу также можно регулировать путем ингибирования. Фосфорилирование Ser40 снимает ингибирование по принципу обратной связи катехоламинов дофамина, адреналина и норадреналина. [ 35 ] [ 36 ] Катехоламины удерживают железо активного центра в состоянии Fe(III), ингибируя фермент. [ 7 ]
Было показано, что на экспрессию тирозингидроксилазы может влиять экспрессия SRY . Понижающая регуляция гена SRY в черной субстанции может привести к снижению экспрессии тирозингидроксилазы. [ 37 ]
Долгосрочная регуляция тирозингидроксилазы также может быть опосредована механизмами фосфорилирования. Гормоны (например, глюкокортикоиды ), лекарства (например, кокаин ) или вторичные мессенджеры , такие как цАМФ, тирозингидроксилазы увеличивают транскрипцию . Увеличение активности тирозингидроксилазы за счет фосфорилирования может поддерживаться никотином до 48 часов. [ 7 ] [ 38 ] Активность тирозингидроксилазы регулируется хронически (в течение нескольких дней) путем синтеза белка . [ 38 ]
Клиническое значение
[ редактировать ]Дефицит тирозингидроксилазы приводит к нарушению синтеза дофамина , а также адреналина и норадреналина . Оно представлено прогрессирующей энцефалопатией и плохим прогнозом. Клинические особенности включают дистонию, которая минимально или не реагирует на терапию леводопой , экстрапирамидные симптомы, птоз , миоз и постуральную гипотензию . Это прогрессирующее и часто смертельное заболевание, которое можно облегчить, но не вылечить с помощью леводопы. [ 39 ] Из-за небольшого числа пациентов и совпадения симптомов с другими расстройствами ранняя диагностика и лечение остаются сложными. [ 40 ] Ответ на лечение варьируется, а долгосрочный и функциональный результат неизвестен. Чтобы обеспечить основу для улучшения понимания эпидемиологии, корреляции генотипа/фенотипа и исхода этих заболеваний, их влияния на качество жизни пациентов, а также для оценки диагностических и терапевтических стратегий, некоммерческой Международной рабочей организацией был создан реестр пациентов. Группа по расстройствам, связанным с нейротрансмиттерами (iNTD). [ 41 ]
Кроме того, изменения активности фермента тирозингидроксилазы могут быть связаны с такими расстройствами, как дистония Сегавы , болезнь Паркинсона и шизофрения . [ 21 ] [ 42 ] Тирозингидроксилаза активируется путем зависимого от фосфорилирования связывания с белками 14-3-3. [ 34 ] Поскольку белки 14-3-3 также, вероятно, связаны с нейродегенеративными заболеваниями, такими как болезнь Альцгеймера , болезнь Паркинсона и болезнь Хантингтона , это устанавливает косвенную связь между тирозингидроксилазой и этими заболеваниями. [ 43 ] Показано, что активность тирозингидроксилазы в мозге пациентов с болезнью Альцгеймера значительно снижена по сравнению со здоровыми людьми. [ 44 ] Тирозингидроксилаза также является аутоантигеном при аутоиммунном полиэндокринном синдроме (АПС) I типа . [ 45 ]
Постоянным нарушением при болезни Паркинсона является дегенерация дофаминергических нейронов черной субстанции , приводящая к снижению уровня дофамина в полосатом теле. Поскольку тирозингидроксилаза катализирует образование L-ДОФА, стадии, ограничивающей скорость биосинтеза дофамина , дефицит тирозингидроксилазы не вызывает болезнь Паркинсона, но обычно приводит к детскому паркинсонизму, хотя спектр распространяется и на состояние, напоминающее дофамин-гидроксилазу. реактивная дистония . Также была предложена прямая патогенетическая роль тирозингидроксилазы, поскольку фермент является источником H 2 O 2 и других активных форм кислорода (АФК) и мишенью для радикальных повреждений. Было продемонстрировано, что L -ДОФА эффективно окисляется тирозингидроксилазой млекопитающих, что, возможно, способствует цитотоксическому действию L - ДОФА. [ 7 ] Как и другие клеточные белки, тирозингидроксилаза также является возможной мишенью для повреждающих изменений, вызванных АФК. Это предполагает, что часть окислительного повреждения тирозингидроксилазы может быть вызвана самой тирозингидроксилазной системой. [ 7 ]
Тирозингидроксилазу можно ингибировать препаратом α-метилпаратирозин ( метирозин ). Это ингибирование может привести к истощению запасов дофамина и норэпинеферина в мозге из-за отсутствия предшественника L -дофа ( L -3,4-дигидроксифенилаланин), который синтезируется тирозингидроксилазой. Этот препарат используется редко и может вызвать депрессию, но он полезен при лечении феохромоцитомы , а также резистентной гипертонии . Более старые примеры ингибиторов, упомянутые в литературе, включают уденон. [ 46 ] и акваямицин . [ 47 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000180176 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: Ensembl, выпуск 89: ENSMUSG00000000214 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Кауфман С (1995). «Тирозингидроксилаза». Достижения энзимологии и смежных областей молекулярной биологии . Достижения в энзимологии и смежных областях молекулярной биологии. Том. 70. стр. 103–220. дои : 10.1002/9780470123164.ch3 . ISBN 978-0-470-12316-4 . ПМИД 8638482 .
- ^ Перейти обратно: а б с Нагацу Т. (1995). «Тирозингидроксилаза: изоформы человека, структура и регуляция в физиологии и патологии». Очерки по биохимии . 30 :15–35. ПМИД 8822146 .
- ^ Перейти обратно: а б с д и ж г Хаавик Дж., Тоска К. (июнь 1998 г.). «Тирозингидроксилаза и болезнь Паркинсона». Молекулярная нейробиология . 16 (3): 285–309. дои : 10.1007/BF02741387 . ПМИД 9626667 . S2CID 35753000 .
- ^ Перейти обратно: а б Тейген К., МакКинни Дж. А., Хаавик Дж., Мартинес А. (2007). «Детерминанты селективности и аффинности связывания лигандов с гидроксилазами ароматических аминокислот». Современная медицинская химия . 14 (4): 455–67. дои : 10.2174/092986707779941023 . ПМИД 17305546 .
- ^ Тони Б., Ауэрбах Г., Блау Н. (апрель 2000 г.). «Биосинтез, регенерация и функции тетрагидробиоптерина» . Биохимический журнал . 347 Ч. 1 (1): 1–16. дои : 10.1042/0264-6021:3470001 . ПМЦ 1220924 . ПМИД 10727395 .
- ^ Рэмси А.Дж., Хиллас П.Дж., Фитцпатрик П.Ф. (октябрь 1996 г.). «Характеристика железа активного центра тирозингидроксилазы. Редокс-состояния железа» . Журнал биологической химии . 271 (40): 24395–400. дои : 10.1074/jbc.271.40.24395 . ПМИД 8798695 .
- ^ Перейти обратно: а б Нагацу Т., Левитт М., Уденфренд С. (сентябрь 1964 г.). «Тирозингидроксилаза. Начальный этап биосинтеза норадреналина» . Журнал биологической химии . 239 : 2910–7. дои : 10.1016/S0021-9258(18)93832-9 . ПМИД 14216443 .
- ^ Перейти обратно: а б с Фицпатрик П.Ф. (1999). «Гидроксилазы тетрагидроптеринзависимых аминокислот». Ежегодный обзор биохимии . 68 : 355–81. doi : 10.1146/annurev.biochem.68.1.355 . ПМИД 10872454 .
- ^ Фитцпатрик П.Ф. (1994). «Кинетические изотопные эффекты на гидроксилирование дейтерированных по кольцу фенилаланинов тирозингидроксилазой предоставляют доказательства против разделения промежуточного продукта оксида арена». Журнал Американского химического общества . 116 (3): 1133–1134. дои : 10.1021/ja00082a046 .
- ^ Хаавик Дж., Флэтмарк Т. (октябрь 1987 г.). «Выделение и характеристика продуктов окисления тетрагидроптерина, образующихся в реакции тирозин-3-монооксигеназы (тирозингидроксилазы)» . Европейский журнал биохимии . 168 (1): 21–6. дои : 10.1111/j.1432-1033.1987.tb13381.x . ПМИД 2889594 .
- ^ Врана К.Э. , Уокер С.Дж., Ракер П., Лю Икс (декабрь 1994 г.). «Для образования тетрамера тирозингидроксилазы необходима лейциновая застежка на карбоксильном конце». Журнал нейрохимии . 63 (6): 2014–20. дои : 10.1046/j.1471-4159.1994.63062014.x . ПМИД 7964718 . S2CID 46042840 .
- ^ Рэмси А.Дж., Даубнер С.С., Эрлих Дж.И., Фитцпатрик П.Ф. (октябрь 1995 г.). «Идентификация железных лигандов в тирозингидроксилазе путем мутагенеза консервативных гистидинильных остатков» . Белковая наука . 4 (10): 2082–6. дои : 10.1002/pro.5560041013 . ПМК 2142982 . ПМИД 8535244 .
- ^ Даубнер С.С., Ле Т., Ван С. (апрель 2011 г.). «Тирозингидроксилаза и регуляция синтеза дофамина» . Архив биохимии и биофизики . 508 (1): 1–12. дои : 10.1016/j.abb.2010.12.017 . ПМК 3065393 . ПМИД 21176768 .
- ^ Кобаяши К., Канеда Н., Ичиносе Х., Киши Ф., Наказава А., Куросава Ю., Фудзита К., Нагацу Т. (июнь 1988 г.). «Структура гена тирозингидроксилазы человека: альтернативный сплайсинг одного гена приводит к образованию четырех типов мРНК». Журнал биохимии . 103 (6): 907–12. doi : 10.1093/oxfordjournals.jbchem.a122386 . ПМИД 2902075 .
- ^ Перейти обратно: а б Накашима А., Хаяши Н., Канеко Ю.С., Мори К., Саббан Э.Л., Нагацу Т., Ота А. (ноябрь 2009 г.). «Роль N-конца тирозингидроксилазы в биосинтезе катехоламинов». Журнал нейронной передачи . 116 (11): 1355–62. дои : 10.1007/ s00702-009-0227-8 ПМИД 19396395 . S2CID 930361 .
- ^ Обсилова В, Недбалкова Е, Силхан Дж, Бура Е, Герман П, Весер Дж, Сулк М, Тейзингер Дж, Дида Ф, Обсил Т (февраль 2008 г.). «Белок 14-3-3 влияет на конформацию регуляторного домена тирозингидроксилазы человека». Биохимия . 47 (6): 1768–77. дои : 10.1021/bi7019468 . ПМИД 18181650 .
- ^ Перейти обратно: а б Гудвилл К.Э., Сабатье К., Маркс К., Рааг Р., Фитцпатрик П.Ф., Стивенс Р.К. (июль 1997 г.). «Кристаллическая структура тирозингидроксилазы при 2,3 А и ее значение для наследственных нейродегенеративных заболеваний». Структурная биология природы . 4 (7): 578–85. дои : 10.1038/nsb0797-578 . ПМИД 9228951 . S2CID 20007900 .
- ^ Гудвилл К.Э., Сабатье С., Стивенс Р.К. (сентябрь 1998 г.). «Кристаллическая структура тирозингидроксилазы со связанным аналогом кофактора и железом при разрешении 2,3 А: самогидроксилирование Phe300 и сайт связывания птерина». Биохимия . 37 (39): 13437–45. дои : 10.1021/bi981462g . ПМИД 9753429 .
- ^ Ледли Ф.Д., ДиЛелла АГ, Квок СК, Ву С.Л. (июль 1985 г.). «Гомология между фенилаланиновой и тирозингидроксилазами обнаруживает общие структурные и функциональные домены». Биохимия . 24 (14): 3389–94. дои : 10.1021/bi00335a001 . ПМИД 2412578 .
- ^ Гренетт Х.Э., Ледли Ф.Д., Рид Л.Л., Ву С.Л. (август 1987 г.). «Полноразмерная кДНК кроличьей триптофангидроксилазы: функциональные домены и эволюция гидроксилаз ароматических аминокислот» . Труды Национальной академии наук Соединенных Штатов Америки . 84 (16): 5530–4. Бибкод : 1987PNAS...84.5530G . дои : 10.1073/pnas.84.16.5530 . ПМЦ 298896 . ПМИД 3475690 .
- ^ Хейкок JW (июль 1990 г.). «Фосфорилирование тирозингидроксилазы in situ по серину 8, 19, 31 и 40» . Журнал биологической химии . 265 (20): 11682–91. дои : 10.1016/S0021-9258(19)38451-0 . ПМИД 1973163 .
- ^ Роскоски Р., Роскоски Л.М. (январь 1987 г.). «Активация тирозингидроксилазы в клетках PC12 системами вторичных мессенджеров циклического GMP и циклического AMP». Журнал нейрохимии . 48 (1): 236–42. дои : 10.1111/j.1471-4159.1987.tb13153.x . ПМИД 2878973 . S2CID 14759673 .
- ^ Леманн И.Т., Бобровская Л., Гордон С.Л., Данкли П.Р., Диксон П.В. (июнь 2006 г.). «Дифференциальная регуляция изоформ тирозингидроксилазы человека посредством иерархического фосфорилирования» . Журнал биологической химии . 281 (26): 17644–51. дои : 10.1074/jbc.M512194200 . ПМИД 16644734 .
- ^ Перейти обратно: а б с Данкли П.Р., Бобровская Л., Грэм М.Е., фон Надь-Фельсобуки Э.И., Диксон П.В. (декабрь 2004 г.). «Фосфорилирование тирозингидроксилазы: регуляция и последствия» . Журнал нейрохимии . 91 (5): 1025–43. дои : 10.1111/j.1471-4159.2004.02797.x . ПМИД 15569247 . S2CID 24324381 .
- ^ Сазерленд С., Альтерио Дж., Кэмпбелл Д.Г., Ле Бурдель Б., Маллет Дж., Хаавик Дж., Коэн П. (октябрь 1993 г.). «Фосфорилирование и активация тирозингидроксилазы человека in vitro с помощью митоген-активируемой протеинкиназы (MAP) и MAP-киназ-активируемых киназ 1 и 2» . Европейский журнал биохимии . 217 (2): 715–22. дои : 10.1111/j.1432-1033.1993.tb18297.x . ПМИД 7901013 .
- ^ Хейкок Дж.В., Ан Н.Г., Кобб М.Х., Кребс Э.Г. (март 1992 г.). «ERK1 и ERK2, две ассоциированные с микротрубочками протеин-киназы 2, опосредуют фосфорилирование тирозингидроксилазы по серину-31 in situ» . Труды Национальной академии наук Соединенных Штатов Америки . 89 (6): 2365–9. Бибкод : 1992PNAS...89.2365H . дои : 10.1073/pnas.89.6.2365 . ПМК 48658 . ПМИД 1347949 .
- ^ Ичимура Т., Исобе Т., Окуяма Т., Такахаши Н., Араки К., Кувано Р., Такахаши Ю. (октябрь 1988 г.). «Молекулярное клонирование кДНК, кодирующей специфичный для мозга белок 14-3-3, протеинкиназо-зависимый активатор тирозин- и триптофангидроксилаз» . Труды Национальной академии наук Соединенных Штатов Америки . 85 (19): 7084–8. Бибкод : 1988PNAS...85.7084I . дои : 10.1073/pnas.85.19.7084 . ПМК 282128 . ПМИД 2902623 .
- ^ Ройо М., Фитцпатрик П.Ф., Даубнер СК (февраль 2005 г.). «Мутация регуляторных серинов крысиной тирозингидроксилазы на глутамат: влияние на стабильность и активность фермента». Архив биохимии и биофизики . 434 (2): 266–74. дои : 10.1016/j.abb.2004.11.007 . ПМИД 15639226 .
- ^ Перейти обратно: а б Чен Р., Вэй Дж., Фаулер С.С., Ву Цзюй (2003). «Демонстрация функциональной связи между синтезом дофамина и его упаковкой в синаптические везикулы» (PDF) . Журнал биомедицинской науки . 10 (6, часть 2): 774–81. дои : 10.1159/000073965 . hdl : 1808/17671 . ПМИД 14631117 . S2CID 5950778 .
- ^ Перейти обратно: а б Хальскау О., Ин М., Бауманн А., Клеппе Р., Родригес-Ларреа Д., Алмос Б., Хаавик Дж., Мартинес А. (ноябрь 2009 г.). «Трехстороннее взаимодействие между белками 14-3-3, N-концевой областью тирозингидроксилазы и отрицательно заряженными мембранами» . Журнал биологической химии . 284 (47): 32758–69. дои : 10.1074/jbc.M109.027706 . ПМЦ 2781693 . ПМИД 19801645 .
- ^ Даубнер С.К., Лауриано С., Хейкок Дж.В., Фитцпатрик П.Ф. (июнь 1992 г.). «Сайт-направленный мутагенез серина 40 крысиной тирозингидроксилазы. Влияние дофамина и цАМФ-зависимого фосфорилирования на активность фермента» . Журнал биологической химии . 267 (18): 12639–46. дои : 10.1016/S0021-9258(18)42325-3 . ПМИД 1352289 .
- ^ Рэмси Эй.Дж., Фитцпатрик П.Ф. (июнь 1998 г.). «Влияние фосфорилирования серина 40 тирозингидроксилазы на связывание катехоламинов: доказательства нового регуляторного механизма». Биохимия . 37 (25): 8980–6. дои : 10.1021/bi980582l . ПМИД 9636040 .
- ^ Дьюинг П., Чанг К.В., Синчак К., Сим Х., Фернагут П.О., Келли С., Чесселет М.Ф., Мицевич П.Е., Альбрехт К.Х., Харли В.Р., Вилен Э. (февраль 2006 г.). «Прямая регуляция функции мозга взрослых с помощью мужского фактора SRY» . Современная биология . 16 (4): 415–20. дои : 10.1016/j.cub.2006.01.017 . ПМИД 16488877 . S2CID 5939578 .
- ^ Перейти обратно: а б Бобровская Л., Гиллиган С., Болстер Е.К., Флаэрти Дж.Дж., Диксон П.В., Данкли П.Р. (январь 2007 г.). «Устойчивое фосфорилирование тирозингидроксилазы по серину 40: новый механизм поддержания синтеза катехоламинов». Журнал нейрохимии . 100 (2): 479–89. дои : 10.1111/j.1471-4159.2006.04213.x . ПМИД 17064352 . S2CID 20406829 .
- ^ Перл П.Л., Тейлор Дж.Л., Тшчински С., Сокол А. (май 2007 г.). «Педиатрические нейромедиаторные расстройства». J Детский Нейрол . 22 (5): 606–616. дои : 10.1177/0883073807302619 . ПМИД 17690069 . S2CID 10689202 .
- ^ Найгаард Г., Сигетвар П.Д., Гриндхайм А.К., Руофф П., Мартинес А., Яавик Дж., Клеппе Р., Флайдал М.И. (ноябрь 2021 г.). «Персонализированная медицина для улучшения лечения дофа-зависимой дистонии — акцент на дефиците тирозингидроксилазы» . Дж. Перс. Мед. 11 (1186): 1186. дои : 10.3390/jpm11111186 . ПМК 8625014 . ПМИД 34834538 .
- ^ «Реестр пациентов» .
- ^ Тибо Ф., Рибейр Ж.М., Дурмап Н., Мелони Р., Лоран С., Кэмпион Д., Менар Ж.Ф., Дольфюс С., Малле Дж., Пети М. (февраль 1997 г.). «Связь полиморфизма ДНК в первом интроне гена тирозингидроксилазы с нарушениями катехоламинергической системы при шизофрении». Исследования шизофрении . 23 (3): 259–64. дои : 10.1016/s0920-9964(96)00118-1 . ПМИД 9075305 . S2CID 46062969 .
- ^ Штайнакер П., Эйткен А., Отто М. (сентябрь 2011 г.). «Белки 14-3-3 при нейродегенерации». Семинары по клеточной биологии и биологии развития . 22 (7): 696–704. дои : 10.1016/j.semcdb.2011.08.005 . ПМИД 21920445 .
- ^ Савада М., Хирата Ю., Араи Х., Иидзука Р., Нагацу Т. (март 1987 г.). «Тирозингидроксилаза, триптофангидроксилаза, биоптерин и неоптерин в мозге нормальных людей и пациентов со старческим слабоумием типа Альцгеймера». Журнал нейрохимии . 48 (3): 760–4. дои : 10.1111/j.1471-4159.1987.tb05582.x . ПМИД 2879891 . S2CID 37490585 .
- ^ Хедстранд Х, Эквалл О, Хаавик Дж, Ландгрен Э, Беттерле С, Перхеентупа Дж, Густафссон Дж, Хасебай Э, Рорсман Ф, Кемпе О (январь 2000 г.). «Идентификация тирозингидроксилазы как аутоантигена при аутоиммунном полиэндокринном синдроме I типа». Связь с биохимическими и биофизическими исследованиями . 267 (1): 456–61. дои : 10.1006/bbrc.1999.1945 . ПМИД 10623641 .
- ^ Оно М., Окамото М., Кавабе Н., Умэдзава Х., Такеучи Т. (март 1971 г.). «Уденон, новый ингибитор тирозингидроксилазы микробного происхождения». Журнал Американского химического общества . 93 (5): 1285–6. дои : 10.1021/ja00734a054 . ПМИД 5545929 .
- ^ Аюкава С., Такеучи Т., Сезаки М., Хара Т., Умэдзава Х. (май 1968 г.). «Ингибирование тирозингидроксилазы акваямицином» . Журнал антибиотиков . 21 (5): 350–3. дои : 10.7164/антибиотики.21.350 . ПМИД 5726288 .
Дальнейшее чтение
[ редактировать ]- Массерано Дж. М., Вайнер Н. (1983). «Регуляция тирозингидроксилазы в центральной нервной системе». Молекулярная и клеточная биохимия . 53–54 (1–2): 129–52. дои : 10.1007/BF00225250 . ПМИД 6137760 . S2CID 19361815 .
- Мелони Р., Биге Н.Ф., Малле Дж. (2002). «Постгеномная эра и открытие генов психических заболеваний: есть новое искусство? Пример микросателлита HUMTH01 в гене тирозингидроксилазы». Молекулярная нейробиология . 26 (2–3): 389–403. дои : 10.1385/МН:26:2-3:389 . ПМИД 12428766 . S2CID 8814324 .
- Джо Т.Х., Парк Д.Х., Рейс DJ (октябрь 1978 г.). «Прямое фосфорилирование тирозингидроксилазы мозга циклической АМФ-зависимой протеинкиназой: механизм активации фермента» . Труды Национальной академии наук Соединенных Штатов Америки . 75 (10): 4744–8. Бибкод : 1978PNAS...75.4744J . дои : 10.1073/pnas.75.10.4744 . ПМК 336196 . ПМИД 33381 .
- Хейкок Дж.В., Ан Н.Г., Кобб М.Х., Кребс Э.Г. (март 1992 г.). «ERK1 и ERK2, две ассоциированные с микротрубочками протеин-киназы 2, опосредуют фосфорилирование тирозингидроксилазы по серину-31 in situ» . Труды Национальной академии наук Соединенных Штатов Америки . 89 (6): 2365–9. Бибкод : 1992PNAS...89.2365H . дои : 10.1073/pnas.89.6.2365 . ПМК 48658 . ПМИД 1347949 .
- Хейкок JW (июль 1990 г.). «Фосфорилирование тирозингидроксилазы in situ по серину 8, 19, 31 и 40» . Журнал биологической химии . 265 (20): 11682–91. дои : 10.1016/S0021-9258(19)38451-0 . ПМИД 1973163 .
- Крейг С.П., Бакл В.Дж., Ламуру А., Маллет Дж., Крейг И. (1986). «Локализация гена тирозингидроксилазы человека в 11p15: дупликация гена и эволюция метаболических путей». Цитогенетика и клеточная генетика . 42 (1–2): 29–32. дои : 10.1159/000132246 . ПМИД 2872999 .
- Грима Б., Ламуру А., Бони С., Жюльен Ж.Ф., Жавой-Агид Ф., Малле Дж. (1987). «Один человеческий ген, кодирующий несколько тирозингидроксилаз с различными предсказанными функциональными характеристиками». Природа . 326 (6114): 707–11. Бибкод : 1987Natur.326..707G . дои : 10.1038/326707a0 . ПМИД 2882428 . S2CID 4314044 .
- Канеда Н., Кобаяши К., Ичиносе Х., Киши Ф., Наказава А., Куросава Ю., Фудзита К., Нагацу Т. (август 1987 г.). «Выделение нового клона кДНК тирозингидроксилазы человека: альтернативный сплайсинг РНК дает четыре вида мРНК из одного гена». Связь с биохимическими и биофизическими исследованиями . 146 (3): 971–5. дои : 10.1016/0006-291X(87)90742-X . ПМИД 2887169 .
- Кобаяши К., Канеда Н., Ичиносе Х., Киши Ф., Наказава А., Куросава Ю., Фудзита К., Нагацу Т. (август 1987 г.). «Выделение полноразмерного клона кДНК, кодирующего тирозингидроксилазу человека типа 3» . Исследования нуклеиновых кислот . 15 (16): 6733. doi : 10.1093/nar/15.16.6733 . ПМК 306135 . ПМИД 2888085 .
- О'Мэлли К.Л., Анхальт М.Дж., Мартин Б.М., Келсо-младший, Уинфилд С.Л., Гиннс Э.И. (ноябрь 1987 г.). «Выделение и характеристика гена тирозингидроксилазы человека: идентификация 5'-альтернативных сайтов сплайсинга, ответственных за множественные мРНК». Биохимия . 26 (22): 6910–4. дои : 10.1021/bi00396a007 . ПМИД 2892528 .
- Ле Бурдель Б, Буларан С, Бони С, Ореллу П, Дюма С, Грима Б, Малле Дж (март 1988 г.). «Анализ 5'-области гена тирозингидроксилазы человека: комбинаторные закономерности сплайсинга экзонов создают множественные регулируемые изоформы тирозингидроксилазы». Журнал нейрохимии . 50 (3): 988–91. дои : 10.1111/j.1471-4159.1988.tb03009.x . ПМИД 2892893 . S2CID 44602622 .
- Гиннс Э.И., Рехави М., Мартин Б.М., Веллер М., О'Мэлли К.Л., ЛаМарка М.Э., Макаллистер К.Г., Пол С.М. (май 1988 г.). «Экспрессия кДНК тирозингидроксилазы человека в клетках беспозвоночных с использованием бакуловирусного вектора» . Журнал биологической химии . 263 (15): 7406–10. дои : 10.1016/S0021-9258(18)68656-9 . ПМИД 2896667 .
- Кобаяши К., Канеда Н., Ичиносе Х., Киши Ф., Наказава А., Куросава Ю., Фудзита К., Нагацу Т. (июнь 1988 г.). «Структура гена тирозингидроксилазы человека: альтернативный сплайсинг одного гена приводит к образованию четырех типов мРНК». Журнал биохимии . 103 (6): 907–12. doi : 10.1093/oxfordjournals.jbchem.a122386 . ПМИД 2902075 .
- Кокер Г.Т., Виннедж Л., О'Мэлли К.Л. (декабрь 1988 г.). «Характеристика генов тирозингидроксилазы крысы и человека: функциональная экспрессия обоих промоторов в нейрональных и ненейрональных типах клеток». Связь с биохимическими и биофизическими исследованиями . 157 (3): 1341–7. дои : 10.1016/S0006-291X(88)81022-2 . ПМИД 2905129 .
- Вуллиет П.Р., Вуджетт-младший, Коэн П. (ноябрь 1984 г.). «Фосфорилирование тирозингидроксилазы кальмодулинзависимой мультипротеинкиназой» . Журнал биологической химии . 259 (22): 13680–3. дои : 10.1016/S0021-9258(18)89798-8 . ПМИД 6150037 .
- Чжоу QY, Quaife CJ, Palmiter RD (апрель 1995 г.). «Направленное разрушение гена тирозингидроксилазы показывает, что катехоламины необходимы для развития плода мыши». Природа . 374 (6523): 640–3. Бибкод : 1995Natur.374..640Z . дои : 10.1038/374640a0 . ПМИД 7715703 . S2CID 4259663 .
- Людеке Б., Бартоломе К. (июнь 1995 г.). «Часто встречающийся вариант последовательности гена тирозингидроксилазы человека». Генетика человека . 95 (6): 716. дои : 10.1007/BF00209496 . ПМИД 7789962 . S2CID 1057532 .
- Людеке Б., Дворничак Б., Бартоломе К. (январь 1995 г.). «Точечная мутация гена тирозингидроксилазы, связанная с синдромом Сегавы». Генетика человека . 95 (1): 123–5. дои : 10.1007/BF00225091 . ПМИД 7814018 . S2CID 26870241 .
- Кнаппског П.М., Флэтмарк Т., Маллет Дж., Людеке Б., Бартоломе К. (июль 1995 г.). «Рецессивно наследуемая дистония, реагирующая на L-ДОФА, вызванная точечной мутацией (Q381K) в гене тирозингидроксилазы». Молекулярная генетика человека . 4 (7): 1209–12. дои : 10.1093/hmg/4.7.1209 . ПМИД 8528210 .