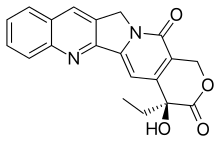
Камптотецин
 | |
| Клинические данные | |
|---|---|
| код АТС |
|
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| КЭБ | |
| ХЭМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.113.172 |
| Химические и физические данные | |
| Формула | С 20 Н 16 Н 2 О 4 |
| Молярная масса | 348.358 g·mol −1 |
| 3D model ( JSmol ) | |
| Температура плавления | От 275 до 277 ° C (от 527 до 531 ° F) |
| (проверять) | |
Камптотецин ( КПТ ) является ингибитором топоизомеразы . Он был открыт в 1966 году М.Э. Уоллом и М.К. Вани при систематическом скрининге натуральных продуктов на наличие противораковых препаратов . Его выделили из коры и стебля ( Camptotheca acuminata Camptotheca, «Счастливое дерево»), дерева, произрастающего в Китае и используемого в традиционной китайской медицине . [ 1 ] [ 2 ] Его клинически использовали в Китае для лечения опухолей желудочно-кишечного тракта. [ 3 ] КПТ продемонстрировал противораковую активность в предварительных клинических испытаниях , особенно в отношении рака молочной железы, яичников, толстой кишки, легких и желудка. [ 4 ] Однако он имеет низкую растворимость , и при его терапевтическом использовании сообщалось о побочных эффектах. [ 3 ] поэтому химики-синтетики и медицинские химики разработали многочисленные способы синтеза камптотецина. [ 5 ] [ 6 ] [ 7 ] и различные производные для увеличения пользы от химического вещества с хорошими результатами. CPT Четыре аналога были одобрены и используются в рака . химиотерапии [ 8 ] на сегодняшний день: топотекан , иринотекан , белотекан и трастузумаб дерукстекан . [ 9 ] [ 10 ] Камптотецин также был обнаружен в других растениях, включая Chonemorpha fragrans . [ 11 ]
Структуры
[ редактировать ]CPT имеет плоскую пентациклическую кольцевую структуру , которая включает пирроло [3,4-β]-хинолиновый фрагмент (кольца A, B и C), сопряженный пиридоновый фрагмент (кольцо D) и один хиральный центр в положении 20 внутри альфа- гидрокси. лактонное кольцо с (S)-конфигурацией (Е-кольцо). Его плоская структура считается одним из наиболее важных факторов ингибирования топоизомеразы. [ 12 ] [ 13 ]

Связывание
[ редактировать ]КПТ связывается с комплексом топоизомеразы I и ДНК (ковалентный комплекс), образуя тройной комплекс и тем самым стабилизируя его. Это предотвращает повторное лигирование ДНК и, следовательно, вызывает повреждение ДНК, что приводит к апоптозу . [ 14 ] КПТ связывается как с ферментом, так и с ДНК водородными связями . Наиболее важной частью структуры является Е-кольцо, которое взаимодействует с ферментом с трех разных позиций. Гидроксильная группа в положении 20 образует водородную связь с боковой цепью аспарагиновой кислоты под номером 533 (Asp533) фермента. Крайне важно, чтобы конфигурация хирального углерода была (S), поскольку (R) неактивен. Лактон связан двумя водородными связями с аминогруппами аргинина 364 ( Arg364 ). D-кольцо взаимодействует с цитозином +1 на нерасщепленной цепи и стабилизирует ковалентный комплекс топоизомераза I-ДНК путем образования водородной связи. Эта водородная связь существует между карбонильной группой в положении 17 D-кольца и аминогруппой пиримидинового кольца +1 цитозина. [ 15 ] [ 16 ] CPT избирательно цитотоксичен для клеток, реплицирующих ДНК во время S-фазы. [ 17 ] и его токсичность является, прежде всего, результатом преобразования одноцепочечных разрывов в двухцепочечные разрывы, когда репликационная вилка сталкивается с комплексами расщепления, образованными ДНК и CPT. [ 18 ]
Химия
[ редактировать ]Лактонное кольцо CPT очень чувствительно к гидролизу . Форма с открытым кольцом неактивна, и поэтому она должна быть закрытой для ингибирования топоизомеразы I. Закрытая форма предпочтительна в кислой среде, как и во многих раковых клеток микроокружении . КПТ транспортируется в клетку путем пассивной диффузии . Клеточному поглощению способствует липофильность , которая усиливает внутриклеточное накопление. Липофильность делает соединения более стабильными из-за улучшения распределения лактона в эритроцитах и, следовательно, меньшего гидролиза лактона. КПТ имеет сродство к сывороточному альбумину человека (ЧСА), особенно к карбоксилатной форме КПТ. Из-за этого равновесие между лактонным кольцом и карбоксилатной формой смещается в сторону карбоксилата. препарата с HSA Снижение взаимодействия может привести к улучшению активности. [ 15 ] [ 19 ]
Отношения структура-деятельность
[ редактировать ]
Исследования показали, что замена в положениях 7, 9, 10 и 11 может оказывать положительное влияние на активность CPT и физические свойства , например эффективность и метаболическую стабильность. Увеличение лактонного кольца на один CH
2 единица также усиливает его способности, как и гомокамптотецин. Замена в положениях 12 и 14 приводит к неактивной производной. [ 19 ]
Модификация A- и B-образных колец
[ редактировать ]Алкильное замещение
[ редактировать ]Алкильное показало повышенную цитотоксичность замещение в положении 7, такое как этил (C 2 H 5 ) или хлорметил (CH 2 Cl), . Эти группы способны реагировать с ДНК в присутствии топоизомеразы I, что приводит к большей активности опухоли . Также было показано, что увеличение длины углеродной цепи (в положении 7) приводит к увеличению липофильности и, следовательно, к большей эффективности и стабильности в плазме человека . [ 15 ] [ 19 ] Другими 7-модифицированными аналогами СРТ являются силатеканы и каренитецины. Они являются мощными ингибиторами топоизомеразы I и оба имеют алкилсилильные группы в положении 7, что делает их липофильными и более стабильными. Силатеканы или 7-силилкамптотецины продемонстрировали снижение взаимодействия препарата с HSA, что способствует его стабильности в крови, а также могут преодолевать гематоэнцефалический барьер . DB-67 представляет собой 10-гидроксипроизводное и относится к наиболее активным силатеканам. BNP1350, принадлежащий к ряду каренитецинов, проявляет цитотоксическую активность и способность преодолевать лекарственную устойчивость . Еще одним способом сделать CPT липофильным является введение липофильных заместителей, таких как иминометильные или оксииминометильные фрагменты. Одним из наиболее мощных соединений является оксииминометильное производное ST1481, которое обладает преимуществом преодоления лекарственной устойчивости, вызванной транспортными системами. [ 19 ] Основной азот в углеродной цепи в положении 7 делает соединение более гидрофильным и, следовательно, более водорастворимым. Например, это производное под названием CKD-602, которое является мощным ингибитором топоизомеразы I и успешно преодолевает плохую растворимость в воде и токсичность, наблюдаемые при CPT. [ 19 ] [ 20 ]
Значительно большей активности можно достичь, помещая электроноакцепторные группы, такие как амино, нитро , бром или хлор, в положения 9 и 10 и гидроксильную группу в положение 10 или 11. Но эти соединения относительно нерастворимы в водных растворах, что вызывает трудности при введении. Метоксигруппа в положении 10 и 11 одновременно приводит к неактивности. [ 12 ] [ 19 ]
Гексациклические аналоги CPT
[ редактировать ]Гексациклические аналоги CPT показали высокую эффективность. Например, метилендиокси или этилендиоксигруппа, соединенная между 10 и 11, образует 5- или 6-членное кольцо, что приводит к образованию более водорастворимых производных и повышению эффективности. Исследования показали, что аналоги этилендиокси менее эффективны, чем метилендиокси. Причина – неблагоприятные стерические взаимодействия аналогов этилендиокси с ферментом. [ 12 ] [ 19 ]
Добавление амино- или хлорогруппы в 9-м положении или хлорметильной группы в 7-м положении к этим 10, 11-метилендиокси- или этилендиокси-аналогам приводит к образованию соединений с еще большей цитотоксичностью, но с меньшей растворимостью в воде. Для получения аналогов 10, 11-метилендиокси или этилендиокси с хорошей растворимостью в воде хорошим способом является введение водорастворимого заместителя в положение 7. Луртотекан отвечает этим требованиям; это аналог 10,11-этилендиокси с 4-метилпиперазинометиленом в положении 7, показавший большую эффективность в клинических исследованиях. [ 12 ]
Кольцо также может образовываться между позициями 7 и 9, как и между позициями 10 и 11. Это открывает новые возможности для получения водорастворимых производных [5]. Эти гексациклические CPT становятся более активными, когда электроноакцепторные группы помещаются в положение 11, а метильные или аминогруппы - в 10. Экзатекан является примером гексациклического CPT, который имеет 6-членное кольцо над положениями 7 и 9 и представляет собой 10-метил, 11 -фторзамещенный [4]. Он водорастворим и более эффективен, чем топотекан. [ 12 ] [ 19 ] [ 21 ]
Модификация C- и D-кольца
[ редактировать ]C- и D-кольца играют важную роль в противоопухолевой активности. Замена в любом положении приводит к получению гораздо менее активного соединения, чем исходное соединение в других анализах цитотоксичности. [ 12 ]

Модификации E-образного кольца
[ редактировать ]E-кольцо не допускает многих структурных изменений без потери активности CPT, поскольку оно необходимо для связывания с активным сайтом TOP I. [ 22 ] Одной из возможных замен является замена гидроксильной группы на Cl, F или Br, поскольку их поляризуемость достаточна для стабилизации ферментного комплекса. [ 19 ]
Другой возможной модификацией является вставка метилена между гидроксилом и лактоном в E-кольце с образованием семичленной группы β-гидроксилактона, так называемого гомокамптотецина (hCPT). Гидроксильная группа hCPT оказывает меньшее индуктивное воздействие на карбоксильную группу, что делает лактон очень реакционноспособным. Это оптимально усиливает взаимодействие свободной гидроксильной группы с топоизомеразой I, и образующийся в ее присутствии ковалентный комплекс становится более стабильным. E-кольцо hCPT открывается медленнее и необратимо . hCPT демонстрируют повышенную стабильность в плазме человека из-за снижения связывания с белками и большего сродства к эритроцитам, чем CPT. [ 12 ] [ 19 ]
Аналоги КПТ
[ редактировать ]С момента открытия CPT было синтезировано множество аналогов. Ниже схематично представлены аналоги CPT, упомянутые в тексте выше.
 | ||||
| Аналоговый | Р 1 | Р 2 | Р 3 | Р 4 |
| Топотекан | -ЧАС | 
|
-ОЙ | -ЧАС |
| Иринотекан (CPT-11) | -ЧАС | 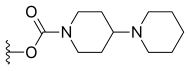
|
-ЧАС | |
| Силатекан (ДБ-67, АР-67) | 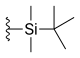
|
-ЧАС | -ОЙ | -ЧАС |
| Коситекан (BNP-1350) | 
|
-ЧАС | -ЧАС | -ЧАС |
| Экзатекан | 
|
—СН 3 | —Ф | |
| Луртотекан | 
|
-ЧАС | 
| |
| Гиматекан (ST1481) | 
|
-ЧАС | -ЧАС | -ЧАС |
| Белотекан (CKD-602) | 
|
-ЧАС | -ЧАС | -ЧАС |
| Рубитекан | -ЧАС | 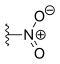
|
-ЧАС | -ЧАС |
CPT связан с полимером на основе циклодекстрина, образуя исследуемый противораковый препарат CRLX101 . [ 23 ]
Биосинтез
[ редактировать ]


Как и все другие монотерпеноидные индолалкалоиды, биосинтез камптотецина требует продукции стриктозидина . Стриктозидин синтезируется в результате реакции конденсации между триптамином шикиматного пути и секологанином либо мевалонатного (MVA), либо немевалонатного пути (MEP). [ 24 ] Затем стриктозидин подвергается межмолекулярной циклизации с образованием стриктозамида, который превращается в камптотецин в результате серии реакций окисления с участием ферментов, которые еще предстоит разрешить. [ 25 ]
Шикиматный путь, ведущий к биосинтезу триптамина, в основном понятен. Сначала хоризмат превращается в антранилат с помощью альфа-субъединицы антранилатсинтазы (ASA). Антранилат реагирует с 5-фосфорибозопирофосфатом с образованием 5-фосфорибозилантранилата. Затем этот промежуточный продукт превращается в индол-глицеринфосфат, который взаимодействует с альфа-субъединицей триптофан-синтазы (TSA) с образованием индола. Бета-субъединица триптофансинтазы (ТСБ) катализирует конденсацию индола с серином, что приводит к образованию триптофана. На следующем этапе в результате декарбоксилирования триптофандекарбоксилазой (TDC) образуется триптамин. [ 26 ]
Синтез секологанина начинается с реакции конденсации между пируватом и D-глицеральдегид-3-фосфатом, катализируемой 1-дезокси-D-ксилулозо-5-фосфатсинтазой (DXS), с образованием 1-дезокси-D-ксилулозо-5-фосфата (DXP). Превращение DXP в изопентенилдифосфат (IPP), который является распространенным предшественником биосинтеза терпеноидов, включает 1-дезокси-D-ксилулозо-5-фосфатредуктоизомеразу (DXR) и 1-гидрокси-2-метил-2(E)-бутенил- 4-дифосфатредуктаза (HDR). Формирование IPP может осуществляться как путем MVA, так и MEP. [ 26 ] Конденсация IPP и диметилаллилдифосфата (DMAPP) дает геранилдифосфат (GPP). Затем гераниолсинтаза (GS) превращает GPP в гераниол. [ 24 ] Превращение гераниола в секологанин происходит посредством различных ферментативных реакций. Согласно исследованиям с радиоактивной меткой и ингибиторами, специфичными для пути, путь MEP является основным источником секологанина. [ 26 ] Триптамин из шикиматного пути и секологанин из пути MVA или MEP превращаются в стриктозидин в результате реакции конденсации, катализируемой стриктозидинсинтазой. Хотя этот вопрос до конца не решен, было высказано предположение, что камптотецин производится из стриктозидина посредством стриктозамида, 3 (S)-пумилозида и 3 (S)-дезоксипумилозида. [ 25 ]
Ссылки
[ редактировать ]- ^ Говиндачари Т.Р., Вишнатан Н. (1972). «Кора ствола Mappia foetida , дерева, произрастающего в Индии, оказалась еще одним важным источником для выделения камптотецина». Фитохимия . 11 (12): 3529–31. дои : 10.1016/s0031-9422(00)89852-0 .
- ^ Эфферт Т., Фу Ю.Дж., Зу Ю.Г., Шварц Г., Конкималла В.С., Винк М. (2007). «Молекулярная целенаправленная терапия опухолей натуральными продуктами, полученными из традиционной китайской медицины». Современная медицинская химия . 14 (19): 2024–2032. дои : 10.2174/092986707781368441 . ПМИД 17691944 .
- ^ Jump up to: а б «Камптотецин» . Chemnetbase — Словарь лекарств .
- ^ Ван С.Х., Хуан М., Чжао С.К., Ли С., Сюй Л. (июнь 2019 г.). «Разработка, синтез и оценка биологической активности конъюгатов камптотецин-ГАА-норкантаридин в качестве противоопухолевых средств in vitro». Химическая биология и дизайн лекарств . 93 (6): 986–992. дои : 10.1111/cbdd.13397 . ПМИД 30218487 . S2CID 52277958 .
- ^ Рейх Х.Дж. «Курранский синтез камптотецина» . Архивировано из оригинала 5 сентября 2009 г.
- ^ Рейх Х.Дж. «Коминс-синтез камптотецина» . Архивировано из оригинала 5 сентября 2009 г.
- ^ Рейх Х.Дж. «Рапапорт Синтез камптотецина» . Архивировано из оригинала 7 сентября 2009 года.
- ^ Такимото Ч., Кальво Э (2008). «Принципы онкологической фармакотерапии» . В Паздуре Р., Вагмане Л.Д., Кампхаузене К.А., Хоскинсе В.Дж. (ред.). Лечение рака: междисциплинарный подход (11-е изд.). Архивировано из оригинала 15 мая 2009 года.
- ^ Уолл М.Э., Вани М.К., Кук Калифорния, Палмер К.Х., Макфэйл А.А., Сим Г.А. (1966). «Растительные противоопухолевые средства. I. Выделение и структура камптотецина, нового алкалоидного лейкоза и ингибитора опухоли из камптотеки остроконечной». Журнал Американского химического общества . 88 (16): 3888–3890. дои : 10.1021/ja00968a057 .
- ^ Самуэльссон Г (2004). Лекарственные средства природного происхождения: Учебник фармакогнозии (5-е изд.). Стокгольм: шведская фармацевтическая пресса. ISBN 91-974318-4-2 .
- ^ Иса Т., Умар С. (сентябрь 2018 г.). «Влияние на клональное размножение Chonemorpha fragrans (moon) Alston in vitro с помощью силы питательной среды, регуляторов роста растений, источника углерода и фотопериодической инкубации». Журнал лесных исследований . 31 : 27–43. дои : 10.1007/s11676-018-0794-3 . S2CID 52297102 .
- ^ Jump up to: а б с д и ж г Улукан Х., Сваан П.В. (2002). «Камптотецины: обзор их химиотерапевтического потенциала». Наркотики . 62 (14) (27 изд.): 2039–2057. дои : 10.2165/00003495-200262140-00004 . ПМИД 12269849 .
- ^ Лу AJ, Чжан З.С., Чжэн М.Ю., Цзоу Х.Дж., Луо XM, Цзян Х.Л. (февраль 2007 г.). «3D-QSAR-исследование 20 аналогов 20 (S)-камптотецина» . Акта Фармакологика Синика . 28 (2): 307–314. дои : 10.1111/j.1745-7254.2007.00477.x . ПМИД 17241535 .
- ^ «Камптотецин» . Наркобанк . Проверено 9 октября 2016 г.
- ^ Jump up to: а б с Адамс Д.Д., Валь М.Л., Флауэрс Дж.Л., Сен Б., Колвин М., Дьюхерст М.В. и др. (январь 2006 г.). «Аналоги камптотецина с повышенной активностью против клеток рака молочной железы человека. II. Влияние градиента pH опухоли». Химиотерапия и фармакология рака . 57 (2): 145–154. дои : 10.1007/s00280-005-0008-5 . ПМИД 16001167 . S2CID 23652115 .
- ^ Рединбо М.Р., Стюарт Л., Кун П., Шампу Дж.Дж., Хол В.Г. (март 1998 г.). «Кристаллические структуры топоизомеразы I человека в ковалентных и нековалентных комплексах с ДНК». Наука . 279 (5356): 1504–1513. Бибкод : 1998Sci...279.1504R . дои : 10.1126/science.279.5356.1504 . ПМИД 9488644 .
- ^ Дель Бино Г., Лассота П., Дажинкевич З. (март 1991 г.). «S-фазная цитотоксичность камптотецина». Экспериментальные исследования клеток . 193 (1): 27–35. дои : 10.1016/0014-4827(91)90534-2 . ПМИД 1995300 .
- ^ Помье И., Редон С., Рао В.А., Зайлер Дж.А., Сордет О., Такемура Х. и др. (ноябрь 2003 г.). «Восстановление и ответ контрольной точки на повреждение ДНК, опосредованное топоизомеразой I» . Мутационные исследования . 532 (1–2): 173–203. дои : 10.1016/j.mrfmmm.2003.08.016 . ПМИД 14643436 .
- ^ Jump up to: а б с д и ж г час я дж Зунино Ф., Даллаваллеб С., Лаккабуэа Д., Береттаа Г., Мерлиниб Л., Пратеси Г. (2002). «Современное состояние и перспективы развития камптотецинов». Текущий фармацевтический дизайн . 8 (27) (27 изд.): 2505–2520. дои : 10.2174/1381612023392801 . ПМИД 12369944 .
- ^ Чунг М.К., Хан С.С., Ким Дж.К. (август 2006 г.). «Оценка токсического потенциала нового противоракового агента камптотецина CKD-602 на фертильность и раннее эмбриональное развитие у крыс». Нормативная токсикология и фармакология . 45 (3): 273–281. дои : 10.1016/j.yrtph.2006.05.004 . ПМИД 16814440 .
- ^ Палумбо М., Сисси С., Гатто Б., Моро С., Заготто Дж. (ноябрь 2001 г.). «Количественное определение камптотецина и родственных соединений». Журнал хроматографии. Б. Биомедицинские науки и их применения . 764 (1–2): 121–140. дои : 10.1016/S0378-4347(01)00345-0 . ПМИД 11817024 .
- ^ Вендитто В.Дж., Симанек Э.Э. (апрель 2010 г.). «Терапия рака с использованием камптотецинов: обзор литературы in vivo» . Молекулярная фармацевтика . 7 (2): 307–349. дои : 10.1021/mp900243b . ПМЦ 3733266 . ПМИД 20108971 .
- ^ «Церулин привлекает 24 миллиона долларов на развитие клинических разработок нанофармацевтических препаратов» . 15 ноября 2010 г.
- ^ Jump up to: а б Ямазаки Ю., Китадзима М., Арита М., Такаяма Х., Судо Х., Ямазаки М. и др. (январь 2004 г.). «Биосинтез камптотецина. Исследование индикаторов in silico и in vivo из [1-13C] глюкозы» . Физиология растений . 134 (1): 161–170. дои : 10.1104/стр.103.029389 . ПМК 316296 . ПМИД 14657405 .
- ^ Jump up to: а б Лоренс А., Несслер К.Л. (октябрь 2004 г.). «Камптотецин, более четырех десятилетий удивительных открытий». Фитохимия . 65 (20): 2735–2749. Бибкод : 2004PChem..65.2735L . doi : 10.1016/j.phytochem.2004.09.001 . ПМИД 15474560 .
- ^ Jump up to: а б с Новый взгляд на биосинтез алкалоидов и перспективы на будущее . Академическая пресса. 27 июля 2013 г. стр. 143–149. ISBN 978-0-08-099411-6 .