Эпигенетика

В биологии эпигенетика — это изучение наследственных признаков или стабильных изменений функции клеток, которые происходят без изменений в последовательности ДНК . [1] Греческий подразумевает признаки , префикс эпи- ( ἐπι- «сверх, снаружи, вокруг») в эпигенетике которые находятся «поверх» или «в дополнение к» традиционному (основанному на последовательности ДНК) генетическому механизму наследования. [2] Эпигенетика обычно включает в себя изменения, которые не стираются при делении клеток и влияют на регуляцию экспрессии генов . [3] Такое воздействие на клеточные и физиологические фенотипические признаки может быть результатом факторов окружающей среды или быть частью нормального развития. Они могут привести к раку. [4]
Этот термин также относится к механизму изменений: функционально значимые изменения генома , не связанные с мутацией нуклеотидной последовательности . Примерами механизмов, вызывающих такие изменения, являются метилирование ДНК и модификация гистонов , каждый из которых изменяет способ экспрессии генов, не изменяя при этом основную последовательность ДНК . [5] Кроме того, было показано, что некодирующие последовательности РНК играют ключевую роль в регуляции экспрессии генов. [6] Экспрессию генов можно контролировать с помощью белков-репрессоров , которые прикрепляются к сайленсёрным участкам ДНК. Эти эпигенетические изменения могут сохраняться в результате клеточных делений на протяжении всей жизни клетки, а также могут сохраняться в течение нескольких поколений, даже если они не связаны с изменениями в основной последовательности ДНК организма; [7] вместо этого негенетические факторы заставляют гены организма вести себя (или «выражать себя») по-другому. [8]
Одним из примеров эпигенетических изменений в биологии эукариот является процесс клеточной дифференциации . В ходе морфогенеза , которые , тотипотентные стволовые клетки превращаются в различные плюрипотентные клеточные линии эмбриона в свою очередь , становятся полностью дифференцированными клетками. Другими словами, поскольку одна оплодотворенная яйцеклетка – зигота – продолжает делиться , образующиеся дочерние клетки превращаются во все различные типы клеток организма, включая нейроны , мышечные клетки , эпителий , эндотелий кровеносных сосудов и т. д., путем активируя одни гены и подавляя экспрессию других. [9]
Определения
[ редактировать ]Термин «эпигенез» имеет общее значение «дополнительный рост», которое используется в английском языке с 17 века. [10] В научных публикациях термин эпигенетика начал появляться в 1930-е годы (см. рис. справа). Однако его современный смысл появился лишь в 1990-е годы. [11]

Определение понятия эпигенетического признака как «стабильно наследуемого фенотипа, возникающего в результате изменений хромосомы без изменений в последовательности ДНК» было сформулировано на встрече в Колд-Спринг-Харборе в 2008 году. [12] хотя альтернативные определения, включающие ненаследственные признаки, все еще широко используются. [13]
Канализация Уоддингтона, 1940-е годы.
[ редактировать ]Гипотезу об эпигенетических изменениях, влияющих на экспрессию хромосом, выдвинул российский биолог Николай Кольцов . [14] Исходя из общего значения и связанного с ним прилагательного «эпигенетический» , британский эмбриолог Ч. Х. Уоддингтон в 1942 году ввёл термин «эпигенетика» , относящийся к эпигенезу , параллельно с Валентина Хеккера «феногенетикой» ( Phänogenetik ). [15] Эпигенезом в контексте биологии того периода обозначали дифференцировку клеток из исходного тотипотентного состояния в процессе эмбрионального развития . [16]
Когда Уоддингтон придумал этот термин, физическая природа генов и их роль в наследственности еще не была известна. Вместо этого он использовал ее как концептуальную модель того, как генетические компоненты могут взаимодействовать с окружающей средой, создавая фенотип ; он использовал фразу « эпигенетический ландшафт » как метафору биологического развития . Уоддингтон считал, что судьбы клеток задаются во время развития в процессе, который он назвал канализацией, подобно тому, как шарик скатывается до точки наименьшего локального возвышения . [17] Уоддингтон предложил визуализировать возрастающую необратимость дифференциации типов клеток как гребни, поднимающиеся между долинами, по которым перемещаются шарики (аналогичные клеткам). [18]
В последнее время представление Уоддингтона об эпигенетическом ландшафте было строго формализовано в контексте подхода системной динамики состояний к изучению судеб клеток. [19] [20] Предполагается, что детерминация клеточной судьбы будет проявлять определенную динамику, такую как конвергенция аттрактора (аттрактор может быть точкой равновесия, предельным циклом или странным аттрактором ) или колебательная. [20]
Современный
[ редактировать ]Робин Холлидей определил в 1990 году эпигенетику как «изучение механизмов временного и пространственного контроля активности генов во время развития сложных организмов». [21]
Более позднее использование этого слова в биологии следует более строгим определениям. По определению Артура Риггса и его коллег, это «исследование митотически и/или мейотически наследуемых изменений в функции генов, которые нельзя объяснить изменениями в последовательности ДНК». [22]
Однако этот термин также использовался для описания процессов, передача которых по наследству не была доказана, таких как некоторые формы модификации гистонов. Следовательно, предпринимаются попытки переопределить «эпигенетику» в более широком смысле, чтобы избежать ограничений, связанных с требованием наследственности . Например, Адриан Берд определил эпигенетику как «структурную адаптацию хромосомных областей с целью регистрации, сигнализации или сохранения измененных состояний активности». [7] Это определение будет включать временные модификации, связанные с репарацией ДНК или фазами клеточного цикла , а также стабильные изменения, сохраняющиеся на протяжении нескольких поколений клеток, но исключать другие, такие как формирование шаблонов мембранной архитектуры и прионы, если они не влияют на функцию хромосом. Однако такие переопределения не являются общепринятыми и все еще являются предметом дискуссий. [23] , В проекте «Дорожная карта эпигеномики» НИЗ который осуществлялся с 2008 по 2017 год, используется следующее определение: «Для целей этой программы эпигенетика относится как к наследственным изменениям в активности и экспрессии генов (в потомстве клеток или индивидуумов), так и к стабильные, долгосрочные изменения транскрипционного потенциала клетки, которые не обязательно передаются по наследству». [24] было принято консенсусное определение эпигенетического признака — «стабильно наследуемого фенотипа, возникающего в результате изменений в хромосоме без изменений в последовательности ДНК». в Колд-Спринг-Харборе В 2008 году на встрече [12]
Сходство слова со словом «генетика» породило множество параллельных его значений. « Эпигеном » является параллелью слова « геном », относящегося к общему эпигенетическому состоянию клетки, а эпигеномика относится к глобальному анализу эпигенетических изменений во всем геноме. [13] Фраза « генетический код » также была адаптирована: « эпигенетический код » использовался для описания набора эпигенетических особенностей, которые создают разные фенотипы в разных клетках на основе одной и той же базовой последовательности ДНК. В крайнем случае, «эпигенетический код» может отражать общее состояние клетки, при этом положение каждой молекулы учитывается на эпигеномной карте , схематическом представлении экспрессии генов, метилирования ДНК и статуса модификации гистонов конкретного генома. область. Чаще всего этот термин используется в отношении систематических усилий по измерению конкретных, соответствующих форм эпигенетической информации, такой как код гистонов или закономерности метилирования ДНК . [ нужна ссылка ]
Механизмы
[ редактировать ]Ковалентная модификация ДНК (например, метилирование и гидроксиметилирование цитозина) или белков-гистонов (например, ацетилирование лизина, метилирование лизина и аргинина, фосфорилирование серина и треонина, а также убиквитинирование и сумойлирование лизина) играют центральную роль во многих типах эпигенетического наследования. Поэтому слово «эпигенетика» иногда используется как синоним этих процессов. Однако это может ввести в заблуждение. Ремоделирование хроматина не всегда наследуется, и не всегда эпигенетическое наследование включает ремоделирование хроматина. [25] В 2019 году в научной литературе появилась еще одна модификация лизина, связывающая модификацию эпигенетики с клеточным метаболизмом, а именно лактилирование. [26]

Поскольку на фенотип клетки или индивидуума влияет то, какой из его генов транскрибируется, наследуемые состояния транскрипции могут вызывать эпигенетические эффекты. Существует несколько уровней регуляции экспрессии генов . Одним из способов регулирования генов является ремоделирование хроматина. Хроматин представляет собой комплекс ДНК и белков- гистонов , с которыми он связан. Если изменится способ, которым ДНК обернута вокруг гистонов, может измениться и экспрессия генов. Ремоделирование хроматина осуществляется посредством двух основных механизмов:
- Первый путь — посттрансляционная модификация аминокислот, входящих в состав белков-гистонов. Гистоновые белки состоят из длинных цепочек аминокислот. Если аминокислоты, находящиеся в цепи, изменяются, форма гистона может измениться. ДНК не полностью раскручивается во время репликации. Таким образом, возможно, что модифицированные гистоны могут быть перенесены в каждую новую копию ДНК. Оказавшись там, эти гистоны могут действовать как шаблоны, инициируя формирование новых окружающих гистонов по-новому. Изменяя форму гистонов вокруг себя, эти модифицированные гистоны будут гарантировать сохранение программы транскрипции, специфичной для линии, после деления клеток.
- Второй путь — добавление к ДНК метильных групп, в основном в сайтах CpG , для преобразования цитозина в 5-метилцитозин . 5-Метилцитозин действует так же, как обычный цитозин, соединяясь с гуанином в двухцепочечной ДНК. Однако когда метилированные цитозины присутствуют в сайтах CpG в областях промотора и энхансера генов, гены часто репрессируются. [27] [28] Когда метилированные цитозины присутствуют в CpG-сайтах тела гена (в кодирующей области, исключая сайт начала транскрипции), экспрессия гена часто усиливается. Транскрипция гена обычно зависит от связывания транскрипционного фактора (10 оснований или меньше) с последовательностью распознавания на энхансере, который взаимодействует с промоторной областью этого гена ( Экспрессия гена # Энхансеры, факторы транскрипции, медиаторный комплекс и петли ДНК в транскрипции млекопитающих). ). [29] Связывание около 22% факторов транскрипции ингибируется, если последовательность узнавания содержит метилированный цитозин. Кроме того, присутствие метилированных цитозинов в промоторной области может привлекать белки метил-CpG-связывающего домена (MBD). Все MBD взаимодействуют с ремоделированием нуклеосом и комплексами гистондеацетилазы , что приводит к молчанию генов. Кроме того, другой ковалентной модификацией с участием метилированного цитозина является его деметилирование ферментами ТЕТ . Сотни таких деметилирований происходят, например, во время процессов обучения и формирования памяти в нейронах . [30] [31]
Часто существует обратная связь между метилированием ДНК и метилированием лизина гистонов. [32] Например, белок метилсвязывающего домена MBD1 , привлекаемый и связывающийся с метилированным цитозином ДНК в CpG-сайте , также может ассоциироваться с активностью метилтрансферазы H3K9 для метилирования гистона 3 по лизину 9. С другой стороны, поддерживающее метилирование ДНК с помощью DNMT1 , по-видимому, частично полагаются на распознавание метилирования гистонов на нуклеосоме, присутствующей в участке ДНК, для осуществления метилирования цитозина на вновь синтезированной ДНК. [32] Между метилированием ДНК, осуществляемым DNMT3A и DNMT3B, и метилированием гистонов существуют дополнительные перекрестные помехи, так что существует корреляция между распределением метилирования ДНК по всему геному и метилированием гистонов. [33]
Механизмы наследственности состояния гистонов недостаточно изучены; однако многое известно о механизме наследования состояния метилирования ДНК во время деления и дифференцировки клеток. Наследственность состояния метилирования зависит от определенных ферментов (таких как DNMT1 ), которые имеют более высокое сродство к 5-метилцитозину, чем к цитозину. Если этот фермент достигает «полуметилированной» части ДНК (где 5-метилцитозин находится только в одной из двух цепей ДНК), фермент метилирует другую половину. Однако теперь известно, что DNMT1 физически взаимодействует с белком UHRF1 . Недавно было признано, что UHRF1 необходим для поддержания метилирования ДНК, опосредованного DNMT1. UHRF1 — это белок, который специфически распознает гемиметилированную ДНК, таким образом перенося DNMT1 на свой субстрат для поддержания метилирования ДНК. [33]
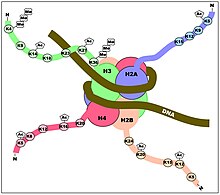

Хотя модификации гистонов происходят на протяжении всей последовательности, особенно сильно модифицируются неструктурированные N-концы гистонов (так называемые хвосты гистонов). Эти модификации включают ацетилирование , метилирование , убиквитилирование , фосфорилирование , сумойлирование , рибозилирование и цитруллинирование. Ацетилирование является наиболее изученной из этих модификаций. Например, ацетилирование лизинов K14 и K9 хвоста гистона H3 ферментами гистон-ацетилтрансферазы (HAT) обычно связано с транскрипционной компетентностью. [35] (см. рисунок).
Один из способов мышления заключается в том, что эта тенденция ацетилирования, связанная с «активной» транскрипцией, имеет биофизическую природу. Поскольку на конце лизина обычно имеется положительно заряженный азот, он может связывать отрицательно заряженные фосфаты основной цепи ДНК. В результате ацетилирования положительно заряженная аминогруппа боковой цепи превращается в нейтральную амидную связь. Это удаляет положительный заряд, тем самым отделяя ДНК от гистона. Когда это происходит, такие комплексы, как SWI/SNF и другие транскрипционные факторы, могут связываться с ДНК и обеспечивать возможность транскрипции. Это «цис» модель эпигенетической функции. Другими словами, изменения в хвостах гистонов оказывают прямое влияние на саму ДНК. [36]
Другая модель эпигенетической функции — «транс»-модель. В этой модели изменения в хвостах гистонов косвенно влияют на ДНК. Например, ацетилирование лизина может создать сайт связывания для ферментов, модифицирующих хроматин (или также механизмов транскрипции). Этот ремоделировщик хроматина может затем вызывать изменения в состоянии хроматина. Действительно, бромодомен – белковый домен, который специфически связывает ацетиллизин – обнаружен во многих ферментах, которые помогают активировать транскрипцию, включая комплекс SWI/SNF . Возможно, ацетилирование действует таким и предыдущим способом, способствуя активации транскрипции.
подтверждается метилированием гистонов Идея о том, что модификации действуют как стыковочные модули для родственных факторов, также . Метилирование лизина 9 гистона H3 уже давно связано с конститутивно транскрипционно молчащим хроматином (конститутивным гетерохроматином ) (см. нижний рисунок). Было установлено, что хромодомен (домен, который специфически связывает метиллизин) в транскрипционно-репрессивном белке HP1 рекрутирует HP1 в метилированные области K9. Одним из примеров, который, по-видимому, опровергает эту биофизическую модель метилирования, является то, что триметилирование гистона H3 по лизину 4 тесно связано с (и необходимо для полной) активацией транскрипции (см. верхний рисунок). В этом случае триметилирование приведет к появлению фиксированного положительного заряда на хвосте.
Было показано, что за активность метилирования гистонов H3 и H4 отвечает гистон-лизин-метилтрансфераза (KMT). Этот фермент использует каталитически активный сайт, называемый доменом SET (супрессор пестролистности, усилитель Zeste, Trithorax). Домен SET представляет собой последовательность из 130 аминокислот, участвующую в модуляции активности генов. Было продемонстрировано, что этот домен связывается с хвостом гистона и вызывает метилирование гистона. [37]
Различные модификации гистонов, вероятно, будут функционировать по-разному; ацетилирование в одном положении, вероятно, будет функционировать иначе, чем ацетилирование в другом положении. Кроме того, одновременно могут возникать множественные модификации, и эти модификации могут работать вместе, изменяя поведение нуклеосомы . Идея о том, что множественные динамические модификации регулируют транскрипцию генов систематическим и воспроизводимым образом, называется кодом гистонов , хотя идея о том, что состояние гистонов можно читать линейно как цифровой носитель информации, в значительной степени развенчана. Одной из наиболее изученных систем, которые управляют молчанием на основе хроматина, является белка SIR подавление дрожжевых скрытых локусов типа спаривания HML и HMR на основе .
Метилирование ДНК
[ редактировать ]Метилирование ДНК часто происходит в повторяющихся последовательностях и помогает подавить экспрессию и подвижность « мобильных элементов »: [38] Поскольку 5-метилцитозин может спонтанно дезаминироваться (замещая азот кислородом) до тимидина , сайты CpG часто мутируют и становятся редкими в геноме, за исключением CpG-островков , где они остаются неметилированными. Таким образом, эпигенетические изменения этого типа могут управлять увеличением частоты постоянных генетических мутаций. Известно, что закономерности метилирования ДНК устанавливаются и модифицируются в ответ на факторы окружающей среды посредством сложного взаимодействия по крайней мере трех независимых ДНК-метилтрансфераз : DNMT1, DNMT3A и DNMT3B, потеря любой из которых приводит к летальному исходу у мышей. [39] DNMT1 является наиболее распространенной метилтрансферазой в соматических клетках. [40] локализуется в очагах репликации, [41] имеет 10–40-кратное предпочтение гемиметилированной ДНК и взаимодействует с ядерным антигеном пролиферирующих клеток (PCNA). [42]
Предпочтительно модифицируя полуметилированную ДНК, DNMT1 переносит паттерны метилирования на вновь синтезированную цепь после репликации ДНК , и поэтому ее часто называют «поддерживающей» метилтрансферазой. [43] DNMT1 необходим для правильного развития эмбриона, импринтинга и Х-инактивации. [39] [44] Чтобы подчеркнуть отличие этого молекулярного механизма наследования от канонического механизма передачи генетической информации спариванием оснований Уотсона-Крика, был введен термин «эпигенетический шаблон». [45] Более того, в дополнение к поддержанию и передаче метилированных состояний ДНК, тот же принцип может работать при поддержании и передаче модификаций гистонов и даже цитоплазматических ( структурных ) наследственных состояний. [46]
Метилирование РНК
[ редактировать ]Метилирование РНК N6-метиладенозина (m6A) как наиболее распространенная модификация эукариотической РНК недавно было признано важным механизмом регуляции генов. [47]
Модификации гистонов
[ редактировать ]Гистонами H3 и H4 также можно манипулировать посредством деметилирования с использованием лизиндеметилазы гистонов (KDM). Этот недавно идентифицированный фермент имеет каталитически активный сайт, называемый доменом Джумонджи (JmjC). Деметилирование происходит, когда JmjC использует несколько кофакторов для гидроксилирования метильной группы, тем самым удаляя ее. JmjC способен деметилировать моно-, ди- и триметилированные субстраты. [48]
Хромосомные области могут принимать стабильные и наследуемые альтернативные состояния, что приводит к бистабильной экспрессии генов без изменений последовательности ДНК. Эпигенетический контроль часто связан с альтернативными ковалентными модификациями гистонов. [49] Предполагается, что стабильность и наследственность состояний более крупных хромосомных областей связаны с положительной обратной связью, когда модифицированные нуклеосомы рекрутируют ферменты, которые аналогичным образом модифицируют близлежащие нуклеосомы. [50] Упрощенную стохастическую модель для этого типа эпигенетики можно найти здесь. [51] [52]
Было высказано предположение, что регуляция транскрипции на основе хроматина может быть опосредована действием малых РНК. Малые интерферирующие РНК могут модулировать экспрессию транскрипционных генов посредством эпигенетической модуляции целевых промоторов . [53]
Транскрипты РНК
[ редактировать ]Иногда ген после включения транскрибирует продукт, который (прямо или косвенно) поддерживает активность этого гена. Например, Hnf4 и MyoD усиливают транскрипцию многих генов, специфичных для печени и мышц, соответственно, включая их собственные, за счет фактора транскрипции активности белков, которые они кодируют. Передача сигналов РНК включает дифференциальное привлечение иерархии родовых комплексов, модифицирующих хроматин, и ДНК-метилтрансфераз к специфическим локусам с помощью РНК во время дифференцировки и развития. [54] Другие эпигенетические изменения опосредуются производством различных форм сплайсинга РНК ) или образованием двухцепочечной РНК ( РНКи . Потомки клетки, в которой был включен ген, унаследуют эту активность, даже если исходный стимул для активации гена больше не присутствует. Эти гены часто включаются или выключаются посредством сигнальной трансдукции , хотя в некоторых системах, где синцитии или щелевые соединения важны , РНК может распространяться непосредственно в другие клетки или ядра путем диффузии . Большое количество РНК и белка вносится в зиготу матерью во время оогенеза или через кормовые клетки , что приводит к материнского эффекта фенотипам . Меньшее количество РНК сперматозоидов передается от отца, но недавно появились данные о том, что эта эпигенетическая информация может привести к видимым изменениям в нескольких поколениях потомства. [55]
микроРНК
[ редактировать ]МикроРНК (миРНК) являются членами некодирующих РНК , размер которых варьируется от 17 до 25 нуклеотидов. микроРНК регулируют широкий спектр биологических функций у растений и животных. [56] К 2013 году у людей было обнаружено около 2000 микроРНК, и их можно найти в Интернете в базе данных микроРНК. [57] Каждая микроРНК, экспрессируемая в клетке, может нацеливаться примерно на 100–200 информационных РНК (мРНК), активность которых она подавляет. [58] Подавление регуляции мРНК в большинстве случаев происходит за счет разрушения целевой мРНК, тогда как некоторое снижение регуляции происходит на уровне трансляции в белок. [59]
Похоже, что около 60% генов, кодирующих человеческие белки, регулируются микроРНК. [60] Многие микроРНК эпигенетически регулируются. Около 50% генов микроРНК связаны с CpG-островками . [56] который может быть подавлен эпигенетическим метилированием. Транскрипция с метилированных CpG-островков сильно и наследственно подавляется. [61] Другие микроРНК эпигенетически регулируются либо модификациями гистонов, либо комбинированным метилированием ДНК и модификацией гистонов. [56]
мРНК
[ редактировать ]В 2011 году было продемонстрировано, что играет решающую метилирование мРНК роль в энергетическом гомеостазе человека . , связанный с ожирением, Показано, что ген FTO способен деметилировать N6-метиладенозин в РНК. [62] [63]
мРНК
[ редактировать ]мРНК – это небольшие (50–250 нуклеотидов) высокоструктурированные некодирующие фрагменты РНК, обнаруженные у бактерий. Они контролируют экспрессию генов, в том числе генов вирулентности патогенов, и рассматриваются как новые мишени в борьбе с устойчивыми к лекарствам бактериями. [64] Они играют важную роль во многих биологических процессах, связываясь с мРНК и белками-мишенями у прокариот. Их филогенетический анализ, например, посредством взаимодействия мРНК-мишени или свойств связывания белков , используется для создания комплексных баз данных. [65] мРНК на основе их мишеней в микробных геномах. карты генов Также строятся [66]
Длинные некодирующие РНК
[ редактировать ]Многочисленные исследования продемонстрировали ключевое участие длинных некодирующих РНК (днРНК) в регуляции экспрессии генов и хромосомных модификаций, тем самым обеспечивая значительный контроль над клеточной дифференцировкой. Эти длинные некодирующие РНК также способствуют геномному импринтингу и инактивации Х-хромосомы. [67] У беспозвоночных, таких как социальные насекомые медоносных пчел, длинные некодирующие РНК выявляются как возможный эпигенетический механизм через аллель-специфические гены, лежащие в основе агрессии посредством реципрокных скрещиваний. [68]
Прионы
[ редактировать ]Прионы – это инфекционные формы белков . В целом белки складываются в отдельные единицы, выполняющие различные клеточные функции, но некоторые белки также способны образовывать инфекционное конформационное состояние, известное как прион. Хотя прионы часто рассматриваются в контексте инфекционных заболеваний , их более широко определяют по их способности каталитически конвертировать другие версии того же белка в нативном состоянии в инфекционное конформационное состояние. Именно в этом последнем смысле их можно рассматривать как эпигенетические агенты, способные вызывать фенотипические изменения без модификации генома. [69]
Некоторые считают, что грибковые прионы являются эпигенетическими, поскольку инфекционный фенотип, вызываемый прионом, может передаваться по наследству без модификации генома. PSI+ и URE3, обнаруженные у дрожжей в 1965 и 1971 годах, являются двумя наиболее изученными прионами этого типа. [70] [71] Прионы могут оказывать фенотипический эффект за счет секвестрации белка в агрегатах, тем самым снижая активность этого белка. В клетках PSI+ потеря белка Sup35 (который участвует в терминации трансляции) приводит к тому, что рибосомы имеют более высокую скорость считывания стоп- кодонов , что приводит к подавлению нонсенс-мутаций в других генах. [72] Способность Sup35 образовывать прионы может быть консервативным признаком. Это может дать адаптивное преимущество, давая клеткам возможность переключаться в состояние PSI+ и выражать спящие генетические особенности, которые обычно прекращаются мутациями стоп-кодонов. [73] [74] [75] [76]
Эпигенетика на основе прионов также наблюдалась у Saccharomyces cerevisiae . [77]
Молекулярная основа
[ редактировать ]Эпигенетические изменения модифицируют активацию определенных генов, но не последовательность генетического кода ДНК. [78] Микроструктура (не код) самой ДНК или связанных с ней белков хроматина может быть изменена, вызывая активацию или молчание. Этот механизм позволяет дифференцированным клеткам многоклеточного организма экспрессировать только те гены, которые необходимы для их собственной активности. Эпигенетические изменения сохраняются при делении клеток. Большинство эпигенетических изменений происходят только в течение жизни одного отдельного организма; однако эти эпигенетические изменения могут передаваться потомству организма посредством процесса, называемого трансгенерационным эпигенетическим наследованием . Более того, если в сперматозоиде или яйцеклетке происходит инактивация гена, что приводит к оплодотворению, эта эпигенетическая модификация также может передаваться следующему поколению. [79]
Специфические эпигенетические процессы включают парамутацию , закладку , импринтинг , молчание генов , инактивацию Х-хромосомы , эффект положения , перепрограммирование метилирования ДНК , трансвекцию , материнские эффекты , прогресс канцерогенеза , многие эффекты тератогенов , регуляцию модификаций гистонов и гетерохроматина , а также технические ограничения, влияющие на партеногенез и клонирование . [80] [81] [82]
повреждение ДНК
[ редактировать ]Повреждение ДНК также может вызывать эпигенетические изменения. [83] [84] [85] Повреждения ДНК происходят очень часто и происходят в среднем около 60 000 раз в день на клетку человеческого тела (см. Повреждение ДНК (естественное происхождение) ). Эти повреждения в значительной степени устраняются, однако эпигенетические изменения все еще могут сохраняться в месте репарации ДНК. [86] В частности, двухцепочечный разрыв ДНК может инициировать незапрограммированное эпигенетическое молчание генов, вызывая как метилирование ДНК, так и способствуя подавлению типов модификаций гистонов (ремоделирование хроматина - см. следующий раздел). [87] Кроме того, фермент Parp1 (поли(ADP)-рибозополимераза) и его продукт поли(ADP)-рибоза (PAR) накапливаются в местах повреждения ДНК в рамках процесса восстановления. [88] Это накопление, в свою очередь, направляет рекрутирование и активацию белка ремоделирования хроматина, ALC1, который может вызывать ремоделирование нуклеосом . [89] Было обнаружено, что ремоделирование нуклеосом вызывает, например, эпигенетическое молчание гена репарации ДНК MLH1. [22] [90] Химические вещества, повреждающие ДНК, такие как бензол , гидрохинон , стирол , четыреххлористый углерод и трихлорэтилен , вызывают значительное гипометилирование ДНК, в некоторых случаях за счет активации путей окислительного стресса. [91]
Известно, что продукты питания изменяют эпигенетику крыс, находящихся на различных диетах. [92] Некоторые пищевые компоненты эпигенетически повышают уровни ферментов репарации ДНК, таких как MGMT и MLH1. [93] и р53 . [94] [95] Другие пищевые компоненты, например изофлавоны сои, могут уменьшить повреждение ДНК . В одном исследовании маркеры окислительного стресса, такие как модифицированные нуклеотиды, которые могут возникнуть в результате повреждения ДНК, были снижены за счет трехнедельной диеты с добавлением сои. [96] Уменьшение окислительного повреждения ДНК также наблюдалось через 2 часа после употребления антоцианами богатого черники, ( Vaccinium myrtillius L.) экстракта выжимок . [97]
восстановление ДНК
[ редактировать ]Повреждения ДНК очень распространены и постоянно восстанавливаются. Эпигенетические изменения могут сопровождать восстановление ДНК в результате окислительного повреждения или двухцепочечных разрывов. В клетках человека окислительное повреждение ДНК происходит примерно 10 000 раз в день, а двухцепочечные разрывы ДНК происходят примерно от 10 до 50 раз за клеточный цикл в соматических реплицирующихся клетках (см. Повреждение ДНК (естественное происхождение) ). Избирательное преимущество репарации ДНК заключается в том, что она позволяет клетке выжить даже после повреждения ДНК. Избирательное преимущество эпигенетических изменений, возникающих при репарации ДНК, неясно. [ нужна ссылка ]
Восстановление окислительных повреждений ДНК может изменить эпигенетические маркеры
[ редактировать ]В устойчивом состоянии (при возникновении и восстановлении эндогенных повреждений) имеется около 2400 окислительно поврежденных гуанинов, которые образуют 8-оксо-2'-дезоксигуанозин (8-OHdG). в средней ДНК клеток млекопитающих [98] 8-OHdG составляет около 5% окислительных повреждений, обычно присутствующих в ДНК. [99] Окисленные гуанины не встречаются случайно среди всех гуанинов в ДНК. Существует предпочтение последовательности гуанина в метилированном сайте CpG (цитозин, за которым следует гуанин в направлении 5' → 3' и где цитозин метилирован (5-mCpG)). [100] Сайт 5-mCpG имеет самый низкий потенциал ионизации для окисления гуанина. [ нужна ссылка ]

Окисленный гуанин обладает потенциалом неправильного спаривания и является мутагенным. [102] Оксогуанингликозилаза (OGG1) является основным ферментом, ответственным за удаление окисленного гуанина во время репарации ДНК. OGG1 находит 8-OHdG и связывается с ним в течение нескольких секунд. [103] Однако OGG1 не удаляет 8-OHdG немедленно. В клетках HeLa половина максимального удаления 8-OHdG происходит за 30 минут. [104] а у облученных мышей 8-OHdG, индуцированные в печени мышей, удаляются с периодом полураспада 11 минут. [99]
Когда OGG1 присутствует в окисленном гуанине в метилированном сайте CpG, он привлекает TET1 к повреждению 8-OHdG (см. Рисунок). Это позволяет TET1 деметилировать соседний метилированный цитозин. Деметилирование цитозина является эпигенетическим изменением. [ нужна ссылка ]
Например, когда эпителиальные клетки молочной железы человека обрабатывались H 2 O 2 в течение шести часов, содержание 8-OHdG в ДНК увеличивалось примерно в 3,5 раза, что вызывало примерно 80% деметилирование 5-метилцитозинов в геноме. [101] Деметилирование CpG в промоторе гена под действием фермента TET увеличивает транскрипцию гена в информационную РНК. [105] В клетках, обработанных H 2 O 2 , исследовали один конкретный ген, BACE1 . [101] Уровень метилирования BACE1 CpG-островка был снижен (эпигенетическое изменение), что позволило примерно в 6,5 раз увеличить экспрессию информационной РНК BACE1 . [ нужна ссылка ]
В то время как шестичасовая инкубация с H 2 O 2 вызывает значительное деметилирование сайтов 5-mCpG, более короткое время инкубации с H 2 O 2 , по-видимому, способствует другим эпигенетическим изменениям. Обработка клеток H 2 O 2 в течение 30 минут приводит к тому, что гетеродимер белка репарации несоответствия MSH2-MSH6 рекрутирует ДНК-метилтрансферазу 1 ( DNMT1 ) в места некоторых видов окислительного повреждения ДНК. [106] Это может вызвать повышенное метилирование цитозинов (эпигенетические изменения) в этих местах.
Цзян и др. [107] обрабатывали клетки HEK 293 агентами, вызывающими окислительное повреждение ДНК ( броматом калия (KBrO3) или хроматом калия (K2CrO4)). Базовая эксцизионная репарация (BER) окислительного повреждения происходила с помощью фермента репарации ДНК- полимеразы бета, локализующегося на окисленных гуанинах. Полимераза бета является основной полимеразой человека при коротком BER окислительного повреждения ДНК. Цзян и др. [107] также обнаружили, что полимераза бета рекрутирует белок ДНК-метилтрансферазы DNMT3b в сайты репарации BER. Затем они оценили характер метилирования на уровне одного нуклеотида в небольшой области ДНК, включая область промотора и область ранней транскрипции гена BRCA1 . Окислительное повреждение ДНК броматом модулировало характер метилирования ДНК (вызывая эпигенетические изменения) в сайтах CpG в исследуемой области ДНК. В необработанных клетках CpG, расположенные в местах -189, -134, -29, -19, +16 и +19 гена BRCA1, содержали метилированные цитозины (где нумерация ведется от места начала транскрипции информационной РНК , а отрицательные числа указывают на нуклеотиды в вышестоящая промоторная область). Окисление, вызванное обработкой броматом, привело к потере метилирования цитозина в точках -189, -134, +16 и +19, а также привело к образованию нового метилирования в CpG, расположенных в точках -80, -55, -21 и +8 после Репарация ДНК была разрешена.
Гомологичная рекомбинационная репарация изменяет эпигенетические маркеры
[ редактировать ]По крайней мере в четырех статьях сообщается о привлечении ДНК-метилтрансферазы 1 (DNMT1) к участкам двухцепочечных разрывов ДНК. [108] [109] [110] [111] Во время гомологичной рекомбинационной репарации (HR) двухцепочечного разрыва участие DNMT1 приводит к тому, что две восстановленные цепи ДНК имеют разные уровни метилированных цитозинов. Одна цепь часто метилируется примерно в 21 сайте CpG ниже восстановленного двухцепочечного разрыва. Другая цепь ДНК теряет метилирование примерно в шести сайтах CpG, которые ранее были метилированы после двухцепочечного разрыва, а также теряет метилирование примерно в пяти сайтах CpG, которые ранее были метилированы перед двухцепочечным разрывом. Когда хромосома реплицируется, это приводит к появлению одной дочерней хромосомы, которая сильно метилирована ниже предыдущего сайта разрыва, и одной, которая неметилирована в области как выше, так и ниже предыдущего сайта разрыва. Что касается гена, который был сломан в результате двухцепочечного разрыва, половина клеток-потомков экспрессирует этот ген на высоком уровне, а в другой половине клеток-потомков экспрессия этого гена подавляется. Когда клоны этих клеток хранились в течение трех лет, новые закономерности метилирования сохранялись в течение этого периода времени. [112]
У мышей с CRISPR-опосредованной вставкой рекомбинации, направленной на гомологию, в их геноме наблюдалось большое количество повышенного метилирования сайтов CpG внутри вставки, связанной с двухцепочечным разрывом. [113]
Негомологичное соединение концов может вызывать некоторые изменения эпигенетических маркеров.
[ редактировать ]негомологичным соединением концов (NHEJ) может вызвать небольшое количество деметилирований ранее существовавших метилирований цитозиновой ДНК ниже восстановленного двухцепочечного разрыва. Восстановление двухцепочечного разрыва [109] Дальнейшая работа Аллена и др. [114] показали, что NHEJ двухцепочечного разрыва ДНК в клетке может давать начало некоторым клеткам-потомкам, имеющим репрессированную экспрессию гена, несущего первоначальный двухцепочечный разрыв, и некоторому потомству, имеющему высокую экспрессию этого гена из-за эпигенетических изменений, связанных с репарацией NHEJ. . Частота эпигенетических изменений, вызывающих репрессию гена после репарации NHEJ двухцепочечного разрыва ДНК в этом гене, может составлять около 0,9%. [110]
Методы, используемые для изучения эпигенетики
[ редактировать ]Эпигенетические исследования используют широкий спектр молекулярно-биологических методов для дальнейшего понимания эпигенетических явлений. Эти методы включают иммунопреципитацию хроматина (вместе с его крупномасштабными вариантами ChIP-on-chip и ChIP-Seq ), флуоресцентную гибридизацию in situ , чувствительные к метилированию ферменты рестрикции , идентификацию ДНК-аденин-метилтрансферазы ( DamID ) и бисульфитное секвенирование . [115] Кроме того, использование методов биоинформатики играет роль в вычислительной эпигенетике . [115]
Иммунопреципитация хроматина
[ редактировать ]Иммунопреципитация хроматина (ChIP) помогла преодолеть разрыв между ДНК и эпигенетическими взаимодействиями. [116] С помощью ChIP исследователи могут делать выводы относительно регуляции генов, механизмов транскрипции и структуры хроматина. [116]
Флуоресцентная in situ гибридизация
[ редактировать ]Флуоресцентная гибридизация in situ (FISH) очень важна для понимания эпигенетических механизмов. [117] FISH можно использовать для определения местоположения генов на хромосомах, а также для поиска некодирующих РНК. [117] [118] FISH преимущественно используется для выявления хромосомных аномалий у людей. [118]
Чувствительные к метилированию ферменты рестрикции
[ редактировать ]Чувствительные к метилированию рестриктазы в сочетании с ПЦР — это способ оценить метилирование в ДНК, особенно в сайтах CpG. [119] Если ДНК метилирована, ферменты рестрикции не будут расщеплять цепь. [119] И наоборот, если ДНК не метилирована, ферменты расщепят цепь, и она будет амплифицирована с помощью ПЦР. [119]
Бисульфитное секвенирование
[ редактировать ]Бисульфитное секвенирование — еще один способ оценить метилирование ДНК. Цитозин будет заменен на урацил при обработке бисульфитом натрия, тогда как метилированные цитозины не будут затронуты. [119] [120] [121]
Нанопоровое секвенирование
[ редактировать ]Некоторые методы секвенирования, такие как секвенирование нанопор , позволяют секвенировать нативную ДНК. Нативная (= неамплифицированная) ДНК сохраняет эпигенетические модификации, которые в противном случае были бы потеряны на этапе амплификации. Модели вызывающих основания нанопор могут различать сигналы, полученные для эпигенетически модифицированных оснований и неизмененных оснований, и предоставлять эпигенетический профиль в дополнение к результату секвенирования. [122]
Структурное наследование
[ редактировать ]У инфузорий, таких как Tetrahymena и Paramecium , генетически идентичные клетки обнаруживают наследственные различия в характере ресничных рядов на поверхности клеток. Экспериментально измененные паттерны могут передаваться дочерним клеткам. Похоже, существующие структуры служат шаблонами для новых структур. Механизмы такого наследования неясны, но существуют основания предполагать, что многоклеточные организмы также используют существующие клеточные структуры для сборки новых. [123] [124] [125]
Позиционирование нуклеосом
[ редактировать ]Геномы эукариот содержат множество нуклеосом . Положение нуклеосом не является случайным и определяет доступность ДНК для регуляторных белков. Показано, что промоторы, активные в разных тканях, имеют разные особенности позиционирования нуклеосом. [126] Это определяет различия в экспрессии генов и дифференцировке клеток. Было показано, что по крайней мере некоторые нуклеосомы сохраняются в сперматозоидах (где большинство, но не все гистоны заменены протаминами ). Таким образом, положение нуклеосом в некоторой степени наследуется. Недавние исследования выявили связь между расположением нуклеосом и другими эпигенетическими факторами, такими как метилирование ДНК и гидроксиметилирование. [127]
Варианты гистонов
[ редактировать ]Различные варианты гистонов неслучайно включаются в определенные участки генома. Их дифференциальные биохимические характеристики могут влиять на функции генома посредством их роли в регуляции генов. [128] и поддержание хромосомных структур. [129]
Геномная архитектура
[ редактировать ]Трехмерная конфигурация генома (3D-геном) сложна, динамична и имеет решающее значение для регуляции геномной функции и ядерных процессов, таких как репликация ДНК, транскрипция и восстановление повреждений ДНК. [130]
Функции и последствия
[ редактировать ]В мозгу
[ редактировать ]Память
[ редактировать ]Формирование и поддержание памяти обусловлено эпигенетическими изменениями, которые вызывают необходимые динамические изменения в транскрипции генов , создающих и обновляющих память в нейронах. [31]
Событие может запустить цепочку реакций, которые приводят к изменению метилирования большого набора генов в нейронах, которые дают представление о событии — память. [31]
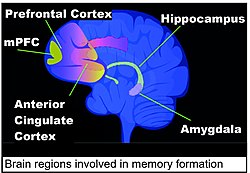
Области мозга, важные для формирования воспоминаний, включают гиппокамп, медиальную префронтальную кору (мПФК), переднюю поясную извилину и миндалевидное тело, как показано на схеме человеческого мозга в этом разделе. [131]
Когда создается сильная память, как у крысы, подвергнутой контекстуальному обусловливанию страха (CFC), одним из самых ранних событий является то, что более 100 двухцепочечных разрывов ДНК образуются топоизомеразой IIB в нейронах гиппокампа и медиальной области. префронтальная кора (мПФК). [132] Эти двухцепочечные разрывы находятся в определенных местах, которые позволяют активировать транскрипцию немедленных ранних генов (IEG), которые важны для формирования памяти, обеспечивая их экспрессию в мРНК , с пиком транскрипции мРНК через семь-десять минут после CFC. [132] [133]
Двумя важными IEG в формировании памяти являются EGR1. [134] и альтернативный вариант промотора DNMT3A , DNMT3A2 . [135] Белок EGR1 связывается с ДНК по своим связывающим мотивам, 5'-GCGTGGGCG-3' или 5'-GCGGGGGCGG-3', и существует около 12 000 мест генома, с которыми может связываться белок EGR1. [136] Белок EGR1 связывается с ДНК в областях промотора и энхансера гена . EGR1 вовлекает в ассоциацию деметилирующий фермент TET1 и переносит TET1 примерно в 600 мест генома, где TET1 может затем деметилировать и активировать связанные гены. [136]

ДНК-метилтрансферазы DNMT3A1, DNMT3A2 и DNMT3B могут метилировать цитозины (см. изображение в этом разделе) в сайтах CpG внутри промоторов генов или рядом с ними. Как показали Манзо и др., [137] эти три ДНК-метилтрансферазы различаются по местам связывания с геномом и активности метилирования ДНК в разных регуляторных сайтах. Манзо и др. обнаружили 3970 областей генома, обогащенных исключительно DNMT3A1, 3838 областей DNMT3A2 и 3432 областей DNMT3B. Когда DNMT3A2 вновь индуцируется как IEG (когда нейроны активированы), происходит множество новых метилирований цитозина, предположительно в целевых областях DNMT3A2. Оливьера и др. [135] обнаружили, что индуцируемые активностью нейронов уровни Dnmt3a2 в гиппокампе определяют способность формировать долговременные воспоминания.
У крыс формируются долговременные ассоциативные воспоминания после контекстного обуславливания страха (CFC) . [138] Дьюк и др. [30] обнаружили, что через 24 часа после CFC у крыс в нейронах гиппокампа 2097 генов (9,17% генов в геноме крысы) изменили метилирование. Когда вновь метилированные цитозины присутствуют в сайтах CpG в промоторных областях генов, гены часто репрессируются, а когда присутствуют вновь деметилированные цитозины, гены могут активироваться. [139] После CFC было 1048 генов со сниженной экспрессией мРНК и 564 гена с повышенной экспрессией мРНК. Аналогичным образом, когда мыши подвергаются CFC, через час в области гиппокампа мышиного мозга появляется 675 деметилированных генов и 613 гиперметилированных генов. [140] Однако воспоминания не остаются в гиппокампе, а через четыре-пять недель воспоминания сохраняются в передней поясной извилине. [141] В исследованиях на мышах после CFC Halder et al. [140] показали, что через четыре недели после CFC в передней поясной извилине было по меньшей мере 1000 дифференциально метилированных генов и более 1000 дифференциально экспрессируемых генов, в то же время измененное метилирование в гиппокампе было обращено вспять.
Эпигенетическое изменение метилирования после установления новой памяти создает другой пул ядерных мРНК. По мнению Бернштейна, [31] Эпигенетически детерминированная новая смесь ядерных мРНК часто упаковывается в нейрональные гранулы или матричные РНП , состоящие из мРНК, малых и больших рибосомальных субъединиц , факторов инициации трансляции и РНК-связывающих белков, которые регулируют функцию мРНК. Эти нейрональные гранулы транспортируются из ядра нейрона и направляются, согласно 3'-нетранслируемым участкам мРНК в гранулах (их «почтовым индексам»), к дендритам нейронов . Примерно 2500 мРНК могут быть локализованы в дендритах пирамидных нейронов гиппокампа и, возможно, 450 транскриптов находятся в возбуждающих пресинаптических нервных окончаниях (дендритных шипиках). Измененные наборы транскриптов (зависящие от эпигенетических изменений в ядре нейрона) обладают разной чувствительностью в ответ на сигналы, что лежит в основе измененной синаптической пластичности. Измененную синаптическую пластичность часто считают нейрохимической основой обучения и памяти.
Старение
[ редактировать ]Эпигенетика играет важную роль в старении мозга и возрастном снижении когнитивных функций, что имеет отношение к продлению жизни . [142] [143] [144] [145] [146]
Другое и общее
[ редактировать ]Во взрослом возрасте изменения эпигенома важны для различных высших когнитивных функций. Нарушение регуляции эпигенетических механизмов связано с нейродегенеративными расстройствами и заболеваниями. Эпигенетические модификации нейронов динамичны и обратимы. [147] Эпигенетическая регуляция влияет на деятельность нейронов, влияя на обучение, память и другие когнитивные процессы. [148]
Ранние события, в том числе во время эмбрионального развития , могут влиять на развитие, познание и состояние здоровья посредством эпигенетических механизмов . [149]
Эпигенетические механизмы были предложены как «потенциальный молекулярный механизм воздействия эндогенных гормонов на организацию развивающихся цепей мозга». [150]
Питательные вещества могут взаимодействовать с эпигеномом, чтобы «защищать или стимулировать когнитивные процессы на протяжении всей жизни». [151] [152]
Обзор предполагает, что нейробиологические эффекты физических упражнений через эпигенетику кажутся «центральными для создания «эпигенетической памяти», влияющей на долгосрочную функцию и поведение мозга» и могут даже передаваться по наследству. [153]
С помощью аксо-цилиарного синапса осуществляется связь между серотонинергическими аксонами и антенноподобными первичными ресничками пирамидных CA1 , нейронов состояние нейрона которая изменяет эпигенетическое в ядре посредством передачи сигналов, отличной от передачи сигналов на плазматической мембране (и на более длительный срок). [154] [155]
Эпигенетика также играет важную роль в эволюции мозга человека . [156]
Разработка
[ редактировать ]Эпигенетику развития можно разделить на предопределенный и вероятностный эпигенез. Предопределенный эпигенез — это однонаправленное движение от структурного развития ДНК к функциональному созреванию белка. «Заранее определенное» здесь означает, что развитие запланировано и предсказуемо. Вероятностный эпигенез, с другой стороны, представляет собой двунаправленное структурно-функциональное развитие с опытом и внешним формирующим развитием. [157]
Соматическое эпигенетическое наследование, особенно посредством ковалентных модификаций ДНК и гистонов и репозиционирования нуклеосом , очень важно в развитии многоклеточных эукариотических организмов. [127] Последовательность генома статична (за некоторыми заметными исключениями), но клетки дифференцируются на множество разных типов, которые выполняют разные функции и по-разному реагируют на окружающую среду и межклеточную передачу сигналов. Таким образом, по мере развития индивидуумов морфогены активируют или заглушают гены эпигенетически наследуемым образом, давая клеткам память. У млекопитающих большинство клеток дифференцируются окончательно, и только стволовые клетки сохраняют способность дифференцироваться в несколько типов клеток («тотипотентность» и «мультипотентность»). У млекопитающих некоторые стволовые клетки продолжают производить вновь дифференцированные клетки на протяжении всей жизни, например, при нейрогенезе , но млекопитающие не способны реагировать на потерю некоторых тканей, например, на неспособность регенерировать конечности, на что способны некоторые другие животные. Эпигенетические модификации регулируют переход от нейральных стволовых клеток к глиальным клеткам-предшественникам (например, дифференцировка в олигодендроциты регулируется деацетилированием и метилированием гистонов). [158] В отличие от животных, растительные клетки не дифференцируются окончательно, оставаясь тотипотентными и способными давать начало новому отдельному растению. Хотя растения действительно используют многие из тех же эпигенетических механизмов, что и животные, такие как ремоделирование хроматина , было высказано предположение, что некоторые виды растительных клеток не используют или не требуют «клеточной памяти», переустанавливая свои паттерны экспрессии генов, используя позиционную информацию из окружающей среды и окружающие клетки, чтобы определить их судьбу. [159]
Эпигенетические изменения могут возникать в ответ на воздействие окружающей среды – например, прием материнских пищевых добавок с генистеином (250 мг/кг) вызывает эпигенетические изменения, влияющие на экспрессию гена агути , который влияет на цвет их шерсти, вес и склонность к развитию рака. [160] [161] [162] Текущие исследования сосредоточены на изучении влияния других известных тератогенов , таких как диабетическая эмбриопатия , на метилирования . признаки [163]
Спорные результаты одного исследования показали, что травматический опыт может вызвать эпигенетический сигнал, который может быть передан будущим поколениям. Мышей обучали с помощью электрошока ногами бояться запаха цветущей вишни. Исследователи сообщили, что потомство мышей испытывало повышенное отвращение к этому специфическому запаху. [164] [165] Они предположили, что эпигенетические изменения увеличивают экспрессию генов, а не самой ДНК, в гене M71, который управляет функционированием рецептора запаха в носу, который специфически реагирует на запах цветущей вишни. В мозгу обученных мышей и их потомков произошли физические изменения, которые коррелировали с обонятельной функцией. Было высказано несколько критических замечаний, в том числе низкая статистическая мощность исследования как свидетельство некоторых нарушений, таких как предвзятость в отчетах о результатах. [166] Из-за ограничений размера выборки существует вероятность того, что эффект не будет продемонстрирован в пределах статистической значимости, даже если он существует. Критика предполагала, что вероятность того, что все описанные эксперименты покажут положительные результаты при соблюдении идентичного протокола, при условии существования заявленных эффектов, составляет всего 0,4%. Авторы также не указали, какие мыши были братьями и сестрами, и считали всех мышей статистически независимыми. [167] Первоначальные исследователи указали в приложении к статье отрицательные результаты, которые критики не включили в свои расчеты, и обязались отслеживать, какие мыши станут братьями и сестрами в будущем. [168]
Трансгенерационный
[ редактировать ]Эпигенетические механизмы были необходимой частью эволюционного происхождения клеточной дифференцировки . [169] [ нужна цитата для проверки ] Хотя обычно считается, что эпигенетика у многоклеточных организмов является механизмом, участвующим в дифференцировке, причем эпигенетические паттерны «сбрасываются» при размножении организмов, были некоторые наблюдения трансгенерационного эпигенетического наследования (например, феномен парамутации, наблюдаемый у кукурузы ). Хотя большинство этих эпигенетических черт, передаваемых через несколько поколений, постепенно утрачиваются в течение нескольких поколений, остается вероятность того, что эпигенетика, передаваемая из нескольких поколений, может быть еще одним аспектом эволюции и адаптации.Как упоминалось выше, некоторые определяют эпигенетику как наследственную.
Секвестрированная зародышевая линия или барьер Вейсмана специфичны для животных, а эпигенетическое наследование чаще встречается у растений и микробов. Ева Яблонка , Мэрион Дж. Лэмб и Этьен Данчин утверждали, что эти эффекты могут потребовать усовершенствования стандартной концептуальной структуры современного синтеза , и призвали к расширенному эволюционному синтезу . [170] [171] [172] Другие биологи-эволюционисты, такие как Джон Мейнард Смит , включили эпигенетическое наследование в популяционной генетики. модели [173] или открыто скептически относятся к расширенному эволюционному синтезу ( Майкл Линч ). [174] Томас Дикинс и Кази Рахман утверждают, что эпигенетические механизмы, такие как метилирование ДНК и модификация гистонов, генетически наследуются под контролем естественного отбора и, следовательно, соответствуют более раннему «современному синтезу» . [175]
Два важных аспекта, которыми эпигенетическое наследование может отличаться от традиционного генетического наследования, что имеет важные последствия для эволюции, заключаются в следующем:
- скорость эпимутации может быть намного быстрее, чем скорость мутации [176]
- эпимутации легче обратимы [177]
У растений наследственные мутации метилирования ДНК встречаются в 100 000 раз чаще, чем мутации ДНК. [178] Эпигенетически унаследованный элемент, такой как система PSI + , может действовать как «заглушка», достаточно хорошая для краткосрочной адаптации, которая позволяет линии выживать достаточно долго, чтобы мутация и / или рекомбинация генетически ассимилировали адаптивные фенотипические изменения. [179] Существование этой возможности увеличивает эволюционность вида.
более чем 100 случаях феномена трансгенерационного эпигенетического наследования у широкого круга организмов, включая прокариотов, растения и животных. Сообщалось о [180] Например, бабочки в траурном плаще меняют цвет из-за гормональных изменений в ответ на эксперименты с различными температурами. [181]
Нитчатый гриб Neurospora crassa представляет собой выдающуюся модельную систему для понимания контроля и функции метилирования цитозина. В этом организме метилирование ДНК связано с остатками системы защиты генома, называемой RIP (повторно-индуцированная точечная мутация), и подавляет экспрессию генов путем ингибирования элонгации транскрипции. [182]
Дрожжевой прион PSI образуется в результате конформационного изменения фактора терминации трансляции, который затем наследуется дочерними клетками. Это может обеспечить преимущество в выживании в неблагоприятных условиях, иллюстрируя эпигенетическую регуляцию, которая позволяет одноклеточным организмам быстро реагировать на стресс окружающей среды. Прионы можно рассматривать как эпигенетические агенты, способные вызывать фенотипические изменения без модификации генома. [183]
Прямое обнаружение эпигенетических меток у микроорганизмов возможно с помощью секвенирования одной молекулы в реальном времени , при котором чувствительность полимеразы позволяет измерять метилирование и другие модификации во время секвенирования молекулы ДНК. [184] Несколько проектов продемонстрировали возможность сбора эпигенетических данных по всему геному бактерий. [185] [186] [187] [188]
Эпигенетика бактерий
[ редактировать ]
Хотя эпигенетика имеет фундаментальное значение у эукариот , особенно у многоклеточных животных , у бактерий она играет иную роль. [189] Самое главное, что эукариоты используют эпигенетические механизмы в первую очередь для регуляции экспрессии генов, что редко делают бактерии. Однако бактерии широко используют пострепликативное метилирование ДНК для эпигенетического контроля взаимодействий ДНК-белок. Бактерии также используют метилирование аденина ДНК (а не метилирование цитозина ДНК ) в качестве эпигенетического сигнала. Метилирование аденина ДНК играет важную роль в вирулентности бактерий в таких организмах, как Escherichia coli , Salmonella , Vibrio , Yersinia , Haemophilus и Brucella . У Alphaproteobacteria метилирование аденина регулирует клеточный цикл и связывает транскрипцию генов с репликацией ДНК. У гаммапротеобактерий метилирование аденина обеспечивает сигналы для репликации ДНК, сегрегации хромосом, восстановления ошибочных спариваний, упаковки бактериофага, активности транспозазы и регуляции экспрессии генов. [183] [190] Существует генетический переключатель, контролирующий Streptococcus pneumoniae (пневмококк), который позволяет бактерии случайным образом изменять свои характеристики в шесть альтернативных состояний, которые могут проложить путь к улучшению вакцин. Каждая форма генерируется случайным образом с помощью фазовой переменной системы метилирования. Способность пневмококка вызывать смертельные инфекции различна в каждом из этих шести состояний. Подобные системы существуют и у других родов бактерий. [191] У Bacillota, такого как Clostridioides difficile , метилирование аденина регулирует споруляцию , образование биопленок и адаптацию к хозяину. [192]
Лекарство
[ редактировать ]Эпигенетика имеет множество разнообразных потенциальных медицинских применений. [193]
Двойняшки
[ редактировать ]Прямое сравнение однояйцевых близнецов представляет собой оптимальную модель для изучения эпигенетики окружающей среды . В случае людей с разным воздействием окружающей среды монозиготные (идентичные) близнецы были эпигенетически неразличимы в первые годы жизни, в то время как близнецы старшего возраста имели заметные различия в общем содержании и геномном распределении ДНК 5-метилцитозина и ацетилировании гистонов. [11] большие различия в истории болезни, показали самые большие различия в уровнях ДНК 5-метилцитозина и ацетилировании гистонов Пары близнецов, которые провели вместе меньшую часть своей жизни и/или имели H3 и H4. [194]
Дизиготные (разнояйцевые) и монозиготные (идентичные) близнецы демонстрируют свидетельства эпигенетического влияния на человека. [194] [195] [196] Различия в последовательностях ДНК, которых было бы много в одноэлементном исследовании, не мешают анализу. Экологические различия могут вызывать долгосрочные эпигенетические эффекты, а различные подтипы монозиготных близнецов по развитию могут различаться в отношении их склонности к дискордантности с эпигенетической точки зрения. [197]
Высокопроизводительное метилировании исследование, подразумевающее технологию, которая рассматривает обширные генетические маркеры, было сосредоточено на эпигенетических различиях между монозиготными близнецами для сравнения глобальных и локус-специфичных изменений в ДНК и модификациях гистонов в выборке из 40 пар монозиготных близнецов. [194] В данном случае изучались только пары здоровых близнецов, но был представлен широкий диапазон возрастов – от 3 до 74 лет. Одним из основных выводов этого исследования было то, что между двумя братьями и сестрами пар близнецов происходит возрастное накопление эпигенетических различий. Такое накопление предполагает существование эпигенетического «дрейфа». Эпигенетический дрейф — это термин, обозначающий эпигенетические модификации, поскольку они происходят как прямая функция с возрастом. Хотя возраст является известным фактором риска многих заболеваний, было обнаружено, что возрастное метилирование происходит по-разному в определенных участках генома. Со временем это может привести к измеримым различиям между биологическим и хронологическим возрастом. Было обнаружено, что эпигенетические изменения отражают образ жизни и могут выступать в качестве функциональных биомаркеров заболевания до того, как будет достигнут клинический порог . [198]
Более недавнее исследование, в котором 114 монозиготных близнецов и 80 дизиготных близнецов были проанализированы на предмет статуса метилирования ДНК около 6000 уникальных геномных областей, пришло к выводу, что эпигенетическое сходство во время расщепления бластоцисты может также способствовать фенотипическому сходству у монозиготных близнецов. Это подтверждает представление о том, что микроокружение на ранних стадиях эмбрионального развития может быть весьма важным для установления эпигенетических меток. [195] Врожденные генетические заболевания хорошо изучены, и очевидно, что эпигенетика может играть роль, например, в случае синдрома Ангельмана и синдрома Прадера-Вилли . Это нормальные генетические заболевания, вызванные делецией или инактивацией генов, но они необычно распространены, поскольку люди по существу являются гемизиготными из-за геномного импринтинга , и поэтому для возникновения заболевания достаточно одного нокаута гена, тогда как в большинстве случаев для возникновения заболевания потребуются обе копии. быть нокаутированным. [199]
Геномный импринтинг
[ редактировать ]Некоторые заболевания человека связаны с геномным импринтингом — феноменом у млекопитающих, когда отец и мать вносят разные эпигенетические паттерны в определенные геномные локусы в своих зародышевых клетках . [200] Самый известный случай импринтинга при заболеваниях человека — это синдром Ангельмана и синдром Прадера-Вилли — оба могут быть вызваны одной и той же генетической мутацией, частичной делецией хромосомы 15q , а конкретный синдром, который разовьется, зависит от того, наследуется ли мутация. от матери ребенка или от его отца. [201]
В исследовании Оверкаликса внуки по отцовской (но не по материнской) [202] шведских мужчин, подвергшихся голоданию в подростковом возрасте в 19 веке, имели меньшую вероятность умереть от сердечно-сосудистых заболеваний. Если еды было много, то смертность от диабета у внуков увеличивалась, что позволяет предположить, что это трансгенерационное эпигенетическое наследование. [203] Противоположный эффект наблюдался у женщин: внучки по отцовской (но не по материнской линии) женщин, переживших голод в утробе матери (и, следовательно, во время формирования яйцеклеток), в среднем жили меньше. [204]
Примеры препаратов, изменяющих экспрессию генов в результате эпигенетических событий
[ редактировать ]Использование бета-лактамных антибиотиков может изменить активность глутаматных рецепторов и действие циклоспорина на несколько факторов транскрипции. Кроме того, литий может влиять на аутофагию аберрантных белков, а опиоидные препараты при хроническом употреблении могут увеличивать экспрессию генов, связанных с фенотипами зависимости. [205]
родителей Питание , внутриутробное воздействие стресса или химических веществ, нарушающих работу эндокринной системы , [206] материнские эффекты, вызванные самцами, такие как привлекательность различного качества партнера, а также материнский и отцовский возраст, а также пол потомства, возможно, могут влиять на то, будет ли эпимутация зародышевой линии в конечном итоге выражаться в потомстве, и на степень, в которой наследование между поколениями остается стабильным на протяжении всего потомства. [207] Однако остается неясным, могут ли и в какой степени эпигенетические эффекты передаваться из поколения в поколение, особенно у людей. [208] [209]
Зависимость
[ редактировать ]Зависимость мозга – это расстройство системы вознаграждения , которое возникает посредством транскрипционных и нейроэпигенетических механизмов и возникает с течением времени из-за хронически высоких уровней воздействия раздражителей, вызывающих привыкание (например, морфия, кокаина, полового акта, азартных игр). [210] [211] [212] трансгенерационное эпигенетическое наследование аддиктивных фенотипов . В доклинических исследованиях было отмечено [213] [214] Однако убедительные доказательства в поддержку сохранения эпигенетических эффектов на протяжении нескольких поколений у людей еще не получены; например, эпигенетический эффект пренатального воздействия курения, который наблюдается у правнуков, не подвергавшихся воздействию курения. [208]
Исследовать
[ редактировать ]Две формы наследственной информации, а именно генетическая и эпигенетическая, вместе называются двойным наследованием. Члены семейства цитозиндезаминаз APOBEC/AID могут одновременно влиять на генетическое и эпигенетическое наследование, используя сходные молекулярные механизмы, и могут быть точкой пересечения между этими концептуально разделенными процессами. [215]
Фторхинолоновые антибиотики вызывают эпигенетические изменения в млекопитающих клетках посредством хелатирования железа . Это приводит к эпигенетическим эффектам за счет ингибирования α-кетоглутарат-зависимых диоксигеназ , кофактором которых является железо . [216]
Различные фармакологические агенты применяются для производства индуцированных плюрипотентных стволовых клеток (иПСК) или поддержания фенотипа эмбриональных стволовых клеток (ЭСК) с помощью эпигенетического подхода. Взрослые стволовые клетки, такие как стволовые клетки костного мозга, также продемонстрировали потенциал дифференцироваться в сердечные компетентные клетки при обработке ингибитором гистон-метилтрансферазы G9a BIX01294. [217] [218]
Клеточная пластичность, то есть адаптация клеток к стимулам без изменения их генетического кода, требует эпигенетических изменений. Это наблюдалось в клеточной пластичности раковых клеток во время эпителиально-мезенхимального перехода. [219] а также в иммунных клетках, таких как макрофаги. [220] Интересно, что в основе этих адаптаций лежат метаболические изменения, поскольку различные метаболиты играют решающую роль в химии эпигенетических меток. Сюда входит, например, альфа-кетоглутарат, который необходим для деметилирования гистонов, и ацетил-коэнзим А, который необходим для ацетилирования гистонов.
Редактирование эпигенома
[ редактировать ]Эпигенетическая регуляция экспрессии генов, которая может быть изменена или использована при редактировании эпигенома, включает или включает модификацию мРНК/днРНК , модификацию метилирования ДНК и модификацию гистонов . [221] [222] [223]
CpG-сайты, SNP и биологические признаки
[ редактировать ]Метилирование — широко известный механизм генетической регуляции, который может определять биологические признаки. Однако убедительные экспериментальные данные коррелируют с паттернами метилирования в SNP как с важной дополнительной особенностью классической эпигенетической догмы активации/ингибирования. Данные о молекулярном взаимодействии, подтвержденные анализом колокализации, идентифицируют множественные пути ядерной регуляции, связывая вариации последовательностей с нарушениями метилирования ДНК, а также молекулярными и фенотипическими вариациями. [224]
UBASH3B локус
[ редактировать ]UBASH3B кодирует белок с активностью тирозинфосфатазы, которую ранее связывали с развитой неоплазией. [225] SNP rs7115089 был идентифицирован как влияющий на метилирование ДНК и экспрессию этого локуса, а также на индекс массы тела (ИМТ). [224] Фактически, SNP rs7115089 тесно связан с ИМТ. [226] и с генетическими вариантами, связанными с другими сердечно-сосудистыми и метаболическими особенностями GWAS. [227] [228] [229] Новые исследования показывают, что UBASH3B является потенциальным медиатором ожирения и кардиометаболических заболеваний. [224] Кроме того, модели на животных продемонстрировали, что экспрессия UBASH3B является индикатором ограничения калорий, которое может способствовать запрограммированной предрасположенности к ожирению, и связано с другими показателями ожирения в периферической крови человека. [230]
NFKBIE Локус
[ редактировать ]SNP rs730775 расположен в первом интроне NFKBIE и представляет собой цис- eQTL для NFKBIE в цельной крови. [224] Ингибитор ядерного фактора (NF)-κB ε (NFKBIE) непосредственно ингибирует активность NF-κB1 и в значительной степени экспрессируется совместно с NF-κB1, а также связан с ревматоидным артритом. [231] Анализ колокализации подтверждает, что варианты для большинства сайтов CpG в SNP rs730775 вызывают генетическую вариацию в локусе NFKBIE , которая, предположительно, связана с ревматоидным артритом посредством трансдействующей регуляции метилирования ДНК с помощью NF-κB. [224]
FADS1 локус
[ редактировать ]Десатураза жирных кислот 1 (FADS1) является ключевым ферментом метаболизма жирных кислот. [232] Более того, rs174548 в гене FADS1 демонстрирует повышенную корреляцию с метилированием ДНК у людей с высоким содержанием CD8+ Т-клеток. [224] SNP rs174548 тесно связан с концентрацией арахидоновой кислоты и других метаболитов в метаболизме жирных кислот. [233] [234] количество эозинофилов в крови. [235] и воспалительные заболевания, такие как астма. [236] Результаты взаимодействия указали на корреляцию между rs174548 и астмой, что дает новое представление о метаболизме жирных кислот в CD8+ Т-клетках с иммунными фенотипами. [224]
Лженаука
[ редактировать ]Поскольку эпигенетика находится на ранних стадиях развития как наука и окружена сенсациями в средствах массовой информации, Дэвид Горски и генетик Адам Резерфорд посоветовали проявлять осторожность против распространения ложных и псевдонаучных выводов авторов нью-эйдж, делающих необоснованные предположения о том, что гены человека а здоровьем можно управлять с помощью контроля над разумом . Неправильное использование этого научного термина авторами-шарлатанами привело к дезинформации среди широкой публики. [2] [237]
См. также
[ редактировать ]- Эффект Болдуина
- Поведенческая эпигенетика
- Биологическое воздействие радиации на эпигеном
- Вычислительная эпигенетика
- Вклад эпигенетических модификаций в эволюцию
- База данных DAnCER (2010)
- Эпигенез (биология)
- Эпигенетика в судебной медицине
- Эпигенетика аутоиммунных заболеваний
- Эпифенотипирование
- Эпигенетическая терапия
- Эпигенетика нейродегенеративных заболеваний
- Генетика
- ламаркизм
- Нутриэпигеномика
- Позиционно-эффектная пестрота
- Преформизм
- Соматический эпитип
- Синтетический генетический массив
- Эпигенетика сна
- Транскрипционная память
- Трансгенерационное эпигенетическое наследование
Ссылки
[ редактировать ]- ^ Дюпон С., Армант Д.Р., Бреннер, Калифорния (сентябрь 2009 г.). «Эпигенетика: определение, механизмы и клиническая перспектива» . Семинары по репродуктивной медицине . 27 (5): 351–7. дои : 10.1055/s-0029-1237423 . ПМК 2791696 . ПМИД 19711245 .
В первоначальном смысле этого определения эпигенетика относилась ко всем молекулярным путям, модулирующим экспрессию генотипа в конкретный фенотип. В последующие годы, с бурным развитием генетики, значение этого слова постепенно сузилось. Эпигенетика была определена и сегодня общепринята как «изучение изменений в функции генов, которые передаются по наследству митотически и/или мейотически и не влекут за собой изменения последовательности ДНК».
- ^ Jump up to: а б Резерфорд А. (19 июля 2015 г.). «Остерегайтесь псевдогенных джиннов» . Хранитель .
- ^ Динс С., Маггерт К.А. (апрель 2015 г.). «Что ты имеешь в виду под словом «эпигенетический»?» . Генетика . 199 (4): 887–896. дои : 10.1534/genetics.114.173492 . ПМЦ 4391566 . ПМИД 25855649 .
- ^ Шарма С., Келли Т.К., Джонс П.А. (январь 2010 г.). «Эпигенетика рака» . Канцерогенез . 31 (1): 27–36. дои : 10.1093/carcin/bgp220 . ПМК 2802667 . ПМИД 19752007 .
- ^ Канвал Р., Гупта С. (апрель 2012 г.). «Эпигенетические модификации рака» . Клиническая генетика . 81 (4): 303–311. дои : 10.1111/j.1399-0004.2011.01809.x . ПМК 3590802 . ПМИД 22082348 .
- ^ Фриас-Лассер Д., Вильягра, Калифорния (2017). «Важность нкРНК как эпигенетических механизмов в фенотипической изменчивости и органической эволюции» . Границы микробиологии . 8 : 2483. дои : 10.3389/fmicb.2017.02483 . ПМЦ 5744636 . ПМИД 29312192 .
- ^ Jump up to: а б Птица А (май 2007 г.). «Представления об эпигенетике» . Природа . 447 (7143): 396–398. Бибкод : 2007Natur.447..396B . дои : 10.1038/nature05913 . ПМИД 17522671 . S2CID 4357965 .
- ^ Хантер П. (1 мая 2008 г.). «Что помнят гены» . Журнал «Проспект» . Архивировано из оригинала 1 мая 2008 года . Проверено 26 июля 2012 г.
- ^ Рейк В. (май 2007 г.). «Стабильность и гибкость эпигенетической регуляции генов в развитии млекопитающих». Природа . 447 (7143): 425–32. Бибкод : 2007Natur.447..425R . дои : 10.1038/nature05918 . ПМИД 17522676 . S2CID 11794102 .
- ^ Оксфордский словарь английского языка : «Это слово используется У. Харви, Exercitationes 1651, стр. 148, и в English Anatomical Exercitations 1653, стр. 272. Объясняется, что оно означает «partium super-exorientium additamentum», «добавление». частей, вырастающих одна из другой».
- ^ Jump up to: а б Мур Д.С. (2015). Развивающийся геном: введение в поведенческую эпигенетику . Издательство Оксфордского университета. ISBN 978-0-19-992235-2 . [ нужна страница ]
- ^ Jump up to: а б Бергер С.Л., Кузаридес Т., Шихаттар Р., Шилатифард А. (апрель 2009 г.). «Оперативное определение эпигенетики» . Гены и развитие . 23 (7): 781–3. дои : 10.1101/gad.1787609 . ПМЦ 3959995 . ПМИД 19339683 .
- ^ Jump up to: а б «Обзор» . Проект эпигеномики дорожной карты НИЗ . Архивировано из оригинала 21 ноября 2019 года . Проверено 7 декабря 2013 г.
- ^ Моранж М. Попытка Николая Кольцова (Кольцов) связать генетику, эмбриологию и физическую химию , J. Biosciences. 2011. Т. 36. С. 211-214.
- ^ Уоддингтон CH (1942). «Эпигенотип». Стараться . 1 :18–20. «Для изучения наследственности связь между фенотипами и генотипами [...] имеет решающее значение с более широкой биологической точки зрения, поскольку она является ядром всей проблемы развития».
- ^ см . в преформизме Историческую справку . Оксфордский словарь английского языка :«теория о том, что зародыш возникает (путем последовательных приростов), а не просто развивается в процессе воспроизводства. [...] Противоположная теория ранее была известна как «теория эволюции»; чтобы избежать двусмысленности под этим названием сейчас говорят главным образом как о «теории преформации», иногда как о «теории инкапсулирования» или «напыления».
- ^ Уоддингтон CH (2014). Эпигенетика птиц . Издательство Кембриджского университета. ISBN 978-1-107-44047-0 . [ нужна страница ]
- ^ Зал БК (январь 2004 г.). «В поисках эволюционных механизмов развития: 30-летний разрыв между 1944 и 1974 годами» . Журнал экспериментальной зоологии, часть B: Молекулярная эволюция и эволюция развития . 302 (1): 5–18. Бибкод : 2004JEZ...302....5H . дои : 10.1002/jez.b.20002 . ПМИД 14760651 .
- ^ Альварес-Буйя Э.Р., Хаос А., Алдана М., Бенитес М., Кортес-Поса Ю., Эспиноза-Сото С. и др. (3 ноября 2008 г.). «Цветочный морфогенез: стохастические исследования эпигенетического ландшафта генной сети» . ПЛОС ОДИН . 3 (11): е3626. Бибкод : 2008PLoSO...3.3626A . дои : 10.1371/journal.pone.0003626 . ПМЦ 2572848 . ПМИД 18978941 .
- ^ Jump up to: а б Рабаханте Дж. Ф., Бабьерра А. Л. (март 2015 г.). «Ветвление и колебания в эпигенетическом ландшафте детерминации клеточной судьбы». Прогресс биофизики и молекулярной биологии . 117 (2–3): 240–249. doi : 10.1016/j.pbiomolbio.2015.01.006 . ПМИД 25641423 . S2CID 2579314 .
- ^ Холлидей Р. (январь 1990 г.). «Метилирование ДНК и эпигенетическое наследование» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 326 (1235): 329–38. Бибкод : 1990RSPTB.326..329H . дои : 10.1098/rstb.1990.0015 . ПМИД 1968668 .
- ^ Jump up to: а б Риггс А.Д., Мартиенссен Р.А., Руссо В.Е. (1996). Эпигенетические механизмы регуляции генов . Плейнвью, Нью-Йорк: Лабораторное издательство Колд-Спринг-Харбор. стр. 1–4. ISBN 978-0-87969-490-6 . [ нужна страница ]
- ^ Ледфорд Х (октябрь 2008 г.). «Язык: спорные определения» . Природа . 455 (7216): 1023–8. дои : 10.1038/4551023а . ПМИД 18948925 .
- ^ Гибни Э.Р., Нолан К.М. (июль 2010 г.). «Эпигенетика и экспрессия генов» . Наследственность . 105 (1): 4–13. дои : 10.1038/hdy.2010.54 . ПМИД 20461105 . S2CID 31611763 .
- ^ Пташне М (апрель 2007 г.). «Об употреблении слова «эпигенетический» » . Современная биология . 17 (7): Р233-6. Бибкод : 2007CBio...17.R233P . дои : 10.1016/j.cub.2007.02.030 . ПМИД 17407749 . S2CID 17490277 .
- ^ Чжан Д., Тан З., Хуан Х., Чжоу Г., Цуй С., Венг Ю. и др. (октябрь 2019 г.). «Метаболическая регуляция экспрессии генов путем лактилирования гистонов» . Природа . 574 (7779): 575–580. Бибкод : 2019Natur.574..575Z . дои : 10.1038/s41586-019-1678-1 . ПМК 6818755 . ПМИД 31645732 .
- ^ Кумар С., Чиннусами В., Мохапатра Т. (2018). «Эпигенетика модифицированных оснований ДНК: 5-метилцитозин и не только» . Границы генетики . 9 : 640. дои : 10.3389/fgene.2018.00640 . ПМК 6305559 . ПМИД 30619465 .
- ^ Гринберг М.В., Бурчис Д. (октябрь 2019 г.). «Разнообразные роли метилирования ДНК в развитии и заболеваниях млекопитающих». Обзоры природы. Молекулярно-клеточная биология . 20 (10): 590–607. дои : 10.1038/s41580-019-0159-6 . ПМИД 31399642 . S2CID 199512037 .
- ^ Шпиц Ф, Ферлонг Э.Э. (сентябрь 2012 г.). «Факторы транскрипции: от связывания энхансера к контролю развития». Нат преподобный Жене . 13 (9): 613–26. дои : 10.1038/nrg3207 . ПМИД 22868264 . S2CID 205485256 .
- ^ Jump up to: а б Дьюк К.Г., Кеннеди Эй.Дж., Гэвин К.Ф., Дэй Дж.Дж., Суэтт Дж.Д. (июль 2017 г.). «Эпигеномная реорганизация в гиппокампе, зависящая от опыта» . Изучите Мем . 24 (7): 278–288. дои : 10.1101/lm.045112.117 . ПМК 5473107 . ПМИД 28620075 .
- ^ Jump up to: а б с д Бернштейн С (2022). «Метилирование ДНК и установление памяти» . Эпигенетические идеи . 15 : 25168657211072499. дои : 10.1177/25168657211072499 . ПМЦ 8793415 . ПМИД 35098021 .
- ^ Jump up to: а б Роуз Н.Р., Клозе Р.Дж. (декабрь 2014 г.). «Понимание связи между метилированием ДНК и метилированием лизина гистонов» . Биохим Биофиз Акта . 1839 (12): 1362–72. дои : 10.1016/j.bbagrm.2014.02.007 . ПМК 4316174 . ПМИД 24560929 .
- ^ Jump up to: а б Ли Ю, Чен Х, Лу Ц (май 2021 г.). «Взаимодействие между ДНК и метилированием гистонов: молекулярные механизмы и последствия заболеваний» . Представитель ЭМБО . 22 (5): e51803. дои : 10.15252/эмбр.202051803 . ПМЦ 8097341 . ПМИД 33844406 .
- ^ Бенданди А., Пателли А.С., Диаспро А., Роккиа В. (2020). «Роль хвостов гистонов в стабильности нуклеосом: электростатический взгляд» . Comput Struct Biotechnol Дж . 18 : 2799–2809. дои : 10.1016/j.csbj.2020.09.034 . ПМЦ 7575852 . ПМИД 33133421 .
- ^ Стюарт, доктор медицинских наук, Ли Дж., Вонг Дж. (апрель 2005 г.). «Связь между метилированием лизина 9 гистона H3, репрессией транскрипции и рекрутированием белка 1 гетерохроматина» . Молекулярная и клеточная биология . 25 (7): 2525–2538. дои : 10.1128/MCB.25.7.2525-2538.2005 . ПМЦ 1061631 . ПМИД 15767660 .
- ^ Хан Ф.А. (2014). «Генетические нарушения и генная терапия». Биотехнология в медицинских науках . стр. 264–289. дои : 10.1201/b16905-14 . ISBN 978-0-429-17411-7 .
- ^ Дженувейн Т., Лайбле Г., Дорн Р., Рейтер Г. (январь 1998 г.). «Белки домена SET модулируют домены хроматина в эу- и гетерохроматине» . Клеточные и молекулярные науки о жизни . 54 (1): 80–93. дои : 10.1007/s000180050127 . ПМЦ 11147257 . ПМИД 9487389 . S2CID 7769686 .
- ^ Слоткин Р.К., Мартиенссен Р. (апрель 2007 г.). «Мобильные элементы и эпигенетическая регуляция генома». Обзоры природы. Генетика . 8 (4): 272–85. дои : 10.1038/nrg2072 . ПМИД 17363976 . S2CID 9719784 .
- ^ Jump up to: а б Ли Э., Бестор Т.Х., Джениш Р. (июнь 1992 г.). «Направленная мутация гена ДНК-метилтрансферазы приводит к эмбриональной смертности». Клетка . 69 (6): 915–26. дои : 10.1016/0092-8674(92)90611-F . ПМИД 1606615 . S2CID 19879601 .
- ^ Робертсон К.Д., Узволги Э., Лян Г., Талмадж С., Сумеги Дж., Гонсалес Ф.А. и др. (июнь 1999 г.). «ДНК-метилтрансферазы человека (DNMT) 1, 3a и 3b: координируют экспрессию мРНК в нормальных тканях и сверхэкспрессию в опухолях» . Исследования нуклеиновых кислот . 27 (11): 2291–8. дои : 10.1093/нар/27.11.2291 . ПМК 148793 . ПМИД 10325416 .
- ^ Леонхардт Х., Пейдж А.В., Вейер Х.У., Бестор Т.Х. (ноябрь 1992 г.). «Нацеливающая последовательность направляет ДНК-метилтрансферазу к сайтам репликации ДНК в ядрах млекопитающих» (PDF) . Клетка . 71 (5): 865–73. дои : 10.1016/0092-8674(92)90561-П . ПМИД 1423634 . S2CID 5995820 .
- ^ Чуанг Л.С., Ян Х.И., Ко Т.В., Нг Х.Х., Сюй Г., Ли Б.Ф. (сентябрь 1997 г.). «Комплекс ДНК человека-(цитозин-5) метилтрансфераза-PCNA как мишень для p21WAF1». Наука . 277 (5334): 1996–2000. дои : 10.1126/science.277.5334.1996 . ПМИД 9302295 .
- ^ Робертсон К.Д., Вольф А.П. (октябрь 2000 г.). «Метилирование ДНК в здоровье и болезни». Обзоры природы. Генетика . 1 (1): 11–9. дои : 10.1038/35049533 . ПМИД 11262868 . S2CID 1915808 .
- ^ Ли Э., Бирд С., Джениш Р. (ноябрь 1993 г.). «Роль метилирования ДНК в геномном импринтинге». Природа . 366 (6453): 362–5. Бибкод : 1993Natur.366..362L . дои : 10.1038/366362a0 . ПМИД 8247133 . S2CID 4311091 .
- ^ Вьенс А., Мехольд У., Бруйар Ф., Жильбер С., Леклерк П., Огрызко В. (июль 2006 г.). «Анализ отложения человеческого гистона H2AZ in vivo свидетельствует против его прямой роли в механизмах эпигенетического шаблонирования» . Молекулярная и клеточная биология . 26 (14): 5325–35. дои : 10.1128/MCB.00584-06 . ПМК 1592707 . ПМИД 16809769 .
- ^ Огрызко В.В. (апрель 2008 г.). «Эрвин Шредингер, Фрэнсис Крик и эпигенетическая стабильность» . Биология Директ . 3:15 . дои : 10.1186/1745-6150-3-15 . ПМК 2413215 . ПМИД 18419815 .
- ^ Барбьери I, Кузаридес Т (июнь 2020 г.). «Роль модификаций РНК при раке». Обзоры природы. Рак . 20 (6): 303–322. дои : 10.1038/s41568-020-0253-2 . ПМИД 32300195 .
- ^ Ноттке А., депутат Колаяково, Ши Ю (март 2009 г.). «Роль гистоновых лизиндеметилаз в развитии» . Разработка . 136 (6): 879–89. дои : 10.1242/dev.020966 . ПМЦ 2692332 . ПМИД 19234061 .
- ^ Розенфельд Дж. А., Ван З., Шонес Д.Э., Чжао К., ДеСалле Р., Чжан М.К. (март 2009 г.). «Определение обогащенных модификаций гистонов в негенных частях генома человека» . БМК Геномика . 10 :143. дои : 10.1186/1471-2164-10-143 . ПМЦ 2667539 . ПМИД 19335899 .
- ^ Снеппен К., Мичилсен М.А., Додд И.Б. (15 апреля 2008 г.). «Сверхчувствительная регуляция генов с помощью петель положительной обратной связи при модификации нуклеосом» . Молекулярная системная биология . 4 (1): 182. doi : 10.1038/msb.2008.21 . ПМК 2387233 . ПМИД 18414483 .
- ^ «Эпигенетическая клеточная память» . Cmol.nbi.dk. Архивировано из оригинала 30 сентября 2011 года . Проверено 26 июля 2012 г.
- ^ Додд И.Б., Мичилсен М.А., Снеппен К., Тон Г. (май 2007 г.). «Теоретический анализ эпигенетической клеточной памяти путем модификации нуклеосом» . Клетка . 129 (4): 813–22. дои : 10.1016/j.cell.2007.02.053 . ПМИД 17512413 . S2CID 16091877 .
- ^ Моррис К.Л. (2008). «Эпигенетическая регуляция экспрессии генов». РНК и регуляция экспрессии генов: скрытый уровень сложности . Норфолк, Англия: Caister Academic Press. ISBN 978-1-904455-25-7 . [ нужна страница ]
- ^ Мэттик Дж.С., Амарал П.П., Дингер М.Э., Мерсер Т.Р., Мелер М.Ф. (январь 2009 г.). «РНК-регуляция эпигенетических процессов» . Биоэссе . 31 (1): 51–9. doi : 10.1002/bies.080099 . ПМИД 19154003 . S2CID 19293469 .
- ^ Чой CQ (25 мая 2006 г.). «РНК может быть наследственной молекулой» . Ученый . Архивировано из оригинала 8 февраля 2007 года.
- ^ Jump up to: а б с Ван З, Яо Х, Линь С, Чжу Х, Шэнь З, Лу Г и др. (апрель 2013 г.). «Транкрипционная и эпигенетическая регуляция микроРНК человека». Письма о раке . 331 (1): 1–10. дои : 10.1016/j.canlet.2012.12.006 . ПМИД 23246373 .
- ^ «Просмотр miRBase по видам» .
- ^ Лим Л.П., Лау Н.К., Гарретт-Энгеле П., Гримсон А., Шелтер Дж.М., Касл Дж. и др. (февраль 2005 г.). «Анализ на микрочипах показывает, что некоторые микроРНК подавляют большое количество целевых мРНК». Природа . 433 (7027): 769–73. Бибкод : 2005Natur.433..769L . дои : 10.1038/nature03315 . ПМИД 15685193 . S2CID 4430576 .
- ^ Ли Д., Шин С. (октябрь 2012 г.). «Взаимодействия микроРНК-мишени: новые идеи полногеномных подходов» . Анналы Нью-Йоркской академии наук . 1271 (1): 118–28. Бибкод : 2012NYASA1271..118L . дои : 10.1111/j.1749-6632.2012.06745.x . ПМЦ 3499661 . ПМИД 23050973 .
- ^ Фридман Р.К., Фарх К.К., Бердж CB, Бартель Д.П. (январь 2009 г.). «Большинство мРНК млекопитающих являются консервативными мишенями микроРНК» . Геномные исследования . 19 (1): 92–105. дои : 10.1101/гр.082701.108 . ПМЦ 2612969 . ПМИД 18955434 .
- ^ Голл М.Г., Бестор Т.Х. (2005). «Эукариотические цитозинметилтрансферазы». Ежегодный обзор биохимии . 74 : 481–514. doi : 10.1146/annurev.biochem.74.010904.153721 . ПМИД 15952895 . S2CID 32123961 .
- ^ Цзя Г, Фу Ю, Чжао Икс, Дай Ц, Чжэн Г, Ян Ю и др. (октябрь 2011 г.). «N6-метиладенозин в ядерной РНК является основным субстратом FTO, связанного с ожирением» . Химическая биология природы . 7 (12): 885–7. дои : 10.1038/nchembio.687 . ПМК 3218240 . ПМИД 22002720 .
- ^ «Новое исследование связывает обычную модификацию РНК с ожирением» . Физорг.com . Проверено 26 июля 2012 г.
- ^ Хауден Б.П., Боум М., Харрисон П.Ф., Эрнандес Д., Шренцель Дж., Зееманн Т. и др. (август 2013 г.). «Анализ транскрипционного ответа малых РНК у золотистого стафилококка с множественной лекарственной устойчивостью после воздействия противомикробных препаратов» . Антимикробные средства и химиотерапия . 57 (8): 3864–74. дои : 10.1128/AAC.00263-13 . ПМЦ 3719707 . ПМИД 23733475 .
- ^ «sRNATarBase 2.0. Полная база данных бактериальных мишеней SRNA, проверенная экспериментами» . Архивировано из оригинала 26 сентября 2013 года.
- ^ «Геномные карты малых некодирующих РНК и их мишеней в микробных геномах» . Архивировано из оригинала 8 июня 2017 года . Проверено 13 августа 2013 г.
- ^ Руффо, Паола и др. «Длинные некодирующие РНК как эпигенетические регуляторы при нейродегенеративных заболеваниях». Исследования нервной регенерации 18.6 (2023): 1243.
- ^ Бреснахан С.Т., Ли Э., Кларк Л., Ма Р., Рэнджел Дж., Грозингер К.М. и др. (июнь 2023 г.). «Изучение влияния родительского происхождения на транскрипцию и метилирование РНК при опосредовании агрессивного поведения медоносных пчел (Apis mellifera)» . БМК Геномика . 24 (1): 315. дои : 10.1186/s12864-023-09411-4 . ПМЦ 10258952 . ПМИД 37308882 .
- ^ Юл А, Эдмундс В.Дж. (1998). «Эпигенетическое наследование и прионы». Журнал эволюционной биологии . 11 (2): 241–42. дои : 10.1007/s000360050085 .
- ^ Кокс Б.С. (1965). «[PSI], цитоплазматический супрессор суперсупрессии у дрожжей» . Наследственность . 20 (4): 505–21. дои : 10.1038/hdy.1965.65 .
- ^ Лакрут Ф (май 1971 г.). «Неменделевская мутация, позволяющая усваивать уреидоянтарную кислоту дрожжами» . Журнал бактериологии . 106 (2): 519–22. дои : 10.1128/JB.106.2.519-522.1971 . ПМК 285125 . ПМИД 5573734 .
- ^ Либман С.В., Шерман Ф. (сентябрь 1979 г.). «Внехромосомная пси+ детерминанта подавляет нонсенс-мутации у дрожжей» . Журнал бактериологии . 139 (3): 1068–71. дои : 10.1128/JB.139.3.1068-1071.1979 . ПМК 218059 . ПМИД 225301 .
- ^ Истинный Х.Л., Линдквист С.Л. (сентябрь 2000 г.). «Дрожжевой прион обеспечивает механизм генетической изменчивости и фенотипического разнообразия». Природа . 407 (6803): 477–83. Бибкод : 2000Natur.407..477T . дои : 10.1038/35035005 . ПМИД 11028992 . S2CID 4411231 .
- ^ Шортер Дж., Линдквист С. (июнь 2005 г.). «Прионы как адаптивные проводники памяти и наследования». Обзоры природы. Генетика . 6 (6): 435–50. дои : 10.1038/nrg1616 . ПМИД 15931169 . S2CID 5575951 .
- ^ Джакомелли М.Г., Хэнкок А.С., Масел Дж. (февраль 2007 г.). «Преобразование 3'-UTR в кодирующие области» . Молекулярная биология и эволюция . 24 (2): 457–64. дои : 10.1093/molbev/msl172 . ПМК 1808353 . ПМИД 17099057 .
- ^ Ланкастер А.К., Бардилл Дж.П., Тру Х.Л., Масел Дж. (февраль 2010 г.). «Скорость спонтанного появления дрожжевого приона [PSI+] и ее влияние на эволюцию свойств эволюционируемости системы [PSI+]» . Генетика . 184 (2): 393–400. дои : 10.1534/genetics.109.110213 . ПМЦ 2828720 . ПМИД 19917766 .
- ^ Гарсия Д.М., Кэмпбелл Э.А., Якобсон К.М., Цучия М., Шоу Э.А., ДиНардо А.Л. и др. (сентябрь 2021 г.). «Прион ускоряет распространение за счет продолжительности жизни» . электронная жизнь . 10 : е60917. doi : 10.7554/eLife.60917 . ПМЦ 8455135 . ПМИД 34545808 .
- ^ Топарт С., Вернер Э., Аримондо П.Б. (июль 2020 г.). «Путешествие по эпигенетической временной шкале» . Клин Эпигенетика . 12 (1): 97. дои : 10.1186/s13148-020-00893-7 . ПМК 7330981 . ПМИД 32616071 .
- ^ Чендлер В.Л. (февраль 2007 г.). «Парамутация: от кукурузы до мышей» . Клетка . 128 (4): 641–5. дои : 10.1016/j.cell.2007.02.007 . ПМИД 17320501 . S2CID 6928707 .
- ^ Заиди С.К., Лиан Дж.Б., ван Вейнен А., Штейн Дж.Л., Штейн Г.С. (2017). «Закладка митотических генов: эпигенетический механизм координации приверженности к линии, идентичности клеток и роста клеток». Белки RUNX в развитии и раке . Достижения экспериментальной медицины и биологии. Том. 962. стр. 95–102. дои : 10.1007/978-981-10-3233-2_7 . ISBN 978-981-10-3231-8 . ПМЦ 7233416 . ПМИД 28299653 .
- ^ Сутер СМ, Мартин Д.И. (январь 2010 г.). «Парамутация: верхушка эпигенетического айсберга?» . Тенденции в генетике . 26 (1): 9–14. дои : 10.1016/j.tig.2009.11.003 . ПМК 3137459 . ПМИД 19945764 .
- ^ Фергюсон-Смит AC (июль 2011 г.). «Геномный импринтинг: возникновение эпигенетической парадигмы». Обзоры природы. Генетика . 12 (8): 565–575. дои : 10.1038/nrg3032 . ПМИД 21765458 . S2CID 23630392 .
- ^ Ковальчук О., Баулч Дж.Е. (январь 2008 г.). «Эпигенетические изменения и нецелевые радиационные эффекты – есть ли связь?» . Экологический и молекулярный мутагенез . 49 (1): 16–25. Бибкод : 2008EnvMM..49...16K . дои : 10.1002/em.20361 . ПМИД 18172877 . S2CID 38705208 .
- ^ Ильницкий Ю., Ковальчук О. (сентябрь 2011 г.). «Нецелевое радиационное воздействие - эпигенетическая связь». Мутационные исследования . 714 (1–2): 113–25. Бибкод : 2011MRFMM.714..113I . дои : 10.1016/j.mrfmmm.2011.06.014 . ПМИД 21784089 .
- ^ Фридл А.А., Мазурек Б., Зайлер Д.М. (2012). «Радиационно-индуцированные изменения в моделях модификации гистонов и их потенциальное влияние на краткосрочные радиационные эффекты» . Границы онкологии . 2 : 117. doi : 10.3389/fonc.2012.00117 . ПМЦ 3445916 . ПМИД 23050241 .
- ^ Куоццо С., Порчеллини А., Ангризано Т., Морано А., Ли Б., Ди Пардо А. и др. (июль 2007 г.). «Повреждение ДНК, репарация, направленная на гомологию, и метилирование ДНК» . ПЛОС Генетика . 3 (7): е110. дои : 10.1371/journal.pgen.0030110 . ЧВК 1913100 . ПМИД 17616978 .
- ^ О'Хаган Х.М., Мохаммад Х.П., Бэйлин С.Б. (август 2008 г.). Ли Джей Ти (ред.). «Двухнитевые разрывы могут инициировать молчание генов и SIRT1-зависимое начало метилирования ДНК на экзогенном промоторном острове CpG» . ПЛОС Генетика . 4 (8): е1000155. дои : 10.1371/journal.pgen.1000155 . ПМЦ 2491723 . ПМИД 18704159 .
- ^ Маланга М., Althaus FR (июнь 2005 г.). «Роль поли(АДФ-рибозы) в сигнальной сети повреждения ДНК» (PDF) . Биохимия и клеточная биология . 83 (3): 354–64. дои : 10.1139/o05-038 . ПМИД 15959561 .
- ^ Готшалк А.Дж., Тимински Г., Конг С.Э., Джин Дж., Кай Ю., Суонсон С.К. и др. (август 2009 г.). «Поли(АДФ-рибозил)ирование направляет рекрутирование и активацию АТФ-зависимого ремоделера хроматина» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (33): 13770–4. Бибкод : 2009PNAS..10613770G . дои : 10.1073/pnas.0906920106 . ПМК 2722505 . ПМИД 19666485 .
- ^ Лин Дж.К., Чон С., Лян Г., Такай Д., Фатеми М., Цай Ю.К. и др. (ноябрь 2007 г.). «Роль нуклеосомной занятости в эпигенетическом молчании CpG-островка MLH1» . Раковая клетка . 12 (5): 432–44. дои : 10.1016/j.ccr.2007.10.014 . ПМЦ 4657456 . ПМИД 17996647 .
- ^ Табиш А.М., Поелс К., Хоет П., Годдерис Л. (2012). Кьяриотти Л. (ред.). «Эпигенетические факторы риска развития рака: влияние химических канцерогенов на глобальный характер метилирования ДНК в клетках ТК6 человека» . ПЛОС ОДИН . 7 (4): e34674. Бибкод : 2012PLoSO...734674T . дои : 10.1371/journal.pone.0034674 . ПМЦ 3324488 . ПМИД 22509344 .
- ^ Бердж Г.К., Хойл С.П., Уллер Т., Томас Н.А., Глюкман П.Д., Хансон М.А. и др. (2011). Имхоф А. (ред.). «Прогрессивные трансгенерационные изменения фенотипа и эпигенотипа потомства после перехода в питание» . ПЛОС ОДИН . 6 (11): e28282. Бибкод : 2011PLoSO...628282B . дои : 10.1371/journal.pone.0028282 . ПМК 3227644 . ПМИД 22140567 .
- ^ Фан М., Чен Д., Ян К.С. (январь 2007 г.). «Пищевые полифенолы могут влиять на метилирование ДНК» . Журнал питания . 137 (1 доп.): 223S–228S. дои : 10.1093/jn/137.1.223S . ПМИД 17182830 .
- ^ Олахарски А.Дж., Райн Дж., Маршалл Б.Л., Бабиарз Дж., Чжан Л., Вердин Э. и др. (декабрь 2005 г.). «Вкусоароматический агент дигидрокумарин обращает вспять эпигенетическое молчание и ингибирует сиртуиндеацетилазы» . ПЛОС Генетика . 1 (6): е77. дои : 10.1371/journal.pgen.0010077 . ПМЦ 1315280 . ПМИД 16362078 .
- ^ Кикуно Н., Шиина Х., Ураками С., Кавамото К., Хирата Х., Танака Ю. и др. (август 2008 г.). «Опосредованное генистеином ацетилирование и деметилирование гистонов активирует гены-супрессоры опухолей в клетках рака простаты». Международный журнал рака . 123 (3): 552–60. дои : 10.1002/ijc.23590 . ПМИД 18431742 . S2CID 4704450 . (Отозвано, см. дои : 10.1002/ijc.30829 , PMID 28782102 , Часы втягивания )
- ^ Джурик З., Чен Г., Дёрге Д.Р., Хайльбрун Л.К., Кучук О. (октябрь 2001 г.). «Влияние добавок соевых изофлавонов на маркеры окислительного стресса у мужчин и женщин». Письма о раке . 172 (1): 1–6. дои : 10.1016/S0304-3835(01)00627-9 . ПМИД 11595123 .
- ^ Кропат С., Мюллер Д., Беттлер У., Циммерманн К., Хейсс Э.Х., Дирш В.М. и др. (март 2013 г.). «Модуляция Nrf2-зависимой транскрипции гена антоцианами черники in vivo». Молекулярное питание и пищевые исследования . 57 (3): 545–50. дои : 10.1002/mnfr.201200504 . ПМИД 23349102 .
- ^ Свенберг Дж.А., Лу К., Мёллер Б.С., Гао Л., Аптон П.Б., Накамура Дж. и др. (март 2011 г.). «Эндогенные и экзогенные аддукты ДНК: их роль в канцерогенезе, эпидемиологии и оценке риска» . Токсикол . 120 (Приложение 1): С130–45. дои : 10.1093/toxsci/kfq371 . ПМК 3043087 . ПМИД 21163908 .
- ^ Jump up to: а б Гамильтон М.Л., Го З., Фуллер К.Д., Ван Реммен Х., Уорд В.Ф., Остад С.Н. и др. (май 2001 г.). «Надежная оценка уровней 8-оксо-2-дезоксигуанозина в ядерной и митохондриальной ДНК с использованием метода йодида натрия для выделения ДНК» . Нуклеиновые кислоты Рез . 29 (10): 2117–26. дои : 10.1093/нар/29.10.2117 . ПМК 55450 . ПМИД 11353081 .
- ^ Минг Икс, Материя Б, Сонг М, Велиат Э, Шэнли Р, Джонс Р и др. (март 2014 г.). «Картирование структурно определенных продуктов окисления гуанина вдоль дуплексов ДНК: влияние контекста локальной последовательности и эндогенного метилирования цитозина» . J Am Chem Soc . 136 (11): 4223–35. дои : 10.1021/ja411636j . ПМЦ 3985951 . ПМИД 24571128 .
- ^ Jump up to: а б с Чжоу X, Чжуан Z, Ван В, Хэ Л, Ву Х, Цао Ю и др. (сентябрь 2016 г.). «OGG1 необходим для деметилирования ДНК, вызванного окислительным стрессом». Сигнал ячейки . 28 (9): 1163–1171. doi : 10.1016/j.cellsig.2016.05.021 . ПМИД 27251462 .
- ^ Поетч А.Р. (2020). «Геномика окислительного повреждения ДНК, репарации и последующего мутагенеза» . Comput Struct Biotechnol Дж . 18 : 207–219. дои : 10.1016/j.csbj.2019.12.013 . ПМК 6974700 . ПМИД 31993111 .
- ^ Д'Огюстен О, Уэ С., Кампаланс А., Радичелла Дж. П. (ноябрь 2020 г.). «Затерянный в толпе: как человеческая 8-оксогуанин ДНК-гликозилаза 1 (OGG1) находит 8-оксогуанин в геноме?» . Int J Mol Sci . 21 (21): 8360. doi : 10.3390/ijms21218360 . ПМЦ 7664663 . ПМИД 33171795 .
- ^ Лан Л., Накадзима С., Оохата Ю., Такао М., Окано С., Масутани М. и др. (сентябрь 2004 г.). «Анализ in situ процессов репарации окислительных повреждений ДНК в клетках млекопитающих» . Proc Natl Acad Sci США . 101 (38): 13738–43. Бибкод : 2004PNAS..10113738L . дои : 10.1073/pnas.0406048101 . ПМК 518826 . ПМИД 15365186 .
- ^ Маедер М.Л., Ангстман Дж.Ф., Ричардсон М.Е., Линдер С.Дж., Касио В.М., Цай С.К. и др. (декабрь 2013 г.). «Направленное деметилирование ДНК и активация эндогенных генов с использованием программируемых слитых белков TALE-TET1» . Нат. Биотехнология . 31 (12): 1137–42. дои : 10.1038/nbt.2726 . ПМЦ 3858462 . ПМИД 24108092 .
- ^ Дин Н., Бонэм Э.М., Хэннон Б.Е., Амик Т.Р., Бэйлин С.Б., О'Хаган Х.М. (июнь 2016 г.). «Белки репарации несоответствия привлекают ДНК-метилтрансферазу 1 к участкам окислительного повреждения ДНК» . J Мол Клеточная Биол . 8 (3): 244–54. дои : 10.1093/jmcb/mjv050 . ПМЦ 4937888 . ПМИД 26186941 .
- ^ Jump up to: а б Цзян З., Лай Ю., Бивер Дж.М., Цегай П.С., Чжао М.Л., Хортон Дж.К. и др. (январь 2020 г.). «Окислительное повреждение ДНК модулирует характер метилирования ДНК в гене рака молочной железы человека 1 (BRCA1) посредством перекрестных помех между ДНК-полимеразой β и ДНК-метилтрансферазой de novo» . Клетки . 9 (1): 225. doi : 10,3390/cells9010225 . ПМК 7016758 . ПМИД 31963223 .
- ^ Мортусевич О., Шермелле Л., Уолтер Дж., Кардосо М.К., Леонхардт Х. (июнь 2005 г.). «Привлечение ДНК-метилтрансферазы I к сайтам репарации ДНК» . Proc Natl Acad Sci США . 102 (25): 8905–9. Бибкод : 2005PNAS..102.8905M . дои : 10.1073/pnas.0501034102 . ПМЦ 1157029 . ПМИД 15956212 .
- ^ Jump up to: а б Куоццо С., Порчеллини А., Ангризано Т., Морано А., Ли Б., Ди Пардо А. и др. (июль 2007 г.). «Повреждение ДНК, репарация, направленная на гомологию, и метилирование ДНК» . ПЛОС Генет . 3 (7): е110. дои : 10.1371/journal.pgen.0030110 . ЧВК 1913100 . ПМИД 17616978 .
- ^ Jump up to: а б О'Хаган Х.М., Мохаммад Х.П., Бэйлин С.Б. (август 2008 г.). «Двухнитевые разрывы могут инициировать молчание генов и SIRT1-зависимое начало метилирования ДНК на экзогенном промоторном острове CpG» . ПЛОС Генет . 4 (8): е1000155. дои : 10.1371/journal.pgen.1000155 . ПМЦ 2491723 . ПМИД 18704159 .
- ^ Ха К., Ли Г.Э., Палий С.С., Браун К.Д., Такеда Ю., Лю К. и др. (январь 2011 г.). «Быстрое и временное привлечение DNMT1 к двухцепочечным разрывам ДНК опосредовано его взаимодействием с множеством компонентов механизма реакции на повреждение ДНК» . Хум Мол Жене . 20 (1): 126–40. дои : 10.1093/hmg/ddq451 . ПМК 3000680 . ПМИД 20940144 .
- ^ Руссо Г., Ланди Р., Пезоне А., Морано А., Зученья С., Романо А. и др. (сентябрь 2016 г.). «Повреждение и восстановление ДНК изменяют метилирование ДНК и домен хроматина целевого локуса: механизм полиморфизма метилирования аллелей» . Научный представитель . 6 : 33222. Бибкод : 2016NatSR...633222R . дои : 10.1038/srep33222 . ПМК 5024116 . ПМИД 27629060 .
- ^ Фаррис М.Х., Текстер П.А., Мора А.А., Уайлс М.В., Мак Гарригл Э.Ф., Клаус С.А. и др. (декабрь 2020 г.). «Обнаружение CRISPR-опосредованных модификаций генома посредством изменения паттернов метилирования CpG-островков» . БМК Геномика . 21 (1): 856. doi : 10.1186/s12864-020-07233-2 . ПМК 7709351 . ПМИД 33267773 .
- ^ Аллен Б., Пезоне А., Порчеллини А., Мюллер М.Т., Мастернак М.М. (июнь 2017 г.). «Номологичные соединения концов вызывают изменения в метилировании ДНК: источник постоянных эпигенетических изменений» . Онкотаргет . 8 (25): 40359–40372. дои : 10.18632/oncotarget.16122 . ПМЦ 5522286 . ПМИД 28423717 .
- ^ Jump up to: а б Верма М., Роджерс С., Диви Р.Л., Шулли С.Д., Нельсон С., Джозеф Су Л. и др. (февраль 2014 г.). «Эпигенетические исследования в эпидемиологии рака: тенденции, возможности и проблемы» . Эпидемиология рака, биомаркеры и профилактика . 23 (2): 223–33. doi : 10.1158/1055-9965.EPI-13-0573 . ПМЦ 3925982 . ПМИД 24326628 .
- ^ Jump up to: а б «Изучение эпигенетики с помощью ЧИП» . Абкам .
- ^ Jump up to: а б Шомей Дж., Оги С., Чоу Дж.К., Херд Э. (2008). «Комбинированная иммунофлуоресценция, флуоресцентная гибридизация РНК in Situ и флуоресцентная гибридизация ДНК in Situ для изучения изменений хроматина, транскрипционной активности, ядерной организации и инактивации X-хромосомы». Ядро . Методы молекулярной биологии. Том. 463. Клифтон, Нью-Джерси: Спрингер. стр. 297–308. дои : 10.1007/978-1-59745-406-3_18 . ISBN 978-1-58829-977-2 . ПМИД 18951174 .
- ^ Jump up to: а б О'Коннор С. (2008). «Флуоресцентная гибридизация in situ (FISH)» . Природное образование . 1 (1): 171.
- ^ Jump up to: а б с д Хасимото К., Кокубун С., Итои Э., Роуч Х.И. (2007). «Улучшенная количественная оценка метилирования ДНК с использованием чувствительных к метилированию рестриктаз и ПЦР в реальном времени» . Эпигенетика . 2 (2): 86–91. дои : 10.4161/epi.2.2.4203 . ПМИД 17965602 . S2CID 26728480 .
- ^ Ли-Бьярли Х., Бонкристиани Х., Хауэлл Дж., Герман Дж., Кларк Л., Стрэнд М.К. и др. (24 сентября 2020 г.). «Транскриптомная и эпигеномная динамика медоносных пчел в ответ на летальную вирусную инфекцию» . Границы генетики . 11 : 566320. doi : 10.3389/fgene.2020.566320 . ПМЦ 7546774 . ПМИД 33101388 .
- ^ Ли-Бьярлей Х., Ли Ю., Страуд Х., Фэн С., Ньюман Т.С., Канеда М. и др. (июль 2013 г.). «Нокаут ДНК-метилтрансферазы 3 РНК-интерференцией влияет на альтернативный сплайсинг генов у медоносной пчелы» . Труды Национальной академии наук Соединенных Штатов Америки . 110 (31): 12750–12755. Бибкод : 2013PNAS..11012750L . дои : 10.1073/pnas.1310735110 . ПМЦ 3732956 . ПМИД 23852726 .
- ^ Симпсон Дж.Т., Уоркман Р.Э., Зузарте ПК, Дэвид М., Дурси Л.Дж., Тимп В. (апрель 2017 г.). «Обнаружение метилирования цитозина ДНК с помощью секвенирования нанопор». Природные методы . 14 (4): 407–410. дои : 10.1038/nmeth.4184 . ПМИД 28218898 . S2CID 16152628 .
- ^ Сапп Дж (1991). «Концепции организации использования инфузорий простейших». Концептуальная история современной эмбриологии . Биология развития. Том. 7. С. 229–258. дои : 10.1007/978-1-4615-6823-0_11 . ISBN 978-1-4615-6825-4 . ПМИД 1804215 .
- ^ Сапп Дж (2003). Бытие: эволюция биологии . Оксфорд: Издательство Оксфордского университета. ISBN 978-0-19-515619-5 .
- ^ Грей Р.Д., Ояма С., Гриффитс П.Е. (2003). Циклы непредвиденных обстоятельств: системы развития и эволюция (Жизнь и разум: философские проблемы биологии и психологии) . Кембридж, Массачусетс: MIT Press. ISBN 978-0-262-65063-2 .
- ^ Серизай Дж., Донг Ю., Янес Дж., Чесни М., Серрато С., Арингер Дж. (20 февраля 2020 г.). «Тканеспецифическое профилирование выявляет отличительные регуляторные архитектуры для распространенных, зародышевых и соматических генов» . bioRxiv : 2020.02.20.958579. дои : 10.1101/2020.02.20.958579 . S2CID 212943176 .
- ^ Jump up to: а б Тейф В.Б., Бешнова Д.А., Вайнштейн Ю., Март С., Мальм Дж.П., Хёфер Т. и др. (август 2014 г.). «Репозиционирование нуклеосом связывает (де)метилирование ДНК и дифференциальное связывание CTCF во время развития стволовых клеток» . Геномные исследования . 24 (8): 1285–95. дои : 10.1101/гр.164418.113 . ПМК 4120082 . ПМИД 24812327 .
- ^ Бушбек М., Хейк С.Б. (май 2017 г.). «Варианты основных гистонов и их роль в принятии решений о судьбе клеток, их развитии и раке» . Обзоры природы. Молекулярно-клеточная биология . 18 (5): 299–314. дои : 10.1038/номер.2016.166 . ПМИД 28144029 . S2CID 3307731 .
- ^ Джанг К.В., Шибата И., Стармер Дж., Йи Д., Магнусон Т. (июль 2015 г.). «Гистон H3.3 поддерживает целостность генома во время развития млекопитающих» . Гены и развитие . 29 (13): 1377–92. дои : 10.1101/gad.264150.115 . ПМК 4511213 . ПМИД 26159997 .
- ^ «3D-геном» . www.nature.com . 2 сентября 2019 года . Проверено 26 сентября 2021 г.
- ^ Китамура Т., Огава С.К., Рой Д.С., Окуяма Т., Моррисси М.Д., Смит Л.М. и др. (апрель 2017 г.). «Инграммы и цепи имеют решающее значение для системной консолидации памяти» . Наука . 356 (6333): 73–78. Бибкод : 2017Наука...356...73К . дои : 10.1126/science.aam6808 . ПМЦ 5493329 . ПМИД 28386011 .
- ^ Jump up to: а б Стотт РТ, Крицкий О, Цай ЛХ (2021). «Профилирование сайтов разрывов ДНК и транскрипционных изменений в ответ на контекстуальное обучение страху» . ПЛОС ОДИН . 16 (7): e0249691. Бибкод : 2021PLoSO..1649691S . дои : 10.1371/journal.pone.0249691 . ПМЦ 8248687 . ПМИД 34197463 .
- ^ Ли Б.Х., Шим Дж.И., Мун Х.К., Ким Д.В., Ким Дж., Юк Дж.С. и др. (июль 2022 г.). «Визуализация синтеза мРНК в реальном времени во время формирования памяти у живых мышей» . Proc Natl Acad Sci США . 119 (27): e2117076119. Бибкод : 2022PNAS..11917076L . дои : 10.1073/pnas.2117076119 . ПМЦ 9271212 . ПМИД 35776545 .
- ^ Тишмейер В., Гримм Р. (апрель 1999 г.). «Активация непосредственных ранних генов и формирование памяти» . Cell Mol Life Sci . 55 (4): 564–74. дои : 10.1007/s000180050315 . ПМЦ 11146814 . ПМИД 10357227 . S2CID 6923522 .
- ^ Jump up to: а б Оливейра А.М., Хемстедт Т.Дж., Бадинг Х. (июль 2012 г.). «Спасение связанного со старением снижения экспрессии Dnmt3a2 восстанавливает когнитивные способности». Нат Нейроски . 15 (8): 1111–3. дои : 10.1038/nn.3151 . ПМИД 22751036 . S2CID 10590208 .
- ^ Jump up to: а б Сунь З, Сюй Х, Хэ Дж, Мюррей А, Сунь М.А., Вэй Икс и др. (август 2019 г.). «EGR1 привлекает TET1 для формирования метилома мозга во время развития и при активности нейронов» . Нат Коммун . 10 (1): 3892. Бибкод : 2019NatCo..10.3892S . дои : 10.1038/s41467-019-11905-3 . ПМЦ 6715719 . ПМИД 31467272 .
- ^ Манзо М., Вирц Дж., Амбрози С., Вилласеньор Р., Рошицкий Б., Баубек Т. (декабрь 2017 г.). «Изоформ-специфическая локализация DNMT3A регулирует точность метилирования ДНК на двухвалентных CpG-островках» . ЭМБО Дж . 36 (23): 3421–3434. дои : 10.15252/embj.201797038 . ПМЦ 5709737 . ПМИД 29074627 .
- ^ Джоэлс Г., Лампрехт Р. (2014). «Формирование памяти о страхе может повлиять на другую память: обусловленность страхом влияет на исчезновение, но не на восстановление условной памяти об отвращении вкуса (CTA)» . Переднее поведение нейронов . 8 : 324. дои : 10.3389/fnbeh.2014.00324 . ПМК 4179742 . ПМИД 25324744 .
- ^ Мур Л.Д., Ле Т., Фан Дж. (январь 2013 г.). «Метилирование ДНК и его основная функция» . Нейропсихофармакология . 38 (1): 23–38. дои : 10.1038/нпп.2012.112 . ПМК 3521964 . ПМИД 22781841 .
- ^ Jump up to: а б Хальдер Р., Хеннион М., Видал Р.О., Шомрони О., Рахман Р.У., Раджпут А. и др. (январь 2016 г.). «Изменения метилирования ДНК в генах пластичности сопровождают формирование и поддержание памяти». Нат Нейроски . 19 (1): 102–10. дои : 10.1038/nn.4194 . ПМИД 26656643 . S2CID 1173959 .
- ^ Франкланд П.В., Бонтемпи Б., Талтон Л.Е., Качмарек Л., Сильва А.Дж. (май 2004 г.). «Вовлечение передней поясной извилины в отдаленные контекстуальные воспоминания о страхе». Наука . 304 (5672): 881–3. Бибкод : 2004Sci...304..881F . дои : 10.1126/science.1094804 . ПМИД 15131309 . S2CID 15893863 .
- ^ Бартер Дж.Д., Фостер Т.К. (октябрь 2018 г.). «Старение мозга: новая роль эпигенетики в снижении когнитивных функций». Нейробиолог . 24 (5): 516–525. дои : 10.1177/1073858418780971 . ПМИД 29877135 . S2CID 46965080 .
- ^ Харман М.Ф., Мартин М.Г. (февраль 2020 г.). «Эпигенетические механизмы, связанные со снижением когнитивных функций во время старения». Журнал нейробиологических исследований . 98 (2): 234–246. дои : 10.1002/jnr.24436 . ПМИД 31045277 . S2CID 143423862 .
- ^ Брага Д.Л., Мусович-Нето Ф., Тонон-да-Силва Г., Салгейру В.Г., Мори М.А. (август 2020 г.). «Эпигенетические изменения во время старения и их основные механизмы». Биогеронтология . 21 (4): 423–443. дои : 10.1007/s10522-020-09874-y . ПМИД 32356238 . S2CID 254292058 .
- ^ Чжан В., Цюй Дж., Лю Г.Х., Бельмонте Дж.К. (март 2020 г.). «Стареющий эпигеном и его омоложение». Обзоры природы. Молекулярно-клеточная биология . 21 (3): 137–150. дои : 10.1038/s41580-019-0204-5 . ПМИД 32020082 . S2CID 211028527 .
- ^ Симпсон DJ, Олова Н.Н., Чандра Т (сентябрь 2021 г.). «Клеточное перепрограммирование и эпигенетическое омоложение» . Клиническая эпигенетика . 13 (1): 170. дои : 10.1186/s13148-021-01158-7 . ПМК 8419998 . PMID 34488874 .
- ^ Хван Дж.Ю., Аромоларан К.А., Зукин Р.С. (май 2017 г.). «Новая область эпигенетики в области нейродегенерации и нейропротекции» . Обзоры природы. Нейронаука . 18 (6): 347–361. дои : 10.1038/nrn.2017.46 . ПМК 6380351 . ПМИД 28515491 .
- ^ Григоренко Е.Л., Корнилов С.А., Наумова О.Ю. (ноябрь 2016). «Эпигенетическая регуляция познания: ограниченный обзор области». Развитие и психопатология . 28 (4 ч. 2): 1285–1304. дои : 10.1017/S0954579416000857 . ПМИД 27691982 . S2CID 21422752 .
- ^ Бэкон Р.Д., Бринтон Р.Д. (июнь 2021 г.). «Эпигенетика развивающегося и стареющего мозга: механизмы, регулирующие начало и результаты реорганизации мозга» . Неврологические и биоповеденческие обзоры . 125 : 503–516. doi : 10.1016/j.neubiorev.2021.02.040 . ПМЦ 8989071 . ПМИД 33657435 .
- ^ Страйфер М., Гор AC (2021). «Эпигенетика, эстрогенные химические вещества, нарушающие работу эндокринной системы (EDC), и мозг». Химические вещества, нарушающие работу эндокринной системы . Достижения фармакологии. Том. 92. С. 73–99. дои : 10.1016/bs.apha.2021.03.006 . ISBN 9780128234662 . ПМИД 34452697 . S2CID 237339845 .
- ^ Бекдаш Р.А. (январь 2018 г.). «Холин, мозг и нейродегенерация: идеи эпигенетики». Границы бионауки . 23 (6): 1113–1143. дои : 10.2741/4636 . ПМИД 28930592 .
- ^ Экстранд Б., Шеерс Н., Расмуссен М.К., Янг Дж.Ф., Росс А.Б., Ландберг Р. (май 2021 г.). «Продукты для мозга – роль диеты в работе мозга и здоровье». Обзоры питания . 79 (6): 693–708. дои : 10.1093/nutrit/nuaa091 . ПМИД 32989449 .
- ^ Фернандес Х., Арида Р.М., Гомес-Пинилья Ф. (сентябрь 2017 г.). «Физические упражнения как эпигенетический модулятор пластичности мозга и познания» . Неврологические и биоповеденческие обзоры . 80 : 443–456. doi : 10.1016/j.neubiorev.2017.06.012 . ПМК 5705447 . ПМИД 28666827 .
- ^ Тамим Б. (4 сентября 2022 г.). «Новое открытие: синапс, скрывающийся в мозгу мышей, может улучшить наше понимание нейронной коммуникации» . Интересный инжиниринг.com . Проверено 19 октября 2022 г.
- ^ Шеу С.Х., Упадьяюла С., Дюпуи В., Пан С., Дэн Ф., Ван Дж. и др. (сентябрь 2022 г.). «Серотонинергический аксон-ресничный синапс управляет ядерной передачей сигналов, изменяя доступность хроматина» . Клетка . 185 (18): 3390–3407.e18. дои : 10.1016/j.cell.2022.07.026 . ПМЦ 9789380 . ПМИД 36055200 . S2CID 251958800 .
- Пресс-релиз университета: «Ученые открыли новый вид синапсов в крошечных волосках нейронов» . Медицинский институт Говарда Хьюза через phys.org . Проверено 19 октября 2022 г.
- ^ Кеверн Э.Б. (апрель 2011 г.). «Эпигенетика и эволюция мозга». Эпигеномика . 3 (2): 183–191. дои : 10.2217/эпи.11.10 . ПМИД 22122280 .
- ^ Гриземер Дж., Хабер М.Х., Ямашита Г., Ганнетт Л. (март 2005 г.). «Критическое уведомление: циклы непредвиденных обстоятельств - системы развития и эволюция». Биология и философия . 20 (2–3): 517–44. дои : 10.1007/s10539-004-0836-4 . S2CID 2995306 .
- ^ Глава: «Развитие нервной системы» в «Эпигенетике» Бенедикта Халлгримссона и Брайана Холла.
- ^ Коста С., Шоу П. (март 2007 г.). « Клетки с открытым разумом: как клетки могут изменить судьбу» (PDF) . Тенденции в клеточной биологии . 17 (3): 101–6. дои : 10.1016/j.tcb.2006.12.005 . ПМИД 17194589 . Архивировано из оригинала (PDF) 15 декабря 2013 года.
Это может свидетельствовать о том, что растительные клетки не используют и не требуют механизма клеточной памяти, а просто реагируют на позиционную информацию. Однако было показано, что растения действительно используют механизмы клеточной памяти, опосредованные белками PcG, в нескольких процессах... (стр. 104).
- ^ Куни Калифорния, Дэйв А.А., Вольф Г.Л. (август 2002 г.). «Материнские добавки метила у мышей влияют на эпигенетические вариации и метилирование ДНК потомства» . Журнал питания . 132 (8 дополнений): 2393S–2400S. дои : 10.1093/jn/132.8.2393S . ПМИД 12163699 .
- ^ Уотерленд Р.А., Йиртл Р.Л. (август 2003 г.). «Мобильные элементы: цели раннего воздействия питания на эпигенетическую регуляцию генов» . Молекулярная и клеточная биология . 23 (15): 5293–300. дои : 10.1128/MCB.23.15.5293-5300.2003 . ПМК 165709 . ПМИД 12861015 .
- ^ Долиной Д.К. (август 2008 г.). «Модель мышей агути: эпигенетический биосенсор для определения изменений питания и окружающей среды в эпигеноме плода» . Обзоры питания . 66 (Приложение 1): S7-11. дои : 10.1111/j.1753-4887.2008.00056.x . ПМЦ 2822875 . ПМИД 18673496 .
- ^ Шульце К.В., Бхатт А., Азамян М.С., Сундгрен Н.К., Сапата Г.Е., Эрнандес П. и др. (ноябрь 2019 г.). «Аберрантное метилирование ДНК как диагностический биомаркер диабетической эмбриопатии» . Генетика в медицине . 21 (11): 2453–2461. дои : 10.1038/s41436-019-0516-z . ПМИД 30992551 . S2CID 116880337 .
- ^ Каллауэй Э (1 декабря 2013 г.). «Страшные воспоминания передаются потомкам мышей: генетический отпечаток травматического опыта передается как минимум через два поколения» . Журнал Nature – через Scientific American.
- ^ Ле Ру М (13 декабря 2013 г.). «Мыши могут «предупреждать» сыновей и внуков об опасности с помощью спермы» .
- ^ Фрэнсис Дж. (октябрь 2014 г.). «Слишком большой успех для недавних революционных эпигенетических экспериментов» . Генетика . 198 (2): 449–451. дои : 10.1534/genetics.114.163998 . ПМК 4196602 . ПМИД 25316784 .
- ^ Диас Б.Г., Ресслер К.Дж. (январь 2014 г.). «Родительский обонятельный опыт влияет на поведение и нервную структуру последующих поколений» . Природная неврология . 17 (1): 89–96. дои : 10.1038/nn.3594 . ПМЦ 3923835 . ПМИД 24292232 . (см. комментарий Гонсало Отазу)
- ^ «Статья по эпигенетике вызывает вопросы» .
- ^ Хоекстра РФ (2000). Эволюция: введение . Оксфорд: Издательство Оксфордского университета. п. 285. ИСБН 978-0-19-854968-0 .
- ^ Лэмб М.Дж., Яблонка Э. (2005). Эволюция в четырех измерениях: генетические, эпигенетические, поведенческие и символические вариации в истории жизни . Кембридж, Массачусетс: MIT Press. ISBN 978-0-262-10107-3 .
- ^ См. также Денис Ноубл : Музыка жизни , особенно стр. 93–98 и стр. 48, где он цитирует Jablonka & Lamb и Массимо Пильуччи обзор на Jablonka and Lamb in Nature 435 , 565–566 (2 июня 2005 г.)
- ^ Данчин Э, Шармантье А, Шампань ФА, Месуди А, Пужоль Б, Бланше С (июнь 2011 г.). «За пределами ДНК: интеграция инклюзивного наследования в расширенную теорию эволюции». Обзоры природы. Генетика . 12 (7): 475–86. дои : 10.1038/nrg3028 . ПМИД 21681209 . S2CID 8837202 .
- ^ Мейнард Смит Дж. (март 1990 г.). «Модели системы двойного наследования». Журнал теоретической биологии . 143 (1): 41–53. Бибкод : 1990JThBi.143...41M . дои : 10.1016/S0022-5193(05)80287-5 . ПМИД 2359317 .
- ^ Линч М. (май 2007 г.). «Хрупкость адаптивных гипотез происхождения сложности организма» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (Приложение 1): 8597–604. Бибкод : 2007PNAS..104.8597L . дои : 10.1073/pnas.0702207104 . ПМК 1876435 . ПМИД 17494740 .
- ^ Дикинс Т.Е., Рахман К. (август 2012 г.). «Расширенный эволюционный синтез и роль мягкого наследования в эволюции» . Слушания. Биологические науки . 279 (1740): 2913–21. дои : 10.1098/rspb.2012.0273 . ПМЦ 3385474 . ПМИД 22593110 .
- ^ Рэндо О.Дж., Верстрепен К.Дж. (февраль 2007 г.). «Временные шкалы генетического и эпигенетического наследования» . Клетка . 128 (4): 655–68. дои : 10.1016/j.cell.2007.01.023 . ПМИД 17320504 . S2CID 17964015 .
- ^ Ланкастер А.К., Масел Дж. (сентябрь 2009 г.). «Эволюция обратимых переключателей при наличии необратимых имитаторов» . Эволюция; Международный журнал органической эволюции . 63 (9): 2350–62. дои : 10.1111/j.1558-5646.2009.00729.x . ПМК 2770902 . ПМИД 19486147 .
- ^ ван дер Грааф А., Варденаар Р., Нейман Д.А., Таудт А., Шоу Р.Г., Янсен Р.К. и др. (май 2015 г.). «Скорость, спектр и эволюционная динамика спонтанных эпимутаций» . Труды Национальной академии наук Соединенных Штатов Америки . 112 (21): 6676–81. Бибкод : 2015PNAS..112.6676V . дои : 10.1073/pnas.1424254112 . ПМК 4450394 . ПМИД 25964364 .
- ^ Грисволд К.К., Мэйсел Дж. (июнь 2009 г.). «Сложные адаптации могут стимулировать эволюцию конденсатора [PSI] даже при реалистичных показателях пола дрожжей» . ПЛОС Генетика . 5 (6): e1000517. дои : 10.1371/journal.pgen.1000517 . ПМК 2686163 . ПМИД 19521499 .
- ^ Яблонка Э., Раз Г (июнь 2009 г.). «Трансгенерационное эпигенетическое наследование: распространенность, механизмы и значение для изучения наследственности и эволюции» (PDF) . Ежеквартальный обзор биологии . 84 (2): 131–76. CiteSeerX 10.1.1.617.6333 . дои : 10.1086/598822 . ПМИД 19606595 . S2CID 7233550 . Архивировано из оригинала (PDF) 15 июля 2011 года . Проверено 1 ноября 2017 г.
- ^ Дэвис, Хейзел (2008). Кусаются ли бабочки?: Увлекательные ответы на вопросы о бабочках и мотыльках (Вопросы и ответы о животных). Издательство Университета Рутгерса.
- ^ Льюис З.А., Хонда С., Хлафаллах Т.К., Джеффресс Дж.К., Фрайтаг М., Мон Ф. и др. (март 2009 г.). «Реликты точковых мутаций, индуцированных повторами, направляют образование гетерохроматина у Neurospora crassa» . Геномные исследования . 19 (3): 427–37. дои : 10.1101/гр.086231.108 . ПМК 2661801 . ПМИД 19092133 .
- ^ Jump up to: а б Тост Дж (2008). Эпигенетика . Норфолк, Англия: Caister Academic Press. ISBN 978-1-904455-23-3 .
- ^ Шадт Э.Э., Банерджи О., Фанг Г., Фэн З., Вонг В.Х., Чжан Х. и др. (январь 2013 г.). «Моделирование изменения кинетической скорости данных секвенирования ДНК третьего поколения для обнаружения предполагаемых модификаций оснований ДНК» . Геномные исследования . 23 (1): 129–41. дои : 10.1101/гр.136739.111 . ПМЦ 3530673 . ПМИД 23093720 .
- ^ Дэвис Б.М., Чао МК, Уолдор МК (апрель 2013 г.). «Вступление в эпоху бактериальной эпигеномики с секвенированием ДНК одной молекулы в реальном времени» . Современное мнение в микробиологии . 16 (2): 192–8. дои : 10.1016/j.mib.2013.01.011 . ПМЦ 3646917 . ПМИД 23434113 .
- ^ Ллуч-Сенар М., Луонг К., Льоренс-Рико В., Дельгадо Дж., Фанг Г., Спиттл К. и др. (2013). Ричардсон П.М. (ред.). «Комплексная характеристика метиломов Mycoplasmagentium и Mycoplasma pneumoniae с одноосновным разрешением» . ПЛОС Генетика . 9 (1): e1003191. дои : 10.1371/journal.pgen.1003191 . ПМЦ 3536716 . ПМИД 23300489 .
- ^ Мюррей И.А., Кларк Т.А., Морган Р.Д., Бойтано М., Антон Б.П., Луонг К. и др. (декабрь 2012 г.). «Метиломы шести бактерий» . Исследования нуклеиновых кислот . 40 (22): 11450–62. дои : 10.1093/nar/gks891 . ПМК 3526280 . ПМИД 23034806 .
- ^ Фанг Г., Мунера Д., Фридман Д.И., Мандлик А., Чао М.С., Банерджи О. и др. (декабрь 2012 г.). «Полногеномное картирование остатков метилированного аденина в патогенных Escherichia coli с использованием секвенирования одиночных молекул в реальном времени» . Природная биотехнология . 30 (12): 1232–9. дои : 10.1038/nbt.2432 . ПМЦ 3879109 . ПМИД 23138224 .
- ^ Оливейра, PH (август 2021 г.). «Бактериальная эпигеномика: достижение совершеннолетия» . mSystems . 6 (4): e0074721. doi : 10.1128/mSystems.00747-21 . ПМЦ 8407109 . ПМИД 34402642 . S2CID 237149441 .
- ^ Касадесус Дж., Лоу Д. (сентябрь 2006 г.). «Эпигенетическая регуляция генов в бактериальном мире» . Обзоры микробиологии и молекулярной биологии . 70 (3): 830–56. дои : 10.1128/MMBR.00016-06 . ПМЦ 1594586 . ПМИД 16959970 .
- ^ Мансо А.С., Чай М.Х., Атак Дж.М., Фури Л., Де Сте Круа М., Хей Р. и др. (сентябрь 2014 г.). «Случайное шестифазное переключение регулирует вирулентность пневмококка посредством глобальных эпигенетических изменений» . Природные коммуникации . 5 : 5055. Бибкод : 2014NatCo...5.5055M . дои : 10.1038/ncomms6055 . ПМК 4190663 . ПМИД 25268848 .
- ^ Оливейра П.Х., Рибис Дж.В., Гарретт Э.М., Трзилова Д., Ким А., Секулович О. и др. (январь 2020 г.). «Эпигеномная характеристика Clostridioides difficile выявила консервативную ДНК-метилтрансферазу, которая опосредует споруляцию и патогенез» . Природная микробиология . 5 (1): 166–180. дои : 10.1038/s41564-019-0613-4 . ПМК 6925328 . ПМИД 31768029 .
- ^ Чахван Р., Вонтакал С.Н., Роа С. (март 2011 г.). «Многомерная природа эпигенетической информации и ее роль в заболеваниях». Медицина открытий . 11 (58): 233–43. ПМИД 21447282 .
- ^ Jump up to: а б с Фрага М.Ф., Баллестар Е., Пас М.Ф., Роперо С., Сетьен Ф., Баллестар М.Л. и др. (июль 2005 г.). «Эпигенетические различия возникают в течение жизни монозиготных близнецов» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (30): 10604–9. Бибкод : 2005PNAS..10210604F . дои : 10.1073/pnas.0500398102 . ПМЦ 1174919 . ПМИД 16009939 .
- ^ Jump up to: а б Каминский З.А., Тан Т., Ван С.К., Птак С., О Г.Х., Вонг А.Х. и др. (февраль 2009 г.). «Профили метилирования ДНК у монозиготных и дизиготных близнецов». Природная генетика . 41 (2): 240–5. дои : 10.1038/ng.286 . ПМИД 19151718 . S2CID 12688031 .
- ^ О'Коннор А. (11 марта 2008 г.). «Утверждение: однояйцевые близнецы имеют идентичную ДНК» . Нью-Йорк Таймс . Проверено 2 мая 2010 г.
- ^ Ballestar E (август 2010 г.). «Уроки эпигенетики от близнецов: перспективы аутоиммунных заболеваний». Клинические обзоры по аллергии и иммунологии . 39 (1): 30–41. дои : 10.1007/s12016-009-8168-4 . ПМИД 19653134 . S2CID 25040280 .
- ^ Уоллес Р.Г., Туми Л.С., Кусто М.А., Мойна Н., Камминс П.М., Мангоне М. и др. (2016). «Потенциальные диагностические и прогностические биомаркеры эпигенетического дрейфа сердечно-сосудистой системы» . БиоМед Исследования Интернэшнл . 2016 : 2465763. дои : 10.1155/2016/2465763 . ПМЦ 4749768 . ПМИД 26942189 .
- ^ Интернет-менделевское наследование у человека (OMIM): 105830
- ^ Вуд Эй.Дж., Оки Р.Дж. (ноябрь 2006 г.). «Геномный импринтинг у млекопитающих: новые темы и устоявшиеся теории» . ПЛОС Генетика . 2 (11): е147. дои : 10.1371/journal.pgen.0020147 . ПМК 1657038 . ПМИД 17121465 .
- ^ Нолл Дж.Х., Николлс Р.Д., Магенис Р.Е., Грэм Дж.М., Лаланд М., Латт С.А. (февраль 1989 г.). «Синдромы Ангельмана и Прадера-Вилли имеют общую делецию 15 хромосомы, но различаются родительским происхождением делеции». Американский журнал медицинской генетики . 32 (2): 285–90. дои : 10.1002/ajmg.1320320235 . ПМИД 2564739 .
- ^ Внук человека по отцовской линии является сыном сына этого человека; внук по материнской линии — сын дочери.
- ^ Пембри М.Э., Бюгрен Л.О., Каати Г., Эдвинссон С., Нортстоун К., Шёстрем М. и др. (февраль 2006 г.). «Полоспецифичные трансгенерационные реакции по мужской линии у людей» . Европейский журнал генетики человека . 14 (2): 159–66. дои : 10.1038/sj.ejhg.5201538 . ПМИД 16391557 . Роберт Уинстон ссылается на это исследование в «Лекция» . Архивировано из оригинала 23 мая 2007 года.
- ^ «NOVA | Стенограммы | Призрак в твоих генах» . ПБС. 16 октября 2007 года . Проверено 26 июля 2012 г.
- ^ Андерсон С.Дж., Фей К.М., Шмидт-МакКормак Г.Р., Малович Э., Млинарчик Г.С., Избицкий П. и др. (май 2016 г.). «Нецелевые эффекты лекарств, приводящие к изменению экспрессии генов эпигенетического и «квазиэпигенетического» происхождения». Фармакологические исследования . 107 : 229–233. дои : 10.1016/J.phrs.2016.03.028 . ПМИД 27025785 .
- ^ Алавиан-Гаванини А, Рюгг Дж (январь 2018 г.). «Понимание эпигенетических эффектов химических веществ, нарушающих работу эндокринной системы: от механизмов к новым методам испытаний» . Базовая и клиническая фармакология и токсикология . 122 (1): 38–45. дои : 10.1111/bcpt.12878 . ПМИД 28842957 .
- ^ Коплан Дж., Чанатри С.Т., Розенблюм Л.А. (2017). «Стойкость раннего стресса на эпигеноме: наблюдения за нечеловеческими приматами ☆». Справочный модуль по неврологии и биоповеденческой психологии . дои : 10.1016/B978-0-12-809324-5.02862-5 . ISBN 9780128093245 .
- ^ Jump up to: а б Пломин Р., ДеФрис Дж.К., Кнопик В.С., Нейдерхайзер Дж.М. (2017). Поведенческая генетика (Седьмое изд.). Стоит издательства. стр. 152–153. ISBN 978-1-4292-4215-8 .
- ^ Херд Э., Мартиенссен Р.А. (март 2014 г.). «Трансгенерационная эпигенетическая наследственность: мифы и механизмы» . Клетка . 157 (1): 95–109. дои : 10.1016/j.cell.2014.02.045 . ПМК 4020004 . ПМИД 24679529 .
- ^ Робисон А.Дж., Нестлер Э.Дж. (октябрь 2011 г.). «Транскрипционные и эпигенетические механизмы зависимости» . Обзоры природы. Нейронаука . 12 (11): 623–637. дои : 10.1038/nrn3111 . ПМЦ 3272277 . ПМИД 21989194 .
- ^ Шерон Дж., Керхове д'Эксард А (август 2021 г.). «Наркомания: от лавки до постели» . Трансляционная психиатрия . 11 (1): 424. дои : 10.1038/s41398-021-01542-0 . ПМЦ 8361217 . ПМИД 34385417 .
- ^ Билински П., Войтыла А., Капка-Скшипчак Л., Хведорович Р., Циранка М., Студзински Т. (2012). «Эпигенетическая регуляция при наркомании». Анналы сельскохозяйственной и экологической медицины . 19 (3): 491–496. ПМИД 23020045 .
- ^ Вассолер Ф.М., Садри-Вакили Г (апрель 2014 г.). «Механизмы трансгенерационного наследования аддиктивного поведения» . Нейронаука . 264 : 198–206. doi : 10.1016/j.neuroscience.2013.07.064 . ПМЦ 3872494 . ПМИД 23920159 .
- ^ Юань Т.Ф., Ли А., Сунь Х, Оуян Х., Кампос С., Роча Н.Б. и др. (ноябрь 2016 г.). «Трансгенерационное наследование отцовских нейроповеденческих фенотипов: стресс, зависимость, старение и обмен веществ». Молекулярная нейробиология . 53 (9): 6367–6376. дои : 10.1007/s12035-015-9526-2 . hdl : 10400.22/7331 . ПМИД 26572641 . S2CID 25694221 .
- ^ Чахван Р., Вонтакал С.Н., Роа С. (октябрь 2010 г.). «Перекресток между генетической и эпигенетической информацией посредством дезаминирования цитозина». Тенденции в генетике . 26 (10): 443–8. дои : 10.1016/j.tig.2010.07.005 . ПМИД 20800313 .
- ^ Бадал С., Хер ЮФ, Махер ЖЖ (сентябрь 2015 г.). «Неантибиотические эффекты фторхинолонов в клетках млекопитающих» . Журнал биологической химии . 290 (36): 22287–97. дои : 10.1074/jbc.M115.671222 . ПМК 4571980 . ПМИД 26205818 .
- ^ Мезенцева Н.В., Ян Дж., Каур К., Иаффалдано Г., Ремонд М.С., Айзенберг К.А. и др. (февраль 2013 г.). «Ингибитор гистон-метилтрансферазы BIX01294 усиливает сердечный потенциал клеток костного мозга» . Стволовые клетки и развитие . 22 (4): 654–67. дои : 10.1089/scd.2012.0181 . ПМЦ 3564468 . ПМИД 22994322 .
- ^ Ян Дж., Каур К., Онг Л.Л., Айзенберг К.А., Айзенберг Л.М. (2015). «Ингибирование метилтрансферазы гистонов G9a превращает мезенхимальные стволовые клетки костного мозга в сердечные компетентные предшественники» . Стволовые клетки Интернешнл . 2015 : 270428. doi : 10.1155/2015/270428 . ПМК 4454756 . ПМИД 26089912 .
- ^ Мюллер С., Синдикубвабо Ф., Каньеке Т., Лафон А., Версини А., Ломбард Б. и др. (октябрь 2020 г.). «CD44 регулирует эпигенетическую пластичность, опосредуя эндоцитоз железа» . Природная химия . 12 (10): 929–938. Бибкод : 2020НатЧ..12..929М . дои : 10.1038/s41557-020-0513-5 . ПМЦ 7612580 . ПМИД 32747755 .
- ^ Сольер С., Мюллер С., Каньеке Т., Версини А., Мансарт А., Синдикубвабо Ф. и др. (май 2023 г.). «Лекарственный сигнальный путь меди, вызывающий воспаление» . Природа . 617 (7960): 386–394. Бибкод : 2023Natur.617..386S . дои : 10.1038/s41586-023-06017-4 . ПМЦ 10131557 . ПМИД 37100912 .
- ^ Лю Н, Пан Т (январь 2015 г.). «Эпигенетика РНК» . Трансляционные исследования . 165 (1): 28–35. дои : 10.1016/j.trsl.2014.04.003 . ПМК 4190089 . ПМИД 24768686 .
- ^ Ронг Д., Сунь Г., Ву Ф., Ченг Ю., Сунь Г., Цзян В. и др. (сентябрь 2021 г.). «Эпигенетика: роль и терапевтическое значение модификаций некодирующей РНК при раке человека» . Молекулярная терапия. Нуклеиновые кислоты . 25 : 67–82. дои : 10.1016/j.omtn.2021.04.021 . ПМЦ 8217334 . ПМИД 34188972 . S2CID 235558945 .
- ^ Шин Х., Чхве В.Л., Лим Дж.Ю., Ха Дж.Х. (март 2022 г.). «Редактирование эпигенома: целенаправленное манипулирование эпигенетическими модификациями растений». Гены и геномика . 44 (3): 307–315. дои : 10.1007/s13258-021-01199-5 . ПМИД 35000141 . S2CID 245848779 .
- ^ Jump up to: а б с д и ж г Хаве Дж.С., Уилсон Р., Шмид К.Т., Чжоу Л., Лакшманан Л.Н., Лене BC и др. (январь 2022 г.). «Генетические вариации, влияющие на метилирование ДНК, дают представление о молекулярных механизмах, регулирующих функции генома» . Природная генетика . 54 (1): 18–29. дои : 10.1038/s41588-021-00969-x . ПМИД 34980917 . S2CID 245654240 . Архивировано из оригинала 29 октября 2022 года . Проверено 20 января 2023 г.
- ^ Ли С.Т., Фэн М., Вэй Ю., Ли З., Цяо Ю., Гуань П. и др. (июль 2013 г.). «Протеин-тирозинфосфатаза UBASH3B сверхэкспрессируется при тройном негативном раке молочной железы и способствует инвазии и метастазированию» . Труды Национальной академии наук Соединенных Штатов Америки . 110 (27): 11121–11126. Бибкод : 2013PNAS..11011121L . дои : 10.1073/pnas.1300873110 . ПМК 3704014 . ПМИД 23784775 .
- ^ Йенго Л., Сидоренко Дж., Кемпер К.Е., Чжэн З., Вуд А.Р., Уидон М.Н. и др. (октябрь 2018 г.). «Метаанализ полногеномных исследований ассоциации роста и индекса массы тела у ~ 700 000 человек европейского происхождения» . Молекулярная генетика человека . 27 (20): 3641–3649. дои : 10.1093/hmg/ddy271 . ПМК 6488973 . ПМИД 30124842 .
- ^ Пулит С.Л., Стоунман С., Моррис А.П., Вуд А.Р., Гластонбери Калифорния, Тиррелл Дж. и др. (январь 2019 г.). «Метаанализ полногеномных ассоциативных исследований распределения жира в организме у 694 649 человек европейского происхождения» . Молекулярная генетика человека . 28 (1): 166–174. дои : 10.1093/hmg/ddy327 . ПМК 6298238 . ПМИД 30239722 .
- ^ Чжу З, Го Ю, Ши Х, Лю С.Л., Панганибан Р.А., Чунг В. и др. (февраль 2020 г.). «Общие генетические и экспериментальные связи между характеристиками, связанными с ожирением, и подтипами астмы в Биобанке Великобритании» . Журнал аллергии и клинической иммунологии . 145 (2): 537–549. дои : 10.1016/j.jaci.2019.09.035 . ПМК 7010560 . ПМИД 31669095 .
- ^ Ричардсон Т.Г., Сандерсон Э., Палмер Т.М., Ала-Корпела М., Ференс Б.А., Дэйви Смит Г. и др. (март 2020 г.). «Оценка связи между циркулирующими липопротеиновыми липидами и аполипопротеинами с риском ишемической болезни сердца: многовариантный менделевский рандомизационный анализ» . ПЛОС Медицина . 17 (3): e1003062. дои : 10.1371/journal.pmed.1003062 . ПМК 7089422 . ПМИД 32203549 .
- ^ Конечна Х, Санчес Х, Палу М, Пико С, Палу А (март 2015 г.). «Ранние биомаркеры неблагоприятного программирования гестационного ограничения калорийности клеток крови, основанные на транскриптоме, и их обратимость добавлением лептина» . Научные отчеты . 5 (1): 9088. Бибкод : 2015NatSR...5E9088K . дои : 10.1038/srep09088 . ПМЦ 4357898 . ПМИД 25766068 .
- ^ Окада Ю (ноябрь 2014 г.). «От эпохи анализа генома к эпохе открытия геномных лекарств: новаторский пример ревматоидного артрита». Клиническая генетика . 86 (5): 432–440. дои : 10.1111/cge.12465 . ПМИД 25060537 . S2CID 8499325 .
- ^ Хэ З, Чжан Р, Цзян Ф, Чжан Х, Чжао А, Сюй Б и др. (август 2018 г.). «Генетические полиморфизмы FADS1-FADS2 связаны с метаболизмом жирных кислот посредством изменений в метилировании ДНК и экспрессии генов» . Клиническая эпигенетика . 10 (1): 113. дои : 10.1186/s13148-018-0545-5 . ПМК 6114248 . ПМИД 30157936 .
- ^ Гуан В., Штеффен Б.Т., Леметр Р.Н., Ву Дж.Х., Танака Т., Маничайкул А. и др. (июнь 2014 г.). «Полногеномное исследование ассоциации полиненасыщенных жирных кислот N6 плазмы в когортах исследований сердца и старения в консорциуме геномной эпидемиологии» . Кровообращение: сердечно-сосудистая генетика . 7 (3): 321–331. doi : 10.1161/circenetics.113.000208 . ПМК 4123862 . ПМИД 24823311 .
- ^ Шин С.Ю., Фауман Э.Б., Петерсен А.К., Крумсик Дж., Сантос Р., Хуанг Дж. и др. (июнь 2014 г.). «Атлас генетических влияний на метаболиты крови человека» . Природная генетика . 46 (6): 543–550. дои : 10.1038/ng.2982 . ПМК 4064254 . ПМИД 24816252 .
- ^ Astle WJ, Британская группа GWAS по признакам крови, эпигеном Cambridge BLUEPRINT (2 декабря 2016 г.). «GWAS с участием 170 000 человек идентифицирует тысячи аллелей, нарушающих свойства клеток крови, многие из которых находятся в суперэнхансерах, определяющих идентичность клеток». Кровь . 128 (22): 2652. doi : 10.1182/blood.v128.22.2652.2652 . ISSN 0006-4971 .
- ^ Камат М.А., Блэкшоу Дж.А., Янг Р., Сурендран П., Берджесс С., Данеш Дж. и др. (ноябрь 2019 г.). «PhenoScanner V2: расширенный инструмент для поиска ассоциаций генотип-фенотип человека» . Биоинформатика . 35 (22): 4851–4853. doi : 10.1093/биоинформатика/btz469 . ПМК 6853652 . ПМИД 31233103 .
- ^ Горский Д. (4 февраля 2013 г.). «Эпигенетика: это не значит то, что думают шарлатаны» . Научная медицина .
Дальнейшее чтение
[ редактировать ]- Хак Ф.Н., Готтесман II, Вонг А.Х. (май 2009 г.). «Не совсем идентичны: эпигенетические различия у монозиготных близнецов и значение для исследований близнецов в психиатрии». Американский журнал медицинской генетики. Часть C. Семинары по медицинской генетике . 151С (2): 136–41. дои : 10.1002/ajmg.c.30206 . ПМИД 19378334 . S2CID 205327825 .
- «Что такое эпигенетика?» . Центры по контролю и профилактике заболеваний . 15 августа 2022 г. Проверено 11 сентября 2023 г.
Внешние ссылки
[ редактировать ]- «Эпигенетика и наследование» . Learn.genetics.utah.edu . Проверено 17 апреля 2019 г.
- Проект эпигенома человека (HEP)
- Эпигеномная сеть передового опыта (NoE)
- Канадский консорциум исследований в области эпигенетики, окружающей среды и здоровья (CEEHRC)
- The Epigenome Network of Excellence (NoE) - публичный международный сайт
- «ДНК — это не судьба» — журнала статья на обложке
- «Призрак в твоих генах» , Horizon (2005), BBC
- Статья об эпигенетике в Hopkins Medicine
- На пути к глобальной карте эпигенетических вариаций