Рецептор глюкагоноподобного пептида-1
| ГЛП1Р | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | GLP1R , рецептор глюкагоноподобного пептида 1, GLP-1, GLP-1-R, GLP-1R, рецептор глюкагоноподобного пептида 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 138032 ; МГИ : 99571 ; Гомологен : 1558 ; Генные карты : GLP1R ; ОМА : GLP1R – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Рецептор глюкагоноподобного пептида-1 ( GLP1R ) представляет собой рецептор, связанный с G-белком (GPCR), обнаруженный на бета-клетках поджелудочной железы и нейронах головного мозга. Он участвует в контроле уровня сахара в крови путем усиления секреции инсулина. У человека он синтезируется геном GLP1R , который присутствует на хромосоме 6 . [5] [6] Он является членом семейства GPCR рецепторов глюкагона . [7] GLP1R состоит из двух доменов: один внеклеточный (ECD), который связывает С-концевую спираль GLP-1, [8] и один трансмембранный (TMD) домен [9] который связывает N-концевую область GLP-1. [10] [11] [12] В домене TMD имеется точка опоры полярных остатков, которая регулирует предвзятую передачу сигналов рецептора. [10] а трансмембранные спиральные границы [13] и внеклеточная поверхность являются триггером предвзятого агонизма. [11]
Лиганды
[ редактировать ]GLP1R связывает глюкагоноподобный пептид-1 (GLP1) и глюкагон как его природные эндогенные агонисты. [14]
Агонисты :
- GLP-1 – эндогенный у человека [14]
- глюкагон - эндогенный у человека [14]
- оксинтомодулин
- эксендин-4 , [14] [15]
- эксенатид
- ликсисенатид [14]
- альбиглутид
- беинаглутид
- дулаглутид
- эффегленатид
- лангленатид
- лираглутид [14]
- ПЭГ-локсенатид
- семаглутид
- таспоглутид
- Экноглутид
- Утреглути
- Глепаглутид
- Апраглутид
- Маридебарт Кафраглутид / AMG133
- Тирзепатид
- пегапамодутид
- Из Маздутов
- Сурводутид
- Бамадута
- пемвидутид
- Котадутид
- Ретатрутид
- хлорид лития
- Груталумаб
- DA1726
- GX-G6
- ГЗР18
- HRS9531
- БГМО504
- ПБ718
- РЭЙ1225
- ВКТ220
- ВК2735
- Положительный:
Структура
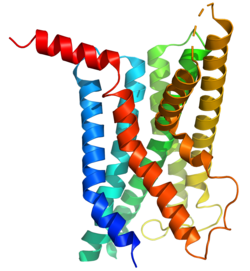
[ редактировать ]Рецептор GLP-1 представляет собой трансмембранный белок, состоящий из семи альфа-спиральных трансмембранных доменов (TM1-TM7), внеклеточного N-конца и внутриклеточного C-конца. Он принадлежит к семейству рецепторов, связанных с G-белком, класса B, также известных как секретиноподобные рецепторы. N-конец рецептора отвечает за связывание лигандов глюкагоноподобного пептида-1 (GLP-1), тогда как внутриклеточный С-конец взаимодействует с внутриклеточными сигнальными белками, инициируя последующие сигнальные пути.
Внеклеточный N-конец содержит ключевые области, участвующие в распознавании и связывании лиганда. При связывании лиганда он претерпевает конформационные изменения, приводящие к активации внутриклеточных сигнальных каскадов. Внутриклеточный С-конец взаимодействует с G-белками и другими сигнальными молекулами, инициируя клеточные реакции.

Функция
[ редактировать ]Глюкагоноподобный пептид-1 (GLP-1) представляет собой гормон, состоящий из 30 аминокислот. Он высвобождается L-клетками кишечника при потреблении питательных веществ. GLP-1 обладает множеством эффектов, включая усиление секреции инсулина бета-клетками поджелудочной железы в ответ на глюкозу , увеличение экспрессии инсулина, предотвращение апоптоза бета-клеток, содействие образованию новых бета-клеток, снижение секреции глюкагона, замедление опорожнения желудка, содействие насыщению, и улучшение утилизации глюкозы в периферических тканях. Из-за этих разнообразных эффектов возник значительный интерес к разработке агонистов рецептора GLP-1 длительного действия (GLP-1R) для лечения диабета 2 типа (СД2).
GLP1R также экспрессируется в мозге. [18] где он участвует в контроле аппетита . [19] Кроме того, мыши с избыточной экспрессией GLP1R демонстрируют улучшенную память и обучаемость. [20]
Реагирующие на растяжение блуждающие нейроны в желудке и кишечнике также экспрессируют GLP1R. [21] Нейроны GLP1R особенно и плотно иннервируют мышцы желудка и могут связываться с дополнительными системами органов, изменяя в результате активации дыхание и частоту сердечных сокращений. [21]
Механизм действия
[ редактировать ]При связывании со своим лигандом GLP-1 рецептор GLP-1 активирует внутриклеточные сигнальные пути, которые регулируют секрецию инсулина, метаболизм глюкозы и насыщение. В бета-клетках поджелудочной железы активация рецептора GLP-1 усиливает стимулируемую глюкозой секрецию инсулина. Это происходит за счет активации аденилатциклазы, что приводит к повышению внутриклеточных уровней циклического АМФ (цАМФ). Повышение уровня цАМФ активирует протеинкиназу А (ПКА), которая способствует экзоцитозу инсулина и повышает выживаемость и пролиферацию бета-клеток.Передача сигналов рецептора GLP-1 в альфа-клетках поджелудочной железы снижает секрецию глюкагона, что еще больше способствует снижению уровня глюкозы. Ингибируя высвобождение глюкагона, активация рецептора GLP-1 помогает поддерживать гомеостаз глюкозы.Другой важной функцией рецептора GLP-1 является регуляция опорожнения желудка. Активация рецептора замедляет скорость опорожнения желудка, что приводит к увеличению насыщения и снижению потребления пищи. Этот эффект способствует управлению весом и контролю аппетита.
« Регуляция аппетита и насыщение» : передача сигналов рецептора GLP-1 влияет на центральную нервную систему, особенно на регионы, участвующие в регуляции аппетита. Активация рецептора GLP-1 способствует ощущению сытости, что приводит к сокращению потребления пищи и улучшению контроля веса.
Опорожнение желудка : активация рецептора GLP-1 замедляет скорость, с которой желудок опорожняет свое содержимое в тонкую кишку. Эта задержка опорожнения желудка способствует ощущению сытости и помогает контролировать уровень глюкозы в крови после приема пищи.
Клиническое значение
[ редактировать ]Эта статья нуждается в более надежных медицинских ссылках для проверки или слишком сильно полагается на первоисточники . ( январь 2024 г. ) |  |
Контроль уровня глюкозы: GLP-1 и его агонисты усиливают контроль уровня глюкозы, стимулируя секрецию инсулина бета-клетками поджелудочной железы глюкозозависимым образом. Это означает, что они стимулируют высвобождение инсулина при повышении уровня глюкозы в крови, помогая поддерживать нормальный уровень сахара в крови. Имитируя физиологическое действие GLP-1, агонисты рецептора GLP-1 эффективно снижают уровень глюкозы в крови, особенно после еды.
Контроль веса: GLP-1 и его агонисты продемонстрировали способность способствовать снижению или стабилизации веса. Эти агенты помогают снизить аппетит, задержать опорожнение желудка и повысить чувство сытости, что приводит к снижению потребления пищи. Эффект снижения веса особенно полезен для людей с диабетом 2 типа, которые часто страдают ожирением или избыточным весом.
Защита сердечно-сосудистой системы: агонисты рецептора GLP-1 продемонстрировали потенциальную пользу для сердечно-сосудистой системы, выходящую за рамки контроля уровня глюкозы. Некоторые исследования показывают, что эти агенты могут снизить риск сердечно-сосудистых событий, таких как сердечные приступы, инсульты и смертность от сердечно-сосудистых заболеваний. Защитные эффекты сердечно-сосудистой системы могут быть связаны с их благоприятным влиянием на артериальное давление, липидный профиль, воспаление и функцию эндотелия.
Сохранение бета-клеток. Было обнаружено, что GLP-1 и его агонисты оказывают защитное действие на бета-клетки поджелудочной железы, которые отвечают за выработку инсулина. Они могут повысить выживаемость бета-клеток, способствовать пролиферации бета-клеток и ингибировать апоптоз бета-клеток, тем самым сохраняя функцию бета-клеток с течением времени.
Комбинированная терапия. Агонисты рецепторов GLP-1 часто используются как часть комбинированной терапии при лечении диабета 2 типа. Их можно назначать вместе с другими пероральными противодиабетическими препаратами, такими как метформин или производные сульфонилмочевины, чтобы обеспечить дополнительный гликемический контроль и улучшить общие результаты лечения.
Различные агонисты рецепторов ГПП-1 подвергаются инактивации ферментами дипептидилпептидазы-4 (ДПП-4). деградация ферментами дипептидилпептидазой-4 (ДПП-4) и нейтральной эндопептидазой ). Одна из стратегий, используемая для решения этой проблемы, заключается в синтезе новых агонистов рецептора GLP-1 с длительным периодом полувыведения из крови , которые будут демонстрировать пониженную деградацию под действием ферментов DPP-4. Другая стратегия — ингибировать ферменты DPP-4.
Споры о том, какое лечение применяется в борьбе с СД2, все еще ведутся. Некоторые исследования предлагают агонисты рецептора GLP1 (GLP1RA), которые показали значительные результаты по сравнению с лечением ингибиторами DPP-4. Некоторые исследования предоставили информацию о снижении количества случаев заболеваний конечностей при лечении GLP1RA. Другие исследования показали, что GLP1RA обеспечивают лучший гликемический контроль и снижение веса по сравнению с ингибиторами ДПП-4 у пациентов с СД2.
Семаглутид
[ редактировать ]Коммерчески известный как Оземпик ( семаглутид ), это лекарство, принадлежащее к классу препаратов, называемых агонистами рецепторов глюкагоноподобного пептида-1 (RA GLP-1). Он в основном используется для лечения диабета 2 типа, а также показал потенциальную пользу в борьбе с ожирением. Экспериментальный период полувыведения семаглутида составляет 183 часа по сравнению с лираглутидом (15 часов).
Что касается ожирения , семаглутид также показал эффективность при лечении ожирения. В более высоких дозах, чем те, которые используются для лечения диабета, он может помочь снизить массу тела. Точный механизм, с помощью которого семаглутид вызывает потерю веса, до конца не изучен, но считается, что на него влияют различные факторы. Семаглутид снижает аппетит, воздействуя на центры мозга, отвечающие за регуляцию аппетита, что приводит к ощущению сытости и снижению потребления пищи. Он также замедляет опорожнение желудка, что может способствовать снижению потребления калорий. Такое комбинированное воздействие на аппетит и пищеварение помогает людям сбросить вес.
Препарат вводят подкожно один раз в неделю. Начальная доза обычно низкая и постепенно увеличивается в течение нескольких недель, чтобы минимизировать потенциальные побочные эффекты со стороны желудочно-кишечного тракта, такие как тошнота. Оптимальная доза для человека определяется лечащим врачом на основе таких факторов, как уровень сахара в крови, реакция на лечение и переносимость.
Клинические испытания продемонстрировали эффективность Оземпика в улучшении гликемического контроля. Препарат продемонстрировал значительное снижение уровня HbA1c (показатель долгосрочного контроля уровня сахара в крови), а также уровня глюкозы натощак и после еды (после еды).
Возможные побочные эффекты семаглутида:
Как и любое лекарство, Оземпик может вызывать побочные эффекты. Общие побочные эффекты включают тошноту, рвоту, диарею и запор. Эти побочные эффекты обычно носят временный характер и имеют тенденцию уменьшаться с течением времени. Редкие, но более серьезные побочные эффекты могут включать панкреатит, заболевания желчного пузыря и аллергические реакции. Перед началом приема Оземпика важно обсудить потенциальные побочные эффекты и риски с врачом.
болезнь Хантингтона
[ редактировать ]Влияние GLP1R на диабет, поджелудочную железу и нейропротекцию также считается потенциальным методом лечения диабета и нарушений энергетического обмена, связанных с болезнью Хантингтона, поражающих мозг и периферию. Эксендин-4 , одобренный FDA агонист рецептора антидиабетического глюкагоноподобного пептида 1 (GLP-1), был протестирован на мышах с мутированным белком хантингтина человека, демонстрирующим нейродегенеративные изменения, двигательную дисфункцию, плохой энергетический обмен и высокий уровень глюкозы в крови. Лечение эксендином-4 (Ex-4) уменьшало накопление мутировавших агрегатов белка хантингтина человека, улучшало двигательную функцию, увеличивало время выживания, улучшало регуляцию глюкозы и уменьшало патологию головного мозга и поджелудочной железы. [22]
Эксендин-4 увеличивает массу бета-клеток в островках поджелудочной железы, улучшая высвобождение инсулина и, в конечном итоге, увеличивая поглощение глюкозы. Механизм увеличения инсулина включает Ex-4 и GLP-1. Когда островки поджелудочной железы подвергаются воздействию GLP-1, наблюдается повышенная экспрессия антиапоптотического гена bcl-2 и снижение экспрессии проапоптотических генов bax и каспазы-3 , что приводит к большей выживаемости клеток. Связывание GLP-1 с рецептором, связанным с G-белком, активирует различные пути, включая рецептор фактора роста, и связывается с путями, стимулирующими митогенез . Некоторые из этих путей включают Rap , Erk1/2 , MAPK , B-RAF , PI3-K , cAMP , PKA и TORC2, которые активируются для инициирования экзоцитоза , экспрессии и трансляции гена проинсулина, увеличения биосинтеза инсулина и генетического увеличения пролиферации бета-клеток. и неогенез. GLP-1R представляет собой рецептор, связанный с G-белком, который зависит от глюкозы, а GLP-1 представляет собой пептидный гормон, который действует непосредственно на бета-клетки, стимулируя секрецию инсулина путем активации передачи сигнала в присутствии глюкозы. Когда глюкоза отсутствует, этот рецептор больше не взаимодействует, стимулируя секрецию инсулина и предотвращая гипогликемию. [23]
Связывая метаболизм глюкозы и чувствительность к инсулину с болезнью Хантингтона, повышенное высвобождение инсулина и пролиферация бета-клеток под действием агониста GLP-1, Ex-4, помогает бороться с повреждением, нанесенным мутантным htt в периферических тканях. Агрегация Htt уменьшает массу бета-клеток и, таким образом, ухудшает высвобождение инсулина и повышает уровень глюкозы в крови. Нарушение гликемического гомеостаза затем влияет на доступность питательных веществ для нейронов и изменяет функцию нейронов, способствуя нейродегенерации и двигательным проблемам, наблюдаемым при болезни Хантингтона. Здоровье нервной системы связано со здоровьем обмена веществ, поэтому лекарство от диабета в качестве лечения болезни Хантингтона является потенциальным методом лечения. Ex-4 легко преодолевает гематоэнцефалический барьер, и было показано, что GLP-1 и Ex-4 действуют на нейроны головного мозга, оказывая нейропротекторное действие. [22]
В исследованиях на мышах с болезнью Хантингтона ежедневное лечение Ex-4 значительно снижало уровень глюкозы по сравнению с мышами, получавшими физиологический раствор. Он также увеличил чувствительность к инсулину примерно на 50%, улучшил стимулируемое инсулином усвоение глюкозы и защитил функцию бета-клеток поджелудочной железы. Болезнь Хантингтона также связана с дисбалансом уровней лептина и грелина . Ex-4 восстановил уровень грелина, а также снизил уровень лептина, что позволило мышам с болезнью Хантингтона есть больше и противодействовать симптоматической потере веса. Это лечение восстановило бета-клетки и структуру островков, уменьшило мутировавшие агрегаты хантингтина человека в мозге и поджелудочной железе, а также улучшило двигательную функцию, о чем свидетельствует повышенный уровень активности мышей. Улучшения были обнаружены в участках тела, экспрессирующих GLP-1R. В дополнение к другим эффектам на мышиной модели болезни Хантингтона ежедневное лечение Ex-4, агонистом GLP-1R, значительно отсрочило наступление смертности и продлило продолжительность жизни примерно на один месяц. [22]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000112164 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000024027 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Торенс Б. (сентябрь 1992 г.). «Экспрессионное клонирование рецептора бета-клеток поджелудочной железы для глюкоинкретинового гормона глюкагоноподобного пептида 1» . Труды Национальной академии наук Соединенных Штатов Америки . 89 (18): 8641–5. Бибкод : 1992PNAS...89.8641T . дои : 10.1073/pnas.89.18.8641 . ПМК 49976 . ПМИД 1326760 .
- ^ Диллон Дж.С., Танизава Ю., Уилер М.Б., Ленг XH, Лигон Б.Б., Рабин Д.У. и др. (октябрь 1993 г.). «Клонирование и функциональная экспрессия рецептора человеческого глюкагоноподобного пептида-1 (GLP-1)». Эндокринология . 133 (4): 1907–10. дои : 10.1210/endo.133.4.8404634 . ПМИД 8404634 .
- ^ Брубейкер П.Л., Друкер DJ (2002). «Структура-функция семейства рецепторов глюкагона, связанных с G-белком, связанных с рецепторами глюкагона, GIP, GLP-1 и GLP-2» (PDF) . Рецепторы и каналы . 8 (3–4): 179–88. дои : 10.1080/10606820213687 . ПМИД 12529935 .
- ^ Андервуд Ч.Р., Гарибай П., Кнудсен Л.Б., Хаструп С., Петерс Г.Х., Рудольф Р., Ридц-Рунге С. (январь 2010 г.). «Кристаллическая структура глюкагоноподобного пептида-1 в комплексе с внеклеточным доменом рецептора глюкагоноподобного пептида-1» . Журнал биологической химии . 285 (1): 723–30. дои : 10.1074/jbc.M109.033829 . ПМК 2804221 . ПМИД 19861722 .
- ^ Сун Дж., Ян Д., Ван Ю., де Грааф С., Чжоу Ц., Цзян С. и др. (июнь 2017 г.). «Трансмембранная доменная структура человеческого рецептора GLP-1 в комплексе с аллостерическими модуляторами». Природа . 546 (7657): 312–315. Бибкод : 2017Natur.546..312S . дои : 10.1038/nature22378 . ПМИД 28514449 . S2CID 2141649 .
- ^ Jump up to: а б Вуттен Д., Рейнольдс К.А., Кул С., Смит К.Дж., Мобарек Дж.К., Симмс Дж. и др. (март 2016 г.). «Полярная сеть с водородными связями в ядре рецептора глюкагоноподобного пептида-1 является точкой опоры для предвзятого агонизма: уроки кристаллических структур класса B» . Молекулярная фармакология . 89 (3): 335–47. дои : 10.1124/моль.115.101246 . ПМК 4767408 . ПМИД 26700562 .
- ^ Jump up to: а б Вуттен Д., Рейнольдс К.А., Смит К.Дж., Мобарек Дж.К., Кул С., Сэвидж Э.Э. и др. (июнь 2016 г.). «Внеклеточная поверхность рецептора GLP-1 является молекулярным триггером предвзятого агонизма» . Клетка . 165 (7): 1632–1643. дои : 10.1016/j.cell.2016.05.023 . ПМЦ 4912689 . ПМИД 27315480 .
- ^ Ян Д., де Грааф С., Ян Л., Сонг Г., Дай А., Цай Икс и др. (июнь 2016 г.). «Структурные детерминанты связывания семитрансмембранного домена рецептора глюкагоноподобного пептида-1 (GLP-1R)» . Журнал биологической химии . 291 (25): 12991–3004. дои : 10.1074/jbc.M116.721977 . ПМЦ 4933217 . ПМИД 27059958 .
- ^ Вуттен Д., Рейнольдс К.А., Смит К.Дж., Мобарек Дж.К., Фернесс С.Г., Миллер Л.Дж. и др. (октябрь 2016 г.). «Ключевые взаимодействия консервативных полярных аминокислот, расположенных на трансмембранных спиральных границах в GPCR класса B, модулируют активацию, эффекторную специфичность и смещенную передачу сигналов в рецепторе глюкагоноподобного пептида-1» . Биохимическая фармакология . 118 : 68–87. дои : 10.1016/j.bcp.2016.08.015 . ПМК 5063953 . ПМИД 27569426 .
- ^ Jump up to: а б с д и ж г Магуайр Джей-Джей, Давенпорт АП. «Рецептор GLP-1» . Руководство IUPHAR/BPS по ФАРМАКОЛОГИИ . Международный союз фундаментальной и клинической фармакологии . Проверено 13 сентября 2015 г.
- ^ Кул С., Рейнольдс К.А., Мобарек Дж.К., Хик С., Секстон П.М., Сакмар Т.П. (апрель 2017 г.). «Генетически кодируемые фотосшиватели определяют сайт биологического связывания пептида эксендина-4 в N-концевом домене интактного человеческого рецептора глюкагоноподобного пептида-1 (GLP-1R)» . Журнал биологической химии . 292 (17): 7131–7144. дои : 10.1074/jbc.M117.779496 . ПМЦ 5409479 . ПМИД 28283573 .
- ^ Биггс Е.К., Лян Лян, Нэйлор Дж., Мадалли С., Коллиер Р., Коглан М.П. и др. (март 2018 г.). «Разработка и характеристика нового антитела к глюкагоноподобному рецептору пептида-1» . Диабетология . 61 (3): 711–721. дои : 10.1007/s00125-017-4491-0 . ПМЦ 5890879 . ПМИД 29119245 .
- ^ О'Брайен А., Эндрюс С., Бэйг А.Х., Бортолато А., Браун Дж.Х., Браун Г.А. и др. (09.08.2019). «Идентификация нового аллостерического антагониста GLP-1R HTL26119 с использованием структурного дизайна лекарств». Письма по биоорганической и медицинской химии . 29 (20): 126611. doi : 10.1016/j.bmcl.2019.08.015 . ПМИД 31447084 . S2CID 201749908 .
- ^ Корк СК, Ричардс Дж. Э., Холт МК, Гриббл Ф. М., Рейманн Ф., Трапп С. (октябрь 2015 г.). «Распределение и характеристика клеток, экспрессирующих глюкагоноподобный пептид-1, в мозге мыши» . Молекулярный метаболизм . 4 (10): 718–31. doi : 10.1016/j.molmet.2015.07.008 . ПМЦ 4588458 . ПМИД 26500843 .
- ^ Кинциг К.П., Д'Алессио Д.А., Сили Р.Дж. (декабрь 2002 г.). «Разнообразные роли специфических рецепторов GLP-1 в контроле потребления пищи и реакции на висцеральные заболевания» . Журнал неврологии . 22 (23): 10470–6. doi : 10.1523/JNEUROSCI.22-23-10470.2002 . ПМЦ 6758755 . ПМИД 12451146 .
- ^ Во время MJ, Цао Л., Зузги Д.С., Фрэнсиса Дж.С., Фитцимонса Х.Л., Цзяо X и др. (сентябрь 2003 г.). «Рецептор глюкагоноподобного пептида-1 участвует в обучении и нейропротекции». Природная медицина . 9 (9): 1173–9. дои : 10.1038/nm919 . ПМИД 12925848 . S2CID 10370218 .
- ^ Jump up to: а б Уильямс Э.К., Чанг Р.Б., Штрохлик Д.Э., Уманс Б.Д., Лоуэлл Б.Б., Либерлес С.Д. (июнь 2016 г.). «Сенсорные нейроны, которые обнаруживают растяжение и питательные вещества в пищеварительной системе» . Клетка . 166 (1): 209–21. дои : 10.1016/j.cell.2016.05.011 . ПМЦ 4930427 . ПМИД 27238020 .
- ^ Jump up to: а б с Мартин Б., Голден Э., Карлсон О.Д., Пистел П., Чжоу Дж., Ким В. и др. (февраль 2009 г.). «Эксендин-4 улучшает гликемический контроль, облегчает патологию головного мозга и поджелудочной железы и продлевает выживаемость на мышиной модели болезни Хантингтона» . Диабет . 58 (2): 318–28. дои : 10.2337/db08-0799 . ПМК 2628604 . ПМИД 18984744 .
- ^ Друкер DJ. «Возрождение бета-клеток при диабете 2 типа: функция бета-клеток, сохранение и неогенез» . Слайды PowerPoint . Медскейп.
Дальнейшее чтение
[ редактировать ]- ван Эйл Б., Ланкат-Бутгерайт Б., Боде Х.П., Гёке Р., Гёке Б. (июль 1994 г.). «Передача сигнала рецептора GLP-1, клонированного из инсулиномы человека» . Письма ФЭБС . 348 (1): 7–13. дои : 10.1016/0014-5793(94)00553-2 . ПМИД 7517895 . S2CID 9085188 .
- Лю С, Сунь С, Се Дж, Ли Х, Ли Т, Ву Ц, Чжан Ю, Бай Икс, Ван Дж, Ван Икс, Ли З, Ван В (2022). «Агонист GLP-1R эксендин-4 защищает от геморрагической трансформации, индуцированной rtPA после ишемического инсульта, через сигнальный путь Wnt/β-катенин» . Мол Нейробиол . 59 (6): 3649–3664. дои : 10.1007/s12035-022-02811-9 . ПМЦ 9148281 . ПМИД 35359227 .
- Громада Дж., Рорсман П., Диссинг С., Вульф Б.С. (октябрь 1995 г.). «Стимуляция клонированного человеческого рецептора глюкагоноподобного пептида 1, экспрессируемого в клетках HEK 293, индуцирует цАМФ-зависимую активацию кальций-индуцированного высвобождения кальция» . Письма ФЭБС . 373 (2): 182–6. дои : 10.1016/0014-5793(95)01070-У . ПМИД 7589461 . S2CID 28488846 .
- Вэй Ю, Мойсов С (январь 1995 г.). «Тканеспецифическая экспрессия человеческого рецептора глюкагоноподобного пептида-I: формы мозга, сердца и поджелудочной железы имеют одинаковые выведенные аминокислотные последовательности» . Письма ФЭБС . 358 (3): 219–24. дои : 10.1016/0014-5793(94)01430-9 . ПМИД 7843404 . S2CID 44371465 .
- Ланкат-Бутгерайт Б, Гёке Р, Штёкманн Ф, Цзян Дж, Феманн ХК, Гёке Б (1994). «Обнаружение амидного рецептора глюкагоноподобного пептида 1 (7-36) человека на клеточных мембранах инсулиномного происхождения». Пищеварение . 55 (1): 29–33. дои : 10.1159/000201119 . ПМИД 8112494 .
- Грациано М.П., Эй П.Дж., Борковски Д., Чикки Г.Г., Strader CD (октябрь 1993 г.). «Клонирование и функциональная экспрессия человеческого глюкагоноподобного пептида-1». Связь с биохимическими и биофизическими исследованиями . 196 (1): 141–6. дои : 10.1006/bbrc.1993.2226 . ПМИД 8216285 .
- Стоффель М., Эспиноза Р., Ле Бо М.М., Белл Г.И. (август 1993 г.). «Ген рецептора глюкагоноподобного пептида-1 человека. Локализация на участке хромосомы 6p21 путем флуоресцентной гибридизации in situ и связывания высокополиморфного простого тандемного полиморфизма ДНК с другими маркерами на хромосоме 6». Диабет . 42 (8): 1215–8. дои : 10.2337/диабет.42.8.1215 . ПМИД 8392011 .
- Диллон Дж.С., Танизава Ю., Уилер М.Б., Ленг XH, Лигон Б.Б., Рабин Д.У. и др. (октябрь 1993 г.). «Клонирование и функциональная экспрессия рецептора человеческого глюкагоноподобного пептида-1 (GLP-1)». Эндокринология . 133 (4): 1907–10. дои : 10.1210/endo.133.4.8404634 . ПМИД 8404634 .
- Торенс Б., Поррет А., Бюлер Л., Денг С.П., Морель П., Видманн С. (ноябрь 1993 г.). «Клонирование и функциональная экспрессия человеческого островкового рецептора GLP-1. Демонстрация того, что эксендин-4 является агонистом, а эксендин-(9-39) - антагонистом рецептора». Диабет . 42 (11): 1678–82. дои : 10.2337/диабет.42.11.1678 . ПМИД 8405712 .
- Ланкат-Бутгерайт Б, Гёке Б (1997). «Клонирование и характеристика 5'-фланкирующих последовательностей (промоторной области) гена рецептора GLP-1 человека». Пептиды . 18 (5): 617–24. дои : 10.1016/S0196-9781(97)00001-6 . ПМИД 9213353 . S2CID 29733898 .
- Фримурер Т.М., Байуотер Р.П. (июнь 1999 г.). «Структура интегрального мембранного домена рецептора GLP1» . Белки . 35 (4): 375–86. doi : 10.1002/(SICI)1097-0134(19990601)35:4<375::AID-PROT1>3.0.CO;2-2 . ПМИД 10382665 .
- Хайпенс П., Линг З., Пайпелерс Д., Шуит Ф. (август 2000 г.). «Рецепторы глюкагона на островковых клетках человека способствуют высвобождению инсулина с помощью глюкозы» . Диабетология . 43 (8): 1012–9. дои : 10.1007/s001250051484 . ПМИД 10990079 .
- Хартли Дж.Л., Темпл Г.Ф., Браш Массачусетс (ноябрь 2000 г.). «Клонирование ДНК с использованием сайт-специфической рекомбинации in vitro» . Геномные исследования . 10 (11): 1788–95. дои : 10.1101/гр.143000 . ПМК 310948 . ПМИД 11076863 .
- Сяо Ц, Дженг В., Уиллер М.Б. (декабрь 2000 г.). «Характеристика детерминант, связывающих рецептор глюкагоноподобного пептида-1» . Журнал молекулярной эндокринологии . 25 (3): 321–35. дои : 10.1677/jme.0.0250321 . ПМИД 11116211 .
- Базарсюрен А., Граушопф У., Возны М., Ройш Д., Хоффманн Е., Шефер В. и др. (май 2002 г.). «Складывание in vitro, функциональная характеристика и дисульфидный паттерн внеклеточного домена рецептора GLP-1 человека». Биофизическая химия . 96 (2–3): 305–18. дои : 10.1016/S0301-4622(02)00023-6 . ПМИД 12034449 .
- Токуяма Ю, Мацуи К, Эгашира Т, Нозаки О, Исидзука Т, Канацука А (октябрь 2004 г.). «Пять миссенс-мутаций в гене рецептора глюкагоноподобного пептида 1 у японской популяции» . Исследования диабета и клиническая практика . 66 (1): 63–9. дои : 10.1016/j.diabres.2004.02.004 . ПМИД 15364163 .
- Йоргенсен Р., Мартини Л., Шварц Т.В., Эллинг CE (март 2005 г.). «Характеристика взаимодействия глюкагоноподобного пептида-1 рецептора бета-аррестина 2: фенотип рецептора с высоким сродством» . Молекулярная эндокринология . 19 (3): 812–23. дои : 10.1210/me.2004-0312 . ПМИД 15528268 .
- Махон М.Дж., Шимада М. (январь 2005 г.). «Кальмодулин взаимодействует с цитоплазматическими хвостами рецептора паратироидного гормона 1 и подмножеством рецепторов класса b, связанных с G-белком». Письма ФЭБС . 579 (3): 803–7. дои : 10.1016/j.febslet.2004.12.056 . ПМИД 15670850 . S2CID 6471940 .
- Грааф С., Доннелли Д., Вуттен Д., Лау Дж., Секстон П.М., Миллер Л.Дж. и др. (октябрь 2016 г.). «Глюкагоноподобный пептид-1 и его рецепторы, связанные с белками класса BG: долгий путь к терапевтическим успехам» . Фармакологические обзоры . 68 (4): 954–1013. дои : 10.1124/пр.115.011395 . ПМК 5050443 . ПМИД 27630114 .
- Сун Дж., Ян Д., Ван Ю., де Грааф С., Чжоу Ц., Цзян С. и др. (июнь 2017 г.). «Трансмембранная доменная структура человеческого рецептора GLP-1 в комплексе с аллостерическими модуляторами». Природа . 546 (7657): 312–315. Бибкод : 2017Natur.546..312S . дои : 10.1038/nature22378 . ПМИД 28514449 . S2CID 2141649 .
- Брантон С. (май 2014 г.). «Агонисты рецепторов GLP-1 против ингибиторов DPP-4 при диабете 2 типа: один подход более успешен или предпочтителен, чем другой?» . Международный журнал клинической практики . 68 (5): 557–567. дои : 10.1111/ijcp.12361 . ПМЦ 4238422 . ПМИД 24499291 .
- Доннелли Д. (май 2012 г.). «Структура и функция рецептора глюкагоноподобного пептида-1 и его лигандов» . Британский журнал фармакологии . 166 (1): 27–41. дои : 10.1111/j.1476-5381.2011.01687.x . ПМЦ 3415635 . ПМИД 21950636 .
- Кристу Г.А., Кацики Н., Бланделл Дж., Фрубек Г., Киорцис Д.Н. (июнь 2019 г.). «Семаглутид как многообещающее лекарство от ожирения». Обзоры ожирения . 20 (6): 805–815. дои : 10.1111/обр.12839 . PMID 30768766 . S2CID 73422503 .
Внешние ссылки
[ редактировать ]- «Семейство рецепторов глюкагона: GLP-1» . База данных IUPHAR по рецепторам и ионным каналам . Международный союз фундаментальной и клинической фармакологии. Архивировано из оригинала 3 марта 2016 г. Проверено 25 октября 2007 г.
- глюкагоноподобный + пептид + рецептор Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)
- Обзор всей структурной информации, доступной в PDB для UniProt : P43220 (рецептор глюкагоноподобного пептида 1) на PDBe-KB .