Транспортер магния
Транспортеры магния — это белки , которые транспортируют магний через клеточную мембрану . Все формы жизни требуют магния , но молекулярные механизмы Mg 2+ Поглощение из окружающей среды и распределение этого жизненно важного элемента внутри организма выясняются лишь медленно.
АТФазная функция MgtA сильно зависит от кардиолипина и, как было показано, обнаруживает свободный магний в диапазоне мкМ. [1]
У бактерий Mg 2+ вероятно, в основном поставляется белком CorA [2] и, где белок CorA отсутствует, белок MgtE . [3] [4] У дрожжей первоначальное поглощение осуществляется через белки Alr1p и Alr2p. [5] но на этом этапе единственный внутренний Mg 2+ Идентифицированный распределяющий белок Mrs2p. [6] У простейших только один Mg 2+ транспортер (XntAp) был идентифицирован. [7] У многоклеточных Mrs2p [8] и гомологи MgtE [9] были идентифицированы вместе с двумя новыми Mg 2+ транспортные системы TRPM6/TRPM7 [10] [11] и PCLN-1. [12] Наконец, у растений было идентифицировано семейство гомологов Mrs2p. [13] [14] наряду с другим новым белком AtMHX. [15]
Эволюция
[ редактировать ]Эволюция Mg 2+ Транспорт, по-видимому, был довольно сложным. Белки, по-видимому, основанные на MgtE, присутствуют у бактерий и многоклеточных животных, но отсутствуют у грибов и растений, тогда как белки, очевидно родственные CorA, присутствуют во всех этих группах. Два активных транспортных переносчика, присутствующие у бактерий, MgtA и MgtB, по-видимому, не имеют какой-либо гомологии у высших организмов. Есть еще мг 2+ транспортные системы, присущие только высшим организмам.
Типы
[ редактировать ]Еще предстоит идентифицировать большое количество белков, которые транспортируют Mg. 2+ . Даже у наиболее изученных эукариот, дрожжей, Боррелли [16] сообщил о мг 2+ /ЧАС + обменник без ассоциированного белка, который, вероятно, локализован в аппарате Гольджи. По крайней мере еще один крупный Mg 2+ транспортер в дрожжах до сих пор неизвестен, тот, который влияет на Mg 2+ транспорт в дрожжевую вакуоль и из нее. У высших многоклеточных организмов, по-видимому, много Mg 2+ транспортирующие белки ждут открытия.
CorA-домен, содержащий Mg 2+ транспортеры (CorA, Alr-подобные и Mrs2-подобные) обладают схожим, но не идентичным набором сродства к двухвалентным катионам. Фактически, это наблюдение можно распространить на все Mg. 2+ перевозчики идентифицированы на данный момент. Это сходство позволяет предположить, что основные свойства Mg 2+ сильно влияют на возможные механизмы распознавания и транспорта. Однако это наблюдение также предполагает, что использование ионов других металлов в качестве индикаторов Mg 2+ поглощение не обязательно даст результаты, сравнимые со способностью транспортера транспортировать Mg. 2+ . В идеале, мг 2+ следует измерять непосредственно. [17]
С 28 мг 2+ практически недостижимо, большую часть старых данных придется интерпретировать по-новому с помощью новых инструментов для измерения Mg. 2+ транспорт, если необходимо напрямую сравнивать разные перевозчики. Новаторская работа Колисек [18] и лягушачий душ [19] использование mag-fura 2 показало, что свободный Mg 2+ может быть надежно измерен in vivo в некоторых системах. Вернувшись к анализу CorA с помощью этого нового инструмента, мы получили важную основу для анализа новых Mg. 2+ транспортные системы по мере их открытия. Однако важно, чтобы количество транспортера, присутствующего в мембране, было точно определено, если необходимо провести сравнение транспортных возможностей. Эта бактериальная система также может быть полезна для анализа эукариотического Mg. 2+ транспортные белки, но в любом эксперименте придется учитывать различия биологических систем прокариот и эукариот.
Функция
[ редактировать ]Сравнивая функции охарактеризованного Mg 2+ Транспортные белки в настоящее время практически невозможны, хотя белки исследуются в разных биологических системах с использованием разных методологий и технологий. Найти систему, в которой можно было бы напрямую сравнивать все белки, было бы большим достижением. Если можно было бы доказать, что белки функциональны в бактериях ( S. typhimurium ), тогда комбинация методов mag-fura 2, количественного определения белка в оболочечной мембране и структуры белков (рентгеновские кристаллы или крио-кристаллы) TEM) может позволить определить основные механизмы, участвующие в распознавании и транспортировке Mg. 2+ ион. Однако, возможно, лучшим достижением могла бы стать разработка методов, позволяющих измерять функцию белка в системе «пэтч-кламп» с использованием искусственных мембран.
Бактерии
[ редактировать ]Ранние исследования
[ редактировать ]В 1968 году Ласк [20] описал ограничение роста бактерий ( Escherichia coli ) на Mg. 2+ -плохая среда, что позволяет предположить, что бактериям необходим магний 2+ и, вероятно, активно забирали этот ион из окружающей среды. В следующем году та же группа [21] и еще одна группа, Сильвер, [22] независимо описали поглощение и отток Mg 2+ в метаболически активных E. coli с использованием клетках 28 мг 2+ . К концу 1971 года были опубликованы две статьи, описывающие вмешательство Ко. 2+ , Является 2+ и Мн 2+ о перевозке Mg 2+ в кишечной палочке [23] и у Aerobacter aerogenes и Bacillus megaterium. [24] В ходе последней крупной разработки перед клонированием генов, кодирующих транспортеры, было обнаружено, что существует второй Mg. 2+ система поглощения, которая показала сходство и кинетику транспорта с первой системой, но имела другой диапазон чувствительности к мешающим катионам. Эта система также поддавалась подавлению высокими внеклеточными концентрациями Mg. 2+ . [25] [26]
КорА
[ редактировать ]Ген CorA и соответствующий ему белок являются наиболее изученными Mg. 2+ Транспортная система любого организма. Большая часть опубликованной литературы по гену CorA принадлежит лаборатории М. Е. Магуайра. Недавно группа Р. Дж. Швейена оказала значительное влияние на понимание Mg. 2+ транспорт КорА. Первоначально ген был назван в честь фенотипа устойчивости к кобальту у E. coli , вызванного инактивацией гена. [25]
Ген был генетически идентифицирован в E. coli Park et al. , [26] но не был клонирован до тех пор, пока Хмиэль и др. [2] выделил гомолог серовара Salmonella enterica Typhimurium ( S. typhimurium ). Позже это покажут Смит и Магуайр. [27] что ген CorA присутствовал у 17 грамотрицательных бактерий. Было показано, что благодаря большому количеству полных последовательностей генома прокариот, CorA практически повсеместно распространен среди эубактерий, а также широко распространен среди архей. [28] Локус CorA в E. coli содержит одну открытую рамку считывания из 948 нуклеотидов, производящую белок из 316 аминокислот. Этот белок хорошо сохраняется среди эубактерий и архей. У E. coli и S. typhimurium белки идентичны на 98%, но у более отдаленных видов сходство падает до 15–20%. [28] В более отдаленных генах сходство часто ограничивается С-концевой частью белка, а короткий аминокислотный мотив GMN в этой области очень консервативен. Домен CorA, также известный как PF01544 в базе данных доменов консервативных белков pFAM ( http://webarchive.loc.gov/all/20110506030957/http%3A//pfam.sanger.ac.uk/ ), дополнительно присутствует в широкий спектр высших организмов, и эти транспортеры будут рассмотрены ниже.
Ген CorA конститутивно экспрессируется у S. typhimurium при широком диапазоне внешних воздействий Mg. 2+ концентрации. [29] Однако недавние данные свидетельствуют о том, что активность белка может регулироваться двухкомпонентной регуляторной системой PhoPQ . [30] Этот датчик реагирует на низкий уровень внешнего Mg 2+ концентрации в процессе заражения S. typhimurium у человека. [31] При низком внешнем Mg 2+ Сообщалось, что система PhoPQ подавляет функцию CorA, и ранее было показано, что транскрипция альтернативного Mg 2+ В этих условиях активируются транспортеры MgtA и MgtB. [29] Чамнонгпол и Гройсман предполагают, что это позволяет бактериям избежать токсичности ионов металлов, вызванной транспортом других ионов, особенно Fe (II), с помощью CorA в отсутствие Mg. 2+ . [30] Папп и Магуайр предлагают противоречивые отчеты об источнике токсичности. [32]

На рисунке (не в масштабе) показана первоначально опубликованная топология трансмембранного (ТМ) домена белка CorA S. typhimurium , который, как утверждается, имеет три трансмембранные области в С-концевой части белка (показаны синим цветом). как определено Смитом и соавт. . [33] Доказательства того, что CorA действует как гомотетрамер, были опубликованы Warren et al. в 2004 году. [34] В декабре 2005 года кристаллическая структура канала CorA была размещена в базе данных структуры белков RSCB. Результаты показали, что белок имеет два ТМ-домена и существует в виде гомопентамера, что прямо противоречит более ранним сообщениям. Перейдите по этой ссылке, чтобы увидеть структуру в 3D . Растворимые внутриклеточные части белка сильно заряжены и содержат 31 положительно заряженный и 53 отрицательно заряженных остатка. И наоборот, домены ТМ содержат только одну заряженную аминокислоту, которая, как было показано, не имеет значения для активности транспортера. [35] Из экспериментов по мутагенезу выяснилось, что химический состав Mg 2+ транспорт зависит от гидроксильных групп, выстилающих внутреннюю часть транспортной поры; Также существует абсолютное требование к мотиву GMN (показан красным). [35] [36]
До того, как активность CorA можно было изучить in vivo , любой другой Mg 2+ Транспортные системы бактериального хозяина необходимо было идентифицировать и инактивировать или удалить (см. ниже). Был сконструирован штамм S. typhimurium, содержащий функциональный ген CorA, но не содержащий MgtA и MgtB. [37] (см. также ниже) и анализировали кинетику поглощения переносчика. [38] Этот штамм показал почти нормальную скорость роста на стандартных средах (50 мкМ Mg 2+ ), но удаление всех трех генов создало бактериальный штамм, требующий 100 мМ внешнего Mg. 2+ для нормального роста. [37]
мг 2+ транспортируется в клетки, содержащие только транспортную систему CorA с аналогичной кинетикой и чувствительностью к катионам, что и Mg. 2+ поглощение описано в более ранних статьях и дополнительно оценено количественно. [38] (см. таблицу). Поглощение магния 2+ наблюдалось плато, как и в более ранних исследованиях, и хотя реальный механизм снижения транспорта не был определен, было предположено, что белок инактивирован. [19] Ко 2+ и Ни 2+ токсичны для клеток S. typhimurium , содержащих функциональный белок CorA, и эта токсичность связана с блокированием Mg. 2+ поглощение (конкурентное ингибирование) и накопление этих ионов внутри клетки. [2] Ко 2+ и Ни 2+ с помощью анализа радиоактивных индикаторов было показано, что они переносятся CorA, [2] [39] хотя и с более низкими сродством (км) и скоростями (Vmax), чем для Mg 2+ (см. таблицу). Значения км для Co 2+ и Ни 2+ значительно превышают те, которые, как ожидается, встречаются клетками в их нормальной среде, поэтому маловероятно, что транспортная система CorA опосредует поглощение этих ионов в естественных условиях. [2] На сегодняшний день доказательства существования Mn 2+ транспорт CorA ограничен E. coli . [26]
| мг 2+ | Ко 2+ | В 2+ | |
|---|---|---|---|
| км (мкМ) | 15 | 30 | 240 |
| Vmax (пмоль/мин/10 8 клетки) | 250 | 500 | 360 |
| Ки (мкМ) - Мг | - | - | 10 |
| Ключ (мкМ) - Co | 50 | - | 20 |
| Ки (мкМ) - Mn | 30 | - | - |
| Так (мкМ) - В | 300 | - | 300 |
В таблице представлена кинетика транспорта CorA Mg. 2+ транспортная система. Эта таблица составлена на основе публикаций Snavely et al. (1989б), [38] Гибсон и др. (1991) [39] и Смит и др. (1998а) [35] и суммирует кинетические данные для транспортного белка CorA, экспрессируемого промотором дикого типа в бактериях, лишенных MgtA и MgtB. km и Vmax определяли при 20 °C как поглощение Mg 2+ при 37 °C было слишком быстрым для точного измерения.
Недавно Мг. 2+ -зависимую флуоресценцию mag-fura 2 использовали для измерения свободного Mg 2+ содержание клеток S. typhimurium в ответ на внешний Mg 2+ , который показал, что CorA является основной системой поглощения Mg. 2+ у бактерий. [19] Авторы также впервые показали, что изменения электрического потенциала (ΔΨ) на плазматической мембране клетки влияют как на скорость Mg 2+ поглощение и свободный Mg 2+ содержимое ячейки; деполяризация подавляла транспорт, а гиперполяризация усиливала транспорт. Кинетика транспорта определялась только скоростью изменения свободного Mg 2+ внутри клеток (250 мкМ с −1 ). Поскольку количественная оценка количества белка CorA в мембране не проводилась, это значение нельзя сравнивать с другими экспериментами по Mg. 2+ транспортеры. [18]
Выход Mg 2+ из бактериальных клеток впервые наблюдали Ласк и Кеннеди (1969). [21] и опосредуется CorA Mg 2+ транспортная система при наличии высоких внеклеточных концентраций Mg 2+ . [38] Отток также может быть вызван Co. 2+ , Мн 2+ и Ни 2+ , хотя и не в такой степени, как Mg 2+ . [23] Ну что? 2+ наблюдался отток через транспортную систему CorA. Процесс Mg 2+ для оттока дополнительно требуется один из генов CorB, CorC или CorD. [39] Мутация любого из этих генов приводит к Co. 2+ сопротивление чуть меньше половины того, которое обеспечивает мутант CorA. Этот эффект может быть обусловлен ингибированием Mg 2+ потери, которые в противном случае произошли бы в присутствии высоких уровней Co 2+ . В настоящее время неизвестно, является ли Mg 2+ более токсичен при удалении генов CorBCD.
Было высказано предположение, что Mg 2+ Ион первоначально будет взаимодействовать с любым транспортным белком через его гидратную оболочку. [40] Гексааммин кобальта (III), Co(III)Hex, представляет собой ковалентно связанный (нелабильный) аналог первой гидратной оболочки нескольких двухвалентных катионов, включая Mg. 2+ . Радиус молекулы Co(III)Hex составляет 244 пм, что очень похоже на радиус 250 пм первой гидратной оболочки Mg. 2+ . Этот аналог является мощным ингибитором транспортной системы CorA, в большей степени, чем Mg. 2+ , Ко 2+ или Ни 2+ . [41] Дополнительная сила ингибирования Co(III)Hex может быть связана с блокировкой транспортной поры из-за неспособности белка «обезвоживать» субстрат. Было также показано, что Co(III)Hex не транспортируется в клетки. [41] предполагая, что для транспорта нормального субстрата (Mg 2+ ). Гексааммин никеля (II) с радиусом 255 мкм не ингибировал транспортную систему CorA, что позволяет предположить, что существует предел максимального размера для связывания иона субстрата CorA. [41] Эти результаты позволяют предположить, что важное свойство, участвующее в распознавании Mg 2+ CorA — размер иона с его первой гидратной оболочкой. Следовательно, изменение объема обычно указывается для чистого и гидратированного Mg. 2+ Ион более чем в 500 раз, включая вторую сферу гидратации, может быть не биологически значимым и может быть причиной более частого использования первого изменения объема сферы в 56 раз.
Мгта и МгтБ
[ редактировать ]Присутствие этих двух генов впервые заподозрили, когда Нельсон и Кеннеди (1972) [25] показало, что существуют Mg 2+ -репрессируемый и нерепрессируемый Mg 2+ системы поглощения в E. coli . Неконтролируемое поглощение Mg 2+ опосредован белком CorA. У S. typhimurium подавляемый Mg 2+ В конечном итоге было показано, что поглощение осуществляется через белки MgtA и MgtB. [37]
И MgtA, и MgtB регулируются системой PhoPQ и активно транскрибируются в процессе заражения пациентов-людей S. typhimurium . [31] [42] [43] Хотя ни один из генов не требуется для патогенности, белок MgtB увеличивает долгосрочное выживание патогена в клетке. [44] Гены также активируются in vitro, когда Mg 2+ концентрация падает ниже 50 мкМ (Snavely et al. , 1991a). Хотя значения km у белков аналогичны CorA, а скорость транспорта примерно в 10 раз меньше, гены могут быть частью Mg. 2+ система очистки. Чамнонгпол и Гройсман (2002) представили доказательства того, что роль этих белков может заключаться в компенсации инактивации белка CorA регулоном PhoPQ. [30] Авторы предполагают, что белок CorA инактивируется, чтобы избежать токсичности металлов через белок в условиях с низким содержанием магния. 2+ Среды, S. typhimurium которым подвергаются клетки после заражения.
Оба белка представляют собой АТФазы P-типа. [38] [45] и ни один из генов не имеет никакого сходства с CorA. Белки MgtA и MgtB схожи на 75% (идентичны на 50%), хотя кажется, что MgtB мог быть приобретен путем горизонтального переноса генов как часть острова патогенности сальмонеллы 3. [45] [46] Топология ТМ белка MgtB была определена экспериментально, показав, что белок имеет десять спиралей, охватывающих ТМ, с концами белка в цитоплазме (см. Рисунок). MgtA присутствует в самых разных бактериях, но не так распространен, как CorA, тогда как MgtB, по-видимому, имеет весьма ограниченное распространение. [47] Никаких гипотез необычного распределения предложено не было.

Рисунок адаптирован из Smith et al. (1993б), [48] показана экспериментально определенная топология мембраны белка MgtB у S. typhimurium . Домены ТМ показаны голубым цветом, указана ориентация в мембране и положения N- и C-концев. Рисунок нарисован не в масштабе.
Хотя белки MgtA и MgtB очень похожи, они демонстрируют некоторые незначительные различия в активности. MgtB очень чувствителен к температуре, теряя всякую активность (по отношению к Mg 2+ транспортировке) при температуре 20°С. [38] Кроме того, MgtB и MgtA ингибируются катионами разного диапазона (Таблица A10.1). [38] ).
В таблице приведены характеристики транспорта катионов белков MgtA и MgtB у S. typhimurium , а также кинетические данные для транспортных белков MgtA и MgtB при 37 °C. [38] Значения Vmax, указанные в скобках, относятся к поглощению при 20 °C. Ингибирование Mg 2+ транспорт по Мн 2+ через MgtA показал необычную кинетику (см. рисунок 1 Snavely et al. , 1989b). [38] )
| мг 2+ | Ко 2+ | ||||
|---|---|---|---|---|---|
| км (мкМ) | Vmax (пмоль/мин/10 8 клетки) | Ки (мкМ) | |||
| Ко 2+ | Мин. 2+ | В 2+ | |||
| Мгта | 29 | 115(24) | 40 | х | 30 |
| МгтБ | 6 | 75(<2) | 8 | 40 | 13 |
Белки MgtA и MgtB являются АТФазами, использующими одну молекулу АТФ на транспортный цикл, тогда как MgtB 2+ поглощение через CorA просто электрохимически выгодно. Чамнонгпол и Гройсман (2002) предположили, что белки MgtA и MgtB являются частью системы предотвращения токсичности металлов. [30] С другой стороны, поскольку большинство АТФаз P-типа функционируют как транспортеры, опосредующие отток, было высказано предположение, что белки MgtA и MgtB действуют как белки оттока неидентифицированного в настоящее время катиона, а Mg 2+ Транспорт либо неспецифичен, либо обменен для поддержания электронейтральности процесса транспорта. [49] Для определения физиологической функции этих белков потребуются дальнейшие эксперименты.
МГТЭ
[ редактировать ]| МГТЭ | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Символ | МГТЭ | ||
| Пфам | PF01769 | ||
| ИнтерПро | ИПР006667 | ||
| TCDB | 1.А.26 | ||
| белок OPM | 2yvx | ||
| |||
В двух статьях описывается MgtE, четвертый Mg 2+ поглощаемый белок бактериями, не связанными с MgtA/B или CorA. [3] [4] Этот ген был секвенирован, и ожидается, что белок размером 312 аминокислот будет содержать четыре или пять охватывающих TM доменов, которые тесно расположены в C-концевой части белка (см. Рисунок). Этот участок белка был идентифицирован в базе данных Pfam как консервативный белковый домен (PF01769), и виды, содержащие белки, имеющие этот белковый домен, примерно одинаково распространены среди Eubacteria и Archaea, хотя это довольно редко по сравнению с распространением у Eubacteria и Archaea. КорА. Однако разнообразие белков, содержащих этот домен, значительно больше, чем разнообразие белков, содержащих домен CorA. В базе данных Pfam перечислены семь различных групп белков, содержащих домен MgtE, шесть из которых содержат архаичного или эубактериального члена. Экспрессия MgtE часто контролируется консервативной структурой РНК, лидером YkoK или M-box. [51]
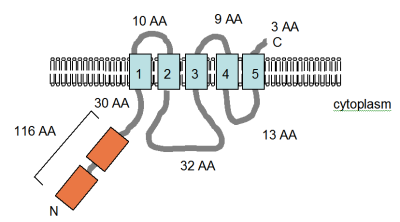
Рисунок (справа), адаптированный из Smith et al. (1995) [4] и запись в базе данных PFAM показывает предсказанную компьютером топологию мембраны белка MgtE в Bacillus Firmus OF4. Домены ТМ показаны голубым цветом. Домены CBS , названные в честь белка, в котором они были идентифицированы, цистатионин-бета-синтазы (показаны оранжевым цветом), идентифицированы в базе данных Pfam как регуляторные домены, но механизм действия еще не описан. Они обнаружены в нескольких потенциалзависимых хлоридных каналах. [52] Указаны ориентация в мембране и положения N- и C-концев. Этот рисунок нарисован не в масштабе. Структура этого транспортера недавно была раскрыта с помощью рентгеновской кристаллографии. [53]
Ген MgtE был впервые идентифицирован Smith et al. (1995) во время скрининга CorA-подобных белков в бактериях и дополняет Mg 2+ -штамм S. typhimurium MM281 с дефицитом поглощения (corA mgtA mgtB), восстанавливающий рост дикого типа на стандартных средах. [4] Кинетика Mg 2+ транспорт белка не определялся, так как 28 мг 2+ был недоступен. В качестве замены используется 57 Ко 2+ был измерен, и было показано, что он имеет км 82 мкМ и Vmax 354 пмоль мин. −1 10 8 клетки −1 . мг 2+ был конкурентным ингибитором с Ki 50 мкМ - Ki Mg. 2+ ингибирование 60 Ко 2+ поглощение через CorA составляет 10 мкМ. [2] Сравнение имеющихся кинетических данных для MgtA и CorA представлено в таблице. Очевидно, что MgtE не транспортирует Co. 2+ в той же степени, что и CorA, и ингибирование транспорта Mg 2+ также менее эффективен, что позволяет предположить, что сродство MgtE к Mg 2+ ниже, чем у CorA. Сильнейший ингибитор Co 2+ поглощение было Zn 2+ , с Ki 20 мкМ. [4] Транспорт цинка 2+ этим белком может быть столь же важным, как и Mg 2+ .
| мг 2+ | Ко 2+ | ||||
|---|---|---|---|---|---|
| км (мкМ) | Vmax (пмоль/мин/10 8 клетки) | км (мкМ) | Vmax (пмоль/мин/10 8 клетки) | К (Мг 2+ ) (мкМ) | |
| МГТЭ | - | - | 82 [4] (при 37 °С) | 354 [4] (при 37 °С) | 50 [4] (при 37 °С) |
| КорА | 15 [38] (при 20 °С) | 250 [38] (при 20 °С) | 30 [2] (при 22 °С) | 500 [2] (при 22 °С) | 10 [2] (при 22 °С) |
В таблице приведено сравнение кинетики транспорта MgtE и CorA, а также указаны значения ключевых кинетических параметров для них. Как показано, данные были получены при различных температурах инкубации. km и Ki существенно не изменяются из-за различной температуры инкубации. И наоборот, Vmax показывает сильную положительную корреляцию с температурой, следовательно, значение Co 2+ Vmax для MgtE напрямую не сопоставим со значениями для CorA.
Дрожжи
[ редактировать ]Ранние исследования
[ редактировать ]Самые ранние исследования, показавшие, что дрожжи поглощают Mg 2+ по-видимому, было сделано Шмидтом и др. (1949). Однако эти авторы показали только измененный дрожжевой Mg. 2+ Содержание таблицы в документе, а выводы отчета полностью касаются метаболизма фосфатов. Серия экспериментов Ротштейна [54] [55] сместили акцент больше на поглощение катионов металлов, показав, что дрожжи поглощают катионы со следующим рядом сродства; мг 2+ , Ко 2+ , Зн 2+ > Мн 2+ > Нет 2+ > Нравится 2+ > Сэр 2+ . Кроме того, было высказано предположение, что транспорт различных катионов осуществляется одной и той же транспортной системой. [55] [56] [57] [58] — ситуация очень похожа на ту, что наблюдается у бактерий.
В 1998 году МакДиармид и Гарднер наконец идентифицировали белки, ответственные за наблюдаемый фенотип транспорта катионов у Saccharomyces cerevisiae . [5] Гены, участвующие в этой системе, и второй митохондриальный Mg 2+ транспортная система, функционально идентифицированная после клонирования гена, описана в разделах ниже.
АЛР1 и АЛР2
[ редактировать ]Два гена, ALR1 и ALR2, были выделены в ходе скрининга Al. 3+ толерантность (резистентность) у дрожжей. [5] Конструкции со сверхэкспрессией, содержащие геномную ДНК дрожжей, вводили в дрожжи дикого типа, и трансформанты проверяли на рост на токсичных уровнях Al. 3+ . Плазмиды, содержащие ALR1 и ALR2, позволяли дрожжам расти в этих условиях.
Белки Alr1p и Alr2p состоят из 859 и 858 аминокислот соответственно и идентичны на 70%. В области С-конца половина этих белков слабо подобна полному белку CorA. Прогнозируемая компьютером топология ТМ Alr1p показана на рисунке. Наличие третьего домена ТМ было предположено МакДиармидом и Гарднером (1998). [5] о силе гомологии последовательностей, а совсем недавно Ли и Гарднер (2006), [59] на основании исследований мутагенеза, что делает топологию ТМ этих белков более похожей на топологию CorA (см. Рисунок). Кроме того, Alr1p содержит консервативный мотив GMN на внешнем конце TM 2 (TM 2'), и мутация метионина (M) в этом мотиве на лейцин (L) привела к потере транспортной способности. [59]
На рисунке показаны две возможные топологии TM Alr1p. Часть A рисунка показывает предсказанную компьютером топологию мембраны белка Alr1p в дрожжах, а часть B показывает топологию Alr1p, основанную на экспериментальных результатах Ли и Гарднера (2006). [59] Местоположение мотива GMN указано красным, а домены TM - голубым. Указаны ориентация в мембране и положения N- и С-концев, различные размеры растворимых доменов указаны в аминокислотах (АА), а ТМ-домены пронумерованы по сходству с CorA. Если какой-либо домен TM отсутствует, остальные домены нумеруются штрихами. Рисунок нарисован не в масштабе.Третий ALR-подобный ген присутствует у S. cerevisiae , и есть два гомологичных гена как у Schizosaccharomyces pombe, так и у Neurospora crassa . Эти белки содержат мотив GMN, аналогичный мотиву CorA, за исключением второго гена N. crassa . Никаких ALR-подобных генов не обнаружено у видов, кроме грибов.
Исследования мембранного фракционирования и слияния зеленого флуоресцентного белка (GFP) установили, что Alr1p локализован в плазматической мембране. [60] [61] Было обнаружено, что локализация Alr1p интернализуется и разрушается в вакуоли в ответ на внеклеточные катионы. мг 2+ , при очень низких внеклеточных концентрациях (100 мкМ; < 10% стандартной среды Mg 2+ контент) и Ко 2+ и Мн 2+ в относительно высоких концентрациях (> 20× стандартных сред) вызывали изменение локализации белка Alr1p, и эффект зависел от функционального убиквитинирования, эндоцитоза и вакуольной деградации. [60] Этот механизм был предложен для регулирования Mg. 2+ поглощение дрожжами. Однако недавний отчет [61] указывает на то, что некоторые наблюдения, сделанные Stadler et al. [60] не были воспроизводимы. [61] Например, регуляция накопления мРНК ALR1 с помощью Mg 2+ поставка не наблюдалась, и стабильность белка Alr1 не снижалась под воздействием избытка Mg. 2+ . Первоначальное наблюдение Mg-зависимого накопления белка Alr1 в стационарных условиях с низким содержанием Mg было воспроизведено, но было показано, что этот эффект является артефактом, вызванным добавлением небольшого пептида (эпитопа) к белку, чтобы обеспечить его обнаружение. . Несмотря на эти проблемы, было продемонстрировано, что активность Alr1 реагирует на поставку Mg. [61] что позволяет предположить, что активность белка регулируется напрямую, как это наблюдалось для некоторых бактериальных белков CorA. [19]
Функциональный Alr1p (дикий тип) или Alr2p (сверхэкспрессированный) необходим для роста S. cerevisiae в стандартных условиях (4 мМ Mg 2+ [5] ), а Alr1p может поддерживать нормальный рост при Mg 2+ концентрации всего 30 мкМ. [60] 57 Ко 2+ поглощается дрожжами через белок Alr1p с км 77 – 105 мкМ (; [56] К. МакДиармид и Р. К. Гарднер, неопубликованные данные), но Ki для Mg 2+ ингибирование этого транспорта в настоящее время неизвестно. Транспорт других катионов белком Alr1p оценивали по ингибированию роста дрожжей. Сверхэкспрессия Alr1p привела к повышению чувствительности к Ca. 2+ , Ко 2+ , С 2+ , 3+ , Мн 2+ , Является 2+ и цинк 2+ , набор катионов, подобных тем, которые, как было показано, транспортируются в дрожжи с помощью CorA-подобной транспортной системы. [5] Предполагается, что повышенная токсичность катионов в присутствии переносчика обусловлена повышенным накоплением катиона внутри клетки.
Доказательства того, что Alr1p представляет собой прежде всего Mg 2+ транспортера заключается в том, что потеря Alr1p приводит к снижению общего содержания в клетках Mg 2+ , но не других катионов. Кроме того, два электрофизиологических исследования, в которых Alr1p продуцировался в ооцитах дрожжей или Xenopus, показали наличие Mg 2+ -зависимый ток в присутствии белка; [62] Салих и др. , в стадии подготовки
Кинетика Mg 2+ поглощение Alr1p было исследовано электрофизиологическими методами на целых дрожжевых клетках. [62] Результаты показали, что Alr1p, скорее всего, будет действовать как ион-селективный канал. В той же статье авторы сообщили, что Mg 2+ Транспорт Alr1p варьировал от 200 до 1500 пА при среднем токе 264 пА. Количественная оценка количества белка, вырабатывающего ток, не была представлена, поэтому результаты несопоставимы с бактериальным Mg. 2+ транспортные белки.
Альтернативные методы 28 мг 2+ радиофармпрепаратный анализ и маг-фура 2 для измерения магния 2+ поглощение еще не использовалось с Alr1p. 28 мг 2+ в настоящее время недоступна, и система mag-fura 2 вряд ли предоставит простые данные об усвоении дрожжами. Дрожжевая клетка поддерживает гетерогенное распределение Mg. 2+ [63] предполагая, что несколько систем внутри дрожжей транспортируют Mg 2+ в отсеки для хранения. Этот внутренний транспорт, скорее всего, будет маскировать процесс поглощения. Экспрессия ALR1 у S. typhimurium без Mg 2+ Альтернативой могут быть гены поглощения, но, как указывалось ранее, необходимо принимать во внимание эффекты гетерологичной системы экспрессии.
МНР2
[ редактировать ]Ген MNR2 кодирует белок, тесно связанный с белками Alr, но включает консервативные особенности, которые определяют отдельную подгруппу белков CorA в геномах грибов, что позволяет предположить особую роль в Mg. 2+ гомеостаз. Как и мутант alr1, рост мутанта mnr2 был чувствителен к Mg. 2+ -дефицитных условиях, но у мутанта mnr2 наблюдалось накопление большего количества Mg 2+ чем штамм дикого типа в этих условиях. [64] Эти фенотипы позволяют предположить, что Mnr2 может регулировать Mg. 2+ хранение во внутриклеточном компартменте. В соответствии с этой интерпретацией, белок Mnr2 был локализован на мембране вакуоли, внутреннего отсека, участвующего в хранении избыточных минеральных питательных веществ дрожжами. Прямая роль Mnr2 в Mg 2+ Транспорт был предположен на основании наблюдения, что повышенная экспрессия Mnr2, которая перенаправляла часть белка Mnr2 на поверхность клетки, также подавляла Mg. 2+ - потребность в двойном мутантном штамме alr1 alr2. Мутация mnr2 также изменила накопление других двухвалентных катионов, что позволяет предположить, что эта мутация может увеличивать экспрессию гена Alr или активность белка. Недавняя работа [61] поддержал эту модель, показав, что активность Alr1 была увеличена в мутантном штамме mnr2 и что мутация была связана с индукцией активности Alr1 при более высокой внешней концентрации Mg, чем наблюдалось для штамма Mnr2 дикого типа. Эти эффекты наблюдались без каких-либо изменений в накоплении белка Alr1, что еще раз указывает на то, что активность Alr1 может регулироваться непосредственно концентрацией Mg внутри клетки.
МРС2 и Лпе10
[ редактировать ]Как и гены ALR, ген MRS2 был клонирован и секвенирован, прежде чем он был идентифицирован как Mg. 2+ транспортер. Ген MRS2 был идентифицирован в ядерном геноме дрожжей при скрининге супрессоров мутации сплайсинга РНК митохондриального гена. [65] и был клонирован и секвенирован Wiesenberger et al. (1992). [66] Mrs2p не был идентифицирован как предполагаемый Mg. 2+ транспортер до Bui et al. (1999). [6] Греган и др. (2001a) идентифицировали LPE10 по гомологии с MRS2 и показали, что мутанты LPE10 и MRS2 изменяют Mg 2+ содержание митохондрий дрожжей и влияло на активность сплайсинга РНК в органелле. [67] [68] мг 2+ Было показано, что транспорт напрямую опосредован Mrs2p, [18] но не для Lpe10p.
Белки Mrs2p и Lpe10p имеют размер 470 и 413 аминокислотных остатков соответственно, а область из 250–300 аминокислот в середине белков демонстрирует слабое сходство с полным белком CorA. Топологии ТМ белков Mrs2p и Lpe10p были оценены с помощью анализа протеазной защиты. [6] [67] и показаны на рисунке. ТМ 1 и 2 соответствуют ТМ 2 и 3 в белке CorA. Консервативный мотив GMN находится на внешнем конце первого домена TM, и когда глицин (G) в этом мотиве был мутирован на цистеин (C) в Mrs2p, Mg 2+ транспорт сильно сократился. [18]
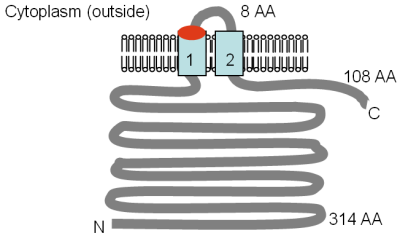
На рисунке показана экспериментально определенная топология Mrs2p и Lpe10p, адаптированная из Bui et al. (1999) [6] и Греган и др. (2001а). [67] Местоположение мотива GMN указано красным, а домены TM - голубым. Указаны ориентация в мембране и положения N- и C-концев. Различные размеры растворимых доменов указаны в аминокислотах (АА), ТМ-домены пронумерованы, рисунок изображен не в масштабе.
Mrs2p был локализован на внутренней мембране митохондрий с помощью субклеточного фракционирования и иммунодетекции. [6] и Lpe10p в митохондрии. [67] Митохондрии, лишенные Mrs2p, не демонстрируют быстрого Mg. 2+ поглощения, только медленная «утечка», а избыточное накопление Mrs2p приводит к увеличению начальной скорости поглощения. [18] Кроме того, CorA при слиянии с митохондриальной лидерной последовательностью Mrs2p может частично дополнять митохондриальный дефект, возникающий в результате потери Mrs2p или Lpe10p. Следовательно, Mrs2p и/или Lpe10p могут быть основными Mg. 2+ Система поглощения митохондрий. Возможно, белки образуют гетеродимеры, поскольку ни один белок (при сверхэкспрессии) не может полностью компенсировать потерю другого. [67]
Характеристики магния 2+ поглощение Mrs2p в изолированных митохондриях определяли количественно с помощью mag-fura 2. [18] Поглощение магния 2+ автор Mrs2p разделяет ряд атрибутов с CorA. Во-первых, мг 2+ поглощение напрямую зависело от электрического потенциала (ΔΨ) через пограничную мембрану. Во-вторых, насыщение поглощения намного ниже того, которое теоретически допускает ΔΨ, поэтому транспорт Mg 2+ Mrs2p, вероятно, будет регулироваться аналогично CorA, возможно, за счет инактивации белка. В-третьих, мг 2+ отток наблюдался через Mrs2p при искусственной деполяризации митохондриальной мембраны валиномицином. Наконец, мг 2+ потоки через Mrs2p ингибируются гексааммином кобальта (III). [18]
Кинетика Mg 2+ поглощение Mrs2p было определено Froschauer et al. (2004) статья о CorA у бактерий. [19] Первоначальное изменение свободного Mg 2+ концентрация составляла 150 мкМ с-1 для дикого типа и 750 мкМ с-1 для митохондрий дрожжей, сверхэкспрессирующих MRS2. Не было предпринято никаких попыток масштабировать наблюдаемый транспорт до количества присутствующих транспортеров.
Простейшие ( парамеции )
[ редактировать ]Транспортировка Mg 2+ в Paramecium был охарактеризован в основном Р. Р. Престоном и его сотрудниками. Электрофизиологические методы на цельных парамециях использовались для идентификации и характеристики Mg. 2+ течения в серии статей [69] [70] [71] [72] до того, как ген был клонирован Haynes et al. (2002). [7]
Открытая рамка считывания гена XNTA имеет размер 1707 п.о., содержит два интрона и производит предсказанный белок из 550 аминокислот. [7] Было предсказано, что белок будет содержать 11 доменов TM, а также мотивы α1 и α2 (см. рисунок) SLC8 ( Na+/Ca 2+ обменник [73] ) и SLC24 ( K+-зависимый Na+/Ca 2+ обменник [74] ) белки-переносчики растворенных веществ человека. XntAp одинаково похож на семейства белков SLC8 и SLC24 по аминокислотной последовательности, но предсказанная топология TM больше похожа на топологию SLC24, но сходство в лучшем случае слабое, а связь очень отдаленная. [7] Растительный белок AtMHX также имеет отдаленное родство с белками SLC8.
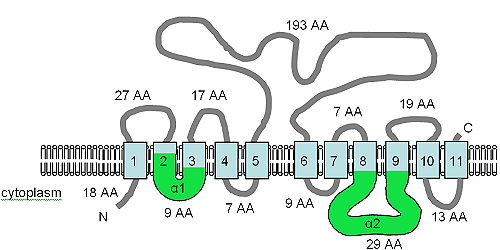
На рисунке показана прогнозируемая топология TM XntAp. Адаптировано из Haynes et al. (2002), [7] на этом рисунке показана предсказанная компьютером топология мембраны XntAp в Paramecium. Ориентацию в мембране определяли с помощью HMMTOP. [75] [76] Домены TM показаны голубым цветом, домены α1 и α2 показаны зеленым. Ориентация в мембране и положения N- и C-концев указаны, рисунок не выполнен в масштабе.
мг 2+ -зависимые токи, переносимые XntAp, кинетически подобны таковым белка канала и имеют порядок ионной селективности Mg. 2+ > Что 2+ , Мн 2+ > Нравится 2+ — серия снова очень похожа на серию CorA. [72] В отличие от других транспортных белков, о которых сообщалось до сих пор, XntAp зависит от внутриклеточного Ca. 2+ . Транспорт также зависит от ΔΨ, но опять же Mg 2+ не транспортируется к равновесию, ограничиваясь примерно 0,4 мМ свободного Mg. 2+ в цитоплазме. Существование внутриклеточного компартмента с гораздо более высокой концентрацией свободного магния 2+ (8 мМ) было подтверждено результатами.
Животные
[ редактировать ]Расследование Мг. 2+ у животных, включая человека, отстает от такового у бактерий и дрожжей. Во многом это связано со сложностью задействованных систем, а также из-за того, что в этой области сложилось впечатление, что Mg 2+ сохранялся на высоком уровне во всех клетках и не изменялся под воздействием внешних воздействий. Только за последние 25 лет серия отчетов начала оспаривать эту точку зрения, а новые методологии обнаружили, что свободный Mg 2+ содержание поддерживается на уровне, при котором изменения могут повлиять на клеточный метаболизм. [77]
МРС2
[ редактировать ]Биоинформатический поиск в базах данных последовательностей выявил один гомолог гена MRS2 дрожжей у ряда многоклеточных животных. [8] Белок имеет очень похожую последовательность и предсказанную топологию TM на дрожжевой белок, а мотив GMN не поврежден в конце первого домена TM. Человеческий белок hsaMrs2p был локализован на митохондриальной мембране клеток мыши с помощью слитого белка GFP.
О Mg известно очень мало. 2+ транспортные характеристики белка у млекопитающих, но Zsurka et al. (2001) показали, что человеческий Mrs2p дополняет мутанты mrs2 в митохондриях дрожжей Mg. 2+ система поглощения. [8]
SLC41 (МгтЭ)
[ редактировать ]Идентификация этого семейства генов у многоклеточных животных началась с метода ловушки сигнальной последовательности для выделения секретируемых и мембранных белков. [9] Большая часть идентификации была получена в результате биоинформационного анализа. Три гена в конечном итоге были идентифицированы у людей, еще три у мышей и три у Caenorhabditis elegans , а также один ген у Anopheles gambiae . В базе данных pFAM домен MgtE указан как pFAM01769, а также идентифицируется белок, содержащий домен MgtE, у Drosophila melanogaster . Белки, содержащие домен MgtE, можно разделить на семь классов, как это определено pFAM с использованием типа и организации идентифицируемых доменов в каждом белке. Белки многоклеточных животных присутствуют в трех из семи групп. Все белки многоклеточных животных содержат два домена MgtE, но некоторые из них были предсказаны только с помощью контекстного распознавания (Coin, Bateman and Durbin, неопубликовано. Дополнительную информацию см. на веб-сайте pFAM).
Человеческий белок SLC41A1 содержит два домена MgtE со сходством на 52% и 46% соответственно с консенсусной последовательностью PF01769 и, по прогнозам, будет содержать десять доменов TM, по пять в каждом домене MgtE (см. рисунок), что позволяет предположить, что белок MgtE бактерий может работать как димер.

Адаптировано из Wabakken et al. (2003) [9] и базы данных pFAM, на рисунке показана предсказанная компьютером топология мембраны MgtE у H. sapiens . Домены ТМ показаны голубым цветом, указана ориентация в мембране и положения N- и С-концев, рисунок приведен не в масштабе.
Вабаккен и др. (2003) [9] обнаружили, что транскрипт гена SLC41A1 экспрессировался во всех протестированных тканях человека, но на разных уровнях, при этом в сердце и семенниках наблюдалась самая высокая экспрессия гена. Никакого объяснения характера экспрессии Mg не было предложено. 2+ - связанная физиология.
Не было показано, транспортируют ли белки SLC41 Mg. 2+ или дополнить Mg 2+ транспортная мутация в любой экспериментальной системе. Однако было высказано предположение, что, поскольку белки MgtE не имеют других известных функций, они, вероятно, представляют собой MgtE. 2+ транспортеры у многоклеточных животных, как и у бактерий. [9] Это необходимо будет проверить, используя одну из теперь стандартных экспериментальных систем для изучения Mg. 2+ транспорт.
ТРПМ6/ ТРПМ7
[ редактировать ]Исследование генов и белков TRPM в клетках человека является областью недавних интенсивных исследований, а иногда и дискуссий. Монтелл и др. (2002) [78] рассмотрели исследования генов TRP и второй обзор Монтелла (2003). [79] рассмотрел исследования генов TRPM.
Семейство ионных каналов TRPM имеет представителей во всех многоклеточных организмах. Белки TRPM6 и TRPM7 весьма необычны: они содержат как домен ионного канала, так и киназный домен (рис. 1.7), роль которых вызывает самые жаркие споры. [79]
Активность этих двух белков очень трудно определить количественно. TRPM7 сам по себе является Ca 2+ канал [80] но в присутствии TRPM6 ряд сродства транспортируемых катионов помещает Mg 2+ выше Са 2+ . [10] [81] Различия в зарегистрированной проводимости были вызваны характером экспрессии этих генов. TRPM7 экспрессируется во всех протестированных на данный момент типах клеток, тогда как TRPM6 демонстрирует более ограниченный характер экспрессии. [82] Неудачный выбор экспериментальной системы Voets et al. , (2004) [83] привели к выводу, что TRPM6 представляет собой функциональный Mg 2+ транспортер. Однако более поздняя работа Чубанова с соавт. (2004) [82] ясно показали, что TRPM7 необходим для активности TRPM6 и что результаты Voets et al. объясняются экспрессией TRPM7 в экспериментальной клеточной линии, использованной Voets et al. в своих экспериментах. Функционален ли TRPM6 сам по себе, еще предстоит определить.

Предсказанная топология ТМ белков TPRM6 и TRPM7 была адаптирована из работы Nadler et al. (2001), [10] Раннелс и др. (2001) [84] и Монтелл и др. (2002), [78] На этом рисунке показана предсказанная компьютером топология мембран белков TRPM6 и TRPM7 у человека разумного . На данный момент показанную топологию следует рассматривать как предварительную гипотезу. Домены TM показаны голубым цветом, петля поры - фиолетовым, мотив TRP - красным, а киназный домен - зеленым. Ориентация в мембране и положения N- и C-концев указаны, рисунок не выполнен в масштабе.
Выводы Voets et al. (2004) [83] статьи, вероятно, неверны в приписывании Mg 2+ зависят токи только от TRPM7, и их кинетические данные, вероятно, отражают комбинированный канал TRPM7/TRPM6. В отчете представлена надежная коллекция данных, соответствующая канальной активности, передающей Mg 2+ , основанный как на электрофизиологических методах, так и на mag-fura 2 для определения изменений содержания свободного Mg в цитоплазме. 2+ .
Парацеллюлярный транспорт
[ редактировать ]Клаудины допускают Mg 2+ транспорт через парацеллюлярный путь; то есть он опосредует транспорт ионов через плотные соединения между клетками, которые образуют слой эпителиальных клеток. В частности, Клаудин-16 обеспечивает избирательный обратный захват магния. 2+ в почке человека. У некоторых пациентов с мутациями гена CLDN19 также нарушен транспорт магния. [85] [86]
Ген Claudin-16 был клонирован Simon et al. (1999), [12] но только после серии сообщений, описывающих Mg 2+ течет сам по себе без гена или белка. [87] [88] [89] Характер экспрессии гена был определен с помощью RT-PCR, и было показано, что он очень тесно ограничен непрерывной областью почечных канальцев, идущей от толстого нисходящего отдела медуллярного мозга к дистальному извитому канальцу. [12] Эта локализация соответствовала более ранним сообщениям о местонахождении Mg. 2+ повторный захват почками. В результате клонирования мутации в гене были выявлены у пациентов с семейной гипомагниемией с гиперкальциурией и нефрокальцинозом. [90] [91] укрепление связей между геном и усвоением Mg 2+ .
Растения
[ редактировать ]Современные знания о молекулярных механизмах образования Mg 2+ Транспорт в растениях очень ограничен: только в трех публикациях сообщается о молекулярной основе Mg. 2+ транспорт в растениях. [13] [14] [15] Однако важность Mg 2+ на растения хорошо описано, а физиологические и экофизиологические исследования воздействия Mg 2+ многочисленны. В этом разделе будут обобщены знания о семействе генов, выявленных у растений и отдаленно связанных с CorA. Другой ген, Mg 2+ /ЧАС + обменник (AtMHX [15] ), не связанный с этим семейством генов и с CorA, также был идентифицирован, локализован в вакуолярной мембране и будет описан последним.
Семейство генов AtMRS2
[ редактировать ]Шок и др. (2000) идентифицировали и назвали семейство AtMRS2 на основании сходства генов с геном MRS2 дрожжей. [13] Авторы также показали, что ген AtMRS2-1 может дополнять мутантный фенотип дрожжей Δmrs2. Независимо Li et al. (2001) [14] опубликовал отчет, идентифицирующий семью и показывающий, что два дополнительных члена могут дополнить Mg. 2+ мутанты с дефицитом транспорта, один у S. typhimurium , а другой у S. cerevisiae .
Три гена, которые, как было показано, транспортируют Mg 2+ являются AtMRS2-1, AtMRS2-10 и AtMRS2-11, и эти гены продуцируют белки размером 442, 443 и 459 аминокислот соответственно. Каждый из белков демонстрирует значительное сходство с Mrs2p дрожжей и слабое сходство с CorA бактерий, содержит консервативный аминокислотный мотив GMN на внешнем конце первого домена TM и, как ожидается, будет иметь два домена TM.
Ген AtMRS2-1, экспрессированный в дрожжах с промотора MRS2 и слитый на С-конце с первыми 95 аминокислотами белка Mrs2p, был направлен в митохондрии, где он фенотипически дополнял мутант Δmrs2 (сплайсинг митохондриальной РНК восстановлен) и по отношению к Mg 2+ содержимое органеллы. [13] Данных о кинетике транспорта не представлено. Ген AtMRS2-11 был проанализирован на дрожжах (штамм alr1 alr2), где было показано, что экспрессия гена значительно увеличивает скорость синтеза Mg. 2+ поглощение голодающими клетками по сравнению с контролем, измеренное с помощью пламенной атомно-абсорбционной спектроскопии общего клеточного Mg 2+ содержание. Однако было показано, что Alr1p значительно более эффективен при транспортировке Mg. 2+ при низких внеклеточных концентрациях, что позволяет предположить, что сродство AtMRS2-11 к Mg 2+ ниже, чем у Alr1p. [14] Электрофизиологический (зажим напряжения) анализ белка AtMRS2-11 в ооцитах Xenopus также показал содержание Mg. 2+ -зависимый ток при мембранных потенциалах (ΔΨ) внутри –100 – –150 мВ. [92] Эти значения физиологически значимы, поскольку некоторые мембраны растений поддерживают ΔΨ в этом диапазоне. Однако автору было трудно воспроизвести эти результаты из-за явной «смерти» ооцитов, содержащих белок AtMRS2-11, и поэтому к этим результатам следует относиться с осторожностью.
Транспортер AtMRS2-10 был проанализирован с использованием анализа поглощения радиоактивных индикаторов. [14] 63Ни 2+ использовался в качестве иона-заместителя, а Mg 2+ было показано, что он ингибирует поглощение 63Ni. 2+ с Ki 20 мкМ. Поглощение также ингибировалось Co(III)Hex и другими двухвалентными катионами. Только Ко 2+ и Cu 2+ ингибировал транспорт при значениях Ki менее 1 мМ.
Белок AtMRS2-10 был слит с GFP, и было показано, что он локализован на плазматической мембране. [14] Подобный эксперимент был предпринят в Schock et al. (2000) бумага, [13] но наблюдаемая локализация существенно не отличалась от локализации, наблюдаемой при использовании неслитого GFP. Наиболее вероятная причина отсутствия окончательной локализации AtMRS2-1 в работе Schock et al. В статье говорится, что авторы удалили ТМ-домены из белка, тем самым предотвратив его встраивание в мембрану.
Точное физиологическое значение белков AtMRS2-1 и AtMRS2-10 в растениях еще предстоит выяснить. Ген AtMRS2-11 сверхэкспрессируется (с промотора 35S CaMV) у A. thaliana. [92] Было показано, что трансгенная линия накапливает высокие уровни транскрипта AtMRS2-11. Сильный мг 2+ дефицитный фенотип (некротические пятна на листьях, см. главу 1.5 ниже) был зафиксирован в процессе скрининга (как в поколениях Т1, так и в поколениях Т2) гомозиготной линии, но этот фенотип был утерян в поколении Т3 и не мог быть воспроизведен при предыдущие поколения были проверены во второй раз. Автор предположил, что наиболее вероятной причиной противоречивого фенотипа было воздействие окружающей среды.
ИMHX
[ редактировать ]AtMHX, первый переносчик магния, выделенный в любом многоклеточном организме, не имеет сходства с каким-либо ранее выделенным Mg. 2+ транспортный белок. [15] Ген был первоначально идентифицирован в базе данных последовательностей геномной ДНК A. thaliana из-за его сходства с семейством SLC8 Na+/Ca. 2+ обменные гены у человека.
Предполагается, что последовательность кДНК длиной 1990 п.н. будет производить белок из 539 аминокислот. AtMHX весьма тесно связан с семейством SLC8 на уровне аминокислот и разделяет топологию с одиннадцатью предсказанными доменами TM (рис. A10.5). Существует одно существенное отличие в последовательности: длинная немембранная петля (см. рисунок A10.5) состоит из 148 аминокислот в белке AtMHX и 500 аминокислот в белках SLC8. Однако эта петля недостаточно консервативна и не требуется для транспортной функции в семействе SLC8. [15]
Ген AtMHX экспрессируется по всему растению, но наиболее сильно в сосудистой ткани. [15] Авторы предполагают, что физиологическая роль белка заключается в хранении Mg. 2+ в этих тканях для последующего высвобождения при необходимости. Локализация белка на вакуолярной мембране подтверждает это предположение (см. также главу 1.5).
Белок транспортирует Mg 2+ в вакуолярное пространство и H + из, как показали электрофизиологические методы. [15] Транспорт осуществляется за счет ΔpH, поддерживаемого между вакуолярным пространством (pH 4,5–5,9) и цитоплазмой (pH 7,3–7,6) с помощью H + -АТФаза. [93] [94] Как транспортируется Mg 2+ белком регулируется не было определено. Было замечено, что токи проходят через белок в обоих направлениях, но Mg 2+ Для тока требовался «цитоплазматический» pH 5,5, состояние, не встречающееся в растительных клетках при нормальных обстоятельствах. Помимо перевозки Mg 2+ , Шауль и др. (1999) [15] также показало, что белок может транспортировать Zn 2+ и Fe 2+ , но не сообщили о способности белка транспортировать другие двухвалентные катионы (например, Co 2+ и Ни 2+ ) или его чувствительность к ингибированию гексааммином кобальта (III).
Подробная кинетика Mg 2+ транспорт для AtMHX не определен. Однако были продемонстрированы физиологические эффекты. Когда растения A. thaliana были трансформированы конструкциями сверхэкспрессии гена AtMHX, управляемыми промотором CaMV 35S, растения избыточно накапливали белок и демонстрировали фенотип некротических поражений листьев, что, по мнению авторов, вызвано нарушением нормальная функция вакуоли, учитывая их наблюдение, что общий Mg 2+ (или Zn 2+ ) содержание растений в трансгенных растениях не менялось.
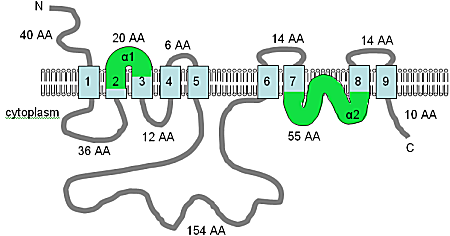
Изображение было адаптировано из Shaul et al. (1999) [15] и Кведнау и др. (2004), [73] В сочетании с анализом с использованием HMMTOP на этом рисунке показана предсказанная компьютером топология мембраны белка AtMHX у Arabidopsis thaliana . На данный момент показанную топологию следует рассматривать как предварительную гипотезу. Домены ТМ показаны голубым цветом, указана ориентация в мембране и положения N- и С-концев, рисунок приведен не в масштабе. Домены α1 и α2, показанные зеленым, оба достаточно гидрофобны и оба могут быть вставлены в мембрану.
Ссылки
[ редактировать ]- ^ Субрамани, Саранья; Пердро-Даль, Гармония; Морт, Йенс Пребен (01 января 2016 г.). «Переносчик магния А активируется кардиолипином и очень чувствителен к свободному магнию in vitro» . электронная жизнь . 5 . дои : 10.7554/eLife.11407 . ISSN 2050-084X . ПМЦ 4758953 . ПМИД 26780187 .
- ^ Перейти обратно: а б с д и ж г час я Хмиэль С.П., Снавли, доктор медицинских наук, Миллер К.Г., Магуайр М.Э. (декабрь 1986 г.). «Транспорт магния у Salmonella typhimurium: характеристика притока магния и клонирование транспортного гена» . Журнал бактериологии . 168 (3): 1444–50. дои : 10.1128/jb.168.3.1444-1450.1986 . ПМК 213658 . ПМИД 3536881 .
- ^ Перейти обратно: а б Таунсенд Д.Э., Эсенвайн А.Дж., Джордж Дж., Бросс Д., Магуайр М.Э., Смит Р.Л. (сентябрь 1995 г.). «Клонирование транспортера mgtE Mg2+ из Providencia stuartii и распределение mgtE в грамотрицательных и грамположительных бактериях» . Журнал бактериологии . 177 (18): 5350–4. дои : 10.1128/jb.177.18.5350-5354.1995 . ПМК 177332 . ПМИД 7665526 .
- ^ Перейти обратно: а б с д и ж г час Смит Р.Л., Томпсон Л.Дж., Магуайр М.Э. (март 1995 г.). «Клонирование и характеристика MgtE, предполагаемого нового класса переносчика Mg2 + из Bacillus Firmus OF4» . Журнал бактериологии . 177 (5): 1233–8. дои : 10.1128/jb.177.5.1233-1238.1995 . ПМК 176728 . ПМИД 7868596 .
- ^ Перейти обратно: а б с д и ж МакДиармид CW, Гарднер RC (январь 1998 г.). «Сверхэкспрессия системы транспорта магния Saccharomyces cerevisiae придает устойчивость к ионам алюминия» . Журнал биологической химии . 273 (3): 1727–32. дои : 10.1074/jbc.273.3.1727 . ПМИД 9430719 .
- ^ Перейти обратно: а б с д и Буй Д.М., Греган Дж., Ярош Э., Рагнини А., Швейен Р.Дж. (июль 1999 г.). «Бактериальный переносчик магния CorA может функционально заменять своего предполагаемого гомолога Mrs2p во внутренней митохондриальной мембране дрожжей» . Журнал биологической химии . 274 (29): 20438–43. дои : 10.1074/jbc.274.29.20438 . ПМИД 10400670 .
- ^ Перейти обратно: а б с д и Хейнс В.Дж., Кунг С., Сайми Ю., Престон Р.Р. (ноябрь 2002 г.). «Обменникоподобный белок лежит в основе большого тока Mg2+ в Paramecium» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (24): 15717–22. Бибкод : 2002PNAS...9915717H . дои : 10.1073/pnas.242603999 . ПМК 137782 . ПМИД 12422021 .
- ^ Перейти обратно: а б с Зсурка Г., Греган Дж., Швейен Р.Дж. (март 2001 г.). «Человеческий митохондриальный белок Mrs2 функционально заменяет своего дрожжевого гомолога, кандидата в переносчик магния». Геномика . 72 (2): 158–68. дои : 10.1006/geno.2000.6407 . ПМИД 11401429 .
- ^ Перейти обратно: а б с д и Вабаккен Т., Риан Э., Квейне М., Аасхайм ХК (июль 2003 г.). «Человеческий растворенный носитель SLC41A1 принадлежит к новому подсемейству эукариот, гомологичному прокариотическим переносчикам MgtE Mg2+». Связь с биохимическими и биофизическими исследованиями . 306 (3): 718–24. дои : 10.1016/S0006-291X(03)01030-1 . ПМИД 12810078 .
- ^ Перейти обратно: а б с Надлер М.Дж., Хермосура М.К., Инабе К., Перро А.Л., Чжу К., Стоукс А.Дж., Куросаки Т., Кинет Дж.П., Пеннер Р., Шаренберг А.М., Флейг А. (май 2001 г.). «LTRPC7 представляет собой двухвалентный катионный канал, регулируемый Mg.ATP, необходимый для жизнеспособности клеток». Природа . 411 (6837): 590–5. Бибкод : 2001Natur.411..590N . дои : 10.1038/35079092 . ПМИД 11385574 . S2CID 4426202 .
- ^ Уолдер Р.Ю., Ландау Д., Мейер П., Шалев Х., Цолиа М., Бороховиц З., Беттгер М.Б., Бек Г.Е., Энглхардт Р.К., Карми Р., Шеффилд В.К. (июнь 2002 г.). «Мутация TRPM6 вызывает семейную гипомагниемию с вторичной гипокальциемией». Природная генетика . 31 (2): 171–4. дои : 10.1038/ng901 . ПМИД 12032570 . S2CID 33192419 .
- ^ Перейти обратно: а б с Саймон Д.Б., Лу Ю., Чоат К.А., Веласкес Х., Аль-Саббан Е., Прага М., Казари Г., Беттинелли А., Колусси Г., Родригес-Сориано Дж., МакКреди Д., Милфорд Д., Санджад С., Лифтон Р.П. (июль 1999 г.). «Парацеллин-1, белок плотного соединения почек, необходимый для парацеллюлярной резорбции Mg2 +». Наука . 285 (5424): 103–6. дои : 10.1126/science.285.5424.103 . ПМИД 10390358 .
- ^ Перейти обратно: а б с д и Шок И., Греган Дж., Штайнхаузер С., Швайен Р., Бреннике А., Кнуп В. (ноябрь 2000 г.). «Член нового семейства генов Arabidopsis thaliana кандидатов в переносчики ионов Mg2 + дополняет дрожжевой митохондриальный мутант, сплайсирующий интроны группы II». Заводской журнал . 24 (4): 489–501. дои : 10.1111/j.1365-313X.2000.00895.x . ПМИД 11115130 .
- ^ Перейти обратно: а б с д и ж Ли Л., Тутон А.Ф., Драммонд Р.С., Гарднер Р.К., Луан С. (декабрь 2001 г.). «Новое семейство генов транспорта магния у Arabidopsis» . Растительная клетка . 13 (12): 2761–75. дои : 10.1105/tpc.010352 . ПМК 139487 . ПМИД 11752386 .
- ^ Перейти обратно: а б с д и ж г час я Шауль О, Хильгеманн Д.В., де-Алмейда-Энглер Дж., Ван Монтегю М., Инц Д., Галили Г. (июль 1999 г.). «Клонирование и характеристика нового обменника Mg(2+)/H(+)» . Журнал ЭМБО . 18 (14): 3973–80. дои : 10.1093/emboj/18.14.3973 . ПМЦ 1171473 . ПМИД 10406802 .
- ^ Боррелли Дж., Бойер Дж. К., Турен Б., Шпонарски В., Рамбье М., Жибрат Р. (август 2001 г.). «Мутант дрожжей vps5Delta, затронутый переработкой мембранных белков Гольджи, демонстрирует повышенную вакуолярную обменную активность Mg2+/H+» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (17): 9660–5. дои : 10.1073/pnas.161215198 . ПМК 55508 . ПМИД 11493679 .
- ^ Тевелев А, Коуэн Дж (1995). «Замещение металлов как исследование биологической химии ионов магния». В Коуэне Дж. (ред.). Биологическая химия магния . Нью-Йорк: ВЧ. ISBN 978-0-471-18583-3 .
- ^ Перейти обратно: а б с д и ж г Колисек М., Зурка Г., Самай Дж., Вегубер Дж., Швейен Р.Дж., Швайгель М. (март 2003 г.). «Mrs2p является важным компонентом основной электрофоретической системы притока Mg2+ в митохондрии» . Журнал ЭМБО . 22 (6): 1235–44. дои : 10.1093/emboj/cdg122 . ПМК 151051 . ПМИД 12628916 .
- ^ Перейти обратно: а б с д и Фрошауэр Э.М., Колисек М., Дитрих Ф., Швайгель М., Швейен Р.Дж. (август 2004 г.). «Измерения флуоресценции свободного [Mg2+] с использованием mag-fura 2 в Salmonella enterica». Письма FEMS по микробиологии . 237 (1): 49–55. дои : 10.1111/j.1574-6968.2004.tb09677.x . ПМИД 15268937 .
- ^ Ласк Дж. Э., Уильямс Р. Дж., Кеннеди Е. П. (май 1968 г.). «Магний и рост кишечной палочки» . Журнал биологической химии . 243 (10): 2618–24. дои : 10.1016/S0021-9258(18)93417-4 . ПМИД 4968384 .
- ^ Перейти обратно: а б Ласк Дж. Э., Кеннеди Е. П. (март 1969 г.). «Транспорт магния в Escherichia coli» . Журнал биологической химии . 244 (6): 1653–5. дои : 10.1016/S0021-9258(18)91809-0 . ПМИД 4886311 .
- ^ Серебро S (март 1969 г.). «Активный транспорт магния в кишечной палочке» . Труды Национальной академии наук Соединенных Штатов Америки . 62 (3): 764–71. Бибкод : 1969PNAS...62..764S . дои : 10.1073/pnas.62.3.764 . ПМК 223664 . ПМИД 4895213 .
- ^ Перейти обратно: а б Нельсон Д.Л., Кеннеди Е.П. (май 1971 г.). «Транспорт магния в Escherichia coli. Ингибирование ионом кобальта» . Журнал биологической химии . 246 (9): 3042–9. дои : 10.1016/S0021-9258(18)62288-4 . ПМИД 4928897 .
- ^ Уэбб, М. (1970). «Взаимосвязь между использованием магния и поглощением других двухвалентных катионов бактериями». Biochimica et Biophysical Acta (BBA) – Общие предметы . 222 (2): 428–440. дои : 10.1016/0304-4165(70)90133-9 . ПМИД 4992522 .
- ^ Перейти обратно: а б с Нельсон Д.Л., Кеннеди Е.П. (май 1972 г.). «Транспорт магния репрессируемой и нерепрессируемой системой у Escherichia coli» . Труды Национальной академии наук Соединенных Штатов Америки . 69 (5): 1091–3. Бибкод : 1972PNAS...69.1091N . дои : 10.1073/pnas.69.5.1091 . ПМК 426636 . ПМИД 4556454 .
- ^ Перейти обратно: а б с Пак М.Х., Вонг Б.Б., Ласк Дж.Э. (июнь 1976 г.). «Мутанты по трем генам, влияющие на транспорт магния у Escherichia coli: генетика и физиология» . Журнал бактериологии . 126 (3): 1096–103. дои : 10.1128/JB.126.3.1096-1103.1976 . ПМК 233130 . ПМИД 780341 .
- ^ Смит Р.Л., Магуайр М.Э. (март 1995 г.). «Распределение транспортной системы CorA Mg2+ у грамотрицательных бактерий» . Журнал бактериологии . 177 (6): 1638–40. дои : 10.1128/jb.177.6.1638-1640.1995 . ПМК 176786 . ПМИД 7883724 .
- ^ Перейти обратно: а б Керес Д.Г., юрист CH, Магуайр ME (1998). «Семейство генов-переносчиков магния CorA». Микробная и сравнительная геномика . 3 (3): 151–69. дои : 10.1089/omi.1.1998.3.151 . ПМИД 9775386 .
- ^ Перейти обратно: а б с д Чамнонгпол С., Гройсман Е.А. (апрель 2002 г.). «Гомеостаз Mg2+ и предотвращение токсичности металлов» . Молекулярная микробиология . 44 (2): 561–71. дои : 10.1046/j.1365-2958.2002.02917.x . ПМИД 11972791 . S2CID 23345853 .
- ^ Перейти обратно: а б Гройсман Э.А. (март 2001 г.). «Плейотропная двухкомпонентная регуляторная система PhoP-PhoQ» . Журнал бактериологии . 183 (6): 1835–42. дои : 10.1128/JB.183.6.1835-1842.2001 . ПМК 95077 . ПМИД 11222580 .
- ^ Папп К.М., Магуайр М.Э. (ноябрь 2004 г.). «Транспортер CorA Mg2+ не транспортирует Fe2+» . Журнал бактериологии . 186 (22): 7653–8. дои : 10.1128/JB.186.22.7653-7658.2004 . ПМК 524906 . ПМИД 15516579 .
- ^ Смит Р.Л., Бэнкс Дж.Л., Снавли М.Д., Магуайр М.Э. (июль 1993 г.). «Последовательность и топология систем транспорта магния CorA Salmonella typhimurium и Escherichia coli. Идентификация нового класса транспортных белков» . Журнал биологической химии . 268 (19): 14071–80. дои : 10.1016/S0021-9258(19)85210-9 . ПМИД 8314774 .
- ^ Уоррен М.А., Кучарски Л.М., Винстра А., Ши Л., Грулич П.Ф., Магуайр М.Е. (июль 2004 г.). «Переносчик CorA Mg2+ является гомотетрамером» . Журнал бактериологии . 186 (14): 4605–12. дои : 10.1128/JB.186.14.4605-4612.2004 . ПМК 438605 . ПМИД 15231793 .
- ^ Перейти обратно: а б с Смит Р.Л., Сегеди М.А., Кучарски Л.М., Уокер С., Вит Р.М., Редпат А., Качмарек М.Т., Магуайр М.Э. (октябрь 1998 г.). «Транспортный белок CorA Mg2+ Salmonella typhimurium. Мутагенез консервативных остатков в третьем мембранном домене идентифицирует пору Mg2+» . Журнал биологической химии . 273 (44): 28663–9. дои : 10.1074/jbc.273.44.28663 . ПМИД 9786860 .
- ^ Сегеди М.А., Магуайр М.Э. (декабрь 1999 г.). «Транспортный белок CorA Mg(2+) Salmonella typhimurium. Мутагенез консервативных остатков во втором мембранном домене» . Журнал биологической химии . 274 (52): 36973–9. дои : 10.1074/jbc.274.52.36973 . ПМИД 10601252 .
- ^ Перейти обратно: а б с Хмиэль С.П., Снавли, доктор медицинских наук, Флорер Дж.Б., Магуайр М.Э., Миллер К.Г. (сентябрь 1989 г.). «Транспорт магния у Salmonella typhimurium: генетическая характеристика и клонирование трех локусов транспорта магния» . Журнал бактериологии . 171 (9): 4742–51. дои : 10.1128/jb.171.9.4742-4751.1989 . ПМК 210275 . ПМИД 2548998 .
- ^ Перейти обратно: а б с Гибсон М.М., Багга Д.А., Миллер К.Г., Магуайр М.Э. (ноябрь 1991 г.). «Транспорт магния у Salmonella typhimurium: влияние новых мутаций, придающих устойчивость к Co2+, на транспортную систему CorA Mg2+». Молекулярная микробиология . 5 (11): 2753–62. дои : 10.1111/j.1365-2958.1991.tb01984.x . ПМИД 1779764 . S2CID 25464328 .
- ^ Смит Р., Магуайр М (1995). «Генетика и молекулярная биология систем транспорта магния». В Коуэне Дж. (ред.). Биологическая химия магния . Нью-Йорк: ВЧ. стр. 211–234. ISBN 978-0-471-18583-3 .
- ^ Перейти обратно: а б с Кучарски Л.М., Люббе В.Дж., Магуайр М.Е. (июнь 2000 г.). «Катионы гексааммины являются селективными и мощными ингибиторами транспортной системы магния CorA» . Журнал биологической химии . 275 (22): 16767–73. дои : 10.1074/jbc.M001507200 . ПМИД 10748031 .
- ^ Смит Р.Л., Качмарек М.Т., Кучарски Л.М., Магуайр М.Е. (июль 1998 г.). «Транспорт магния у Salmonella typhimurium: регуляция mgtA и mgtCB во время инвазии эпителиальных и макрофагальных клеток» . Микробиология . 144 (7): 1835–43. дои : 10.1099/00221287-144-7-1835 . ПМИД 9695916 .
- ^ Монкриф МБ, Магуайр МЭ (октябрь 1999 г.). «Транспорт магния у прокариот». Журнал биологической неорганической химии . 4 (5): 523–7. дои : 10.1007/s007750050374 . ПМИД 10550680 . S2CID 25825329 .
- ^ Перейти обратно: а б Тао Т., Снавли, доктор медицинских наук, Фарр С.Г., Магуайр М.Э. (май 1995 г.). «Транспорт магния у Salmonella typhimurium: mgtA кодирует АТФазу P-типа и регулируется Mg2+ аналогично тому, как это происходит с АТФазой P-типа mgtB» . Журнал бактериологии . 177 (10): 2654–62. дои : 10.1128/jb.177.10.2654-2662.1995 . ПМК 176934 . ПМИД 7751273 .
- ^ Блан-Потар AB, Гройсман EA (сентябрь 1997 г.). «Локус Salmonella selC содержит остров патогенности, опосредующий выживание внутримакрофагов» . Журнал ЭМБО . 16 (17): 5376–85. дои : 10.1093/emboj/16.17.5376 . ПМК 1170169 . ПМИД 9311997 .
- ^ Смит Д.Л., Тао Т., Магуайр М.Э. (октябрь 1993 г.). «Топология мембраны АТФазы P-типа. Белок-переносчик магния MgtB Salmonella typhimurium» . Журнал биологической химии . 268 (30): 22469–79. дои : 10.1016/S0021-9258(18)41553-0 . ПМИД 8226755 .
- ^ Керес Д.Г., Магуайр М.Э. (сентябрь 2002 г.). «Структура, свойства и регуляция белков-транспортеров магния». Биометаллы . 15 (3): 261–70. дои : 10.1023/А:1016078832697 . ПМИД 12206392 . S2CID 30291849 .
- ^ Хаттори М., Ивасе Н., Фуруя Н., Танака Ю., Цуказаки Т., Ишитани Р., Магуайр М.Э., Ито К., Матурана А., Нуреки О (ноябрь 2009 г.). «Mg(2+)-зависимое открытие бактериального канала MgtE лежит в основе гомеостаза Mg(2+)» . Журнал ЭМБО . 28 (22): 3602–12. дои : 10.1038/emboj.2009.288 . ПМК 2782099 . ПМИД 19798051 .
- ^ Баррик Дж.Э., Корбино К.А., Винклер В.К., Нахви А., Мандал М., Коллинз Дж., Ли М., Рот А., Сударсан Н., Джона И., Викайзер Дж.К., Брейкер Р.Р. (апрель 2004 г.). «Новые мотивы РНК предполагают расширение возможностей рибопереключателей в генетическом контроле бактерий» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (17): 6421–6. Бибкод : 2004PNAS..101.6421B . дои : 10.1073/pnas.0308014101 . ПМК 404060 . ПМИД 15096624 .
- ^ Понтинг CP (март 1997 г.). «Домены CBS в хлоридных каналах CIC, участвующие в миотонии и нефролитиазе (камни в почках)». Журнал молекулярной медицины . 75 (3): 160–3. ПМИД 9106071 .
- ^ Хаттори М., Танака Ю., Фукаи С., Ишитани Р., Нуреки О. (2007). «Кристаллическая структура транспортера MgtE Mg2+». Природа . 448 (7157): 1072–1075. Бибкод : 2007Natur.448.1072H . дои : 10.1038/nature06093 . ПМИД 17700703 . S2CID 4396170 .
- ^ Ротштейн А., Хейс А., Дженнингс Д., Хупер Д. (январь 1958 г.). «Активный транспорт Mg++ и Mn++ в дрожжевую клетку» . Журнал общей физиологии . 41 (3): 585–94. CiteSeerX 10.1.1.283.3914 . дои : 10.1085/jgp.41.3.585 . ПМК 2194844 . ПМИД 13491823 .
- ^ Перейти обратно: а б Фурманн Г.Ф., Ротштейн А. (ноябрь 1968 г.). «Транспорт Zn2+, Co2+ и Ni2+ в дрожжевые клетки». Biochimica et Biophysical Acta (BBA) – Биомембраны . 163 (3): 325–30. дои : 10.1016/0005-2736(68)90117-X . ПМИД 5721896 .
- ^ Перейти обратно: а б Норрис П., Келли, ДП (1977). «Накопление кадмия и кобальта Saccharomyces cerevisiae» . Журнал общей микробиологии . 99 (2): 317–324. дои : 10.1099/00221287-99-2-317 .
- ^ Окороков Л.А., Личко Л.П., Кадомцева В.М., Холоденко В.П., Титовский В.Т., Кулаев И.С. (май 1977 г.). «Энергозависимый транспорт марганца в дрожжевые клетки и распределение накопленных ионов» . Европейский журнал биохимии . 75 (2): 373–7. дои : 10.1111/j.1432-1033.1977.tb11538.x . ПМИД 328273 .
- ^ Конклин Д.С., Кунг С., Калбертсон М.Р. (апрель 1993 г.). «Ген COT2 необходим для глюкозозависимого транспорта двухвалентных катионов у Saccharomyces cerevisiae» . Молекулярная и клеточная биология . 13 (4): 2041–9. дои : 10.1128/mcb.13.4.2041 . ПМК 359525 . ПМИД 8455597 .
- ^ Перейти обратно: а б с Ли Дж. М., Гарднер Р. К. (январь 2006 г.). «Остатки дрожжевого белка ALR1, имеющие решающее значение для усвоения магния». Современная генетика . 49 (1): 7–20. дои : 10.1007/s00294-005-0037-y . ПМИД 16328501 . S2CID 29578323 .
- ^ Перейти обратно: а б с д Грашопф А., Штадлер Дж.А., Хеллерер М.К., Эдер С., Зигхардт М., Кольвайн С.Д., Швайен Р.Дж. (май 2001 г.). «Белок плазматической мембраны дрожжей Alr1 контролирует гомеостаз Mg2+ и подвергается Mg2+-зависимому контролю его синтеза и деградации» . Журнал биологической химии . 276 (19): 16216–22. дои : 10.1074/jbc.M101504200 . ПМИД 11279208 .
- ^ Перейти обратно: а б с д и Лим П.Х., Писат Н.П., Гадия Н., Пандей А., Донован FX, Стейн Л., Солт Д.Э., Эйде DJ, МакДиармид CW (2011). «Регуляция активности переносчика Alr1 Mg с помощью внутриклеточного магния» . ПЛОС ОДИН . 6 (6): e20896. Бибкод : 2011PLoSO...620896L . дои : 10.1371/journal.pone.0020896 . ПМЦ 3125163 . ПМИД 21738593 .
- ^ Перейти обратно: а б Лю Дж.Дж., Мартин Д.К., Гарднер Р.К., Райан П.Р. (август 2002 г.). «Большие Mg(2+)-зависимые токи связаны с повышенной экспрессией ALR1 у Saccharomyces cerevisiae» . Письма FEMS по микробиологии . 213 (2): 231–7. дои : 10.1111/j.1574-6968.2002.tb11311.x . ПМИД 12167543 .
- ^ Чжан А., Ченг Т.П., Ву XY, Алтура Б.Т., Алтура Б.М. (январь 1997 г.). «Внеклеточный Mg2+ регулирует внутриклеточный Mg2+ и его субклеточную компартментацию у делящихся дрожжей Schizosaccharomyces pombe» . Клеточные и молекулярные науки о жизни . 53 (1): 69–72. дои : 10.1007/PL00000581 . ПМЦ 11147206 . ПМИД 9117998 . S2CID 21460552 .
- ^ Писат Н.П., Пандей А., Макдиармид К.В. (ноябрь 2009 г.). «MNR2 регулирует внутриклеточное накопление магния у Saccharomyces cerevisiae» . Генетика . 183 (3): 873–84. дои : 10.1534/genetics.109.106419 . ПМЦ 2778983 . ПМИД 19720860 .
- ^ Колл Х., Шмидт С., Визенбергер Г., Шмельцер С. (1987). «Три ядерных гена подавляют дефект сплайсинга митохондрий дрожжей, когда они присутствуют в большом количестве копий». Современная генетика . 12 (7): 503–9. дои : 10.1007/BF00419559 . ПМИД 2452028 . S2CID 38971326 .
- ^ Визенбергер Г., Вальдхерр М., Швайен Р.Дж. (апрель 1992 г.). «Ядерный ген MRS2 необходим для вырезания интронов группы II из митохондриальных транскриптов дрожжей in vivo» . Журнал биологической химии . 267 (10): 6963–9. дои : 10.1016/S0021-9258(19)50522-1 . ПМИД 1551905 .
- ^ Перейти обратно: а б с д и Греган Дж., Буй Д.М., Пиллих Р., Финк М., Зурка Г., Швейен Р.Дж. (февраль 2001 г.). «Белок внутренней мембраны митохондрий Lpe10p, гомолог Mrs2p, необходим для гомеостаза магния и сплайсинга интронов группы II у дрожжей». Молекулярная и общая генетика . 264 (6): 773–81. дои : 10.1007/s004380000366 . ПМИД 11254124 . S2CID 490016 .
- ^ Греган Дж., Колисек М., Швейен Р.Дж. (сентябрь 2001 г.). «Митохондриальный гомеостаз Mg (2+) имеет решающее значение для сплайсинга интронов группы II in vivo» . Гены и развитие . 15 (17): 2229–37. дои : 10.1101/gad.201301 . ПМЦ 312778 . ПМИД 11544180 .
- ^ Престон Р.Р. (октябрь 1990 г.). «Магниевый ток в парамециях». Наука . 250 (4978): 285–8. Бибкод : 1990Sci...250..285P . дои : 10.1126/science.2218533 . ПМИД 2218533 .
- ^ Престон Р.Р., Кунг С. (май 1994 г.). «Ингибирование тока Mg2+ мутацией одного гена у Paramecium». Журнал мембранной биологии . 139 (3): 203–13. дои : 10.1007/bf00232624 . ПМИД 7538166 . S2CID 29747892 .
- ^ Престон Р.Р., Кунг С. (июль 1994 г.). «Выделение и характеристика мутантов парамеций, дефектных по реакции на магний» . Генетика . 137 (3): 759–69. дои : 10.1093/генетика/137.3.759 . ПМК 1206036 . ПМИД 8088522 .
- ^ Перейти обратно: а б Престон Р.Р. (июль 1998 г.). «Трансмембранные токи Mg2+ и внутриклеточная концентрация свободного Mg2+ у Paramecium тетраурелия». Журнал мембранной биологии . 164 (1): 11–24. дои : 10.1007/s002329900389 . ПМИД 9636240 . S2CID 919015 .
- ^ Перейти обратно: а б Кеннау Б.Д., Николл Д.А., Филипсон К.Д. (февраль 2004 г.). «Семейство натрий-кальциевых обменников-SLC8». Архив Пфлюгерса . 447 (5): 543–8. дои : 10.1007/s00424-003-1065-4 . ПМИД 12734757 . S2CID 26502273 .
- ^ Шнеткамп П.П. (февраль 2004 г.). «Семейство теплообменников SLC24 Na+/Ca2+-K+: видение и не только». Архив Пфлюгерса . 447 (5): 683–8. дои : 10.1007/s00424-003-1069-0 . ПМИД 14770312 . S2CID 37553960 .
- ^ Туснади Г.Е., Симон I (октябрь 1998 г.). «Принципы, определяющие аминокислотный состав интегральных мембранных белков: применение к предсказанию топологии». Журнал молекулярной биологии . 283 (2): 489–506. дои : 10.1006/jmbi.1998.2107 . ПМИД 9769220 .
- ^ Туснади Г.Е., Симон I (сентябрь 2001 г.). «Сервер прогнозирования трансмембранной топологии HMMTOP» . Биоинформатика . 17 (9): 849–50. дои : 10.1093/биоинформатика/17.9.849 . ПМИД 11590105 .
- ^ Романи AM, Магуайр ME (сентябрь 2002 г.). «Гормональная регуляция транспорта и гомеостаза Mg2+ в эукариотических клетках». Биометаллы . 15 (3): 271–83. дои : 10.1023/А:1016082900838 . ПМИД 12206393 . S2CID 20835803 .
- ^ Перейти обратно: а б Монтелл С., Бирнбаумер Л., Флокерци В. (март 2002 г.). «Каналы TRP — удивительно функциональное семейство» . Клетка . 108 (5): 595–8. дои : 10.1016/S0092-8674(02)00670-0 . ПМИД 11893331 . S2CID 18575588 .
- ^ Перейти обратно: а б Монтелл С. (октябрь 2003 г.). «Гомеостаз Mg2+: эффективные ханзимы TRPM Mg2+» . Современная биология . 13 (20): 799–801 рэнд. дои : 10.1016/j.cub.2003.09.048 . ПМИД 14561419 . S2CID 15221656 .
- ^ Раннелс Л.В., Юэ Л., Клэпхэм Д.Э. (май 2002 г.). «Канал TRPM7 инактивируется гидролизом PIP (2)». Природная клеточная биология . 4 (5): 329–36. дои : 10.1038/ncb781 . ПМИД 11941371 . S2CID 21592843 .
- ^ Монтей-Цоллер М.К., Эрмосура М.К., Надлер М.Ю., Шаренберг А.М., Пеннер Р., Флейг А. (январь 2003 г.). «TRPM7 обеспечивает механизм ионного канала для проникновения в клетку следовых ионов металлов» . Журнал общей физиологии . 121 (1): 49–60. дои : 10.1085/jgp.20028740 . ПМК 2217320 . ПМИД 12508053 .
- ^ Перейти обратно: а б Чубанов В., Вальдеггер С., Медерос-и-Шницлер М., Витцтум Х., Сассен М.С., Зайберт Х.В., Конрад М., Гудерманн Т. (март 2004 г.). «Нарушение образования комплекса TRPM6/TRPM7 из-за мутации в гене TRPM6 вызывает гипомагниемию с вторичной гипокальциемией» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (9): 2894–9. Бибкод : 2004PNAS..101.2894C . дои : 10.1073/pnas.0305252101 . ПМЦ 365716 . ПМИД 14976260 .
- ^ Перейти обратно: а б Воетс Т., Нилиус Б., Хофс С., ван дер Кемп А.В., Другманс Г., Бинделс Р.Дж., Хендероп Дж.Г. (январь 2004 г.). «TRPM6 образует канал притока Mg2+, участвующий в абсорбции Mg2+ в кишечнике и почках» . Журнал биологической химии . 279 (1): 19–25. дои : 10.1074/jbc.M311201200 . hdl : 2066/57440 . ПМИД 14576148 .
- ^ Раннелс Л.В., Юэ Л., Клэпхэм Д.Э. (февраль 2001 г.). «TRP-PLIK, бифункциональный белок с активностью киназы и ионного канала». Наука . 291 (5506): 1043–7. Бибкод : 2001Sci...291.1043R . дои : 10.1126/science.1058519 . ПМИД 11161216 . S2CID 30327400 .
- ^ Наим М., Хуссейн С., Ахтар Н. (2011). «Мутация гена плотного соединения клаудина 19 (CLDN19) и семейная гипомагниемия, гиперкальциурия, нефрокальциноз (FHHNC) и тяжелые заболевания глаз» . Американский журнал нефрологии . 34 (3): 241–8. дои : 10.1159/000330854 . ПМИД 21791920 .
- ^ Конрад М, Шаллер А, Зеелов Д, Пандей А.В., Вальдеггер С, Лесслауер А, Вицтум Х, Сузуки Й, Люк Дж.М., Беккер С, Шлингманн К.П., Шмид М., Родригес-Сориано Дж., Арисета Г., Кано Ф., Энрикес Р., Юппнер Х., Баккалоглу С.А., Хедигер М.А., Галлати С., Нойхаусс С.К., Нюрнберг П., Вебер С. (ноябрь 2006 г.). «Мутации в гене плотного соединения клаудина 19 (CLDN19) связаны с потерей магния почками, почечной недостаточностью и тяжелым поражением глаз» . Американский журнал генетики человека . 79 (5): 949–57. дои : 10.1086/508617 . ПМЦ 1698561 . ПМИД 17033971 .
- ^ Ди Стефано А., Ройнель Н., де Руффиньяк С., Виттнер М. (1993). «Трансэпителиальный транспорт Ca2+ и Mg2+ в корковом толстом восходящем отделе петли Генле мыши представляет собой потенциал-зависимый процесс». Физиология и биохимия почек . 16 (4): 157–66. дои : 10.1159/000173762 . ПМИД 7689239 .
- ^ де Руффиньяк С, Квамм Ж (апрель 1994 г.). «Обработка почечного магния и его гормональный контроль». Физиологические обзоры . 74 (2): 305–22. дои : 10.1152/physrev.1994.74.2.305 . ПМИД 8171116 .
- ^ Вебер С., Хоффманн К., Джек Н., Саар К., Босвальд М., Куверц-Брукинг Е., Мей II, Кноерс Н.В., Кочат П., Сулакова Т., Бонзель К.Е., Зёргель М., Манц Ф., Шерер К., Зайберт Х.В., Рейс А., Конрад М. (июнь 2000 г.). «Семейная гипомагниемия с гиперкальциурией и нефрокальцинозом локализуется на хромосоме 3q27 и связана с мутациями в гене PCLN-1» . Европейский журнал генетики человека . 8 (6): 414–22. дои : 10.1038/sj.ejhg.5200475 . ПМИД 10878661 .
- ^ Вебер С., Шнайдер Л., Петерс М., Миссельвитц Дж., Рённефарт Г., Бёсвальд М., Бонзель К.Е., Зееман Т., Сулакова Т., Куверц-Брёкинг Е., Грегорич А., Палку Ж.Б., Тасич В., Манц Ф., Шерер К., Зайберт Х.В., Конрад М. (сентябрь 2001 г.). «Новые мутации парацеллина-1 в 25 семьях с семейной гипомагниемией с гиперкальциурией и нефрокальцинозом» . Журнал Американского общества нефрологов . 12 (9): 1872–81. дои : 10.1681/ASN.V1291872 . ПМИД 11518780 .
- ^ Перейти обратно: а б Тутон А (2004). Клонирование и характеристика Mg 2+ транспортный ген A. thaliana (Диссертация). Школа биологических наук (Окленд: Оклендский университет).
- ^ Куркджян А., Герн Дж. (1989). «Внутриклеточный pH: измерение и значение в клеточной активности» . Ежегодный обзор физиологии растений и молекулярной биологии растений . 40 : 271–303. дои : 10.1146/annurev.pp.40.060189.001415 .
- ^ Маршнер Х (1995). Минеральное питание высших растений. (Сан-Диего: Academic Press) .