Альдегид

В органической химии альдегид содержащим ( / ˈ æ æ l d ɪ h aɪ d / ) является органическим соединением, функциональную группу со структурой R -ch = o . [ 1 ] Сама функциональная группа (без боковой цепи «R» ) может быть названа альдегидом, но также может быть классифицирована как формальная группа . Альдегиды являются общим мотивом во многих химических веществах, важных для технологий и биологии. [ 2 ] [ 3 ]
Структура и связь
[ редактировать ]Молекулы альдегида имеют центральный атом углерода, который связан двойной связью с кислородом, одной связью с водородом и другой единственной связью с третьим заместителем, который является углеродом или, в случае формальдегида, водорода. Центральный углерод часто описывается как SP 2 - гибридизован . Группа альдегида несколько полярна . А C = Длина связи составляет около 120–122 пикометров . [ 4 ]
Физические свойства и характеристика
[ редактировать ]Альдегиды обладают разнообразными свойствами и зависят от оставшейся части молекулы. Меньшие альдегиды более растворимы в воде, формальдегиде и ацетальдегиде . У летучих альдегидов есть острые запахи.
Альдегиды могут быть идентифицированы спектроскопическими методами. Используя ИК -спектроскопию , они отображают сильную полосу ν CO около 1700 см. −1 Полем В их 1 Спектры ЯМР , центр формального водорода поглощает Δ H 9,5–10, что является отличительной частью спектра. Этот сигнал показывает характерную связь с любыми протонами на α -углероде с небольшой константой связи, как правило, менее 3,0 Гц. А 13 Спектры ЯМР альдегидов и кетонов дают подавленный (слабый), но отличительный сигнал при Δ C 190–205.
Приложения и появление
[ редактировать ]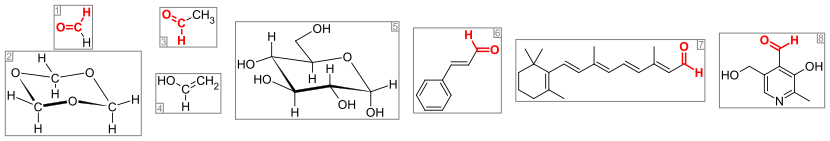
Важные альдегиды и связанные с ними соединения. Группа альдегида (или формальная группа ) цветная красная. Слева: (1) формальдегид и (2) его тример 1,3,5-триоксан , (3) ацетальдегид и (4) его энол виниловый спирт (пиранозная форма как α-глюкопираноза), (5) глюкоза (пираноза как α-глюкопираноза), (5) -глюкопираноза), (5) глюкоза (пираноза в виде α-глюкопиранозы), (5) глюкоза глюкоза (пираноза как α , (5) глюкоза (пираноза образует как α- d - глюкопираноза) (6) ароматный циннамальдегид , (7) сетчатка , которая образуется с опсинов фоторецепторами и (8) витамин пиридоксаль .
Природные альдегиды
[ редактировать ]Следы многих альдегидов встречаются в эфирных маслах и часто способствуют их благоприятным запахам, например, Cinnamaldehyde , Cintro и Vanillin . Возможно, из -за высокой реакционной способности формальной группы альдегиды не распространены в нескольких естественных строительных блоках: аминокислоты, нуклеиновые кислоты, липиды. Большинство сахаров, однако, являются производными альдегидов. Эти альдозы существуют в качестве гемиацеталов , своего рода маскированной формы родительского альдегида. Например, в водном растворе только крошечная доля глюкозы существует в качестве альдегида.
Синтез
[ редактировать ]Есть несколько методов подготовки альдегидов, [ 2 ] Но доминирующей технологией является гидроформилирование . [ 5 ] Иллюстративным является генерация бутиральдегида путем гидроформилирования пропена :
- H 2 + CO + CH 3 CH = CH 2 → CH 3 CH 2 CH 2 CHO CHO
Окислительные маршруты
[ редактировать ]Альдегиды обычно генерируются путем окисления алкоголя . Промышленность окисляет метанол до формальдегида в больших масштабах, [ 6 ] и, в процессе Wacker , этилен до ацетальдегида в присутствии медных и палладийских катализаторов (ацетальдегид также вырабатывается в больших масштабах с помощью гидратации ацетилена). « Зеленый » и дешевый кислород - это окислитель. Для чувствительных субстратов окисление Oppenauer позволяет избежать переоксировки в карбоновую кислоту . Когда смесь продуктов может быть приемлемой, гидроформилирование напрямую добавляет карбонил в олефин . [ Цитация необходима ]
Вместо этого лаборатории могут применять широкий спектр специализированных окислительных агентов ; Реагенты хрома (VI) популярны . Окисление может быть достигнуто путем нагрева спирта подкисленным раствором дихромата калия . В этом случае избыточный дихромат дополнительно окисляет альдегид до карбоновой кислоты , поэтому либо альдегид дистиллируется , поскольку он образуется (если летучие ) или более мягкие реагенты, такие как PCC . [ 7 ]
- [O] + Ch 3 (Ch 2 ) 9 OH → Ch 3 (Ch 2 ) 8 CHO + H 2 O
Разнообразные системы реагентов достигают альдегидов в условиях без хрома. Одним из таких гипервалентных соединений органоооооооооооооооооооооооооо из гипервалентного органоооооооооооооооооооооооо из органоооооооооооооооооооооооо гипервалентного для периодинана DESS -Martin ), хотя они часто также окисляют положение α . Кислота роскошного тела будет активировать другие предварительно окисленные субстраты: различные сульфоксиды (например, окисление Swern ) или оксиды амина (например, окисление Ganem ). Стерически завязанные нитроксилы (т.е., темп ) могут катализировать образование альдегида с более дешевым окислителем .
Альтернативно, викоминальные диолы или их окисленные последствия ( ацилоины или α-гидрокси кислоты ) могут быть окислены расщеплением до двух альдегидов или альдегида и углекислого газа . [ 8 ] [ 9 ]
Специальные методы
[ редактировать ]| Имя реакции | Субстрат | Комментарий |
|---|---|---|
| Озонолиз | Алкены | Редактивная тренировка ; Подобный эффект с синглетным кислородом и без тренировки |
| Сокращение карбонила | Эфиры , амиды | Восстановление эфира с гидридом диизобутилалиминия ( дибал-H ) или гидридом натрия ; См. Также амидное сокращение . |
| Реакция Розенмунда | Ацилхлориды | Acyl chlorides selectively reduced to aldehydes. Lithium tri-t-butoxyaluminium hydride (LiAlH(OtBu)3) is an effective reagent.[citation needed] |
| Wittig reaction | Ketones | A modified Wittig reaction using methoxymethylenetriphenylphosphine as a reagent. |
| Formylation reactions | Nucleophilic arenes | Various reactions, for example the Vilsmeier-Haack reaction. |
| Nef reaction | Nitro compounds | The acid hydrolysis of a primary nitro compound to form an aldehyde. |
| Kornblum oxidation | Haloalkanes | The oxidation of primary halide with dimethyl sulfoxide to form an aldehyde. |
| Zincke reaction | Pyridines | Zincke aldehydes formed in a reaction variation. |
| Stephen aldehyde synthesis | Nitriles | Hydrolysis of an iminium salt generated by tin(II) chloride and HCl to form an aldehyde. |
| Geminal halide hydrolysis | Geminal dihalides | Hydrolysis of primary geminal dihalides to yield aldehydes. |
| Meyers synthesis | Oxazines | Hemiaminal oxazine hydrolysis with water and oxalic acid to yield an aldehyde. |
| Hofmann rearrangement variation[10][11] | Unsaturated or α-hydroxy amides | Aldehydes via the hydrolysis of an intermediate carbamate. |
| McFadyen-Stevens reaction | Hydrazides | Base-catalyzed thermal decomposition of acylsulfonylhydrazides. |
| Biotransformation | Alkenes | Lyophilized cell cultures of Trametes hirsuta in the presence of oxygen.[12] |
Common reactions
[edit]Aldehydes participate in many reactions.[2] From the industrial perspective, important reactions are:
- condensations, e.g., to prepare plasticizers and polyols, and
- reduction to produce alcohols, especially "oxo-alcohols". From the biological perspective, the key reactions involve addition of nucleophiles to the formyl carbon in the formation of imines (oxidative deamination) and hemiacetals (structures of aldose sugars).[13][2]
Acid-base reactions
[edit]Because of resonance stabilization of the conjugate base, an α-hydrogen in an aldehyde is weakly acidic with a pKa near 17. Note, however, this is much more acidic than an alkane or ether hydrogen, which has pKa near 50 approximately, and is even more acidic than a ketone α-hydrogen which has pKa near 20. This acidification of the α-hydrogen in aldehyde is attributed to:
- the electron-withdrawing quality of the formyl center and
- the fact that the conjugate base, an enolate anion, delocalizes its negative charge.
The formyl proton itself does not readily undergo deprotonation.
Enolization
[edit]Aldehydes (except those without an alpha carbon, or without protons on the alpha carbon, such as formaldehyde and benzaldehyde) can exist in either the keto or the enol tautomer. Keto–enol tautomerism is catalyzed by either acid or base. In neutral solution, the enol is the minority tautomer, reversing several times per second.[14] But it becomes the dominant tautomer in strong acid or base solutions, and enolized aldehydes undergo nucleophilic attack at the α position.[15][16]
Reduction
[edit]The formyl group can be readily reduced to a primary alcohol (−CH2OH). Typically this conversion is accomplished by catalytic hydrogenation either directly or by transfer hydrogenation. Stoichiometric reductions are also popular, as can be effected with sodium borohydride.
Oxidation
[edit]The formyl group readily oxidizes to the corresponding carboxyl group (−COOH). The preferred oxidant in industry is oxygen or air. In the laboratory, popular oxidizing agents include potassium permanganate, nitric acid, chromium(VI) oxide, and chromic acid. The combination of manganese dioxide, cyanide, acetic acid and methanol will convert the aldehyde to a methyl ester.[2]
Another oxidation reaction is the basis of the silver-mirror test. In this test, an aldehyde is treated with Tollens' reagent, which is prepared by adding a drop of sodium hydroxide solution into silver nitrate solution to give a precipitate of silver(I) oxide, and then adding just enough dilute ammonia solution to redissolve the precipitate in aqueous ammonia to produce [Ag(NH3)2]+ complex. This reagent converts aldehydes to carboxylic acids without attacking carbon–carbon double bonds. The name silver-mirror test arises because this reaction produces a precipitate of silver, whose presence can be used to test for the presence of an aldehyde.
A further oxidation reaction involves Fehling's reagent as a test. The Cu2+ complex ions are reduced to a red-brick-coloured Cu2O precipitate.
If the aldehyde cannot form an enolate (e.g., benzaldehyde), addition of strong base induces the Cannizzaro reaction. This reaction results in disproportionation, producing a mixture of alcohol and carboxylic acid.
Nucleophilic addition reactions
[edit]Nucleophiles add readily to the carbonyl group. In the product, the carbonyl carbon becomes sp3-hybridized, being bonded to the nucleophile, and the oxygen center becomes protonated:
- RCHO + Nu− → RCH(Nu)O−
- RCH(Nu)O− + H+ → RCH(Nu)OH
In many cases, a water molecule is removed after the addition takes place; in this case, the reaction is classed as an addition–elimination or addition–condensation reaction. There are many variations of nucleophilic addition reactions.
Oxygen nucleophiles
[edit]In the acetalisation reaction, under acidic or basic conditions, an alcohol adds to the carbonyl group and a proton is transferred to form a hemiacetal. Under acidic conditions, the hemiacetal and the alcohol can further react to form an acetal and water. Simple hemiacetals are usually unstable, although cyclic ones such as glucose can be stable. Acetals are stable, but revert to the aldehyde in the presence of acid. Aldehydes can react with water to form hydrates, R−CH(OH)2. These diols are stable when strong electron withdrawing groups are present, as in chloral hydrate. The mechanism of formation is identical to hemiacetal formation.
Nitrogen nucleophiles
[edit]In alkylimino-de-oxo-bisubstitution, a primary or secondary amine adds to the carbonyl group and a proton is transferred from the nitrogen to the oxygen atom to create a carbinolamine. In the case of a primary amine, a water molecule can be eliminated from the carbinolamine intermediate to yield an imine or its trimer, a hexahydrotriazine This reaction is catalyzed by acid. Hydroxylamine (NH2OH) can also add to the carbonyl group. After the elimination of water, this results in an oxime. An ammonia derivative of the form H2NNR2 such as hydrazine (H2NNH2) or 2,4-dinitrophenylhydrazine can also be the nucleophile and after the elimination of water, resulting in the formation of a hydrazone, which are usually orange crystalline solids. This reaction forms the basis of a test for aldehydes and ketones.[17]
Carbon nucleophiles
[edit]The cyano group in HCN can add to the carbonyl group to form cyanohydrins, R−CH(OH)CN. In this reaction the CN− ion is the nucleophile that attacks the partially positive carbon atom of the carbonyl group. The mechanism involves a pair of electrons from the carbonyl-group double bond transferring to the oxygen atom, leaving it single-bonded to carbon and giving the oxygen atom a negative charge. This intermediate ion rapidly reacts with H+, such as from the HCN molecule, to form the alcohol group of the cyanohydrin.
Organometallic compounds, such as organolithium reagents, Grignard reagents, or acetylides, undergo nucleophilic addition reactions, yielding a substituted alcohol group. Related reactions include organostannane additions, Barbier reactions, and the Nozaki–Hiyama–Kishi reaction.
In the aldol reaction, the metal enolates of ketones, esters, amides, and carboxylic acids add to aldehydes to form β-hydroxycarbonyl compounds (aldols). Acid or base-catalyzed dehydration then leads to α,β-unsaturated carbonyl compounds. The combination of these two steps is known as the aldol condensation.
The Prins reaction occurs when a nucleophilic alkene or alkyne reacts with an aldehyde as electrophile. The product of the Prins reaction varies with reaction conditions and substrates employed.
Bisulfite reaction
[edit]Aldehydes characteristically form "addition compounds" with bisulfites:
- RCHO + HSO−3 → RCH(OH)SO−3
This reaction is used as a test for aldehydes and is useful for separation or purification of aldehydes.[17][18]
More complex reactions
[edit]| Reaction name | Product | Comment |
|---|---|---|
| Wolff–Kishner reduction | Alkane | If an aldehyde is converted to a simple hydrazone (RCH=NHNH2) and this is heated with a base such as KOH, the terminal carbon is fully reduced to a methyl group. The Wolff–Kishner reaction may be performed as a one-pot reaction, giving the overall conversion RCH=O → RCH3. |
| Pinacol coupling reaction | Diol | With reducing agents such as magnesium |
| Wittig reaction | Alkene | Reagent: an ylide |
| Takai reaction | Alkene | Diorganochromium reagent |
| Corey–Fuchs reactions | Alkyne | Phosphine-dibromomethylene reagent |
| Ohira–Bestmann reaction | Alkyne | Reagent: dimethyl (diazomethyl)phosphonate |
| Johnson–Corey–Chaykovsky reaction | Epoxide | Reagent: a sulfonium ylide |
| Oxo-Diels–Alder reaction | Pyran | Aldehydes can, typically in the presence of suitable catalysts, serve as partners in cycloaddition reactions. The aldehyde serves as the dienophile component, giving a pyran or related compound. |
| Hydroacylation | Ketone | In hydroacylation an aldehyde is added over an unsaturated bond to form a ketone. |
| Decarbonylation | Alkane | Catalysed by transition metals |
Dialdehydes
[edit]A dialdehyde is an organic chemical compound with two aldehyde groups. The nomenclature of dialdehydes have the ending -dial or sometimes -dialdehyde. Short aliphatic dialdehydes are sometimes named after the diacid from which they can be derived. An example is butanedial, which is also called succinaldehyde (from succinic acid).
Biochemistry
[edit]Some aldehydes are substrates for aldehyde dehydrogenase enzymes which metabolize aldehydes in the body. There are toxicities associated with some aldehydes that are related to neurodegenerative disease, heart disease, and some types of cancer.[19]
Examples of aldehydes
[edit]- Formaldehyde (methanal)
- Acetaldehyde (ethanal)
- Propionaldehyde (propanal)
- Butyraldehyde (butanal)
- Isovaleraldehyde
- Benzaldehyde (phenylmethanal)
- Cinnamaldehyde
- Vanillin
- Tolualdehyde
- Furfural
- Retinaldehyde
- Glycolaldehyde
Examples of dialdehydes
[edit]Uses
[edit]Of all aldehydes, formaldehyde is produced on the largest scale, about 6000000 tons per year. It is mainly used in the production of resins when combined with urea, melamine, and phenol (e.g., Bakelite). It is a precursor to methylene diphenyl diisocyanate ("MDI"), a precursor to polyurethanes.[6] The second main aldehyde is butyraldehyde, of which about 2500000 tons per year are prepared by hydroformylation. It is the principal precursor to 2-ethylhexanol, which is used as a plasticizer.[20] Acetaldehyde once was a dominating product, but production levels have declined to less than 1000000 tons per year because it mainly served as a precursor to acetic acid, which is now prepared by carbonylation of methanol. Many other aldehydes find commercial applications, often as precursors to alcohols, the so-called oxo alcohols, which are used in detergents. Some aldehydes are produced only on a small scale (less than 1000 tons per year) and are used as ingredients in flavours and perfumes such as Chanel No. 5. These include cinnamaldehyde and its derivatives, citral, and lilial.
Nomenclature
[edit]IUPAC names for aldehydes
[edit]The common names for aldehydes do not strictly follow official guidelines, such as those recommended by IUPAC, but these rules are useful. IUPAC prescribes the following nomenclature for aldehydes:[21][22][23]
- Acyclic aliphatic aldehydes are named as derivatives of the longest carbon chain containing the aldehyde group. Thus, HCHO is named as a derivative of methane, and CH3CH2CH2CHO is named as a derivative of butane. The name is formed by changing the suffix -e of the parent alkane to -al, so that HCHO is named methanal, and CH3CH2CH2CHO is named butanal.
- In other cases, such as when a −CHO group is attached to a ring, the suffix -carbaldehyde may be used. Thus, C6H11CHO is known as cyclohexanecarbaldehyde. If the presence of another functional group demands the use of a suffix, the aldehyde group is named with the prefix formyl-. This prefix is preferred to methanoyl-.
- If the compound is a natural product or a carboxylic acid, the prefix oxo- may be used to indicate which carbon atom is part of the aldehyde group; for example, CHOCH2COOH is named 2-oxoethanoic acid.
- If replacing the aldehyde group with a carboxyl group (−COOH) would yield a carboxylic acid with a trivial name, the aldehyde may be named by replacing the suffix -ic acid or -oic acid in this trivial name by -aldehyde.
Etymology
[edit]Слово альдегид было придумано Юстусом фон Либигом как сокращение латинского аль -кохола Дегида Рогенатуса (дегидрированный алкоголь). [ 24 ] [ 25 ] В прошлом альдегиды иногда называли в честь соответствующих спиртов , например, винового альдегида для ацетальдегида . ( Vines из латинского вина «вина», традиционного источника этанола , родственного с винилом .)
Термин Formyl Group получен из латинского слова Formica "Ant". Это слово может быть распознано в простейшем альдегиде, формальдегиде и в простейшей карбоновой кислоте, муравьиной кислоте .
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ IUPAC Gold Book, Aldehydes .
- ^ Jump up to: а беременный в дюймовый и Смит, Майкл Б.; Март, Джерри (2007), Advanced Organic Chemistry: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Саул Патай, изд. (1966). Карбонильная группа . Химия функциональных групп Патая. Тол. 1. Джон Вили и сыновья. doi : 10.1002/9780470771051 . ISBN 9780470771051 . Джейкоб Забики, изд. (1970). Карбонильная группа . Химия функциональных групп Патая. Тол. 2. Джон Вили и сыновья. doi : 10.1002/9780470771228 . ISBN 9780470771228 .
- ^ G. Berthier, J. Serre (1966). «Общие и теоретические аспекты карбонильной группы». В Саул Патай (ред.). Карбонильная группа . Химия функциональных групп Патая. Тол. 1. Джон Вили и сыновья. С. 1–77. doi : 10.1002/9780470771051.CH1 . ISBN 9780470771051 .
- ^ Bertleff, W.; Roeper, M. and Sava, X. (2003) «Карбонилирование» в энциклопедии промышленной химии Уллмана , Wiley-VCH: Weinheim. два : 10.1002/14356007.a05_217.pub2
- ^ Jump up to: а беременный Reuss, G.; Disteldorf, W.; Gamer, AO and Hilt, A. (2005) «Формальдегид» в энциклопедии промышленной химии Уллмана. Wiley-Vch, Weinheim. Doi : 10.1002/14356007.a11_619 .
- ^ Ratcliffe, RW (1988). «Окисление комплексом триоксида-пиридина хрома, приготовленного in situ: 1-деканал» . Органические синтезы ; Собранные объемы , вып. 6, с. 373 .
- ^ Ода, Харуоми (1934). «Окисление некоторых α-гидрокси-ацидков с тетраацетатом свинца» . Бюллетень химического общества Японии . 9 (1): 8–14. doi : 10.1246/bcsj.9.8 .
- ^ Нвауква, Стивен; Keehn, Philip (1982). «Окислительное расщепление α-диол, α-дионов, α-гидрокси-кетонов и α-гидрокси и α-кето кислоты с гипохлоритом кальция [CA (OCL) 2]». Тетраэдр буквы . 23 (31): 3135–3138. doi : 10.1016/s0040-4039 (00) 88578-0 .
- ^ Верман, Р.А. (1913). «Влияние гипохлорита натрия на ненасыщенные кислоты» . Юстус Либигс Анналы химии . 401 (1): 1–20. Doi : 10.1002/jlac.191340102 .
- ^ Эверетт, Уоллис; Лейн, Джон (1946). Реакция Хофманна . Органические реакции. Тол. 3. С. 267–306. doi : 10.1002/0471264180.or003.07 . ISBN 9780471005285 .
- ^ Саттон, Питер; Уитталл, Джон (2012). Практические методы биокатализа и биотрансформаций 2 . Чичестер, Западный Суссекс: Джон Уайли и сыновья, Ltd. с. 199–202. ISBN 9781119991397 .
- ^ «Альдегид и кетон - NEB Class 12 Chemistry 2080» . ИСВИ ОБРАЗОВАНИЕ . 2023-07-29 . Получено 2023-07-29 .
- ^ «Альдегид таутомеризм». Энциклопедия Британская . 4 июня 2024 года.
- ^ Уоррен, Стюарт; Уайетт, Пол (2008). Органический синтез: подход отключения (2 -е изд.). Уайли. С. 129–133. ISBN 978-0-470-71236-8 .
- ^ Кэри, Фрэнсис А.; Сандберг, Ричард Дж. (2007). Усовершенствованная органическая химия . Тол. A: Структура и механизмы (5 -е изд.). Спрингер. С. 601–608. ISBN 978-0-387-44899-2 .
- ^ Jump up to: а беременный Шрайнер, RL; Германн, CKF; Моррилл, ТК; Кертин, Да; Fuson, RC (1997). Систематическая идентификация органических соединений . Джон Уайли и сыновья. ISBN 978-0-471-59748-3 .
- ^ Furigay, Maxwell H.; Баучер, Мария М.; Mizgier, Nikola A.; Бриндл, Шайенн С. (2018-04-02). «Разделение альдегидов и реактивных кетонов от смесей с использованием протокола экстракции бисульфита» . Журнал визуализированных экспериментов (134): 57639. DOI : 10.3791/57639 . ISSN 1940-087X . PMC 5933314 . PMID 29658940 .
- ^ Чен, Че-Хонг; Феррейра, Хулио Сезар Батиста; Гросс, Эрик Р.; Розен, Дарья Мохли (1 января 2014 г.). «Ориентация на альдегиддегидрогеназу 2: новые терапевтические возможности» . Физиологические обзоры . 94 (1): 1–34. doi : 10.1152/physrev.00017.2013 . PMC 3929114 . PMID 24382882 .
- ^ Kohlpaintner, C.; Schulte, M.; Falbe, J.; Lappe, P. and Weber, J. (2008) «Альдегиды, алифатические» в энциклопедии промышленной химии Уллмана. Wiley-Vch, Weinheim. Два : 10.1002/14356007.a01_321.pub2 .
- ^ Краткое краткое изложение номенклатуры IUPAC Органических соединений, архивных 2006-09-01 на The Wayback Machine , Web Page, колледжи Университета Висконсин, доступ к онлайн-линии 4 августа 2007 года.
- ^ §R-5.6.1, Альдегиды, тиоальдегиды и их аналоги, руководство по номенклатуре IUPAC органических соединений: рекомендации 1993 , IUPAC, Комиссия по номенклатуре органической химии, Blackwell Scientific, 1993.
- ^ §R-5.7.1, карбоновые кислоты, руководство по номенклатуре IUPAC органических соединений: рекомендации 1993 , IUPAC, Комиссия по номенклатуре органической химии, Blackwell Scientific, 1993.
- ^ Liebig, J. (1835) «о продуктах окисления алкоголя» (о продуктах окисления алкоголя), Анналы химии и физики , 59 : 289–327. На стр. 290: «Я опишу это в этой памяти под именем альдегида ; это имя состоит из алкоголя дегидрогената ». ; this name is formed from alcohol dehydrogenatusПолем
- ^ Crosland, Maurice P. (2004), Исторические исследования на языке химии , Publications Courier Dover, ISBN 9780486438023 .