Периодическая таблица
| Часть серии о |
| Периодическая таблица |
|---|
Таблица Менделеева , также известная как периодическая таблица элементов , представляет собой упорядоченное расположение химических элементов в ряды (« периоды ») и столбцы (« группы »). Это символ химии , широко используемый в физике и других науках. Это изображение периодического закона , который гласит, что, когда элементы расположены в порядке их атомных номеров, приблизительная повторяемость их свойств очевидна . Таблица разделена на четыре примерно прямоугольные области, называемые блоками . Элементы одной группы имеют схожие химические характеристики.
вертикальные, горизонтальные и диагональные тенденции Таблицу Менделеева характеризуют . Металлический характер увеличивается при движении вниз по группе и уменьшается слева направо в течение периода. Неметаллический характер увеличивается от нижнего левого угла таблицы Менделеева к правому верхнему углу.
Первой периодической таблицей, ставшей общепринятой, была таблица русского химика Дмитрия Менделеева , составленная в 1869 году; он сформулировал периодический закон как зависимость химических свойств от атомной массы . Поскольку не все элементы тогда были известны, в его таблице Менделеева были пробелы, и Менделеев успешно использовал периодический закон, чтобы предсказать некоторые свойства некоторых недостающих элементов . Периодический закон был признан фундаментальным открытием в конце 19 века. Это было объяснено в начале 20-го века, с открытием атомных чисел и связанными с ним новаторскими работами в области квантовой механики ; обе идеи послужили прояснением внутренней структуры атома. Узнаваемая современная форма таблицы была достигнута в 1945 году, когда Гленн Т. Сиборг открыл, что актиниды на самом деле представляют собой элементы f-блока, а не d-блока. Таблица Менделеева и закон теперь являются центральной и неотъемлемой частью современной химии.
Таблица Менделеева продолжает развиваться вместе с прогрессом науки. В природе существуют только элементы с атомным номером до 94; [а] чтобы идти дальше, необходимо было синтезировать новые элементы в лаборатории. К 2010 году были известны первые 118 элементов, тем самым заполнив первые семь строк таблицы; [1] однако для самых тяжелых элементов по-прежнему необходима химическая характеристика, чтобы подтвердить, что их свойства соответствуют их положению. Новые открытия расширят таблицу за пределы этих семи строк , хотя пока неизвестно, сколько еще элементов возможно; более того, теоретические расчеты предполагают, что эта неизвестная область не будет следовать закономерностям известной части таблицы. Продолжаются также научные дискуссии относительно того, правильно ли расположены некоторые элементы в сегодняшней таблице. Существует множество альтернативных представлений периодического закона, и ведутся дискуссии о том, существует ли оптимальная форма таблицы Менделеева.
Обзор
| Группа | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Водород и щелочные металлы | Щелочноземельные металлы | Испытания | Тетрелы | Pnictogens | Chalcogens | Halogens | Благородный газы | ||||||||||||
| Период | |||||||||||||||||||
| 2 | |||||||||||||||||||
| 3 | |||||||||||||||||||
| 4 | |||||||||||||||||||
| 5 | |||||||||||||||||||
| 6 | |||||||||||||||||||
| 7 | |||||||||||||||||||
- Ca: 40,078 — Сокращенное значение (неопределенность здесь опущена) [3]
- Po: [209] — массовое число наиболее стабильного изотопа.
Каждый химический элемент имеет уникальный атомный номер ( Z ), обозначающий количество протонов в его ядре . [4] Все элементы имеют несколько изотопов , варианты с одинаковым количеством протонов, но разным количеством нейтронов . Например, углерод имеет три встречающихся в природе изотопа: все его атомы имеют шесть протонов и большинство из них также имеют шесть нейтронов, но около одного процента имеют семь нейтронов, а очень небольшая часть имеет восемь нейтронов. Изотопы никогда не разделяются в периодической таблице; они всегда группируются под одним элементом. Когда указывается атомная масса, это обычно средневзвешенное значение природных изотопов; но если в природе в значительных количествах изотопы не встречаются, обычно указывается масса наиболее стабильного изотопа, часто в скобках. [5]
В стандартной периодической таблице элементы перечислены в порядке возрастания атомного Z. номера Новый ряд ( период ) начинается, когда в новой электронной оболочке появляется первый электрон . Столбцы ( группы ) определяются электронной конфигурацией атома; элементы с одинаковым количеством электронов в конкретной подоболочке попадают в одни и те же столбцы (например, кислород , сера и селен находятся в одном столбце, потому что все они имеют четыре электрона во внешней p-подоболочке). Элементы со схожими химическими свойствами обычно попадают в одну и ту же группу периодической таблицы, хотя в f-блоке и, в некоторой степени, в d-блоке элементы одного и того же периода также имеют схожие свойства. Таким образом, относительно легко предсказать химические свойства элемента, если знать свойства окружающих его элементов. [6]
Первые 94 элемента встречаются в природе; [а] остальные 24, от америция до оганессона (95–118), встречаются только при синтезе в лабораториях. Из 94 встречающихся в природе элементов 83 являются первичными , а 11 встречаются только в цепочках распада первичных элементов. Некоторые из последних настолько редки, что не были обнаружены в природе, а были синтезированы в лаборатории до того, как было установлено, что они все-таки существуют в природе: технеций (элемент 43), прометий (элемент 61), астат (элемент 61). 85), нептуний (элемент 93) и плутоний (элемент 94). [7] Ни один элемент тяжелее эйнштейния (элемент 99) никогда не наблюдался в макроскопических количествах в чистом виде, равно как и астат ; франций (элемент 87) был сфотографирован только в виде света , излучаемого микроскопическими количествами (300 000 атомов). [8]
Названия и номера групп
Согласно международному соглашению об именах, группы нумеруются от 1 до 18 от крайнего левого столбца (щелочные металлы) до крайнего правого столбца (благородные газы). Группы f-блоков в этой нумерации игнорируются. [9] Группы также могут быть названы по их первому элементу, например, «группа скандия» для группы 3. [9] Раньше группы обозначались римскими цифрами . В Соединенных Штатах за римскими цифрами следовала либо «А», если группа находилась в s- или p-блоке , либо «B», если группа находилась в d-блоке . Используемые римские цифры соответствуют последней цифре сегодняшнего соглашения об именах (например, элементы группы 4 относились к группе IVB, а элементы группы 14 — к группе IVA). В Европе буквы были аналогичными, за исключением того, что «А» использовалась для групп с 1 по 7, а «В» использовалась для групп с 11 по 17. Кроме того, группы 8, 9 и 10 раньше рассматривались как одна тройка. группа размера, известная в обоих обозначениях как группа VIII. В 1988 году была введена в действие новая система именования IUPAC (Международный союз теоретической и прикладной химии) (1–18), а старые названия групп (I–VIII) были признаны устаревшими. [10]
| группа ИЮПАК | 1 а | 2 | — б | 3 с | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Менделеев (I–VIII) | К | II | III | IV | В | VI | VII | VIII | я | II | III | IV | В | VI | VII | д | |||
| CAS (США, ABA) | Я | ИМА | IIIБ | ИВБ | ВБ | ВИБ | ПРЕБЫВАНИЕ | VIIIB | ИБ | МИБ | IIIА | ИВА | И | С ПОМОЩЬЮ | ОСТАВЛЯТЬ | VIIIА | |||
| Старый ИЮПАК (Европа, AB) | Я | ИМА | IIIА | ИВА | И | С ПОМОЩЬЮ | ОСТАВЛЯТЬ | VIII | ИБ | МИБ | IIIБ | ИВБ | ВБ | ВИБ | ПРЕБЫВАНИЕ | 0 | |||
| Тривиальное имя р | H и щелочные металлы | щелочноземельные металлы | триели | тетрали | pnictogens | chalcogens | halogens | благородные газы | |||||||||||
| Имя по элементу р | литиевая группа | группа бериллия | группа скандия | титановая группа | группа ванадия | группа хрома | марганцевая группа | железная группа | группа кобальта | никелевая группа | медная группа | цинковая группа | группа бора | углеродная группа | группа азота | кислородная группа | группа фтора | гелиевая или неоновая группа | |
| Период 1 | ЧАС | Он | |||||||||||||||||
| Период 2 | Что | Быть | Б | С | Н | ТО | Ф | Ne | |||||||||||
| Период 3 | Уже | мг | Ал | И | П | С | кл. | С | |||||||||||
| Период 4 | К | Что | наук | Из | V | Кр | Мин. | Фе | Ко | В | С | Зн | Здесь | Ге | Как | Се | Бр | НОК | |
| Период 5 | руб. | старший | И | Зр | Нб | Мо | Тс | Ру | резус | ПД | В | компакт-диск | В | Сн | Сб | Te | я | Машина | |
| Период 6 | Cs | Нет | Ла–Иб | Лу | хф | Облицовка | В | Ре | Ты | И | Пт | В | ртуть | Тл | Pb | С | Po | В | Рн |
| Период 7 | Пт | Солнце | Ac–Нет | лр | РФ | ДБ | Сг | Бх | Хс | гора | Дс | Рг | Сп | Нх | В | Мак | Лев | Ц | И |
б 14 групп (столбцов) f-блоков не имеют номера группы.
с Правильный состав группы 3 — это скандий (Sc), иттрий (Y), лютеций (Lu) и лоуренсий (Lr), как показано здесь: это подтверждено 1988 г. [10] и 2021 год [11] Об этом сообщает IUPAC. В текстах по общей неорганической химии скандий (Sc), иттрий (Y), лантан (La) и актиний (Ac) часто помещаются в группу 3, так что Ce-Lu и Th-Lr становятся f-блоком между группами 3 и 4; это было основано на неправильно измеренных электронных конфигурациях из истории, [12] а Лев Ландау и Евгений Лифшиц уже в 1948 году считали это неверным. [13] В современной литературе все еще можно встретить аргументы в ее защиту, но большинство авторов считают их логически непоследовательными. [14] [15] [16] Некоторые источники следуют компромиссу, который помещает La-Lu и Ac-Lr в качестве строк f-блока (несмотря на то, что в каждой строке содержится 15 элементов f-блока, что противоречит квантовой механике), оставляя более тяжелые члены группы 3 неоднозначными. [11] См. также элемент группы 3#Composition .
д Группа 18, благородные газы, не была открыта во времена первоначальной таблицы Менделеева. Позднее (1902 г.) Менделеев принял доказательства их существования, и их можно было поместить в новую «группу 0», последовательно и не нарушая принципа таблицы Менделеева.
р Имя группы, рекомендованное IUPAC.
Формы презентации
Из соображений простора [17] [18] Таблица Менделеева обычно представлена с вырезанными элементами f-блока и расположенными как отдельная часть под основным корпусом. [19] [17] [10] Это уменьшает количество столбцов элементов с 32 до 18. [17]
Обе формы представляют одну и ту же периодическую таблицу. [20] Форму с включенным в основной корпус f-блоком иногда называют 32-колонной. [20] или полная форма; [21] форма с ф-блоком вырезала 18-колонку [20] или средне-длинная форма. [21] Преимущество формы из 32 столбцов состоит в том, что все элементы отображаются в правильной последовательности, но у нее есть недостаток: требуется больше места. [22] Выбранная форма является выбором редакции и не предполагает каких-либо изменений научных утверждений или утверждений. Например, при обсуждении состава группы 3 варианты могут быть показаны одинаково (непредвзято) в обеих формах. [23]
В периодических таблицах обычно хотя бы показаны символы элементов; многие также предоставляют дополнительную информацию об элементах либо посредством цветового кодирования, либо в виде данных в ячейках. В приведенной выше таблице показаны названия и атомные номера элементов, а также их блоки, природные явления и стандартные атомные веса . Для короткоживущих элементов без стандартных атомных весов вместо этого используется массовое число наиболее стабильного известного изотопа. Другие таблицы могут включать такие свойства, как состояние вещества, температуры плавления и кипения, плотности, а также давать различные классификации элементов. [б]
Атомные структуры элементов
Ядро и окружающие его электроны

Наименьшие составляющие всей нормальной материи известны как атомы . Атомы чрезвычайно малы: около одной десятимиллиардной метра в поперечнике; таким образом, их внутренняя структура регулируется квантовой механикой . [24] Атомы состоят из небольшого положительно заряженного ядра , состоящего из положительно заряженных протонов и незаряженных нейтронов , окруженного облаком отрицательно заряженных электронов ; заряды компенсируются, поэтому атомы нейтральны. [25] Электроны участвуют в химических реакциях , а ядро — нет. [25] Когда атомы участвуют в химических реакциях, они либо приобретают, либо теряют электроны, образуя положительно или отрицательно заряженные ионы ; или делиться электронами друг с другом. [19]
Атомы можно разделить на разные типы в зависимости от количества имеющихся у них протонов (а значит, и электронов). [25] Это называется атомным номером , часто обозначаемым Z. [26] (от «Zahl» — по-немецки «число»). Таким образом, каждый отдельный атомный номер соответствует классу атомов: эти классы называются химическими элементами . [27] Химические элементы — это то, что классифицирует и систематизирует таблица Менделеева. Водород — это элемент с атомным номером 1; гелий , атомный номер 2; литий , атомный номер 3; и так далее. Каждое из этих названий может быть дополнительно сокращено одно- или двухбуквенным химическим символом ; для водорода, гелия и лития — соответственно H, He и Li. [20] Нейтроны не влияют на химическую идентичность атома, но влияют на его вес. Атомы с одинаковым числом протонов, но разным числом нейтронов называются изотопами одного и того же химического элемента. [20] Встречающиеся в природе элементы обычно встречаются в виде смесей разных изотопов; поскольку каждый изотоп обычно встречается с характерным содержанием, встречающиеся в природе элементы имеют четко определенный атомный вес , определяемый как средняя масса встречающегося в природе атома этого элемента. [28]
Сегодня известно 118 элементов, первые 94 из которых, как известно, встречаются на Земле в природе в настоящее время. [29] [а] Из 94 природных элементов восемьдесят имеют стабильный изотоп и еще один ( висмут ) имеет почти стабильный изотоп (с периодом полураспада 2,01×10). 19 лет, что более чем в миллиард раз превышает возраст Вселенной ). [32] [с] Еще два, торий и уран , имеют изотопы, подвергающиеся радиоактивному распаду с периодом полураспада, сравнимым с возрастом Земли . Стабильные элементы плюс висмут, торий и уран составляют 83 первичных элемента, сохранившихся с момента формирования Земли. [д] Остальные одиннадцать природных элементов распадаются достаточно быстро, поэтому их дальнейшее присутствие в следовых количествах зависит главным образом от постоянной регенерации в качестве промежуточных продуктов распада тория и урана. [и] Все 24 известных искусственных элемента радиоактивны. [20]
Электронные конфигурации
Таблица Менделеева представляет собой графическое описание периодического закона, [39] который утверждает, что свойства и атомные структуры химических элементов являются периодической функцией их атомного номера . [40] Элементы располагаются в таблице Менделеева в соответствии с их электронными конфигурациями . [41] периодическая повторяемость которых объясняет тенденции свойств в периодической таблице. [42]
Электрон можно рассматривать как обитающий на атомной орбитали , которая характеризует вероятность его нахождения в любой конкретной области вокруг атома. Их энергии квантованы , то есть они могут принимать только дискретные значения. Более того, электроны подчиняются принципу запрета Паули : разные электроны всегда должны находиться в разных состояниях. Это позволяет классифицировать возможные состояния, которые электрон может принимать на различных энергетических уровнях, известных как оболочки, разделенных на отдельные подоболочки, каждая из которых содержит одну или несколько орбиталей. Каждая орбиталь может содержать до двух электронов: они различаются величиной, известной как спин , условно обозначаемой «вверх» или «вниз». [43] [ф] В холодном атоме (находящемся в основном состоянии) электроны располагаются таким образом, что общая энергия, которую они имеют, минимизируется за счет занятия орбиталей с наименьшей энергией. [45] Только крайние электроны (так называемые валентные электроны ) обладают достаточной энергией, чтобы вырваться из ядра и участвовать в химических реакциях с другими атомами. Остальные называются остовными электронами . [46]
| ℓ = | 0 | 1 | 2 | 3 | 4 | 5 | 6 | Емкость снаряда (2 н 2 ) [47] |
|---|---|---|---|---|---|---|---|---|
| орбитальный | с | п | д | ж | г | час | я | |
| п = 1 | 1 с | 2 | ||||||
| п = 2 | 2 с | 2р | 8 | |||||
| п = 3 | 3 с | 3р | 3d | 18 | ||||
| п = 4 | 4 с | 4р | 4д | 4ф | 32 | |||
| п = 5 | 5 с | 5 пенсов | 5д | 5ф | 5г | 50 | ||
| п = 6 | 6 с | 6р | 6д | 6ф | 6г | 6 часов | 72 | |
| п = 7 | 7 с | 7р | 7д | 7ф | 7г | 7 часов | 7и | 98 |
| Емкость подоболочки (4ℓ+2) | 2 | 6 | 10 | 14 | 18 | 22 | 26 | |
Известны элементы, у которых занято до семи оболочек. Первая оболочка содержит только одну орбиталь — сферическую s-орбиталь. Как и в первой оболочке, она называется 1s-орбиталью. Он может удерживать до двух электронов. Вторая оболочка также содержит 2s-орбиталь, а также три 2p-орбитали в форме гантели и, таким образом, может заполнить до восьми электронов (2×1 + 2×3 = 8). Третья оболочка содержит одну 3s-орбиталь, три 3p-орбитали и пять 3d-орбиталей и, таким образом, имеет емкость 2×1 + 2×3 + 2×5 = 18. Четвертая оболочка содержит одну 4s-орбиталь, три 4p-орбитали, пять 4d-орбитали и семь 4f-орбиталей, что дает емкость 2×1 + 2×3 + 2×5 + 2×7 = 32. [17] Более высокие оболочки содержат больше типов орбиталей, продолжающих узор, но такие типы орбиталей не заполняются основными состояниями известных элементов. [48] Типы подоболочек характеризуются квантовыми числами . Четыре числа полностью описывают орбиталь в атоме: главное квантовое число n , азимутальное квантовое число ℓ (тип орбитали), орбитальное магнитное квантовое число m ℓ и спиновое магнитное квантовое число m s . [42]
Порядок заполнения подоболочки

Последовательность заполнения подоболочек в большинстве случаев задается принципом Ауфбау , также известным как правило Маделунга или Клечковского (в честь Эрвина Маделунга и Всеволода Клечковского соответственно). Это правило впервые эмпирически наблюдал Маделунг, а Клечковский и более поздние авторы дали ему теоретическое обоснование. [49] [50] [51] [52] [г] Оболочки перекрываются по энергиям, а правило Маделунга определяет последовательность заполнения согласно: [50]
- 1с ≪ 2с < 2п ≪ 3с < 3п ≪ 4с < 3д < 4п ≪ 5с < 4д < 5п ≪ 6с < 4ф < 5д < 6п ≪ 7с < 5ф < 6д < 7п ≪ ...
Здесь знак ≪ означает «намного меньше чем», в отличие от знака <, означающего просто «меньше чем». [50] Другими словами, электроны выходят на орбитали в порядке возрастания n + ℓ, и если доступны две орбитали с одинаковым значением n та, у которой n меньше. + ℓ, первой занимает [48] [52] В общем, орбитали с одинаковым значением n + ℓ схожи по энергии, но в случае s-орбиталей (с ℓ = 0) квантовые эффекты повышают их энергию, приближаясь к энергии следующей n + ℓ группы. Следовательно, таблица Менделеева обычно рисуется так, чтобы каждая строка (часто называемая периодом) начиналась с заполнения новой s-орбитали, которая соответствует началу новой оболочки. [50] [51] [17] Таким образом, за исключением первой строки, длина каждого периода появляется дважды: [50]
- 2, 8, 8, 18, 18, 32, 32, ...
Перекрытия становятся довольно близкими в той точке, где на сцену выходят d-орбитали. [53] и порядок может немного меняться в зависимости от атомного номера [54] и атомный заряд. [55] [час]
Начиная с простейшего атома, это позволяет нам строить периодическую таблицу по одному в порядке атомного номера, рассматривая случаи отдельных атомов. В водороде есть только один электрон, который должен перейти на орбиталь с самой низкой энергией 1s. Эта электронная конфигурация записывается 1s 1 , где верхний индекс указывает количество электронов в подоболочке. Гелий добавляет второй электрон, который также переходит в 1s, полностью заполняя первую оболочку и давая конфигурацию 1s. 2 . [42] [61] [я]
Начиная с третьего элемента, лития , первая оболочка заполнена, поэтому его третий электрон занимает 2s-орбиталь, что дает 1s-орбиталь. 2 2 с 1 конфигурация. Электрон 2s — единственный валентный электрон лития, поскольку подоболочка 1s теперь слишком прочно связана с ядром, чтобы участвовать в химической связи с другими атомами: такая оболочка называется « основной оболочкой ». Подоболочка 1s — это основная оболочка для всех элементов, начиная с лития. Подоболочку 2s завершает следующий элемент бериллий (1s 2 2 с 2 ). Затем следующие элементы приступают к заполнению подоболочки 2p. Бор (1с 2 2 с 2 2р 1 ) помещает свой новый электрон на 2p-орбиталь; углерод (1с 2 2 с 2 2р 2 ) заполняет вторую 2p-орбиталь; и с азотом (1с 2 2 с 2 2р 3 ) все три 2p-орбитали становятся по отдельности занятыми. Это согласуется с правилом Хунда , которое гласит, что атомы обычно предпочитают по отдельности занять каждую орбиталь одного и того же типа, прежде чем заполнить их вторым электроном. Кислород (1с 2 2 с 2 2р 4 ), фтор (1с 2 2 с 2 2р 5 ) и неон (1 с 2 2 с 2 2р 6 ) затем завершают уже однократно заполненные 2p-орбитали; последний из них полностью заполняет вторую оболочку. [42] [61]
Начиная с элемента 11, натрия , вторая оболочка является полной, что делает вторую оболочку основной оболочкой для этого и всех более тяжелых элементов. Одиннадцатый электрон начинает заполнение третьей оболочки, занимая 3s-орбиталь, образуя конфигурацию 1s. 2 2 с 2 2р 6 3 с 1 для натрия. Эта конфигурация сокращенно обозначается [Ne] 3s. 1 , где [Ne] представляет конфигурацию неона. Магний ([Ne] 3s 2 ) завершает эту 3s-орбиталь, а следующие шесть элементов: алюминий , кремний , фосфор , сера , хлор и аргон заполняют три 3p-орбитали ([Ne] 3s 2 3р 1 через [Ne] 3s 2 3р 6 ). [42] [61] Это создает аналогичную серию, в которой структуры внешней оболочки от натрия до аргона аналогичны структурам от лития до неона и являются основой периодичности химических свойств, которую иллюстрирует таблица Менделеева: [42] при регулярных, но меняющихся промежутках атомных номеров свойства химических элементов примерно повторяются. [39]
Таким образом, первые восемнадцать элементов можно расположить как начало периодической таблицы. Элементы в одном столбце имеют одинаковое количество валентных электронов и аналогичную конфигурацию валентных электронов: эти столбцы называются группами. Единственным исключением является гелий, который имеет два валентных электрона, как бериллий и магний, но обычно его помещают в столбец неона и аргона, чтобы подчеркнуть, что его внешняя оболочка заполнена. (Некоторые современные авторы подвергают сомнению даже это единственное исключение, предпочитая последовательно следовать валентным конфигурациям и помещать гелий над бериллием.) В этом фрагменте таблицы Менделеева восемь столбцов, соответствующих не более восьми электронам внешней оболочки. [19] Начинается период, когда начинает заполняться новая оболочка. [17] Наконец, раскраска иллюстрирует блоки : элементы в s-блоке (окрашенные в красный цвет) заполняют s-орбитали, а элементы в p-блоке (окрашенные в желтый цвет) заполняют p-орбитали. [17]
| 1 ЧАС | 2 Он | 2×1 = 2 элемента 1с | ||||||
| 3 Что | 4 Быть | 5 Б | 6 С | 7 Н | 8 ТО | 9 Ф | 10 Ne | 2×(1+3) = 8 элементов 2с 2п |
| 11 Уже | 12 мг | 13 Ал | 14 И | 15 П | 16 С | 17 кл. | 18 С | 2×(1+3) = 8 элементов 3с 3р |
Начиная со следующего ряда, для калия и кальция подоболочка 4s имеет наименьшую энергию, и поэтому они ее заполняют. [42] [61] Калий добавляет один электрон к оболочке 4s ([Ar] 4s 1 ), а затем его завершает кальций ([Ar] 4s 2 ). Однако, начиная со скандия ([Ar] 3d 1 4 с 2 ) 3d подоболочка становится следующей по величине по энергии. Подоболочки 4s и 3d имеют примерно одинаковую энергию и конкурируют за заполнение электронов, поэтому заполнение 3d-орбиталей по одной за раз не совсем последовательно. Точный энергетический порядок 3d и 4s меняется вдоль ряда, а также меняется в зависимости от того, сколько электронов удалено из атома. Например, из-за отталкивания между 3d-электронами и 4s-электронами у хрома энергетический уровень 4s становится несколько выше, чем 3d, и поэтому атому хрома становится выгоднее иметь [Ar]3d 5 4 с 1 конфигурация, чем [Ar] 3d 4 4 с 2 один. Аналогичная аномалия наблюдается у меди , атом которой имеет [Ar]3d 10 4 с 1 конфигурация, а не ожидаемая [Ar] 3d 9 4 с 2 . [42] Это нарушение правила Маделунга. Однако никакого химического значения такие аномалии не имеют: [55] большая часть химии не связана с изолированными газообразными атомами, [63] и различные конфигурации настолько близки по энергии друг к другу [53] что присутствие соседнего атома может изменить баланс. [42] Поэтому таблица Менделеева их игнорирует и рассматривает только идеализированные конфигурации. [41]
По цинку ([Ar]3d 10 4 с 2 ), 3d-орбитали полностью заполнены десятью электронами. [42] [61] Далее следуют 4p-орбитали, завершающие ряд, которые постепенно заполняются галлием ([Ar] 3d 10 4 с 2 4р 1 ) через криптон ([Ar] 3d 10 4 с 2 4р 6 ), аналогично предыдущим элементам p-блока. [42] [61] Начиная с галлия, 3d-орбитали составляют часть электронного ядра и больше не участвуют в химических процессах. [60] Элементы s- и p-блока, заполняющие их внешние оболочки, называются элементами основной группы ; элементы d-блока (окрашены синим цветом ниже), которые заполняют внутреннюю оболочку, называются переходными элементами (или переходными металлами, поскольку все они являются металлами). [64]
Следующие восемнадцать элементов заполняют орбитали 5s ( рубидий и стронций ), затем 4d ( от иттрия через кадмий , опять же с несколькими аномалиями по пути), а затем 5p ( от индия через ксенон ). [17] [61] Опять же, начиная с индия, 4d-орбитали находятся в ядре. [61] [65] Следовательно, пятая строка имеет ту же структуру, что и четвертая. [17]
| 1 ЧАС | 2 Он | 2×1 = 2 элемента 1с | ||||||||||||||||
| 3 Что | 4 Быть | 5 Б | 6 С | 7 Н | 8 ТО | 9 Ф | 10 Ne | 2×(1+3) = 8 элементов 2с 2п | ||||||||||
| 11 Уже | 12 мг | 13 Ал | 14 И | 15 П | 16 С | 17 кл. | 18 С | 2×(1+3) = 8 элементов 3с 3п | ||||||||||
| 19 К | 20 Что | 21 наук | 22 Из | 23 V | 24 Кр | 25 Мин. | 26 Фе | 27 Ко | 28 В | 29 С | 30 Зн | 31 Здесь | 32 Ге | 33 Как | 34 Се | 35 Бр | 36 НОК | 2×(1+3+5) = 18 элементов 4с 3д 4п |
| 37 руб. | 38 старший | 39 И | 40 Зр | 41 Нб | 42 Мо | 43 Тс | 44 Ру | 45 резус | 46 ПД | 47 В | 48 компакт-диск | 49 В | 50 Сн | 51 Сб | 52 Te | 53 я | 54 Машина | 2×(1+3+5) = 18 элементов 5с 4д 5п |
Шестая строка таблицы также начинается с двух элементов s-блока: цезия и бария . [61] После этого начинают появляться первые элементы f-блока (окрашены в зеленый цвет ниже), начиная с лантана . Их иногда называют внутренними переходными элементами. [64] Поскольку теперь существуют не только подоболочки 4f, но также подоболочки 5d и 6s с одинаковыми энергиями, конкуренция снова возникает со многими нерегулярными конфигурациями; [53] это привело к некоторому спору о том, где именно должен начинаться f-блок, но большинство изучающих этот вопрос согласны с тем, что он начинается в лантане в соответствии с принципом Ауфбау. [14] Несмотря на то, что лантан сам по себе не заполняет подоболочку 4f как один атом из-за отталкивания между электронами, [55] его 4f-орбитали имеют достаточно низкую энергию, чтобы участвовать в химических процессах. [66] [56] [67] У иттербия семь 4f-орбиталей полностью заполнены четырнадцатью электронами; после этого следует ряд из десяти переходных элементов ( от лютеция через ртуть ), [61] [68] [69] [70] и, наконец, шесть элементов основной группы ( от таллия до радона ) завершают период. [61] [71] Начиная с лютеция, 4f-орбитали находятся в ядре. [61] [67] и, начиная с таллия, - 5d-орбитали. [61] [60] [72]
Седьмой ряд аналогичен шестому ряду: заполняется 7s ( франций и радий ), затем 5f ( актиний в нобелий ), затем 6d ( лауренсий в коперниций ) и, наконец, 7p ( нихоний в оганессон ). [61] Начиная с лоуренция, в ядре находятся 5f-орбитали, [61] и, вероятно, 6d-орбитали присоединяются к ядру, начиная с нихония. [61] [73] [Дж] Опять же, на этом пути есть несколько аномалий: [17] например, поскольку отдельные атомы ни актиний, ни торий на самом деле не заполняют подоболочку 5f, а лоуренсий не заполняет оболочку 6d, но все эти подоболочки все равно могут заполняться в химической среде. [75] [76] [77] Очень долгое время седьмой ряд был неполным, так как большинство его элементов не встречаются в природе. Недостающие элементы, помимо урана, начали синтезировать в лаборатории в 1940 году, когда был получен нептуний. [78] (Однако первым элементом, открытым путем синтеза, а не в природе, был технеций в 1937 году.) Ряд завершился синтезом теннессина в 2010 году. [79] (последний элемент оганессона уже был изготовлен в 2002 году), [80] а последние элементы в этом седьмом ряду получили имена в 2016 году. [81]
| 1 ЧАС | 2 Он | 2×1 = 2 элемента 1с | ||||||||||||||||||||||||||||||
| 3 Что | 4 Быть | 5 Б | 6 С | 7 Н | 8 ТО | 9 Ф | 10 Ne | 2×(1+3) = 8 элементов 2с 2п | ||||||||||||||||||||||||
| 11 Уже | 12 мг | 13 Ал | 14 И | 15 П | 16 С | 17 кл. | 18 С | 2×(1+3) = 8 элементов 3с 3п | ||||||||||||||||||||||||
| 19 К | 20 Что | 21 наук | 22 Из | 23 V | 24 Кр | 25 Мин. | 26 Фе | 27 Ко | 28 В | 29 С | 30 Зн | 31 Здесь | 32 Ге | 33 Как | 34 Се | 35 Бр | 36 НОК | 2×(1+3+5) = 18 элементов 4с 3д 4п | ||||||||||||||
| 37 руб. | 38 старший | 39 И | 40 Зр | 41 Нб | 42 Мо | 43 Тс | 44 Ру | 45 резус | 46 ПД | 47 В | 48 компакт-диск | 49 В | 50 Сн | 51 Сб | 52 Te | 53 я | 54 Машина | 2×(1+3+5) = 18 элементов 5с 4д 5п | ||||||||||||||
| 55 Cs | 56 Нет | 57 La | 58 Этот | 59 Пр | 60 Нд | 61 вечера | 62 см | 63 Евросоюз | 64 Б-г | 65 Тб | 66 Те | 67 К | 68 Является | 69 Тм | 70 Ыб | 71 Лу | 72 хф | 73 Облицовка | 74 В | 75 Ре | 76 Ты | 77 И | 78 Пт | 79 В | 80 ртуть | 81 Тл | 82 Pb | 83 С | 84 Po | 85 В | 86 Рн | 2×(1+3+5+7) = 32 элемента 6с 4ф 5д 6п |
| 87 Пт | 88 Солнце | 89 И | 90 че | 91 Хорошо | 92 В | 93 Например | 94 Мог | 95 Являюсь | 96 См | 97 Бк | 98 См. | 99 Является | 100 Фм | 101 Мэриленд | 102 Нет | 103 лр | 104 РФ | 105 ДБ | 106 Сг | 107 Бх | 108 Хс | 109 гора | 110 Дс | 111 Рг | 112 Сп | 113 Нх | 114 В | 115 Мак | 116 Лев | 117 Ц | 118 И | 2×(1+3+5+7) = 32 элемента 7с 5ф 6д 7п |
Это завершает современную таблицу Менделеева, все семь рядов которой заполнены до отказа. [81]
Таблица электронной конфигурации
В следующей таблице показана электронная конфигурация нейтрального атома газовой фазы каждого элемента. В разных химических средах могут быть предпочтительны разные конфигурации. [55] Элементы основной группы имеют полностью правильную электронную конфигурацию; переходный и внутренний переходные элементы имеют двадцать неровностей из-за упомянутой выше конкуренции между близкими по энергетическому уровню подоболочками. По последним десяти элементам (109–118) экспериментальные данные отсутствуют. [82] поэтому вместо них показаны расчетные конфигурации. [83] Полностью заполненные подоболочки выделены серым цветом.
| Группа : | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1с: | 1 ЧАС 1 | 2 Он 2 | ||||||||||||||||||||||||||||||
| [Он] 2 с: 2п: | 3 Что 1 - | 4 Быть 2 - | 5 Б 2 1 | 6 С 2 2 | 7 Н 2 3 | 8 ТО 2 4 | 9 Ф 2 5 | 10 Ne 2 6 | ||||||||||||||||||||||||
| [Ne] 3с: 3р: | 11 Уже 1 - | 12 мг 2 - | 13 Ал 2 1 | 14 И 2 2 | 15 П 2 3 | 16 С 2 4 | 17 кл. 2 5 | 18 С 2 6 | ||||||||||||||||||||||||
| [С] 4с: 3d: 4п: | 19 К 1 - - | 20 Что 2 - - | 21 наук 2 1 - | 22 Из 2 2 - | 23 V 2 3 - | 24 Кр 1 5 - | 25 Мин. 2 5 - | 26 Фе 2 6 - | 27 Ко 2 7 - | 28 В 2 8 - | 29 С 1 10 - | 30 Зн 2 10 - | 31 Здесь 2 10 1 | 32 Ге 2 10 2 | 33 Как 2 10 3 | 34 Се 2 10 4 | 35 Бр 2 10 5 | 36 НОК 2 10 6 | ||||||||||||||
| [кр] 5 с: 4д: 5р: | 37 руб. 1 - - | 38 старший 2 - - | 39 И 2 1 - | 40 Зр 2 2 - | 41 Нб 1 4 - | 42 Мо 1 5 - | 43 Тс 2 5 - | 44 Ру 1 7 - | 45 резус 1 8 - | 46 ПД - 10 - | 47 В 1 10 - | 48 компакт-диск 2 10 - | 49 В 2 10 1 | 50 Сн 2 10 2 | 51 Сб 2 10 3 | 52 Te 2 10 4 | 53 я 2 10 5 | 54 Машина 2 10 6 | ||||||||||||||
| [Машина] 6 с: 4ф: 5д: 6р: | 55 Cs 1 - - - | 56 Нет 2 - - - | 57 La 2 - 1 - | 58 Этот 2 1 1 - | 59 Пр 2 3 - - | 60 Нд 2 4 - - | 61 вечера 2 5 - - | 62 см 2 6 - - | 63 Евросоюз 2 7 - - | 64 Б-г 2 7 1 - | 65 Тб 2 9 - - | 66 Те 2 10 - - | 67 К 2 11 - - | 68 Является 2 12 - - | 69 Тм 2 13 - - | 70 Ыб 2 14 - - | 71 Лу 2 14 1 - | 72 хф 2 14 2 - | 73 Облицовка 2 14 3 - | 74 В 2 14 4 - | 75 Ре 2 14 5 - | 76 Ты 2 14 6 - | 77 И 2 14 7 - | 78 Пт 1 14 9 - | 79 В 1 14 10 - | 80 ртуть 2 14 10 - | 81 Тл 2 14 10 1 | 82 Pb 2 14 10 2 | 83 С 2 14 10 3 | 84 Po 2 14 10 4 | 85 В 2 14 10 5 | 86 Рн 2 14 10 6 |
| [Рн] 7 с: 5ф: 6д: 7р: | 87 Пт 1 - - - | 88 Солнце 2 - - - | 89 И 2 - 1 - | 90 че 2 - 2 - | 91 Хорошо 2 2 1 - | 92 В 2 3 1 - | 93 Например 2 4 1 - | 94 Мог 2 6 - - | 95 Являюсь 2 7 - - | 96 См 2 7 1 - | 97 Бк 2 9 - - | 98 См. 2 10 - - | 99 Является 2 11 - - | 100 Фм 2 12 - - | 101 Мэриленд 2 13 - - | 102 Нет 2 14 - - | 103 лр 2 14 - 1 | 104 РФ 2 14 2 - | 105 ДБ 2 14 3 - | 106 Сг 2 14 4 - | 107 Бх 2 14 5 - | 108 Хс 2 14 6 - | 109 гора 2 14 7 - | 110 Дс 2 14 8 - | 111 Рг 2 14 9 - | 112 Сп 2 14 10 - | 113 Нх 2 14 10 1 | 114 В 2 14 10 2 | 115 Мак 2 14 10 3 | 116 Лев 2 14 10 4 | 117 Ц 2 14 10 5 | 118 И 2 14 10 6 |
Вариации
Период 1
Хотя современная таблица Менделеева сегодня является стандартной, размещение элементов периода 1, водорода и гелия, остается открытым вопросом, обсуждаемым, и можно найти некоторые вариации. [60] [84] Следуя своим соответствующим 1 и с 2 В электронных конфигурациях водород будет помещен в группу 1, а гелий — во 2 группу. [60] Помещение водорода в группу 1 является обычным явлением, но гелий почти всегда помещается в группу 18 вместе с другими благородными газами. [20] Дебаты связаны с противоречивым пониманием того, в какой степени химические или электронные свойства должны определять размещение в таблице Менделеева. [84]
Как и металлы первой группы, водород имеет один электрон во внешней оболочке. [85] и обычно теряет свой единственный электрон в химических реакциях. [86] Водород обладает некоторыми металлоподобными химическими свойствами и способен вытеснять некоторые металлы из их солей . [86] Но при стандартных условиях он образует двухатомный неметаллический газ, в отличие от щелочных металлов, которые являются химически активными твердыми металлами. водорода Это, а также образование гидридов , в которых он приобретает электрон, приближает его по свойствам к галогенам , которые делают то же самое. [86] (хотя водород реже образует H − чем Ч + ). [87] Более того, два самых легких галогена ( фтор и хлор ) при стандартных условиях являются газообразными, как водород. [86] Некоторые свойства водорода не подходят ни для одной из групп: водород не является ни сильным окислителем, ни сильным восстановителем и не вступает в реакцию с водой. [87] Таким образом, водород имеет свойства, соответствующие свойствам как щелочных металлов, так и галогенов, но не соответствует полностью ни одной из групп, и поэтому его трудно определить по химическому составу. [86] Следовательно, хотя электронное расположение водорода в группе 1 преобладает, в некоторых более редких расположениях водород находится либо в группе 17, либо в группе 17. [88] дублируют водород в обеих группах 1 и 17, [89] [90] или разместите его отдельно от всех групп. [90] [91] [60] Тем не менее этот последний вариант подвергся критике со стороны химика и философа науки Эрика Шерри на том основании, что он, по-видимому, подразумевает, что водород вообще находится над периодическим законом, в отличие от всех других элементов. [92]
Гелий — единственный элемент, который обычно занимает в таблице Менделеева положение, не соответствующее его электронной структуре. На внешней оболочке у него два электрона, тогда как у других благородных газов их восемь; и это элемент s-блока, тогда как все остальные благородные газы являются элементами p-блока. Однако он инертен в стандартных условиях и имеет полную внешнюю оболочку: эти свойства аналогичны свойствам благородных газов группы 18, но совсем не свойственны реакционноспособным щелочноземельным металлам группы 2. По этим причинам гелий почти всегда относят к группе 18 [20] каким его свойствам лучше всего соответствуют; [60] По этим причинам предложение о переводе гелия в группу 2 было отклонено ИЮПАК в 1988 году. [10] Тем не менее, гелий и сегодня иногда относят ко второй группе. [93] а некоторые его физические и химические свойства ближе к элементам группы 2 и поддерживают электронное размещение. [85] [60] Твердый гелий кристаллизуется в гексагональную плотноупакованную структуру, которая соответствует бериллию и магнию из группы 2, но не другим благородным газам из группы 18. [94] Недавние теоретические разработки в области химии благородных газов, в которых ожидается, что гелий будет проявлять немного меньшую инертность, чем неон, и образовывать (HeO)(LiF) 2 со структурой, аналогичной аналогичному соединению бериллия (но без ожидаемого неонового аналога), привели к все больше химиков выступают за отнесение гелия к группе 2. Это относится к электронному аргументу, поскольку причиной большей инертности неона является отталкивание от его заполненной p-оболочки, которой нет у гелия, хотя на самом деле маловероятно, что гелийсодержащие молекулы будут стабилен вне условий экстремально низких температур (около 10 К ). [95] [96] [97] [98]
Аномалия первого ряда в таблице Менделеева также была указана в пользу перехода гелия в группу 2. Она возникает из-за того, что первая орбиталь любого типа необычно мала, поскольку, в отличие от своих более высоких аналогов, она не испытывает межэлектронного отталкивания от меньшей орбитали. того же типа. Это делает первый ряд элементов в каждом блоке необычно маленьким, и такие элементы имеют тенденцию демонстрировать характерные для своей группы виды аномалий. Некоторые химики, выступающие за изменение положения гелия, указали, что гелий проявляет эти аномалии, если его поместить в группу 2, но не в том случае, если его поместить в группу 18: с другой стороны, неон, который был бы первым элементом группы 18, если бы он был помещен в группу 18. гелий, удаленный из этого места, действительно демонстрирует эти аномалии. [95] Затем утверждается, что отношения между гелием и бериллием напоминают отношения между водородом и литием, и это положение гораздо более общепринято. [96] Например, из-за такой тенденции размеров орбиталей в группах 1 и 13–17 наблюдается большая разница в атомных радиусах между первыми и вторыми членами каждой основной группы: она существует между неоном и аргоном, между гелием и бериллий, но не между гелием и неоном. Это аналогичным образом влияет на температуру кипения и растворимость благородных газов в воде, где гелий слишком близок к неону, а большая разница, характерная для первых двух элементов группы, проявляется только между неоном и аргоном. Перемещение гелия в группу 2 делает эту тенденцию последовательной и в группах 2 и 18, делая гелий элементом первой группы 2, а неон - элементом первой группы 18: оба проявляют характерные свойства кайносимметричного первого элемента группы. [99] [100] Тем не менее размещение гелия в 18-й группе остается почти универсальным из-за его чрезвычайной инертности. [101] Кроме того, редко можно встретить таблицы, в которых водород и гелий находятся вне всех групп. [91] [60] [61]
Группа 3
Во многих таблицах Менделеева f-блок сдвинут на один элемент вправо, так что лантан и актиний становятся элементами d-блока в группе 3, а Ce-Lu и Th-Lr образуют f-блок. Таким образом, d-блок разделен на две очень неровные части. Это пережиток ранних ошибочных измерений электронных конфигураций; современные измерения более согласуются с формой с лютецием и лоуренсием в группе 3, а также с La–Yb и Ac–No в качестве f-блока. [12] [102]
Оболочка 4f полностью заполнена иттербием, и по этой причине Лев Ландау и Евгений Лифшиц в 1948 году сочли неправильным относить лютеций к элементу f-блока. [13] Они еще не предприняли шаг по удалению лантана из d-блока, но в 1963 году Дзюн Кондо понял, что низкотемпературная сверхпроводимость лантана подразумевает активность его 4f-оболочки. [103] В 1965 году Дэвид К. Гамильтон связал это наблюдение с его положением в таблице Менделеева и утверждал, что f-блок должен состоять из элементов La – Yb и Ac – No. [66] С тех пор физические, химические и электронные доказательства подтвердили это предположение. [12] [10] [102] Этот вопрос привлек широкое внимание Уильямом Б. Дженсеном в 1982 году. [12] а отнесение лютеция и лоуренция к группе 3 было поддержано отчетами IUPAC, датированными 1988 годом (когда были рекомендованы номера групп 1–18). [10] и 2021 год. [11] Тем не менее, это изменение все еще существует, поскольку большинство авторов учебников не знают об этой проблеме. [12]
Иногда можно встретить третью форму, при которой места под иттрием в группе 3 остаются пустыми, как, например, в таблице на веб-сайте ИЮПАК: [20] но это создает несоответствие с квантовой механикой, поскольку ширина f-блока составляет 15 элементов (La-Lu и Ac-Lr), хотя в f-подоболочку могут поместиться только 14 электронов. [11] Более того, в литературе существует некоторая путаница относительно того, какие элементы относятся к группе 3. [11] [21] [104] [105] [106] Хотя в отчете IUPAC 2021 года отмечалось, что f-блоки из 15 элементов поддерживаются некоторыми практиками специализированной отрасли релятивистской квантовой механики, фокусирующейся на свойствах сверхтяжелых элементов , мнение проекта заключалось в том, что такие озабоченности, зависящие от интересов, не должны иметь никакого значения. в зависимости от того, как таблица Менделеева представлена «широкому химическому и научному сообществу». [11] Другие авторы, сосредоточившие внимание на сверхтяжелых элементах, с тех пор пояснили, что «15-я запись f-блока представляет собой первый слот d-блока, который остается свободным, чтобы указать место вставок f-блока», что означало бы, что эта форма по-прежнему имеет лютеций и лоуренсий (15-я рассматриваемая запись) в качестве элементов d-блока в группе 3. [107] Действительно, когда публикации ИЮПАК расширяют таблицу до 32 столбцов, они ясно дают это понять и помещают лютеций и лоуренсий после иттрия в группу 3. [108] [109]
В литературе можно встретить несколько аргументов в пользу Sc-Y-La-Ac. [110] [111] но они были подвергнуты сомнению как логически непоследовательные. [14] [15] [16] Например, утверждалось, что лантан и актиний не могут быть элементами f-блока, потому что как отдельные атомы газовой фазы они еще не начали заполнять f-подоболочки. [112] Но то же самое верно и для тория, который никогда не оспаривался как элемент f-блока. [11] [12] и этот аргумент упускает из виду проблему с другой стороны: что f-оболочки полностью заполняются у иттербия и нобелия, что соответствует форме Sc-Y-Lu-Lr, а не у лютеция и лоуренция, как у формы Sc-Y-La-Ac. было бы это. [113] Мало того, что такие исключительные конфигурации встречаются в меньшинстве, [113] но они также в любом случае никогда не считались важными для размещения каких-либо других элементов в таблице Менделеева: в газообразных атомах d-оболочки завершают свое заполнение у меди, палладия и золота, но химики общепризнаны, что эти конфигурации являются исключительными и что d-блок действительно заканчивается в соответствии с правилом Маделунга на цинке, кадмии и ртути. [21] Соответствующий факт для размещения [41] [68] заключается в том, что лантан и актиний (как и торий) имеют валентные f-орбитали, которые могут заниматься в химической среде, тогда как лютеций и лоуренсий этого не делают: [61] [114] [77] их f-оболочки находятся в ядре и не могут использоваться для химических реакций. [67] [115] Таким образом, связь между иттрием и лантаном является лишь вторичной связью между элементами с одинаковым числом валентных электронов, но разными типами валентных орбиталей, например, между хромом и ураном; тогда как связь между иттрием и лютецием является первичной, поскольку они имеют общее как количество валентных электронов, так и тип валентной орбитали. [61]
Периодические тенденции
Поскольку в химических реакциях участвуют валентные электроны, [19] Можно ожидать, что элементы со схожими внешними электронными конфигурациями будут реагировать аналогичным образом и образовывать соединения с одинаковыми пропорциями элементов в них. [116] Такие элементы помещаются в одну и ту же группу, и поэтому при движении вниз по группе, как правило, наблюдаются явные сходства и тенденции в химическом поведении. [117] Поскольку аналогичные конфигурации возникают через равные промежутки времени, свойства элементов демонстрируют периодическую повторяемость, отсюда и название таблицы Менделеева и периодического закона. Эти периодические повторения были замечены задолго до того, как была разработана основная теория, объясняющая их. [118] [119]
Атомный радиус
Исторически физический размер атомов был неизвестен до начала 20 века. Первая расчетная оценка атомного радиуса водорода была опубликована физиком Артуром Хаасом в 1910 году с точностью до порядка (в 10 раз) принятого значения - радиуса Бора (~ 0,529 Å). В своей модели Хаас использовал одноэлектронную конфигурацию, основанную на классической атомной модели, предложенной Дж. Дж. Томсоном в 1904 году, часто называемой моделью сливового пудинга . [120]
Атомные радиусы (размеры атомов) зависят от размеров их крайних орбиталей. [99] Обычно они уменьшаются слева направо вдоль элементов главной группы, поскольку заряд ядра увеличивается, но внешние электроны все еще находятся в той же оболочке. Однако при движении вниз по столбцу радиусы обычно увеличиваются, поскольку самые внешние электроны находятся в более высоких оболочках, которые, следовательно, находятся дальше от ядра. [19] [121] Первый ряд каждого блока аномально мал из-за эффекта, называемого кайносимметрией или примогенным отталкиванием: [122] подоболочки 1s, 2p, 3d и 4f не имеют внутренних аналогов. Например, 2p-орбитали не испытывают сильного отталкивания от 1s- и 2s-орбиталей, которые имеют совершенно разные распределения углового заряда и, следовательно, не очень велики; но 3p-орбитали испытывают сильное отталкивание от 2p-орбиталей, которые имеют аналогичное распределение углового заряда. Таким образом, более высокие s-, p-, d- и f-подоболочки испытывают сильное отталкивание от своих внутренних аналогов, которые имеют примерно такое же угловое распределение заряда, и должны расширяться, чтобы избежать этого. Это приводит к возникновению существенных различий между небольшими 2p-элементами, которые предпочитают множественные связи , и более крупными 3p-элементами и более высокими p-элементами, которые этого не делают. [99] Аналогичные аномалии возникают для элементов 1s, 2p, 3d, 4f и гипотетического 5g: [123] степень этой аномалии первого ряда наиболее высока для s-блока, умеренна для р-блока и менее выражена для d- и f-блоков. [124]
У переходных элементов внутренняя оболочка заполняется, но размер атома по-прежнему определяется внешними электронами. Увеличение заряда ядра в серии и увеличение количества внутренних электронов для экранирования несколько компенсируют друг друга, поэтому уменьшение радиуса меньше. [121] Атомы 4p и 5d, возникающие сразу после появления новых типов переходных рядов, меньше, чем можно было бы ожидать. [125] потому что добавленные подоболочки ядра 3d и 4f обеспечивают лишь неполную защиту ядерного заряда для внешних электронов. Следовательно, например, атомы галлия немного меньше атомов алюминия. [99] Вместе с каиносимметрией это приводит к четно-нечетной разнице периодов (кроме s-блока). [к] это иногда называют вторичной периодичностью: элементы в четных периодах имеют меньшие атомные радиусы и предпочитают терять меньше электронов, тогда как элементы в нечетных периодах (кроме первого) различаются в противоположном направлении. Так, например, многие свойства в p-блоке демонстрируют зигзагообразную, а не плавную тенденцию вдоль группы. Например, фосфор и сурьма в нечетные периоды 15-й группы легко достигают степени окисления +5, тогда как азот, мышьяк и висмут в четные периоды предпочитают оставаться при +3. [124] [126] Аналогичная ситуация наблюдается и для d-блока: лютеций через атомы вольфрама немного меньше, чем иттрий через атомы молибдена соответственно. [127] [128]

Атомы таллия и свинца примерно такого же размера, как атомы индия и олова соответственно, но от висмута до радона атомы 6p больше, чем аналогичные атомы 5p. Это происходит потому, что когда атомные ядра становятся сильно заряженными, возникает необходимость в специальной теории относительности , чтобы оценить влияние ядра на электронное облако. Эти релятивистские эффекты приводят к тому, что тяжелые элементы все чаще имеют свойства, отличающиеся от их более легких гомологов в таблице Менделеева. Спин-орбитальное взаимодействие расщепляет p-подоболочку: одна p-орбиталь релятивистски стабилизируется и сжимается (она заполняется таллием и свинцом), но две другие (заполняются висмутом через радон) релятивистски дестабилизируются и расширяются. [99] Релятивистские эффекты также объясняют, почему золото золотое, а ртуть — жидкость при комнатной температуре. [129] [130] Ожидается, что они станут очень сильными в конце седьмого периода, что потенциально может привести к коллапсу периодичности. [131] Электронные конфигурации четко известны только до элемента 108 ( хассий ), а экспериментальная химия за пределами 108 проводилась только для 112 ( коперниций ), 113 ( нихоний ) и 114 ( флеровий ), поэтому химическая характеристика самых тяжелых элементов остается темой. текущих исследований. [132]
Тенденция уменьшения атомных радиусов слева направо также присутствует в ионных радиусах , хотя ее сложнее исследовать, поскольку наиболее распространенные ионы последовательных элементов обычно различаются по заряду. Ионы с одинаковой электронной конфигурацией уменьшаются в размерах по мере увеличения их атомного номера из-за увеличения притяжения со стороны более положительно заряженного ядра: так, например, ионные радиусы уменьшаются в ряду Se 2− , Бр − , руб. + , сэр 2+ , И 3+ , Зр 4+ , Нб 5+ , Мо 6+ , Тс 7+ . Ионы одного и того же элемента становятся меньше по мере удаления большего количества электронов, потому что притяжение ядра начинает перевешивать отталкивание между электронами, что приводит к расширению электронных облаков: так, например, ионные радиусы уменьшаются в ряду V. 2+ , V 3+ , V 4+ , V 5+ . [133]
Энергия ионизации

Первая энергия ионизации атома — это энергия, необходимая для отрыва от него электрона. Это зависит от радиуса атома: энергия ионизации увеличивается слева направо и вниз вверх, поскольку электроны, находящиеся ближе к ядру, удерживаются крепче и их труднее удалить. Таким образом, энергия ионизации минимизируется в первом элементе каждого периода – водороде и щелочных металлах – и затем обычно возрастает, пока не достигнет благородного газа на правом краю периода. [19] Есть некоторые исключения из этой тенденции, например кислород, где удаляемый электрон спарен, и, таким образом, межэлектронное отталкивание облегчает удаление, чем ожидалось. [134]
В переходной серии внешние электроны преимущественно теряются, хотя внутренние орбитали заполняются. Например, в 3d-серии первыми теряются 4s-электроны, хотя 3d-орбитали заполняются. Экранирующий эффект добавления дополнительного 3d-электрона примерно компенсирует рост заряда ядра, и поэтому энергии ионизации остаются в основном постоянными, хотя наблюдается небольшое увеличение, особенно в конце каждой серии переходов. [135]
Поскольку атомы металлов имеют тенденцию терять электроны в химических реакциях, энергия ионизации обычно коррелирует с химической реакционной способностью, хотя есть и другие факторы. [135]
Сродство к электрону
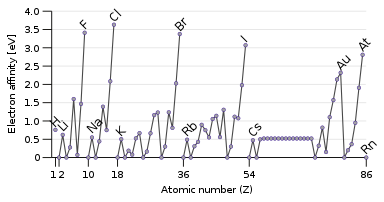
Свойством, противоположным энергии ионизации, является сродство к электрону , которое представляет собой энергию, выделяющуюся при присоединении электрона к атому. [136] Пролетающий электрон будет легче притянуться к атому, если он сильнее почувствует притяжение ядра, и особенно если есть доступная частично заполненная внешняя орбиталь, которая может вместить его. Следовательно, сродство к электрону имеет тенденцию увеличиваться сверху вниз и слева направо. Исключение составляет последний столбец — благородные газы, имеющие полную оболочку и не имеющие места для другого электрона. Это дает галогенам в предпоследнем столбце самое высокое сродство к электрону. [19]
Некоторые атомы, например благородные газы, не имеют сродства к электрону: они не могут образовывать стабильные анионы в газовой фазе. [137] (Они могут образовывать метастабильные резонансы , если входящий электрон прилетает с достаточной кинетической энергией, но они неизбежно и быстро самоотделяются : например, время жизни самого долгоживущего гелия − уровень составляет около 359 микросекунд.) [138] Благородные газы, имеющие высокую энергию ионизации и не имеющие сродства к электрону, мало склонны к приобретению или потере электронов и, как правило, нереакционноспособны. [19]
Встречаются некоторые исключения из этих тенденций: кислород и фтор имеют более низкое сродство к электрону, чем их более тяжелые гомологи, сера и хлор, поскольку они представляют собой маленькие атомы, и, следовательно, вновь добавленный электрон будет испытывать значительное отталкивание от уже имеющихся. Для неметаллических элементов сродство к электрону также в некоторой степени коррелирует с реакционной способностью, но не идеально, поскольку здесь задействованы и другие факторы. Например, фтор имеет более низкое сродство к электрону, чем хлор (из-за сильного межэлектронного отталкивания очень маленького атома фтора), но более реакционноспособен. [136]
Валентность и степени окисления
Валентность т.е. элемента можно определить либо как количество атомов водорода, которые могут объединиться с ним с образованием простого бинарного гидрида, либо как удвоенное количество атомов кислорода, которые могут объединиться с ним с образованием простого бинарного оксида ( не пероксид или супероксид ). [113] Валентность элементов основной группы напрямую связана с номером группы: гидриды в основных группах 1–2 и 13–17 имеют формулы MH, MH 2 , MH 3 , MH 4 , MH 3 , MH 2 и наконец МХ. Вместо этого высшие оксиды увеличивают валентность по формулам M 2 O, MO, M 2 O 3 , MO 2 , M 2 O 5 , MO 3 , M 2 O 7 . [л] Сегодня понятие валентности было расширено за счет степени окисления , которая представляет собой формальный заряд, остающийся на элементе, когда все другие элементы в соединении удалены в виде своих ионов. [116]
Электронная конфигурация предполагает готовое объяснение количества электронов, доступных для связи; [116] действительно, количество валентных электронов начинается с 1 в группе 1, а затем увеличивается к правой части таблицы Менделеева, сбрасываясь только на 3 каждый раз, когда начинается каждый новый блок. Таким образом, в период 6 Cs–Ba имеет 1–2 валентных электрона; У La–Yb 3–16; Lu–Hg — 3–12; а у Tl–Rn – 3–8. [115] Однако ближе к правой стороне d- и f-блоков теоретический максимум, соответствующий использованию всех валентных электронов, вообще не достижим; [139] такая же ситуация обстоит с кислородом, фтором и легкими благородными газами вплоть до криптона. [140]
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | ЧАС 1 | Он 2 | ||||||||||||||||||||||||||||||
| 2 | Что 1 | Быть 2 | Б 3 | С 4 | Н 5 | ТО 6 | Ф 7 | Ne 8 | ||||||||||||||||||||||||
| 3 | Уже 1 | мг 2 | Ал 3 | И 4 | П 5 | С 6 | кл. 7 | С 8 | ||||||||||||||||||||||||
| 4 | К 1 | Что 2 | наук 3 | Из 4 | V 5 | Кр 6 | Мин. 7 | Фе 8 | Ко 9 | В 10 | С 11 | Зн 12 | Здесь 3 | Ге 4 | Как 5 | Се 6 | Бр 7 | НОК 8 | ||||||||||||||
| 5 | руб. 1 | старший 2 | И 3 | Зр 4 | Нб 5 | Мо 6 | Тс 7 | Ру 8 | резус 9 | ПД 10 | В 11 | компакт-диск 12 | В 3 | Сн 4 | Сб 5 | Te 6 | я 7 | Машина 8 | ||||||||||||||
| 6 | Cs 1 | Нет 2 | La 3 | Этот 4 | Пр 5 | Нд 6 | вечера 7 | см 8 | Евросоюз 9 | Б-г 10 | Тб 11 | Те 12 | К 13 | Является 14 | Тм 15 | Ыб 16 | Лу 3 | хф 4 | Облицовка 5 | В 6 | Ре 7 | Ты 8 | И 9 | Пт 10 | В 11 | ртуть 12 | Тл 3 | Pb 4 | С 5 | Po 6 | В 7 | Рн 8 |
| 7 | Пт 1 | Солнце 2 | И 3 | че 4 | Хорошо 5 | В 6 | Например 7 | Мог 8 | Являюсь 9 | См 10 | Бк 11 | См. 12 | Является 13 | Фм 14 | Мэриленд 15 | Нет 16 | лр 3 | РФ 4 | ДБ 5 | Сг 6 | Бх 7 | Хс 8 | гора 9 | Дс 10 | Рг 11 | Сп 12 | Нх 3 | В 4 | Мак 5 | Лев 6 | Ц 7 | И 8 |
Полное объяснение требует рассмотрения энергии, которая будет высвобождена при образовании соединений с различной валентностью, а не просто рассмотрения только электронных конфигураций. [141] Например, магний образует Mg 2+ а не мг + катионы при растворении в воде, поскольку последняя самопроизвольно диспропорционируется в Mg 0 и мг 2+ катионы. Это связано с тем, что энтальпия гидратации (окружения катиона молекулами воды) увеличивается по величине с увеличением заряда и радиуса иона. В мг + , самая внешняя орбиталь (определяющая ионный радиус) по-прежнему равна 3 с, поэтому энтальпия гидратации мала и недостаточна для компенсации энергии, необходимой для удаления электрона; но снова ионизируется до Mg 2+ раскрывает ядро 2p подоболочки, делая энтальпию гидратации достаточно большой, чтобы позволить образоваться соединениям магния (II). По тем же причинам общие состояния окисления более тяжелых элементов p-блока (где ns-электроны становятся более низкими по энергии, чем np) имеют тенденцию меняться с шагом 2, потому что это необходимо для раскрытия внутренней подоболочки и уменьшения ионного радиуса. (например, Тл + открывает 6s и Tl 3+ открывает 5d, поэтому, потеряв два электрона, таллий имеет тенденцию терять и третий). Аналогичные аргументы, основанные на орбитальной гибридизации, можно использовать для менее электроотрицательных элементов p-блока. [142] [м]

Для переходных металлов обычные степени окисления почти всегда составляют не менее +2 по тем же причинам (открытие следующей подоболочки); это справедливо даже для металлов с аномальным d х+1 с 1 или д х+2 с 0 конфигурации (кроме серебра ), поскольку отталкивание между d-электронами означает, что движение второго электрона из s- в d-подоболочку существенно не меняет его энергию ионизации. [144] Поскольку дальнейшая ионизация переходных металлов не приводит к обнаружению каких-либо новых внутренних подоболочек, вместо этого их степени окисления имеют тенденцию меняться с шагом в 1. [142] Лантаниды и поздние актиниды обычно демонстрируют стабильную степень окисления +3, удаляя внешние s-электроны, а затем (обычно) один электрон с (n-2)f-орбиталей, которые по энергии аналогичны ns. [145] Общие и максимальные степени окисления элементов d- и f-блока обычно зависят от энергии ионизации. Поскольку разница в энергии между (n-1)d и ns-орбиталями увеличивается вдоль каждой серии переходов, ионизация дальнейших электронов становится менее энергетически выгодной. Таким образом, группы ранних переходных металлов имеют тенденцию отдавать предпочтение более высоким степеням окисления, но степень окисления +2 становится более стабильной для групп поздних переходных металлов. Таким образом, высшая формальная степень окисления увеличивается от +3 в начале каждой строки d-блока до +7 или +8 в середине (например, OsO 4 ), а затем снижается до +2 в конце. [144] Лантаниды и поздние актиниды обычно имеют высокую энергию четвертой ионизации и, следовательно, редко превосходят степень окисления +3, тогда как ранние актиниды имеют низкую энергию четвертой ионизации, поэтому, например, нептуний и плутоний могут достигать +7. [113] [144] [145] Самые последние актиниды идут дальше, чем лантаноиды, в сторону низких степеней окисления: менделевий легче восстанавливается до состояния +2, чем тулий или даже европий (лантанид с наиболее стабильным состоянием +2 из-за его наполовину заполненной f-оболочки). ), а нобелий явно отдает предпочтение +2, а не +3, в отличие от иттербия. [57]
Поскольку элементы одной группы имеют одинаковые валентные конфигурации, они обычно демонстрируют схожее химическое поведение. Например, все щелочные металлы первой группы имеют один валентный электрон и образуют очень однородный класс элементов: все они мягкие и химически активные металлы. Однако здесь задействовано множество факторов, и группы часто могут быть довольно разнородными. Например, водород также имеет один валентный электрон и принадлежит к той же группе, что и щелочные металлы, но его химическое поведение совершенно иное. К стабильным элементам 14-й группы относятся неметалл ( углерод ), два полупроводника ( кремний и германий ) и два металла ( олово и свинец ); тем не менее, они объединены наличием четырех валентных электронов. [146] Это часто приводит к сходству максимальной и минимальной степеней окисления (например, сера и селен в группе 16 имеют максимальную степень окисления +6, как в SO 3 и SeO 3 , и минимальную степень окисления -2, как в сульфидах и селенидах ); но не всегда (например, кислород образует степень окисления +6, несмотря на то, что он находится в той же группе, что и сера и селен). неизвестно, что [61]
Электроотрицательность

Еще одним важным свойством элементов является их электроотрицательность . Атомы могут образовывать ковалентные связи друг с другом, разделяя электроны парами, создавая перекрытие валентных орбиталей. Степень, в которой каждый атом притягивает общую электронную пару, зависит от электроотрицательности атома. [147] – склонность атома к приобретению или потере электронов. [19] Более электроотрицательный атом будет стремиться притянуть электронную пару больше, а менее электроотрицательный (или более электроположительный) — меньше. В крайних случаях электрон можно считать полностью перешедшим от более электроположительного атома к более электроотрицательному, хотя это упрощение. Тогда связь связывает два иона: один положительный (отдавший электрон) и один отрицательный (принявший его), и называется ионной связью . [19]
Электроотрицательность зависит от того, насколько сильно ядро может притягивать пару электронов, поэтому она демонстрирует вариацию, аналогичную другим уже обсуждавшимся свойствам: электроотрицательность имеет тенденцию падать сверху вниз и повышаться слева направо. Щелочные и щелочноземельные металлы относятся к наиболее электроположительным элементам, а халькогены, галогены и благородные газы — к наиболее электроотрицательным. [147]
Электроотрицательность обычно измеряется по шкале Полинга, в которой наиболее электроотрицательному реактивному атому ( фтору ) присвоена электроотрицательность 4,0, а наименее электроотрицательному атому ( цезию ) присвоена электроотрицательность 0,79. [19] На самом деле неон является наиболее электроотрицательным элементом, но шкала Полинга не может измерить его электроотрицательность, поскольку он не образует ковалентных связей с большинством элементов. [148]
Электроотрицательность элемента зависит от характера и количества атомов, с которыми он связан, а также от того, сколько электронов он уже потерял: атом становится более электроотрицательным, когда он потерял больше электронов. [147] Иногда это имеет большое значение: свинец в степени окисления +2 имеет электроотрицательность 1,87 по шкале Полинга, а свинец в степени окисления +4 имеет электроотрицательность 2,33. [149]
Металличность

(В сером олове ширина запрещенной зоны исчезает и происходит металлизация. [150] У олова есть еще один аллотроп — белое олово, структура которого еще более металлическая.)
Простое вещество – это вещество, образованное из атомов одного химического элемента. Простые вещества с более электроотрицательными атомами имеют тенденцию делиться электронами (образовать ковалентные связи) друг с другом. Они образуют либо маленькие молекулы (например, водород или кислород, атомы которых связаны парами), либо гигантские структуры, простирающиеся до бесконечности (например, углерод или кремний). Благородные газы просто остаются отдельными атомами, поскольку у них уже есть полная оболочка. [19] Вещества, состоящие из отдельных молекул или отдельных атомов, удерживаются вместе более слабыми силами притяжения между молекулами, такими как дисперсионная сила Лондона : когда электроны движутся внутри молекул, они создают мгновенный дисбаланс электрического заряда, который вызывает аналогичные дисбалансы на соседних молекулах и создает синхронизированные движения электронов между многими соседними молекулами. [151]

Однако более электроположительные атомы имеют тенденцию вместо этого терять электроны, создавая «море» электронов, поглощающее катионы. [19] Внешние орбитали одного атома перекрываются, разделяя электроны со всеми его соседями, создавая гигантскую структуру молекулярных орбиталей, охватывающую все атомы. [152] Это отрицательно заряженное «море» притягивает все ионы и удерживает их вместе в металлической связи . Элементы, образующие такие связи, часто называют металлами ; те, которые этого не делают, часто называют неметаллами . [19] Некоторые элементы могут образовывать несколько простых веществ с разной структурой: их называют аллотропами . Например, алмаз и графит — две аллотропы углерода. [146] [н]
Металличность элемента можно предсказать по электронным свойствам. Когда атомные орбитали перекрываются во время металлической или ковалентной связи, они создают как связывающие, так и разрыхляющие молекулярные орбитали одинаковой емкости, причем разрыхляющие орбитали имеют более высокую энергию. Чистый характер связи возникает, когда на связывающих орбиталях больше электронов, чем на разрыхляющих. Таким образом, металлическая связь возможна, когда количество электронов, делокализованных каждым атомом, менее чем в два раза превышает количество орбиталей, способствующих перекрытию. Так обстоит дело с элементами групп с 1 по 13; у них также слишком мало валентных электронов, чтобы образовывать гигантские ковалентные структуры, в которых все атомы занимают эквивалентные положения, и поэтому почти все они металлизуются. Исключением являются водород и бор, которые имеют слишком высокую энергию ионизации. Таким образом, водород образует ковалентную молекулу H 2 , а бор образует гигантскую ковалентную структуру на основе икосаэдрических B 12 кластеров . В металле связывающая и разрыхляющая орбитали имеют перекрывающуюся энергию, создавая единую зону, через которую электроны могут свободно проходить, обеспечивая электрическую проводимость. [154]
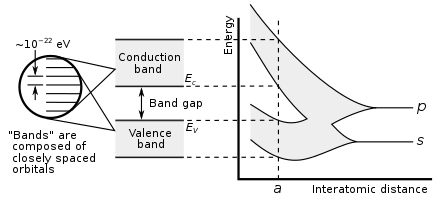
В группе 14 становится возможной как металлическая, так и ковалентная связь. В кристалле алмаза ковалентные связи между атомами углерода прочные, поскольку они имеют небольшой атомный радиус и, следовательно, ядро сильнее удерживает электроны. Следовательно, образующиеся в результате связывающие орбитали имеют гораздо меньшую энергию, чем разрыхляющие орбитали, и перекрытия нет, поэтому электропроводность становится невозможной: углерод является неметаллом. Однако ковалентная связь становится слабее для более крупных атомов, и энергетическая щель между связывающими и разрыхляющими орбиталями уменьшается. Следовательно, кремний и германий имеют меньшую запрещенную зону и являются полупроводниками в условиях окружающей среды : электроны могут пересекать запрещенную зону при термическом возбуждении. (Бор также является полупроводником в условиях окружающей среды.) В олове исчезает запрещенная зона, так что олово и свинец становятся металлами. [154] С повышением температуры все неметаллы приобретают некоторые полупроводниковые свойства, в большей или меньшей степени в зависимости от размера запрещенной зоны. Таким образом, металлы и неметаллы можно отличить по температурной зависимости их электропроводности: проводимость металла снижается с повышением температуры (поскольку тепловое движение затрудняет свободное движение электронов), тогда как проводимость неметалла возрастает (поскольку может быть больше электронов). с нетерпением жду возможности преодолеть пропасть). [155]
Элементы в группах с 15 по 17 имеют слишком много электронов, чтобы образовывать гигантские ковалентные молекулы, растягивающиеся во всех трех измерениях. Для более легких элементов связи в небольших двухатомных молекулах настолько сильны, что конденсированная фаза нежелательна: так, азот (N 2 ), кислород (О 2 ), белый фосфор и желтый мышьяк (P 4 и As 4 ), сера и красный селен (S 8 и Se 8 ) и стабильные галогены (F 2 , Cl 2 , Br 2 и I 2 ) легко образуют ковалентные молекулы с небольшим количеством атомов. Более тяжелые имеют тенденцию образовывать длинные цепочки (например, красный фосфор, серый селен, теллур) или слоистые структуры (например, углерод в виде графита, черный фосфор, серый мышьяк, сурьма, висмут), которые простираются только в одном или двух измерениях, а не в трех измерениях. Оба типа структур можно обнаружить в виде аллотропов фосфора, мышьяка и селена, хотя аллотропы с длинной цепью более стабильны во всех трех. Поскольку эти структуры не используют все свои орбитали для связывания, в конечном итоге у них появляются связывающие, несвязывающие и разрыхляющие полосы в порядке возрастания энергии. Как и в группе 14, у более тяжелых элементов ширина запрещенной зоны сокращается и становится возможным свободное перемещение электронов между цепочками или слоями. Так, например, черный фосфор, черный мышьяк, серый селен, теллур и йод являются полупроводниками; серый мышьяк, сурьма и висмут полуметаллы (обладающие квазиметаллической проводимостью с очень небольшим перекрытием зон); а полоний и, вероятно, астат — настоящие металлы. [154] Наконец, все элементы естественной группы 18 остаются отдельными атомами. [154] [the]
Разделительная линия между металлами и неметаллами проходит примерно по диагонали сверху слева вниз справа, при этом серия переходов появляется слева от этой диагонали (поскольку у них есть много доступных орбиталей для перекрытия). Это ожидаемо, поскольку металличность имеет тенденцию коррелировать с электроположительностью и готовностью терять электроны, которая увеличивается справа налево и вверх-вниз. Таким образом, количество металлов значительно превышает количество неметаллов. Элементы вблизи границы трудно классифицировать: они, как правило, обладают свойствами, промежуточными между свойствами металлов и неметаллов, и могут иметь некоторые свойства, характерные для обоих. Их часто называют полуметаллами или металлоидами . [19] Термин «полуметалл», используемый в этом смысле, не следует путать с его строгим физическим смыслом, связанным с зонной структурой: висмут физически является полуметаллом, но химики обычно считают его металлом. [157]
В следующей таблице рассмотрены наиболее стабильные аллотропы в стандартных условиях. Элементы, окрашенные в желтый цвет, образуют простые вещества, для которых хорошо характерны металлические связи. Элементы, окрашенные в голубой цвет, образуют гигантские сетевые ковалентные структуры, тогда как элементы, окрашенные в темно-синий цвет, образуют небольшие ковалентно связанные молекулы, которые удерживаются вместе более слабыми силами Ван-дер-Ваальса . Благородные газы окрашены в фиолетовый цвет: их молекулы состоят из одиночных атомов и ковалентной связи не возникает. Затененные серым цветом ячейки предназначены для элементов, которые не были получены в достаточных количествах для того, чтобы их наиболее стабильные аллотропы можно было охарактеризовать таким образом. Теоретические соображения и текущие экспериментальные данные предполагают, что все эти элементы металлизировались бы, если бы могли образовывать конденсированные фазы. [154] за исключением, пожалуй, оганессона. [158] [п]
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Группа → | ||||||||||||||||||||||||||||||||
| ↓ Период | ||||||||||||||||||||||||||||||||
| 1 | ЧАС | Он | ||||||||||||||||||||||||||||||
| 2 | Что | Быть | Б | С | Н | ТО | Ф | Ne | ||||||||||||||||||||||||
| 3 | Уже | мг | Ал | И | П | С | кл. | С | ||||||||||||||||||||||||
| 4 | К | Что | наук | Из | V | Кр | Мин. | Фе | Ко | В | С | Зн | Здесь | Ге | Как | Се | Бр | НОК | ||||||||||||||
| 5 | руб. | старший | И | Зр | Нб | Мо | Тс | Ру | резус | ПД | В | компакт-диск | В | Сн | Сб | Te | я | Машина | ||||||||||||||
| 6 | Cs | Нет | La | Этот | Пр | Нд | вечера | см | Евросоюз | Б-г | Тб | Те | К | Является | Тм | Ыб | Лу | хф | Облицовка | В | Ре | Ты | И | Пт | В | ртуть | Тл | Pb | С | Po | В | Рн |
| 7 | Пт | Солнце | И | че | Хорошо | В | Например | Мог | Являюсь | См | Бк | См. | Является | Фм | Мэриленд | Нет | лр | РФ | ДБ | Сг | Бх | Хс | гора | Дс | Рг | Сп | Нх | В | Мак | Лев | Ц | И |
Ковалентная металлическая сеть Молекулярная ковалентная связь Одиночные атомы Неизвестно Цвет фона показывает связь простых веществ в периодической таблице . Если их несколько, считается наиболее стабильный аллотроп.
- Железо, металл
- Сера, неметалл
- Мышьяк, элемент, часто называемый полуметаллом или металлоидом.
Обычно металлы блестящие и плотные. [19] Они обычно имеют высокие температуры плавления и кипения из-за прочности металлической связи и часто являются податливыми и пластичными (легко растягиваются и формируются), поскольку атомы могут перемещаться относительно друг друга, не разрывая металлическую связь. [168] Они проводят электричество, потому что их электроны могут свободно перемещаться во всех трех измерениях. Точно так же они проводят тепло, которое передается электронами в виде дополнительной кинетической энергии : они движутся быстрее. Эти свойства сохраняются и в жидком состоянии, так как хотя кристаллическая структура и разрушается при плавлении, атомы все равно соприкасаются и металлическая связь сохраняется, хотя и ослаблена. [168] Металлы имеют тенденцию вступать в реакцию с неметаллами. [19] Из этих обобщений можно найти некоторые исключения: например, бериллий, хром, [87] марганец, [169] сурьма, [170] висмут, [171] и уран хрупкие (список не исчерпывающий); [87] хром чрезвычайно тверд; [172] галлий, рубидий, цезий и ртуть являются жидкими при комнатной температуре или близкой к ней; [д] а благородные металлы, такие как золото, химически очень инертны. [173] [174]
Неметаллы проявляют разные свойства. Те, что образуют гигантские ковалентные кристаллы, имеют высокие температуры плавления и кипения, поскольку для преодоления прочных ковалентных связей требуется значительная энергия. Те, что образуют дискретные молекулы, удерживаются вместе главным образом за счет дисперсионных сил, которые легче преодолеть; таким образом, они имеют тенденцию иметь более низкие температуры плавления и кипения, [175] и многие из них представляют собой жидкости или газы при комнатной температуре. [19] Неметаллы часто выглядят тусклыми. Они имеют тенденцию быть реактивными по отношению к металлам, за исключением благородных газов, которые инертны по отношению к большинству веществ. [19] В твердом состоянии они хрупкие, поскольку их атомы плотно удерживаются на месте. Они менее плотные и плохо проводят электричество. [19] потому что нет подвижных электронов. [176] Вблизи границы запрещенная зона мала, поэтому многие элементы в этой области являются полупроводниками, такими как кремний, германий, [176] и теллур. [154] Селен имеет как полупроводниковый серый аллотроп, так и изолирующий красный аллотроп; мышьяк имеет металлический серый аллотроп, полупроводниковый черный аллотроп и изолирующий желтый аллотроп (хотя последний нестабилен в условиях окружающей среды). [155] Опять же, есть исключения; например, алмаз имеет самую высокую теплопроводность из всех известных материалов, больше, чем любой металл. [177]
Принято обозначать класс металлоидов, лежащий на границе между металлами и неметаллами, поскольку элементы в этой области являются промежуточными как по физическим, так и по химическим свойствам. [19] Однако в литературе не существует единого мнения относительно того, какие именно элементы следует обозначать таким образом. Когда используется такая категория, почти всегда включаются кремний, германий, мышьяк и теллур, а также обычно бор и сурьма; но большинство источников включают также и другие элементы без согласия относительно того, какие дополнительные элементы следует добавить, а некоторые вместо этого вычитают из этого списка. [р] Например, в отличие от всех других элементов, которые обычно считаются металлоидами или неметаллами, единственная стабильная форма сурьмы имеет металлическую проводимость. Более того, по своему физическому и химическому поведению этот элемент напоминает висмут и, в более общем смысле, другие металлы p-блока. На этом основании некоторые авторы утверждают, что его лучше классифицировать как металл, чем как металлоид. [87] [182] [155] С другой стороны, селен обладает некоторыми полупроводниковыми свойствами в своей наиболее стабильной форме (хотя у него также есть изолирующие аллотропы), и утверждалось, что его следует рассматривать как металлоид. [182] – хотя эта ситуация справедлива и для фосфора, [155] что является гораздо более редким включением среди металлоидов. [р]
Дальнейшие проявления периодичности
В периодической таблице Менделеева существуют и другие отношения между элементами, не входящими в одну и ту же группу, например, диагональные отношения между элементами, соседними по диагонали (например, литием и магнием). [124] Некоторые сходства также можно обнаружить между основными группами и группами переходных металлов или между ранними актинидами и ранними переходными металлами, когда элементы имеют одинаковое количество валентных электронов. Таким образом, уран чем-то напоминает хром и вольфрам шестой группы. [124] поскольку все три имеют шесть валентных электронов. [183] Отношения между элементами с одинаковым количеством валентных электронов, но разными типами валентных орбиталей называются вторичными или изодонорными отношениями: они обычно имеют одинаковые максимальные степени окисления, но не одинаковые минимальные степени окисления. Например, и хлор, и марганец имеют максимальную степень окисления +7 (например, Cl 2 O 7 и Mn 2 O 7 ), но их соответствующие минимальные степени окисления составляют -1 (например, HCl ) и -3 (K 2 [Mn( СО) 4 ]). Элементы с одинаковым количеством валентных вакансий, но разным количеством валентных электронов связаны третичными или изоакцепторными отношениями: они обычно имеют схожие минимальные, но не максимальные степени окисления. Например, водород и хлор имеют минимальную степень окисления -1 (в гидридах и хлоридах ), но максимальная степень окисления водорода равна +1 (например, H 2 O ), а у хлора - +7. [61]
Многие другие физические свойства элементов демонстрируют периодические изменения в соответствии с периодическим законом, например , температуры плавления , температуры кипения , теплоты плавления , теплоты испарения , энергия атомизации и так далее. Подобные периодические изменения возникают и у соединений элементов, которые можно наблюдать, сравнивая гидриды, оксиды, сульфиды, галогениды и т. д. [147] Химические свойства сложнее описать количественно, но они также имеют свою периодичность. Примеры включают изменение кислотных и основных свойств элементов и их соединений, стабильность соединений и методы выделения элементов. [116] Периодичность использовалась и использовалась очень широко для предсказания свойств неизвестных новых элементов и новых соединений и занимает центральное место в современной химии. [184]
Классификация элементов
В литературе использовалось множество терминов для описания наборов элементов, которые ведут себя одинаково. Названия групп: щелочной металл , щелочноземельный металл , триэль , тетрел , пниктоген , халькоген , галоген и благородный газ признаны ИЮПАК; другие группы могут обозначаться по их номеру или по их первому элементу (например, группа 6 представляет собой группу хрома). [9] [185] Некоторые делят элементы р-блока на группы с 13 по 16 по металличности, [180] [178] хотя не существует ни определения ИЮПАК, ни точного консенсуса относительно того, какие именно элементы следует считать металлами, неметаллами или полуметаллами (иногда называемыми металлоидами). [180] [178] [9] Не существует также единого мнения относительно того, как следует называть металлы, пришедшие на смену переходным металлам, при этом постпереходные металлы и плохие металлы среди использованных возможностей были . Некоторые передовые монографии исключают элементы 12-й группы из числа переходных металлов на основании их иногда совершенно разных химических свойств, но это не универсальная практика. [186] и ИЮПАК в настоящее время не упоминает его как допустимый в своих Принципах химической номенклатуры . [187]
Лантаноидами . считаются элементы La-Lu, которые очень похожи друг на друга: исторически они включали только Ce-Lu, но лантан стал широко использоваться [9] Редкоземельные элементы (или редкоземельные металлы) добавляют к лантанидам скандий и иттрий. [9] Аналогично актинидами считаются элементы Ac–Lr (исторически Th–Lr), [9] хотя изменчивость свойств в этом наборе гораздо больше, чем внутри лантаноидов. [55] ИЮПАК рекомендует называть лантаноиды и актиноиды во избежание двусмысленности, поскольку суффикс -ide обычно обозначает отрицательный ион; однако лантаноиды и актиниды остаются обычным явлением. [9] С ростом признания лютеция и лоуренсия как элементов d-блока некоторые авторы начали определять лантаноиды как La-Yb, а актиниды как Ac-No, что соответствует f-блоку. [60] [12] [188] [189] [190] [191] Трансактиниды — это короткоживущие элементы, не считая или сверхтяжелые элементы актинидов, начиная с лоуренсия или резерфордия (в зависимости от того, где заканчиваются актиниды). [191] [192] [193] [194] [195]
Существует гораздо больше категорий, которые используются в соответствии с определенными дисциплинами. В астрофизике металл определяется как любой элемент с атомным номером больше 2, то есть все, кроме водорода и гелия. [196] Термин «полуметалл» имеет другое определение в физике, чем в химии: висмут по физическим определениям является полуметаллом, но химики обычно считают его металлом. [197] Некоторые термины широко используются, но без какого-либо формального определения, например, « хэви-метал », которому дали такой широкий спектр определений, что его критиковали как «фактически бессмысленный». [198]
Объем терминов значительно различается у разных авторов. Например, согласно ИЮПАК, к благородным газам можно отнести всю группу, включая очень радиоактивный сверхтяжелый элемент оганессон. [199] Однако среди специалистов по сверхтяжелым элементам это делается нечасто: в этом случае под «благородным газом» обычно понимают инерционное поведение более легких элементов группы. Поскольку расчеты обычно предсказывают, что оганессон не должен быть особенно инертен из-за релятивистских эффектов и даже не может быть газом при комнатной температуре, если его можно будет производить в больших количествах, его статус как благородного газа часто подвергается сомнению в этом контексте. [200] Кроме того, иногда встречаются национальные различия: в Японии щелочноземельные металлы часто не включают бериллий и магний, поскольку их поведение отличается от более тяжелых металлов 2 группы. [201]
История

Ранняя история
В 1817 году немецкий физик Иоганн Вольфганг Дёберейнер начал формулировать одну из первых попыток классификации элементов. [202] В 1829 году он обнаружил, что может объединять некоторые элементы в группы по три, причем члены каждой группы обладают родственными свойствами. Он назвал эти группы триадами . [203] [204] Хлор, бром и йод образовали триаду; как и кальций, стронций и барий; литий, натрий и калий; и сера, селен и теллур. Сегодня все эти триады входят в состав современных групп: галогены, щелочноземельные металлы, щелочные металлы и халькогены. [205] Различные химики продолжали его работу и смогли выявить все новые и новые связи между небольшими группами элементов. Однако они не смогли построить одну схему, охватывающую их всех. [206]

Джон Ньюлендс в феврале 1863 года письмо опубликовал в журнале Chemical News о периодичности химических элементов. [207] статью, В 1864 году Ньюлендс опубликовал в «Chemical News» в которой показал, что, если элементы расположены в порядке их атомного веса, элементы, имеющие последовательные номера, часто либо принадлежат к одной и той же группе, либо занимают сходные позиции в разных группах, и он указал, что каждый восьмой элемент, начинающийся от заданного, является в этой аранжировке своего рода повторением первого, подобно восьмой ноте октавы в музыке (Закон октав). [207] Однако формулировка Ньюлендса хорошо работала только для элементов основной группы и столкнулась с серьезными проблемами с остальными. [61]
Немецкий химик Лотар Мейер заметил последовательности схожих химических и физических свойств, повторяющиеся через определенные промежутки времени. По его мнению, если бы атомные массы были отложены по ординатам (т.е. по вертикали), а атомные объёмы по абсциссам (т.е. по горизонтали) (кривая получила серию максимумов и минимумов), то наиболее электроположительные элементы появились бы на вершинах кривой в порядок их атомных весов. В 1864 году вышла его книга; он содержал раннюю версию таблицы Менделеева, содержащую 28 элементов, и классифицировал элементы на шесть семейств по их валентности - впервые элементы были сгруппированы по их валентности. Работы по организации элементов по атомному весу до сих пор блокировались из-за неточных измерений атомных весов. [208] В 1868 году он переработал свою таблицу, но эта редакция была опубликована как черновик только после его смерти. [209]
Менделеев

Окончательный прорыв совершил русский химик Дмитрий Менделеев . Хотя другие химики (в том числе Мейер) примерно в то же время открыли некоторые другие версии периодической системы, Менделеев был самым преданным делу разработки и защиты своей системы, и именно его система больше всего повлияла на научное сообщество. [210] 17 февраля 1869 г. (1 марта 1869 г. по григорианскому календарю) Менделеев начал упорядочивать элементы и сравнивать их по атомному весу. Он начал с нескольких элементов, и в течение дня его система росла, пока не охватила большинство известных элементов. После того как он нашел непротиворечивое расположение, его печатная таблица появилась в мае 1869 г. в журнале Русского химического общества. [211] Когда элементы не вписывались в систему, он смело предсказывал, что либо валентности, либо атомные веса были измерены неправильно, либо что еще предстоит обнаружить недостающий элемент. [61] В 1871 году Менделеев опубликовал длинную статью, включающую обновленную форму своей таблицы, в которой были ясны его предсказания для неизвестных элементов. Менделеев подробно предсказал свойства трех из этих неизвестных элементов: поскольку в них отсутствовали более тяжелые гомологи бора, алюминия и кремния, он назвал их эка-бор, эка-алюминий и эка-кремний («эка» на санскрите означает «эка-бор», «эка-алюминий» и «эка-кремний»). "один"). [211] [212] : 45

В 1875 году французский химик Поль-Эмиль Лекок де Буабодран , работая, не зная о предсказании Менделеева, обнаружил новый элемент в образце минерала сфалерита и назвал его галлием. Он выделил элемент и начал определять его свойства. Менделеев, прочитав публикацию де Буабодрана, отправил письмо, в котором утверждал, что галлий и есть предсказанный им эка-алюминий. Хотя Лекок де Буабодран поначалу был настроен скептически и подозревал, что Менделеев пытается присвоить себе свое открытие, позже он признал, что Менделеев был прав. [213] В 1879 году шведский химик Ларс Фредрик Нильсон открыл новый элемент, который назвал скандием: им оказался экабор. Эка-кремний был открыт в 1886 году немецким химиком Клеменсом Винклером , который назвал его германием. Свойства галлия, скандия и германия соответствовали предсказаниям Менделеева. [214] В 1889 году Менделеев отметил на лекции Фарадея в Королевском институте в Лондоне, что он не ожидал, что проживет достаточно долго, «чтобы упомянуть об их открытии Химическому обществу Великобритании как подтверждение точности и общности периодического закона». [215] Даже открытие благородных газов в конце XIX века, которое Менделеев не предсказал, четко вписывалось в его схему в качестве восьмой основной группы. [216]
Тем не менее у Менделеева возникли некоторые проблемы с вписыванием известных лантаноидов в свою схему, поскольку они не демонстрировали периодического изменения валентности, как другие элементы. После долгих исследований чешский химик Богуслав Браунер в 1902 году предположил, что все лантаноиды можно объединить в одну группу в таблице Менделеева. Он назвал это «гипотезой астероидов» в качестве астрономической аналогии: точно так же, как между Марсом и Юпитером вместо одной планеты существует пояс астероидов , так и место под иттрием считалось занятым всеми лантанидами, а не только одним элементом. [21]
Атомный номер
После исследования внутренней структуры атома голландский физик-любитель Антониус ван ден Брук в 1913 году предположил, что заряд ядра определяет расположение элементов в таблице Менделеева. [217] [218] Новозеландский физик Эрнест Резерфорд придумал слово «атомный номер» для обозначения этого ядерного заряда. [219] В опубликованной статье ван ден Брука он проиллюстрировал первую электронную периодическую таблицу, показывающую элементы, расположенные по числу их электронов. [220] Резерфорд подтвердил в своей статье 1914 года, что Бор принял точку зрения ван ден Брука. [221]

В том же году английский физик Генри Мозли с помощью рентгеновской спектроскопии экспериментально подтвердил предложение ван ден Брока. Мозли определил величину ядерного заряда каждого элемента от алюминия до золота и показал, что порядок Менделеева фактически размещает элементы в последовательном порядке по ядерному заряду. [222] Заряд ядра идентичен количеству протонов и определяет значение атомного номера ( Z ) каждого элемента. Использование атомного номера дает точную целочисленную последовательность элементов. Исследования Мозли сразу же разрешили несоответствия между атомным весом и химическими свойствами; это были такие случаи, как теллур и йод, где атомный номер увеличивается, но атомный вес уменьшается. [217] Хотя Мозли вскоре погиб во время Первой мировой войны, шведский физик Манне Зигбан продолжил свои исследования до урана и установил, что это элемент с самым высоким из известных на тот момент атомным номером (92). [223] На основе исследований Мозли и Зигбана также было известно, какие атомные номера соответствуют недостающим элементам, которые еще предстоит найти: 43, 61, 72, 75, 85 и 87. [217] (Элемент 75 на самом деле уже был открыт японским химиком Масатакой Огавой в 1908 году и назван ниппонием , но он ошибочно присвоил ему элемент 43 вместо 75, и поэтому его открытие не было общепризнанным до тех пор, пока позже. Принято считать, что открытие элемента 75 произошло позже. в 1925 году, когда Уолтер Ноддак , Ида Таке и Отто Берг независимо заново открыли его и дали ему нынешнее название — рений .) [224]
Рассвет атомной физики также прояснил ситуацию с изотопами . В цепочках распада первичных радиоактивных элементов тория и урана вскоре стало очевидно, что существует множество новых элементов, имеющих разные атомные массы, но совершенно одинаковые химические свойства. В 1913 году Фредерик Содди ввел термин «изотоп» для описания этой ситуации и считал изотопы просто разными формами одного и того же химического элемента. Это также прояснило такие расхождения, как теллур и йод: природный изотопный состав теллура взвешен в сторону более тяжелых изотопов, чем у йода, но теллур имеет более низкий атомный номер. [225]
Электронные оболочки
Датский физик Нильс Бор применил Макса Планка к атому идею о квантовании. Он пришел к выводу, что энергетические уровни электронов квантованы: разрешен только дискретный набор стабильных энергетических состояний. Затем Бор попытался понять периодичность через электронные конфигурации, предположив в 1913 году, что внутренние электроны должны отвечать за химические свойства элемента. [226] [227] В 1913 году он создал первую электронную таблицу Менделеева, основанную на квантовом атоме. [228]
Бор назвал свои электронные оболочки «кольцами» в 1913 году: во времена его планетарной модели атомные орбитали внутри оболочек не существовали. Бор объясняет в части 3 своей знаменитой статьи 1913 года, что максимальное количество электронов в оболочке равно восьми, написав: «Мы видим далее, что кольцо из n электронов не может вращаться в одном кольце вокруг ядра с зарядом ne, если только n < 8 ." Для меньших атомов электронные оболочки заполнялись бы следующим образом: «кольца электронов соединятся только в том случае, если они содержат равное число электронов; и что, соответственно, число электронов на внутренних кольцах будет только 2, 4, 8». Однако в более крупных атомах самая внутренняя оболочка будет содержать восемь электронов: «с другой стороны, периодическая система элементов убедительно предполагает, что уже в неоне N = 10 возникнет внутреннее кольцо из восьми электронов». Предложенные им электронные конфигурации атомов (показаны справа) по большей части не соответствуют известным сейчас. [229] [230] Они были усовершенствованы после того, как работы Арнольда Зоммерфельда и Эдмунда Стоунера открыли новые квантовые числа. [225]
| Элемент | Электроны на оболочку |
|---|---|
| 4 | 2,2 |
| 6 | 2,4 |
| 7 | 4,3 |
| 8 | 4,2,2 |
| 9 | 4,4,1 |
| 10 | 8,2 |
| 11 | 8,2,1 |
| 16 | 8,4,2,2 |
| 18 | 8,8,2 |
Первым, кто систематически расширил и исправил химические потенциалы атомной теории Бора, был Вальтер Коссель в 1914 и 1916 годах. Коссель объяснил, что в периодической таблице новые элементы будут создаваться по мере добавления электронов к внешней оболочке. В статье Косселя он пишет: «Это приводит к выводу, что электроны, добавляемые в дальнейшем, должны располагаться в концентрических кольцах или оболочках, на каждом из которых... только известное число электронов, а именно восемь в нашем корпус — должен быть устроен. Как только одно кольцо или оболочка завершена, необходимо начинать новое для следующего элемента, число электронов, которые наиболее легко доступны и лежат на самой внешней периферии, снова увеличивается от элемента; к элементу и, следовательно, при образовании каждой новой оболочки химическая периодичность повторяется». [231] [232]
В статье 1919 года Ирвинг Ленгмюр постулировал существование «ячеек», которые мы теперь называем орбиталями, каждая из которых может содержать только два электрона, и они были расположены в «эквидистантных слоях», которые мы теперь называем оболочками. Он сделал исключение: первая оболочка содержала только два электрона. [233] Химик Чарльз Раджли Бери в 1921 году предположил, что восемь и восемнадцать электронов в оболочке образуют стабильные конфигурации. Бери предположил, что электронные конфигурации переходных элементов зависят от валентных электронов в их внешней оболочке. [234] Он ввел слово «переход» для описания элементов, ныне известных как переходные металлы или переходные элементы. [235] Теория Бора была подтверждена открытием 72-го элемента: Жорж Урбен утверждал, что открыл его как редкоземельный элемент целлий , но Бери и Бор предсказали, что 72-й элемент не может быть редкоземельным элементом и должен быть гомологом циркония . Дирк Костер и Георг фон Хевеши искали этот элемент в циркониевых рудах и нашли элемент 72, который они назвали гафнием в честь родного города Бора, Копенгагена ( Hafnia на латыни). [236] [237] Целций Урбена оказался просто очищенным лютецием (71-й элемент). [238] Таким образом, гафний и рений стали последними открытыми стабильными элементами. [225]
По инициативе Бора Вольфганг Паули занялся проблемой электронных конфигураций в 1923 году. Паули расширил схему Бора, включив в нее четыре квантовых числа , и сформулировал свой принцип исключения , который гласил, что никакие два электрона не могут иметь одинаковые четыре квантовых числа. Это объяснило длину периодов в таблице Менделеева (2, 8, 18 и 32), которая соответствовала количеству электронов, которые могла занять каждая оболочка. [239] В 1925 году Фридрих Хунд пришел к конфигурациям, близким к современным. [240] В результате этих достижений периодичность стала основываться на количестве химически активных или валентных электронов, а не на валентностях элементов. [61] Принцип Ауфбау , описывающий электронные конфигурации элементов, был впервые эмпирически обнаружен Эрвином Маделунгом в 1926 году. [48] хотя первым, кто опубликовал его, был Владимир Карапетов в 1930 году. [241] [242] В 1961 году Всеволод Клечковский вывел первую часть правила Маделунга (что орбитали заполняются в порядке возрастания n + ℓ) из модели Томаса – Ферми ; [243] полное правило было получено на основе аналогичного потенциала в 1971 году Юрием Н. Демковым и Валентином Н. Островским. [244] [с]

Квантовая теория уточнила, что переходные металлы и лантаноиды образуют свои отдельные группы, переходные между основными группами, хотя некоторые химики уже предлагали таблицы, показывающие их таким образом, до этого: английский химик Генри Бассет сделал это в 1892 году, датский химик Юлиус Томсен в 1895 году и швейцарский химик Альфред Вернер в 1905 году. Бор использовал форму Томсена в своей Нобелевской лекции 1922 года; Форма Вернера очень похожа на современную форму из 32 столбцов. В частности, это вытеснило астероидную гипотезу Браунера. [21]
Точное положение лантаноидов и, следовательно, состав группы 3 оставалось спорным еще несколько десятилетий, поскольку их электронные конфигурации изначально были измерены неправильно. [12] [95] По химическим соображениям Бассетт, Вернер и Бери сгруппировали скандий и иттрий с лютецием, а не с лантаном (первые два оставили пустое пространство ниже иттрия, поскольку лютеций еще не был обнаружен). [21] [234] В 1927 году Хунд предположил, что все атомы лантаноидов имеют конфигурацию [Xe]4f. 0−14 5д 1 6 с 2 , ввиду их преобладающей трехвалентности. Теперь известно, что взаимосвязь между химией и электронной конфигурацией более сложна. [т] [57] Ранние спектроскопические данные, казалось, подтверждали эти конфигурации, и поэтому периодическая таблица была структурирована таким образом, чтобы иметь группу 3, состоящую из скандия, иттрия, лантана и актиния, с четырнадцатью f-элементами, разбивающими d-блок между лантаном и гафнием. [12] Но позже было обнаружено, что это справедливо только для четырех из пятнадцати лантаноидов (лантана, церия, гадолиния и лютеция), а остальные атомы лантаноидов не имеют d-электрона. В частности, иттербий завершает 4f-оболочку, и поэтому советские физики Лев Ландау и Евгений Лифшиц отметили в 1948 году, что лютеций правильно рассматривается как элемент d-блока, а не элемента f-блока; [13] То, что объемный лантан является f-металлом, было впервые предположено Джун Кондо в 1963 году на основании его низкотемпературной сверхпроводимости . [103] Это прояснило важность изучения низколежащих возбужденных состояний атомов, которые могут играть роль в химической среде при классификации элементов по блокам и расположении их на столе. [66] [68] [12] Многие авторы впоследствии заново открыли эту поправку, основываясь на физических, химических и электронных проблемах, и применили ее ко всем соответствующим элементам, в результате чего группа 3 содержит скандий, иттрий, лютеций и лоуренсий. [66] [10] [95] и наличие лантана через иттербий и актиния через нобелий в качестве рядов f-блока: [66] [10] эта исправленная версия обеспечивает соответствие правилу Маделунга и подтверждает первоначальное размещение химикатов Бассетта, Вернера и Бери. [21]
В 1988 году ИЮПАК опубликовал отчет в поддержку такого состава группы 3. [10] решение, которое было подтверждено в 2021 году. [11] Вариации еще можно встретить в учебниках по составу 3 группы, [23] и некоторые аргументы против этого формата публикуются до сих пор, [14] но химики и физики, которые рассматривали этот вопрос, в основном согласны с группой 3, содержащей скандий, иттрий, лютеций и лоуренсий, и оспаривают контраргументы как непоследовательные. [14]
Синтетические элементы

К 1936 году пул недостающих элементов от водорода до урана сократился до четырех: элементы 43, 61, 85 и 87 остались отсутствующими. Элемент 43 в конечном итоге стал первым элементом, который был синтезирован искусственно посредством ядерных реакций, а не обнаружен в природе. Он был открыт в 1937 году итальянскими химиками Эмилио Сегре и Карло Перье , которые назвали свое открытие технецием , в честь греческого слова, означающего «искусственный». [245] Элементы 61 ( прометий ) и 85 ( астат ) также были получены искусственно в 1945 и 1940 годах соответственно; Элемент 87 ( франций ) стал последним элементом, открытым в природе французским химиком Маргаритой Перей в 1939 году. [246] [в] Элементы помимо урана также были открыты искусственно, начиная с Эдвином Макмилланом и Филипом Абельсоном открытия в 1940 году нептуния (путем бомбардировки урана нейтронами). [78] Гленн Т. Сиборг и его команда из Национальной лаборатории Лоуренса Беркли (LBNL) продолжили открытие трансурановых элементов, начиная с плутония в 1941 году, и обнаружили, что вопреки прежним представлениям, элементы, начиная с актиния, были родственниками лантаноидов, а не переходных металлов. [247] Бассетт (1892 г.), Вернер (1905 г.) и французский инженер Шарль Жане (1928 г.) ранее предлагали это, но их идеи тогда не получили всеобщего признания. [21] Поэтому Сиборг назвал их актинидами. [247] Элементы до 101 (названные менделевием в честь Менделеева) были синтезированы до 1955 года либо путем облучения нейтронами или альфа-частицами, либо в результате ядерных взрывов в случае 99 (эйнштейний) и 100 (фермий). [78]
Значительные разногласия возникли с элементами со 102 по 106 в 1960-х и 1970-х годах, когда возникла конкуренция между командой LBNL (ныне возглавляемой Альбертом Гиорсо ) и командой советских ученых Объединенного института ядерных исследований (ОИЯИ) под руководством Георгия Флерова . Каждая команда заявляла об открытии, а в некоторых случаях каждая предлагала свое собственное название элемента, что вызвало споры об именах элементов , которые длились десятилетия. Эти элементы были получены путем бомбардировки актинидов легкими ионами. [248] ИЮПАК сначала придерживался подхода невмешательства, предпочитая подождать и посмотреть, будет ли достигнут консенсус. Но поскольку это был разгар Холодной войны , стало ясно, что этого не произойдет. Таким образом, ИЮПАК и Международный союз теоретической и прикладной физики (IUPAP) создали в 1985 году рабочую группу по трансфермию (TWG, фермий является элементом 100) для определения критериев открытия. [249] которые были опубликованы в 1991 году. [250] После некоторых дальнейших разногласий эти элементы получили свои окончательные названия в 1997 году, включая сиборгий (106) в честь Сиборга. [251]

Критерии TWG использовались для разрешения более поздних претензий об открытии элементов от LBNL и ОИЯИ, а также от исследовательских институтов Германии ( GSI ) и Японии ( Riken ). [252] В настоящее время рассмотрение заявлений об открытии осуществляется Совместной рабочей группой IUPAC/IUPAP . После присвоения приоритета элементы были официально добавлены в таблицу Менделеева, и первооткрывателям было предложено предложить свои названия. [20] К 2016 году это произошло со всеми элементами до 118, таким образом заполнив первые семь строк таблицы Менделеева. [20] [253] Открытие элементов после 106 стало возможным благодаря методам, разработанным Юрием Оганесяном в ОИЯИ: холодный синтез (бомбардировка свинца и висмута тяжелыми ионами) сделал возможным открытие в 1981–2004 годах элементов со 107 по 112 в GSI и 113 в Рикене. и он возглавил группу ОИЯИ (в сотрудничестве с американскими учеными) по открытию элементов со 114 по 118 с помощью горячего синтеза (бомбардировки актинидов ионами кальция) в 1998–2010 годах. [254] [255] Самый тяжелый из известных элементов — оганессон (118) назван в честь Оганесяна. Элемент 114 назван флеровием в честь своего предшественника и наставника Флёрова. [255]
В честь 150-летия таблицы Менделеева Организация Объединенных Наций объявила 2019 год Международным годом таблицы Менделеева, отмечая «одно из самых значительных достижений в науке». [256] Критерии открытия, установленные TWG, были обновлены в 2020 году в ответ на экспериментальный и теоретический прогресс, который не был предусмотрен в 1991 году. [257] Сегодня таблица Менделеева является одним из самых узнаваемых символов химии. [84] Сегодня ИЮПАК участвует во многих процессах, связанных с таблицей Менделеева: распознавании и присвоении названий новым элементам, рекомендации номеров групп и коллективных названий, а также обновлении атомных весов. [20]
Будущее продление после седьмого периода

Последние названные элементы — нихоний (113), московий (115), теннессин (117) и оганессон (118) — завершили седьмую строку таблицы Менделеева. [20] Будущие элементы должны будут начинаться с восьмого ряда . Эти элементы можно обозначать либо по их атомным номерам (например, « элемент 119 ИЮПАК, »), либо по систематическим названиям элементов принятым в 1978 году, которые напрямую связаны с атомными номерами (например, «унунэнниум» для элемента 119, производное от латинского unus «один», греческое ennea «девять» и традиционный суффикс -ium для металлических элементов). [20] Все попытки синтезировать такие элементы до сих пор не увенчались успехом. Попытка создания 119-го элемента продолжается с 2018 года в научно-исследовательском институте Рикен в Японии. LBNL в США, ОИЯИ в России и Центр исследования тяжелых ионов в Ланьчжоу (HIRFL) в Китае также планируют предпринять собственные попытки синтеза первых нескольких элементов 8-го периода. [260] [261] [262] [263] [264] [265]
Если бы восьмой период следовал шаблону, заданному предыдущими периодами, то он содержал бы пятьдесят элементов, заполняющих подоболочки 8s, 5g, 6f, 7d и, наконец, 8p в этом порядке. Но к этому моменту релятивистские эффекты должны привести к значительным отклонениям от правила Маделунга. Были предложены различные модели конфигураций элементов восьмого периода, а также способов отображения результатов в таблице Менделеева. Все согласны с тем, что восьмой период должен начинаться, как и предыдущие, с двух элементов восьмерок, 119 и 120 . Однако после этого массивные энергетические перекрытия между подоболочками 5g, 6f, 7d и 8p означают, что все они начинают заполняться вместе, и неясно, как выделить конкретные серии 5g и 6f. [62] [266] [267] [268] [269] Таким образом, элементы с 121 по 156 не подходят в качестве химических аналогов любой предыдущей группы в предыдущих частях таблицы. [131] хотя иногда их помещали в серии 5g, 6f и другие, чтобы формально отразить их электронную конфигурацию. [131] Эрик Шерри поднял вопрос о том, должна ли расширенная таблица Менделеева учитывать несоблюдение правила Маделунга в этом регионе или такие исключения следует игнорировать. [266] На этом этапе оболочечная структура также может быть довольно формальной: уже ожидается, что распределение электронов в атоме оганессона будет довольно однородным, без заметной оболочечной структуры. [270]
Ситуация с элементами 157 по 172 должна вернуться в норму и больше напоминать предыдущие строки. [259] Тяжелые p-оболочки расщепляются в результате спин-орбитального взаимодействия : одна p-орбиталь (p 1/2 ) более стабилизирована, а две другие (p 3/2 ) дестабилизированы. (Такие сдвиги квантовых чисел происходят для всех типов оболочек, но наибольшее различие в порядке они имеют для p-оболочек.) Вполне вероятно, что к элементу 157 заполнены 8s и 8p 1/2 оболочки с четырьмя электронами. в общей сложности провалились в ядро. За пределами ядра следующие орбитали — это 7d и 9s с одинаковыми энергиями, за ними следуют 9p 1/2 и 8p 3/2 с аналогичными энергиями, а затем большой разрыв. [259] Таким образом, орбитали 9s и 9p 1/2 по существу заменяют орбитали 8s и 8p 1/2 , что делает элементы 157–172, вероятно, химически аналогичными группам 3–18: например, элемент 164 будет располагаться на две позиции ниже свинца в группе 14. по обычной схеме, но по расчетам он очень похож на палладий в группе 10. [57] [268] [62] [258] [131] Таким образом, для достижения следующего благородного элемента после 118 требуется пятьдесят четыре элемента, а не пятьдесят. [271] Однако, хотя эти выводы о химическом составе элементов со 157 по 172 в целом согласуются с моделями, [131] [62] существуют разногласия относительно того, должна ли таблица Менделеева быть составлена так, чтобы отражать химические аналогии, или она должна отражать вероятные формальные электронные конфигурации, которые должны сильно отличаться от более ранних периодов и не согласованы между источниками. Таким образом, дискуссия о формате восьмой строки продолжается. [62] [268] [269] [107]
За пределами элемента 172 расчет усложняется тем, что уровень энергии электрона 1s становится мнимым. Такая ситуация имеет физическую интерпретацию и сама по себе не накладывает электронных ограничений на периодическую таблицу, но правильный способ включения таких состояний в многоэлектронные расчеты все еще остается открытой проблемой. Эту проблему необходимо будет решить, чтобы продолжить расчет структуры таблицы Менделеева после этого момента. [272]
Ядерная стабильность, вероятно, окажется решающим фактором, ограничивающим количество возможных элементов. Это зависит от баланса между электрическим отталкиванием между протонами и сильной силой, связывающей протоны и нейтроны вместе. [273] Протоны и нейтроны располагаются в оболочках , так же, как и электроны, поэтому закрытая оболочка может значительно повысить стабильность: известные сверхтяжелые ядра существуют благодаря такому замыканию оболочки, вероятно, при примерно 114–126 протонах и 184 нейтронах. [272] Вероятно, они близки к предсказанному острову стабильности , где сверхтяжелые нуклиды должны быть более долгоживущими, чем ожидалось: прогнозы для самых долгоживущих нуклидов на острове варьируются от микросекунд до миллионов лет. [107] [274] [275] Тем не менее следует отметить, что это, по сути, экстраполяции на неизвестную часть карты нуклидов, и необходимо учитывать систематические неопределенности модели. [107]
При прохождении замкнутых оболочек стабилизирующий эффект должен исчезнуть: [276] таким образом, ожидается, что сверхтяжелые нуклиды с числом нейтронов более 184 будут иметь гораздо более короткое время жизни и спонтанно делиться в течение 10 −15 секунды. Если это так, то не имело бы смысла считать их химическими элементами: ИЮПАК определяет, что элемент существует только в том случае, если ядро живет дольше 10 −14 секунды — время, необходимое для того, чтобы собрать электронное облако. Тем не менее, теоретические оценки периодов полураспада очень зависят от модели и варьируются на многие порядки. [272] Прогнозируется, что сильное отталкивание между протонами приведет к экзотическим ядерным топологиям с ожидаемыми пузырьками, кольцами и торами: это еще больше усложняет экстраполяцию. [107] Неясно, существуют ли какие-либо дальнейшие замыкания оболочек из-за ожидаемого размытия отдельных ядерных оболочек (как уже ожидается для электронных оболочек в Оганессоне). [276] Более того, даже если существуют более поздние оболочки раковин, неясно, позволят ли они существовать таким тяжелым элементам. [277] [278] [279] [180] Таким образом, вполне возможно, что периодическая таблица практически заканчивается вокруг элемента 120, поскольку элементы становятся слишком недолговечными, чтобы их можно было наблюдать, а затем и слишком недолговечными, чтобы иметь химию; Таким образом, эра открытия новых элементов подошла бы к концу. [180] [280] Если еще одно закрытие протонной оболочки после 126 действительно существует, то оно, вероятно, произойдет около 164; [277] таким образом, область, где периодичность нарушается, более или менее соответствует области нестабильности между замыканиями оболочек. [131]
Альтернативно, кварковая материя может стать стабильной при высоких массовых числах, когда ядро состоит из свободно текущих вверх и вниз кварков, а не связывает их в протоны и нейтроны; это создало бы континент стабильности вместо острова. [281] [282] Могут сыграть роль и другие эффекты: например, в очень тяжелых элементах 1s-электроны, вероятно, будут проводить значительное количество времени так близко к ядру, что фактически находятся внутри него, что делает их уязвимыми для захвата электронов . [283]
Даже если элементы восьмого ряда могут существовать, их производство, вероятно, будет трудным, и это должно стать еще более трудным по мере увеличения атомного номера. [284] Хотя ожидается, что элементы 119 и 120 8s будут достижимы с помощью существующих средств, ожидается, что элементы, выходящие за их пределы, потребуют новой технологии. [285] если они вообще могут быть произведены. [286] Экспериментальная характеристика этих элементов химически также будет представлять собой большую проблему. [260]
Альтернативные таблицы Менделеева

Периодический закон может быть представлен несколькими способами, из которых стандартная таблица Менделеева является лишь одним из них. [287] В течение 100 лет после появления таблицы Менделеева в 1869 году Эдвард Г. Мазурс собрал около 700 различных опубликованных версий таблицы Менделеева. [183] [288] Многие формы сохраняют прямоугольную структуру, в том числе Шарля Жане левоступенчатую периодическую таблицу (на фото ниже) и модернизированную форму оригинального восьмиколоночного макета Менделеева, который до сих пор распространен в России. Другие форматы периодической таблицы имеют гораздо более экзотическую форму, например спирали ( изображение Отто Теодора Бенфея справа), круги и треугольники. [289]
Альтернативные таблицы Менделеева часто разрабатываются, чтобы выделить или подчеркнуть химические или физические свойства элементов, которые не так очевидны в традиционных таблицах Менделеева, при этом разные таблицы больше ориентированы на химию или физику с обеих сторон. [290] Стандартная форма, которая остается наиболее распространенной, находится где-то посередине. [290]
Множество различных форм таблицы Менделеева вызвали вопросы о том, существует ли оптимальная или окончательная форма таблицы Менделеева, и если да, то какой она может быть. На оба вопроса в настоящее время нет единого ответа. [291] [290] Таблица левого шага Джанет все чаще обсуждается как кандидат на роль оптимальной или наиболее фундаментальной формы; Скерри написал в поддержку этого, поскольку он проясняет природу гелия как элемента s-блока, увеличивает регулярность за счет повторения всех длин периодов, точно следует правилу Маделунга, заставляя каждый период соответствовать одному значению n + ℓ , [г] и упорядочивает триады атомных номеров и тенденцию аномалий первого ряда. Хотя он отмечает, что размещение гелия поверх щелочноземельных металлов можно рассматривать как недостаток с химической точки зрения, он парирует это, апеллируя к аномалии первого ряда, указывая, что таблица Менделеева «фундаментально сводится к квантовой механике» и что речь идет об «абстрактных элементах» и, следовательно, об атомных свойствах, а не о макроскопических свойствах. [297]
| ж 1 | ж 2 | ж 3 | ж 4 | ж 5 | ж 6 | ж 7 | ж 8 | ж 9 | ж 10 | ж 11 | ж 12 | ж 13 | ж 14 | д 1 | д 2 | д 3 | д 4 | д 5 | д 6 | д 7 | д 8 | д 9 | д 10 | п 1 | п 2 | п 3 | п 4 | п 5 | п 6 | с 1 | с 2 | |||
| 1 с | ЧАС | Он | ||||||||||||||||||||||||||||||||
| 2 с | Что | Быть | ||||||||||||||||||||||||||||||||
| 2п 3с | Б | С | Н | ТО | Ф | Ne | Уже | мг | ||||||||||||||||||||||||||
| 3п 4с | Ал | И | П | С | кл. | С | К | Что | ||||||||||||||||||||||||||
| 3д 4п 5с | наук | Из | V | Кр | Мин. | Фе | Ко | В | С | Зн | Здесь | Ге | Как | Се | Бр | НОК | руб. | старший | ||||||||||||||||
| 4д 5п 6с | И | Зр | Нб | Мо | Тс | Ру | резус | ПД | В | компакт-диск | В | Сн | Сб | Te | я | Машина | Cs | Нет | ||||||||||||||||
| 4ф 5д 6п 7с | La | Этот | Пр | Нд | вечера | см | Евросоюз | Б-г | Тб | Те | К | Является | Тм | Ыб | Лу | хф | Облицовка | В | Ре | Ты | И | Пт | В | ртуть | Тл | Pb | С | Po | В | Рн | Пт | Солнце | ||
| 5ф 6д 7п 8с | И | че | Хорошо | В | Например | Мог | Являюсь | См | Бк | См. | Является | Фм | Мэриленд | Нет | лр | РФ | ДБ | Сг | Бх | Хс | гора | Дс | Рг | Сп | Нх | В | Мак | Лев | Ц | И | Новый | Мистер | ||
| f-блок | d-блок | p-блок | S-блок | |||||||||||||||||||||||||||||||
См. также
Примечания
- ^ Jump up to: Перейти обратно: а б с Вопрос о том, сколько природных элементов, достаточно сложен и до конца не решен. Самый тяжелый элемент, который встречается в больших количествах на Земле, — это элемент 92, уран . Однако в природе уран может подвергаться спонтанному делению , и образующиеся нейтроны могут поражать другие атомы урана. Если затем происходит захват нейтрона, элементы 93 и 94, нептуний и плутоний , образуются в результате бета-распада ; [29] на самом деле они более распространены, чем некоторые из самых редких элементов из первых 92, такие как прометий , астат и франций (см. «Обилие элементов в земной коре »). Теоретически захват нейтронов образующимся плутонием мог бы привести к образованию элементов даже с более высокими номерами, но их количества были бы слишком малы, чтобы их можно было наблюдать. [29] В ранней Солнечной системе короткоживущие элементы еще не распались, и, следовательно, в природе существовало более 94 элементов. Кюрий (элемент 96) является самым долгоживущим элементом после первых 94 и, вероятно, до сих пор попадает на Землю через космические лучи , но он не обнаружен. [29] Элементы до 99 ( эйнштейний ) наблюдались в Звезде Пшибыльского . [30] Элементы до 100 ( фермий ), вероятно, возникли в естественном ядерном реакторе деления на шахте Окло , в Габоне но они уже давно распались. [7] Еще более тяжелые элементы могут быть произведены в r-процессе в результате слияния сверхновых или нейтронных звезд , но это не подтверждено. Неясно, насколько далеко они продлятся после 100 и как долго они продлятся: расчеты показывают, что нуклиды с массовым числом от 280 до 290 образуются в r-процессе, но быстро бета-распадают до нуклидов, которые подвергаются спонтанному делению , так что 99,9% произведенных сверхтяжелых нуклидов распадутся в течение месяца. [31] Если бы вместо этого они были достаточно долгоживущими, они могли бы аналогичным образом быть доставлены на Землю с помощью космических лучей, но опять же ничего не было обнаружено. [29]
- ^ См., например, плакат с периодической таблицей, проданный Sigma-Aldrich.
- ^ Теоретически ожидается, что некоторые изотопы, которые в настоящее время считаются стабильными, будут радиоактивными с чрезвычайно длительным периодом полураспада: например, ожидается, что все стабильные изотопы элементов 62 ( самарий ), 63 ( европий ) и всех элементов, начиная с 67 ( гольмий ), будут претерпевают альфа-распад или двойной бета-распад . Однако предсказанные периоды полураспада чрезвычайно велики (например, альфа-распад 208 Pb в основное состояние 204 Ожидается, что ртуть будет иметь период полураспада более 10 120 лет), и распады никогда не наблюдались. [33] [34]
- ^ Период полураспада самого стабильного изотопа плутония достаточно велик, чтобы он также мог быть первичным элементом. В исследовании 1971 года утверждалось, что был обнаружен первичный плутоний. [35] но более недавнее исследование 2012 года не смогло его обнаружить. [36] Учитывая его вероятную первоначальную численность в Солнечной системе, нынешние эксперименты, проведенные в 2022 году, вероятно, будут примерно на порядок далеки от обнаружения живых первичных существ. 244 Мог. [37]
- ^ Крошечные следы плутония также постоянно доставляются на Землю через космические лучи. [38]
- ^ Строго говоря, нельзя нарисовать орбиталь так, чтобы электрон гарантированно находился внутри нее, но ее можно нарисовать, например, с гарантией 90% вероятности этого. [44]
- ^ Jump up to: Перейти обратно: а б Авторы расходятся во мнениях относительно того, n + ℓ было ли правило выведено из квантовой механики. Шерри утверждает, что это не так. [292] [293] несмотря на несколько попыток сделать это. [294] С другой стороны, Островский, заявлявший о таком обосновании с 1971 года, писал: «Некоторые авторы настаивают на том, что «до сих пор никто не вывел правило n+l из принципов квантовой теории». механика», в то время как другие представляют квантовое обоснование правила, которое никогда не оспаривалось». [295] Другие авторы утверждают, что в таком выводе нет необходимости, поскольку он допускает исключения. [296]
- ^ После удаления двух-четырех электронов энергия d- и f-орбиталей обычно становится ниже, чем у s: [55]
- 1s ≪ 2s < 2p ≪ 3s < 3p ≪ 3d < 4s < 4p ≪ 4d < 5s < 5p ≪ 4f < 5d < 6s < 6p ≪ 5f < 6d < 7s < 7p ≪ ...
- Cs 0 : 6s < 6p < 5d < 7s < 4f
- Нет + : 6s < 5d < 6p < 7s < 4f
- La2+ : 5d < 4f < 6 с < 6p < 7 с
- Этот 3+ : 4f < 5d < 6 с < 6p < 7 с
- ^ Фактически, электронные конфигурации представляют собой приближение первого порядка: атом действительно существует в суперпозиции нескольких конфигураций, и электроны в атоме неразличимы. [15] Элементы в d- и f-блоках имеют множество конфигураций, разделенных небольшими энергиями, и могут менять конфигурацию в зависимости от химической среды. [55] В некоторых из неоткрытых элементов g-блока смешивание конфигураций может стать настолько важным, что результат больше не может быть хорошо описан одной конфигурацией. [62]
- ^ Соединения, которые будут использовать 6d-орбитали нихония в качестве валентных орбиталей, были теоретически исследованы, но ожидается, что все они будут слишком нестабильными, чтобы их можно было наблюдать. [74]
- ^ Тем не менее, свойства элементов p-блока влияют на последующие элементы s-блока. Оболочка 3s в натрии находится над кайносимметричным ядром 2p, а оболочка 4s в калии находится над гораздо большим ядром 3p. Следовательно, хотя уже можно было ожидать, что атомы калия будут больше атомов натрия, разница в размерах больше, чем обычно. [99]
- ^ Существует также много низших оксидов: например, фосфор в 15-й группе образует два оксида, P 2 O 3 и P 2 O 5 . [116]
- ^ Обычно «запрещенные» промежуточные состояния окисления могут быть стабилизированы путем образования димеров , как в [Cl 3 Ga–GaCl 3 ] 2− (галлий в степени окисления +2) или S 2 F 10 (сера в степени окисления +5). [142] Некоторые соединения, находящиеся в таких промежуточных степенях окисления, на самом деле являются соединениями смешанной валентности, например Sb 2 O 4 , который содержит как Sb(III), так и Sb(V). [143]
- ^ Граница между дисперсионными силами и металлической связью постепенная, как и граница между ионной и ковалентной связью. Характерные металлические свойства не проявляются в малых кластерах ртути, но проявляются в крупных. [153]
- ^ Все это описывает ситуацию при стандартном давлении. При достаточно высоком давлении ширина запрещенной зоны любого твердого тела падает до нуля и происходит металлизация. Так, например, при давлении около 170 кбар йод становится металлом. [154] а металлический водород должен образоваться при давлении около четырех миллионов атмосфер. [156] см . в разделе «Давление металлизации» . Значения для всех неметаллов
- ^ Описания структур, образованных элементами, можно найти по всему Гринвуду и Эрншоу. Есть два пограничных случая. Самая стабильная форма мышьяка проводит электричество, как металл, но связь значительно более локализована среди ближайших соседей, чем для аналогичных структур сурьмы и висмута. [159] и в отличие от обычных металлов он не имеет длительного диапазона жидкого состояния, а вместо этого сублимируется. Следовательно, его структуру лучше рассматривать как ковалентную сеть. [160] Углерод в виде графита демонстрирует металлическую проводимость параллельно своим плоскостям, но является полупроводником перпендикулярно им. Некоторые расчеты предсказывают, что коперниций и флеровий неметаллические. [161] [162] но самые последние эксперименты над ними позволяют предположить, что они металлические. [163] [164] [165] Астат рассчитан на металлизацию при стандартных условиях, [166] так что, по-видимому, Теннессин тоже должен. [167]
- ^ См. точки плавления элементов (страница данных) . То же самое, вероятно, справедливо и в отношении франция, но из-за его крайней нестабильности это никогда не было подтверждено экспериментально. Предполагается, что коперниций и флеровий будут жидкими. [161] [162] похожи на ртуть, и экспериментальные данные позволяют предположить, что это металлы. [163] [164] [165]
- ^ Jump up to: Перейти обратно: а б См. списки металлоидов . Например, периодическая таблица, используемая Американским химическим обществом, включает полоний в качестве металлоида. [178] но тот, который используется Королевским химическим обществом, этого не делает, [179] а то, что включено в Британскую энциклопедию, вообще не относится к металлоидам или полуметаллам. [180] Классификация может меняться даже в пределах одного произведения. Например, в книге Шервина и Уэстона «Химия неметаллических элементов» (1966) на стр. 100 приведена периодическая таблица. 7 отнесение сурьмы к неметаллам, а на с. 115 его называют металлом. [181]
- ^ Демков и Островский рассматривают потенциал где и – постоянные параметры; это приближается к кулоновскому потенциалу для малых . Когда удовлетворяет условию , где для этого потенциала с нулевой энергией решения уравнения Шрёдингера могут быть описаны аналитически с помощью полиномов Гегенбауэра . Как проходит через каждое из этих значений, многообразие, содержащее все состояния с этим значением возникает при нулевой энергии, а затем становится связанным, восстанавливая порядок Маделунга. Соображения теории возмущений показывают, что состояния с меньшими имеют меньшую энергию и что s-орбитали (с ) их энергии приближаются к следующему группа. [244] [93]
- ^ Например, ранние актиниды продолжают вести себя больше как переходные металлы с d-блоком в своей склонности к высоким степеням окисления на всем пути от актиния к урану, хотя на самом деле только актиний и торий имеют конфигурации, подобные d-блоку. в газовой фазе; f-электроны появляются уже в протактинии. [113] Фактическая конфигурация [Rn]5f урана 3 6д 1 7 с 2 на самом деле аналогично тому, что Хунд предположил для лантаноидов, но уран не предпочитает трехвалентное состояние, предпочитая быть четырехвалентным или шестивалентным. [57] С другой стороны, лантаноидные конфигурации для актинидов начинаются с плутония, но сдвиг в сторону поведения, подобного лантанидам, ясен только в кюрии: элементы между ураном и кюрием образуют переход от поведения, подобного переходному металлу, к поведению, подобному лантаниду. поведение. [113] Таким образом, химическое поведение и электронная конфигурация не совсем совпадают. [113]
- ^ В конечном итоге было обнаружено, что технеций, прометий, астат, нептуний и плутоний также встречаются в природе, хотя и в крошечных следах. См. хронологию открытий химических элементов .
Ссылки
- ^ «Таблица Менделеева элементов» . ИЮПАК | Международный союз теоретической и прикладной химии . Проверено 11 мая 2024 г.
- ^ Мейя, Юрис; и др. (2016). «Атомные массы элементов 2013 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . 88 (3): 265–91. дои : 10.1515/pac-2015-0305 .
- ^ Прохаска, Томас; Ирргехер, Йоханна; Бенефилд, Жаклин; Бёлке, Джон К.; Чессон, Лесли А.; Коплен, Тайлер Б.; Дин, Типинг; Данн, Филип Дж. Х.; Грёнинг, Манфред; Холден, Норман Э.; Мейер, Харро Эй Джей (4 мая 2022 г.). «Стандартные атомные веса элементов 2021 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . дои : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ^ ( Нулевой элемент то есть вещество, состоящее исключительно из нейтронов) включен в несколько альтернативных представлений, например, в «Химическую галактику» . Видеть Лабарка, М. (2016). «Элемент с атомным номером ноль?». Новый химический журнал . 40 (11): 9002–9006. дои : 10.1039/C6NJ02076C . hdl : 11336/46854 .
- ^ Гринвуд и Эрншоу, стр. 24–27.
- ^ Грей, с. 6
- ^ Jump up to: Перейти обратно: а б Эмсли, Джон (2011). Строительные блоки природы: Путеводитель по элементам от Аризоны (новое издание). Нью-Йорк, штат Нью-Йорк: Издательство Оксфордского университета. ISBN 978-0-19-960563-7 .
- ^ Сильва, Роберт Дж. (2006). «Фермий, Менделевий, Нобелий и Лоренсий». В Морссе, ЛР; Эдельштейн, Нью-Мексико; Фугер, Дж. (ред.). Химия актинидных и трансактинидных элементов (3-е изд.). Дордрехт: Springer Science+Business Media . ISBN 978-1-4020-3555-5 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час Коннелли, Нью-Йорк; Дамхус, Т.; Хартсхорн, РМ; Хаттон, AT (2005). Номенклатура неорганической химии: Рекомендации ИЮПАК 2005 г. (PDF) . Издательство РСК. п. 51. ИСБН 978-0-85404-438-2 . Архивировано (PDF) из оригинала 23 ноября 2018 г. Проверено 26 ноября 2018 г.
- ^ Jump up to: Перейти обратно: а б с д и ж г час я Флак, Э. (1988). «Новые обозначения в таблице Менделеева» (PDF) . Чистое приложение. хим. 60 (3): 431–436. дои : 10.1351/pac198860030431 . S2CID 96704008 . Архивировано (PDF) из оригинала 25 марта 2012 года . Проверено 24 марта 2012 г.
- ^ Jump up to: Перейти обратно: а б с д и ж г час Шерри, Эрик (18 января 2021 г.). «Предварительный отчет о дискуссиях по группе 3 периодической таблицы» (PDF) . Химия Интернэшнл . 43 (1): 31–34. дои : 10.1515/ci-2021-0115 . S2CID 231694898 . Архивировано (PDF) из оригинала 13 апреля 2021 года . Проверено 9 апреля 2021 г.
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж Уильям Б. Дженсен (1982). «Положения лантана (актиния) и лютеция (лоуренция) в периодической таблице». Дж. Хим. Образование . 59 (8): 634–636. Бибкод : 1982JChEd..59..634J . дои : 10.1021/ed059p634 .
- ^ Jump up to: Перейти обратно: а б с Л. Д. Ландау , Е. М. Лифшиц (1958). Квантовая механика: нерелятивистская теория . Том. 3 (1-е изд.). Пергамон Пресс . стр. 256–7.
- ^ Jump up to: Перейти обратно: а б с д и Дженсен, Уильям Б. (2015). «Положения лантана (актиния) и лютеция (лоуренция) в периодической таблице: обновление» . Основы химии . 17 : 23–31. дои : 10.1007/s10698-015-9216-1 . S2CID 98624395 . Архивировано из оригинала 30 января 2021 года . Проверено 28 января 2021 г.
- ^ Jump up to: Перейти обратно: а б с Шерри, Эрик (2009). «Какие элементы относятся к группе 3?» . Журнал химического образования . 86 (10): 1188. doi : 10.1021/ed086p1188 . Проверено 1 января 2023 г.
- ^ Jump up to: Перейти обратно: а б Чеми, Александр Т.; Альбрехт-Шмитт, Томас Э. (2019). «Эволюция таблицы Менделеева посредством синтеза новых элементов». Радиохимика Акта . 107 (9–11): 1–31. дои : 10.1515/ract-2018-3082 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж Петруччи и др., с. 331
- ^ Пфайффер, Пол (1920). «Оплодотворение химии рентгеновской физикой» . Естественные науки (на немецком языке). 8 (50): 984–991. Бибкод : 1920NW......8..984P . дои : 10.1007/BF02448807 . S2CID 7071495 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в Гоник, Первый; Криддл, Крейг (2005). Мультяшный справочник по химии . Коллинз. стр. 17–65. ISBN 0-06-093677-0 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж к л м н «Таблица Менделеева элементов» . iupac.org . ИЮПАК. 2021. Архивировано из оригинала 10 апреля 2016 года . Проверено 3 апреля 2021 г.
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж Тиссен, П.; Биннеманс, К. (2011). «Размещение редких земель в таблице Менделеева: исторический анализ». В Гшнейднере, К.А. младшем; Бюнцли, JC.G; Вечарский, Бюнцли (ред.). Справочник по физике и химии редких земель . Том. 41. Амстердам: Эльзевир. стр. 1–93. дои : 10.1016/B978-0-444-53590-0.00001-7 . ISBN 978-0-444-53590-0 .
- ^ Скерри, с. 375
- ^ Jump up to: Перейти обратно: а б «Состав 3 группы таблицы Менделеева» . ИЮПАК. 2015. Архивировано из оригинала 5 июля 2016 года . Проверено 30 июля 2016 г.
- ^ Фейнман, Ричард; Лейтон, Роберт Б.; Сэндс, Мэтью (1964). «2. Связь точек зрения волн и частиц». Фейнмановские лекции по физике . Том. 3. Аддисон–Уэсли. ISBN 0-201-02115-3 . Архивировано из оригинала 19 октября 2021 года . Проверено 15 августа 2021 г.
- ^ Jump up to: Перейти обратно: а б с Фейнман, Ричард; Лейтон, Роберт Б.; Сэндс, Мэтью (1964). «2. Фундаментальная физика». Фейнмановские лекции по физике . Том. 1. Аддисон-Уэсли. ISBN 0-201-02115-3 . Архивировано из оригинала 28 марта 2014 года . Проверено 15 августа 2021 г.
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Атомный номер ». два : 10.1351/goldbook.A00499
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Онлайн исправленная версия: (2006–) « Химический элемент ». doi : 10.1351/goldbook.C01022
- ^ «Стандартные атомные веса» . Комиссия по изотопному содержанию и атомному весу . Международный союз теоретической и прикладной химии. 2019. Архивировано из оригинала 8 августа 2020 года . Проверено 7 февраля 2021 г.
- ^ Jump up to: Перейти обратно: а б с д и Торнтон, Бретт Ф.; Бердетт, Шон К. (2019). «Нейтронная звездная пыль и элементы Земли» . Природная химия . 11 (1): 4–10. Бибкод : 2019НатЧ..11....4Т . дои : 10.1038/s41557-018-0190-9 . ПМИД 30552435 . S2CID 54632815 . Архивировано из оригинала 14 августа 2021 года . Проверено 19 февраля 2022 г.
- ^ Гопка, В.Ф.; Ющенко А.В.; Ющенко В.А.; Панов, ИВ; Ким, Ч. (15 мая 2008 г.). «Идентификация линий поглощения актинидов с коротким периодом полураспада в спектре звезды Пшибыльского (HD 101065)». Кинематика и физика небесных тел . 24 (2): 89–98. Бибкод : 2008KPCB...24...89G . дои : 10.3103/S0884591308020049 . S2CID 120526363 .
- ^ Панов, ИВ (2017). «Образование сверхтяжелых элементов в природе». Физика атомных ядер . 81 (1): 57–65. дои : 10.1134/S1063778818010167 . S2CID 125149409 .
- ^ Марсильяк, Пьер де; Ноэль Корон; Жерар Дамбье; Жак Леблан; Жан-Пьер Моалик (апрель 2003 г.). «Экспериментальное обнаружение α-частиц радиоактивного распада природного висмута». Природа . 422 (6934): 876–878. Бибкод : 2003Natur.422..876D . дои : 10.1038/nature01541 . ПМИД 12712201 . S2CID 4415582 .
- ^ Белли, П.; Бернабей, Р.; Даневич, Ф.А.; и др. (2019). «Экспериментальные поиски редких альфа- и бета-распадов». Европейский физический журнал А. 55 (8): 140–1–140–7. arXiv : 1908.11458 . Бибкод : 2019EPJA...55..140B . дои : 10.1140/epja/i2019-12823-2 . ISSN 1434-601X . S2CID 201664098 .
- ^ Третьяк, В.И.; Здесенко, Ю.Г. (2002). «Таблицы данных двойного бета-распада — обновление». В. Данные Нукл. Таблицы данных . 80 (1): 83–116. Бибкод : 2002ADNDT..80...83T . дои : 10.1006/доп.2001.0873 .
- ^ Хоффман, округ Колумбия; Лоуренс, ФО; Мьюхертер, Дж.Л.; Рурк, FM (1971). «Обнаружение плутония-244 в природе». Природа . 234 (5325): 132–134. Бибкод : 1971Natur.234..132H . дои : 10.1038/234132a0 . S2CID 4283169 .
- ^ Лакнер, Дж.; и др. (2012). «Попытка обнаружить первобытное 244 Pu на Земле». Physical Review C. 85 ( 1): 015801. Bibcode : 2012PhRvC..85a5801L . doi : 10.1103/PhysRevC.85.015801 .
- ^ Ву, Ян; Син, Шан; Кристл, Маркус; Хоу, Шаочунь (2022) . 244 Pu in Bayan Obo bastnaesite» . Chinese Chemical Letters . 33 (7): 3522–3526. doi : 10.1016/j.cclet.2022.03.036 . S2CID 247443809. Проверено 29 января 2024 г.
- ^ Валлнер, А.; Фастерманн, Т.; Файги, Дж.; Фельдштейн, К.; Кни, К.; Корщинек, Г.; и др. (2015). «Изобилие живого 244 Pu в глубоководных резервуарах на Земле указывает на редкость актинидного нуклеосинтеза» Nature Communications . 6 : 5956. arXiv : 1509.08054 . Bibcode : 2015NatCo...6.5956W . doi : 10.1038/ncomms6956 . ISSN 2041-1723 . . 4309418 . ПМИД 25601158 .
- ^ Jump up to: Перейти обратно: а б Шерри, с. 17
- ^ «периодический закон» . Словарь Merriam-Webster.com . Проверено 29 марта 2021 г.
- ^ Jump up to: Перейти обратно: а б с Дженсен, Уильям Б. (2009). «Неправильное применение Периодического закона» . Журнал химического образования . 86 (10): 1186. Бибкод : 2009JChEd..86.1186J . дои : 10.1021/ed086p1186 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж к Фейнман, Ричард; Лейтон, Роберт Б.; Сэндс, Мэтью (1964). «19. Атом водорода и периодическая таблица». Фейнмановские лекции по физике . Том. 3. Аддисон–Уэсли. ISBN 0-201-02115-3 . Архивировано из оригинала 19 октября 2021 года . Проверено 15 августа 2021 г.
- ^ Петруччи и др., с. 323
- ^ Петруччи и др., с. 306
- ^ Петруччи и др., с. 322
- ^ Болл, Дэвид В.; Ки, Джесси А. (2011). Вводная химия (1-е канадское изд.). Ванкувер, Британская Колумбия: Кампус Британской Колумбии (opentextbc.ca). ISBN 978-1-77420-003-2 . Архивировано из оригинала 15 августа 2021 года . Проверено 15 августа 2021 г.
- ^ «Электронные конфигурации» . www.chem.fsu.edu . Государственный университет Флориды. 6 мая 2020 года. Архивировано из оригинала 6 мая 2022 года . Проверено 17 апреля 2022 г.
- ^ Jump up to: Перейти обратно: а б с д Гаудсмит, ЮАР; Ричардс, Пол I. (1964). «Порядок электронных оболочек в ионизированных атомах» (PDF) . Учеб. Натл. акад. наук. 51 (4): 664–671 (с исправлением на стр. 906). Бибкод : 1964PNAS...51..664G . дои : 10.1073/pnas.51.4.664 . ПМК 300183 . ПМИД 16591167 . Архивировано (PDF) из оригинала 10 октября 2017 г. Проверено 15 августа 2021 г.
- ^ Джолли, Уильям Л. (1984). Современная неорганическая химия (1-е изд.). МакГроу-Хилл. стр. 10–12 . ISBN 0-07-032760-2 .
- ^ Jump up to: Перейти обратно: а б с д и Островский В.Н. (май 2001 г.). «Что и как физика способствует пониманию периодического закона». Основы химии . 3 (2): 145–181. дои : 10.1023/А:1011476405933 . S2CID 15679915 .
- ^ Jump up to: Перейти обратно: а б Островский В.Н. (1981). «Динамическая симметрия атомного потенциала». Физический журнал B: Атомная и молекулярная физика . 14 (23): 4425–4439. Бибкод : 1981JPhB...14.4425O . дои : 10.1088/0022-3700/14/23/008 .
- ^ Jump up to: Перейти обратно: а б Вонг, Д. Пан (1979). «Теоретическое обоснование правления Маделунга». Дж. Хим. Образование. 56 (11): 714–718. Бибкод : 1979JChEd..56..714W . дои : 10.1021/ed056p714 .
- ^ Jump up to: Перейти обратно: а б с Петруччи и др., с. 328
- ^ Jump up to: Перейти обратно: а б Цао, Чансу; Вернон, Рене Э.; Шварц, WH Ойген; Ли, Цзюнь (6 января 2021 г.). «Понимание периодической и непериодической химии в таблицах Менделеева» . Границы в химии . 8 (813): 813. Бибкод : 2021FrCh....8..813S . дои : 10.3389/fchem.2020.00813 . ПМЦ 7818537 . ПМИД 33490030 .
- ^ Jump up to: Перейти обратно: а б с д и ж г Йоргенсен, Кристиан (1973). «Слабая связь между электронной конфигурацией и химическим поведением тяжелых элементов (трансуранов)». Angewandte Chemie, международное издание . 12 (1): 12–19. дои : 10.1002/anie.197300121 .
- ^ Jump up to: Перейти обратно: а б Эльяшевич, М.А. (1953). Спектры редких земель . Москва: Государственное издательство технико-теоретической литературы. стр. 382, 397.
- ^ Jump up to: Перейти обратно: а б с д и ж Йоргенсен, Кристиан Кликсбулл (1988). «Влияние редких земель на химическое понимание и классификацию». В деле Гшнейднер-младший, Карл А.; Айринг, Лерой (ред.). Справочник по физике и химии редких земель . Том. 11. Эльзевир. стр. 197–292. ISBN 978-0-444-87080-3 .
- ^ НИСТ (2023 г.). «База данных атомных спектров NIST: данные об энергиях ионизации: все в стиле Хо» . nist.gov . НИСТ . Проверено 5 января 2024 г.
- ^ Тосселл, Дж. А. (1 ноября 1977 г.). «Теоретические исследования энергий связи валентных орбиталей в твердом сульфиде цинка, оксиде цинка и фториде цинка». Неорганическая химия . 16 (11): 2944–2949. дои : 10.1021/ic50177a056 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж Киллер, Джеймс; Уотерс, Питер (2014). Химическая структура и реакционная способность (2-е изд.). Издательство Оксфордского университета. стр. 257–260. ISBN 978-0-19-9604135 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х и Дженсен, Уильям Б. (2000). «Периодический закон и таблица» (PDF) . Архивировано из оригинала (PDF) 10 ноября 2020 года . Проверено 10 декабря 2022 г.
- ^ Jump up to: Перейти обратно: а б с д и Нефедов В.И.; Тржасковская, М.Б.; Яржемский, В.Г. (2006). «Электронные конфигурации и периодическая таблица сверхтяжелых элементов» (PDF) . Доклады физической химии . 408 (2): 149–151. дои : 10.1134/S0012501606060029 . ISSN 0012-5016 . S2CID 95738861 . Архивировано (PDF) из оригинала 13 октября 2016 г. Проверено 15 августа 2021 г.
- ^ Вульфсберг, с. 27
- ^ Jump up to: Перейти обратно: а б Петруччи и др., стр. 326–7
- ^ Фарберович О.В.; Курганский С.И.; Домашевская, Е.П. (1980). «Проблемы метода ОПВ. II. Расчет зонной структуры ZnS и CdS». Физический статус Solidi B. 97 (2): 631–640. Бибкод : 1980ПССБР..97..631Ф . дои : 10.1002/pssb.2220970230 .
- ^ Jump up to: Перейти обратно: а б с д и Гамильтон, Дэвид К. (1965). «Положение лантана в периодической таблице». Американский журнал физики . 33 (8): 637–640. Бибкод : 1965AmJPh..33..637H . дои : 10.1119/1.1972042 .
- ^ Jump up to: Перейти обратно: а б с Кринский, Джамин Л.; Минасян, Стефан Г.; Арнольд, Джон (8 декабря 2010 г.). «Химия ковалентных лантанидов вблизи предела слабой связи: наблюдение (CpSiMe 3 ) 3 Ce-ECp * и комплексный анализ теории функциональной плотности Cp 3 Ln-ECp (E = Al, Ga)». Неорганическая химия . 50 (1). Американское химическое общество (ACS): 345–357. дои : 10.1021/ic102028d . ISSN 0020-1669 . ПМИД 21141834 .
- ^ Jump up to: Перейти обратно: а б с Дженсен, ВБ (2015). «Некоторые комментарии о положении Лоуренсия в периодической таблице» (PDF) . Архивировано из оригинала (PDF) 23 декабря 2015 года . Проверено 20 сентября 2015 г.
- ^ исследование роли 4f-орбиталей лантаноидов в связывании]. Acta Chimica Sinica (на китайском языке) . Ван, Фан; Ли-Мин (2002). «Теоретическое исследование роли 4f-орбиталей лантаноидов в связывании» [ Теоретическое 8): 1379–84.
- ^ Сюй, Вэй; Цзи, Вэнь-Синь; Цю, И-Сян; Шварц, WH Ойген; Ван, Шу-Гуан (2013). «О строении и связи трифторидов лантаноидов LnF 3 (Ln = La с Lu)». Физическая химия Химическая физика . 2013 (15): 7839–47. Бибкод : 2013PCCP...15.7839X . дои : 10.1039/C3CP50717C . ПМИД 23598823 .
- ^ Чи, Чаосянь; Пан, Судип; Джин, Джиай; Мэн, Луян; Ло, Минбяо; Чжао, Лили; Чжоу, Минфэй; Френкинг, Гернот (2019). «Октакарбонильные ионные комплексы актинидов [An(CO)8]+/- (An=Th, U) и роль f-орбиталей в связи металл-лиганд» . хим. Евро. Дж. 25 (50): 11772–11784. дои : 10.1002/chem.201902625 . ПМК 6772027 . ПМИД 31276242 .
- ^ Сингх, Прабхакар П. (1994). «Релятивистские эффекты в ртути: атом, кластеры и объем». Физический обзор B . 49 (7): 4954–4958. Бибкод : 1994PhRvB..49.4954S . дои : 10.1103/PhysRevB.49.4954 . ПМИД 10011429 .
- ^ Ху, Шу-Сянь; Цзоу, Вэньли (23 сентября 2021 г.). «Стабильный гексафторид коперниция (CnF 6 ) со степенью окисления VI+». Физическая химия Химическая физика . 2022 (24): 321–325. Бибкод : 2021PCCP...24..321H . дои : 10.1039/D1CP04360A . ПМИД 34889909 .
- ^ Сет, Майкл; Швердтфегер, Питер; Фегри, Кнут (1999). «Химия сверхтяжелых элементов. III. Теоретические исследования соединений 113-го элемента» . Журнал химической физики . 111 (14): 6422–6433. Бибкод : 1999JChPh.111.6422S . дои : 10.1063/1.480168 . S2CID 41854842 .
- ^ Келли, Морган П.; Деблонд, Готье Ж.-П.; Су, Цзин; Бут, Корвин Х.; Абергель, Ребекка Дж.; Батиста, Энрике Р.; Ян, Пин (2018). «Ковалентность связи и состояние окисления ионов актинида в комплексе с терапевтическим хелатирующим агентом 3,4,3-LI (1,2-HOPO)» . Неорганическая химия . 57 (9): 5352–5363. doi : 10.1021/acs.inorgchem.8b00345 . ОСТИ 1458511 . ПМИД 29624372 .
- ^ Йоханссон, Б.; Абуджа, Р.; Эрикссон, О.; и др. (1995). «Аномальная ГЦК-кристаллическая структура металлического тория» . Письма о физических отзывах . 75 (2): 280–283. Бибкод : 1995PhRvL..75..280J . doi : 10.1103/PhysRevLett.75.280 . ПМИД 10059654 .
- ^ Jump up to: Перейти обратно: а б Сюй, Вэнь-Хуа; Пюиккё, Пекка (8 июня 2016 г.). «Особенна ли химия лоуренция» . Физ. хим. хим. Физ . 2016 (18): 17351–5. Бибкод : 2016PCCP...1817351X . дои : 10.1039/c6cp02706g . hdl : 10138/224395 . ПМИД 27314425 . S2CID 31224634 . Проверено 24 апреля 2017 г.
- ^ Jump up to: Перейти обратно: а б с Шерри, с. 354–6
- ^ Оганесян, Ю.Ц. ; Абдуллин, Ф.Ш.; Бейли, PD; Бенкер, Делавэр; Беннетт, Мэн; Дмитриев С.Н.; и др. (2010). «Синтез нового элемента с атомным номером Z = 117 » . Письма о физических отзывах . 104 (14): 142502. Бибкод : 2010PhRvL.104n2502O . doi : 10.1103/PhysRevLett.104.142502 . ПМИД 20481935 . S2CID 3263480 .
- ^ Оганесян, Ю. Т.; и др. (2002). «Результаты первого 249
Ср + 48
Ca эксперимент» (PDF) . Сообщение ОИЯИ . Архивировано из оригинала (PDF) 13 декабря 2004 года . Проверено 13 июня 2009 года . - ^ Jump up to: Перейти обратно: а б «ИЮПАК объявляет названия элементов 113, 115, 117 и 118» . ИЮПАК . 30 ноября 2016 г. Архивировано из оригинала 30 ноября 2016 г. Проверено 1 декабря 2016 г.
- ^ Национальный институт стандартов и технологий (NIST) (август 2019 г.). «Периодическая таблица элементов» . НИСТ . Архивировано из оригинала 8 февраля 2021 года . Проверено 7 февраля 2021 г.
- ^ Фрике, Б. (1975). Дуниц, доктор медицинских наук (ред.). «Сверхтяжелые элементы и предсказание их химических и физических свойств». Структура и связь . 21 . Берлин: Springer-Verlag: 89–144. дои : 10.1007/BFb0116496 . ISBN 978-3-540-07109-9 .
- ^ Jump up to: Перейти обратно: а б с Лемоник, Сэм (2019). «Таблица Менделеева — это икона. Но химики до сих пор не могут договориться, как ее упорядочить» . Новости C&EN . Архивировано из оригинала 28 января 2021 года . Проверено 16 декабря 2020 г.
- ^ Jump up to: Перейти обратно: а б Грей, с. 12
- ^ Jump up to: Перейти обратно: а б с д и Власов Л.; Трифонов, Д. (1970). 107 рассказов о химии . Перевод Соболева, Издательство «Д. Мир». стр. 23–27. ISBN 978-0-8285-5067-3 .
- ^ Jump up to: Перейти обратно: а б с д и Рейнер-Кэнхэм, Джеффри (2020). Таблица Менделеева: прошлое, настоящее, будущее . Всемирная научная. стр. 53–70, 85–102. ISBN 978-981-12-1850-7 .
- ^ Клейден, Джонатан ; Гривз, Ник; Уоррен, Стюарт ; Уотерс, Питер (2001). Органическая химия (1-е изд.). Издательство Оксфордского университета. ISBN 978-0-19-850346-0 .
- ^ Сиборг, Г. (1945). «Химические и радиоактивные свойства тяжелых элементов». Новости химии и техники . 23 (23): 2190–93. doi : 10.1021/cen-v023n023.p2190 .
- ^ Jump up to: Перейти обратно: а б Каес, Херб; Аткинс, Питер (2009). «Центральное положение водорода в таблице Менделеева» . Химия Интернэшнл . 25 (6): 14. doi : 10.1515/ci.2003.25.6.14 .
- ^ Jump up to: Перейти обратно: а б Гринвуд и Эрншоу на протяжении всей книги
- ^ Шерри, Эрик (2004). «Размещение водорода в таблице Менделеева» . Химия Интернэшнл . 26 (3): 21–22. дои : 10.1515/ci.2004.26.3.21 . Проверено 1 января 2023 г.
- ^ Jump up to: Перейти обратно: а б Тиссен, Питер; Сеулеманс, Арну (2017). Нарушенная симметрия: теория групп от восьмеричного пути к таблице Менделеева . Издательство Оксфордского университета. стр. 336, 360–381. ISBN 978-0-19-061139-2 .
- ^ Курушкин, Михаил (2020). «Размещение гелия в периодической таблице с точки зрения кристаллической структуры» . МСКРЖ . 7 (4): 577–578. Бибкод : 2020IUCrJ...7..577K . дои : 10.1107/S2052252520007769 . ПМК 7340260 . ПМИД 32695406 . Архивировано из оригинала 19 октября 2021 года . Проверено 19 июня 2020 г.
- ^ Jump up to: Перейти обратно: а б с д Шерри, стр. 392−401
- ^ Jump up to: Перейти обратно: а б Грочала, Войцех (1 ноября 2017 г.). «О месте гелия и неона в Периодической таблице элементов» . Основы химии . 20 (2018): 191–207. дои : 10.1007/s10698-017-9302-7 .
- ^ Бент Вебер, Либби (18 января 2019 г.). « Таблица Менделеева» . Новости химии и техники . 97 (3). Архивировано из оригинала 1 февраля 2020 года . Проверено 27 марта 2020 г.
- ^ Грандинетти, Феличе (23 апреля 2013 г.). «Неон за вывесками» . Природная химия . 5 (2013): 438. Бибкод : 2013НатЧ...5..438Г . дои : 10.1038/nchem.1631 . ПМИД 23609097 .
- ^ Jump up to: Перейти обратно: а б с д и ж Секерский и Берджесс, стр. 23–26.
- ^ Секерский и Берджесс, с. 128
- ^ Льюарс, Эррол Г. (5 декабря 2008 г.). Чудеса моделирования: вычислительное предвидение новых молекул . Springer Science & Business Media. стр. 69–71. ISBN 978-1-4020-6973-4 . Архивировано из оригинала 19 мая 2016 года.
- ^ Jump up to: Перейти обратно: а б Вульфсберг, с. 53: «Как отметил У.Б. Йенсен, металлургическое сходство [с иттрием] гораздо сильнее у лютеция, чем у лантана, поэтому мы приняли металлургическое соглашение о включении Lu (и, соответственно, Lr) в список ниже Sc и Y. Важное дополнение Преимущество этого состоит в том, что периодическая таблица становится более симметричной, и становится легче предсказывать электронные конфигурации. Э. Р. Скерри указывает, что недавние определения электронных конфигураций большинства элементов f -блока теперь более совместимы с таким расположением Lu и. Лр."
- ^ Jump up to: Перейти обратно: а б Кондо, Дзюн (январь 1963 г.). «Сверхпроводимость переходных металлов» . Успехи теоретической физики . 29 (1): 1–9. Бибкод : 1963PThPh..29....1K . дои : 10.1143/PTP.29.1 .
- ^ Барбер, Роберт С.; Карол, Пол Дж; Накахара, Хиромичи; Вардачи, Эмануэле; Фогт, Эрих В. (2011). «Открытие элементов с атомными номерами больше или равными 113 (Технический отчет ИЮПАК)» . Чистое приложение. Хим . 83 (7): 1485. doi : 10.1351/PAC-REP-10-05-01 .
- ^ Карол, Пол Дж.; Барбер, Роберт С.; Шерилл, Брэдли М.; Вардачи, Эмануэле; Ямазаки, Тосимицу (22 декабря 2015 г.). «Открытие элементов с атомными номерами Z = 113, 115 и 117 (Технический отчет ИЮПАК)» . Чистое приложение. Хим . 88 (1–2): 139–153. дои : 10.1515/pac-2015-0502 .
- ^ Пюиккё, Пекка (2019). «Очерк периодических таблиц» (PDF) . Чистая и прикладная химия . 91 (12): 1959–1967. дои : 10.1515/pac-2019-0801 . S2CID 203944816 . Проверено 27 ноября 2022 г.
- ^ Jump up to: Перейти обратно: а б с д и Смитс, Одиль Р.; Дюльманн, Кристоф Э.; Инделикато, Пол; Назаревич, Витольд; Швердтфегер, Питер (2023). «Поиски сверхтяжелых элементов и предел таблицы Менделеева». Обзоры природы Физика . 6 (2): 86–98. дои : 10.1038/s42254-023-00668-y . S2CID 266276980 .
- ^ Ли, Дж. Джеффри (2009). «Таблицы Менделеева и ИЮПАК» . Химия Интернэшнл . 31 (1): 4–6. дои : 10.1515/ci.2009.31.1.4 . Проверено 8 января 2024 г.
- ^ Ли, Дж. Джеффри, изд. (1990). Номенклатура неорганической химии: рекомендации 1990 . Научные публикации Блэквелла. п. 283. ИСБН 0-632-02319-8 .
- ^ Вернон, Р. (2021). «Расположение и состав 3 группы таблицы Менделеева» . Основы химии . 23 (2): 155–197. дои : 10.1007/s10698-020-09384-2 . S2CID 254501533 .
- ^ Коттон, ЮАР; Рэйтби, Британская Колумбия; Щит, А (2022). «Сравнение структурной химии скандия, иттрия, лантана и лютеция: вклад в дебаты группы 3» (PDF) . Обзоры координационной химии . 455 : 214366. doi : 10.1016/j.ccr.2021.214366 . S2CID 245712597 .
- ^ Лавель, Лоуренс (2008). «Лантан (La) и актиний (Ac) должны остаться в d-блоке» . Журнал химического образования . 85 (11): 1482–1483. Бибкод : 2008JChEd..85.1482L . дои : 10.1021/ed085p1482 .
- ^ Jump up to: Перейти обратно: а б с д и ж г Джонсон, Дэвид (1984). Периодический закон (PDF) . Королевское химическое общество. ISBN 0-85186-428-7 .
- ^ Виттиг, Йорг (1973). «Переменная давления в физике твердого тела: как насчет сверхпроводников 4f-диапазона?». В HJ Queisser (ред.). Проблема Festkörper: пленарные лекции на отделениях физики полупроводников, физики поверхности, физики низких температур, высоких полимеров, термодинамики и статистической механики Немецкого физического общества, Мюнстер, 19–24 марта 1973 г. Достижения физики твердого тела. Том. 13. Берлин, Гейдельберг: Шпрингер. стр. 375–396. дои : 10.1007/BFb0108579 . ISBN 978-3-528-08019-8 .
- ^ Jump up to: Перейти обратно: а б Вульфсберг, с. 26
- ^ Jump up to: Перейти обратно: а б с д и Гринвуд и Эрншоу, стр. 27–9.
- ^ Месслер, Р.В. (2010). Сущность материалов для инженеров . Садбери, Массачусетс: Издательство Jones & Bartlett. п. 32. ISBN 978-0-7637-7833-0 .
- ^ Майерс, Р. (2003). Основы химии . Вестпорт, Коннектикут: Издательская группа Greenwood. стр. 61–67 . ISBN 978-0-313-31664-7 .
- ^ Чанг, Р. (2002). Химия (7-е изд.). Нью-Йорк: МакГроу-Хилл. стр. 289–310, 340–42 . ISBN 978-0-07-112072-2 .
- ^ Хаас, Артур Эрих (1884–1941) Об электродинамическом значении закона излучения Планка и о новом определении элементарного электрического кванта и размера атома водорода. Труды Императорской Академии наук в Вене. 2а, 119 стр. 119–144 (1910). Хаас А.Е. История развития закона сохранения силы. Докторская диссертация, Вена, 1909. Герман, А. Артур Эрих Хаас, Первый квантовый подход к атому. Штутгарт, 1965 г. [содержит перепечатку]
- ^ Jump up to: Перейти обратно: а б Кларк, Джим (2012). «Атомный и ионный радиус» . Химгид . Архивировано из оригинала 14 ноября 2020 года . Проверено 30 марта 2021 г.
- ^ Цао, Чанг-Су; Ху, Хань-Ши; Ли, Цзюнь; Шварц, WH Eugen (2019). «Физическое происхождение химических периодичностей в системе элементов» . Чистая и прикладная химия . 91 (12): 1969–1999. дои : 10.1515/pac-2019-0901 . S2CID 208868546 .
- ^ Каупп, Мартин (1 декабря 2006 г.). «Роль радиальных узлов атомных орбиталей для химической связи и таблицы Менделеева» . Журнал вычислительной химии . 28 (1): 320–25. дои : 10.1002/jcc.20522 . ПМИД 17143872 . S2CID 12677737 .
- ^ Jump up to: Перейти обратно: а б с д Шерри, стр. 407–420
- ^ Гринвуд и Эрншоу, с. 29
- ^ Имянитов, Наум С. (2018). «Таблица Менделеева получается двойной? Два варианта разделения элементов на два подмножества. Внутренняя и вторичная периодичность». Основы химии . 21 : 255–284. дои : 10.1007/s10698-018-9321-z . S2CID 254514910 .
- ^ Чистяков В.М. (1968). «Вторичная периодичность Бирона боковых d-подгрупп короткой таблицы Менделеева» . Журнал общей химии СССР . 38 (2): 213–214 . Проверено 6 января 2024 г.
- ^ П. Пюиккё; М. Ацуми (2009). «Молекулярные ковалентные радиусы одинарных связей для элементов 1-118». Химия: Европейский журнал . 15 (1): 186–197. дои : 10.1002/chem.200800987 . ПМИД 19058281 .
- ^ Jump up to: Перейти обратно: а б Пюиккё, Пекка; Декло, Жан Поль (1979). «Относительность и периодическая система элементов». Отчеты о химических исследованиях . 12 (8): 276. дои : 10.1021/ar50140a002 .
- ^ Норрби, Ларс Дж. (1991). «Почему ртуть жидкая? Или почему релятивистские эффекты не попадают в учебники химии?». Журнал химического образования . 68 (2): 110. Бибкод : 1991ЖЧЭд..68..110Н . дои : 10.1021/ed068p110 .
- ^ Jump up to: Перейти обратно: а б с д и ж Фрике, Буркхард; Вабер, Дж.Т. (1971). «Теоретические предсказания химии сверхтяжелых элементов: продолжение таблицы Менделеева до Z = 184» (PDF) . Обзоры актинидов . 1 : 433–485 . Проверено 5 января 2024 г.
- ^ Шедель, М. (2003). Химия сверхтяжелых элементов . Дордрехт: Kluwer Academic Publishers. п. 277. ИСБН 978-1-4020-1250-1 .
- ^ Вульфсберг, стр. 33–34.
- ^ Гринвуд и Эрншоу, стр. 24–5.
- ^ Jump up to: Перейти обратно: а б Кларк, Джим (2016). «Энергия ионизации» . Химгид . Архивировано из оригинала 22 апреля 2021 года . Проверено 30 марта 2021 г.
- ^ Jump up to: Перейти обратно: а б Кларк, Джим (2012). «Электронное сродство» . Химгид . Архивировано из оригинала 23 апреля 2021 года . Проверено 30 марта 2021 г.
- ^ Карденас, Карлос; Айерс, Пол; Де Профт, Фрэнк; Тозер, Дэвид Дж.; Герлингс, Пол (2010). «Следует ли использовать отрицательное сродство к электрону для оценки химической твердости?». Физическая химия Химическая физика . 13 (6): 2285–2293. дои : 10.1039/C0CP01785J . ПМИД 21113528 .
- ^ Шмидт, ХТ; Рейнхед, П.; Орбан А.; Розен, С.; Томас, доктор медицинских наук; Йоханссон, HAB; Вернер, Дж.; Мисра, Д.; Бьорхаге, М.; Брэннхольм, Л.; Лёфгрен, П.; Лильджеби, Л.; Седерквист, Х. (2012). «Время жизни аниона гелия» . Физический журнал: серия конференций . 388 (1): 012006. Бибкод : 2012JPhCS.388a2006S . дои : 10.1088/1742-6596/388/1/012006 .
- ^ Вульфсберг, с. 28
- ^ Вульфсберг, с. 274
- ^ Гринвуд и Эрншоу, с. 113
- ^ Jump up to: Перейти обратно: а б с Секерский и Берджесс, стр. 45–54.
- ^ Амадор, Дж.; Пуэбла, Э. Гутьеррес; Монж, Массачусетс; Разинес, И.; Валеро, К. Руис (1988). «Возвращение к тетраоксидам дисурьмы». Неорганическая химия . 27 (8): 1367–1370. дои : 10.1021/ic00281a011 .
- ^ Jump up to: Перейти обратно: а б с Секерский и Берджесс, стр. 134–137.
- ^ Jump up to: Перейти обратно: а б Секерский и Берджесс, стр. 178–180.
- ^ Jump up to: Перейти обратно: а б Шерри, стр. 14–15
- ^ Jump up to: Перейти обратно: а б с д Гринвуд и Эрншоу, стр. 25–6.
- ^ Аллен, Лиланд К. (1989). «Электроотрицательность - это средняя одноэлектронная энергия электронов валентной оболочки в свободных атомах в основном состоянии». Журнал Американского химического общества . 111 (25): 9003–9014. дои : 10.1021/ja00207a003 .
- ^ Дитер, РК; Уотсон, RT (2009). «Реакции трансметаллирования с образованием медьорганических соединений» . В Раппопорте З.; Марек, И. (ред.). Химия медьорганических соединений . Том. 1. Джон Уайли и сыновья. стр. 443–526. ISBN 978-0-470-77296-6 . Архивировано из оригинала 17 октября 2022 года . Проверено 6 апреля 2022 г.
- ^ Карраско, Риго А.; Замаррипа, Сеси М.; Цольнер, Стефан; Менендес, Хосе; Частанг, Стефани А.; Дуань, Цзиньсун; Гжибовский, Гордон Дж.; Клафлин, Брюс Б.; Кифер, Арнольд М. (2018). «Прямая запрещенная зона серого α-олова, исследованная методом инфракрасной эллипсометрии» . Письма по прикладной физике . 113 (23): 232104. Бибкод : 2018ApPhL.113w2104C . дои : 10.1063/1.5053884 . S2CID 125130534 .
- ^ «Межмолекулярная связь – силы Ван-дер-Ваальса» . Архивировано из оригинала 22 января 2022 года . Проверено 17 ноября 2021 г.
- ^ Кларк, Джим (2019). «Металлическое соединение» . Химгид . Архивировано из оригинала 21 апреля 2021 года . Проверено 30 марта 2021 г.
- ^ Пастор, генеральный директор; Стампфли, П.; Беннеманн, К. (1988). «О переходе от Ван-дер-Ваальсовой связи к металлической в Hg-кластерах в зависимости от размера кластера». Физика Скрипта . 38 (4): 623–626. Бибкод : 1988PhyS...38..623P . дои : 10.1088/0031-8949/38/4/022 . S2CID 250842014 .
- ^ Jump up to: Перейти обратно: а б с д и ж г Секерский и Берджесс, стр. 60–66.
- ^ Jump up to: Перейти обратно: а б с д Штойдель, Ральф; Шешкевиц, Дэвид (2020). Химия неметаллов . Вальтер де Грюйтер. стр. 154–155, 425, 436. ISBN. 978-3-11-057805-8 .
В 15-й группе таблицы Менделеева, как и в обеих соседних группах, металлический характер усиливается при движении вниз. Точнее, происходит переход от чисто неметаллического элемента (N) через элементы с неметаллическими и металлическими модификациями к чисто металлическим элементам (Sb, Bi). В этой главе рассматриваются два элемента, помимо азота, которые при стандартных условиях явно неметаллические: фосфор и мышьяк. Однако химия мышьяка описана лишь кратко, поскольку многие соединения мышьяка напоминают соответствующие виды фосфора.
- ^ Макминис, Дж.; Клэй, RC; Ли, Д.; Моралес, Массачусетс (2015). «Молекулярный фазовый переход в атомный в водороде под высоким давлением» . Физ. Преподобный Летт. 114 (10): 105305. Бибкод : 2015PhRvL.114j5305M . doi : 10.1103/PhysRevLett.114.105305 . ПМИД 25815944 .
- ^ Хоукс, Стивен Дж. (2001). «Полуметалличность?». Журнал химического образования . 78 (12): 1686. Бибкод : 2001JChEd..78.1686H . дои : 10.1021/ed078p1686 .
- ^ Мьюз, Ян Майкл; Смитс, Одиль Розетт; Джерабек, Пол; Швердтфегер, Питер (25 июля 2019 г.). «Оганессон - полупроводник: о релятивистском сужении запрещенной зоны в самых тяжелых твердых телах благородных газов» . Прикладная химия . 58 (40): 14260–14264. дои : 10.1002/anie.201908327 . ПМК 6790653 . ПМИД 31343819 .
- ^ Смит, доктор медицинских наук (1973). Химия мышьяка, сурьмы и висмута . Пергамон Пресс. п. 556.
- ^ Рейнер-Кэнхэм, Джефф; Овертон, Тина (2008). Описательная неорганическая химия (5-е изд.). Нью-Йорк: WH Freeman and Company. п. 194. ИСБН 978-1-4292-2434-5 .
- ^ Jump up to: Перейти обратно: а б Мьюз, Ж.-М.; Смитс, Орегон; Кресс, Г.; Швердтфегер, П. (2019). «Коперниций — релятивистская благородная жидкость» . Международное издание «Прикладная химия» . 58 (50): 17964–17968. дои : 10.1002/anie.201906966 . ПМК 6916354 . ПМИД 31596013 .
- ^ Jump up to: Перейти обратно: а б Флорес, Эдисон; Смитс, Одиль Р.; Мьюз, Ян-Майкл; Джерабек, Пол; Швердтфегер, Питер (2022). «Из газовой фазы в твердое состояние: химическая связь в сверхтяжелом элементе флеровии». Журнал химической физики . 157 (6): 064304. Бибкод : 2022JChPh.157f4304F . дои : 10.1063/5.0097642 . ПМИД 35963734 . S2CID 250539378 .
- ^ Jump up to: Перейти обратно: а б Геггелер, HW (2007). «Газовая фазовая химия сверхтяжелых элементов» (PDF) . Институт Пола Шеррера . стр. 26–28. Архивировано из оригинала (PDF) 20 февраля 2012 года.
- ^ Jump up to: Перейти обратно: а б Инго, Питер (15 сентября 2022 г.). «Исследование показывает, что флеровий — самый летучий металл в таблице Менделеева» . физ.орг . Проверено 22 ноября 2022 г.
- ^ Jump up to: Перейти обратно: а б Якушев А.; Ленс, Л.; Дюльманн, Ч. Э.; и др. (25 августа 2022 г.). «Об адсорбции и реакционной способности элемента 114 флеровия» . Границы в химии . 10 (976635): 976635. Бибкод : 2022FrCh...10.6635Y . дои : 10.3389/fchem.2022.976635 . ПМЦ 9453156 . ПМИД 36092655 .
- ^ Германн, А.; Хоффманн, Р.; Эшкрофт, Северо-Запад (2013). «Конденсированный астат: одноатомный и металлический». Письма о физических отзывах . 111 (11): 116404-1–116404-5. Бибкод : 2013PhRvL.111k6404H . doi : 10.1103/PhysRevLett.111.116404 . ПМИД 24074111 .
- ^ Болл, Филип (13 сентября 2013 г.). «Металлические свойства астата предсказаны» . Химический мир . Проверено 7 апреля 2023 г.
- ^ Jump up to: Перейти обратно: а б Кларк, Джим (2012). «Металлические конструкции» . Химгид . Архивировано из оригинала 24 апреля 2021 года . Проверено 30 марта 2021 г.
- ^ Холлеман, Арнольд Ф.; Виберг, Эгон; Виберг, Нильс (1985). «Марганец». Учебник неорганической химии (на немецком языке) (91–100 изд.). Вальтер де Грюйтер. стр. 1110–1117. ISBN 978-3-11-007511-3 .
- ^ Виберг, Эгон; Виберг, Нильс и Холлеман, Арнольд Фредерик (2001). Неорганическая химия . Академическая пресса. п. 758. ИСБН 978-0-12-352651-9 .
- ^ Хаммонд, ЧР (2004). Элементы в Справочнике по химии и физике (81-е изд.). Бока-Ратон (Флорида, США): CRC press. стр. 4–1 . ISBN 978-0-8493-0485-9 .
- ^ Г.В. Самсонов, изд. (1968). «Механические свойства элементов». Справочник физико-химических свойств элементов . Нью-Йорк, США: Пленум МФИ. стр. 387–446. дои : 10.1007/978-1-4684-6066-7_7 . ISBN 978-1-4684-6066-7 . Архивировано из оригинала 2 апреля 2015 года.
- ^ Хаммер, Б.; Норсков, Ю.К. (1995). «Почему золото — благороднейший из всех металлов». Природа . 376 (6537): 238–240. Бибкод : 1995Natur.376..238H . дои : 10.1038/376238a0 . S2CID 4334587 .
- ^ Джонсон, ПБ; Кристи, RW (1972). «Оптические константы благородных металлов». Физический обзор B . 6 (12): 4370–4379. Бибкод : 1972PhRvB...6.4370J . дои : 10.1103/PhysRevB.6.4370 .
- ^ Кларк, Джим (2018). «Атомные и физические свойства элементов периода 3» . Химгид . Архивировано из оригинала 22 апреля 2021 года . Проверено 30 марта 2021 г.
- ^ Jump up to: Перейти обратно: а б Кларк, Джим (2015). «Тенденция от неметалла к металлу в элементах группы 4» . Химгид . Архивировано из оригинала 27 апреля 2021 года . Проверено 30 марта 2021 г.
- ^ Вэй, Ланьхуа; Куо, ПК; Томас, РЛ; Энтони, ТР; Банхольцер, ВФ (1993). «Теплопроводность изотопно-модифицированного монокристаллического алмаза». Письма о физических отзывах . 70 (24): 3764–3767. Бибкод : 1993PhRvL..70.3764W . дои : 10.1103/PhysRevLett.70.3764 . ПМИД 10053956 .
- ^ Jump up to: Перейти обратно: а б с д «Таблица Менделеева химических элементов» . www.acs.org . Американское химическое общество . 2021. Архивировано из оригинала 3 февраля 2021 года . Проверено 27 марта 2021 г.
- ^ «Таблица Менделеева» . www.rsc.org . Королевское химическое общество . 2021. Архивировано из оригинала 21 марта 2021 года . Проверено 27 марта 2021 г.
- ^ Jump up to: Перейти обратно: а б с д и Сиборг, Г. (ок. 2006 г.). «трансурановый элемент (химический элемент)» . Британская энциклопедия . Архивировано из оригинала 30 ноября 2010 года . Проверено 16 марта 2010 г.
- ^ Шервин, Э.; Уэстон, Дж.Дж. (1966). Спайс, Дж. Э. (ред.). Химия неметаллических элементов . Пергамон Пресс. ISBN 978-1-4831-3905-0 .
- ^ Jump up to: Перейти обратно: а б Хоукс, Стивен Дж. (2001). «Полуметалличность?». Журнал химического образования . 78 (12): 1686–1687. Бибкод : 2001JChEd..78.1686H . дои : 10.1021/ed078p1686 .
- ^ Jump up to: Перейти обратно: а б Дженсен, Уильям Б. (1986). «Классификация, симметрия и таблица Менделеева» (PDF) . Комп. и математика. С приложениями . 12Б (I/2). Архивировано (PDF) из оригинала 31 января 2017 года . Проверено 18 января 2017 г.
- ^ Гринвуд и Эрншоу, стр. 29–31.
- ^ Фернелиус, WC; Лёнинг, Курт; Адамс, Рой М. (1971). «Названия групп и элементов». Журнал химического образования . 48 (11): 730–731. Бибкод : 1971JChEd..48..730F . дои : 10.1021/ed048p730 .
- ^ Дженсен, Уильям Б. (2003). «Место цинка, кадмия и ртути в периодической таблице» (PDF) . Журнал химического образования . 80 (8): 952–961. Бибкод : 2003JChEd..80..952J . дои : 10.1021/ed080p952 . Архивировано из оригинала (PDF) 11 июня 2010 года . Проверено 6 мая 2012 г.
- ^ Ли, Дж.Дж., изд. (2011). Принципы химической номенклатуры (PDF) . Королевское химическое общество. п. 9. ISBN 978-1-84973-007-5 .
- ^ Винтер, Марк (1993–2022). «ВебЭлементы» . Университет Шеффилда и компания WebElements Ltd, Великобритания . Проверено 5 декабря 2022 г.
- ^ Коуэн, Роберт Д. (1981). Теория атомной структуры и спектров . Издательство Калифорнийского университета. п. 598. ИСБН 978-0-520-90615-0 .
- ^ Вильяр, GE (1966). «Предлагаемая модификация периодической таблицы». Журнал неорганической и ядерной химии . 28 (1): 25–29. дои : 10.1016/0022-1902(66)80224-5 .
- ^ Jump up to: Перейти обратно: а б Коттон, ЮАР (1996). «После актинидов что дальше?». Обзоры химического общества . 25 (3): 219–227. дои : 10.1039/CS9962500219 .
- ^ Неве, Франческо (2022). «Химия сверхтяжелых переходных металлов». Журнал координационной химии . 75 (17–18): 2287–2307. дои : 10.1080/00958972.2022.2084394 . S2CID 254097024 .
- ^ Мингос, Майкл (1998). Основные направления неорганической химии . Издательство Оксфордского университета. п. 387. ИСБН 978-0-19-850109-1 .
- ^ «Новая эра открытий: долгосрочный план развития ядерной науки на 2023 год» (PDF) . Министерство энергетики США. Октябрь 2023 г. Архивировано из оригинала (PDF) 5 октября 2023 г. . Проверено 20 октября 2023 г. - через OSTI.
Сверхтяжелые элементы ( Z > 102) балансируют на пределе массы и заряда.
- ^ Краг, Хельге (2017). «Поиски сверхтяжелых элементов: историко-философские перспективы». arXiv : 1708.04064 [ physical.hist-ph ].
- ^ Теунс, Том. «Металличность звезд» . icc.dur.ac.uk. Даремский университет. Архивировано из оригинала 27 сентября 2021 года . Проверено 27 марта 2021 г.
- ^ Бернс, Джеральд (1985). Физика твердого тела . Academic Press, Inc., стр. 339–40. ISBN 978-0-12-146070-9 .
- ^ Даффус, Джон Х. (2002). « Тяжелые металлы – бессмысленный термин?» (PDF) . Чистая и прикладная химия . 74 (5): 793–807. дои : 10.1351/pac200274050793 . S2CID 46602106 . Архивировано (PDF) из оригинала 11 апреля 2021 года . Проверено 27 марта 2021 г.
- ^ Коппенол, В. (2016). «Как назвать новые химические элементы» (PDF) . Чистая и прикладная химия . ДеГрюйтер. дои : 10.1515/pac-2015-0802 . hdl : 10045/55935 . S2CID 102245448 . Архивировано (PDF) из оригинала 11 мая 2020 года . Проверено 15 августа 2021 г.
- ^ Рот, Клаус (3 апреля 2018 г.). «Является ли элемент 118 благородным газом?» . Chemie in unserer Zeit . дои : 10.1002/chemv.201800029 . Архивировано из оригинала 2 марта 2021 года . Проверено 27 марта 2021 г.
- ^ Химическое общество Японии (25 января 2018 г.). «[Уведомление] Реакция на предложение (1) относительно терминологии, используемой в школьной химии» www.chemistry.or.jp . Архивировано из оригинала 16. Май 2021 г. Получено 3 апреля 2021 г.
Что касается темы «12. Щелочноземельные металлы», все учебники учитывают это предложение, если △ включен. Исторически этот термин относился к четвертому периоду кальция и ниже, но теперь естественно следовать рекомендации ИЮПАК1), согласно которой этот термин соответствует 2-й группе периодической таблицы.
- ^ Вурцер, Фердинанд (1817). «Отрывок из письма придворного советника Вурцера, профессора химии из Марбурга». Анналы физики (на немецком языке). 56 (7): 331–334. Бибкод : 1817АнП....56..331. . дои : 10.1002/andp.18170560709 . Архивировано из оригинала 8 октября 2021 года . Проверено 15 августа 2021 г. Здесь Дёберейнер обнаружил, что свойства стронция были промежуточными по сравнению со свойствами кальция и бария.
- ^ Дёберейнер, JW (1829). «Versuch zu einer Gruppirung der elementaren Stoffe nach ihrer Analogie» [Попытка сгруппировать элементарные вещества по их аналогиям]. Аннален дер Физик и Химия . 2-я серия (на немецком языке). 15 (2): 301–307. Бибкод : 1829АнП....91..301Д . дои : 10.1002/andp.18290910217 . Архивировано из оригинала 8 октября 2021 года . Проверено 15 августа 2021 г. Английский перевод этой статьи см.: Иоганн Вольфганг Дёберейнер: «Попытка сгруппировать элементарные вещества по их аналогиям» (Колледж Лемойн (Сиракьюс, Нью-Йорк, США)) Архивировано 9 марта 2019 г. в Wayback Machine.
- ^ Хорвиц, Л. (2002). Эврика!: Научные прорывы, изменившие мир . Нью-Йорк: Джон Уайли. п. 43. Бибкод : 2001esbt.book.....H . ISBN 978-0-471-23341-1 . OCLC 50766822 .
- ^ Скерри, с. 47
- ^ Болл, П. (2002). Ингредиенты: экскурсия по элементам . Оксфорд: Издательство Оксфордского университета. п. 100. ИСБН 978-0-19-284100-1 .
- ^ Jump up to: Перейти обратно: а б Чисхолм, Хью , изд. (1911). . энциклопедия Британская Том. 19 (11-е изд.). Издательство Кембриджского университета. п. 515.
- ^ Мейер, Юлиус Лотар; Современные теории химии (1864 г.); таблица на странице 137. Архивировано 2 января 2019 г. в Wayback Machine.
- ^ Скерри, стр. 106–108
- ^ Скерри, с. 113
- ^ Jump up to: Перейти обратно: а б Шерри, стр. 117–123
- ^ Менделеев, Д. (1871). «Природная система элементов и ее применение к указанию свойств неоткрытых элементов» . Журнал Российского химического общества (на русском языке). 3 : 25–56. Архивировано из оригинала 13 августа 2017 года . Проверено 23 августа 2017 г.
- ^ Скерри, с. 149
- ^ Скерри, с. 151–2
- ^ Рувре, Р. «Дмитрий Менделеев» . Новый учёный . Архивировано из оригинала 15 августа 2021 года . Проверено 19 апреля 2020 г.
- ^ Скерри, стр. 164–169
- ^ Jump up to: Перейти обратно: а б с Маршалл, Дж.Л.; Маршалл, VR (2010). «Повторное открытие элементов: Мозли и атомные номера» (PDF) . Шестиугольник . Том. 101, нет. 3. Альфа Хи Сигма . стр. 42–47. S2CID 94398490 . Архивировано из оригинала (PDF) 16 июля 2019 года . Проверено 15 августа 2021 г.
- ^ А. ван ден Брук, Physical Journal , 14, (1913), 32–41.
- ^ Скерри, с. 185
- ^ А. ван ден Брук, Радиоэлементы, периодическая система и строение атома, Физика. Журнал, 14, 32 (1913).
- ^ Э. Резерфорд, Фил. Маг., 27, 488–499 (март 1914 г.). «Это привело к интересному предположению Ван Брока о том, что число единиц заряда ядра и, следовательно, количество внешних электронов может быть равно числу элементов, расположенных в порядке возрастания атомного веса. Согласно этой точке зрения, заряды ядер водорода, гелия и углерода равны 1, 2, 6 соответственно и так далее для остальных элементов, при условии, что нет разрыва из-за отсутствия элемента. Эта точка зрения была принята Бором в его теории. строение простых атомов и молекул».
- ^ Аткинс, PW (1995). Периодическое царство . HarperCollins Publishers, Inc. с. 87 . ISBN 978-0-465-07265-1 .
- ^ Эгделл, Рассел Г.; Брутон, Элизабет (2020). «Генри Мозли, рентгеновская спектроскопия и таблица Менделеева» . Философские труды Королевского общества A: Математические, физические и технические науки . 378 (2180). дои : 10.1002/chem.202004775 . ПМИД 32811359 .
- ^ Хисамацу, Ёдзи; Эгашира, Казухиро; Маэно, Ёситеру (2022). «Ниппоний Огавы и его переприсвоение рению» . Основы химии . 24 : 15–57. дои : 10.1007/s10698-021-09410-x .
- ^ Jump up to: Перейти обратно: а б с Шерри, Эрик (2013). Сказка о семи стихиях . Издательство Оксфордского университета. стр. 47–53, 115. ISBN. 978-0-19-539131-2 .
- ^ См. таблицу Бора из статьи 1913 года ниже.
- ^ Хельге Краг, Орхус, Ларс Вегард, атомная структура и периодическая система, Bull. Хист. Chem., ТОМ 37, №1 (2012), стр.43.
- ^ Скерри, стр. 208–218
- ^ Нильс Бор, «О строении атомов и молекул, Часть III, Системы, содержащие несколько ядер» Philosophical Magazine 26:857-875 (1913)
- ^ Краг, Хельге (1 января 1979 г.). «Вторая атомная теория Нильса Бора» . Исторические исследования в физических науках . 10 : 123–186. дои : 10.2307/27757389 . ISSN 0073-2672 . JSTOR 27757389 .
- ^ В. Коссель, «Об образовании молекул в результате атомной структуры», Ann. Физика, 1916, 49, 229–362 (237).
- ^ Переведено в Хельге Краге, Орхусе, Ларсе Вегарде, Атомной структуре и периодической системе, Bull. Хист. Chem., ТОМ 37, номер 1 (2012), стр.43.
- ^ Ленгмюр, Ирвинг (июнь 1919 г.). «Расположение электронов в атомах и молекулах» . Журнал Американского химического общества . 41 (6): 868–934. дои : 10.1021/ja02227a002 . ISSN 0002-7863 . Архивировано из оригинала 26 января 2021 года . Проверено 22 октября 2021 г.
- ^ Jump up to: Перейти обратно: а б Бери, Чарльз Р. (июль 1921 г.). «Теория Ленгмюра о расположении электронов в атомах и молекулах» . Журнал Американского химического общества . 43 (7): 1602–1609. дои : 10.1021/ja01440a023 . ISSN 0002-7863 . Архивировано из оригинала 30 октября 2021 года . Проверено 22 октября 2021 г.
- ^ Дженсен, Уильям Б. (2003). «Место цинка, кадмия и ртути в периодической таблице» (PDF) . Журнал химического образования . 80 (8): 952–961. Бибкод : 2003JChEd..80..952J . дои : 10.1021/ed080p952 . Архивировано (PDF) из оригинала 19 апреля 2012 года . Проверено 18 сентября 2021 г.
Первое использование термина «переход» в его современном электронном смысле, по-видимому, связано с британским химиком Ч. Р. Бери, который впервые использовал этот термин в своей статье 1921 года об электронной структуре атомов и периодической таблице.
- ^ Костер, Д.; Хевеши, Г. (1923). «О недостающем элементе атомного номера 72» . Природа . 111 (2777): 79. Бибкод : 1923Natur.111...79C . дои : 10.1038/111079a0 .
- ^ Фернелиус, WC (1982). «Гафний» (PDF) . Журнал химического образования . 59 (3): 242. Бибкод : 1982JChEd..59..242F . дои : 10.1021/ed059p242 . Архивировано из оригинала (PDF) 15 марта 2020 года . Проверено 3 сентября 2009 г.
- ^ Бёрдетт, Шон С.; Торнтон, Бретт Ф. (2018). «Гафний, лютеций, которым я был раньше» . Природная химия . 10 (10): 1074. Бибкод : 2018НатЧ..10.1074Б . дои : 10.1038/s41557-018-0140-6 . ПМИД 30237529 . Проверено 8 февраля 2024 г.
- ^ Скерри, стр. 218–23
- ^ Дженсен, Уильям Б. (2007). «Происхождение орбитальных меток s, p, d, f» (PDF) . Журнал химического образования . 84 (5): 757–8. Бибкод : 2007JChEd..84..757J . дои : 10.1021/ed084p757 . Архивировано из оригинала (PDF) 23 ноября 2018 года . Проверено 15 августа 2021 г.
- ^ Карапетов, Владимир (1930). «Диаграмма последовательных наборов электронных орбит внутри атомов химических элементов». Журнал Института Франклина . 210 (5): 609–624. дои : 10.1016/S0016-0032(30)91131-3 .
- ^ Островский, Валентин Н. (2003). «Физическое объяснение таблицы Менделеева». Анналы Нью-Йоркской академии наук . 988 (1): 182–192. Бибкод : 2003NYASA.988..182O . дои : 10.1111/j.1749-6632.2003.tb06097.x . ПМИД 12796101 . S2CID 21629328 .
- ^ Клечковский, В. М. (1962). «Обоснование правила последовательного заполнения (n+l) групп» . Журнал экспериментальной и теоретической физики . 14 (2): 334 . Проверено 23 июня 2022 г.
- ^ Jump up to: Перейти обратно: а б Демков Юрий Н.; Островский, Валентин Николаевич (1972). «Правило заполнения n+l в периодической системе и фокусирующие потенциалы» . Журнал экспериментальной и теоретической физики . 35 (1): 66–69. Бибкод : 1972ЖЭТП...35...66Д . Проверено 25 ноября 2022 г.
- ^ Скерри, стр. 313–321
- ^ Скерри, стр. 322–340
- ^ Jump up to: Перейти обратно: а б Сиборг, Гленн Т. (1997). «Источник концепции актинидов» (PDF) . fas.org . Лос-Аламосская национальная лаборатория. Архивировано (PDF) из оригинала 15 августа 2021 года . Проверено 28 марта 2021 г.
- ^ Скерри, стр. 356–9
- ^ Орстрем, Ларс; Холден, Норман Э. (2016). «Трехбуквенные символы стихий» . Химия Интернэшнл . 38 (2): 4–8. дои : 10.1515/ci-2016-0204 . S2CID 124737708 .
- ^ Вапстра, АХ (1991). «Критерии, которым необходимо удовлетворить, чтобы открытие нового химического элемента было признано» . Чистая и прикладная химия . 63 (6): 879–886. дои : 10.1351/pac199163060879 . S2CID 95737691 . Проверено 18 октября 2022 г.
- ^ «Названия и символы трансфермиевых элементов (Рекомендации ИЮПАК 1997 г.)» . Чистая и прикладная химия . 69 (12): 2471–2474. 1997. doi : 10.1351/pac199769122471 .
- ^ Хофманн, Сигурд (2019). «Критерии открытия новых элементов» . Химия Интернэшнл . 41 (1): 10–15. дои : 10.1515/ci-2019-0103 .
- ^ Шерри, Э. (2012). «Таблица Менделеева наконец завершена и что делать с третьей группой?» . Химия Интернэшнл . 34 (4). дои : 10.1515/ci.2012.34.4.28 . Архивировано из оригинала 5 июля 2017 года.
- ^ Скерри, стр. 356–363
- ^ Jump up to: Перейти обратно: а б Чепмен, Кит (30 ноября 2016 г.). «Что нужно, чтобы сделать новый элемент» . Химический мир . Королевское химическое общество . Архивировано из оригинала 28 октября 2017 года . Проверено 22 марта 2022 г.
- ^ Бриггс, Хелен (29 января 2019 г.). «150 лет периодической таблице: проверь свои знания» . Архивировано из оригинала 9 февраля 2019 года . Проверено 8 февраля 2019 г.
- ^ Хофманн, Сигурд; Дмитриев Сергей Н.; Фаландер, Клаас; Гейтс, Джеклин М.; Роберто, Джеймс Б.; Сакаи, Хидеюки (4 августа 2020 г.). «Об открытии новых элементов (Отчет IUPAC/IUPAP)» . Чистая и прикладная химия . 92 (9): 1387–1446. дои : 10.1515/pac-2020-2926 . S2CID 225377737 .
- ^ Jump up to: Перейти обратно: а б Фрике, Буркхард (1975). «Сверхтяжелые элементы: предсказание их химических и физических свойств» . Недавнее влияние физики на неорганическую химию . Структура и связь. 21 : 89–144 . дои : 10.1007/BFb0116498 . ISBN 978-3-540-07109-9 . Проверено 4 октября 2013 г.
- ^ Jump up to: Перейти обратно: а б с Фрике, Буркхард (1977). «Расчеты Дирака – Фока – Слейтера для элементов от Z = 100, фермий, до Z = 173» (PDF) . Недавнее влияние физики на неорганическую химию . 19 : 83–192. Бибкод : 1977ADNDT..19...83F . дои : 10.1016/0092-640X(77)90010-9 . Проверено 25 февраля 2016 г. .
- ^ Jump up to: Перейти обратно: а б Болл, П. (2019). «Экстремальная химия: эксперименты на краю таблицы Менделеева» . Природа . 565 (7741): 552–555. Бибкод : 2019Natur.565..552B . дои : 10.1038/d41586-019-00285-9 . ISSN 1476-4687 . ПМИД 30700884 .
- ^ Дмитриев Сергей; Иткис, Михаил; Оганесян, Юрий (2016). Состояние и перспективы Дубненского завода сверхтяжелых элементов (PDF) . Нобелевский симпозиум NS160 – Химия и физика тяжелых и сверхтяжелых элементов. doi : 10.1051/epjconf/201613108001 . Архивировано (PDF) из оригинала 28 августа 2021 года . Проверено 15 августа 2021 г.
- ^ Соколова Светлана; Попеко, Андрей (24 мая 2021 г.). «Как рождаются новые химические элементы?» . jinr.ru. ОИЯИ. Архивировано из оригинала 4 ноября 2021 года . Проверено 4 ноября 2021 г.
- ^ Чепмен, Кит (10 октября 2023 г.). «Лаборатория Беркли возглавит охоту США за элементом 120 после разрыва сотрудничества с Россией» . Химический мир . Проверено 20 октября 2023 г.
- ^ Бирон, Лорен (16 октября 2023 г.). «Лаборатория Беркли протестирует новый подход к созданию сверхтяжелых элементов» . lbl.gov . Национальная лаборатория Лоуренса Беркли . Проверено 20 октября 2023 г.
- ^ Ган, З.Г.; Хуанг, Западная Европа; Чжан, ЗЯ; Чжоу, XH; Сюй, HS (2022). «Итоги и перспективы исследования тяжелых и сверхтяжелых ядер и элементов в IMP/CAS». Европейский физический журнал А. 58 (158). Бибкод : 2022EPJA...58..158G . дои : 10.1140/epja/s10050-022-00811-w .
- ^ Jump up to: Перейти обратно: а б Шерри, Эрик (2020). «Недавние попытки изменить таблицу Менделеева» . Философские труды Королевского общества А. 378 (2180). Бибкод : 2020RSPTA.37890300S . дои : 10.1098/rsta.2019.0300 . ПМИД 32811365 . S2CID 221136189 .
- ^ Фрейзер, К. (1978). «Сверхтяжелые элементы». Новости науки . 113 (15): 236–38. дои : 10.2307/3963006 . JSTOR 3963006 .
- ^ Jump up to: Перейти обратно: а б с Фрике, Б.; Грейнер, В.; Вабер, Дж.Т. (1971). «Продолжение таблицы Менделеева до Z = 172. Химия сверхтяжелых элементов». Теоретика Химика Акта . 21 (3): 235–60. дои : 10.1007/BF01172015 . S2CID 117157377 .
- ^ Jump up to: Перейти обратно: а б Пюиккё, П. (2011). «Предлагаемая таблица Менделеева до Z ≤ 172, основанная на расчетах Дирака – Фока по атомам и ионам». Физическая химия Химическая физика . 13 (1): 161–68. Бибкод : 2011PCCP...13..161P . дои : 10.1039/c0cp01575j . ПМИД 20967377 . S2CID 31590563 .
- ^ Джерабек, Пол; Шуетрампф, Бастиан; Швердтфегер, Питер; Назаревич, Витольд (2018). «Функции локализации электронов и нуклонов Оганессона: приближение к пределу Томаса-Ферми». Физ. Преподобный Летт . 120 (5): 053001. arXiv : 1707.08710 . Бибкод : 2018PhRvL.120e3001J . doi : 10.1103/PhysRevLett.120.053001 . ПМИД 29481184 . S2CID 3575243 .
- ^ Уотерс, Питер (2019). Сурьма, золото и волк Юпитера . Издательство Оксфордского университета. п. VII. ISBN 978-0-19-965272-3 .
- ^ Jump up to: Перейти обратно: а б с Смитс, Орегон; Инделикато, П.; Назаревич, В.; Пийбелехт, М.; Швердтфегер, П. (2023). «Расширяя границы таблицы Менделеева - обзор атомной релятивистской теории электронной структуры и расчетов сверхтяжелых элементов». Отчеты по физике . 1035 : 1–57. arXiv : 2301.02553 . Бибкод : 2023PhR..1035....1S . дои : 10.1016/j.physrep.2023.09.004 .
- ^ Першина, Валерия (2020). «Релятивистские эффекты на электронную структуру самых тяжелых элементов. Бесконечная ли Таблица Менделеева?» (PDF) . Comptes Rendus Chimie . 23 (3): 255–265. дои : 10.5802/crchim.25 . S2CID 222225772 . Архивировано (PDF) из оригинала 11 декабря 2020 г. Проверено 28 марта 2021 г.
- ^ «Подтверждено наличие сверхтяжелого элемента 114: ступенька на пути к острову стабильности» . Лаборатория Беркли . 2009. Архивировано из оригинала 20 июля 2019 года . Проверено 23 октября 2019 г.
- ^ Оганесян, Ю. Ц. (2012). «Ядра на «острове стабильности» сверхтяжелых элементов» . Физический журнал: серия конференций . 337 (1): 012005. Бибкод : 2012JPhCS.337a2005O . дои : 10.1088/1742-6596/337/1/012005 .
- ^ Jump up to: Перейти обратно: а б Швердтфегер, Питер; Паштека, Лукаш Ф.; Паннетт, Эндрю; Боуман, Патрик О. (2015). «Релятивистские и квантовые электродинамические эффекты в сверхтяжелых элементах». Ядерная физика А . 944 (декабрь 2015 г.): 551–577. Бибкод : 2015НуФА.944..551С . doi : 10.1016/j.nuclphysa.2015.02.005 .
- ^ Jump up to: Перейти обратно: а б Грейнер, В. (2013). «Ядра: сверхтяжелые, сверхнейтронные, странные и антиматерии» (PDF) . Физический журнал: серия конференций . 413 (1): 012002-1–012002-9. Бибкод : 2013JPhCS.413a2002G . дои : 10.1088/1742-6596/413/1/012002 . Архивировано (PDF) из оригинала 30 марта 2019 г. Проверено 15 августа 2021 г.
- ^ Хофманн, Сигурд (2019). «Синтез и свойства изотопов трансактинидов». Радиохимика Акта . 107 (9–11): 879–915. дои : 10.1515/ract-2019-3104 . S2CID 203848120 .
- ^ Скерри, с. 386
- ^ Петер Мёллер (2016). «Границы ядерной карты, установленные делением и альфа-распадом | Сеть конференций EPJ» . Сеть конференций Европейского физического журнала . 131 . Epj-conferences.org: 03002. Бибкод : 2016EPJWC.13103002M . дои : 10.1051/epjconf/201613103002 . Архивировано из оригинала 20 июня 2022 года . Проверено 13 июня 2022 г.
- ^ Холдом, Б.; Рен, Дж.; Чжан, К. (2018). «Кварковая материя не может быть странной». Письма о физических отзывах . 120 (1): 222001-1–222001-6. arXiv : 1707.06610 . Бибкод : 2018PhRvL.120v2001H . doi : 10.1103/PhysRevLett.120.222001 . ПМИД 29906186 . S2CID 49216916 .
- ^ Ченг-Цзюнь, Ся; Ше-Шэн, Сюэ; Жэнь-Синь, Сюй; Шань-Гуй, Чжоу (2020). «Сверхкритически заряженные объекты и создание электрон-позитронных пар». Физический обзор D . 101 (10): 103031. arXiv : 2001.03531 . Бибкод : 2020PhRvD.101j3031X . дои : 10.1103/PhysRevD.101.103031 . S2CID 210157134 .
- ^ Джулиани, SA; Мэтисон, З.; Назаревич, В.; Олсен, Э.; Рейнхард, П.-Г.; Садухан Дж.; Штруемпф, Б.; Шунк, Н.; Швердтфегер, П. (2019). «Коллоквиум: Сверхтяжелые элементы: Оганессон и за его пределами» . Обзоры современной физики . 91 (1): 011001-1–011001-25. Бибкод : 2019РвМП...91а1001Г . дои : 10.1103/RevModPhys.91.011001 . S2CID 126906074 .
- ^ Джардина, Г.; Фасио, Г.; Мандаглио, Г.; Манганаро, М.; Насиров А.К.; Романюк, М.В.; Сака, К. (2010). «Ожидания и пределы синтеза ядер с Z ≥ 120» . Международный журнал современной физики Э. 19 (5 и 6): 882–893. Бибкод : 2010IJMPE..19..882G . дои : 10.1142/S0218301310015333 . Архивировано из оригинала 19 октября 2021 года . Проверено 15 августа 2021 г.
- ^ Загребаев Валерий; Карпов, Александр; Грейнер, Уолтер (2013). «Будущее исследований сверхтяжелых элементов: какие ядра можно будет синтезировать в ближайшие несколько лет?» (PDF) . Журнал физики . 420 (1). IOP Publishing Ltd.: 012001. arXiv : 1207.5700 . Бибкод : 2013JPhCS.420a2001Z . дои : 10.1088/1742-6596/420/1/012001 . S2CID 55434734 . Архивировано (PDF) из оригинала 3 октября 2015 г. Проверено 1 декабря 2020 г.
- ^ Субраманиан, С. (2019). «Создание новых элементов нерентабельно. Просто спросите этого ученого из Беркли» . Блумберг Бизнесуик . Архивировано из оригинала 11 декабря 2019 года . Проверено 18 января 2020 г.
- ^ Скерри, с. 20
- ^ Эдвард Г. Мазурс Коллекция изображений периодических систем (В поисках помощи). Институт истории науки . Архивировано из оригинала 27 марта 2019 года . Проверено 2 октября 2018 г. Нажмите «В поисках помощи», чтобы перейти к полному поиску помощи.
- ^ Франкл, М. (май 2009 г.). «Правила за столом» (PDF) . Природная химия . 1 (2): 97–98. Бибкод : 2009НатЧ...1...97Ф . дои : 10.1038/nchem.183 . ПМИД 21378810 . Архивировано (PDF) из оригинала 25 октября 2012 года.
- ^ Jump up to: Перейти обратно: а б с Шерри, стр. 402–3
- ^ Шерри, Эрик (29 января 2019 г.). «Поздравляем с полуторасотлетием периодической таблицы элементов» . Издательство Оксфордского университета. Архивировано из оригинала 27 марта 2019 года . Проверено 12 апреля 2019 г.
- ^ Скерри, с. 255
- ^ Шерри, ER (2021). «Влияние физики двадцатого века на таблицу Менделеева и некоторые оставшиеся вопросы в двадцать первом веке». В Джунте, CJ; Майнц, ВВ; Джиролами, Г.С. (ред.). 150 лет Таблице Менделеева: перспективы истории химии . Книжные издательства. стр. 409–423 (414). дои : 10.1007/978-3-030-67910-1_16 .
- ^ Шерри, ER (2009). «Двойной смысл термина «элемент» заключается в попытке вывести правило Маделунга и оптимальную форму таблицы Менделеева, если таковая имеется». Int J Quantum Chem . 109 : 959–971. дои : 10.1002/qua.21914 . ; Бент, Ха; Вайнхольд, Ф (2007). «Новости из таблицы Менделеева: введение в символы периодичности, таблицы и модели валентности высшего порядка и донорно-акцепторного родства». J Chem Educ . 84 : 1145–1146. дои : 10.1021/ed084p1145 . ; Аллен, LC; Найт, ET (2002). «Задача Лёвдина: происхождение правила (Маделунга) для заполнения орбитальных конфигураций таблицы Менделеева». Дж. Квантум Хим . 90 : 80–82. дои : 10.1002/qua.965 . ; Вонг, ДП (1979). «Теоретическое обоснование правления Маделунга». J Chem Educ . 56 ::714–717. дои : 10.1021/ed056p714 . ; Демков Ю.Н.; Островский, В (1972). «Правило заполнения n + ' в периодической системе и фокусирующие потенциалы» (PDF) . Советский физический ЖЭТФ . 35 :66–69 . Проверено 8 февраля 2024 г.
- ^ Островский В.Н. (2005). «О недавней дискуссии по поводу квантового обоснования периодической таблицы элементов». Основы химии . 7 (3): 235–239. дои : 10.1007/s10698-005-2141-y . S2CID 93589189 .
- ^ Шерри, Эрик (2012). «Что такое элемент? Что такое периодическая таблица? И какой вклад в этот вопрос вносит квантовая механика?» (PDF) . Основы химии . 14 : 69–81. дои : 10.1007/s10698-011-9124-y . S2CID 254503469 .
- ^ Шерри, Эрик (2021). «Различные формы периодической таблицы, включая таблицу левого шага, регуляризацию триад атомных номеров и аномалий первых членов». Химтексты . 8 (6). дои : 10.1007/s40828-021-00157-8 . S2CID 245540088 .
Библиография
- Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- Петруччи, Ральф Х.; Харвуд, Уильям С.; Херринг, Ф. Джеффри (2002). Общая химия: принципы и современные приложения (8-е изд.). Река Аппер-Седл, Нью-Джерси: Прентис-Холл. ISBN 978-0-13-014329-7 . LCCN 2001032331 . OCLC 46872308 .
- Секерский, С.; Берджесс, Дж. (2002). Краткая химия элементов . Хорвуд. ISBN 978-1-898563-71-6 .
- Шерри, Эрик Р. (2020). Таблица Менделеева, ее история и значение (2-е изд.). Издательство Оксфордского университета, Нью-Йорк, ISBN 978-0-19-091436-3 .
- Вульфсберг, Гэри (2000). Неорганическая химия . Университетские научные книги. ISBN 9781891389016 .
Дальнейшее чтение
- Кальво, Мигель (2019). Построение таблицы Менделеева . Сарагоса, Испания: Прамес. п. 407. ИСБН 978-84-8321-908-9 .
- Эмсли, Дж. (2011). «Таблица Менделеева». Строительные блоки природы: Путеводитель по элементам от А до Я (новое издание). Оксфорд: Издательство Оксфордского университета. стр. 634–651. ISBN 978-0-19-960563-7 .
- Фонтани, Марко; Коста, Мариаграция; Орна, Мэри Вирджиния (2007). Утраченные элементы: теневая сторона периодической таблицы . Оксфорд: Издательство Оксфордского университета. п. 508. ИСБН 978-0-19-938334-4 .
- Мазурс, Э.Г. (1974). Графические изображения периодической системы за сто лет . Алабама: Издательство Университета Алабамы. ISBN 978-0-19-960563-7 .
- Рувре, DH; Кинг, РБ, ред. (2004). Таблица Менделеева: в XXI век . Материалы 2-й Международной конференции по периодической таблице, часть 1, Ранчо Кананаскис, Альберта, 14–20 июля 2003 г. Бэлдок, Хартфордшир: Research Studies Press. ISBN 978-0-86380-292-8 .
- Рувре, DH; Кинг, РБ, ред. (2006). Математика таблицы Менделеева . Материалы 2-й Международной конференции по периодической таблице, часть 2, Ранчо Кананаскис, Альберта, 14–20 июля 2003 г. Нью-Йорк: Nova Science. ISBN 978-1-59454-259-6 .
- Шерри, Э (nd). «Книги по элементам и таблице Менделеева» (PDF) . Архивировано (PDF) из оригинала 11 августа 2020 г. Проверено 9 июля 2018 г.
- Шерри, Э.; Рестрепо, Дж., ред. (2018). Менделеев — Оганессону: междисциплинарный взгляд на периодическую таблицу Менделеева . Материалы 3-й Международной конференции по периодической таблице, Куско, Перу, 14–16 августа 2012 г. Оксфорд: Oxford University Press. ISBN 978-0-86380-292-8 .
- ван Спронсен, JW (1969). Периодическая система химических элементов: история первых ста лет . Амстердам: Эльзевир. ISBN 978-0-444-40776-4 .
- Грин, М., изд. (1971). элементарном строении материи . симметрия в Материалы Менделеевской конференции: Периодичность и 1-я Международная конференция по периодической таблице, Турин-Рим, 15–21 сентября 1969 г. Турин: Академия наук Турина.
Внешние ссылки
- Тематическая страница «Таблицы Менделеева» в Института истории науки цифровых коллекциях содержит избранные визуальные представления периодической таблицы элементов с упором на альтернативные макеты, включая круглую, цилиндрическую, пирамидальную, спиральную и треугольную формы.
- Периодическая таблица элементов ИЮПАК
- Динамическая таблица Менделеева с интерактивными макетами
- Эрик Шерри , ведущий философ науки, специализирующийся на истории и философии таблицы Менделеева.
- Интернет-база данных периодических таблиц
- Периодическая таблица элементов, находящихся под угрозой исчезновения
- Периодическая таблица образцов
- Периодическая таблица видео. Архивировано 3 июля 2023 г. на Wayback Machine.
- ВебЭлементы
- Периодическая графика элементов














