Множественная миелома
| Множественная миелома | |
|---|---|
| Другие имена | Плазмоклеточная миелома, миеломатоз, болезнь Калера, миелома [ 1 ] |
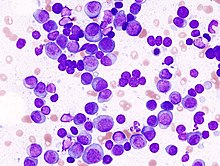 | |
| Образец костного мозга пациента с множественной миеломой | |
| Специальность | Гематология и онкология |
| Симптомы | Боль в костях , усталость. [ 2 ] : 653 |
| Осложнения | Амилоидоз , проблемы с почками , переломы костей , синдром повышенной вязкости , инфекции, анемия [ 3 ] [ 2 ] : 653 |
| Обычное начало | Около 60 |
| Продолжительность | Долгосрочная перспектива [ 3 ] |
| Причины | Неизвестный [ 4 ] |
| Факторы риска | Ожирение [ 5 ] |
| Метод диагностики | Анализы крови или мочи, биопсия костного мозга , медицинская визуализация. [ 6 ] |
| Уход | Стероиды , химиотерапия , талидомид , трансплантация стволовых клеток , бисфосфонаты , лучевая терапия [ 3 ] [ 6 ] |
| Прогноз | Пятилетняя выживаемость 54% / ожидаемая продолжительность жизни 6 лет (США) [ 7 ] |
| Частота | 488 200 (пострадало в 2015 г.) [ 8 ] |
| Летальные исходы | 101,100 (2015) [ 9 ] |
Множественная миелома ( ММ ), также известная как плазмоклеточная миелома и просто миелома , представляет собой рак плазматических клеток , типа лейкоцитов , которые в норме продуцируют антитела . [ 6 ] Зачастую изначально никаких симптомов не наблюдается. [ 10 ] По мере прогрессирования могут возникнуть боли в костях , анемия , почечная недостаточность и инфекции. [ 10 ] Осложнения могут включать гиперкальциемию и амилоидоз . [ 3 ]
Причина множественной миеломы неизвестна. [ 4 ] Факторы риска включают ожирение , радиационное воздействие, семейный анамнез, возраст и некоторые химические вещества. [ 5 ] [ 11 ] [ 12 ] Существует повышенный риск развития множественной миеломы у представителей определенных профессий. [ 13 ] Это связано с профессиональным воздействием ароматических углеводородных растворителей, которые играют роль в возникновении множественной миеломы. [ 14 ] Множественная миелома является результатом многоступенчатой злокачественной трансформации и практически всегда возникает из предзлокачественной стадии моноклональной гаммапатии неустановленного значения (МГУС). По мере того как MGUS развивается в ММ, достигается еще одна предварительная стадия заболевания, известная как тлеющая миелома (ТММ) . [ 15 ]
При ММ аномальные плазматические клетки производят аномальные антитела , которые могут вызвать проблемы с почками и слишком густую кровь . [ 10 ] Плазматические клетки также могут образовывать массы в костном мозге или мягких тканях. [ 10 ] Когда присутствует одна опухоль, ее называют плазмоцитомой ; более одного называется множественной миеломой. [ 10 ] Множественная миелома диагностируется на основании анализов крови или мочи, обнаруживающих аномальные белки антител (часто с использованием электрофоретических методов, выявляющих наличие моноклонального всплеска в результатах, называемого м-спайком), биопсии костного мозга, выявляющей раковые плазматические клетки, и медицинских изображений, выявляющих кость. поражения. [ 6 ] Еще одним частым признаком является высокий уровень кальция в крови . [ 6 ]
Множественная миелома считается излечимой, но, как правило, неизлечимой. [ 3 ] Ремиссии можно добиться с помощью стероидов , химиотерапии , таргетной терапии и трансплантации стволовых клеток . [ 3 ] Бисфосфонаты и лучевая терапия иногда используются для уменьшения боли при поражениях костей. [ 3 ] [ 6 ] Недавно новые подходы, использующие терапию CAR-T-клетками . в схемы лечения были включены [ 16 ]
В 2020 году во всем мире это заболевание было диагностировано примерно у 175 000 человек, а в том же году от этой болезни умерло около 117 000 человек. По прогнозам, в США в 2023 году это заболевание будет диагностировано около 35 000 человек, а в этом году от этой болезни умрут около 12 000 человек. [ 17 ] По оценкам, в 2020 году в США с миеломой жили 170 405 человек. [ 18 ]
Трудно судить о статистике смертности, поскольку методы лечения этого заболевания быстро развиваются. Согласно данным о людях, у которых было диагностировано это заболевание в период с 2013 по 2019 год, около 60% прожили пять лет и более после постановки диагноза, а около 34% прожили десять лет и более. [ 18 ] Люди, у которых впервые диагностировано это заболевание, теперь имеют лучший прогноз благодаря улучшению лечения. [ 19 ]
Заболевание обычно возникает в возрасте около 60 лет и чаще встречается у мужчин, чем у женщин. [ 6 ] До 40 лет это редкость. [ 6 ] Слово миелома происходит от греческого myelo- «костный мозг» и -oma «опухоль». [ 20 ]
Признаки и симптомы
[ редактировать ]Поскольку миелома может поражать многие органы, симптомы и признаки сильно различаются. Утомляемость и боль в костях являются наиболее распространенными симптомами при поступлении. Критерии CRAB ранее использовались для установления наличия активной множественной миеломы (в отличие от более ранней, обычно бессимптомной, «тлеющей» формы заболевания). Критерии CRAB: [ 21 ] [ 2 ] [ 22 ]
- Кальций : кальций в сыворотке >0,25 ммоль/л ( >1 мг/дл) выше верхней границы нормы или >2,75 ммоль/л (>11 мг/дл)
- Почечная недостаточность : клиренс креатинина <40 мл в минуту или креатинин сыворотки >1,77 моль/л (>2 мг/дл)
- Неемия : уровень гемоглобина > 2 г/дл ниже нижней границы нормы или уровень гемоглобина <10 г/дл.
- B одно поражение : остеолитические поражения на рентгенографии скелета, КТ или ПЭТ/КТ.
По состоянию на 2014 год [update] IMWG (Международная рабочая группа по миеломе) расширила и обновила диагностические критерии, включив в них три события, определяющих миелому, любое из которых указывает на наличие активной множественной миеломы. Каждое из этих трех событий может произойти до появления любого из критериев CRAB, что дает большему количеству людей право на лечение препаратами для лечения миеломы раньше. [ 22 ]
Боль в костях
[ редактировать ]
Боль в костях встречается почти у 70% людей с множественной миеломой и является одним из наиболее распространенных симптомов. [ 2 ] : 653 [ 23 ] Боль в костях при миеломе обычно поражает позвоночник и ребра и усиливается при физической активности. Постоянная локализованная боль может указывать на патологический перелом кости . Вовлечение позвонков может привести к сдавлению спинного мозга или кифозу . Миеломная болезнь костей возникает из-за сверхэкспрессии рецептора-активатора лиганда ядерного фактора κ B ( RANKL ) стромой костного мозга . RANKL активирует остеокласты , которые резорбируют кость. Возникающие в результате поражения костей носят литический характер (вызывают разрушение) и лучше всего видны на обычных рентгенограммах, которые могут показывать «перфорированные» резорбтивные поражения (включая вид черепа в виде «дождевой капли» на рентгенограмме). Разрушение костей также приводит к выбросу ионов кальция в кровь, что приводит к гиперкальциемии и связанным с ней симптомам. [ 24 ]
Анемия
[ редактировать ]Анемия, обнаруживаемая при миеломе, обычно нормоцитарная и нормохромная . Это происходит в результате замены нормального костного мозга инфильтрацией опухолевых клеток и ингибирования нормального производства эритроцитов ( кроветворения ) цитокинами . [ 25 ]
Нарушение функции почек
[ редактировать ]Нарушение функции почек может развиваться остро или хронически , любой степени тяжести. [ 26 ] [ 27 ] Наиболее распространенной причиной почечной недостаточности при множественной миеломе являются белки, секретируемые злокачественными клетками. Клетки миеломы продуцируют моноклональные белки различных типов, чаще всего иммуноглобулины (антитела) и свободные легкие цепи , что приводит к аномально высоким уровням этих белков в крови. В зависимости от размера этих белков они могут выводиться через почки. Почки могут быть повреждены воздействием белков или легких цепей. Повышенная резорбция кости приводит к гиперкальциемии и нефрокальцинозу , тем самым способствуя почечной недостаточности. Амилоидоз занимает третье место в причинно-следственной связи. Люди с амилоидозом имеют высокий уровень амилоидного белка , который может выводиться через почки и вызывать повреждение почек и других органов. [ 28 ] [ 29 ]
Легкие цепи производят множество эффектов, которые могут проявляться как синдром Фанкони ( почечный канальцевый ацидоз II типа ). [ 28 ]
Инфекция
[ редактировать ]Побочные инфекции часто встречаются при множественной миеломе, поскольку заболевание нарушает функционирование компонентов крови, которые в норме сопротивляются патогенам. Наиболее распространенными инфекциями являются пневмонии, инфекции мочевыводящих путей и сепсис. [ 30 ] Период наибольшего риска возникновения инфекции приходится на первые несколько месяцев после начала новой лекарственной терапии, поскольку многие медикаментозные методы лечения дополнительно подавляют нормальный иммунный ответ. [ 31 ]
Инфекции (и «нежелательные явления» для всех заболеваний) оцениваются по стандартизированной шкале. [ 32 ] При применении некоторых медикаментозных методов лечения миеломы более 30% людей заболевают инфекцией 3-й степени или выше (многие люди страдают множественными такими инфекциями). [ 33 ] призывая к вмешательству, по крайней мере, с помощью антибиотиков. [ 32 ] Среди людей, которые умирают в течение 6 месяцев после постановки диагноза миеломы, от 20% до 50% умирают от побочных инфекций. [ 30 ]
Клиническая оценка иммунного ответа человека обычно проводится с помощью лабораторного теста, который измеряет уровни различных иммуноглобулинов в крови. Существует пять разновидностей иммуноглобулинов, обозначаемых достаточным количеством -A, -D, -E, -G и -M. [ 34 ] В совокупности уровень иммуноглобулинов может повышаться при заболевании, но большинство таких повышенных антител имеют моноклональную разновидность из-за клональных плазматических клеток и, следовательно, неэффективны. Такие неэффективные антитела обычно относятся к разновидностям иммуноглобулинов -A и -G. [ 34 ] Когда количество эффективных антител падает ниже порогового значения (состояние, называемое гипогаммаглобулинемией ), [ 35 ] дополнительные иммуноглобулины могут вводиться посредством периодических инфузий, чтобы снизить риск побочных инфекций. [ 33 ]
Неврологические симптомы
[ редактировать ]Некоторые симптомы (например, слабость , спутанность сознания и утомляемость ) могут быть следствием анемии или гиперкальциемии. Головная боль , изменения зрения и ретинопатия могут быть следствием повышенной вязкости крови в зависимости от свойств парапротеина . Наконец, могут возникнуть корешковые боли , потеря контроля над кишечником или мочевым пузырем (из-за поражения спинного мозга приводящего к его сдавлению ) или синдром запястного канала , а также другие нейропатии (из-за инфильтрации периферических нервов амилоидом , ). это может привести к параплегии . В поздних случаях [ 36 ]
Когда заболевание хорошо контролируется, неврологические симптомы могут возникнуть в результате текущего лечения, некоторые из которых могут вызывать периферическую невропатию, проявляющуюся в виде онемения или боли в руках, ногах и голенях. [ нужна ссылка ]
Рот
[ редактировать ]Первоначальные симптомы могут включать боль, онемение, отек, расширение челюсти, подвижность зубов и рентгенопрозрачность . [ 37 ] Множественная миелома во рту может имитировать распространенные проблемы с зубами, такие как периапикальный абсцесс или пародонтальный абсцесс , гингивит , пародонтит или другое увеличение или образование десен. [ 38 ]
Причина
[ редактировать ]Причина множественной миеломы обычно неизвестна. [ 4 ]
Факторы риска
[ редактировать ]- Моноклональная гаммапатия неустановленного значения (МГУС) повышает риск развития множественной миеломы. MGUS трансформируется в множественную миелому со скоростью от 1% до 2% в год , и почти всем случаям множественной миеломы предшествует MGUS. [ 39 ]
- Тлеющая множественная миелома увеличивает риск развития множественной миеломы. У лиц с диагнозом этого предракового заболевания развивается множественная миелома со скоростью 10% в год в течение первых 5 лет, 3% в год в течение следующих 5 лет, а затем 1% в год. [ 40 ] [ 41 ]
- Ожирение связано с множественной миеломой, причем каждое увеличение индекса массы тела на пять увеличивает относительный риск на 11%. Кроме того, исследования показали положительную корреляцию между ИМТ и адгезией клеток множественной миеломы. [ 42 ]
Исследования сообщили о семейной предрасположенности к миеломе. [ 43 ] [ 44 ] Гиперфосфорилирование ряда белков — белков-паратаргов — тенденция, наследуемая по аутосомно-доминантному типу, кажется распространенным механизмом в этих семьях. Эта тенденция чаще встречается у афроамериканцев с миеломой и может способствовать более высокому уровню заболеваемости миеломой в этой группе. [ 43 ]
Занятия
[ редактировать ]В исследовании по изучению связи между профессиональным воздействием ароматических углеводородных растворителей ( бензола и его многочисленных производных) данные показали, что эти растворители играют роль в возникновении множественной миеломы. [ 14 ] Множественная миелома может возникать чаще у представителей определенных профессий. Риск возникновения множественной миеломы выше у профессий пожарных, парикмахеров, а также у работников сельского хозяйства и промышленности. [ 45 ] Риск в некоторых профессиях связан с воздействием различных химических веществ. Повторное воздействие химических веществ увеличивает риск развития множественной миеломы. Было замечено, что использование пестицидов и опасных химикатов в таких профессиях, как пожаротушение и сельское хозяйство, приводит к увеличению риска развития множественной миеломы. [ 13 ] Другие профессии, например, промышленные, также подвергаются повышенному риску развития множественной миеломы. Промышленные рабочие подвергаются воздействию химикатов, содержащих ароматические углеводородные растворители. [ 14 ] [ 13 ]
Воздействие ароматических углеводородных растворителей, бензола , толуола и ксилола может увеличить риск развития множественной миеломы. Увеличение продолжительности, высокая интенсивность воздействия или повторное воздействие были связаны с увеличением риска развития множественной миеломы до 63%. [ 14 ] Изучалось время от воздействия до постановки диагноза, а диагноз после воздействия отставал не менее чем на 20 лет. [ 14 ] Когда устанавливалось воздействие одного химического вещества, обычно обнаруживалось воздействие другого углеводородного растворителя. [ 14 ] Множественная миелома поражает больше мужчин, пожилых людей и афроамериканцев. Эти группы населения также имеют более высокую частоту воздействия, чем их коллеги-женщины. [ 14 ]
Вирус Эпштейна-Барра
[ редактировать ]Редко вирус Эпштейна-Барра (ВЭБ) связан с множественной миеломой, особенно у людей с иммунодефицитом , например, вследствие ВИЧ/СПИДа , трансплантации органов или хронического воспалительного заболевания, такого как ревматоидный артрит . [ 46 ] ВЭБ-положительная множественная миелома классифицируется Всемирной организацией здравоохранения (2016) как одна из форм лимфопролиферативных заболеваний, связанных с вирусом Эпштейна-Барра , и называется плазмоклеточной миеломой, ассоциированной с вирусом Эпштейна-Барр . ВЭБ-положительное заболевание чаще встречается при плазмоцитоме , чем при множественной миеломе плазмоклеточного рака. [ 47 ] В тканях, участвующих в заболевании EBV+, обычно наблюдаются очаги EBV+ клеток с появлением быстро пролиферирующих незрелых или плохо дифференцированных плазматических клеток. [ 47 ] Клетки экспрессируют продукты генов EBV, таких как EBER1 и EBER2. [ 48 ] Хотя ВЭБ способствует развитию и/или прогрессированию большинства лимфопролиферативных заболеваний, связанных с вирусом Эпштейна-Барра, его роль при множественной миеломе неизвестна. [ 49 ] Однако у людей с EBV-положительной локализацией плазмоцитомы вероятность развития множественной миеломы выше, чем у людей с EBV-негативной плазмоцитомой(ами). Это позволяет предположить, что ВЭБ может играть роль в прогрессировании плазмоцитомы в системную множественную миелому. [ 48 ]
Патофизиология
[ редактировать ]
В-лимфоциты зарождаются в костном мозге и перемещаются в лимфатические узлы. По мере развития они созревают и отображают на поверхности своих клеток различные белки (антигены клеточной поверхности). Когда они активируются для секреции антител, они называются плазматическими клетками. [ 50 ]
Множественная миелома развивается в В-лимфоцитах после того, как они покинули часть лимфатического узла, известную как зародышевый центр . Тип нормальных клеток, наиболее тесно связанный с клетками ММ, обычно считается либо активированными В-клетками памяти , либо предшественниками плазматических клеток, плазмобластами . [ 51 ]
Иммунная система держит под строгим контролем пролиферацию В-клеток и секрецию антител. Когда хромосомы и гены повреждаются, часто в результате перестройки, этот контроль теряется. Часто ген-промотор перемещается (или транслоцируется) в хромосому, где стимулирует ген антитела к перепроизводству. [ нужна ссылка ]
Хромосомная транслокация между геном тяжелой цепи иммуноглобулина (на хромосоме 14 , локус q32) и онкогеном (часто 11q13, 4p16.3, 6p21, 16q23 и 20q11). [ 52 ] ) часто наблюдается у людей с множественной миеломой. Эта мутация приводит к нарушению регуляции онкогена, что считается важным инициирующим событием в патогенезе миеломы. [ 53 ] Результатом является пролиферация клона плазматических клеток и нестабильность генома, что приводит к дальнейшим мутациям и транслокациям. Аномалия 14-й хромосомы наблюдается примерно в 50% всех случаев миеломы. Делеция (частей) хромосомы 13 также наблюдается примерно в 50% случаев.
Продукция цитокинов [ 54 ] (особенно IL-6 ) плазматическими клетками вызывает большую часть их локальных повреждений, таких как остеопороз , и создает микросреду, в которой процветают злокачественные клетки. Ангиогенез (образование новых кровеносных сосудов) увеличивается. [ нужна ссылка ]
Вырабатываемые антитела откладываются в различных органах, что приводит к почечной недостаточности, полинейропатии и различным другим симптомам, связанным с миеломой.
Эпигенетика
[ редактировать ]Эпигенетические модификации , такие как метилирование ДНК или модификации гистонов , являются ключевыми для возникновения и прогрессирования заболевания. [ 55 ] В исследовании, в котором изучался профиль метилирования ДНК клеток множественной миеломы и нормальных плазматических клеток , наблюдалось постепенное деметилирование стволовых клеток в плазматические клетки с усилением метилирования в определенных местах. [ 56 ] Потеря метилирования связана с активацией генов , а усиление метилирования коррелирует с молчанием генов. Нарушенный характер метилирования при множественной миеломе приводит к активации специфических онкогенов и репрессии специфических генов-супрессоров опухолей . Наблюдаемый паттерн метилирования CpG в интронных областях с метками хроматина, связанными с энхансером, при множественной миеломе аналогичен недифференцированным предшественникам и стволовым клеткам. Эти результаты могут представлять собой эпигенетическое перепрограммирование de novo при множественной миеломе, приводящее к приобретению паттерна метилирования, связанного с стволовостью. [ 57 ]
Другие исследования выявили паттерн молчания генов, специфичный для множественной миеломы, связанный с аномальными модификациями гистонов, вызванными нарушением регуляции репрессивного комплекса 2 полигребенков (PRC2). [ 58 ] [ 59 ] Было описано, что повышенная экспрессия субъединицы PRC2, EZH2, является распространенным признаком множественной миеломы, что приводит к накоплению и перераспределению триметилирования лизина 27 гистона H3, которое прогрессирует с тяжестью заболевания. [ 60 ]
Генетика
[ редактировать ]Генетические аномалии при множественной миеломе делят заболевание на две основные группы: гипердиплоидную множественную миелому и негипердиплоидную множественную миелому. Гипердиплоидная ММ связана с хорошим прогнозом и включает трисомии нечетных хромосом. Негипердиплоидная ММ имеет худший исход и характеризуется транслокациями на 14 хромосоме, которые приводят к экспрессии онкогенов. Этими транслокациями могут быть t(11;14), t(6;14), t(4;14), t(14;16), t(14;20). [ 61 ] . Другими генетическими изменениями являются амплификация 1q, делеция 1p, делеция 17, делеция 13, сверхэкспрессия MYC и точечные мутации в ключевых путях.
Связанные генетические мутации включают ATM , BRAF , CCND1 , DIS3 , FAM46C , KRAS , NRAS и TP53 . [ 62 ]
Разработка
[ редактировать ]Этот раздел может быть слишком техническим для понимания большинства читателей . ( Июль 2024 г. ) |
Генетические и эпигенетические изменения происходят постепенно. Первоначальное изменение, часто вовлекающее транслокацию одной хромосомы 14, создает клон плазматических клеток костного мозга, который вызывает бессимптомное заболевание MGUS , которое представляет собой предраковое заболевание, характеризующееся увеличением количества плазматических клеток в костном мозге или циркуляцией миеломного белка-иммуноглобулина. . Дальнейшие генетические или эпигенные изменения приводят к появлению нового клона плазматических клеток костного мозга, обычно потомка исходного клона, который вызывает более серьезное, но все еще бессимптомное предраковое заболевание, тлеющую множественную миелому. Эта миелома характеризуется увеличением количества плазматических клеток костного мозга или уровня циркулирующего белка миеломы выше, чем при MGUS. [ 63 ]
Последующие генетические и эпигенетические изменения приводят к появлению нового, более агрессивного клона плазматических клеток, что вызывает дальнейшее повышение уровня циркулирующего белка миеломы, дальнейшее увеличение количества плазматических клеток костного мозга или развитие одного или нескольких специфический набор симптомов «КРАБ», которые являются основой для диагностики злокачественной множественной миеломы и лечения заболевания. [ 64 ]
В небольшом проценте случаев множественной миеломы дальнейшие генетические и эпигенетические изменения приводят к развитию клона плазматических клеток, который перемещается из костного мозга в систему кровообращения , проникает в отдаленные ткани и тем самым вызывает наиболее злокачественную из всех дискразий плазматических клеток . плазмоклеточный лейкоз . [ 40 ] [ 65 ] [ 66 ] Таким образом, фундаментальная генетическая нестабильность плазматических клеток или их предшественников приводит к прогрессированию:
Моноклональная гаммапатия неустановленного значения → тлеющая множественная миелома → множественная миелома → плазмоклеточный лейкоз
Бессимптомная моноклональная гаммапатия неопределенного значения и тлеющая множественная миелома обычно диагностируются случайно путем обнаружения белка миеломы в тестах электрофореза белков сыворотки, проводимых для других целей. MGUS — относительно стабильное заболевание, от которого страдают 3% людей в возрасте 50 лет и 5% людей в возрасте 70 лет; прогрессирует до множественной миеломы со скоростью 0,5–1% случаев в год; при тлеющей множественной миеломе этот показатель составляет 10% в год в течение первых 5 лет, но затем резко падает до 3% в год в течение следующих 5 лет, а затем до 1% в год. [ 40 ] [ 41 ]
В целом, около 2–4% случаев множественной миеломы в конечном итоге перерастают в плазмоклеточный лейкоз . [ 65 ]
Диагностика
[ редактировать ]Анализы крови
[ редактировать ]
Уровень глобулина может быть нормальным при уже установленном заболевании. Врач может назначить электрофорез белков крови и мочи, который может показать наличие полосы парапротеина (моноклонального белка или белка М ) со снижением или без снижения других (нормальных) иммуноглобулинов (известный как иммунный парез). Одним из типов парапротеина является белок Бенс-Джонса , который представляет собой парапротеин мочи, состоящий из свободных легких цепей. Количественные измерения парапротеина необходимы для установления диагноза и мониторинга заболевания. Парапротеин представляет собой специфический иммуноглобулин (или фрагмент иммуноглобулина), первоначально продуцируемый мутировавшей плазматической клеткой, начавшей размножаться, а теперь вырабатываемый всей линией злокачественных клеток. [ 67 ]
Теоретически, множественная миелома может продуцировать все классы иммуноглобулинов, но IgG наиболее распространены парапротеины , за которыми следуют IgA и IgM . IgD и IgE миеломы встречаются очень редко. Кроме того, легкие и тяжелые цепи (строительные блоки антител) могут секретироваться изолированно: κ- или λ-легкие цепи или любой из пяти типов тяжелых цепей (α-, γ-, δ-, ε- или μ-тяжелые цепи). У людей без признаков моноклонального белка может быть «несекреторная» миелома (не продуцирующая иммуноглобулины); это составляет около 3% всех людей с множественной миеломой. [ 68 ]
Дополнительные данные могут включать повышенный уровень кальция (когда остеокласты разрушают кость, высвобождая ее в кровоток), повышенный уровень креатинина в сыворотке из-за снижения функции почек , что в основном связано с отложением парапротеина в почках, хотя гипс может также содержат полноценные иммуноглобулины, белок Тамма-Хорсфалла и альбумин . [ 69 ]
Другие полезные лабораторные тесты включают количественное измерение IgA, IgG и IgM для выявления иммунного пареза, а также бета-2-микроглобулина, который дает прогностическую информацию. В мазке периферической крови кольцеобразное образование эритроцитов обычно выявляют , хотя это не является специфичным.
Недавнее внедрение коммерческого иммуноанализа для измерения свободных легких цепей потенциально предлагает улучшение мониторинга прогрессирования заболевания и реакции на лечение, особенно там, где парапротеин трудно точно измерить электрофорезом (например, при миеломе легких цепей или когда уровень парапротеина очень низкий). Первоначальные исследования также показывают, что измерение свободных легких цепей также может использоваться в сочетании с другими маркерами для оценки риска прогрессирования MGUS в множественную миелому. [ 70 ]
Этот анализ, анализ свободных легких цепей в сыворотке, недавно был рекомендован Международной рабочей группой по миеломе для скрининга, диагностики, прогноза и мониторинга дискразий плазматических клеток . [ 71 ]
-
Аспират костного мозга, показывающий гистологический коррелят множественной миеломы под микроскопом, окраска H&E
-
Плазмоцитома, окраска H&E
-
Микрофотография, демонстрирующая нефропатию миеломного цилиндрика в биопсии почки : гиалиновые цилиндры являются PAS-положительными (темно-розовый/красный – справа на изображении). Миеломатозные цилиндры PAS-отрицательны (бледно-розовые – слева на изображении), окраска PAS .
-
Атипичный инфильтрат плазматических клеток с тельцами Рассела (цитоплазматические) и Датчера (ядерные) (H&E, 50x)
Гистопатология
[ редактировать ]Биопсия костного мозга обычно проводится для оценки процента костного мозга, занятого плазматическими клетками. Этот процент используется в диагностических критериях миеломы. Иммуногистохимия (окрашивание определенных типов клеток с использованием антител против поверхностных белков) позволяет обнаружить плазматические клетки, экспрессирующие иммуноглобулин в цитоплазме, а иногда и на поверхности клетки; Клетки миеломы часто являются CD56 , CD38 , CD138 и CD319- положительными и CD19 , CD20 и CD45- отрицательными. [ 21 ] Проточная цитометрия часто используется для установления клональной природы плазматических клеток, которые обычно экспрессируют только легкую цепь каппа или лямбда. Цитогенетика также может быть выполнена при миеломе в прогностических целях, включая специфичную для миеломы флуоресцентную in situ гибридизацию и виртуальный кариотип . [ нужна ссылка ]
Плазматические клетки, наблюдаемые при множественной миеломе, имеют несколько возможных морфологий. Во-первых, они могут выглядеть как нормальные плазматические клетки, крупные клетки, в два или три раза превышающие размер периферических лимфоцитов. Поскольку они активно вырабатывают антитела, аппарат Гольджи обычно образует светлую область, прилегающую к ядру, называемую перинуклеарным ореолом. Единственное ядро (внутри которого имеется одно ядрышко с везикулярным ядерным хроматином) эксцентрично, смещено обильной цитоплазмой. Другие распространенные морфологии, которые не являются обычными для нормальных плазматических клеток, включают:
- Причудливые многоядерные клетки
- Клетки Мотта, содержащие множественные сгруппированные цитоплазматические капли или другие включения (иногда путают с палочками Ауэра , часто встречающимися при миелоидных бластах)
- Пламенные клетки, имеющие огненно-красную цитоплазму. [ 72 ] [ 73 ]
Исторически CD138 использовался для выделения клеток миеломы в диагностических целях. Однако этот антиген быстро исчезает ex vivo . Однако недавно было обнаружено, что поверхностный антиген CD319 (SLAMF7) значительно более стабилен и позволяет надежно изолировать злокачественные плазматические клетки из отсроченных или даже криоконсервированных образцов. [ 74 ]
Прогноз широко варьируется в зависимости от различных факторов риска. Клиника Мэйо разработала модель стратификации риска под названием «Стратификация Мэйо для миеломы и терапия, адаптированная к риску» (mSMART), которая делит людей на категории высокого и стандартного риска. [ 75 ] Люди с делецией хромосомы 13 или гиподиплоидией по данным общепринятой цитогенетики, t(4;14), t(14;16), t(14;20) или 17p - по данным молекулярно-генетических исследований, или с высоким индексом мечения плазматических клеток (3 % и более) считаются больными миеломой высокого риска. [ 76 ]
Медицинская визуализация
[ редактировать ]Диагностическое обследование человека с подозрением на множественную миелому обычно включает исследование скелета . Это серия рентгеновских снимков черепа, осевого скелета и проксимальных частей длинных костей. Активность миеломы иногда проявляется в виде «литических поражений» (с местным исчезновением нормальной кости вследствие резорбции) или в виде «перфорированных поражений» на рентгенограмме черепа («череп в виде капли дождя»). Поражения также могут быть склеротическими , что рассматривается как радиоплотные . [ 77 ] В целом радиоплотность миеломы составляет от -30 до 120 единиц Хаунсфилда (HU). [ 78 ] Магнитно-резонансная томография более чувствительна, чем простая рентгенография, при обнаружении литических поражений и может заменить исследование скелета, особенно при подозрении на заболевание позвоночника. Иногда проводят компьютерную томографию для измерения размера плазмоцитом мягких тканей. Ядерная медицина Сканирование костей обычно не имеет никакой дополнительной ценности при обследовании людей с миеломой (нет образования новой кости; литические поражения плохо визуализируются при ядерном сканировании костей).
-
Рентгенограмма предплечья с литическими поражениями
-
Рентгенограмма черепа, показывающая множественные просветления из-за множественной миеломы.
-
Множественная миелома плеча
-
Патологический перелом поясничного отдела позвоночника вследствие множественной миеломы
-
КТ височных костей , головного мозга выявило литическое поражение левой височной кости (правая часть изображения) и каменистых затрагивающих сосцевидный сегмент канала лицевого нерва . Красные стрелки: поражение; зеленая стрелка: нормальный контрлатеральный канал лицевого нерва. Поражения соответствуют отложению миеломы.
-
КТ нижнего отдела позвоночника у мужчины с множественной миеломой, показывающая множественные остеобластические поражения: они более рентгеноплотные (более яркие на этом изображении), чем окружающая губчатая кость , в отличие от остеолитических поражений, которые менее радиоплотные.
-
Бедренная кость с множественными поражениями миеломы
-
Та же бедренная кость до поражения миеломой для сравнения.
-
Плечевая кость с множественными поражениями миеломы
-
Та же плечевая кость раньше, с незначительными повреждениями
Диагностические критерии
[ редактировать ]В 2003 году ИМГ [ 21 ] согласовали диагностические критерии симптоматической миеломы, бессимптомной миеломы и MGUS, которые впоследствии были обновлены в 2009 году: [ 79 ]
- Симптоматическая миелома (должны быть соблюдены все три критерия):
- Клональные плазматические клетки >10% в биопсии костного мозга или (в любом количестве) в биопсии других тканей ( плазмоцитома )
- Моноклональный белок (белок миеломы) в сыворотке или моче, его концентрация должна быть более 3 г/дл ( за исключением случаев истинной несекреторной миеломы)
- Доказательства поражения органов-мишеней, которые кажутся связанными с заболеванием плазматических клеток (связанное поражение органов или тканей, CRAB):
- Гипер -C- алцемия (скорректированный кальций >2,75 ммоль/л, >11 мг/дл)
- Почечная недостаточность (почечная недостаточность), обусловленная миеломой
- Неемия ( гемоглобин <10 г/дл)
- B одни поражения (литические поражения или остеопороз с компрессионными переломами)
Примечание. Рецидивирующих инфекций у человека, у которого нет ни одного из признаков CRAB, недостаточно для постановки диагноза миеломы. Людей, у которых отсутствуют признаки CRAB, но имеются признаки амилоидоза, следует рассматривать как амилоидоз, а не миелому. CRAB-подобные аномалии часто встречаются при многих заболеваниях, и следует понимать, что эти аномалии напрямую связаны с соответствующим заболеванием плазматических клеток и каждой попыткой исключить другие основные причины анемии, почечной недостаточности и т. д.
В 2014 году IMWG обновила свои критерии, включив в них биомаркеры злокачественных новообразований. [ 71 ] [ 80 ] Этими биомаркерами являются >60% клональных плазматических клеток, соотношение вовлеченных/невовлеченных свободных легких цепей в сыворотке ≥ 100 (концентрация задействованной свободной легкой цепи должна быть ≥ 100 мг/л) и более одного очагового поражения размером ≥ 5 мм по данным МРТ. [ 71 ] [ 80 ] Вместе эти биомаркеры и критерии CRAB известны как события, определяющие миелому (MDE). Для того чтобы поставить диагноз миеломы, у человека должно быть >10 % клональных плазматических клеток и любой MDE. [ 71 ] Критерии биомаркеров были добавлены для того, чтобы у людей с тлеющей множественной миеломой с высоким риском развития множественной миеломы можно было диагностировать до того, как произойдет повреждение органов, и, следовательно, у них был бы лучший прогноз. [ 80 ]
- Бессимптомная/тлеющая миелома:
- Сывороточный белок М >30 г/л (3 г/дл) или
- Клональные плазматические клетки >10% при биопсии костного мозга и
- Отсутствие поражений органов или тканей, связанных с миеломой
- Моноклональная гаммапатия неустановленного значения (МГУС):
- Сывороточный парапротеин <30 г/л (3 г/дл) и
- Клональные плазматические клетки <10% при биопсии костного мозга и
- Отсутствие поражений органов или тканей, связанных с миеломой, или связанных с ними В-клеточных лимфопролиферативных заболеваний.
Сопутствующие состояния включают одиночную плазмоцитому (одиночная опухоль плазматических клеток, обычно лечится облучением ), дискразию плазматических клеток (когда только антитела вызывают симптомы, например, AL-амилоидоз ) и периферическую нейропатию, органомегалию, эндокринопатию, моноклональное заболевание плазматических клеток и изменения кожи .
Постановка
[ редактировать ]При множественной миеломе определение стадии помогает в прогнозировании, но не влияет на принятие решения о лечении. Система стадирования Дьюри-Салмона использовалась исторически и была заменена Международной системой стадирования (ISS), опубликованной Международной рабочей группой по миеломе в 2005 году. [ 81 ] Пересмотренная версия ISS (R-ISS) была опубликована в 2015 году и включает цитогенетику и лактатдегидрогеназу (ЛДГ). [ 82 ] : 1730–1 [ 83 ] [ 84 ] : 732–3
- I стадия: β 2 микроглобулин (β2M) < 3,5 мг/л, альбумин ≥ 3,5 г/дл, цитогенетика нормальная, повышенного уровня ЛДГ нет.
- Стадия II: Не классифицируется как стадия I или стадия III.
- Стадия III: β2M ≥ 5,5 мг/л и либо повышенный уровень ЛДГ, либо цитогенетика высокого риска [t(4,14), t(14,16) и/или del(17p)]
Профилактика
[ редактировать ]Риск множественной миеломы можно немного снизить, поддерживая нормальный вес тела. [ 85 ]
Уход
[ редактировать ]В большинстве медикаментозных методов лечения используются несколько агентов, например, так называемая «тройная» или «квадруплетная» терапия. Многие такие группы включают одно или несколько моноклональных антител (например, изатуксимаб или даратумумаб ), иммуномодулирующего агента (например, леналидомид или помалидомид ) и ингибитора протеасом (например, бортезомиб , карфилзомиб или иксазомиб ) в комбинации со стероидом . (например, дексаметазон ). [ 86 ]
В то время как тройная терапия была стандартом лечения в течение многих лет, в современной практике чаще применяется четверная терапия. [ 86 ] Такие комбинированные методы лечения обычно обозначаются инициалами, используя прописные буквы для торговых марок лекарств и строчные буквы для названий непатентованных лекарств, например, VRd для Велкейда (торговая марка бортезомиба ), Ревлимид (торговая марка леналидомида ) и дексаметазон. Аналогично с DKRd, где буква D представляет Дарзалекс (торговая марка даратумумаба ), а буква K представляет Кипролис (торговая марка карфилзомиба ). [ 87 ] (Новая практика не предполагает называть такие препараты « химиотерапией », поскольку они не являются традиционными неспецифическими внутриклеточными ядами, которые действуют классическим «химическим» способом, ингибируя митоз или вызывая повреждение ДНК. [ 88 ] [ 89 ] )
Обычно эффективность каждого препарата со временем снижается, поскольку рак развивает механизмы устойчивости к лекарствам, например, в результате клональной эволюции или генетических мутаций. Частично по этой причине исторически множественную миелому не лечили в «тлеющей» стадии, поскольку используемый препарат(ы) может иметь сниженную эффективность, если заболевание переходит в симптоматическую стадию. Таким образом, стандартом лечения было «бдительное ожидание», пока болезнь тлела. [ 90 ] Однако все чаще предпринимаются усилия по изучению того, может ли медикаментозная терапия, применяемая на стадии тления, предотвратить переход заболевания в активную стадию. Образцовыми являются GEM-CESAR, [ 91 ] ПОДЪЕМ [ 92 ] и Иммуно-ПРИЗМА [ 93 ] клинические испытания.
После того, как лекарственная терапия снизила бремя рака у пациента, некоторым пациентам проводится трансплантация костного мозга (более правильно называемая аутологичной трансплантацией гемопоэтических стволовых клеток , или ASCT) для дальнейшего подавления заболевания. Однако эта процедура недоступна для ослабленных пациентов. [ 94 ] поскольку это по существу перезагружает аспекты иммунной системы и требует восстановления естественной защиты, например, путем введения детских вакцин. [ 95 ]
Все чаще изучаются методы точной медицины , причем исследования показывают, что определенные варианты и генетические подтипы заболевания более благоприятно реагируют на одни лекарственные методы лечения, чем на другие. [ 96 ] Например, некоторые исследования показывают, что пациенты с генетической транслокацией t(11,14) (присутствующей примерно у 15-20% пациентов с множественной миеломой) могут получить особую пользу от терапии Венетоклаксом (которая одобрена FDA для лечения других видов рака крови, но еще не доступна). для пациентов с множественной миеломой, за исключением клинических исследований). [ 96 ] [ 97 ]
В то время как медикаментозная терапия обычно требует месяцев или лет лечения, терапия CAR-T предлагает альтернативу однократному лечению (хотя и предполагающему длительное пребывание в больнице). Более того, лечение CAR-T, по-видимому, обеспечивает более глубокую и длительную ремиссию заболевания, чем существующие лекарства. [ 98 ] Однако в настоящее время такая терапия одобрена FDA только для пациентов на поздних стадиях заболевания и доступна только в некоторых медицинских центрах. [ 99 ]
Предстоящей терапией, которая также усиливает иммунный ответ Т-клеток, является класс препаратов, называемых биспецифическими ингибиторами Т-клеток (BITE), или иногда просто биспецифическими антителами . Первым препаратом этого класса, одобренным для лечения множественной миеломы, является Теклистамаб , но опять же, его использование в настоящее время предназначено для пациентов на более поздних стадиях заболевания. [ 100 ] Еще один препарат BITE, Талкетамаб , находится в стадии изучения; другие находятся в стадии разработки. [ 101 ] (В настоящее время проводятся клинические испытания терапии BITE для пациентов с тлеющим заболеванием и пациентов с впервые диагностированным заболеванием. [ 93 ] )
Некоторые пациенты стремятся пройти клинические испытания лекарств, поскольку они обеспечивают определенную степень медицинского контроля, отсутствующую в большинстве других клинических учреждений, не говоря уже о доступе к новым лекарствам, которые, по-видимому, имеют многообещающий эффект по сравнению с существующими методами лечения. Некоторые пациенты временно переезжают в городские районы, где такие исследования доступны.
Крупнейшие научно-исследовательские институты рака предлагают большинство клинических исследований, но некоторые исследования (особенно испытания поздней стадии, фазы 3) доступны в спутниковых сетях, охватывающих сотни больниц. Национальный институт здравоохранения США ведет каталог клинических испытаний. [ 102 ] В США в таких городах, как Нью-Йорк, Бостон, Хьюстон и Рочестер, проводятся ведущие исследования множественной миеломы; Во всем мире другие ведущие программы исследования миеломы реализуются, среди прочего, в Университете Саламанки (Испания) и Свободном университете в Брюсселе.
Медицинская информация быстро устаревает в быстро меняющихся областях медицины, таких как методы лечения множественной миеломы, поэтому онкологи в небольших медицинских центрах могут быть не в состоянии быть в курсе литературы по всем соответствующим дисциплинам. Это привело к появлению организаций, которые работают над информированием пациентов о последних изменениях в заболевании, например, предлагая вебинары с участием выдающихся исследователей и практиков, специализирующихся на множественной миеломе; примерами таких организаций являются Международный фонд миеломы и Фонд исследования множественной миеломы . Некоторые пациенты, интересующиеся последними разработками, просматривают материалы крупных гематологических конференций по раку, таких как конференция Американского общества гематологов (ASH), [ 103 ] Конференция Американского общества клинической онкологии (ASCO), [ 104 ] саммит МВФ IMWG и ежегодная конференция Европейской гематологической ассоциации (ЕГА). [ 105 ]
Лечение показано при наличии симптомов миеломы. Если симптомов нет, но присутствует парапротеин, типичный для миеломы и диагностического костного мозга, без поражения органов-мишеней, лечение обычно откладывают или ограничивают клиническими исследованиями. [ 106 ] Лечение множественной миеломы направлено на уменьшение популяции клональных плазматических клеток и, следовательно, на уменьшение симптомов заболевания.
Химиотерапия
[ редактировать ]Исходный
[ редактировать ]Предпочтительным лечением для лиц в возрасте до 65 лет является высокодозная химиотерапия, обычно с использованием схем на основе бортезомиба и леналидомида -дексаметазона. [ 107 ] с последующей трансплантацией стволовых клеток. Исследование 2016 года пришло к выводу, что трансплантация стволовых клеток является предпочтительным методом лечения множественной миеломы. [ 108 ] Существует два типа трансплантации стволовых клеток для лечения множественной миеломы. [ 109 ] При аутологичной трансплантации гемопоэтических стволовых клеток (АСКТ) собственные стволовые клетки пациента собираются из собственной крови пациента. Пациенту назначают высокие дозы химиотерапии, а затем стволовые клетки пациента трансплантируют обратно пациенту. Этот процесс не является излечивающим, но продлевает общую выживаемость и полную ремиссию. При аллогенной трансплантации стволовых клеток больному человеку пересаживают стволовые клетки здорового донора. Аллогенная трансплантация стволовых клеток имеет потенциал для излечения, но используется у очень небольшого процента людей (и в случае рецидива, а не в рамках первоначального лечения). [ 52 ] Кроме того, уровень смертности, связанной с лечением, составляет 5–10%, связанный с аллогенной трансплантацией стволовых клеток.
Люди старше 65 лет и люди с серьезными сопутствующими заболеваниями часто не переносят трансплантацию стволовых клеток. Для этих людей стандартом лечения была химиотерапия мелфаланом и преднизолоном. Недавние исследования среди этой группы населения показывают улучшение результатов при использовании новых схем химиотерапии, например, бортезомиба. [ 110 ] [ 111 ] При лечении бортезомибом, мелфаланом и преднизолоном общая выживаемость составила 83% через 30 месяцев, леналидомид плюс низкие дозы дексаметазона - 82% выживаемость через 2 года, а мелфалан, преднизолон и леналидомид - 90% выживаемость через 2 года. По состоянию на 2008 г. прямые исследования, сравнивающие эти схемы, не проводились. [update]. [ 112 ]
Существует поддержка непрерывной терапии с использованием нескольких комбинаций противомиеломных препаратов бортезомиба , леналидомида и талидомида в качестве начального лечения множественной миеломы, непригодной для трансплантации. [ 113 ] Необходимы дальнейшие клинические исследования для определения потенциального вреда этих препаратов и их влияния на качество жизни человека. [ 113 ] В обзоре 2009 года отмечалось: «Тромбоз глубоких вен и тромбоэмболия легочной артерии являются основными побочными эффектами лечения». талидомид и леналидомид. Леналидомид вызывает более сильную миелосупрессию, а талидомид вызывает больший седативный эффект. Периферическая невропатия и тромбоцитопения, вызванные химиотерапией, являются основными побочными эффектами бортезомиба». [ 114 ] Добавление подкожного даратумумаба к индукционной и консолидационной терапии бортезомибом, леналидомидом и дексаметазоном, а также к поддерживающей терапии леналидомидом способствовало улучшению выживаемости без прогрессирования среди пациентов с впервые диагностированной множественной миеломой, нуждающихся в трансплантации. [ 115 ]
Лечение связанного с ним синдрома повышенной вязкости может потребоваться для предотвращения неврологических симптомов или почечной недостаточности. [ 116 ] [ 117 ]
Обслуживание
[ редактировать ]У большинства людей, включая тех, кто лечился с помощью ASCT, после первоначального лечения наблюдается рецидив. Для предотвращения рецидива часто применяют поддерживающую терапию с использованием длительного курса малотоксичных препаратов. Метаанализ 2017 года показал, что поддерживающая терапия леналидомидом после ТГСК улучшает выживаемость без прогрессирования и общую выживаемость у людей со стандартным риском. [ 118 ] Клиническое исследование 2012 года показало, что людям с заболеваниями среднего и высокого риска выгодна схема поддерживающей терапии на основе бортезомиба. [ 119 ]
Рецидив
[ редактировать ]Причины рецидива включают развитие заболевания либо в результате селективного давления, оказываемого лечением, либо в результате мутаций de novo и/или если заболевание не было адекватно представлено в первоначальной биопсии. [ 82 ] Рецидив в течение первых 18 месяцев после постановки диагноза рассматривается как функциональная множественная миелома высокого риска. [ 82 ] В зависимости от состояния человека, использованных ранее методов лечения и продолжительности ремиссии варианты рецидива заболевания включают повторное лечение оригинальным препаратом, использование других препаратов (таких как мелфалан, циклофосфамид, талидомид или дексаметазон, отдельно или в комбинации), и второй ASCT.
Позже в ходе заболевания он становится рефрактерным (резистентным) к ранее эффективному лечению. Эта стадия называется рецидивирующей/рефрактерной множественной миеломой (RRMM). Методы лечения, которые обычно используются для лечения RRMM, включают дексаметазон, ингибиторы протеасом (например, бортезомиб и карфилзомиб ), иммуномодулирующие имидные препараты (например, талидомид, леналидомид и помалидомид ) и некоторые моноклональные антитела (например, изатуксимаб против CD38 или антитела, нацеленные на CD319 ). В последние годы ожидаемая выживаемость возросла. [ 120 ] и новые методы лечения находятся в стадии разработки. [ нужна медицинская ссылка ]
Почечная недостаточность при множественной миеломе может быть острой (обратимой) или хронической (необратимой). Острая почечная недостаточность обычно проходит, когда уровень кальция и парапротеина находится под контролем. Лечение хронической почечной недостаточности зависит от типа почечной недостаточности и может включать диализ .
Несколько новых вариантов одобрены для лечения поздних стадий заболевания:
- белантамаб мафодотин : моноклональное антитело против антигена созревания B-клеток (BCMA), также известное как CD269, предназначенное для лечения взрослых с рецидивирующей или рефрактерной множественной миеломой, которые ранее получали как минимум четыре терапии, включая моноклональное антитело против CD38, ингибитор протеасом и иммуномодулирующий агент. [ 121 ] [ 122 ]
- карфилзомиб : ингибитор протеасом, показанный:
- в качестве монотерапии у людей, получивших одну или несколько линий терапии.
- в сочетании с дексаметазоном или леналидомидом и дексаметазоном у людей, получивших от одной до трех линий терапии [ 123 ]
- даратумумаб : моноклональное антитело против CD38 , показанное людям, которые ранее получали по крайней мере три линии терапии, включая ингибитор протеасом и иммуномодулирующий агент, или которые имеют двойную рефрактерность к ингибитору протеасом и иммуномодулирующему агенту. [ 124 ]
- элотузумаб : иммуностимулирующее гуманизированное моноклональное антитело против SLAMF7 (также известное как CD319), показанное в комбинации с леналидомидом и дексаметазоном у людей, получивших от одного до трех предшествующих курсов лечения. [ 125 ]
- изатуксимаб : моноклональное антитело против CD38 , показанное в сочетании с помалидомидом и дексаметазоном для лечения взрослых с множественной миеломой, которые ранее получали как минимум два курса лечения, включая леналидомид и ингибитор протеасом . [ 126 ] [ 127 ]
- иксазомиб : пероральный ингибитор протеасом, показанный в сочетании с леналидомидом и дексаметазоном людям, получившим хотя бы один предшествующий курс лечения. [ 128 ]
- панобиностат : пероральный ингибитор гистондеацетилазы, используемый в сочетании с бортезомибом и дексаметазоном у людей, которые ранее получали как минимум два режима химиотерапии, включая бортезомиб и иммуномодулирующий агент. [ 129 ]
- селинексор : доступный для перорального применения селективный ингибитор ядерного экспорта, показанный в сочетании с дексаметазоном людям, которые ранее получали как минимум четыре курса лечения и чье заболевание не реагирует как минимум на два ингибитора протеасом, два иммуномодулирующих агента и моноклональное антитело против CD38. [ 130 ]
- idecabtagene vicleucel : первая клеточная генная терапия была одобрена FDA в 2021 году для лечения взрослых с рецидивирующей или рефрактерной множественной миеломой, которые ранее получали как минимум четыре курса лечения. [ 131 ]
Талкетамаб (Талви) и элранатамаб (Элрексфио) были одобрены для медицинского применения в США в августе 2023 года. [ 132 ] [ 133 ] [ 134 ] [ 135 ]
Трансплантация стволовых клеток
[ редактировать ]Трансплантацию стволовых клеток можно использовать для лечения множественной миеломы. [ 3 ] Трансплантация стволовых клеток сопряжена с риском реакции «трансплантат против хозяина» . Мезенхимальные стромальные клетки могут снизить смертность от всех причин, если они используются в терапевтических целях, а терапевтическое использование МСК может увеличить полный ответ на острую и хроническую РТПХ, но доказательства очень неопределенны. [ 136 ] Имеющиеся данные свидетельствуют о том, что МСК в профилактических целях практически не приводят к различиям в смертности от всех причин, рецидивах злокачественных заболеваний и частоте возникновения острой РТПХ. [ 136 ] Имеющиеся данные свидетельствуют о том, что МСК в профилактических целях снижают частоту возникновения хронической РТПХ. [ 136 ]
Трансплантация костного мозга
[ редактировать ]Плериксафор (Мозобил) был одобрен для медицинского применения в США в 2008 году. [ 137 ]
Мотиксафортид (Афексда) был одобрен для медицинского применения в США в сентябре 2023 года. [ 138 ]
Генная терапия
[ редактировать ]- Idecabtagene vicleucel (Abecma) - первая клеточная генная терапия была одобрена FDA в 2021 году для лечения взрослых с рецидивирующей или рефрактерной множественной миеломой, которые ранее получали как минимум четыре курса лечения. [ 131 ]
- Цилтакабтаген аутолейцел (Carvykti) был одобрен для медицинского применения в США в феврале 2022 года. [ 139 ] Цилтакабтагеновый аутолейцел показан для лечения взрослых с рецидивирующей или рефрактерной множественной миеломой после четырех или более предшествующих линий терапии, включая ингибитор протеасом, иммуномодулирующий агент и моноклональное антитело против CD38. [ 139 ]
Другие меры
[ редактировать ]Помимо прямого лечения пролиферации плазматических клеток, бисфосфонаты (например, памидронат или золедроновую кислоту для предотвращения переломов обычно назначают ); также было обнаружено, что они оказывают прямое противоопухолевое действие даже у людей без известных заболеваний скелета. [ нужна ссылка ] переливание эритроцитов или эритропоэтина При необходимости для лечения анемии можно использовать .
Побочные эффекты
[ редактировать ]Химиотерапия и трансплантация стволовых клеток могут вызвать нежелательные кровотечения и могут потребовать переливания тромбоцитов. Было замечено, что переливание тромбоцитов людям, проходящим химиотерапию или трансплантацию стволовых клеток для предотвращения кровотечений, по-разному влияло на количество участников с кровотечением, количество дней, в которые произошло кровотечение, вторичную смертность от кровотечения. и количество трансфузий тромбоцитов в зависимости от способа их применения (терапевтические, в зависимости от порога, различные схемы дозирования или профилактические). [ 140 ] [ 141 ]
Поддерживающее лечение
[ редактировать ]Добавление физических упражнений к стандартному лечению взрослых пациентов со злокачественными новообразованиями крови, такими как множественная миелома, может практически не привести к изменению показателей смертности, качества жизни и физического функционирования. [ 142 ] Эти упражнения могут привести к небольшому уменьшению депрессии. [ 142 ] Кроме того, аэробные физические упражнения, вероятно, уменьшают утомляемость. Доказательства очень неопределенны в отношении эффекта и серьезных побочных эффектов. [ 142 ]
Паллиативная помощь
[ редактировать ]Многие национальные руководства по лечению рака рекомендуют раннюю паллиативную помощь людям с поздней стадией множественной миеломы на момент постановки диагноза и всем, у кого есть серьезные симптомы. [ 143 ] [ 144 ]
Паллиативная помощь целесообразна на любой стадии множественной миеломы и может оказываться наряду с лечебным лечением. Помимо устранения симптомов рака, паллиативная помощь помогает справиться с нежелательными побочными эффектами, такими как боль и тошнота, вызванными лечением. [ 145 ] [ 146 ]
Зубы
[ редактировать ]Профилактика полости рта, инструкции по гигиене и устранение источников инфекции во рту перед началом лечения рака могут снизить риск инфекционных осложнений. Перед началом терапии бисфосфонатами необходимо оценить состояние зубов человека, чтобы оценить факторы риска и предотвратить развитие медикаментозного остеонекроза челюсти (MRONJ). При наличии каких-либо симптомов или рентгенологических проявлений MRONJ, таких как боль в челюсти, шатающийся зуб, отек слизистой оболочки, рекомендуется раннее обращение к хирургу-стоматологу. Следует избегать удаления зубов в активный период лечения и вместо этого лечить зуб нехирургическим лечением корневых каналов. [ 147 ]
Прогноз
[ редактировать ]В целом 5-летняя выживаемость в США составляет около 54%. [ 148 ] При применении высоких доз терапии с последующим ASCT медиана выживаемости, по оценкам, в 2003 году составила около 4,5 лет по сравнению со средним значением около 3,5 лет при «стандартной» терапии. [ 149 ]
Международная система стадирования может помочь прогнозировать выживаемость: медиана выживаемости (в 2005 г.) составляла 62 месяца для болезни 1-й стадии, 45 месяцев для болезни 2-й стадии и 29 месяцев для болезни 3-й стадии. [ 81 ] Средний возраст на момент постановки диагноза составляет 69 лет. [ 148 ]
Генетическое тестирование
[ редактировать ]Кариотипирование с помощью массива SNP может обнаружить изменения числа копий, имеющие прогностическое значение, которые могут быть пропущены целевой панелью FISH. [ 150 ]
В следующей таблице представлен прогностический эффект различных генетических признаков при множественной миеломе с хромосомными транслокациями , обозначенными буквой t, за которыми следует их стандартная номенклатура: [ 151 ]
| Генетическая аномалия | Ген(ы) | Заболеваемость среди миелом | Прогностическое воздействие |
|---|---|---|---|
| Делеция /изолированная моносомия 13 | РБ1, ДИС3 | 45–50% | Влияние на прогноз неясно |
| Трисомии | 40–50% | Медиана общей выживаемости: 7–10 лет. | |
| Увеличение 1q21 как дополнение к другому отклонению | CKS1B, ANP32E | 35–40% | Медиана общей выживаемости: 5 лет. |
| т(11;14)(д13;д32) | IgH и CCND1 | 15–20% | Медиана общей выживаемости: 7–10 лет. |
| Трисомия плюс любая транслокация IgH | 15% | Может нейтрализовать транслокации IgH и del 17p высокого риска. | |
| Гиподиплоидия | 13–20% | Прогноз неблагоприятный, высокий риск прогрессирования. | |
| т(4:14)(p16;q32) | IgH и FGFR3/MMSET | 10–15% | Медиана общей выживаемости: 5 лет. |
| Делеция 17p как дополнение к другой аномалии | ТП53 | 10% | Медиана общей выживаемости: 5 лет. |
| т(14;16) | IgH и C-MAF | 2–5% | Медиана общей выживаемости: 5 лет. |
| т(6;14)(p21;q32) | IgH и CCND3 | 2% | Медиана общей выживаемости: 7–10 лет. |
| т(14;20)(д32;д12) | МАФБ | 1% | Медиана общей выживаемости: 5 лет. |
Эпидемиология
[ редактировать ]

Во всем мире множественная миелома затронула 488 000 человек и привела к 101 100 смертельным случаям в 2015 году. [ 8 ] [ 9 ] Это больше, чем 49 000 в 1990 году. [ 153 ]
Соединенные Штаты
[ редактировать ]В Соединенных Штатах в 2016 году было зарегистрировано около 30 330 новых случаев заболевания и 12 650 смертей. [ 7 ] Эти цифры основаны на предположениях, сделанных с использованием данных за 2011 год, согласно которым число заболевших составило 83 367 человек, количество новых случаев - 6,1 на 100 000 человек в год, а смертность - 3,4 на 100 000 человек в год.
Множественная миелома является вторым по распространенности раком крови (10%) после неходжкинской лимфомы . [ 154 ] На его долю приходится около 1,8% всех новых случаев рака и 2,1% всех случаев смерти от рака. [ 7 ]
Множественная миелома поражает несколько чаще мужчин, чем женщин. У афроамериканцев и коренных жителей тихоокеанских островов зарегистрировано наибольшее количество новых случаев этого заболевания в Соединенных Штатах, а у азиатов – наименьшее. Результаты одного исследования показали, что количество новых случаев миеломы составляет 9,5 случаев на 100 000 афроамериканцев и 4,1 случая на 100 000 американцев европеоидной расы. [ 155 ] Среди афроамериканцев миелома входит в десятку основных причин смертности от рака. [ 156 ]
Великобритания
[ редактировать ]Миелома является 17-м по распространенности раком в Великобритании: в 2011 году это заболевание было диагностировано у около 4800 человек. Это 16-е место по распространенности среди причин смерти от рака: в 2012 году от нее умерло около 2700 человек. [ 157 ]
Другие животные
[ редактировать ]У собак диагностировали множественную миелому. [ 158 ] кошки и лошади. [ 159 ]
У собак множественная миелома составляет около 8% всех гемопоэтических опухолей. Множественная миелома встречается у пожилых собак и не особенно связана ни с кобелями, ни с суками. В проведенных обзорах случаев ни одна порода не оказалась чрезмерно представленной. [ 160 ] Диагностика у собак обычно задерживается из-за первоначальной неспецифичности и диапазона возможных клинических признаков. Диагноз обычно включает исследование костного мозга, рентгенологическое исследование и исследование белков плазмы. У собак исследования белка обычно выявляют повышение уровня моноклонального гаммаглобулина IgA или IgG в равном числе случаев. [ 160 ] В редких случаях повышение уровня глобулинов представляет собой IgM, что называется макроглобулинемией Вальденстрема . [ 161 ] Прогноз первоначального контроля и возвращения к хорошему качеству жизни у собак хороший; 43% собак, начавших лечение по протоколу комбинированной химиотерапии, достигли полной ремиссии. Долгосрочная выживаемость является нормальной, ее медиана составляет 540 дней. [ 160 ] Со временем заболевание рецидивирует, становясь устойчивым к доступным методам лечения. [ нужна медицинская ссылка ] Осложнения в виде почечной недостаточности, сепсиса или боли могут привести к смерти животного, часто в результате эвтаназии . [ нужна медицинская ссылка ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «Миелома Канада | Что такое множественная миелома?» . www.myelomacanada.ca . Архивировано из оригинала 13 мая 2020 года . Проверено 17 апреля 2020 г.
- ^ Jump up to: а б с д Раджкумар С.В. (2018). "Множественная миелома". В Хенсли М.Л., Миловски М.И., Раджкумар С.В., Шютце С.М. (ред.). ASCO-SEP: Программа самооценки медицинской онкологии (7-е изд.). Александрия, Вирджиния: Американское общество клинической онкологии. ISBN 978-0-9983747-4-1 . OCLC 1080368315 .
- ^ Jump up to: а б с д и ж г час «Лечение плазмоклеточных новообразований (включая множественную миелому) (PDQ®) – версия для медицинских работников» . НЦИ . 29 июля 2016 года. Архивировано из оригинала 4 июля 2016 года . Проверено 8 августа 2016 г.
- ^ Jump up to: а б с Всемирный доклад о раке, 2014 год . Всемирная организация здравоохранения. 2014. С. Глава 5.13. ISBN 978-92-832-0429-9 .
- ^ Jump up to: а б Всемирный доклад о раке, 2014 год . Всемирная организация здравоохранения. 2014. стр. Главы 2.3 и 2.6. ISBN 978-92-832-0429-9 .
- ^ Jump up to: а б с д и ж г час Рааб М.С., Подар К., Брейткройц И., Ричардсон П.Г., Андерсон К.К. (июль 2009 г.). "Множественная миелома". Ланцет . 374 (9686): 324–339. дои : 10.1016/S0140-6736(09)60221-X . ПМИД 19541364 . S2CID 12906881 .
- ^ Jump up to: а б с «Информационные бюллетени SEER: миелома» . Программа NCI по надзору, эпидемиологии и конечным результатам . Архивировано из оригинала 27 июля 2016 года . Проверено 8 августа 2016 г.
- ^ Jump up to: а б Вос Т. и др. (октябрь 2016 г.). «Глобальная, региональная и национальная заболеваемость, распространенность и продолжительность жизни с инвалидностью по 310 заболеваниям и травмам, 1990-2015 гг.: систематический анализ для исследования глобального бремени болезней 2015 г.» . Ланцет . 388 (10053): 1545–1602. дои : 10.1016/S0140-6736(16)31678-6 . ПМК 5055577 . ПМИД 27733282 .
- ^ Jump up to: а б Ван Х и др. (октябрь 2016 г.). «Глобальная, региональная и национальная продолжительность жизни, смертность от всех причин и смертность от конкретных причин по 249 причинам смерти, 1980-2015 гг.: систематический анализ для исследования глобального бремени болезней 2015 г.» . Ланцет . 388 (10053): 1459–1544. дои : 10.1016/s0140-6736(16)31012-1 . ПМЦ 5388903 . ПМИД 27733281 .
- ^ Jump up to: а б с д и «Плазмоклеточные новообразования (включая множественную миелому) — версия для пациента» . НЦИ . 1 января 1980 года. Архивировано из оригинала 27 июля 2016 года . Проверено 8 августа 2016 г.
- ^ «Лечение плазмоклеточных новообразований (включая множественную миелому)» . Национальный институт рака . 1 января 1980 года. Архивировано из оригинала 9 января 2021 года . Проверено 28 ноября 2017 г.
- ^ Ферри ФФ (2013). Электронная книга «Клинический консультант Ферри», 2014 г.: 5 книг в 1 . Elsevier Науки о здоровье. п. 726. ИСБН 978-0-323-08431-4 . Архивировано из оригинала 18 августа 2023 года . Проверено 23 августа 2020 г. .
- ^ Jump up to: а б с Георгакопулу Р., Фисте О., Сергентанис Т.Н., Андрикопулу А., Загури Ф., Гавриатопулу М. и др. (сентябрь 2021 г.). «Профессиональное воздействие и риск множественной миеломы: обновленный обзор метаанализа» . Журнал клинической медицины . 10 (18): 4179. doi : 10.3390/jcm10184179 . ПМЦ 8469366 . ПМИД 34575290 .
- ^ Jump up to: а б с д и ж г Де Роос А.Дж., Спинелли Дж., Браун Э.Б., Атанакович Д., Барис Д., Бернштейн Л. и др. (ноябрь 2018 г.). «Объединенное исследование профессионального воздействия ароматических углеводородных растворителей и риска множественной миеломы» . Профессиональная и экологическая медицина . 75 (11): 798–806. doi : 10.1136/oemed-2018-105154 . ПМЦ 9386620 . ПМИД 30121582 .
- ^ ван де Донк Н.В., Мутис Т., Поддиг П.Дж., Локхорст Х.М., Цвигман С. (май 2016 г.). «Диагностика, стратификация риска и лечение моноклональной гаммапатии неустановленного значения и тлеющей множественной миеломы» . Международный журнал лабораторной гематологии . 38 (Приложение 1): 110–122. дои : 10.1111/ijlh.12504 . ПМИД 27161311 .
- ^ Мартино М, Канале ФА, Алати К, Винчелли И.Д., Москато Т, Порту Г, Лотета Б, Насо В, Мацца М, Николини Ф, Гелли Лузерна ди Рора А, Симонетти Г, Ронкони С, Чекколини М, МУРАКА Г (27 мая) 2021). «CART-клеточная терапия: последние достижения и новые данные о множественной миеломе» . Раки . 13 (11): 2639. doi : 10.3390/cancers13112639 . ISSN 2072-6694 . ПМЦ 8197914 . ПМИД 34072068 .
- ^ «Множественная миелома: статистика» . ASCO Cancer.net . Март 2023 г. Архивировано из оригинала 11 июня 2023 г. Проверено 10 июня 2023 г.
- ^ Jump up to: а б «Факты о раке: миелома» . Национальный институт рака . Архивировано из оригинала 7 мая 2020 года . Проверено 10 июня 2023 г.
- ^ «Уровни выживаемости при множественной миеломе» . Американское онкологическое общество . Архивировано из оригинала 11 июня 2023 года . Проверено 10 июня 2023 г.
- ^ Дипенброк, Нью-Хэмпшир (2011). Краткий справочник по интенсивной терапии . Липпинкотт Уильямс и Уилкинс. п. 292. ИСБН 978-1-60831-464-5 . Архивировано из оригинала 21 августа 2016 года.
- ^ Jump up to: а б с Международная рабочая группа по миеломе (июнь 2003 г.). «Критерии классификации моноклональных гаммапатий, множественной миеломы и родственных заболеваний: отчет Международной рабочей группы по миеломе» . Британский журнал гематологии . 121 (5): 749–757. дои : 10.1046/j.1365-2141.2003.04355.x . ПМИД 12780789 . S2CID 3195084 .
- ^ Jump up to: а б «Критерии Международной рабочей группы по миеломе (IMWG) для диагностики множественной миеломы» . Международный фонд миеломы . 26 октября 2014 г. Архивировано из оригинала 7 декабря 2022 г. . Проверено 11 июня 2023 г.
- ^ Лонго Д. (2012). Принципы внутренней медицины Харрисона, 18-е издание . МакГроу Хилл Медикал. п. 938. ИСБН 978-0-07-174889-6 .
- ^ «Гиперкальциемия» . Библиотека медицинских концепций Lecturio . Архивировано из оригинала 25 июля 2021 года . Проверено 11 августа 2021 г.
- ^ Брунс И., Кадедду Р.П., Брюкманн И., Фребель Дж., Гейх С., Бюст С. и др. (сентябрь 2012 г.). «Связанная с множественной миеломой дерегуляция кроветворных стволовых клеток и клеток-предшественников CD34 (+) костного мозга» . Кровь . 120 (13): 2620–2630. дои : 10.1182/blood-2011-04-347484 . ПМК 3460684 . ПМИД 22517906 .
- ^ Бладе Дж., Фернандес-Лама П., Бош Ф., Монтолиу Дж., Ленс XM, Монтото С. и др. (сентябрь 1998 г.). «Почечная недостаточность при множественной миеломе: особенности и предикторы исхода у 94 пациентов из одного учреждения» . Архив внутренней медицины . 158 (17): 1889–1893. дои : 10.1001/archinte.158.17.1889 . ПМИД 9759684 .
- ^ Кнудсен Л.М., Хиппе Э., Йорт М., Холмберг Э., Вестин Дж. (октябрь 1994 г.). «Функция почек при впервые диагностированной множественной миеломе - демографическое исследование 1353 пациентов. Группа по изучению миеломы стран Северной Европы». Европейский журнал гематологии . 53 (4): 207–212. дои : 10.1111/j.1600-0609.1994.tb00190.x . ПМИД 7957804 . S2CID 2861880 .
- ^ Jump up to: а б Наср С.Х., Саид С.М., Валери А.М., Сетхи С., Фидлер М.Е., Корнелл Л.Д. и др. (март 2013 г.). «Диагностика и характеристики амилоидоза тяжелых и легких цепей почек и их сравнение с амилоидозом легких цепей почек» . Почки Интернешнл . 83 (3): 463–470. дои : 10.1038/ki.2012.414 . ПМИД 23302715 .
- ^ Кастильо Джей-Джей (декабрь 2016 г.). «Заболевания плазматических клеток». Первичный уход . 43 (4): 677–691. дои : 10.1016/j.pop.2016.07.002 . ПМИД 27866585 .
- ^ Jump up to: а б Blimark C (январь 2015 г.). «Множественная миелома и инфекции: популяционное исследование с участием 9253 пациентов с множественной миеломой» . Гематологическая . 100 (1): 107–113. дои : 10.3324/haematol.2014.107714 . ПМЦ 4281323 . ПМИД 25344526 .
- ^ Часовня HM, Ли М. (июль 1994 г.). «Применение внутривенного иммуноглобулина при множественной миеломе» . Клиническая и экспериментальная иммунология . 97 (Приложение 1): 21–24. ПМК 1550368 . ПМИД 8033429 .
- ^ Jump up to: а б «Общие терминологические критерии нежелательных явлений (CTCAE), версия 5.0» (PDF) . Министерство здравоохранения и социальных служб США . 27 ноября 2017 г. Архивировано (PDF) из оригинала 19 мая 2023 г. . Проверено 12 июня 2023 г.
- ^ Jump up to: а б Ланцман Дж. (15 ноября 2022 г.). «Инфекции и тяжелая гипогаммаглобулинемия у пациентов с множественной миеломой, получающих биспецифические антитела против BCMA» . Архивировано из оригинала 11 июня 2023 года . Проверено 11 июня 2023 г.
- ^ Jump up to: а б «Диагностика множественной миеломы» . Канадское онкологическое общество . Архивировано из оригинала 11 июня 2023 года . Проверено 11 июня 2023 г.
- ^ Харгривз Р.М., Леа Дж.Р., Гриффитс Х., Фаукс Дж.А., Холт Дж.М., Рид С. и др. (март 1995 г.). «Иммунологические факторы и риск заражения при миеломе в фазе плато» . Журнал клинической патологии . 48 (3): 260–266. дои : 10.1136/jcp.48.3.260 . ПМК 502468 . ПМИД 7730490 .
- ^ «Гематологическая клиника Рудхирам — Поиск в Google» . www.google.com . Архивировано из оригинала 1 апреля 2023 года . Проверено 4 февраля 2022 г.
- ^ Глик М. (январь 2015 г.). Глик М. (ред.). Пероральный препарат Буркета . PMPH США. ISBN 978-1-60795-188-9 . ОСЛК 888026338 .
- ^ Шах А., Али А., Лату С., Ахмад I (июнь 2010 г.). «Множественная миелома, проявляющаяся как образование десны» . Журнал челюстно-лицевой и оральной хирургии . 9 (2): 209–212. дои : 10.1007/s12663-010-0050-7 . ПМЦ 3244103 . ПМИД 22190790 .
- ^ Ландгрен О., Кайл Р.А., Пфайффер Р.М., Кацманн Дж.А., Капорасо Н.Е., Хейс Р.Б. и др. (май 2009 г.). «Моноклональная гаммапатия неопределенного значения (MGUS) постоянно предшествует множественной миеломе: проспективное исследование» . Кровь . 113 (22): 5412–5417. дои : 10.1182/кровь-2008-12-194241 . ПМК 2689042 . ПМИД 19179464 .
- ^ Jump up to: а б с Датта А.К., Хьюитт Д.Р., Финк Дж.Л., Грейди Дж.П., Занеттино AC (июль 2017 г.). «Передовые достижения в области геномики позволяют по-новому взглянуть на развитие опухолей, прогрессирование заболевания и терапевтические эффекты при множественной миеломе» . Британский журнал гематологии . 178 (2): 196–208. дои : 10.1111/bjh.14649 . ПМИД 28466550 .
- ^ Jump up to: а б Уиллрич М.А., Мюррей Д.Л., Кайл Р.А. (январь 2018 г.). «Лабораторное тестирование моноклональных гаммапатий: внимание к моноклональной гаммапатии неустановленного значения и тлеющей множественной миеломе». Клиническая биохимия . 51 : 38–47. doi : 10.1016/j.clinbiochem.2017.05.001 . ПМИД 28479151 .
- ^ Робертс Д.Л., Дайв С., Ренехан А.Г. (2010). «Биологические механизмы, связывающие ожирение и риск рака: новые перспективы». Ежегодный обзор медицины . 61 : 301–316. дои : 10.1146/annurev.med.080708.082713 . ПМИД 19824817 .
- ^ Jump up to: а б Коура Д.Т., Лэнгстон А.А. (август 2013 г.). «Наследственная предрасположенность к множественной миеломе» . Терапевтические достижения в гематологии . 4 (4): 291–297. дои : 10.1177/2040620713485375 . ПМЦ 3734900 . ПМИД 23926460 .
- ^ Схинаси Л.Х., Браун Э.Э., Кэмп Нью-Джерси, Ван С.С., Хофманн Дж.Н., Чиу Б.С. и др. (октябрь 2016 г.). «Множественная миелома и семейный анамнез лимфогематопоэтического рака: результаты Международного консорциума множественной миеломы» . Британский журнал гематологии . 175 (1): 87–101. дои : 10.1111/bjh.14199 . ПМК 5035512 . ПМИД 27330041 .
- ^ Сергентанис Т.Н., Загури Ф., Цилимидос Г., Цаянни А., Целиу М., Димопулос М.А., Псалтопулу Т. (октябрь 2015 г.). «Факторы риска множественной миеломы: систематический обзор метаанализа». Клиническая лимфома, миелома и лейкемия . 15 (10): 563–577.е3. дои : 10.1016/j.clml.2015.06.003 . ПМИД 26294217 .
- ^ Секигути Й., Симада А., Итикава К., Вакабаяши М., Сугимото К., Икеда К. и др. (2015). «Вирус-положительная множественная миелома Эпштейна-Барра, развивающаяся после иммунодепрессивной терапии ревматоидного артрита: описание случая и обзор литературы» . Международный журнал клинической и экспериментальной патологии . 8 (2): 2090–2102. ПМЦ 4396324 . ПМИД 25973110 .
- ^ Jump up to: а б Резк С.А., Чжао X, Вайс Л.М. (сентябрь 2018 г.). «Лимфоидная пролиферация, связанная с вирусом Эпштейна-Барра (ВЭБ), обновленная информация за 2018 год». Патология человека . 79 : 18–41. дои : 10.1016/j.humpath.2018.05.020 . ПМИД 29885408 . S2CID 47010934 .
- ^ Jump up to: а б Ян Дж, Ван Дж, Чжан В, Чен М, Чен Дж, Лю В (апрель 2017 г.). «Солитарная плазмоцитома, связанная с вирусом Эпштейна-Барра: клинико-патологическое, цитогенетическое исследование и обзор литературы». Анналы диагностической патологии . 27 : 1–6. doi : 10.1016/j.anndiagpath.2016.09.002 . ПМИД 28325354 .
- ^ Дойчинов С.Д., Фенд Ф., Кинтанилья-Мартинес Л. (март 2018 г.). «EBV-положительные лимфопролиферации производных B-T- и NK-клеток у хозяев без иммунодефицита» . Патогены . 7 (1): 28. doi : 10.3390/pathogens7010028 . ПМК 5874754 . ПМИД 29518976 .
- ^ Мутусами Н., Калиджури М.А. (2021). «Глава 73: Структура лимфоцитов и плазматических клеток». Гематология Уильямса (10-е изд.). Макгроу-Хилл Образование.
- ^ Федерико Калигарис-Каппио, Манлио Феррарини (1997). Популяции В-клеток человека . Химическая иммунология. Том. 67. Швейцария: С. Каргер АГ. п. 105. ИСБН 978-3-8055-6460-1 . Архивировано из оригинала 27 мая 2016 года.
- ^ Jump up to: а б Кайл Р.А., Раджкумар С.В. (октябрь 2004 г.). "Множественная миелома" . Медицинский журнал Новой Англии . 351 (18): 1860–1873. дои : 10.1056/NEJMra041875 . ПМК 2265446 . ПМИД 15509819 .
- ^ Шпильманн М., Лупианьес Д.Г., Мундлос С. (июль 2018 г.). «Структурные вариации 3D-генома». Обзоры природы. Генетика . 19 (7): 453–467. дои : 10.1038/s41576-018-0007-0 . hdl : 21.11116/0000-0003-610A-5 . ПМИД 29692413 . S2CID 22325904 .
- ^ Трико G (январь 2000 г.). «Новый взгляд на роль микроокружения при множественной миеломе». Ланцет . 355 (9200): 248–250. дои : 10.1016/S0140-6736(00)00019-2 . ПМИД 10675068 . S2CID 41876106 .
- ^ Калушкова А., Нюлунд П., Паррага А.А., Леннартссон А., Йернберг-Виклунд Х. (8 октября 2021 г.). «Один омический подход не управляет ими всеми: метаболом и эпигеном объединяют усилия при гематологических злокачественных новообразованиях» . Эпигеномы . 5 (4): 22. doi : 10.3390/epigenomes5040022 . ISSN 2075-4655 . ПМЦ 8715477 . ПМИД 34968247 .
- ^ Ян Т., Лю Икс, Кумар С.К., Джин Ф, Дай Ю (январь 2022 г.). «Расшифровка метилирования ДНК в эпигенетике множественной миеломы» . Обзоры крови . 51 : 100872. doi : 10.1016/j.blre.2021.100872 . ПМИД 34384602 .
- ^ Агирре X, Кастеллано Дж., Паскуаль М., Хит С., Кулис М., Сегура В. и др. (апрель 2015 г.). «Анализ всего эпигенома при множественной миеломе выявляет гиперметилирование ДНК специфичных для В-клеток энхансеров» . Геномные исследования . 25 (4): 478–487. дои : 10.1101/гр.180240.114 . ПМЦ 4381520 . ПМИД 25644835 .
- ^ Калушкова А, Фрикнес М, Лемэр М, Фристедт С, Агарвал П, Эрикссон М и др. (июль 2010 г.). «Гены-мишени Polycomb подавляются при множественной миеломе» . ПЛОС ОДИН . 5 (7): e11483. Бибкод : 2010PLoSO...511483K . дои : 10.1371/journal.pone.0011483 . ПМК 2901331 . ПМИД 20634887 .
- ^ Агарвал П., Альзригат М., Паррага А.А., Энрот С., Сингх У., Унгерстедт Дж. и др. (февраль 2016 г.). «Полногеномное профилирование триметилирования лизина 27 и лизина 4 гистона H3 при множественной миеломе показывает важность нацеливания на ген Polycomb и подчеркивает EZH2 как потенциальную терапевтическую мишень» . Онкотаргет . 7 (6): 6809–6823. дои : 10.18632/oncotarget.6843 . ПМЦ 4872750 . ПМИД 26755663 .
- ^ Крунквист, Пенсильвания, Ван Несс Б. (сентябрь 2005 г.). «Белковый усилитель группы поликомб гомолога 2 zeste (EZH 2) представляет собой онкоген, который влияет на рост клеток миеломы и мутантный фенотип ras» . Онкоген . 24 (41): 6269–6280. дои : 10.1038/sj.onc.1208771 . ПМИД 16007202 . S2CID 24588617 .
- ^ Придо С.М., Конвей О'Брайен Э., Чевассут Т.Дж. (2014). «Генетическая архитектура множественной миеломы» . Достижения гематологии . 2014 : 1–16. дои : 10.1155/2014/864058 . ISSN 1687-9104 . ПМЦ 3996928 . ПМИД 24803933 .
- ^ Уивер CJ, Тариман JD (август 2017 г.). «Геномика множественной миеломы: систематический обзор» . Семинары по сестринскому делу в онкологии . 33 (3): 237–253. дои : 10.1016/j.soncn.2017.05.001 . ПМИД 28729121 . S2CID 20956622 . Архивировано из оригинала 18 июля 2020 года . Проверено 13 июля 2019 г.
- ^ Бригл К., Роджерс Б. (август 2017 г.). «Патобиология и диагностика множественной миеломы» . Семинары по сестринскому делу в онкологии . 33 (3): 225–236. дои : 10.1016/j.soncn.2017.05.012 . ПМИД 28688533 .
- ^ Раджкумар С.В. (август 2022 г.). «Множественная миелома: обновленная информация о диагностике, стратификации риска и управлении на 2022 год» . Американский журнал гематологии . 97 (8): 1086–1107. дои : 10.1002/ajh.26590 . ISSN 0361-8609 . ПМЦ 9387011 . ПМИД 35560063 .
- ^ Jump up to: а б Фернандес де Ларреа С., Кайл Р.А., Дьюри Б.Г., Людвиг Х., Усмани С., Весоле Д.Х. и др. (апрель 2013 г.). «Плазмоклеточный лейкоз: консенсусное заявление Международной рабочей группы по миеломе о диагностических требованиях, критериях ответа и рекомендациях по лечению» . Лейкемия . 27 (4): 780–791. дои : 10.1038/leu.2012.336 . ПМЦ 4112539 . ПМИД 23288300 .
- ^ Симеон В., Тодоэрти К., Ла Рокка Ф., Кайвано А., Трино С., Лионетти М. и др. (июль 2015 г.). «Молекулярная классификация и фармакогенетика первичного плазмоклеточного лейкоза: первоначальный подход к точной медицине» . Международный журнал молекулярных наук . 16 (8): 17514–17534. дои : 10.3390/ijms160817514 . ПМЦ 4581206 . ПМИД 26263974 .
- ^ Любимова Н.В., Тимофеев Ю.С., Абаев В.М., Вотякова О.М., Кушлинский Н.Е. (май 2018). «Иммунохимическая диагностика множественной миеломы» . Бюллетень экспериментальной биологии и медицины . 165 (1): 84–87. дои : 10.1007/s10517-018-4105-y . ISSN 1573-8221 . ПМИД 29797132 .
- ^ Лониал С., Кауфман Дж.Л. (сентябрь 2013 г.). «Несекреторная миелома: руководство для врача» . Онкология . 27 (9): 924–8, 930. PMID 24282993 . Архивировано из оригинала 12 января 2018 года.
- ^ Митчелл, Ричард Шеппард, Кумар, Винай, Аббас, Абул К., Фаусто, Нельсон (2007). "Множественная миелома". Основная патология Роббинса (8-е изд.). Филадельфия: Сондерс. п. 455. ИСБН 978-1-4160-2973-1 .
- ^ Раджкумар С.В. (1 января 2005 г.). «MGUS и тлеющая множественная миелома: обновленная информация о патогенезе, естественном течении и лечении» . Гематология. Американское общество гематологии. Образовательная программа . 2005 (1): 340–345. doi : 10.1182/asheducation-2005.1.340 . ПМИД 16304401 .
- ^ Jump up to: а б с д Раджкумар С.В., Димопулос М.А., Палумбо А., Блейд Дж., Мерлини Г., Матеос М.В. и др. (ноябрь 2014 г.). «Международная рабочая группа по миеломе обновила критерии диагностики множественной миеломы». «Ланцет». Онкология . 15 (12): е538–е548. дои : 10.1016/s1470-2045(14)70442-5 . hdl : 2268/174646 . ПМИД 25439696 . S2CID 36384542 .
- ^ «Патологическая основа болезней Роббинса и Котрана - 9781455726134 | Книжный магазин Elsevier Health в США» . www.us.elsevierhealth.com . Архивировано из оригинала 27 апреля 2021 года . Проверено 26 октября 2016 г.
- ^ Клатт ЕС (8 сентября 2011 г.). Атлас патологии Роббинса и Котрана . Elsevier Науки о здоровье. ISBN 978-1-4557-2683-7 . Архивировано из оригинала 10 сентября 2017 года.
- ^ Фригези И., Адольфссон Дж., Али М., Кристоферсен М.К., Джонссон Э., Турессон И. и др. (февраль 2014 г.). «Надежная изоляция злокачественных плазматических клеток при множественной миеломе» . Кровь . 123 (9): 1336–1340. дои : 10.1182/blood-2013-09-529800 . ПМИД 24385542 .
- ^ «Стратификация Мэйо для миеломы и терапия, адаптированная к риску» . nebula.wsimg.com . Архивировано из оригинала 28 августа 2021 года . Проверено 29 сентября 2017 г.
- ^ Зонневельд П., Авет-Луазо Х., Лониал С., Усмани С., Сигел Д., Андерсон К.С. и др. (июнь 2016 г.). «Лечение множественной миеломы цитогенетикой высокого риска: консенсус Международной рабочей группы по миеломе» . Кровь . 127 (24): 2955–2962. дои : 10.1182/blood-2016-01-631200 . ПМЦ 4920674 . ПМИД 27002115 .
- ^ Ангтуако Э.Дж., Фассас А.Б., Уокер Р., Сетхи Р., Барлоги Б. (апрель 2004 г.). «Множественная миелома: клинический обзор и диагностическая визуализация». Радиология . 231 (1): 11–23. дои : 10.1148/радиол.2311020452 . ПМИД 14990813 .
- ^ Нисида И., Кимура С., Мизобе Х., Ямамичи Дж., Кодзима К., Кавагути А. и др. (октябрь 2017 г.). «Автоматическая цифровая количественная оценка объема миеломы костного мозга в аппендикулярных скелетах - клиническое значение и прогностическое значение» . Научные отчеты . 7 (1): 12885. Бибкод : 2017NatSR...712885N . дои : 10.1038/s41598-017-13255-w . ПМЦ 5635114 . ПМИД 29018236 .
- ^ Кайл Р.А., Раджкумар С.В. (январь 2009 г.). «Критерии диагностики, стадирования, стратификации риска и оценки ответа на множественную миелому» . Лейкемия . 23 (1): 3–9. дои : 10.1038/leu.2008.291 . ПМЦ 2627786 . ПМИД 18971951 .
- ^ Jump up to: а б с «Критерии Международной рабочей группы по миеломе (IMWG) для диагностики множественной миеломы» . Международная рабочая группа по миеломе . 29 октября 2015 года. Архивировано из оригинала 7 ноября 2017 года . Проверено 5 августа 2018 г.
- ^ Jump up to: а б Грейпп П.Р., Сан-Мигель Дж., Дьюри Б.Г., Кроули Дж.Дж., Барлоги Б., Блейд Дж. и др. (май 2005 г.). «Международная система стадирования множественной миеломы» . Журнал клинической онкологии . 23 (15): 3412–3420. дои : 10.1200/JCO.2005.04.242 . ПМИД 15809451 .
- ^ Jump up to: а б с Коста LJ, Усмани С.З. (декабрь 2020 г.). «Определение и лечение множественной миеломы высокого риска: современные концепции» . Журнал Национальной комплексной онкологической сети . 18 (12): 1730–1737. дои : 10.6004/jnccn.2020.7673 . ПМИД 33285523 .
- ^ Палумбо А., Авет-Луазо Х., Олива С., Локхорст Х.М., Гольдшмидт Х., Розинол Л. и др. (сентябрь 2015 г.). «Пересмотренная международная система стадирования множественной миеломы: отчет Международной рабочей группы по миеломе» . Журнал клинической онкологии . 33 (26): 2863–2869. дои : 10.1200/JCO.2015.61.2267 . ПМЦ 4846284 . ПМИД 26240224 .
- ^ Лидтке М, Фонсека Р (2019). «Глава 25: Заболевания плазматических клеток». Кукер А., Альтман Дж., Гердс А., Вун Т. (ред.). Программа самооценки Американского общества гематологов (Седьмое изд.). Американское общество гематологии. стр. 722–69. ISBN 978-0-9789212-4-8 .
- ^ Лауби-Секретан Б, Скоччианти С, Лумис Д, Гросс Й, Бьянкини Ф, Страйф К (август 2016 г.). «Ожирение и рак – точка зрения рабочей группы IARC» . Медицинский журнал Новой Англии . 375 (8): 794–798. дои : 10.1056/NEJMsr1606602 . ПМК 6754861 . ПМИД 27557308 .
- ^ Jump up to: а б Раджкумар С.В. (8 декабря 2012 г.). «Двойники, тройки или четверки новых агентов при впервые диагностированной миеломе?» . Гематология. Американское общество гематологии. Образовательная программа . 2012 : 354–361. doi : 10.1182/asheducation.V2012.1.354.3798330 . ПМИД 23233604 . Архивировано из оригинала 11 июня 2023 года . Проверено 10 июня 2023 г.
- ^ Рубинштейн С.М. (28 января 2020 г.). «Стандартизация номенклатуры схем химиотерапии: предложение и оценка содержания схем HemOnc и тезауруса Национального института рака» . JCO Клиническая информатика рака . 4 (4): 60–70. дои : 10.1200/CCI.19.00122 . ПМК 7000232 . ПМИД 31990580 .
- ^ «Медикаментозная терапия множественной миеломы» . Американское онкологическое общество . Архивировано из оригинала 11 июня 2023 года . Проверено 10 июня 2023 г.
- ^ «Что такое ДАРЗАЛЕКС®?» . 9 апреля 2021 года. Архивировано из оригинала 11 июня 2023 года . Проверено 10 июня 2023 г.
- ^ «Бдительное ожидание множественной миеломы» . Канадское онкологическое общество . Архивировано из оригинала 11 июня 2023 года . Проверено 10 июня 2023 г.
- ^ «Триплетные и квадруплетные схемы лечения тлеющей множественной миеломы» . 10 марта 2023 года. Архивировано из оригинала 11 июня 2023 года . Проверено 10 июня 2023 г.
- ^ «Агрессивный тлеющий лечебный подход к оценке новых методов лечения и трансплантации (ASCENT)» . Архивировано из оригинала 3 июня 2023 года . Проверено 3 июня 2023 г.
- ^ Jump up to: а б «Иммуно-ПРИЗМА (Точное вмешательство при тлеющей миеломе)» . Архивировано из оригинала 3 июня 2023 года . Проверено 3 июня 2023 г.
- ^ «Получение стволовых клеток или трансплантация костного мозга» . Американское онкологическое общество . Архивировано из оригинала 10 июня 2023 года . Проверено 10 июня 2023 г.
- ^ Камбой М. (1 июня 2020 г.). «Вакцинация реципиента трансплантата стволовых клеток (SCT) и пациента с гематологическими злокачественными новообразованиями» . Клиники инфекционных заболеваний Северной Америки . 33 (2): 593–609. дои : 10.1016/j.idc.2019.02.007 . ПМК 6814287 . ПМИД 31005140 .
- ^ Jump up to: а б Пан Д (20 января 2022 г.). «Где мы находимся в области прецизионной терапии миеломы: процветание, обещания и несбыточные мечты» . Границы онкологии . 11 : 819127. doi : 10.3389/fonc.2021.819127 . ПМЦ 8811139 . ПМИД 35127532 .
- ^ Кумар С (2020). «Обновленные результаты BELLINI, исследования III фазы венетоклакса или плацебо в сочетании с бортезомибом и дексаметазоном при рецидивирующей/рефрактерной множественной миеломе» . Журнал клинической онкологии . 38 (15_suppl): 8509. doi : 10.1200/JCO.2020.38.15_suppl.8509 . S2CID 219779811 . Архивировано из оригинала 18 августа 2023 года . Проверено 3 июня 2023 г.
- ^ «FDA одобрило CAR T-клеточную терапию, нацеленную на BCMA, для лечения множественной миеломы» . Национальный институт рака . 14 апреля 2021 года. Архивировано из оригинала 11 июня 2023 года . Проверено 10 июня 2023 г.
- ^ «Одобрение Carvykti знаменует собой вторую терапию CAR T-клетками для лечения множественной миеломы» . Национальный институт рака . 30 марта 2022 года. Архивировано из оригинала 10 июня 2023 года . Проверено 10 июня 2023 г.
- ^ «FDA одобрило препарат теклистамаб-cqyv для лечения рецидивирующей или рефрактерной множественной миеломы» . Управление по контролю за продуктами и лекарствами США . 25 октября 2022 года. Архивировано из оригинала 27 октября 2022 года . Проверено 10 июня 2023 г.
- ^ Чари А (15 декабря 2022 г.). «Талкетамаб, биспецифическое антитело GPRC5D, перенаправляющее Т-клетки, при множественной миеломе» . Медицинский журнал Новой Англии . 387 (24): 2232–2244. дои : 10.1056/NEJMoa2204591 . ПМИД 36507686 . S2CID 254560960 .
- ^ «Клинические испытания» . Архивировано из оригинала 18 декабря 2020 года . Проверено 3 июня 2023 г.
- ^ «Американское общество гематологии» . Архивировано из оригинала 3 июня 2023 года . Проверено 3 июня 2023 г.
- ^ «Американское общество клинической онкологии» . Архивировано из оригинала 23 августа 2020 года . Проверено 3 июня 2023 г.
- ^ «Европейская гематологическая ассоциация» . Архивировано из оригинала 3 июня 2023 года . Проверено 3 июня 2023 г.
- ^ Корде Н., Кристинссон С.Ю., Ландгрен О. (май 2011 г.). «Моноклональная гаммапатия неопределенного значения (MGUS) и тлеющая множественная миелома (SMM): новые биологические открытия и разработка стратегий раннего лечения» . Кровь . 117 (21): 5573–5581. doi : 10.1182/blood-2011-01-270140 . ПМК 3316455 . ПМИД 21441462 .
- ^ Кайл Р.А., Раджкумар С.В. (март 2008 г.). "Множественная миелома" . Кровь . 111 (6): 2962–2972. дои : 10.1182/кровь-2007-10-078022 . ПМК 2265446 . ПМИД 18332230 .
- ^ Сайгин Д., Табиб Т., Биттар Х.Э., Валензи Э., Сембрат Дж., Чан С.Ю. и др. (20 сентября 2016 г.). «Транскрипционное профилирование популяций клеток легких при идиопатической легочной артериальной гипертензии» . Легочное кровообращение . 10 (1): 2937. doi : 10.1002/cncr.30334 . ПМК 7052475 . ПМИД 32166015 . S2CID 78285186 .
- ^ «Трансплантация стволовых клеток при множественной миеломе» . www.cancer.org . Архивировано из оригинала 13 октября 2019 года . Проверено 13 октября 2019 г.
- ^ Сан Мигель Дж. Ф., Шлаг Р., Хуагева Н. К., Димопулос М. А., Шпильберг О., Кропфф М. и др. (август 2008 г.). «Бортезомиб плюс мелфалан и преднизолон для начального лечения множественной миеломы». Медицинский журнал Новой Англии . 359 (9): 906–917. doi : 10.1056/NEJMoa0801479 . hdl : 10261/59573 . ПМИД 18753647 .
- ^ Член парламента Каррана, Маккидж К. (май 2009 г.). «Бортезомиб: обзор его применения у пациентов с множественной миеломой». Наркотики . 69 (7): 859–888. дои : 10.2165/00003495-200969070-00006 . ПМИД 19441872 .
- ^ Дьюри Б.Г. (август 2008 г.). «Лечение миеломы – мы добиваемся прогресса?». Медицинский журнал Новой Англии . 359 (9): 964–966. дои : 10.1056/NEJMe0805176 . ПМИД 18753654 .
- ^ Jump up to: а б Пьехотта В., Якоб Т., Лангер П., Монсеф И., Шайд С., Эсткур Л.Дж. и др. (Кокрейновская гематологическая группа) (ноябрь 2019 г.). «Множественные комбинации препаратов бортезомиба, леналидомида и талидомида для лечения первой линии у взрослых с множественной миеломой, непригодной для трансплантации: сетевой метаанализ» . Кокрановская база данных систематических обзоров . 2019 (11). дои : 10.1002/14651858.CD013487 . ПМК 6876545 . ПМИД 31765002 .
- ^ Авраам Дж. (февраль 2009 г.). «Достижения в лечении множественной миеломы: леналидомид и бортезомиб». Общественная онкология . 6 (2): 53–55. дои : 10.1016/S1548-5315(11)70208-X .
- ^ Сонневельд П., Димопулос М.А., Боккадоро М., Куах Х., Хо П.Дж., Бексак М., Хулин С., Антониоли Е., Лелеу Икс, Мангиакавалли С., Перро А., Каво М., Белотти А., Бройл А., Гей Ф (12 декабря 2023 г.). «Даратумумаб, бортезомиб, леналидомид и дексаметазон при множественной миеломе» . Медицинский журнал Новой Англии . 390 (4): 301–313. дои : 10.1056/NEJMoa2312054 . ISSN 0028-4793 . ПМИД 38084760 . S2CID 266217426 .
- ^ Джонсон В.Дж., Кайл Р.А., Пинеда А.А., О'Брайен ПК, Холли К.Э. (апрель 1990 г.). «Лечение почечной недостаточности, связанной с множественной миеломой. Плазмаферез, гемодиализ и химиотерапия». Архив внутренней медицины . 150 (4): 863–869. doi : 10.1001/archinte.1990.00390160111022 . ПМИД 2183734 .
- ^ Пол М., Уокер Ф., Беар Р.А. (ноябрь 1982 г.). «Терапия плазмаферезом у больного множественной миеломой» . Журнал Канадской медицинской ассоциации . 127 (10):956. ПМЦ 1862296 . ПМИД 7139441 .
- ^ Маккарти П.Л., Гольштейн С.А., Петруччи М.Т., Ричардсон П.Г., Хулин С., Този П. и др. (октябрь 2017 г.). «Поддержка леналидомида после трансплантации аутологичных стволовых клеток при впервые диагностированной множественной миеломе: метаанализ» . Журнал клинической онкологии . 35 (29): 3279–3289. дои : 10.1200/JCO.2017.72.6679 . ПМЦ 5652871 . ПМИД 28742454 .
- ^ Зонневельд П., Шмидт-Вольф И.Г., ван дер Холт Б., Эль Джарари Л., Берч У., Салвендер Х. и др. (август 2012 г.). «Индукционная и поддерживающая терапия бортезомибом у пациентов с впервые выявленной множественной миеломой: результаты рандомизированного исследования III фазы HOVON-65/GMMG-HD4» . Журнал клинической онкологии . 30 (24): 2946–2955. дои : 10.1200/JCO.2011.39.6820 . hdl : 1765/73197 . ПМИД 22802322 . Архивировано из оригинала 18 августа 2023 года . Проверено 23 декабря 2022 г.
- ^ Раджкумар С.В. (июнь 2019 г.). «Множественная миелома: каждый год новый стандарт?» . Гематологическая онкология . 37 (Приложение 1): 62–65. дои : 10.1002/hon.2586 . ПМК 6570407 . ПМИД 31187526 .
- ^ «FDA выдало ускоренное одобрение белантамаба мафодотина-blmf для лечения множественной миеломы» . США Управление по контролю за продуктами и лекарствами (FDA). 5 августа 2020 года. Архивировано из оригинала 6 августа 2020 года . Проверено 6 августа 2020 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «FDA одобрило препарат BLENREP компании GSK (белантамаб мафодотин-blmf) для лечения пациентов с рецидивирующей или рефрактерной множественной миеломой» (пресс-релиз). ГлаксоСмитКляйн. 6 августа 2020 г. Проверено 6 августа 2020 г. - через Business Wire.
- ^ «Кипролис (карфилзомиб) для инъекций, для внутривенного применения. Полная информация о назначении» (PDF) . Таузенд-Оукс, Калифорния: Onyx Pharmaceuticals. Архивировано из оригинала (PDF) 23 октября 2016 года . Проверено 20 августа 2016 г.
- ^ «Дарзалекс (даратумумаб) для инъекций для внутривенного применения. Полная информация о назначении» (PDF) . Хоршем, Пенсильвания: Janssen Biotech. Архивировано из оригинала (PDF) 18 августа 2016 года . Проверено 18 августа 2016 г.
- ^ «Эмплицити (элотузумаб) для инъекций и внутривенного применения. Полная информация о назначении» (PDF) . Принстон, Нью-Джерси: Компания Bristol-Myers Squibb. Архивировано из оригинала (PDF) 8 декабря 2015 года . Проверено 18 августа 2016 г.
- ^ «FDA одобрило изатуксимаб-IRFC для лечения множественной миеломы» . США Управление по контролю за продуктами и лекарствами (FDA). 2 марта 2020 года. Архивировано из оригинала 5 марта 2020 года . Проверено 2 марта 2020 г.
- ^ Мартин Т.Г., Корсо К., Хирон М., Вельде Х.В., Аббадесса Г., Кампана Ф. и др. (ноябрь 2019 г.). «Терапевтические возможности фармакологического ингибирования CD38 с помощью исатуксимаба» . Клетки . 8 (12): 1522. doi : 10.3390/cells8121522 . ПМК 6953105 . ПМИД 31779273 .
- ^ «Нинларо (иксазомиб) Капсулы для перорального применения. Полная информация о назначении» (PDF) . Millennium Pharmaceuticals, Inc. Архивировано из оригинала (PDF) 19 августа 2016 года . Проверено 18 августа 2016 г.
- ^ «Капсулы Фаридак (панобиностат) для перорального применения. Полная информация по назначению» (PDF) . Восточный Ганновер, Нью-Джерси: Novartis Pharmaceuticals Corporation. Архивировано из оригинала (PDF) 22 октября 2016 года . Проверено 18 августа 2016 г.
- ^ «Таблетки Xpovio (селинексор) для перорального применения. Полная информация о назначении» (PDF) . Ньютон, Массачусетс: Karyopharm Therapeutics. Архивировано из оригинала (PDF) 3 августа 2019 года . Проверено 3 августа 2019 г.
- ^ Jump up to: а б «FDA одобрило первую клеточную генную терапию для взрослых пациентов с множественной миеломой» (пресс-релиз). Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США; FDA . 27 марта 2021 г.
- ^ «FDA предоставляет ускоренное одобрение талькетамаба-тгвс для лечения рецидивирующей или рефрактерной множественной миеломы» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 9 августа 2023 года. Архивировано из оригинала 11 августа 2023 года . Проверено 10 августа 2023 г.
- ^ «FDA США одобрило Талви (талкетамаб-тгвс), первый в своем классе биспецифический препарат для лечения пациентов с множественной миеломой, предварительно получавшей интенсивное лечение» (пресс-релиз). Янссен. 10 августа 2023 г. Проверено 17 августа 2023 г. - через PR Newswire.
- ^ «FDA предоставляет ускоренное одобрение элранатамаба-bcmm для лечения множественной миеломы» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 14 августа 2023 г. Проверено 14 августа 2023 г.
- ^ «Элрексфио компании Pfizer получает ускоренное одобрение FDA США для лечения рецидивирующей или рефрактерной множественной миеломы» (пресс-релиз). Пфайзер. 14 августа 2023 г. Проверено 17 августа 2023 г. - через Business Wire.
- ^ Jump up to: а б с Фишер С.А., Катлер А., Дори С., Бранскилл С.Дж., Стэнворт С.Дж., Наваррете С., Гердлстоун Дж. и др. (Кокрейновская группа по гематологическим злокачественным новообразованиям) (январь 2019 г.). «Мезенхимальные стромальные клетки как лечение или профилактика острой или хронической реакции трансплантат против хозяина у реципиентов трансплантата гемопоэтических стволовых клеток (ТГСК) с гематологическими заболеваниями» . Кокрановская база данных систематических обзоров . 1 (1): CD009768. дои : 10.1002/14651858.CD009768.pub2 . ПМК 6353308 . ПМИД 30697701 .
- ^ «Мозобил-плерикса для инъекций, раствор» . ДейлиМед . 26 июня 2023 г. Проверено 13 сентября 2023 г.
- ^ «BioLineRx объявляет об одобрении FDA препарата Афексда (мотиксафортид) в сочетании с филграстимом (G-CSF) для мобилизации гемопоэтических стволовых клеток для сбора и последующей аутологичной трансплантации пациентам с множественной миеломой» (пресс-релиз). BioLineRx Ltd. 11 сентября 2023 г. . Проверено 13 сентября 2023 г. - через PR Newswire.
- ^ Jump up to: а б «FDA одобрило цилтакабтагеновый аутолейцел для лечения рецидивирующей или рефрактерной множественной миеломы» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 7 марта 2022 года. Архивировано из оригинала 17 марта 2022 года . Проверено 16 марта 2022 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Эсткорт Л., Стэнворт С., Дори С., Хоупвелл С., Мерфи М.Ф., Тинмут А., Хеддл Н. и др. (Кокрейновская группа по гематологическим злокачественным новообразованиям) (май 2012 г.). «Профилактическое переливание тромбоцитов для профилактики кровотечений у больных с гематологическими заболеваниями после химиотерапии и трансплантации стволовых клеток». Кокрейновская база данных систематических обзоров (5): CD004269. дои : 10.1002/14651858.CD004269.pub3 . ПМИД 22592695 .
- ^ Эсткорт Л.Дж., Стэнворт С.Дж., Дори С., Хоупвелл С., Тривелла М., Мерфи М.Ф. и др. (Кокрейновская группа по гематологическим злокачественным новообразованиям) (ноябрь 2015 г.). «Сравнение различных пороговых значений количества тромбоцитов для определения профилактического переливания тромбоцитов для предотвращения кровотечений у людей с гематологическими заболеваниями после миелосупрессивной химиотерапии или трансплантации стволовых клеток» . Кокрановская база данных систематических обзоров . 2015 (11): CD010983. дои : 10.1002/14651858.CD010983.pub2 . ПМЦ 4717525 . ПМИД 26576687 .
- ^ Jump up to: а б с Книпс Л., Бергенталь Н., Стрекманн Ф., Монсеф И., Эльтер Т., Скетц Н. и др. (Кокрейновская группа по гематологическим злокачественным новообразованиям) (январь 2019 г.). «Аэробные физические упражнения для взрослых пациентов со злокачественными новообразованиями крови» . Кокрановская база данных систематических обзоров . 1 (1): CD009075. дои : 10.1002/14651858.CD009075.pub3 . ПМК 6354325 . ПМИД 30702150 .
- ^ Американское общество клинической онкологии дало эту рекомендацию на основании различных видов рака. Видеть Американское общество клинической онкологии , «Пять вопросов, которые должны задать врачи и пациенты» (PDF) , Мудрый выбор: инициатива Фонда ABIM , Американское общество клинической онкологии , заархивировано из оригинала (PDF) 31 июля 2012 г. , получено 14 августа 2012 год
- ^ Сноуден Дж.А., Ахмедзай С., Эшкрофт Дж. и др. (2010). «Руководство по поддерживающей терапии при миеломе» (PDF) . Британский комитет стандартов в гематологии. Архивировано из оригинала (PDF) 23 сентября 2015 года . Проверено 21 августа 2014 г.
- ^ Хиггинсон И.Дж., Эванс С.Дж. (2010). «Какие доказательства того, что команды паллиативной помощи улучшают результаты лечения онкологических больных и их семей?» . Раковый журнал . 16 (5): 423–435. дои : 10.1097/PPO.0b013e3181f684e5 . ПМИД 20890138 . S2CID 39881122 .
- ^ Лоренц К.А., Линн Дж., Дай С.М., Шугарман Л.Р., Уилкинсон А., Муларски Р.А. и др. (январь 2008 г.). «Доказательства улучшения паллиативной помощи в конце жизни: систематический обзор» . Анналы внутренней медицины . 148 (2): 147–159. дои : 10.7326/0003-4819-148-2-200801150-00010 . ПМИД 18195339 .
- ^ Сайгин Д., Табиб Т., Биттар Х.Э., Валензи Э., Сембрат Дж., Чан С.Ю. и др. (2 мая 2018 г.). «Транскрипционное профилирование популяций клеток легких при идиопатической легочной артериальной гипертензии» . Легочное кровообращение . 10 (1): 383–399. дои : 10.12968/denu.2018.45.5.383 . ПМК 7052475 . ПМИД 32166015 .
- ^ Jump up to: а б «Миелома — факты о статистике рака» . ПРОИДЧИК . Архивировано из оригинала 7 мая 2020 года . Проверено 17 апреля 2020 г.
- ^ Чайлд Дж.А., Морган Г.Дж., Дэвис Ф.Е., Оуэн Р.Г., Белл С.Э., Хокинс К. и др. (май 2003 г.). «Высокодозная химиотерапия с восстановлением гемопоэтических стволовых клеток при множественной миеломе» . Медицинский журнал Новой Англии . 348 (19): 1875–1883. doi : 10.1056/NEJMoa022340 . ПМИД 12736280 . S2CID 41048909 .
- ^ Авет-Луазо Х., Ли С., Магранжеас Ф., Гуро В., Шарбоннель С., Харуссо Дж.Л. и др. (сентябрь 2009 г.). «Прогностическое значение изменений количества копий при множественной миеломе» . Журнал клинической онкологии . 27 (27): 4585–4590. дои : 10.1200/JCO.2008.20.6136 . ПМК 2754906 . ПМИД 19687334 .
- ^ Сайгин Д., Табиб Т., Биттар Х.Э., Валензи Э., Сембрат Дж., Чан С.Ю. и др. (2021). «Транскрипционное профилирование популяций клеток легких при идиопатической легочной артериальной гипертензии» . Легочное кровообращение . 10 (1): 361–370. дои : 10.1177/2045894020908782 . ПМК 7052475 . ПМИД 32166015 .
- ^ «Оценки ВОЗ по болезням и травмам в странах» . Всемирная организация здравоохранения . 2009. Архивировано из оригинала 11 ноября 2009 года . Проверено 11 ноября 2009 г.
- ^ ГББ 2013 Смертность и причины смерти Соавторы (январь 2015 г.). «Глобальная, региональная и национальная смертность от всех причин и по конкретным причинам в разбивке по возрасту и по конкретным причинам по 240 причинам смерти, 1990-2013 гг.: систематический анализ для исследования глобального бремени болезней, 2013 г.» . Ланцет . 385 (9963): 117–171. дои : 10.1016/s0140-6736(14)61682-2 . ПМК 4340604 . ПМИД 25530442 .
{{cite journal}}:|author1=имеет общее имя ( справка ) CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Компакт-диск Коллинза (ноябрь 2005 г.). «Проблемы мониторинга реакции при множественной миеломе» . Визуализация рака . 5 Спецификация A (Спецификация A): S119–S126. дои : 10.1102/1470-7330.2005.0033 . ПМЦ 1665317 . ПМИД 16361127 .
- ^ Браун Л.М., Линет М.С., Гринберг Р.С., Сильверман Д.Т., Хейс Р.Б., Суонсон Г.М. и др. (июнь 1999 г.). «Множественная миелома и семейный анамнез рака среди чернокожих и белых в США» . Рак . 85 (11). Уайли: 2385–2390. doi : 10.1002/(sici)1097-0142(19990601)85:11<2385::aid-cncr13>3.0.co;2-a . ПМИД 10357409 . S2CID 41616510 .
- ^ Сайгин Д., Табиб Т., Биттар Х.Э., Валензи Э., Сембрат Дж., Чан С.Ю. и др. (6 декабря 2014 г.). «Транскрипционное профилирование популяций клеток легких при идиопатической легочной артериальной гипертензии» . Легочное кровообращение . 10 (1). Американское общество гематологии: 1292. doi : 10.1182/blood.v124.21.1292.1292 . ПМК 7052475 . ПМИД 32166015 .
- ^ «Статистика миеломы» . Исследования рака Великобритании . Архивировано из оригинала 28 октября 2014 года . Проверено 28 октября 2014 г.
- ^ Эттингер С.Дж., Фельдман ЕС (1 июня 2000 г.). Учебник ветеринарной внутренней медицины: Болезни собак и кошек . Том. 1. У.Б. Сондерс. стр. 516–9. ISBN 978-0-7216-7257-1 .
- ^ Макаллистер С., Куаллс С., Тайлер Р., Рут CR (август 1987 г.). «Множественная миелома у лошади». Журнал Американской ветеринарной медицинской ассоциации . 191 (3): 337–339. ПМИД 3654300 .
- ^ Jump up to: а б с Матус Р.Э., Лейфер К.Э., МакИвен Э.Г., Хурвиц А.И. (июнь 1986 г.). «Прогностические факторы множественной миеломы у собак». Журнал Американской ветеринарной медицинской ассоциации . 188 (11): 1288–1292. ПМИД 3721983 .
- ^ МакИвен Э.Г., Гурвиц А.И. (февраль 1977 г.). «Диагностика и лечение моноклональных гаммапатий». Ветеринарные клиники Северной Америки . 7 (1): 119–132. дои : 10.1016/S0091-0279(77)50010-X . ПМИД 403649 .














