Модулятор лигазы Цереблона Е3
| Модулятор лигазы Цереблона Е3 | |
|---|---|
| Класс препарата | |
 Талидомид | |
| Идентификаторы классов | |
| Использовать | Узловатая эритема, лепрозная эритема , множественная миелома , миелодиспластический синдром , острый миелолейкоз и другие иммунологические состояния. |
| код АТС | L04AX |
| Биологическая цель | TNF , IL-6 , VEGF , NF-kB и т. д. |
| Клинические данные | |
| Drugs.com | Классы наркотиков |
| Юридический статус | |
| В Викиданных | |
Модуляторы лигазы E3 Цереблона , также известные как иммуномодулирующие имидные препараты ( ИМиД ), представляют собой класс иммуномодулирующих препаратов. [ 1 ] (препараты, регулирующие иммунные реакции ), содержащие имидную группу. В класс ИМиД входят талидомид и его аналоги ( леналидомид , помалидомид , мезигдомид) . и ибердомид ). [ 1 ] Эти препараты также можно назвать «модуляторами Цереблона». Цереблон (CRBN) — это белок, на который воздействуют препараты этого класса.
Название «IMiD» отсылает как к «IMD», что означает «иммуномодулирующий препарат», так и к формам «имид » , «имидо- », «имид- » и «имид» .
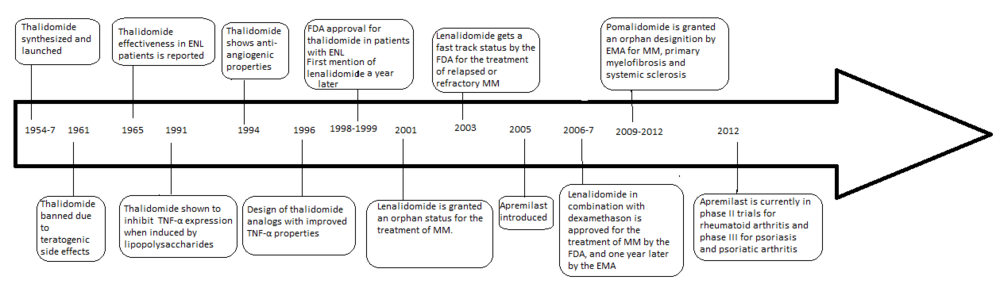
Разработка аналогов талидомида была ускорена открытием антиангиогенных и противовоспалительных свойств препарата, что позволило создать новый способ борьбы с раком, а также некоторыми воспалительными заболеваниями после его запрета в 1961 году. Проблемы с талидомидом включали тератогенные побочные эффекты, высокая частота других побочных реакций, плохая растворимость в воде и плохая абсорбция из кишечника.
США (FDA) одобрило талидомид В 1998 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов для применения при впервые диагностированной множественной миеломе (ММ) в соответствии со строгими правилами. [ 2 ] Это привело к разработке ряда аналогов с меньшим количеством побочных эффектов и повышенной эффективностью , в том числе леналидомид и помалидомид , которые в настоящее время продаются и производятся компанией Celgene .
История
[ редактировать ]Талидомид был первоначально выпущен в Федеративной Республике Германия (Западная Германия) под маркой Contergan 1 октября 1957 года компанией Chemie Grünenthal (ныне Grünenthal ). Препарат в первую очередь назначался как успокаивающее или снотворное средство, но его также использовали как противорвотное средство при утренней тошноте у беременных женщин. Препарат был запрещен в 1961 году после того, как были обнаружены его тератогенные свойства. Проблемы с талидомидом, помимо тератогенных побочных эффектов, заключались в высокой частоте других побочных реакций, а также в плохой растворимости в воде и всасывании из кишечника . [ 3 ] [ 4 ] Побочные реакции включают периферическую нейропатию у подавляющего большинства пациентов, запоры , тромбоэмболии , а также дерматологические осложнения. [ 5 ]
Через четыре года после того, как талидомид был изъят с рынка из-за его способности вызывать тяжелые врожденные дефекты, его противовоспалительные свойства были обнаружены, когда пациенты с узловатой лепрозной эритемой (ЭНЛ) использовали талидомид в качестве седативного средства, и он уменьшил как клинические признаки, так и симптомы заболевания. болезнь. В 1991 году было обнаружено, что талидомид ингибирует фактор некроза опухоли-альфа (TNF-α) (5a Sampaio, Sarno, Galilly Cohn and Kaplan, JEM 173 (3) 699–703, 1991). TNF-α — цитокин, продуцируемый макрофагами иммунной системы, а также медиатор воспалительной реакции. Таким образом, препарат эффективен против некоторых воспалительных заболеваний, таких как ЭНЛ (6а Сампайо, Каплан, Миранда, Нери..... JID 168 (2) 408-414 2008). В 1994 году было обнаружено, что талидомид обладает антиангиогенной активностью. [ 6 ] и противоопухолевая активность [ 7 ] что послужило толчком к началу клинических испытаний рака, включая множественную миелому. Открытие противовоспалительной, антиангиогенной и противоопухолевой активности талидомида повысило интерес к дальнейшим исследованиям и синтезу более безопасных аналогов. [ 8 ] [ 9 ]
Леналидомид — первый аналог талидомида, поступивший на рынок. Он значительно более эффективен, чем его исходный препарат, и имеет только два различия на молекулярном уровне: добавление аминогруппы в положении 4 фталоильного кольца и удаление карбонильной группы из фталоильного кольца. [ 10 ] Разработка леналидомида началась в конце 1990-х годов, а клинические испытания леналидомида начались в 2000 году. В октябре 2001 года леналидомиду был присвоен статус орфанного препарата для лечения ММ. В середине 2002 года он вступил в фазу II, а к началу 2003 года — в фазу III. В феврале 2003 г. FDA предоставило леналидомиду ускоренный статус для лечения рецидивирующей или рефрактерной ММ. [ 8 ] В 2006 году он был одобрен для лечения ММ наряду с дексаметазоном, а в 2007 году – Европейским агентством лекарственных средств (EMA). В 2008 году исследование фазы II выявило эффективность препарата при лечении неходжкинской лимфомы . [ 11 ]
Помалидомид (3-аминоталидомид) был вторым аналогом талидомида, поступившим в клинику, и оказался более эффективным, чем оба его предшественника. [ 12 ] Впервые сообщалось в 2001 году, что помалидомид напрямую ингибирует пролиферацию клеток миеломы и, таким образом, ингибирует ММ как в опухолевых, так и в сосудистых компартментах. [ 13 ] Эта двойная активность помалидомида делает его более эффективным, чем талидомид, как in vitro , так и in vivo . [ 14 ] Этот эффект не связан с ингибированием TNF-α, поскольку мощные ингибиторы TNF-α, такие как ролипрам и пентоксифиллин, не ингибируют рост клеток миеломы и ангиогенез. [ 9 ] Сообщалось о повышении уровня интерферона гамма, IL-2 и IL-10 для помалидомида, что может способствовать его антиангиогенной и антимиеломной активности.
Разработка
[ редактировать ]Молекула талидомида представляет собой синтетическое производное глутаминовой кислоты и состоит из глутаримидного кольца и фталоильного кольца (рис. 5). [ 15 ] [ 16 ] Его название IUPAC - 2-(2,6-диоксопиперидин-3-ил)изоиндол-1,3-дион, он имеет один хиральный центр. [ 15 ] После того как стало известно о избирательном ингибировании ФНО-α талидомидом, были предприняты новые усилия по клинической разработке талидомида. Клинические разработки привели к открытию новых аналогов, которые имели улучшенную активность и уменьшали побочные эффекты. [ 8 ] [ 17 ]
Клинически талидомид всегда использовался в качестве рацемата . Обычно S - изомер связан с печально известным тератогенным действием талидомида, а R -изомер лишен тератогенных свойств, но оказывает седативное действие. [ 8 ] однако эта точка зрения широко обсуждается, и утверждалось, что модель на животных, эти различные R- и S на которой наблюдались -эффекты, не была чувствительна к тератогенным эффектам талидомида. Более поздние исследования на кроликах, которые являются чувствительным видом, выявили тератогенные эффекты обоих изомеров. [ 8 ] [ 15 ] [ 16 ] [ 17 ] Более того, было показано, что энантиомеры талидомида взаимопревращаются in vivo благодаря кислому хиральному водороду в асимметричном центре (показано для аналога EM-12 на рисунке 3). [ 16 ] [ 17 ] поэтому план по введению очищенного одиночного энантиомера во избежание тератогенных эффектов, скорее всего, окажется напрасным. [ 8 ] [ 15 ] [ 16 ]
Разработка леналидомида и помалидомида
[ редактировать ]
Один из представляющих интерес аналогов был получен изоиндолиноновым замещением фталоильного кольца. Ему было присвоено название ЭМ-12 (рис. 3). Считалось, что эта замена увеличивает биодоступность вещества из-за повышенной стабильности. Сообщалось, что эта молекула является даже более сильным тератогенным агентом, чем талидомид, у крыс, кроликов и обезьян. Кроме того, эти аналоги являются более мощными ингибиторами ангиогенеза, чем талидомид. [ 13 ] Кроме того, аминоталидомид и амино-ЕМ-12 были мощными ингибиторами TNF-α. [ 16 ] Эти два аналога позже получили название леналидомид (аминоаналог ЕМ-12) и помалидомид (аминоаналог талидомида). [ 8 ]
Медицинское использование
[ редактировать ]Основное применение IMiD в медицине приходится на лечение рака и аутоиммунных заболеваний (в том числе тех, которые являются ответом на инфекцию проказы ). [ 18 ] Показания к применению этих агентов, получивших одобрение регулирующих органов, включают: [ 19 ]
- Миелодиспластический синдром , предвестник острого миелолейкоза
- Узловатая эритема , осложнение проказы
- Множественная миелома
Показания, не указанные в инструкции, для которых они кажутся многообещающими, включают: [ 20 ]
- Лимфома Ходжкина
- Амилоидоз, связанный с легкими цепями (AL)
- Первичный миелофиброз (ПМФ)
- Острый миелоидный лейкоз (ОМЛ)
- Рак простаты
- Метастатический почечно-клеточный рак (мПКР)
Талидомид
[ редактировать ]Талидомид был одобрен FDA для лечения ЭНЛ и ММ в сочетании с дексаметазоном . EMA также одобрило его для лечения ММ в сочетании с преднизоном и/или мелфаланом . Орфанные показания по мнению FDA включают реакцию «трансплантат против хозяина» , микобактериальную инфекцию, рецидивирующие афтозные язвы , тяжелый рецидивирующий афтозный стоматит , связанный со СПИДом истощения , первичные злокачественные новообразования головного мозга, синдром Крона , болезнь , саркому Капоши , миелодиспластический синдром и трансплантацию гемопоэтических стволовых клеток . [ 21 ] [ 22 ]
Леналидомид
[ редактировать ]Леналидомид одобрен почти в 70 странах в сочетании с дексаметазоном для лечения пациентов с ММ, получивших хотя бы один предшествующий курс терапии. Орфанные показания включают диффузную крупноклеточную В-клеточную лимфому , хронический лимфоцитарный лейкоз и лимфому из мантийных клеток . Леналидомид также одобрен для лечения трансфузионно-зависимой анемии, вызванной миелодиспластическими синдромами низкого или среднего риска 1, связанными с цитогенетической аномалией делеции 5q с дополнительными цитогенетическими аномалиями или без них в США, Канаде, Швейцарии, Австралии, Новой Зеландии, Малайзии, Израиле и других странах. в нескольких странах Латинской Америки, в то время как заявка на получение регистрационного удостоверения в настоящее время рассматривается в ряде других стран. [ 23 ] [ 24 ] Многочисленные клинические испытания уже находятся в стадии разработки или проводятся для изучения дальнейшего использования леналидомида, отдельно или в сочетании с другими препаратами. Некоторые из этих показаний включают острый миелолейкоз , фолликулярную лимфому , MALT-лимфому , макроглобулинемию Вальденстрема , красную волчанку , лимфому Ходжкина , миелодиспластический синдром и другие. [ 25 ] [ 26 ]
Помалидомид
[ редактировать ]Помалидомид был подан на одобрение FDA 26 апреля 2012 г. [ 27 ] а 21 июня было объявлено, что препарат пройдет стандартную проверку FDA. Заявка на получение регистрационного удостоверения была подана в EMA 21 июня 2012 г., решение по которой может быть принято уже в начале 2013 г. EMA уже предоставило помалидомиду статус «сиротского» для лечения первичного миелофиброза , ММ, системного склероза , постполицитемии и постэссенциального тромбоцитемического миелофиброза. [ 28 ]
Побочные эффекты
[ редактировать ]Основными проявлениями токсичности одобренных IMiDs являются периферическая нейропатия , тромбоцитопения , анемия и венозная тромбоэмболия . [ 20 ] может быть повышен риск вторичных злокачественных новообразований, особенно острого миелолейкоза . У тех, кто получает IMiD, [ 20 ]
Тератогенность
[ редактировать ]Тератогенность талидомида была предметом многочисленных дискуссий, и на протяжении многих лет множество гипотез было предложено . Двумя наиболее известными из них являются гипотеза антиангиогенеза и гипотеза модели окислительного стресса, при этом имеются значительные экспериментальные данные, подтверждающие эти две гипотезы относительно тератогенности талидомида. [ 29 ]
Недавно появились новые данные, которые предполагают новый механизм тератогенности. Цереблон представляет собой белок массой 51 кДа , локализованный в цитоплазме , ядре и периферической мембране клеток во многих частях тела. [ 30 ] Он действует как компонент убиквитинлигазы Е3 , регулируя различные процессы развития, включая эмбриогенез , канцерогенез и регуляцию клеточного цикла, посредством деградации ( убиквитинирования ) неизвестных субстратов. Было показано, что талидомид связывается с цереблоном, ингибируя активность убиквитинлигазы Е3, что приводит к накоплению субстратов лигазы и подавлению фактора роста фибробластов 8 (FGF8) и FGF10 . Это нарушает петлю положительной обратной связи между двумя факторами роста, возможно, вызывая как множественные врожденные дефекты, так и противомиеломные эффекты.
Результаты также подтверждают гипотезу о том, что увеличение экспрессии цереблона является важным элементом противомиеломного эффекта как леналидомида, так и помалидомида. [ 29 ] Экспрессия цереблона была в три раза выше у пациентов, ответивших на лечение, по сравнению с пациентами, не ответившими на лечение, причем более высокая экспрессия цереблона также была связана с частичным или полным ответом, тогда как более низкая экспрессия была связана со стабильным или прогрессирующим заболеванием. [ 30 ]
Механизм действия
[ редактировать ]Механизм их действия не совсем ясен, но известно, что они ингибируют выработку фактора некроза опухоли , интерлейкина 6 и иммуноглобулина G и VEGF (что приводит к его антиангиогенному эффекту), ко-стимулируют Т-клетки и NK-клетки и увеличивает выработку интерферона гамма и интерлейкина 2 . [ 31 ] [ 32 ] [ 33 ] Их тератогенные эффекты, по-видимому, опосредованы связыванием с цереблоном . [ 34 ]
Считается, что талидомид и его аналоги, леналидомид и помалидомид, действуют аналогичным образом, хотя точный механизм их действия еще полностью не изучен. Считается, что при различных заболеваниях они действуют через разные механизмы. Общий эффект, вероятно, обусловлен сочетанием различных механизмов. Механизм действия будет объяснен в свете сегодняшних знаний.
Талидомид, леналидомид и помалидомид
[ редактировать ]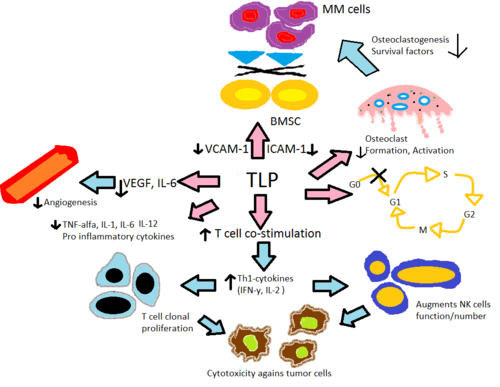
Изменение выработки цитокинов
[ редактировать ]Талидомид и его иммуномодулирующие аналоги изменяют выработку воспалительных цитокинов TNF-α, IL-1 , IL-6 , IL-12 и противовоспалительного цитокина IL-10 . [ 30 ] Считается, что аналоги ингибируют выработку TNF-α, при этом аналоги в 50 000 раз более эффективны in vitro, чем исходный препарат талидомид. [ 35 ] Считается, что этот механизм заключается в усилении деградации мРНК TNF-α , что приводит к уменьшению количества секретируемого провоспалительного цитокина. [ 36 ] Это объясняет эффект талидомида при назначении пациентам с ЭНЛ, поскольку у них обычно наблюдается высокий уровень TNF-α в крови и при дерматологических поражениях. [ 8 ] Напротив, анализ in vitro продемонстрировал, что TNF-α на самом деле усиливается при активации Т-клеток, когда CD4+ и CD8+ Т-лимфоциты стимулируются анти-CD3. [ 8 ] [ 35 ] что позже было подтверждено в исследованиях ранней фазы, включающих солидные опухоли и воспалительные дерматологические заболевания. [ 36 ] IL-12 — еще один цитокин, который одновременно подавляется и усиливается талидомидом и его аналогами. Когда моноциты стимулируются липополисахаридами , продукция IL-12 подавляется, но во время стимуляции Т-клеток продукция увеличивается. [ 35 ]
Считается, что леналидомид примерно в 1000 раз более эффективен in vitro, чем талидомид по противовоспалительным свойствам, а помалидомид примерно в 10 раз более эффективен, чем леналидомид. Однако стоит отметить, что при сравнении леналидомида и помалидомида клиническая значимость более высокой эффективности in vitro неясна, поскольку максимально переносимая доза помалидомида составляет 2 мг в день по сравнению с 25 мг леналидомида, что приводит к снижению концентрации препарата в плазме в 10–100 раз. помалидомид. [ 37 ]
Активация Т-клеток
[ редактировать ]Талидомид и его аналоги способствуют совместной стимуляции Т-клеток через комплекс B7 - CD28 путем фосфорилирования тирозина на рецепторе CD28. [ 8 ] Данные in vitro показывают, что эта совместная стимуляция приводит к увеличению Th1 высвобождения цитокинов типа IFN-γ и IL-2, что дополнительно стимулирует пролиферацию клональных Т-клеток, а также пролиферацию и активность естественных клеток-киллеров . Это усиливает естественную и антителозависимую клеточную цитотоксичность . [ 38 ] Леналидомид и помалидомид примерно в 100–1000 раз более эффективны в стимуляции клональной пролиферации Т-клеток, чем талидомид. Кроме того, in vitro данные позволяют предположить, что помалидомид превращает клетки Th2 в Th1 за счет усиления транскрипционного фактора T-bet . [ 30 ]
Антиангиогенез
[ редактировать ]Сообщалось, что ангиогенез или рост новых кровеносных сосудов соответствуют прогрессированию ММ, где фактор роста эндотелия сосудов (VEGF) и его рецептор bFGF [ 8 ] и Ил-6 [ 35 ] по-видимому, необходимы для миграции эндотелиальных клеток во время ангиогенеза. Считается, что талидомид и его аналоги подавляют ангиогенез посредством модуляции вышеупомянутых факторов, при этом эффективность антиангиогенной активности леналидомида и помалидомида была в 2-3 раза выше, чем у талидомида в различных in vivo . анализах [ 39 ] Также было показано, что талидомид блокирует активность NF-κB посредством блокирования IL-6, а NF-κB участвует в ангиогенезе. [ 35 ] Ингибирование TNF-α не является механизмом ингибирования ангиогенеза талидомидом, поскольку многие другие ингибиторы TNF-α не ингибируют ангиогенез. [ 6 ]
Противоопухолевая активность
[ редактировать ]Считается, что противоопухолевая активность талидомида in vivo обусловлена мощным антиангиогенным эффектом, а также изменениями в экспрессии цитокинов. Анализы in vitro на апоптоз в клетках ММ показали, что при лечении талидомидом и его аналогами повышается активность каспазы-8 . Это вызывает перекрестную передачу апоптотических сигналов между каспазой-8 и каспазой-9, что приводит к непрямому повышению активности каспазы-9. [ 30 ] [ 36 ] Дальнейшая противоопухолевая активность опосредуется ингибированием апоптоза белка-2. [ 39 ] , способствующие выживанию и эффекты IGF-1 , повышение чувствительности к FAS-опосредованной гибели клеток и усиление связанного с TNF лиганда, индуцирующего апоптоз . [ 36 ] Также было показано, что они вызывают дозозависимую G0 / G1 остановку клеточного цикла в линиях клеток лейкемии. [ 35 ] где аналоги показали в 100 раз большую эффективность, чем талидомид. [ 37 ]
Среда костного мозга
[ редактировать ]Роль ангиогенеза в поддержке миеломы была впервые обнаружена Ваккой в 1994 году. [ 40 ] Они обнаружили, что усиление ангиогенеза в костном мозге коррелирует с ростом миеломы, а поддерживающие стромальные клетки являются важным источником ангиогенных молекул при миеломе. Считается, что это основной компонент механизма in vivo, с помощью которого талидомид ингибирует множественную миелому.
Кроме того, считается, что воспалительные реакции в костном мозге способствуют развитию многих гематологических заболеваний. Секреция IL-6 костного мозга стромальными клетками (BMSC) и секреция молекул адгезии VCAM-1 , ICAM-1 и LFA индуцируются в присутствии TNF-α и адгезии клеток ММ к BMSC. IL-6 способствует пролиферации клеточных линий ММ in vitro и ингибированию Fas-опосредованного апоптоза. [ 36 ] Талидомид и его аналоги напрямую снижают активацию IL-6 и опосредованно через TNF-α, тем самым снижая секрецию молекул адгезии, что приводит к меньшему количеству клеток ММ, прикрепляющихся к BMSC. Остеокласты становятся высокоактивными во время ММ, что приводит к резорбции кости и секреции различных факторов выживания ММ. Они снижают уровни молекул адгезии , имеющих первостепенное значение для активации остеокластов, уменьшают образование клеток, образующих остеокласты, и подавляют катепсин К , важную цистеиновую протеазу, экспрессируемую в остеокластах. [ 39 ]
Отношения структура-деятельность
[ редактировать ]
Поскольку механизм действия талидомида и его аналогов не до конца ясен, а биорецептор этих веществ не идентифицирован, понимание взаимосвязи между структурой и активностью талидомида и его аналогов в основном основано на молекулярном моделировании и продолжающихся научных исследованиях. . [ 17 ] [ 41 ] Информация об SAR талидомида и его аналогов все еще находится в обработке, поэтому любые тенденции, описанные здесь, наблюдаются в ходе отдельных исследований. Исследования в основном были сосредоточены на улучшении ингибирования TNF-α и PDE4 талидомидом. [ 8 ] [ 15 ] а также антиангиогенезная активность. [ 42 ] [ 43 ]
Ингибиторы TNF-α (не через PDE4)
[ редактировать ]Исследования показали, что замена фталоильного кольца увеличит ингибирующую активность TNF-α (рис. 5). Замену аминогруппы тестировали в различных местах фталоильного кольца (C4, C5, C6, C7) талидомида и EM-12 (описанных ранее). Добавление аминокислоты в положение C4 как на талидомиде, так и на EM-12 привело к гораздо более сильному ингибированию TNF-α. Это также показало, что для наиболее мощной активности аминогруппа должна находиться прямо напротив карбонильной группы в кольцевой системе изоиндолинона. [ 44 ] Эти аналоги не ингибируют ФДЭ4 и, следовательно, не ингибируют ФДЭ4. Другие добавления более длинных и крупных групп в положениях C4 и C5 фталоильной кольцевой системы талидомида, некоторые из которых имеют олефиновую функциональность, были протестированы с различными результатами. Повышенный ингибирующий эффект по сравнению с талидомидом был отмечен у групп, у которых атом кислорода был присоединен непосредственно к олефину C5 или C4. Добавление йода и брома к C4 или C5 приводило к равной или пониженной активности по сравнению с талидомидом. [ 45 ] Эти группы не сравнивали с леналидомидом или помалидомидом.
Ингибиторы ФДЭ4
[ редактировать ]

Общая структура аналогов, ингибирующих TNF-α посредством ингибирования PDE4, получена на основе гидролиза глутаримидного кольца талидомида. Эти аналоги не имеют кислого хирального водорода, в отличие от талидомида, и поэтому можно ожидать, что они будут хирально стабильными. [ 16 ]
В фенильном кольце 3,4-диалкоксифенильный фрагмент (рис. 6) является известным фармафором в ингибиторах PDE4, таких как ролипрам . Оптимальная активность достигается при наличии метоксигруппы в 4-м положении (X2) и более крупной группы, такой как циклопентокси, в 3-м положении углерода (X3). Однако аналоги талидомида, ингибирующие ФДЭ4, не соответствуют напрямую SAR аналогов ролипрама. Для аналогов талидомида этоксигруппа в X3 и метоксигруппа в X2, где X1 представляет собой просто водород, давали наибольшее ингибирование PDE4 и TNF-α. [ 15 ] Заместители большего размера, чем диэтокси, в положении X2–X3 имели пониженную активность. Эффекты этих замен, по-видимому, опосредованы стерическими эффектами. [ 16 ]
Для Y-позиции был исследован ряд групп. Замещенные амиды, размер которых превышает размер метиламида (CONHCH 3 ), снижают ингибирующую активность PDE4. [ 16 ] Используя карбоновую кислоту в качестве отправной точки, амидная группа обладает сходной ингибирующей активностью PDE4, но было показано, что обе группы значительно менее эффективны, чем группа метилового эфира, которая имела примерно шестикратное увеличение ингибирующей активности PDE4. Сульфоновая группа имела такое же ингибирование PDE4, как и группа метилового эфира. Наилучшее ингибирование ФДЭ4 наблюдалось при присоединении нитрильной группы, которая обладает в 32 раза большей ингибирующей активностью в отношении ФДЭ4, чем карбоновая кислота. [ 15 ] Таким образом, заместители у Y, приводящие к увеличению ингибирующей активности PDE4, располагались в следующем порядке:
- COOH ≤ CONH 2 ≤ COOCH 3 ≤ SO 2 CH 3 < CN
Были исследованы замены во фталоильном кольце, и было замечено, что нитрогруппы в положении C4 или C5 снижают активность, но аминозамещение C4 или C5 резко увеличивает ее. [ 16 ] Когда было исследовано замещение в положении 4 (Z) фталоильного кольца, оказалось, что гидроксильные и метоксигруппы делают аналог менее сильным ингибитором PDE4. Увеличение активности наблюдалось для амино и диметиламино в одинаковой степени, но метильная группа улучшала активность дальше, чем вышеупомянутые группы. Группа 4- N -ацетиламино имела несколько меньшую ингибирующую активность в отношении ФДЭ4 по сравнению с метильной группой, но еще больше повышала ингибирующую активность соединения в отношении ФНО-α. [ 15 ] Таким образом, заместители у Z, приводящие к увеличению ингибирующей активности PDE4, следовали в следующем порядке:
- N(CH 3 ) 2 ≤ NH 2 < NHC(O)CH 3 < CH 3
Ингибирование ангиогенеза
[ редактировать ]
Для активности ингибирования ангиогенеза, интактное глутаримидное по-видимому, необходимо кольцо. Различные группы тестировались в позиции R. Хорошую активность проявили вещества, имевшие в качестве R-группы соли азота. Улучшенная ингибирующая ангиогенез активность может быть обусловлена повышенной растворимостью или тем, что положительно заряженный азот дополнительно взаимодействует с активным центром. Тетрафторирование фталоильного кольца, по-видимому, усиливает ингибирование ангиогенеза. [ 42 ]
Синтез
[ редактировать ]Этот раздел может быть слишком техническим для понимания большинства читателей . ( Апрель 2017 г. ) |
Ниже описаны схемы синтеза талидомида, леналидомида и помалидомида, как сообщается в известной первичной литературе . Обратите внимание, что эти схемы синтеза не обязательно отражают стратегии органического синтеза, используемые для синтеза этих отдельных химических соединений.
Талидомид
[ редактировать ]

Синтез талидомида обычно проводят, как показано на схеме 1. Этот синтез представляет собой достаточно упрощенный трехстадийный процесс. Однако недостатком этого процесса является то, что последний этап требует высокотемпературной реакции плавления, которая требует многократной рекристаллизации и не соответствует стандартному оборудованию.
Схема 2 представляет собой новый путь синтеза, который был разработан, чтобы сделать реакцию более прямой и обеспечить более высокие выходы. Этот путь использует L -глутамин, а не L -глутаминовую кислоту в качестве исходного материала, и в результате реакции с N -карбэтоксифталимидом получается N -фталоил- L -глутамин (4) с выходом 50–70%. Затем вещество 4 перемешивают в смеси карбонилдиимидазола ( CDI ) с достаточным количеством 4-диметиламинопиридина ( DMAP ) в тетрагидрофуране ( THF ) для катализа реакции и нагревают с обратным холодильником в течение 15–18 часов. Во время кипячения талидомид кристаллизуется из смеси. На заключительном этапе выход талидомида составляет 85–93%, в результате чего общий выход достигает 43–63%. [ 46 ]
Леналидомид и помалидомид
[ редактировать ]
Оба аминоаналога получают конденсацией гидрохлорида 3-аминопиперидин-2,6-диона (Соединение 3), который синтезируют в двухстадийной реакции из коммерчески доступного Cbz - L -глутамина. Cbz- L -глутамин обрабатывают CDI в кипящем ТГФ с получением Cbz-аминоглутаримида. Для удаления защитной группы Cbz был проведен гидрогенолиз 50–60 фунтов на квадратный дюйм под давлением водорода с использованием 10% Pd/C, смешанного с этилацетатом и HCl. Полученный гидрохлорид (соединение 3 на схеме 3) затем подвергали взаимодействию с 3-нитрофталевым ангидридом в кипящей уксусной кислоте с получением 4-нитрозамещенного аналога талидомида, а затем нитрогруппу восстанавливали гидрированием с получением помалидомида. [ 44 ]

Леналидомид синтезируют аналогичным образом с использованием соединения 3 (3-аминопиперидин-2,6-диона), обработанного нитрозамещенным метил-2-(бромметил)бензоатом, и гидрирования нитрогруппы. [ 44 ]
Фармакокинетика
[ редактировать ]Талидомид
[ редактировать ]| Талидомид | ||
|---|---|---|
| Т макс [препарат] | 4–6 часов у субъектов с ММ. [ 47 ] |
|
| Связывание с белками | 55–65% [ 48 ] | |
| Метаболиты | Гидролизованные метаболиты [ 48 ] | |
| Период полураспада [t 1/2 ] | 5,5–7,6 часов [ 48 ] | |
Леналидомид
[ редактировать ]| Леналидомид | ||
|---|---|---|
| Т макс [препарат] | 0,6–1,5 часа у здоровых людей [ 49 ] 0,5–4 часа у субъектов с ММ [ 50 ] |
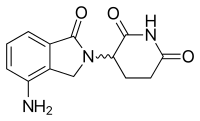
|
| Связывание с белками | ~30% [ 49 ] | |
| Метаболиты | Еще не изучен [ 49 ] | |
| Период полураспада [t 1/2 ] | 3 часа у здоровых людей [ 49 ] 3,1–4,2 часа у субъектов с ММ. [ 50 ] | |
Помалидомид
[ редактировать ]| Помалидомид | ||
|---|---|---|
| Т макс [препарат] | 0,5–8 часов [ 51 ] |
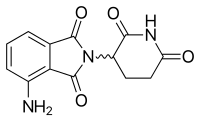
|
| Связывание с белками | Неизвестный | |
| Метаболиты | Неизвестный | |
| Период полураспада [t 1/2 ] | 6,2–7,9 часа [ 51 ] | |
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б Найт, Р. (август 2005 г.). «IMiDs: новый класс иммуномодуляторов». Семинары по онкологии . 32 (4 Приложение 5): С24–С30. doi : 10.1053/j.seminoncol.2005.06.018 . ПМИД 16085014 .
- ^ Арагон-Чинг А.Б., Ли Х, Гарднер Э.Р., Фигг В.Д. (2007). «Аналоги талидомида как противораковые препараты» . Недавнее обсуждение противораковых препаратов Pat . 2 (2): 167–174. дои : 10.2174/157489207780832478 . ПМК 2048745 . ПМИД 17975653 .
- ^ Изменение судьбы: как порицаемый препарат стал спасительным агентом в «войне» против рака - Onco'Zine - Международная онкологическая сеть (30 ноября 2013 г.). Архивировано 3 января 2014 г., archive.today.
- ^ Маццокколи, Л; Кадосо, Ш.; Амаранте, Джорджия; де Соуза, М.В.; ДОМИНГ, Р; МАЧАДО, Массачусетс; де Алмейда, М.В.; Тейшейра, ХК (июль 2012 г.). «Новые аналоги талидомида из диаминов ингибируют выработку провоспалительных цитокинов и экспрессию CD80, одновременно усиливая IL-10». Биомедицина и фармакотерапия . 66 (5): 323–9. дои : 10.1016/j.biopha.2012.05.001 . ПМИД 22770990 .
- ^ Проммер, Э.Э. (20 октября 2009 г.). «Обзорная статья: Паллиативная онкология: Талидомид». Американский журнал хосписной и паллиативной медицины . 27 (3): 198–204. дои : 10.1177/1049909109348981 . ПМИД 19843880 . S2CID 24167431 .
- ^ Перейти обратно: а б Д'Амато Р.Дж., Локнан М.С., Флинн Э., Фолкман Дж. (апрель 1994 г.). «Талидомид является ингибитором ангиогенеза» . Учеб. Натл. акад. наук. США . 91 (9): 4082–5. Бибкод : 1994PNAS...91.4082D . дои : 10.1073/pnas.91.9.4082 . ПМК 43727 . ПМИД 7513432 .
- ^ Верхол Х.М., Паниграхи Д., Юань Дж., Д'Амато Р.Дж. (январь 1999 г.). «Комбинация пероральной антиангиогенной терапии с талидомидом и сулиндаком подавляет рост опухоли у кроликов» . Бр. Дж. Рак . 79 (1): 114–8. дои : 10.1038/sj.bjc.6690020 . ПМК 2362163 . ПМИД 10408702 .
- ^ Перейти обратно: а б с д и ж г час я дж к л Бартлетт, Дж. Блейк; Дредж, Кейт; Далглиш, Ангус Г. (1 апреля 2004 г.). «Хронология: эволюция талидомида и его производных IMiD как противораковых средств». Обзоры природы Рак . 4 (4): 314–322. дои : 10.1038/nrc1323 . ПМИД 15057291 . S2CID 7293027 .
- ^ Перейти обратно: а б Д'Амато Р.Дж., Ленч С., Андерсон К.К., Роджерс М.С. (декабрь 2001 г.). «Механизм действия талидомида и 3-аминоталидомида при множественной миеломе». Семин. Онкол . 28 (6): 597–601. дои : 10.1016/S0093-7754(01)90031-4 . ПМИД 11740816 .
- ^ Циммерман, Тодд (1 мая 2009 г.). «Иммуномодуляторы в онкологии». Обновленная информация о лечении рака . 3 (4): 170–181. дои : 10.1016/j.uct.2009.03.003 .
- ^ Зелдис, Джером Б.; Найт, Роберт; Хусейн, Мохамад; Чопра, Раджеш; Мюллер, Джордж (1 марта 2011 г.). «Обзор истории, свойств и использования иммуномодулирующего соединения леналидомида». Анналы Нью-Йоркской академии наук . 1222 (1): 76–82. Бибкод : 2011NYASA1222...76Z . дои : 10.1111/j.1749-6632.2011.05974.x . ПМИД 21434945 . S2CID 5336195 .
- ^ «Вектор сдвинулся» .
- ^ Перейти обратно: а б Д'Амато, Р.Дж.; Ленч, С; Андерсон, КЦ; Роджерс, MS (декабрь 2001 г.). «Механизм действия талидомида и 3-аминоталидомида при множественной миеломе». Семинары по онкологии . 28 (6): 597–601. дои : 10.1016/S0093-7754(01)90031-4 . ПМИД 11740816 .
- ^ Ленч С., Роджерс М.С., ЛеБлан Р. и др. (апрель 2002 г.). «S-3-аминофталимидоглутаримид ингибирует ангиогенез и рост B-клеточных неоплазий у мышей». Рак Рез . 62 (8): 2300–5. ПМИД 11956087 .
- ^ Перейти обратно: а б с д и ж г час Мужик, Хон-Ва; Шафер, Питер; Вонг, Лу Мин; Паттерсон, Ребекка Т.; Коррал, Лаура Г.; Рэймон, Хизер; Будьте здоровы, Кейт; Лейстен, Джим; Ширли, Майкл А.; Тан, Ян; Бабусис, Дариус М.; Чен, Роджер; Стирлинг, Дэйв; Мюллер, Джордж В. (26 марта 2009 г.). «Открытие ( S ) -N- {2-[1-(3-этокси-4-метоксифенил)-2-метансульфонилэтил]-1,3-диоксо-2,3-дигидро-1 H -изоиндол-4-ил }ацетамид (апремиласт), мощный и перорально активный ингибитор фосфодиэстеразы 4 и фактора некроза опухоли-α». Журнал медицинской химии . 52 (6): 1522–4. дои : 10.1021/jm900210d . ПМИД 19256507 .
- ^ Перейти обратно: а б с д и ж г час я Мюллер, Джордж В.; Коррал, Лаура Г.; Шайр, Мэри Г.; Ван, Хуа; Морейра, Андре; Каплан, Гилла; Стерлинг, Дэвид И. (1 января 1996 г.). «Структурные модификации талидомида производят аналоги с повышенной ингибирующей активностью фактора некроза опухоли». Журнал медицинской химии . 39 (17): 3238–3240. дои : 10.1021/jm9603328 . ПМИД 8765505 .
- ^ Перейти обратно: а б с д Мужик, Хон-Ва; Коррал, Лаура Дж; Стерлинг, Дэвид I; Мюллер, Джордж В. (1 октября 2003 г.). «А-фторзамещенные аналоги талидомида». Письма по биоорганической и медицинской химии . 13 (20): 3415–3417. дои : 10.1016/S0960-894X(03)00778-9 . ПМИД 14505639 .
- ^ Пан, Б; Ленч, С. (октябрь 2012 г.). «Применение и биология иммуномодулирующих препаратов (ИМиД) при раке». Фармакология и терапия . 136 (1): 56–68. doi : 10.1016/j.pharmthera.2012.07.004 . ПМИД 22796518 .
- ^ Седларикова Л; Кубичкова, Л; Шевчикова, С; Хаек, Р. (октябрь 2012 г.). «Механизм действия иммуномодулирующих препаратов при множественной миеломе». Исследования лейкемии . 36 (10): 1218–1224. doi : 10.1016/j.leukres.2012.05.010 . ПМИД 22727252 .
- ^ Перейти обратно: а б с Валлет, С; Витценс-Хариг, М; Джагер, Д; Подар, К. (март 2012 г.). «Обновленная информация об иммуномодулирующих препаратах (IMiD) при гематологических и солидных злокачественных новообразованиях». Экспертное заключение по фармакотерапии . 13 (4): 473–494. дои : 10.1517/14656566.2012.656091 . ПМИД 22324734 . S2CID 7981368 .
- ^ «Дозировка Таломида (талидомида), показания, взаимодействие, побочные эффекты и многое другое» . Ссылка на MedScape . Проверено 18 сентября 2012 г.
- ^ «Талидомид Целген (ранее Талидомид Фармион)» . Европейское агентство по лекарственным средствам . Проверено 18 сентября 2012 г.
- ^ «Celgene Biopharmaceutical – Связи с инвесторами – Пресс-релизы» . Архивировано из оригинала 19 января 2013 года . Проверено 18 сентября 2012 г.
- ^ «Дозировка ревлимида (леналидомида), показания, взаимодействие, побочные эффекты и многое другое» . Ссылки на Medscape . Проверено 18 сентября 2012 г.
- ^ «Поиск: леналидомид — Результаты по списку» . Клинические испытания . Проверено 18 сентября 2012 г.
- ^ «Реестр клинических исследований» . Реестр клинических исследований ЕС . Проверено 18 сентября 2012 г.
- ^ «Celgene подает помалидомид на одобрение FDA» . Миеломный маяк.
- ^ «Европейское агентство лекарственных средств — Результаты поиска по вашему запросу» . Европейское агентство лекарственных средств. Архивировано из оригинала 5 марта 2016 года . Проверено 18 сентября 2012 г.
- ^ Перейти обратно: а б Ито, Такуми; Ханда, Хироши (1 марта 2012 г.). «Расшифровка тайны тератогенности талидомида» . Врожденные аномалии . 52 (1): 1–7. дои : 10.1111/j.1741-4520.2011.00351.x . ПМИД 22348778 .
- ^ Перейти обратно: а б с д и Мартиниани, Роберта; Ди Лорето, Валентина; Ди Сано, Кьяра; Ломбардо, Алессандра; Либерати, Анна Марина (1 января 2012 г.). «Биологическая активность леналидомида и его основные терапевтические эффекты при множественной миеломе» . Достижения гематологии . 2012 : 842945. doi : 10.1155/2012/842945 . ПМЦ 3417169 . ПМИД 22919394 .
- ^ Куах, Х; Ричи, Д; Стюарт, АК; Нисон, П; Харрисон, С; Смит, MJ; Принс, Его Величество (январь 2010 г.). «Механизм действия иммуномодулирующих препаратов (ИМиДС) при множественной миеломе» . Лейкемия . 24 (1): 22–32. дои : 10.1038/leu.2009.236 . ПМЦ 3922408 . ПМИД 19907437 .
- ^ Андхаварапу, С; Рой, В. (февраль 2013 г.). «Иммуномодулирующие препараты при множественной миеломе» . Экспертное обозрение гематологии . 6 (1): 69–82. дои : 10.1586/эхм.12.62 . ПМИД 23373782 . S2CID 12782141 .
- ^ Седларикова Л; Кубичкова, Л; Шевчикова, С; Хаек, Р. (октябрь 2012 г.). «Механизм действия иммуномодулирующих препаратов при множественной миеломе». Исследования лейкемии . 36 (10): 1218–1224. doi : 10.1016/j.leukres.2012.05.010 . ПМИД 22727252 .
- ^ Чанг, XB; Стюарт, АК (2011). «Какова функциональная роль талидомидсвязывающего белка цереблона?» . Международный журнал биохимии и молекулярной биологии . 2 (3): 287–94. ПМЦ 3193296 . ПМИД 22003441 .
- ^ Перейти обратно: а б с д и ж Хуан, Йен-Та; Сюй, Чжи В.; Чиу, Тед Х. (1 сентября 2008 г.). «Талидомид и его аналоги как противораковые средства» . Медицинский журнал Цзы Чи . 20 (3): 188–195. дои : 10.1016/S1016-3190(08)60034-8 .
- ^ Перейти обратно: а б с д и Мельхерт, Магда; Лист, Алан (1 июля 2007 г.). «Сага о талидомиде». Международный журнал биохимии и клеточной биологии . 39 (7–8): 1489–1499. doi : 10.1016/j.biocel.2007.01.022 . ПМИД 17369076 .
- ^ Перейти обратно: а б Куах, Х; Ричи, Д; Стюарт, АК; Нисон, П; Харрисон, С; Смит, MJ; Принс, Его Величество (12 ноября 2009 г.). «Механизм действия иммуномодулирующих препаратов (ИМиДС) при множественной миеломе» . Лейкемия . 24 (1): 22–32. дои : 10.1038/leu.2009.236 . ПМЦ 3922408 . ПМИД 19907437 .
- ^ Томас, Шиба К.; Ричардс, Тиффани А.; Вебер, Донна М. (1 декабря 2007 г.). «Леналидомид при множественной миеломе». Передовая практика и исследования в области клинической гематологии . 20 (4): 717–735. дои : 10.1016/j.beha.2007.09.002 . ПМИД 18070715 .
- ^ Перейти обратно: а б с Котла, Венумадхав; Гоэл, Свати; Нишал, Сангита; Хек, Кристоф; Вивек, Кумар; Дас, Бхаскар; Верма, Амит (1 января 2009 г.). «Механизм действия леналидомида при гематологических злокачественных новообразованиях» . Журнал гематологии и онкологии . 2 (1): 36. дои : 10.1186/1756-8722-2-36 . ПМЦ 2736171 . ПМИД 19674465 .
- ^ Вакка А., Рибатти Д., Ронкали Л. и др. (июль 1994 г.). «Ангиогенез костного мозга и прогрессирование множественной миеломы» . Бр. Дж. Гематол . 87 (3): 503–8. дои : 10.1111/j.1365-2141.1994.tb08304.x . ПМК 3301416 . ПМИД 7527645 .
- ^ Авила, Каролина Мартинс; Ромейро, Нелилма Коррейя; Сперандио да Силва, Жилберту М.; Сант'Анна, Карлос М.Р.; Баррейро, Элиэзер Дж.; Фрага, Карлос AM (1 октября 2006 г.). «Разработка новых моделей CoMFA и CoMSIA 3D-QSAR для противовоспалительных фталимидсодержащих модуляторов TNFα». Биоорганическая и медицинская химия . 14 (20): 6874–6885. дои : 10.1016/j.bmc.2006.06.042 . ПМИД 16843662 .
- ^ Перейти обратно: а б Леппер, Эрин Р.; Нг, Сильвия СВ; Гютшоу, Майкл; Вайс, Майкл; Хаушильдт, Сунна; Хекер, Томас К.; Луцио, Фредерик А.; Эгер, Курт; Фигг, Уильям Д. (1 апреля 2004 г.). «Сравнительный молекулярно-полевой анализ и сравнительный анализ индексов молекулярного сходства аналогов талидомида как ингибиторов ангиогенеза». Журнал медицинской химии . 47 (9): 2219–2227. дои : 10.1021/jm0304820 . ПМИД 15084120 .
- ^ Ногучи, Томоми; Фудзимото, Харука; Сано, Хироко; Миядзима, Ацуши; Миячи, Хироюки; Хашимото, Юичи (1 декабря 2005 г.). «Ингибиторы ангиогенеза, производные талидомида». Письма по биоорганической и медицинской химии . 15 (24): 5509–5513. дои : 10.1016/j.bmcl.2005.08.086 . ПМИД 16183272 .
- ^ Перейти обратно: а б с Мюллер, Г.В.; Чен, Р; Хуанг, Ю.Ю.; Коррал, LG; Вонг, Л.М.; Паттерсон, RT; Чен, Ю; Каплан, Г; Стерлинг, DI (7 июня 1999 г.). «Аминозамещенные аналоги талидомида: мощные ингибиторы продукции TNF-альфа». Письма по биоорганической и медицинской химии . 9 (11): 1625–30. дои : 10.1016/s0960-894x(99)00250-4 . ПМИД 10386948 .
- ^ Стюарт, Скотт Г.; Спаньоло, Даниэль; Поломская, Марта Е.; Грех, Мелвин; Карими, Махдад; Авраам, Лоуренс Дж. (1 ноября 2007 г.). «Свойства ингибирования синтеза и экспрессии TNF новых аналогов талидомида, полученных посредством перекрестного связывания Хека». Письма по биоорганической и медицинской химии . 17 (21): 5819–5824. дои : 10.1016/j.bmcl.2007.08.042 . ПМИД 17851074 .
- ^ Мюллер, Джордж В.; Коннеке, Уильям Э.; Смит, Элисон М.; Хетани, Викрам Д. (1 марта 1999 г.). «Краткий двухэтапный синтез талидомида». Исследования и разработки органических процессов . 3 (2): 139–140. дои : 10.1021/op980201b .
- ^ Чанг, Ф. (1 сентября 2004 г.). «Фармакокинетика талидомида и образование метаболитов у мышей, кроликов и пациентов с множественной миеломой» . Клинические исследования рака . 10 (17): 5949–5956. дои : 10.1158/1078-0432.CCR-04-0421 . ПМИД 15355928 .
- ^ Перейти обратно: а б с «Краткий обзор характеристик продукта: Талидомид Celgene» (PDF) . Европейское агентство по лекарственным средствам . Проверено 23 сентября 2012 г.
- ^ Перейти обратно: а б с д Оружейная палата, X.; Олагнер, Г.; Факон, Т. (1 июня 2008 г.). «Леналидомид в лечении множественной миеломы: обзор» . Журнал клинической фармации и терапии . 33 (3): 219–226. дои : 10.1111/j.1365-2710.2008.00920.x . ПМИД 18452408 .
- ^ Перейти обратно: а б Ричардсон, П.Г. (12 июля 2002 г.). «Иммуномодулирующий препарат СС-5013 преодолевает лекарственную устойчивость и хорошо переносится пациентами с рецидивирующей множественной миеломой» . Кровь . 100 (9): 3063–3067. дои : 10.1182/кровь-2002-03-0996 . ПМИД 12384400 .
- ^ Перейти обратно: а б Шей, С.А. (15 августа 2004 г.). «Фаза I исследования иммуномодулирующего аналога талидомида, CC-4047, при рецидивирующей или рефрактерной множественной миеломе» . Журнал клинической онкологии . 22 (16): 3269–3276. дои : 10.1200/JCO.2004.10.052 . ПМИД 15249589 .