Фактор некроза опухоли
| ФНО | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | TNF , DIF, TNF-альфа, TNFA, TNFSF2, фактор некроза опухоли, TNF-α, фактор некроза опухоли, TNLG1F, фактор некроза опухоли альфа | |||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 191160 ; МГИ : 104798 ; Гомологен : 496 ; Генные карты : TNF ; ОМА : TNF – ортологи | |||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
Фактор некроза опухоли (' TNF ), также известный как кахексин или кахектин , представляет собой цитокин и член суперсемейства TNF , которое включает различные трансмембранные белки с гомологичным доменом TNF. Первоначально называвшийся TNFα (с тире или без него), этот цитокин был первым, который был идентифицирован как адипокин , секретируемый жировой тканью . [ 5 ] Передача сигналов TNF происходит через два рецептора: TNFR1 и TNFR2 . [ 6 ] [ 7 ] TNFR1 широко экспрессируется в большинстве типов клеток и обычно связан с провоспалительной и апоптотической передачей сигналов. Напротив, TNFR2 в основном обнаруживается на эндотелиальных, эпителиальных и иммунных клетках, где он опосредует противовоспалительные реакции и способствует пролиферации клеток. [ 8 ]
TNF-α существует как в трансмембранной (mTNF-α), так и в растворимой формах (sTNF-α). Растворимая форма образуется в результате ферментативного расщепления трансмембранной формы - процесса, известного как презентация субстрата. [ 9 ] Трансмембранная форма преимущественно взаимодействует как с TNFR1, так и с TNFR2 посредством межклеточного контакта, тогда как растворимая форма преимущественно связывается с TNFR1. [ 10 ] Связывание TNF-α с TNFR1 необратимо, что приводит к длительной передаче сигнала, тогда как его связывание с TNFR2 является обратимым. [ 11 ]
Основная роль TNF заключается в регуляции иммунных клеток . Как эндогенный пироген, TNF может вызывать лихорадку , запускать апоптоз , вызывать кахексию и инициировать воспаление . Он играет решающую роль в ингибировании онкогенеза и репликации вируса , а также в ответе на сепсис в сочетании с IL-1 и IL-6 . Однако нарушение регуляции производства TNF связано с несколькими заболеваниями, включая болезнь Альцгеймера . [ 12 ] рак , [ 13 ] большая депрессия , [ 14 ] псориаз , [ 15 ] и воспалительные заболевания кишечника (ВЗК). [ 16 ]
Как адипокин, TNF способствует резистентности к инсулину и тесно связан с ожирением вызванным диабетом 2 типа, . [ 5 ] Как цитокин, TNF играет решающую роль в иммунной системе , выступая в качестве ключевого медиатора в передаче сигналов в клетках . Когда макрофаги обнаруживают инфекцию, они выделяют TNF, чтобы предупредить другие иммунные клетки, инициируя воспалительную реакцию. [ 5 ] Некоторые виды рака могут привести к перепроизводству TNF, который, как и паратиреоидный гормон , может вызвать вторичную гиперкальциемию . Под названием тазонермин TNF используется в качестве иммуностимулирующего препарата при лечении некоторых видов рака. И наоборот, препараты, ингибирующие ФНО, используются для лечения различных воспалительных заболеваний, таких как ревматоидный артрит .
История
[ редактировать ]Открытие
[ редактировать ]В 1890-х годах Уильям Б. Коли , основываясь на анекдотах о больных раком, излеченных внезапными приступами рожи , выдвинул теорию, что бактериальные инфекции оказывают благотворное воздействие на опухоли, особенно саркомы . Коли смог успешно лечить больных раком, вводя им смесь бактериальных токсинов из стерилизованных нагреванием Streptococcus и Bacillus prodigiosus в опухоли и вокруг них, вызывая кровотечение из опухолей. Однако эффективность этого лечения была непостоянной, а повторные инъекции вызывали серьезные побочные эффекты, такие как озноб и лихорадка, в результате чего лечение было прекращено. [ 17 ]
В 1930-х и 1940-х годах Шир и др. выделил активный опухолекровоизлияющий агент из бактериальных токсинов Escherichia coli и Serratia marcescens . Они продемонстрировали, что этот агент, эндотоксин , при введении мышам с саркомами может ингибировать рост опухоли или вызывать регрессию опухоли. [ 18 ] Однако регрессия опухоли была весьма вариабельной: меньшие дозы эндотоксина часто имели большую эффективность, чем большие дозы, или целые партии мышей были устойчивы к эндотоксину. [ 19 ]
В 1975 году Элизабет Карсвелл и Ллойд Олд и др. исследовали противоопухолевые свойства эндотоксина, извлекая сыворотку мышей-доноров, которым вводили эндотоксин, и вводя сыворотку мышам-реципиентам с трансплантированными саркомами. Они обнаружили, что мыши-доноры, инфицированные Bacillus Calmette Guerin (BCG), при воздействии эндотоксина производят сыворотку, которая вызывает кровоизлияние в опухоли у мышей-реципиентов. Сыворотка мышей-доноров, инфицированных БЦЖ, не содержала остаточных эндотоксинов, что привело авторов к выводу, что сыворотка содержит отдельный цитотоксический фактор, называемый фактором некроза опухоли (TNF). Поскольку у мышей, инфицированных БЦЖ, селезенка была увеличена из-за повышенного производства макрофагов , авторы пришли к выводу, что TNF высвобождается макрофагами при воздействии эндотоксинов. [ 20 ]
Помимо того, что TNF вызывал кровоизлияния в саркомах in vivo , он также был цитотоксичен для клеток L-929, трансформированной клеточной линии, in vitro . Цитотоксичность по отношению к клеткам L-929 in vitro стала стандартным методом обнаружения TNF. [ 21 ] TNF был цитотоксичен для раковых и трансформированных клеточных линий, но не для нормальных, нетрансформированных клеточных линий, что вселяет надежду на то, что его можно будет использовать в качестве лечения рака. [ 20 ]
Выделение, секвенирование и экспрессия
[ редактировать ]В августе 1984 года Бхарат Аггарвал и др. в Genentech очистили и охарактеризовали человеческий TNF. TNF был получен путем культивирования HL-60 , линии клеток человека, с форболмиристатацетатом (PMA), стимулятором фагоцитов, подобным эндотоксину. TNF очищали с использованием стеклянных шариков с контролируемыми порами , DEAE -хроматографии, Mono Q-хроматографии и обращенно-фазовой ВЭЖХ . Было установлено, что TNF, очищенный с помощью обращенно-фазовой ВЭЖХ, имеет молекулярную массу 17 000 кДа с помощью SDS-PAGE , тогда как TNF, очищенный с помощью TSK-HPLC в неденатурирующих условиях, имеет приблизительную молекулярную массу 45 000 кДа, что позволяет предположить, что TNF существует в природе в виде олигомер . Аминокислотную последовательность TNF определяли с помощью деградации по Эдману , в результате чего была обнаружена последовательность из 157 аминокислот со значительной гомологией с аминокислотной последовательностью лимфотоксина . [ 22 ]
В том же месяце Пенника и др., также из Genentech, секвенировали кДНК человеческого TNF. Библиотеку кДНК конструировали из мРНК клеток HL-60, индуцированных PMA. длиной 42 основания ДНК-зонд , сконструированный путем угадывания кодонов части аминокислотной последовательности TNF, использовался для скрининга библиотеки кДНК. Соответствующую кДНК секвенировали, обнаружив пре-последовательность из 76 аминокислот, за которой следовали 157 аминокислот зрелого TNF. Авторы пришли к выводу, что TNF сначала синтезируется в более крупную форму-предшественник, содержащую сигнальный пептид , а затем процессируется и высвобождается в виде более мелкой зрелой формы. Авторы также синтезировали TNF в e coli и подтвердили его цитотоксичность в отношении клеток L-929 in vitro и против сарком мышей in vivo . [ 23 ]
Физиологические эффекты
[ редактировать ]В июне 1981 года Ян А. Кларк и др. обнаружили, что у здоровых мышей, инфицированных Plasmodium vinckei , паразитом, вызывающим малярию , при воздействии эндотоксина развивались малярийно-подобные симптомы, такие как повреждение печени, гипогликемия и свертывание крови, а также высвобождались медиаторы, включая TNF. Неинфицированные мыши не выделяли эти медиаторы при инъекции эндотоксина. Эти результаты в сочетании с данными о наличии эндотоксинов в сыворотке больных малярией позволили авторам предположить, что такие медиаторы, как TNF, присутствуют при острых малярийных инфекциях и что они играют роль в возникновении симптомов малярии. [ 24 ]
В 1985 году Кевин Дж. Трейси , Ян Милсарк и Энтони Керами обнаружили, что мыши, иммунизированные TNF с помощью антисыворотки к TNF, были устойчивы к летальному воздействию эндотоксина, что указывает на то, что TNF является одним из медиаторов летальности эндотоксина. [ 25 ] В 1986 году это было подтверждено Кевином Дж. Трейси и Брюсом Бейтлером , когда они продемонстрировали, что у мышей, которым вводили TNF, наблюдались общие симптомы отравления эндотоксинами, такие как гипотония , метаболический ацидоз , гемоконцентрация и смерть. [ 26 ]
В 1991 году Майкл Гудман продемонстрировал, что мыши, которым вводили TNF, высвобождали повышенные уровни тирозина и 3-метил-L-гистидина в скелетных мышцах, что указывает на то, что TNF вызывает распад мышц. [ 27 ] В 1996 году Штефферл и др. продемонстрировали, что у мышей, которым вводили мышиный TNF, развивается лихорадка, окончательно доказав, что TNF является пирогеном . Предыдущие исследования показали неубедительные результаты из-за использования на мышах человеческого TNF, а не мышиного. [ 28 ]
Наблюдение того, что TNF вызывает истощение и эндотоксический шок, привело к переосмыслению его потенциальной роли в терапии рака. [ 21 ]
Идентификация с кахектином
[ редактировать ]В сентябре 1981 года Масанобу Каваками и Энтони Черами исследовали склонность бактериальных эндотоксинов вызывать гипертриглицеридемию , вызванную дефицитом липопротеинлипазы (ЛПЛ), при введении животным. Они извлекли сыворотку у мышей-доноров, которым вводили эндотоксин, и ввели ее мышам-реципиентам. Они обнаружили, что у мышей-реципиентов, устойчивых к эндотоксину, активность LPL снизилась после получения сыворотки мышей, обработанных эндотоксином, хотя их активность LPL не была заметно снижена при непосредственном введении эндотоксина. Авторы также обнаружили, что клетки экссудата , состоящие в основном из макрофагов, при инкубации с эндотоксинами продуцируют среду, которая снижает активность ЛПЛ при инъекции мышам. Авторы пришли к выводу, что гипертриглицеридемия вызвана опосредующим фактором, называемым кахектином, секретируемым клетками экссудата в ответ на эндотоксины. [ 29 ]
В 1985 году Бейтлер и др. продемонстрировали, что мышиный кахектин обладает такой же цитотоксичностью в отношении клеток L-929, как и TNF, а также имеет почти идентичную N-концевую аминокислотную последовательность с человеческим TNF, что указывает на то, что кахектин и TNF представляют собой один и тот же белок. Поскольку известно, что кахектин (теперь TNF) подавляет биосинтез специфического белка, липопротеинлипазы, авторы пришли к выводу, что цитотоксический механизм TNF действует аналогичным образом. [ 30 ]
Номенклатура
[ редактировать ]В 1968 году был открыт лимфотоксин — цитотоксин, секретируемый лимфоцитами . И TNF, и лимфотоксин были обнаружены на основании их способности убивать клетки L-929, способности связываться с двумя известными рецепторами TNF, TNFRI и TNFRII , и имели значительную генетическую и аминокислотную гомологию. Сходство между ФНО и лимфотоксином привело к неофициальному переименованию ФНО в ФНО-α, а лимфотоксина в ФНО-β, причем опубликованное обоснование заключается в том, что они обнаруживаются с помощью одних и тех же анализов in vitro . [ 21 ]
В 1993 году было обнаружено, что лимфотоксин, который не является трансмембранным белком , присутствует на клеточной мембране путем образования комплекса с отдельным трансмембранным гликопротеином , названным лимфотоксином-β . [ 31 ] Также было обнаружено, что лимфотоксин играет решающую роль в развитии лимфоидных органов , что отличает его биологическую функцию от TNF. В результате этих разработок TNF-β был переименован в лимфотоксин-α, а TNF-α снова переименован в TNF. [ 21 ]
Ген
[ редактировать ]TNF человека Ген картирован на хромосоме 6p21.3 , расположенной в класса III регионе главного комплекса гистосовместимости . Его центромерная длина составляет 250 тыс. нуклеотидов локуса HLA-B, теломерная длина 850 килобаз локуса HLA-DR и 1100 пар оснований ниже гена лимфотоксина-α . [ 32 ] Ген TNF имеет длину 2762 пары оснований, в результате чего образуется зрелая мРНК, состоящая из 1669 нуклеотидов. [ 33 ] Проксимальная область промотора имеет длину примерно 200 пар оснований. [ 34 ]
Транскрибируемый регион
[ редактировать ]
Транскрибируемая область содержит 4 экзона, разделенных 3 интронами , что в общей сложности составляет 2762 пары оснований в первичном транскрипте и 1669 пар оснований в мРНК. Первый экзон содержит 5'-нетранслируемую область и основную часть сигнального пептида предшественника TNF. Второй экзон содержит минорную область сигнального пептида и минорную область кодирующей области зрелого TNF. Третий экзон содержит минорную область кодирующей области. Четвертый экзон содержит основную часть кодирующей области и 3'-нетранслируемую область и имеет значительную гомологию с лимфотоксином-α. [ 35 ]
3'-нетранслируемая область содержит богатый AU элемент (ARE), который регулирует репрессию трансляции и стабильность мРНК. Удаление этой последовательности у мышей приводит к повышению уровня TNF, артриту и фенотипу, подобному болезни Крона. [ 32 ]
Выражение
[ редактировать ]Ген TNF экспрессируется в широком спектре клеток, включая макрофаги , Т-клетки , В-клетки , естественные клетки-киллеры , тучные клетки , дендритные клетки и фибробласты . [ 34 ]
Ген TNF также является геном немедленного раннего ответа ; он активируется быстро в ответ на раздражители и не зависит от синтеза других белков. К таким стимулам относятся эндотоксины бактерий, вещества вирусов и простейших , ионофоры , одноцепочечные и двухцепочечные РНК, митогены , суперантигены , анти-CD3 , полигидроксиалканоаты и частицы кремнезема. Эти стимулы связываются с рядом рецепторов, включая Toll-подобный рецептор , NOD2 , рецептор Т-клеток , рецептор B-клеток , рецептор тучных клеток и рецептор NK-клеток . TNF также активируется другими цитокинами, такими как интерлейкин-1 , интерлейкин-2 , GM-CSF и сам TNF, которые связываются с такими рецепторами, как TNFR1 и TNFR2 . [ 36 ] Ген TNF также может активироваться под воздействием стрессов окружающей среды, таких как радиация , осмотический стресс и высокий уровень глюкозы. [ 34 ]
Эти стимулы активируют такие пути, как NF-κB. [ 37 ] , Каспаза-1 [ 37 ] и МАПК [ 37 ] пути, которые активируют факторы транскрипции, такие как NF-κB , NFAT , c-jun , ATF-2 , Ets , Elk-1 и Sp1 . Эти факторы транскрипции перемещаются в ядро, чтобы начать транскрипцию TNF. [ 34 ]
Энхансосомная транскрипция
[ редактировать ]
Экспрессия гена TNF регулируется посредством энхансосом , где множество факторов транскрипции и коактиваторов собираются в структуры высокого порядка для активации транскрипции. Проксимальная область промотора, охватывающая примерно 200 пар оснований перед транскрипционной областью, содержит множество сайтов связывания транскрипционных факторов, многие из которых могут распознавать более одного типа транскрипционных факторов. [ 34 ]
Состав энхансосомы зависит от окружающей концентрации NFAT в ядре . Если уровни NFAT высоки, например, в Т-клетках при стимуляции иономицином, энхансосома будет состоять в основном из NFAT, связанных с сайтами связывания NFAT. Если уровни NFAT низкие, энхансосома будет состоять в основном из белков Sp1 и Ets/Elk, связанных в совместимых сайтах связывания. [ 34 ]
Кроме того, проксимальная область промотора содержит элемент ответа циклического AMP (CRE), сайт связывания гетеродимера белков ATF -2 и c-jun , который имеет решающее значение для активации TNF во всех типах клеток и состояниях. CRE и близлежащие комплексы транскрипционных факторов образуют основные составные комплексы, которые взаимодействуют с другими якорными комплексами для стабилизации взаимодействий с коактиваторами и транскрипционным аппаратом. Проксимальная область промотора также содержит ТАТА-бокс, способствующий транскрипции. [ 34 ]
Гибкость состава энхансосом позволяет активировать ген TNF различными факторами транскрипции в зависимости от типа клеток и стимула. [ 34 ]
Регулирование через NF-κB
[ редактировать ]транскрипционный фактор NF-κB Было показано, что играет важную роль в регуляции экспрессии гена TNF. Однако неясно, активирует ли NF-κB транскрипцию TNF путем непосредственного связывания с сайтами в промоторной области или посредством вторичных эффектов. [ 34 ]
Из шести последовательностей, идентифицированных как потенциальные сайты связывания NF-κB в области промотора TNF человека, только одна находится в проксимальной области промотора. Более того, делеция или мутация этих сайтов связывания не влияет на активацию гена TNF путем индукции эндотоксина, что указывает на то, что NF-κB может не влиять на экспрессию TNF путем прямого связывания с промотором. [ 34 ]
Было обнаружено, что другие факторы транскрипции потенциально влияют на экспрессию гена TNF, такие как белки семейств bZIP , STAT и IRF , а также индуцируемый эндотоксином фактор TNF-α (LIPAF). Однако их влияние на экспрессию гена TNF еще полностью не изучено. [ 34 ]
Регуляция через структуру хроматина
[ редактировать ]Экспрессия гена TNF связана с несколькими гистон-ацетилтрансферазами , белками, которые расслабляют структуру ДНК для увеличения экспрессии генов, такими как ATF-2, CBP/p300, p/CAF и GCN5. Также было показано, что метилирование гистонов регулирует экспрессию гена TNF, например, метилирование лизина 4 гистона H3 на промоторе TNF после стимуляции клеток, экспрессирующих TNF. [ 34 ]
Экспрессия гена TNF также контролируется наличием участков гиперчувствительности к ДНКазе (HSS), участков хроматина, которые неконденсированы и, следовательно, доступны для ДНК-связывающих белков. Несколько исследований показали, что HSS присутствуют в промоторе TNF и области гена в клетках, экспрессирующих TNF, и отсутствуют в клетках, которые не экспрессируют TNF. Другие исследования также показали, что HSS присутствуют в промоторе TNF и областях генов в зависимости от стимулятора, используемого для индукции клетки. [ 34 ]
Также было обнаружено, что долгосрочные внутрихромосомные и межхромосомные взаимодействия регулируют экспрессию гена TNF. Например, в активированных Т-клетках промотор TNF взаимодействует с HSS+3 и HSS-9, приближая дистальные энхансеры к промотору TNF и увеличивая локальную концентрацию комплексов энхансеров. Эти взаимодействия также сделают ген TNF кольцевым и позволят повторно использовать транскрипционный аппарат, обеспечивая быструю и раннюю экспрессию TNF в Т-клетках. [ 34 ]
Эволюция
[ редактировать ]Считается, что гены TNF и лимфотоксина-α произошли от общего предкового гена, который развился на ранних этапах эволюции позвоночных, до разделения Agnatha и Gnathostomata . Этот предковый ген был исключен из предка Agnatha, но сохранился у предка Gnathostomata. В ходе эволюции челюстноротых этот предковый ген был дублирован в гены TNF и лимфотоксина-α. [ 38 ]
Таким образом, хотя предковый ген TNF/лимфотоксина-α обнаружен у множества видов челюстноротых, только часть видов челюстноротых содержат ген TNF. Ген TNF был обнаружен у рыб, млекопитающих, птиц и амфибий. Было обнаружено, что некоторые виды рыб, такие как данио , содержат дубликаты гена TNF. [ 38 ]
Ген TNF очень похож у млекопитающих и содержит от 233 до 235 аминокислот. [ 39 ] Область проксимального промотора TNF также высоко консервативна у млекопитающих и почти идентична у высших приматов . [ 34 ] Сходство гена TNF у рыб ниже и составляет от 226 до 256 аминокислот. как и TNF млекопитающих, ген TNF рыб стимулируется в макрофагах антигенами Было показано, что , . [ 39 ] Все гены TNF имеют высококонсервативный С-концевой модуль, известный как домен гомологии TNF, из-за его важной роли в связывании TNF с его рецепторами. [ 38 ]
Белок
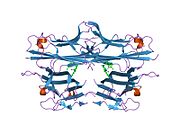
[ редактировать ]Человеческий TNF первоначально вырабатывается как трансмембранный белок типа II , обозначаемый tmTNF, который расщепляется ферментом, превращающим TNF-альфа (TACE), в растворимую форму, обозначаемую sTNF. И tmTNF, и sTNF биоактивны и расположены в виде гомотримеров . [ 40 ] Мономер TNF также биоактивен, но в гораздо меньшей степени. [ 41 ]
Трансмембранная форма
[ редактировать ]tmTNF состоит из 233 аминокислот, весит 26 кДа и представляет собой гомотример. tmTNF передает двунаправленный сигнал как в клетку-мишень, так и в собственную клетку, связываясь с рецепторами TNF при межклеточном контакте. tmTNF связывается как с TNFR1, так и с TNFR2, но его активность в основном опосредована TNFR2. tmTNF устроен таким образом, что N-конец направлен внутрь клетки, а C-конец направлен наружу из клетки. [ 40 ]
tmTNF состоит из внутриклеточной части из 30 аминокислот, трансмембранной части из 26 аминокислот и внеклеточной части из 177 аминокислот. Остаток цистеина на границе внутриклеточной и трансмембранной частей пальмитоилируется , что делает его более гидрофобным и притягивает к клеточной мембране. Внутриклеточная часть содержит остатки серина, которые высоко консервативны между видами и необходимы для передачи сигналов в клетку. Эти остатки серина также фосфорилируются , хотя неясно, какую роль это играет. [ 40 ]
При расщеплении ТАСЕ секретируются концевые 157 аминокислот внеклеточной части, образующие sTNF. Оставшийся tmTNF снова расщепляется SPPL2b , вызывая перемещение внутриклеточного домена в ядро, где, как полагают, он регулирует выработку цитокинов, например, запуская экспрессию интерлейкина-12 . [ 40 ]
Растворимая форма
[ редактировать ]
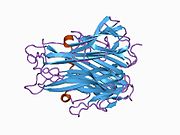
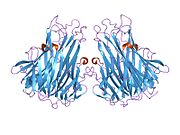
sTNF состоит из 157 аминокислот, массой 17 кДа, имеет форму треугольного клина и также устроен в виде гомотримера. Вторичная структура sTNF состоит из 8 β-нитей и одной α-спирали. Третичная структура состоит из двух антипараллельных β-листов, расположенных в виде антипараллельного β-сэндвича, при этом внутренний лист содержит 3 β-нити, а внешний лист содержит 5 β-нитей. Дисульфидный мостик соединяет две самые длинные межлистные петли. Эта структура аналогична структурному мотиву «желеобразного рулета» белков вирусной оболочки. Три мономера sTNF соединяются друг с другом с помощью упаковки от края к лицу. [ 42 ]
Биологические действия
[ редактировать ]TNF оказывает несколько эффектов на различные системы органов, часто в сочетании с IL-1 и интерлейкином-6 (IL-6). В гипоталамусе TNF стимулирует гипоталамо-гипофизарно-надпочечниковую систему , способствуя высвобождению кортикотропин-рилизинг-гормона (CRH), подавляя аппетит и вызывая лихорадку . В печени TNF стимулирует реакцию острой фазы , что приводит к увеличению уровня С-реактивного белка и других медиаторов. Кроме того, TNF индуцирует резистентность к инсулину , способствуя фосфорилированию серина субстрата инсулинового рецептора-1 (IRS-1), что ухудшает передачу сигналов инсулина.
TNF также действует как мощный хемоаттрактант для нейтрофилов и способствует экспрессии молекул адгезии на эндотелиальных клетках , способствуя миграции нейтрофилов. В макрофагах TNF стимулирует фагоцитоз , а также выработку IL-1, оксидантов и воспалительного липида простагландина E2 (PGE2 ) . TNF повышает резистентность к инсулину в других тканях за счет фосфорилирования остатков серина на инсулиновых рецепторах, тем самым блокируя передачу сигнала. Кроме того, TNF играет роль в регуляции восприятия горького вкуса, влияя на метаболизм и потребление пищи. [ 43 ]
Локальное увеличение концентрации TNF вызывает кардинальные признаки воспаления: жар, отек, покраснение, боль и потерю функции.
Передача сигналов ячейки
[ редактировать ]TNF может связывать два рецептора: TNFR1 ( рецептор TNF типа 1; CD120a; p55/60) и TNFR2 (рецептор TNF типа 2; CD120b; p75/80). TNFR1 имеет массу 55 кДа, а TNFR2 — 75 кДа. [ 44 ] TNFR1 экспрессируется в большинстве тканей и может полностью активироваться как мембраносвязанной, так и растворимой тримерной формой TNF, тогда как TNFR2 обычно обнаруживается в клетках иммунной системы и реагирует на мембраносвязанную форму гомотримера TNF. Поскольку большая часть информации о передаче сигналов TNF получена из TNFR1, роль TNFR2, вероятно, недооценивается. По крайней мере частично, поскольку TNFR2 не имеет домена внутриклеточной смерти, он проявляет нейропротекторные свойства. [ 45 ]

При контакте со своим лигандом рецепторы TNF также образуют тримеры, их кончики входят в бороздки, образованные между мономерами TNF. Это связывание вызывает конформационные изменения в рецепторе, приводящие к диссоциации ингибирующего белка SODD от домена внутриклеточной смерти. Эта диссоциация позволяет адаптерному белку TRADD связываться с доменом смерти, служа платформой для последующего связывания белка. После связывания TRADD могут быть инициированы три пути. [ 46 ] [ 47 ]
- Активация NF-κB : TRADD привлекает TRAF2 и RIP. TRAF2, в свою очередь, рекрутирует многокомпонентную протеинкиназу IKK , позволяя серин-треониновой киназы RIP активировать ее. Ингибирующий белок IκBα , который в норме связывается с NF-κB и ингибирует его транслокацию, фосфорилируется IKK и впоследствии расщепляется, высвобождая NF-κB. NF-κB представляет собой гетеродимерный транскрипционный фактор , который транслоцируется в ядро и опосредует транскрипцию широкого спектра белков, участвующих в выживании и пролиферации клеток, воспалительной реакции и антиапоптотических факторах .
- Активация путей МАРК : Из трех основных каскадов МАРК TNF индуцирует сильную активацию стрессом , связанной со группы JNK , вызывает умеренный ответ p38-MAPK и отвечает за минимальную активацию классических ERK . /Rac активирует JNK-индуцирующие вышестоящие киназы MLK2 MLK3 / TRAF2 , [ 48 ] TAK1 , MEKK1 и ASK1 (либо напрямую, либо через GCK и Trx соответственно). Ось SRC-Vav-Rac активирует MLK2/MLK3, и эти киназы фосфорилируют MKK7 , что затем активирует JNK. JNK транслоцируется в ядро и активирует факторы транскрипции , такие как c-Jun и ATF2 . Путь JNK участвует в дифференцировке и пролиферации клеток и обычно является проапоптотическим .
- Индукция передачи сигналов смерти: Как и все члены суперсемейства TNFR, содержащие домен смерти, TNFR1 участвует в передаче сигналов смерти. [ 49 ] Однако гибель клеток, индуцированная TNF, играет лишь незначительную роль по сравнению с его подавляющими функциями в воспалительном процессе. Его способность вызывать смерть слаба по сравнению с другими членами семейства (такими как Fas ) и часто маскируется антиапоптотическим действием NF-κB. Тем не менее, TRADD связывает FADD , который затем рекрутирует цистеиновую протеазу каспазу-8 . Высокая концентрация каспазы -8 индуцирует ее аутопротеолитическую активацию и последующее расщепление эффекторных каспаз, что приводит к апоптозу клеток .
Множество и часто противоречивых эффектов, опосредованных вышеуказанными путями, указывают на существование обширных перекрестных помех. Например, NF-κB усиливает транскрипцию C-FLIP , Bcl-2 и cIAP1 / cIAP2 , ингибирующих белков, которые мешают передаче сигналов смерти. С другой стороны, активированные каспазы расщепляют несколько компонентов пути NF-κB, включая RIP, IKK и субъединицы самого NF-κB. Другие факторы, такие как тип клеток, одновременная стимуляция других цитокинов или количество активных форм кислорода (АФК), могут сместить баланс в пользу того или иного пути. [ нужна ссылка ] Такая сложная передача сигналов гарантирует, что всякий раз, когда высвобождается TNF, различные клетки с совершенно разными функциями и состояниями могут соответствующим образом реагировать на воспаление . [ нужна ссылка ] Обе белковые молекулы фактора некроза опухоли альфа и кератина 17, по-видимому, быть связаны в случае подслизистого фиброза полости рта [ 50 ]
На животных моделях TNF избирательно убивает аутореактивные Т-клетки . [ 51 ]
Имеются также доказательства того, что передача сигналов TNF-α запускает последующие эпигенетические модификации, которые приводят к длительному усилению провоспалительных реакций в клетках. [ 52 ] [ 53 ] [ 54 ] [ 55 ]
Регуляция ферментов
[ редактировать ]Этот белок может использовать морфеиновую модель аллостерической регуляции . [ 56 ]
Клиническое значение
[ редактировать ]Большие количества TNF высвобождаются в ответ на липополисахарид (ЛПС), другие бактериальные продукты и интерлейкин-1 (IL-1). В коже тучные клетки являются основным источником предварительно сформированного TNF, который может высвобождаться при воспалительных раздражителях, таких как ЛПС. [ 57 ]
В то время как высокие концентрации TNF могут вызывать симптомы, подобные шоку , длительное воздействие низких концентраций может привести к кахексии , синдрому истощения, часто наблюдаемому у онкологических больных.
Роль в иммунной регуляции
[ редактировать ]TNF вызывает IL-10-зависимое ингибирование расширения и функционирования CD4 Т-клеток путем повышения уровня PD-1 в моноцитах. Это приводит к продукции IL-10 моноцитами после связывания PD-1 с помощью PD-L. [ 58 ]
Упражнение
[ редактировать ]Увеличение TNF в ответ на сепсис ингибируется выработкой миокинов , вызванной физической нагрузкой . Чтобы выяснить, вызывают ли острые физические нагрузки истинную противовоспалительную реакцию, была использована модель «воспаления низкой степени». В этой модели низкие дозы эндотоксина E. coli вводились здоровым добровольцам, которые были рандомизированы для отдыха или физических упражнений перед введением эндотоксина. У покоящихся субъектов эндотоксин вызывал 2-3-кратное увеличение уровня циркулирующего TNF. Однако когда испытуемые выполняли трехчасовую езду на эргометре и получали болюс эндотоксина через 2,5 часа, реакция TNF полностью притуплялась. [ 59 ] Сильные физические нагрузки могут подавлять выработку TNF. [ 60 ]
Неврологическая функция
[ редактировать ]В мозге TNF может защищать от эксайтотоксичности . [ 45 ] укрепить синапсы, [ 6 ] и способствуют выживанию нейронов. Однако TNF, продуцируемый макрофагами и микроглией, может приводить к выработке нейротоксинов , индуцирующих апоптоз. [ 45 ]
При метаболических нарушениях
[ редактировать ]Повышенные концентрации TNF-α и IL-6 связаны с ожирением . [ 61 ] [ 62 ] [ 63 ] Использование моноклональных антител против TNF-α парадоксальным образом связано с увеличением, а не снижением ожирения, что позволяет предположить, что воспаление является следствием, а не причиной ожирения. [ 63 ] TNF и IL-6 являются одними из наиболее известных цитокинов, предсказывающих тяжесть и смертность от COVID-19 . [ 5 ]
При фиброзе печени
[ редактировать ]TNFα опосредует воспаление, которое активирует резидентные звездчатые клетки печени (ЗКП) в фиброгенные миофибробласты , которые в значительной степени ответственны за фиброз печени . Однако, в то время как мыши с нокаутом рецептора TNF 1 демонстрируют снижение фиброза, TNFα может также подавлять экспрессию гена коллагена α1(I) в фибробластах in vitro, что поднимает вопросы относительно сложности его роли в фиброзе печени. [ 64 ]
В то время как лечение TNFα подавляет экспрессию гена коллагена α1, апоптоз и пролиферацию в активированных ЗКП in vitro (действие, которое должно уменьшать фиброз), было также показано, что оно ингибирует апоптоз в активированных ЗКП , действие, которое, в принципе, должно индуцировать фиброз. [ 65 ] В частности, известно, что TNFα, продуцируемый печеночными макрофагами, поддерживает выживание ЗКП, источника печеночных миофибробластов. [ 66 ] Таким образом, считается, что TNFα способствует фиброзу печени благодаря своему эффекту, способствующему выживанию, несмотря на его плейотропное воздействие на ЗКП. [ 67 ]
которым TNFα способствует ухудшению фиброза печени, заключается в стимуляции продукции TGF-β гепатоцитами и TIMP1 гепатоцитами Еще один способ , и ЗКП . [ 68 ]
Кроме того, следует отметить, что макрофаги CCR9+, играющие важную роль в патогенезе фиброза печени, являются TNFα-зависимыми. Когда TNFα ослабляется с помощью антитела против TNFα, ЗКП печени не активируются макрофагами CCR9+ . [ 69 ]
При неалкогольной жировой болезни печени (НАЖБП)
[ редактировать ]Двойная роль в развитии НАЖБП
[ редактировать ]TNFα играет двойную роль в развитии НАЖБП . Во-первых, он высвобождается среди других провоспалительных цитокинов , таких как IL-6 и IL-1β , в ответ на усиление передачи сигналов от NF-κB во время стеатоза . Затем TNFα участвует в привлечении клеток Купфера , которые усиливают воспаление и приводят к развитию НАСГ . [ 70 ]
Инсулинорезистентность
[ редактировать ]Во-вторых, связывание TNFα с рецептором TNFα 1 ( TNFR1 ) способствует резистентности к инсулину , известному фактору, способствующему прогрессированию НАЖБП, путём подавления передачи сигналов инсулина . [ 71 ] После связывания TNF-α с TNFR1 активируются внутриклеточные сигналы N-концевой киназы c-JUN (JNK) и киназы IkB (IKK), а фосфорилирование JNK (p-JNK) и IKK1/1KK2 дополнительно ослабляет субстрат 1 инсулинового рецептора. ( ИРС-1 ). Фосфорилирование IRS-1 приводит к подавлению передачи сигналов инсулина и, как следствие, к инсулинорезистентности. [ 72 ] Блокирование TNFR1 защищало крыс Wistar от ожирения, вызванного диетой, и резистентности к инсулину. [ 72 ]
Потенциальные терапевтические подходы
[ редактировать ]Ингибирование TNFR1 было предложено в качестве возможной терапии НАЖБП . Мышиная модель НАЖБП с диетой с высоким содержанием жиров (HFD) была использована для демонстрации того, что использование антитела против TNFR1 может снизить стеатоз печени и содержание триглицеридов , а также активацию нижестоящих генов-мишеней липогенеза . Устойчивость к инсулину также улучшилась у этих мышей в результате снижения активации MAP-киназы MKK7 и ее нижестоящей мишени JNK . [ 73 ]
Кроме того, считается, что TNFα увеличивает выработку MCP-1 (белка-1, хемоаттрактанта моноцитов). Известно, что MCP-1 сверхэкспрессируется при ожирении и, как полагают, отвечает за рекрутирование макрофагов в жировую ткань и способствует резистентности к инсулину. [ 74 ] Продукция MCP-1 увеличивается в первичных гепатоцитах, подвергшихся воздействию TNFα; TNF-α стимулирует транскрипцию гена Mcp1, активируя путь Akt/PKB. [ 75 ]
Двойной роли TNFα в развитии НАЖБП противодействует противовоспалительное действие адипонектина , продукция которого нарушается при метаболическом синдроме. [ 68 ]
Таким образом, считается, что TNFα играет пагубную роль в прогрессировании НАЖБП в НАСГ и цирроз печени .
Фармакология
[ редактировать ]TNF способствует воспалительной реакции, которая, в свою очередь, вызывает многие клинические проблемы, связанные с аутоиммунными заболеваниями, такими как ревматоидный артрит , болезнь Бехтерева , воспалительные заболевания кишечника , псориаз , гнойный гидраденит и рефрактерная астма . Эти расстройства иногда лечат с помощью ингибитора ФНО . Это ингибирование может быть достигнуто с помощью моноклональных антител, таких как инфликсимаб (Remicade), связывающихся непосредственно с TNF, адалимумаб (Humira), цертолизумаб пегол с циркулирующим рецептором, (Cimzia) или с помощью белка-ловушки, слитого такого как этанерцепт (Enbrel), который связывается с TNF более эффективно. сходство, чем TNFR. [ 76 ]
С другой стороны, у некоторых пациентов, получающих ингибиторы ФНО, наблюдается обострение заболевания или новое возникновение аутоиммунитета. TNF, по-видимому, также обладает иммуносупрессивным действием. Одним из объяснений возможного механизма является наблюдение о том, что TNF оказывает положительное влияние на регуляторные Т-клетки (Tregs) благодаря его связыванию с рецептором фактора некроза опухоли 2 (TNFR2). [ 77 ]
Терапия против TNF показала лишь умеренный эффект при лечении рака. Лечение почечно-клеточного рака инфликсимабом приводило к длительной стабилизации заболевания у некоторых пациентов. Этанерцепт был протестирован для лечения пациентов с раком молочной железы и раком яичников, продемонстрировав длительную стабилизацию заболевания у некоторых пациентов за счет снижения уровня IL-6 и CCL2 . С другой стороны, добавление инфликсимаба или этанерцепта к гемцитабину для лечения пациентов с распространенным раком поджелудочной железы не было связано с различиями в эффективности по сравнению с плацебо. [ 78 ]
Взаимодействия
[ редактировать ]Было показано, что TNF взаимодействует с TNFRSF1A . [ 79 ] [ 80 ]
Номенклатура
[ редактировать ]Поскольку LTα больше не называют TNFβ, [ 81 ] TNFα, как предыдущий символ гена, теперь называется просто TNF, как показано в базе данных HGNC (Комитета по номенклатуре генов HUGO).
Ссылки
[ редактировать ]- ^ Jump up to: а б с ENSG00000230108, ENSG00000223952, ENSG00000204490, ENSG00000228321, ENSG00000232810, ENSG00000228849, ENSG00000206439 GRCh38: Версия ансамбля 89: 0000228978, ENSG00000230108, ENSG00000223952, ENSG00000204490, ENSG00000228321, ENSG00000232810, ENSG00000228849, ENSG00000206439 – ансамбль , май 2017 год
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000024401 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Jump up to: а б с д Сетхи Дж. К., Хотамислигил Г. С. (октябрь 2021 г.). «Метаболические мессенджеры: фактор некроза опухоли» . Природный метаболизм . 3 (10): 1302–1312. дои : 10.1038/s42255-021-00470-z . ПМИД 34650277 . S2CID 238991468 .
- ^ Jump up to: а б Наследник Р, Stellwagen D (2020). «ФНО-опосредованная гомеостатическая синаптическая пластичность: от моделей in vitro к моделям in vivo » . Границы клеточной нейронауки . 14 : 565841. doi : 10.3389/fncel.2020.565841 . ПМЦ 7556297 . ПМИД 33192311 .
- ^ Гоф П., Майлз И.А. (2020). «Рецепторы фактора некроза опухоли: плейотропные сигнальные комплексы и их дифференциальные эффекты» . Границы в иммунологии . 11 : 585880. дои : 10.3389/fimmu.2020.585880 . ПМЦ 7723893 . ПМИД 33324405 .
- ^ Рольски Ф, Блыщук П (октябрь 2020 г.). «Сложность передачи сигналов TNF-α при заболеваниях сердца» . Журнал клинической медицины . 9 (10): 3267. doi : 10.3390/jcm9103267 . ПМЦ 7601316 . ПМИД 33053859 .
- ^ Цюй Ю, Чжао Г, Ли Х (2017). «Прямая и обратная передача сигналов, опосредованная трансмембранным фактором некроза опухоли-альфа и рецептором TNF 2: потенциальная роль в иммуносупрессивном микроокружении опухоли» . Границы в иммунологии . 8 : 1675. дои : 10.3389/fimmu.2017.01675 . ПМЦ 5712345 . ПМИД 29234328 .
- ^ Проберт Л. (август 2015 г.). «ФНО и его рецепторы в ЦНС: существенные, желательные и вредные эффекты» . Нейронаука . 302 : 2–22. doi : 10.1016/j.neuroscience.2015.06.038 . ПМИД 26117714 .
- ^ Сонди З., Паллай А. (январь 2017 г.). «Трансмембранная обратная передача сигналов TNF-альфа, ведущая к выработке TGF-бета, избирательно активируется молекулами, нацеленными на TNF: терапевтические последствия». Фармакологические исследования . 115 : 124–132. дои : 10.1016/J.phrs.2016.11.025 . ПМИД 27888159 . S2CID 40818956 .
- ^ Свардфагер В., Ланкто К., Ротенбург Л., Вонг А., Каппелл Дж., Херрманн Н. (ноябрь 2010 г.). «Метаанализ цитокинов при болезни Альцгеймера». Биологическая психиатрия . 68 (10): 930–941. doi : 10.1016/j.biopsych.2010.06.012 . ПМИД 20692646 . S2CID 6544784 .
- ^ Локсли Р.М., Киллин Н., Ленардо М.Дж. (февраль 2001 г.). «Суперсемейства рецепторов TNF и TNF: интеграция биологии млекопитающих» . Клетка . 104 (4): 487–501. дои : 10.1016/S0092-8674(01)00237-9 . ПМИД 11239407 . S2CID 7657797 .
- ^ Доулати Ю., Херрманн Н., Свардфагер В., Лю Х., Шам Л., Рейм Е.К. и др. (март 2010 г.). «Метаанализ цитокинов при большой депрессии». Биологическая психиатрия . 67 (5): 446–457. doi : 10.1016/j.biopsych.2009.09.033 . ПМИД 20015486 . S2CID 230209 .
- ^ Виктор ФК, Готлиб АБ (декабрь 2002 г.). «ФНО-альфа и апоптоз: значение для патогенеза и лечения псориаза». Журнал лекарств в дерматологии . 1 (3): 264–275. ПМИД 12851985 .
- ^ Брынсков Дж., Фог П., Педерсен Г., Эллервик С., Киркегор Т., Бингхэм А. и др. (июль 2002 г.). «Активность альфа-превращающего фермента фактора некроза опухоли (ТАСЕ) в слизистой оболочке толстой кишки пациентов с воспалительными заболеваниями кишечника» . Гут . 51 (1): 37–43. дои : 10.1136/gut.51.1.37 . ПМЦ 1773288 . ПМИД 12077089 .
- ^ Лундин Дж.И., Чековей Х. (сентябрь 2009 г.). «Эндотоксин и рак» . Перспективы гигиены окружающей среды . 117 (9): 1344–1350. дои : 10.1289/ehp.0800439 . ПМК 225248 . ПМИД 19750096 .
- ^ Шир М.Дж., Перро А. (апрель 1944 г.). «Химическое лечение опухолей. IX. Реакции мышей с первичными подкожными опухолями на введение кровоизлиятельного бактериального полисахарида». Журнал Национального института рака . 4 (5): 461–476. дои : 10.1093/jnci/4.5.461 .
- ^ Шир М.Дж., Перро А. (август 1943 г.). «Химическое лечение опухолей. VI. Метод определения активности кровоизлиятельных бактериальных препаратов». Журнал Национального института рака . 4 (1): 99–105. дои : 10.1093/jnci/4.1.99 .
- ^ Jump up to: а б Карсвелл Э.А., Олд Л.Дж., Кассель Р.Л., Грин С., Фиоре Н., Уильямсон Б. (сентябрь 1975 г.). «Вызванный эндотоксином сывороточный фактор, вызывающий некроз опухолей» . Труды Национальной академии наук Соединенных Штатов Америки . 72 (9): 3666–3670. Бибкод : 1975PNAS...72.3666C . дои : 10.1073/pnas.72.9.3666 . ПМК 433057 . ПМИД 1103152 .
- ^ Jump up to: а б с д Раддл, Нью-Хэмпшир (апрель 2014 г.). «Лимфотоксин и ФНО: Как все начиналось – дань уважения путешественникам» . Обзоры цитокинов и факторов роста . 25 (2): 83–89. doi : 10.1016/j.cytogfr.2014.02.001 . ПМК 4027955 . ПМИД 24636534 .
- ^ Аггарвал Б.Б., Кор В.Дж., Хасс П.Е., Моффат Б., Спенсер С.А., Хензель В.Дж. и др. (февраль 1985 г.). «Фактор некроза опухолей человека. Производство, очистка и характеристика» . Журнал биологической химии . 260 (4): 2345–2354. дои : 10.1016/S0021-9258(18)89560-6 . ПМИД 3871770 .
- ^ Пенника Д., Недвин Дж.Э., Хейфлик Дж.С., Сибург П.Х., Деринк Р., Палладино М.А. и др. (декабрь 1985 г.). «Фактор некроза опухоли человека: структура предшественника, экспрессия и гомология с лимфотоксином». Природа . 312 (5996): 724–729. дои : 10.1038/312724a0 . ПМИД 6392892 .
- ^ Кларк И.А., Вирелизье Дж.Л., Карсвелл Э.А., Вуд PR (июнь 1981 г.). «Возможная важность медиаторов макрофагального происхождения при острой малярии» . Инфекция и иммунитет . 32 (3): 1058–1066. дои : 10.1128/iai.32.3.1058-1066.1981 . ПМК 351558 . ПМИД 6166564 .
- ^ Бейтлер Б., Милсарк И.В., Черами AC (август 1985 г.). «Пассивная иммунизация против кахектина/фактора некроза опухоли защищает мышей от летального действия эндотоксина». Наука . 229 (4716): 869–871. Бибкод : 1985Sci...229..869B . дои : 10.1126/science.3895437 . ПМИД 3895437 .
- ^ Трейси К.Дж., Бейтлер Б., Лоури С.Ф., Мерриуэзер Дж., Вулпе С., Милсарк И.В. и др. (октябрь 1986 г.). «Шок и повреждение тканей, вызванные рекомбинантным человеческим кахектином». Наука . 234 (4775): 470–474. Бибкод : 1986Sci...234..470T . дои : 10.1126/science.3764421 . ПМИД 3764421 .
- ^ Гудман М.Н. (май 1991 г.). «Фактор некроза опухоли вызывает распад белка скелетных мышц у крыс». Американский журнал физиологии . 260 (5, ч. 1): 727–730. дои : 10.1152/ajpendo.1991.260.5.E727 . ПМИД 2035628 .
- ^ Стефферл А., Хопкинс С.Дж., Ротвелл Нью-Джерси, Лухеши Г.Н. (август 1996 г.). «Роль TNF-альфа при лихорадке: противоположные действия человеческого и мышиного TNF-альфа и взаимодействие с IL-бета у крыс» . Британский журнал фармакологии . 118 (8): 1919–1924. дои : 10.1111/j.1476-5381.1996.tb15625.x . ПМК 1909906 . PMID 8864524 .
- ^ Каваками М., Керами А. (сентябрь 1981 г.). «Исследование эндотоксин-индуцированного снижения активности липопротеинлипазы» . Журнал экспериментальной медицины . 154 (3): 631–639. дои : 10.1084/jem.154.3.631 . ПМК 2186462 . PMID 7276825 .
- ^ Бейтлер Б., Гринвальд Д., Халмс Дж.Д., Чанг М., Пан Ю.К., Мэтисон Дж. и др. (август 1985 г.). «Идентичность фактора некроза опухоли и фактора кахектина, секретируемого макрофагами». Природа . 316 (6028): 552–554. Бибкод : 1985Natur.316..552B . дои : 10.1038/316552a0 . ПМИД 2993897 .
- ^ Браунинг Дж.Л., Нгам-ек А., Лоутон П., ДеМаринис Дж., Тизард Р., Чоу Э.П. и др. (март 1993 г.). «Лимфотоксин бета, новый член семейства TNF, который образует гетеромерный комплекс с лимфотоксином на поверхности клетки». Клетка . 72 (6): 847–856. дои : 10.1016/0092-8674(93)90574-а . ПМИД 7916655 .
- ^ Jump up to: а б Пападакис К.А., Тарган С.Р. (октябрь 2000 г.). «Фактор некроза опухоли: биология и терапевтические ингибиторы» . Гастроэнтерология . 119 (4): 1148–1157. дои : 10.1053/gast.2000.18160 . ПМИД 11040201 .
- ^ Чен Ф (июнь 2004 г.). «TNF (фактор некроза опухоли (суперсемейство TNF, член 2))» . Атлас Генет Цитогенет Онкол Гематол .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот Фальво Ю.В., Цыцыкова А.В., Гольдфельд А.Е. (2010). «Транскрипционный контроль гена TNF». Патофизиология ФНО . Современные направления в области аутоиммунитета. Том. 11. Каргер. стр. 27–60. дои : 10.1159/000289196 . ISBN 978-3-8055-9384-7 . ПМЦ 4785889 . ПМИД 20173386 .
- ^ Недвин Дж.Э., Нейлор С.Л., Сакагути А.Ю., Смит Д., Джарретт-Недвин Дж., Пенника Д. и др. (сентябрь 1985 г.). «Гены лимфотоксина человека и фактора некроза опухолей: структура, гомология и хромосомная локализация» . Исследования нуклеиновых кислот . 13 (17): 6361–6373. дои : 10.1093/нар/13.17.6361 . ПМК 321958 . ПМИД 2995927 .
- ^ Лоо Г.В., Бертран, MJM (ноябрь 2022 г.). «Смерть от TNF: путь к воспалению» . Обзоры природы Иммунология . 23 : 289–303. дои : 10.1038/s41577-022-00792-3 .
- ^ Jump up to: а б с Сабио Дж., Дэвис Р.Дж. (июнь 2014 г.). «Сигнальные пути киназы TNF и MAP» . Семин Иммунол . 26 (3): 237–245. дои : 10.1016/j.smim.2014.02.009 . ПМК 4099309 . ПМИД 24647229 . Ошибка цитирования: именованная ссылка «pmid24647229» была определена несколько раз с разным содержимым (см. страницу справки ).
- ^ Jump up to: а б с Марин I (ноябрь 2020 г.). «Суперсемейство факторов некроза опухоли: наследственные функции и ремоделирование в ранней эволюции позвоночных» . Геном Биол Эвол . 12 (11): 2074–2092. дои : 10.1093/gbe/evaa140 . ПМЦ 7674686 . ПМИД 33210144 .
- ^ Jump up to: а б Гетц Ф.В., Планас СП, Маккензи С.И. (май 2004 г.). «Факторы некроза опухоли». Развитие и сравнительная иммунология . 28 (5): 487–497. дои : 10.1016/j.dci.2003.09.008 . ПМИД 15062645 .
- ^ Jump up to: а б с д Хориучи Т., Митома Х., Харашима С., Цукамото Х., Симода Т. (июль 2010 г.). «Трансмембранный ФНО-альфа: структура, функции и взаимодействие с агентами против ФНО» . Ревматология (Оксфорд) . 49 (7): 1215–1228. doi : 10.1093/ревматология/keq031 . ПМК 2886310 . ПМИД 20194223 .
- ^ Смит Р.А., Бальони С. (май 1987 г.). «Активной формой фактора некроза опухоли является тример» . Журнал биологической химии . 262 (15): 6951–6954. дои : 10.1016/S0021-9258(18)48183-5 . ПМК 2886310 . ПМИД 20194223 .
- ^ Джонс Э., Стюарт Д., Уокер Н. (март 1989 г.). «Структура фактора некроза опухоли». Природа . 338 : 225–228. дои : 10.1038/338225a0 .
- ^ Фэн П., Джиотаки М., Ким А., Чай Дж., Саймон Н., Чжоу М. и др. (октябрь 2015 г.). «Регуляция реакции горького вкуса с помощью фактора некроза опухоли» . Мозг, поведение и иммунитет . 49 : 32–42. дои : 10.1016/j.bbi.2015.04.001 . ПМЦ 4567432 . ПМИД 25911043 .
- ^ Тайсс А.Л., Симмонс Дж.Г., Джобин С., Лунд П.К. (октябрь 2005 г.). «Фактор некроза опухоли (TNF) альфа увеличивает накопление и пролиферацию коллагена в миофибробластах кишечника через рецептор TNF 2» . Журнал биологической химии . 280 (43): 36099–109. дои : 10.1074/jbc.M505291200 . ПМИД 16141211 .
- ^ Jump up to: а б с Чедвик В., Магнус Т., Мартин Б., Кесельман А., Мэттсон член парламента, Модсли С. (октябрь 2008 г.). «Нацеливание на рецепторы TNF-альфа для нейротерапии» . Тенденции в нейронауках . 31 (10): 504–511. дои : 10.1016/j.tins.2008.07.005 . ПМК 2574933 . ПМИД 18774186 .
- ^ Вадант Х., Пфиценмайер К., Шойрих П. (январь 2003 г.). «Сигнализация фактора некроза опухоли» . Смерть клеток и дифференцировка . 10 (1): 45–65. дои : 10.1038/sj.cdd.4401189 . ПМИД 12655295 .
- ^ Чен Г., Гёддел Д.В. (май 2002 г.). «Передача сигналов TNF-R1: красивый путь». Наука . 296 (5573): 1634–1635. Бибкод : 2002Sci...296.1634C . дои : 10.1126/science.1071924 . ПМИД 12040173 . S2CID 25321662 .
- ^ Кант С., Сват В., Чжан С., Чжан З.Ю., Нил Б.Г., Флавелл Р.А. и др. (октябрь 2011 г.). «ФНО-стимулируемая активация киназы MAP, опосредованная сигнальным путем ГТФазы семейства Rho» . Гены и развитие . 25 (19): 2069–2078. дои : 10.1101/gad.17224711 . ПМК 3197205 . ПМИД 21979919 .
- ^ Гаур У, Аггарвал Б.Б. (октябрь 2003 г.). «Регуляция пролиферации, выживания и апоптоза членами суперсемейства TNF». Биохимическая фармакология . 66 (8): 1403–1408. дои : 10.1016/S0006-2952(03)00490-8 . ПМИД 14555214 .
- ^ Абд Эль Латиф Г.А. (январь 2019 г.). «Экспрессия фактора некроза опухоли альфа и кератина 17 при подслизистом фиброзе полости рта на модели крыс». Египетский стоматологический журнал . 65 (1 января (пероральная медицина, рентген, биология полости рта и патология полости рта)): 277–288. дои : 10.21608/edj.2015.71414 .
- ^ Бан Л., Чжан Дж., Ван Л., Кутрайбер В., Бургер Д., Фаустман Д.Л. (сентябрь 2008 г.). «Селективная гибель аутореактивных Т-клеток при диабете человека из-за агонизма TNF или рецептора TNF 2» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (36): 13644–13649. Бибкод : 2008PNAS..10513644B . дои : 10.1073/pnas.0803429105 . ПМЦ 2533243 . ПМИД 18755894 .
- ^ Истман А.Дж., Сюй Дж., Бермик Дж., Потчен Н., ден Деккер А., Нил Л.М. и др. (декабрь 2019 г.). «Эпигенетическая стабилизация DC и классической активации предшественников DC с помощью TNFα способствует защитной поляризации Т-клеток» . Достижения науки . 5 (12): eaaw9051. Бибкод : 2019SciA....5.9051E . дои : 10.1126/sciadv.aaw9051 . ПМК 6892624 . ПМИД 31840058 .
- ^ Чжао З., Лан М., Ли Дж., Донг К., Ли Х., Лю Б. и др. (апрель 2019 г.). «Провоспалительный цитокин TNFα индуцирует зависимую от деметилирования ДНК и независимую от деметилирования активацию экспрессии интерлейкина-32 » . Журнал биологической химии . 294 (17): 6785–6795. дои : 10.1074/jbc.RA118.006255 . ПМК 6497958 . ПМИД 30824537 .
- ^ Ци С, Ли Ю, Дай З, Сян М, Ван Г, Ван Л и др. (декабрь 2019 г.). «Метилирование гена Tnf-α, опосредованное Uhrf1, контролирует провоспалительные макрофаги при экспериментальном колите, напоминающем воспалительное заболевание кишечника» . Журнал иммунологии . 203 (11): 3045–3053. doi : 10.4049/jimmunol.1900467 . ПМИД 31611260 .
- ^ Сун М, Фан Ф, Дай Икс, Ю Л, Фанг М, Сюй Ю (март 2017 г.). «MKL1 является эпигенетическим медиатором провоспалительной транскрипции, индуцированной TNF-α, в макрофагах путем взаимодействия с ASH2» . Письма ФЭБС . 591 (6): 934–945. дои : 10.1002/1873-3468.12601 . ПМИД 28218970 .
- ^ Селвуд Т., Яффе Е.К. (март 2012 г.). «Динамическая диссоциация гомоолигомеров и контроль функции белка» . Архив биохимии и биофизики . 519 (2): 131–143. дои : 10.1016/j.abb.2011.11.020 . ПМЦ 3298769 . ПМИД 22182754 .
- ^ Уолш Л.Дж., Тринкьери Дж., Уолдорф Х.А., Уитакер Д., Мерфи Г.Ф. (май 1991 г.). «Тучные клетки кожи человека содержат и высвобождают фактор некроза опухоли альфа, который индуцирует молекулу адгезии эндотелиальных лейкоцитов 1» . Труды Национальной академии наук Соединенных Штатов Америки . 88 (10): 4220–4224. Бибкод : 1991PNAS...88.4220W . дои : 10.1073/pnas.88.10.4220 . ПМК 51630 . ПМИД 1709737 .
- ^ Саид Э.А., Дюпюи Ф.П., Траутманн Л., Чжан Ю., Ши Ю., Эль-Фар М. и др. (апрель 2010 г.). «Продукция моноцитами интерлейкина-10, индуцированная запрограммированной смертью-1, нарушает активацию CD4+ Т-клеток во время ВИЧ-инфекции» . Природная медицина . 16 (4): 452–459. дои : 10.1038/нм.2106 . ПМЦ 4229134 . ПМИД 20208540 .
- ^ Старки Р., Островски С.Р., Джофред С., Феббрайо М., Педерсен Б.К. (май 2003 г.). «Упражнения и инфузия IL-6 подавляют индуцированную эндотоксином выработку TNF-альфа у людей» . Журнал ФАСЭБ . 17 (8): 884–886. doi : 10.1096/fj.02-0670fje . ПМИД 12626436 . S2CID 30200779 .
- ^ Педерсен Б.К. (декабрь 2009 г.). «Болезнь, связанная с отсутствием физической активности, и роль миокинов в мышечно-жировом обмене» . Журнал физиологии . 587 (Часть 23): 5559–5568. дои : 10.1113/jphysicalol.2009.179515 . ПМЦ 2805368 . ПМИД 19752112 .
- ^ Coppack SW (август 2001 г.). «Провоспалительные цитокины и жировая ткань» . Труды Общества питания . 60 (3): 349–356. дои : 10.1079/PNS2001110 . ПМИД 11681809 .
- ^ Керн Л., Миттенбюлер М.Дж., Вестинг А.Дж., Остерманн А.Л., Вундерлих К.М., Вундерлих Ф.Т. (декабрь 2018 г.). «Вызванная ожирением передача сигналов TNFα и IL-6: недостающее звено между ожирением и вызванным воспалением раком печени и колоректальным раком» . Раки . 11 (1): 24. doi : 10.3390/cancers11010024 . ПМК 6356226 . ПМИД 30591653 .
- ^ Jump up to: а б Вирдис А., Колуччи Р., Бернардини Н., Бландиззи С., Таддеи С., Маси С. (февраль 2019 г.). «Микрососудистая эндотелиальная дисфункция при ожирении человека: роль TNF-α» . Журнал клинической эндокринологии и метаболизма . 104 (2): 341–348. дои : 10.1210/jc.2018-00512 . ПМИД 30165404 .
- ^ Эрнандес-Муньос I, де ла Торре П., Санчес-Алькасар Х.А., Гарсия И., Сантьяго Э., Муньос-Ягуэ М.Т. и др. (август 1997 г.). «Фактор некроза опухоли альфа ингибирует экспрессию гена коллагена альфа 1 (I) в звездчатых клетках печени крысы посредством G-белка». Гастроэнтерология . 113 (2): 625–640. дои : 10.1053/gast.1997.v113.pm9247485 . ПМИД 9247485 .
- ^ Саиле Б., Маттес Н., Книттель Т., Рамадори Г. (июль 1999 г.). «Трансформирующий фактор роста бета и фактор некроза опухоли альфа ингибируют как апоптоз, так и пролиферацию активированных звездчатых клеток печени крыс». Гепатология . 30 (1): 196–202. дои : 10.1002/hep.510300144 . ПМИД 10385656 . S2CID 85343893 .
- ^ Прадере Дж.П., Клюве Дж., Де Минисис С., Цзяо Дж.Дж., Гвак Г.И., Дапито Д.Х. и др. (октябрь 2013 г.). «Макрофаги печени, но не дендритные клетки, способствуют фиброзу печени, способствуя выживанию активированных звездчатых клеток печени у мышей» . Гепатология . 58 (4): 1461–1473. дои : 10.1002/hep.26429 . ПМЦ 3848418 . ПМИД 23553591 .
- ^ Ян Ю.М., Секи Э (декабрь 2015 г.). «TNFα при фиброзе печени» . Текущие отчеты по патобиологии . 3 (4): 253–261. дои : 10.1007/s40139-015-0093-z . ПМК 4693602 . ПМИД 26726307 .
- ^ Jump up to: а б Какино С., Оки Т., Накаяма Х., Юань Х., Отабэ С., Хашинага Т. и др. (январь 2018 г.). «Основная роль TNF-α в развитии и прогрессировании неалкогольной жировой болезни печени на мышиной модели». Гормональные и метаболические исследования = Hormon- und Stoffwechselforschung = Hormones et Métabolisme . 50 (1): 80–87. дои : 10.1055/s-0043-118666 . ПМИД 28922680 . S2CID 25137248 .
- ^ Чу П.С., Накамото Н., Эбинума Х., Усуи С., Саэки К., Мацумото А. и др. (июль 2013 г.). «Положительные макрофаги хемокинового рецептора 9 с мотивом CC активируют звездчатые клетки печени и способствуют фиброзу печени у мышей». Гепатология . 58 (1): 337–350. дои : 10.1002/hep.26351 . ПМИД 23460364 .
- ^ Рамадори Дж., Армбруст Т. (июль 2001 г.). «Цитокины в печени». Европейский журнал гастроэнтерологии и гепатологии . 13 (7): 777–784. дои : 10.1097/00042737-200107000-00004 . ПМИД 11474306 .
- ^ Дхармалингам М., Ямасандхи П.Г. (2018). «Неалкогольная жировая болезнь печени и сахарный диабет 2 типа» . Индийский журнал эндокринологии и метаболизма . 22 (3): 421–428. дои : 10.4103/ijem.IJEM_585_17 . ПМК 6063173 . ПМИД 30090738 .
- ^ Jump up to: а б Лян Х., Инь Б., Чжан Х., Чжан С., Цзэн Ц., Ван Дж. и др. (июнь 2008 г.). «Блокада рецептора фактора некроза опухоли (TNF) типа 1, опосредованная передача сигналов TNF-альфа, защищала крыс Wistar от ожирения, вызванного диетой, и резистентности к инсулину». Эндокринология . 149 (6): 2943–2951. дои : 10.1210/en.2007-0978 . ПМИД 18339717 .
- ^ Вандрер Ф., Либих С., Мархенке С., Фогель А., Джон К., Маннс М.П. и др. (март 2020 г.). «Ингибирование рецептора TNF-1 снижает стеатоз печени, гепатоцеллюлярное повреждение и фиброз у мышей с НАЖБП» . Смерть клеток и болезни . 11 (3): 212. doi : 10.1038/s41419-020-2411-6 . ПМК 7109108 . ПМИД 32235829 .
- ^ Канда Х., Татея С., Тамори Ю., Котани К., Хиаса К., Китазава Р. и др. (июнь 2006 г.). «MCP-1 способствует инфильтрации макрофагов в жировую ткань, резистентности к инсулину и стеатозу печени при ожирении» . Журнал клинических исследований . 116 (6): 1494–1505. дои : 10.1172/JCI26498 . ПМЦ 1459069 . ПМИД 16691291 .
- ^ Мурао К., Охяма Т., Имати Х., Исида Т., Цао В.М., Намихира Х. и др. (сентябрь 2000 г.). «Стимуляция TNF-альфа экспрессии MCP-1 опосредована путем передачи сигнала Akt/PKB в эндотелиальных клетках сосудов». Связь с биохимическими и биофизическими исследованиями . 276 (2): 791–796. дои : 10.1006/bbrc.2000.3497 . ПМИД 11027549 .
- ^ Харауи Б., Байкерк В. (март 2007 г.). «Этанерцепт в лечении ревматоидного артрита» . Терапия и управление клиническими рисками . 3 (1): 99–105. дои : 10.2147/tcrm.2007.3.1.99 . ЧВК 1936291 . ПМИД 18360618 .
- ^ Саломон Б.Л., Леклерк М., Тоселло Дж., Ронин Э., Пьяджио Э., Коэн Дж.Л. (2018). «Фактор некроза опухоли α и регуляторные Т-клетки в онкоиммунологии» . Границы в иммунологии . 9 : 444. дои : 10.3389/fimmu.2018.00444 . ПМЦ 5857565 . ПМИД 29593717 .
- ^ Korneev KV, Atretkhany KN, Drutskaya MS, Grivennikov SI, Kuprash DV, Nedospasov SA (January 2017). "TLR-signaling and proinflammatory cytokines as drivers of tumorigenesis". Cytokine . 89 : 127–135. doi : 10.1016/j.cyto.2016.01.021 . PMID 26854213 .
- ^ Баумистер Т., Баух А., Раффнер Х., Ангранд П.О., Бергамини Г., Кротон К. и др. (февраль 2004 г.). «Физическая и функциональная карта пути передачи сигнала TNF-альфа / NF-каппа B человека». Природная клеточная биология . 6 (2): 97–105. дои : 10.1038/ncb1086 . ПМИД 14743216 . S2CID 11683986 .
- ^ Мишо О, Чопп Дж (июль 2003 г.). «Индукция апоптоза, опосредованного рецептором TNF I, посредством двух последовательных сигнальных комплексов». Клетка . 114 (2): 181–190. дои : 10.1016/S0092-8674(03)00521-X . ПМИД 12887920 . S2CID 17145731 .
- ^ Кларк И.А. (июнь – август 2007 г.). «Как TNF был признан ключевым механизмом заболевания». Обзоры цитокинов и факторов роста . 18 (3–4): 335–343. doi : 10.1016/j.cytogfr.2007.04.002 . hdl : 1885/31135 . ПМИД 17493863 . S2CID 36721785 .
Внешние ссылки
[ редактировать ]- Фактор некроза опухоли-альфа в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Обзор всей структурной информации, доступной в PDB для UniProt : P01375 (фактор некроза опухоли) в PDBe-KB .