Нейромодуляция
Нейромодуляция — это физиологический процесс, посредством которого данный нейрон использует одно или несколько химических веществ для регулирования различных популяций нейронов. Нейромодуляторы обычно связываются с метаботропными рецепторами , связанными с G-белком (GPCR), инициируя каскад передачи сигналов вторичного мессенджера, который индуцирует широкий и продолжительный сигнал. Эта модуляция может длиться от сотен миллисекунд до нескольких минут. Некоторые из эффектов нейромодуляторов включают изменение внутренней импульсной активности, [1] увеличение или уменьшение токов, зависящих от напряжения, [2] изменение синаптической эффективности, увеличение взрывной активности [2] и реконфигурация синаптической связи. [3]

К основным нейромодуляторам центральной нервной системы относятся: дофамин , серотонин , ацетилхолин , гистамин , норадреналин , оксид азота и некоторые нейропептиды . Каннабиноиды также могут быть мощными нейромодуляторами ЦНС. [4] [5] [6] Нейромодуляторы могут быть упакованы в везикулы и высвобождены нейронами, секретированы в виде гормонов и доставлены через систему кровообращения. [7] Нейромодулятор можно представить как нейромедиатор , который не реабсорбируется пресинаптическим нейроном и не расщепляется до метаболита. Некоторые нейромодуляторы в конечном итоге проводят значительное количество времени в спинномозговой жидкости (СМЖ), влияя (или «модулируя») активность нескольких других нейронов головного мозга . [8]
Нейромодуляторные системы
[ редактировать ]Основными системами нейротрансмиттеров являются норадреналиновая (норадреналиновая) система, дофаминовая система, серотониновая система и холинергическая система. Лекарства, нацеленные на нейромедиаторы таких систем, влияют на всю систему, что объясняет механизм действия многих лекарств.
С другой стороны, большинство других нейротрансмиттеров, например, глутамат , ГАМК и глицин , широко используются в центральной нервной системе.
| Система | Источник [9] | Цели [9] | Эффекты [9] |
|---|---|---|---|
| Норадреналиновая система | Голубое пятно | Адренергические рецепторы : |
|
| Латеральное тегментальное поле | |||
| Дофаминовая система | Дофаминовые пути : | Дофаминовые рецепторы на окончаниях пути. | |
| Серотониновая система | ядро каудального дорсального шва | Рецепторы серотонина : |
|
| рострального дорсального шва ядро | Рецепторы серотонина : | ||
| Холинергическая система | Ножковое ядро и дорсолатеральные тегментальные ядра ( понтомезэнцефалотегментальный комплекс ) | (в основном) рецепторы M1 в: |
|
| базальное оптическое ядро Мейнерта | (в основном) рецепторы M1 в: | ||
| медиальное перегородочное ядро | (в основном) рецепторы M1 в: |
Норадреналиновая система
[ редактировать ]
Норадреналиновая система состоит примерно из 15 000 нейронов, преимущественно в голубом пятне . [12] Это ничтожно мало по сравнению с более чем 100 миллиардами нейронов в мозге. Как и дофаминергические нейроны черной субстанции, нейроны голубого пятна имеют тенденцию быть пигментированными меланином . Норадреналин высвобождается из нейронов и действует на адренергические рецепторы . Норадреналин часто высвобождается постоянно, чтобы подготовить поддерживающие глиальные клетки к калиброванным ответам. Несмотря на относительно небольшое количество нейронов, норадреналиновая система при активации играет важную роль в мозге, включая участие в подавлении нейровоспалительной реакции, стимуляции пластичности нейронов посредством LTP, регуляции поглощения глутамата астроцитами и LTD, а также консолидации памяти. . [13]
Дофаминовая система
[ редактировать ]Дофаминовая или дофаминергическая система состоит из нескольких путей, берущих начало, из вентральной покрышки или черной субстанции например, . Он действует на дофаминовые рецепторы . [14]

Болезнь Паркинсона, по крайней мере частично, связана с выпадением дофаминергических клеток в глубоких ядрах мозга , в первую очередь меланин-пигментированных нейронов черной субстанции и, во вторую очередь, норадренергических нейронов голубого пятна. Были предложены и применяются методы лечения, усиливающие эффект предшественников дофамина, с умеренным успехом.
Дофаминовая фармакология
[ редактировать ]- Кокаин , например, блокирует обратный захват дофамина синаптической , оставляя эти нейромедиаторы в щели на более длительное время.
- AMPT предотвращает превращение тирозина в L-ДОФА , предшественник дофамина; резерпин предотвращает накопление дофамина в везикулах ; а депренил ингибирует моноаминоксидазу (МАО)-B и, таким образом, повышает уровень дофамина.
Серотониновая система
[ редактировать ]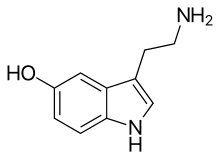
Серотонин, вырабатываемый мозгом, составляет около 10% от общего количества серотонина в организме. Большая часть (80-90%) обнаруживается в желудочно-кишечном тракте. [15] [16] Он путешествует по мозгу вдоль медиального пучка переднего мозга и действует на рецепторы серотонина . В периферической нервной системе (например, в стенке кишечника) серотонин регулирует тонус сосудов.
Серотониновая фармакология
[ редактировать ]- Селективные ингибиторы обратного захвата серотонина (СИОЗС), такие как флуоксетин , являются широко используемыми антидепрессантами, которые специфически блокируют обратный захват серотонина с меньшим влиянием на другие медиаторы. [17] [18] [19]
- Трициклические антидепрессанты также блокируют обратный захват биогенных аминов из синапсов, но могут в первую очередь влиять на серотонин или норадреналин, или на то и другое. Обычно им требуется от четырех до шести недель, чтобы облегчить любые симптомы депрессии. Считается, что они имеют немедленный и долгосрочный эффект. [17] [19] [20]
- Ингибиторы моноаминоксидазы позволяют осуществлять обратный захват биогенных аминных нейротрансмиттеров из синапса, но ингибируют фермент , который обычно разрушает (метаболизирует) некоторые медиаторы после их обратного захвата. Больше нейротрансмиттеров (особенно серотонина , норадреналина и дофамина ) доступно для высвобождения в синапсы. ИМАО требуется несколько недель, чтобы облегчить симптомы депрессии. [17] [19] [21] [22]
Хотя изменения в нейрохимии обнаруживаются сразу после приема этих антидепрессантов, симптомы могут начать улучшаться только через несколько недель после приема. Повышение уровня медиатора в синапсе само по себе не облегчает депрессию или тревогу. [17] [19] [22]
Холинергическая система
[ редактировать ]Холинергическая система состоит из проекционных нейронов мостовидного ядра , латеродорсального тегментального ядра , базального отдела переднего мозга и интернейронов полосатого тела и прилежащего ядра. Пока неясно, действует ли ацетилхолин как нейромодулятор посредством объемной передачи или классической синаптической передачи, поскольку есть доказательства, подтверждающие обе теории. Ацетилхолин связывается как с метаботропными мускариновыми рецепторами (мАХР), так и с ионотропными никотиновыми рецепторами (нАХР). Было обнаружено, что холинергическая система участвует в реагировании на сигналы, связанные с путем вознаграждения, усилении обнаружения сигналов и сенсорного внимания, регулировании гомеостаза, опосредовании реакции на стресс и кодировании формирования воспоминаний. [23] [24]
ПЕРЕДНИЙ
[ редактировать ]
Гамма-аминомасляная кислота (ГАМК) оказывает тормозящее действие на деятельность головного и спинного мозга. [17] ГАМК – это аминокислота, которая является основным тормозным нейромедиатором центральной нервной системы (ЦНС). Он снижает возбудимость нейронов, подавляя нервную передачу. ГАМК выполняет множество различных функций во время развития и влияет на миграцию, пролиферацию и правильное морфологическое развитие нейронов. Это также влияет на время критических периодов и потенциально запускает самые ранние нейронные сети. Существует два основных типа рецепторов ГАМК: ГАМКа и ГАМКаб. Рецепторы ГАМКа ингибируют высвобождение нейромедиаторов и/или возбудимость нейронов и представляют собой лиганд-управляемые хлоридные каналы. Рецепторы GABAb реагируют медленнее из-за GCPR, который ингибирует нейроны. ГАМК может быть виновником многих расстройств, от шизофрении до большого депрессивного расстройства, из-за ослабления ее тормозных свойств. [25] [26] [27]
Нейропептиды
[ редактировать ]Нейропептиды — это небольшие белки, используемые для связи в нервной системе. Нейропептиды представляют собой наиболее разнообразный класс сигнальных молекул. Известно 90 генов, кодирующих предшественники нейропептидов человека. У беспозвоночных известно около 50 генов, кодирующих предшественники нейропептидов. [28] Большинство нейропептидов связываются с рецепторами, связанными с G-белком, однако некоторые нейропептиды непосредственно воротают ионные каналы или действуют через киназные рецепторы.
- Опиоидные пептиды – большое семейство эндогенных нейропептидов, широко распространенных в центральной и периферической нервной системе. Опиатные наркотики, такие как героин и морфин, действуют на рецепторы этих нейротрансмиттеров. [29] [30]
- Вазопрессин
- окситоцин
- Гастрин
- Холецистокинины
- Соматостатин
- Кортистатины
- RF-амиды
- Нейропептид FF
- Нейропептид Y -
- Панкреатический полипептид
- Пептид YY
- Пептид, высвобождающий пролактин
- Кальцитонин
- Адреномедуллин
- натриуретик
- Бомбезиноподобные пептиды
- Эндотелин
- глюкагон
- секретин
- Вазоактивный кишечный пептид
- Релизинг-гормон гормона роста
- Желудочный ингибирующий пептид
- Кортикотропин-рилизинг-гормон
- Урокортин
- Уротензин
- Вещество Р
- Нейромедины
- Напряжение
- Хинин
- Бабушка
- Фактор роста нервов
- я переехал
- Грелин
- Галанин
- Нейропептид Ч/Б
- Нейрексофилин
- Инсулин
- Релаксин
- Ген гомолога белка, родственного агути
- Пролактин
- Обращение
- Подавитель метастазов
- Ингибитор связывания диазепама
- Церебеллины
- Пойдем
- Адипонектин
- Висфатин
- резистин
- Нуклеибиндин
- Убикитин
Нервно-мышечные системы
[ редактировать ]Нейромодуляторы могут изменять выходные данные физиологической системы, воздействуя на соответствующие входы (например, генераторы центральных паттернов ). Однако работа по моделированию показывает, что одного этого недостаточно. [31] потому что нервно-мышечная трансформация от нервного входа к мышечным выходным сигналам может быть настроена на определенные диапазоны входных сигналов. Стерн и др. (2007) предполагают, что нейромодуляторы должны воздействовать не только на входную систему, но и изменять саму трансформацию, чтобы на выходе вызывать правильные сокращения мышц. [31]
Передача объема
[ редактировать ]Нейромедиаторные системы — это системы нейронов головного мозга, экспрессирующие определенные типы нейротрансмиттеров и, таким образом, образующие отдельные системы. Активация системы вызывает эффекты в больших объемах мозга, называемые объемной передачей . [32] Объемная передача — это диффузия нейротрансмиттеров через внеклеточную жидкость головного мозга, высвобождаемых в точках, которые могут быть удалены от клеток-мишеней, с последующей активацией внесинаптических рецепторов и с более длительным периодом времени, чем при передаче через одиночный синапс. [33] Такое продолжительное действие передатчика называется тонической передачей , в отличие от фазической передачи , которая происходит быстро в одиночных синапсах. [34] [35]
Тоническая передача
Существует три основных компонента передачи тоника: продолжительное высвобождение, замедленное высвобождение и базовая регуляция. В контексте нейромодуляции непрерывное высвобождение отвечает за высвобождение нейротрансмиттеров/нейромодуляторов на постоянно низком уровне из глиальных клеток и тонически активных нейронов. Устойчивое влияние обеспечивает долгосрочную стабильность всего процесса, а базовое регулирование гарантирует, что нейроны находятся в состоянии постоянной готовности реагировать на любые сигналы. Ацетилхолин, норадреналин, дофамин, норадреналин и серотонин являются одними из основных компонентов тонической передачи, обеспечивающих возбуждение и внимание. [1]
Фазовая передача
Существует три основных компонента фазовой передачи: импульсный выброс, временные эффекты и эффекты, вызванные стимулом. Как следует из названия, взрывной выброс отвечает за высвобождение нейротрансмиттеров/нейромодуляторов интенсивными, острыми выбросами. Временные эффекты вызывают резкие мгновенные изменения в нейронной активности. Наконец, как следует из названия, стимулирующие эффекты реагируют на сенсорную информацию, внешние стрессоры и стимулы вознаграждения, которые включают дофамин, норадреналин и серотонин. [2]
Виды нейромодуляционной терапии и лечения
[ редактировать ]Существует две основные категории нейромодуляционной терапии: химическая и электрическая.
Электрическая нейромодуляторная терапия
Электрическая нейромодуляция имеет три подкатегории: глубокую мозговую, спинную и транскраниальную, каждая из которых направлена на лечение определенных состояний. Глубокая стимуляция мозга предполагает хирургическую имплантацию электродов в определенные участки мозга, которые обычно ответственны за нарушения и нарушения двигательного контроля, такие как болезнь Паркинсона и тремор. Стимуляция спинного мозга проводится рядом со спинным мозгом и посылает электрические сигналы по всему телу для лечения различных форм хронической боли, таких как боль в пояснице и КРБС. Эта форма лечения нейромодуляторами считается одним из методов лечения с повышенным риском из-за воздействия на спинной мозг. Транскраниальная магнитная стимуляция немного отличается тем, что использует магнитное поле для генерации электрических токов по всему мозгу. Это лечение широко используется для лечения различных психических заболеваний, таких как депрессия, обсессивно-компульсивное расстройство и другие расстройства настроения. [3] [4]
Нейромодуляция часто используется в качестве механизма лечения мигрени средней и тяжелой степени путем стимуляции нервов. Эти методы лечения работают, используя основные восходящие пути. Есть три основных режима. Он работает путем подключения к телу устройства, которое посылает электрические импульсы непосредственно в пораженный участок (чрескожная электрическая стимуляция нервов), непосредственно в мозг (транскраниальная магнитная стимуляция) или путем поднесения устройства близко к шее, которое блокирует болевые сигналы. модуляция от ПНС к ЦНС. [5] и описывает два наиболее примечательных способа этого лечения: электрическую и магнитную стимуляцию. Электрическая стимуляция нервов и некоторые характеристики включают транскраниальную переменную стимуляцию и транскраниальную стимуляцию постоянным током. Другой метод — магнитная стимуляция, которая включает в себя одиночный импульс и повторяющуюся транскраниальную стимуляцию.
Химическая нейромодульная терапия
Химическая нейромодуляция в основном состоит из взаимодействия природных и искусственных химических веществ для лечения различных состояний. Здесь используются как инвазивные, так и неинвазивные методы лечения, включая помпы, инъекции и пероральные препараты. Этот метод лечения можно использовать для управления иммунными реакциями, такими как воспаление, настроение и двигательные расстройства. [6]
См. также
[ редактировать ]- Агонист рецептора 5-HT2c
- Натуральное нейроактивное вещество
- Определение оценки достоверности симптома : достоверность испытуемого проверяется путем проверки его правдивости и точности в отношении конкретного поведенческого представления, самоотчетов и нейропсихологических показателей. [36] Определение тестирования валидности показателей – способ, с помощью которого экзаменатор измеряет общую эффективность метода оценки. [37] [Пользователь:Ngwinn]/Редактирование пользователя:Ngwinn/Нейромодуляция - Arc.Ask3.Ru]
Ссылки
[ редактировать ]- ^ ДеРимер С.А., Стронг Дж.А., Альберт К.А., Грингард П., Качмарек Л.К. (24–30 января 1985 г.). «Усиление тока кальция в нейронах аплизии с помощью сложного эфира форбола и протеинкиназы C». Природа . 313 (6000): 313–316. Бибкод : 1985Natur.313..313D . дои : 10.1038/313313a0 . ПМИД 2578617 . S2CID 4230710 .
- ^ Jump up to: а б Харрис-Уоррик Р.М., Фламм Р.Э. (июль 1987 г.). «Множественные механизмы взрыва в условно разрывающемся нейроне» . Журнал неврологии . 7 (7): 2113–2128. doi : 10.1523/JNEUROSCI.07-07-02113.1987 . ПМК 6568948 . ПМИД 3112322 .
- ^ Кляйн М., Кандел Э.Р. (ноябрь 1980 г.). «Механизм модуляции кальциевого тока, лежащий в основе пресинаптической фасилитации и поведенческой сенсибилизации при аплизии» . Труды Национальной академии наук Соединенных Штатов Америки . 77 (11): 6912–6916. Бибкод : 1980PNAS...77.6912K . дои : 10.1073/pnas.77.11.6912 . ПМЦ 350401 . ПМИД 6256770 .
- ^ Фортин Д.А., Левин Э.С. (январь 2007 г.). «Дифференциальное воздействие эндоканнабиноидов на глутаматергические и ГАМКергические входы в пирамидные нейроны 5-го слоя» . Кора головного мозга . 17 (1): 163–174. дои : 10.1093/cercor/bhj133 . ПМИД 16467564 .
- ^ Хороший Чемпион (январь 2007 г.). «Эндоканнабиноид-зависимая регуляция упреждающего торможения в клетках Пуркинье мозжечка» . Журнал неврологии . 27 (1): 1–3. doi : 10.1523/JNEUROSCI.4842-06.2007 . ПМЦ 6672293 . ПМИД 17205618 .
- ^ Хасимотодани Ю, Оно-Сёсаку Т, Кано М (январь 2007 г.). «Активность пресинаптической моноацилглицеринлипазы определяет базальный тонус эндоканнабиноидов и прекращает ретроградную передачу сигналов эндоканнабиноидов в гиппокампе» . Журнал неврологии . 27 (5): 1211–1219. doi : 10.1523/JNEUROSCI.4159-06.2007 . ПМК 6673197 . ПМИД 17267577 .
- ^ Мардер Э (октябрь 2012 г.). «Нейромодуляция нейрональных цепей: назад в будущее» . Нейрон . 76 (1): 1–11. дои : 10.1016/j.neuron.2012.09.010 . ПМЦ 3482119 . ПМИД 23040802 .
- ^ Конлей Л.А., Сабунджян Л.А., Вуртман Р.Дж. (октябрь 1992 г.). «Упражнения и нейромодуляторы: холин и ацетилхолин у марафонцев». Международный журнал спортивной медицины . 13 (Приложение 1): S141–S142. дои : 10.1055/s-2007-1024619 . ПМИД 1483754 . S2CID 36276472 . [ нужна проверка ]
- ^ Jump up to: а б с Если в полях не указано иное, то ссылка равна: Ранг, HP (2003). Фармакология . Эдинбург: Черчилль Ливингстон. стр. 474 для норадреналиновой системы, стр. 476 для дофаминовой системы, стр. 480 для серотониновой системы и стр. 483 для холинергической системы. ISBN 978-0-443-07145-4 .
- ^ Jump up to: а б с д и ж г Вульф, штат Нью-Джерси, Батчер, Л.Л. (декабрь 1989 г.). «Холинергические системы мозга крысы: IV. Нисходящие проекции понтомезэнцефалической покрышки». Бюллетень исследований мозга . 23 (6): 519–540. дои : 10.1016/0361-9230(89)90197-4 . ПМИД 2611694 . S2CID 4721282 .
- ^ Jump up to: а б с д Вульф, штат Нью-Джерси, Батчер, Л.Л. (май 1986 г.). «Холинергические системы в мозге крысы: III. Проекции от понтомезэнцефалической покрышки на таламус, тектум, базальные ганглии и базальные отделы переднего мозга». Бюллетень исследований мозга . 16 (5): 603–637. дои : 10.1016/0361-9230(86)90134-6 . ПМИД 3742247 . S2CID 39665815 .
- ^ Сара С.Дж., Буре С. (октябрь 2012 г.). «Ориентация и переориентация: голубое пятно обеспечивает познание посредством возбуждения» . Нейрон . 76 (1): 130–141. дои : 10.1016/j.neuron.2012.09.011 . ПМИД 23040811 .
- ^ О'Доннелл Дж., Цеппенфельд Д., МакКоннелл Е., Пена С., Недергаард М. (ноябрь 2012 г.). «Норэпинефрин: нейромодулятор, который усиливает функцию нескольких типов клеток для оптимизации работы ЦНС» . Нейрохимические исследования . 37 (11): 2496–2512. дои : 10.1007/s11064-012-0818-x . ПМЦ 3548657 . ПМИД 22717696 .
- ^ Шелер Г. (апрель 2004 г.). «Регуляция эффективности рецепторов нейромодуляторов - влияние на пластичность целых нейронов и синаптическую пластичность». Прогресс нейробиологии . 72 (6): 399–415. arXiv : q-bio/0401039 . Бибкод : 2004q.bio.....1039S . doi : 10.1016/j.pneurobio.2004.03.008 . ПМИД 15177784 . S2CID 9353254 .
- ^ Макинтош Дж. «Что такое серотонин? Что делает серотонин?» . Медицинские новости сегодня . Проверено 12 апреля 2015 г.
- ^ Бергер М., Грей Дж.А., Рот Б.Л. (2009). «Расширенная биология серотонина» . Ежегодный обзор медицины . 60 : 355–366. дои : 10.1146/annurev.med.60.042307.110802 . ПМЦ 5864293 . ПМИД 19630576 .
- ^ Jump up to: а б с д и Свеча Скорая помощь (1991). Принципы нейронауки . Восточный Норуолк, Коннектикут: Appleton & Lang. стр. 100-1 872–873 . ISBN 978-0-8385-8034-9 .
- ^ «Лекарства от депрессии: антидепрессанты, СИОЗС, антидепрессанты, СИОЗС, антидепрессанты, ТЦА, антидепрессанты, ингибиторы МАО, усиливающие агенты, модуляторы серотонин-дофаминовой активности, антидепрессанты, другие, стимуляторы, препараты для щитовидной железы, неврология и психиатрия, травы» . emedicine.medscape.com . Проверено 7 ноября 2016 г.
- ^ Jump up to: а б с д Кориелл В. (2016). «Медикаментозное лечение депрессии» . В Портере RS (ред.). Руководство Merck (19-е изд.). Станция Уайтхаус, Нью-Джерси: Merck. ISBN 978-0-911910-19-3 .
- ^ «Медикаментозное лечение депрессии» . Руководства Merck Профессиональная версия . Проверено 7 ноября 2016 г.
- ^ Бендер К.Дж., Уокер С.Е. (8 октября 2012 г.). «Возврат к необратимым ингибиторам моноаминоксидазы» . Психиатрические времена . Psychiatric Times Том 29 № 10. 29 (10) . Проверено 7 ноября 2016 г.
- ^ Jump up to: а б Уимбискус М., Костенко О., Мэлоун Д. (декабрь 2010 г.). «Ингибиторы МАО: риски, преимущества и знания» . Медицинский журнал Кливлендской клиники . 77 (12): 859–882. дои : 10.3949/ccjm.77a.09103 . ПМИД 21147941 . S2CID 33761576 .
- ^ Пиччиотто М.Р., Хигли М.Дж., Майнер Ю.С. (октябрь 2012 г.). «Ацетилхолин как нейромодулятор: холинергическая передача сигналов формирует функцию и поведение нервной системы» . Нейрон . 76 (1): 116–129. дои : 10.1016/j.neuron.2012.08.036 . ПМЦ 3466476 . ПМИД 23040810 .
- ^ Хассельмо М.Э., Сартер М. (январь 2011 г.). «Режимы и модели холинергической нейромодуляции познания переднего мозга» . Нейропсихофармакология . 36 (1): 52–73. дои : 10.1038/нпп.2010.104 . ПМЦ 2992803 . ПМИД 20668433 .
- ^ Аллен М.Дж., Сабир С., Шарма С. (2024). «ГАМК-рецептор» . СтатПерлс . Остров сокровищ (Флорида): StatPearls Publishing. ПМИД 30252380 . Проверено 27 июня 2024 г.
- ^ Сигел Э., Штайнманн М.Э. (ноябрь 2012 г.). «Структура, функции и модуляция рецепторов ГАМК (А)» . Журнал биологической химии . 287 (48): 40224–40231. дои : 10.1074/jbc.R112.386664 . ПМЦ 3504738 . ПМИД 23038269 .
- ^ Зорге Р. (2020). Динамика боли . Великая река. ISBN 978-1-64496-496-5 .
- ^ Нэссель Д.Р., Зандавала М. (август 2019 г.). «Последние достижения в передаче сигналов нейропептидов у дрозофилы, от генов до физиологии и поведения». Прогресс нейробиологии . 179 : 101607. doi : 10.1016/j.pneurobio.2019.02.003 . ПМИД 30905728 . S2CID 84846652 .
- ^ Свеча Скорая помощь (1991). Принципы нейронауки . Восточный Норуолк, Коннектикут: Appleton & Lang. стр. 100-1 872–873 . ISBN 978-0-8385-8034-9 . [ нужна проверка ]
- ^ Фрелих Дж. К. (1 января 1997 г.). «Опиоидные пептиды» (PDF) . Алкогольное здоровье и мир исследований . 21 (2): 132–136. ПМК 6826828 . ПМИД 15704349 . [ нужна проверка ]
- ^ Jump up to: а б Стерн Э., Форт Т.Дж., Миллер М.В., Пескин К.С., Брезина В. (июнь 2007 г.). «Расшифровка модуляции нервно-мышечного преобразования» . Нейрокомпьютинг . 70 (10): 1753–1758. дои : 10.1016/j.neucom.2006.10.117 . ПМК 2745187 . ПМИД 19763188 .
- ^ Табер К.Х., Херли Р.А. (январь 2014 г.). «Передача объема в мозге: за пределами синапса» . Журнал нейропсихиатрии и клинических нейронаук . 26 (1): iv, 1-iv, 4. doi : 10.1176/appi.neuropsych.13110351 . ПМИД 24515717 .
- ^ Кастаньеда-Эрнандес Г.К., Бах-и-Рита П. (август 2003 г.). «Передача объема и восприятие боли» . Научный мировой журнал . 3 : 677–683. дои : 10.1100/tsw.2003.53 . ПМЦ 5974734 . ПМИД 12920309 .
- ^ Дрейер Дж.К., Херрик К.Ф., Берг Р.В., Хаунсгаард Дж.Д. (октябрь 2010 г.). «Влияние фазового и тонического высвобождения дофамина на активацию рецепторов» . Журнал неврологии . 30 (42): 14273–14283. doi : 10.1523/JNEUROSCI.1894-10.2010 . ПМК 6634758 . ПМИД 20962248 .
- ^ Гото Ю., Отани С., Грейс А.А. (октябрь 2007 г.). «Инь и Ян высвобождения дофамина: новый взгляд» . Нейрофармакология . 53 (5): 583–587. doi : 10.1016/j.neuropharm.2007.07.007 . ПМК 2078202 . ПМИД 17709119 .
- ^ Буш С.С., Рафф Р.М., Тростер А.И., Барт Дж.Т., Коффлер С.П., Плискин Н.Х. и др. (июнь 2005 г.). «Оценка достоверности симптомов: вопросы практики и медицинская необходимость, комитет по политике и планированию NAN». Архив клинической нейропсихологии . 20 (4): 419–426. дои : 10.1016/j.acn.2005.02.002 . ПМИД 15896556 .
- ^ Грехер М.Р., Водушек Т.Р. (март 2017 г.). «Тестирование валидности эффективности в нейропсихологии: научная основа и клиническое применение - краткий обзор». Журнал психиатрической практики . 23 (2): 134–140. doi : 10.1097/PRA.0000000000000218 . ПМИД 28291039 .
