Cobalt
 | ||||||||||||||||||||||||||||||||||||
| Cobalt | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | /ˈkoʊbɒlt/ [1] | |||||||||||||||||||||||||||||||||||
| Appearance | Hard lustrous bluish gray metal | |||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Co) | ||||||||||||||||||||||||||||||||||||
| Cobalt in the periodic table | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 27 | |||||||||||||||||||||||||||||||||||
| Group | group 9 | |||||||||||||||||||||||||||||||||||
| Period | period 4 | |||||||||||||||||||||||||||||||||||
| Block | d-block | |||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 3d7 4s2 | |||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 15, 2 | |||||||||||||||||||||||||||||||||||
| Physical properties | ||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | |||||||||||||||||||||||||||||||||||
| Melting point | 1768 K (1495 °C, 2723 °F) | |||||||||||||||||||||||||||||||||||
| Boiling point | 3200 K (2927 °C, 5301 °F) | |||||||||||||||||||||||||||||||||||
| Density (at 20° C) | 8.834 g/cm3 [4] | |||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 7.75 g/cm3 | |||||||||||||||||||||||||||||||||||
| Heat of fusion | 16.06 kJ/mol | |||||||||||||||||||||||||||||||||||
| Heat of vaporization | 377 kJ/mol | |||||||||||||||||||||||||||||||||||
| Molar heat capacity | 24.81 J/(mol·K) | |||||||||||||||||||||||||||||||||||
Vapor pressure
| ||||||||||||||||||||||||||||||||||||
| Atomic properties | ||||||||||||||||||||||||||||||||||||
| Oxidation states | −3, −1, 0, +1, +2, +3, +4, +5[5] (an amphoteric oxide) | |||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.88 | |||||||||||||||||||||||||||||||||||
| Ionization energies |
| |||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 125 pm | |||||||||||||||||||||||||||||||||||
| Covalent radius | Low spin: 126±3 pm High spin: 150±7 pm | |||||||||||||||||||||||||||||||||||
| Other properties | ||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | |||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonal close-packed (hcp) (hP2) | |||||||||||||||||||||||||||||||||||
| Lattice constants | a = 250.71 pm c = 407.00 pm (at 20 °C)[4] | |||||||||||||||||||||||||||||||||||
| Thermal expansion | 12.9×10−6/K (at 20 °C)[a] | |||||||||||||||||||||||||||||||||||
| Thermal conductivity | 100 W/(m⋅K) | |||||||||||||||||||||||||||||||||||
| Electrical resistivity | 62.4 nΩ⋅m (at 20 °C) | |||||||||||||||||||||||||||||||||||
| Magnetic ordering | Ferromagnetic | |||||||||||||||||||||||||||||||||||
| Young's modulus | 209 GPa | |||||||||||||||||||||||||||||||||||
| Shear modulus | 75 GPa | |||||||||||||||||||||||||||||||||||
| Bulk modulus | 180 GPa | |||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 4720 m/s (at 20 °C) | |||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.31 | |||||||||||||||||||||||||||||||||||
| Mohs hardness | 5.0 | |||||||||||||||||||||||||||||||||||
| Vickers hardness | 1043 MPa | |||||||||||||||||||||||||||||||||||
| Brinell hardness | 470–3000 MPa | |||||||||||||||||||||||||||||||||||
| CAS Number | 7440-48-4 | |||||||||||||||||||||||||||||||||||
| History | ||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | Georg Brandt (1735) | |||||||||||||||||||||||||||||||||||
| Isotopes of cobalt | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||
Cobalt is a chemical element; it has symbol Co and atomic number 27. As with nickel, cobalt is found in the Earth's crust only in a chemically combined form, save for small deposits found in alloys of natural meteoric iron. The free element, produced by reductive smelting, is a hard, lustrous, somewhat brittle, gray metal.
Cobalt-based blue pigments (cobalt blue) have been used since antiquity for jewelry and paints, and to impart a distinctive blue tint to glass. The color was long thought to be due to the metal bismuth. Miners had long used the name kobold ore (German for goblin ore) for some of the blue pigment-producing minerals. They were so named because they were poor in known metals and gave off poisonous arsenic-containing fumes when smelted.[7] In 1735, such ores were found to be reducible to a new metal (the first discovered since ancient times), which was ultimately named for the kobold.
Today, some cobalt is produced specifically from one of a number of metallic-lustered ores, such as cobaltite (CoAsS). The element is more usually produced as a by-product of copper and nickel mining. The Copperbelt in the Democratic Republic of the Congo (DRC) and Zambia yields most of the global cobalt production. World production in 2016 was 116,000 tonnes (114,000 long tons; 128,000 short tons) (according to Natural Resources Canada), and the DRC alone accounted for more than 50%.[8]
Cobalt is primarily used in lithium-ion batteries, and in the manufacture of magnetic, wear-resistant and high-strength alloys. The compounds cobalt silicate and cobalt(II) aluminate (CoAl2O4, cobalt blue) give a distinctive deep blue color to glass, ceramics, inks, paints and varnishes. Cobalt occurs naturally as only one stable isotope, cobalt-59. Cobalt-60 is a commercially important radioisotope, used as a radioactive tracer and for the production of high-energy gamma rays. Cobalt is also used in the petroleum industry as a catalyst when refining crude oil. This is to purge it of sulfur, which is very polluting when burned and causes acid rain.[9]
Cobalt is the active center of a group of coenzymes called cobalamins. Vitamin B12, the best-known example of the type, is an essential vitamin for all animals. Cobalt in inorganic form is also a micronutrient for bacteria, algae, and fungi.
The name cobalt derives from a type of ore considered a nuisance by 16th century German silver miners, which in turn may have been named from a spirit or goblin held superstitiously responsible for it; this spirit is considered equitable to the kobold (a household spirit) by some, or, categorized as a gnome (mine spirit) by others.
Characteristics
[edit]
Cobalt is a ferromagnetic metal with a specific gravity of 8.9. The Curie temperature is 1,115 °C (2,039 °F)[10] and the magnetic moment is 1.6–1.7 Bohr magnetons per atom.[11] Cobalt has a relative permeability two-thirds that of iron.[12] Metallic cobalt occurs as two crystallographic structures: hcp and fcc. The ideal transition temperature between the hcp and fcc structures is 450 °C (842 °F), but in practice the energy difference between them is so small that random intergrowth of the two is common.[13][14][15]
Cobalt is a weakly reducing metal that is protected from oxidation by a passivating oxide film. It is attacked by halogens and sulfur. Heating in oxygen produces Co3O4 which loses oxygen at 900 °C (1,650 °F) to give the monoxide CoO.[16] The metal reacts with fluorine (F2) at 520 K to give CoF3; with chlorine (Cl2), bromine (Br2) and iodine (I2), producing equivalent binary halides. It does not react with hydrogen gas (H2) or nitrogen gas (N2) even when heated, but it does react with boron, carbon, phosphorus, arsenic and sulfur.[17] At ordinary temperatures, it reacts slowly with mineral acids, and very slowly with moist, but not dry, air.[citation needed]
Compounds
[edit]Common oxidation states of cobalt include +2 and +3, although compounds with oxidation states ranging from −3 to +5 are also known. A common oxidation state for simple compounds is +2 (cobalt(II)). These salts form the pink-colored metal aquo complex [Co(H
2O)
6]2+
in water. Addition of chloride gives the intensely blue [CoCl
4]2−
.[5] In a borax bead flame test, cobalt shows deep blue in both oxidizing and reducing flames.[18]
Oxygen and chalcogen compounds
[edit]Several oxides of cobalt are known. Green cobalt(II) oxide (CoO) has rocksalt structure. It is readily oxidized with water and oxygen to brown cobalt(III) hydroxide (Co(OH)3). At temperatures of 600–700 °C, CoO oxidizes to the blue cobalt(II,III) oxide (Co3O4), which has a spinel structure.[5] Black cobalt(III) oxide (Co2O3) is also known.[19] Cobalt oxides are antiferromagnetic at low temperature: CoO (Néel temperature 291 K) and Co3O4 (Néel temperature: 40 K), which is analogous to magnetite (Fe3O4), with a mixture of +2 and +3 oxidation states.[20]
The principal chalcogenides of cobalt are the black cobalt(II) sulfides, CoS2 (pyrite structure), Co2S3 (spinel structure), and CoS (nickel arsenide structure).[5]: 1118
Halides
[edit]
Four dihalides of cobalt(II) are known: cobalt(II) fluoride (CoF2, pink), cobalt(II) chloride (CoCl2, blue), cobalt(II) bromide (CoBr2, green), cobalt(II) iodide (CoI2, blue-black). These halides exist in anhydrous and hydrated forms. Whereas the anhydrous dichloride is blue, the hydrate is red.[21]
The reduction potential for the reaction Co3+
+ e− → Co2+
is +1.92 V, beyond that for chlorine to chloride, +1.36 V. Consequently, cobalt(III) chloride would spontaneously reduce to cobalt(II) chloride and chlorine. Because the reduction potential for fluorine to fluoride is so high, +2.87 V, cobalt(III) fluoride is one of the few simple stable cobalt(III) compounds. Cobalt(III) fluoride, which is used in some fluorination reactions, reacts vigorously with water.[16]
Coordination compounds
[edit]The inventory of complexes is very large. Starting with higher oxidation states, complexes of Co(IV) and Co(V) are rare. Examples are found in caesium hexafluorocobaltate(IV) (Cs2CoF6) and potassium percobaltate (K3CoO4).[16]
Cobalt(III) forms a wide variety of coordination complexes with ammonia and amines, which are called ammine complexes. Examples include [Co(NH3)6]3+, [Co(NH3)5Cl]2+ (chloropentamminecobalt(III)), and cis- and trans-[Co(NH3)4Cl2]+. The corresponding ethylenediamine complexes are also well known. Analogues are known where the halides are replaced by nitrite, hydroxide, carbonate, etc. Alfred Werner worked extensively on these complexes in his Nobel-prize winning work.[22] The robustness of these complexes is demonstrated by the optical resolution of tris(ethylenediamine)cobalt(III) ([Co(en)
3]3+
).[23]
Cobalt(II) forms a wide variety of complexes, but mainly with weakly basic ligands. The pink-colored cation hexaaquocobalt(II) [Co(H2O)6]2+ is found in several routine cobalt salts such as the nitrate and sulfate. Upon addition of excess chloride, solutions of the hexaaquo complex converts to the deep blue CoCl2−4, which is tetrahedral.
Softer ligands like triphenylphosphine form complexes with Co(II) and Co(I), examples being bis- and tris(triphenylphosphine)cobalt(I) chloride, CoCl2(PPh3)2 and CoCl(PPh3)3. These Co(I) and Co(II) complexes represent a link to the organometallic complexes described below.
Organometallic compounds
[edit]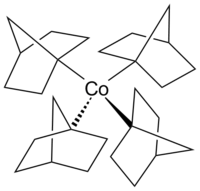
Cobaltocene is a structural analog to ferrocene, with cobalt in place of iron. Cobaltocene is much more sensitive to oxidation than ferrocene.[24] Cobalt carbonyl (Co2(CO)8) is a catalyst in carbonylation and hydrosilylation reactions.[25] Vitamin B12 (see below) is an organometallic compound found in nature and is the only vitamin that contains a metal atom.[26] An example of an alkylcobalt complex in the otherwise uncommon +4 oxidation state of cobalt is the homoleptic complex tetrakis(1-norbornyl)cobalt(IV) (Co(1-norb)4), a transition metal-alkyl complex that is notable for its resistance to β-hydrogen elimination,[27] in accord with Bredt's rule. The cobalt(III) and cobalt(V) complexes [Li(THF)
4]+
[Co(1-norb)
4]−
and [Co(1-norb)
4]+
[BF
4]−
are also known.[28]
Isotopes
[edit]59Co is the only stable cobalt isotope and the only isotope that exists naturally on Earth. Twenty-two radioisotopes have been characterized: the most stable, 60Co, has a half-life of 5.2714 years; 57Co has a half-life of 271.8 days; 56Co has a half-life of 77.27 days; and 58Co has a half-life of 70.86 days. All the other radioactive isotopes of cobalt have half-lives shorter than 18 hours, and in most cases shorter than 1 second. This element also has 4 meta states, all of which have half-lives shorter than 15 minutes.[29]
The isotopes of cobalt range in atomic weight from 50 u (50Co) to 73 u (73Co). The primary decay mode for isotopes with atomic mass unit values less than that of the only stable isotope, 59Co, is electron capture and the primary mode of decay in isotopes with atomic mass greater than 59 atomic mass units is beta decay. The primary decay products below 59Co are element 26 (iron) isotopes; above that the decay products are element 28 (nickel) isotopes.[29]
Etymology
[edit]Many different stories about the origin of the word "cobalt" have been proposed. In one version the element cobalt was named after "kobelt", the name which 16th century German silver miners had given to a nuisance type of ore which occurred that was corrosive and issued poisonous gas.[30][31] Although such ores had been used for blue pigmentation since antiquity, the Germans at that time did not have the technology to smelt the ore into metal (cf. § History below).[32]
The authority on such kobelt ore (Latinized as cobaltum or cadmia[33][34]) at the time was Georgius Agricola.[30][32] He was also the oft-quoted authority on the mine spirits called "kobel" (Latinized as cobalus or pl. cobali) in a separate work.[35][36][37]
Agricola did not make an connection between the similarly named ore and spirit. However, a causal connection (ore blamed on "kobel") was made by a contemporary,[39] and a word origin connection (word "formed" from cobalus) made by a late 18th century writer.[40] Later, Grimms' dictionary (1868) noted the kobalt/kobelt ore was blamed on the mountain spirit (Bergmännchen[b]) which was also held responsible for "stealing the silver and putting out an ore that caused poor mining atmosphere (Wetter[41]) and other health hazards".[31]
Grimms' dictionary entries equated the word "kobel" with "kobold", and listed it as a mere variant diminutive,[43] but the latter is defined in it as a household spirit.[42] Whereas some of the more recent commentators prefer to characterize the ore's namesake kobelt (recté kobel) as a gnome.[44][47]
The early 20th century Oxford English Dictionary (1st edition, 1908) had upheld Grimm's etymology.[c][48] But by around the same time in Germany, the alternate etymology not endorsed by Grimm (kob/kof "house, chamber" + walt "power, ruler") was being proposed as more convincing.[49][50]
Somewhat later, Paul Kretschmer (1928) explained that while this "house ruler" etymology was the proper one that backed the original meaning of kobold as household spirit, a corruption later occurred introducing the idea of "mine demon" to it.[51] The present edition of the Etymologisches Wörterbuch (25th ed., 2012) under "kobold" lists the latter, not Grimm's etymology, but still persists, under its entry for "kobalt", that while the cobalt ore may have got its name from "a type of mine spirit/demon" (daemon metallicus) while stating that this is "apparently" the kobold.[52]
Joseph William Mellor (1935) also stated that cobalt may derive from kobalos (κόβαλος), though other theories had been suggested.[53]
Alternate theories
[edit]Several alternative etymologies that have been suggested, which may not involve a spirit (kobel or kobold) at all. Karl Müller-Fraureuth conjectured that kobelt derived from Kübel, a bucket used in mining, frequently mentioned by Agricola,[49] namely the kobel/köbel (Latinized as modulus).[54]
Another theory given by the Etymologisches Wörterbuch derives the term from kōbathium[52] or rather cobathia (κωβάθια, "arsenic sulfide"[55]) which occurs as noxious fumes.[32]
An etymology from Slavonic kowalti was suggested by Emanuel Merck (1902).[56][53]
W. W. Skeat and J. Berendes construed κόβαλος as "parasite", i.e. as an ore parasitic to nickel,[53] but this explanation is faulted for its anachronism since nickel was not discovered until 1751.[57][58]
History
[edit]
Cobalt compounds have been used for centuries to impart a rich blue color to glass, glazes, and ceramics. Cobalt has been detected in Egyptian sculpture, Persian jewelry from the third millennium BC, in the ruins of Pompeii, destroyed in 79 AD, and in China, dating from the Tang dynasty (618–907 AD) and the Ming dynasty (1368–1644 AD).[59]
Cobalt has been used to color glass since the Bronze Age. The excavation of the Uluburun shipwreck yielded an ingot of blue glass, cast during the 14th century BC.[60][61] Blue glass from Egypt was either colored with copper, iron, or cobalt. The oldest cobalt-colored glass is from the eighteenth dynasty of Egypt (1550–1292 BC). The source for the cobalt the Egyptians used is not known.[62]
The word cobalt is derived from the 16th century German "kobelt", a type of ore, as aforementioned. The first attempts to smelt those ores for copper or silver failed, yielding simply powder (cobalt(II) oxide) instead. Because the primary ores of cobalt always contain arsenic, smelting the ore oxidized the arsenic into the highly toxic and volatile arsenic oxide, adding to the notoriety of the ore.[63] Paracelsus, Georgius Agricola, and Basil Valentine all referred to such silicates as "cobalt".[64]
Swedish chemist Georg Brandt (1694–1768) is credited with discovering cobalt c. 1735, showing it to be a previously unknown element, distinct from bismuth and other traditional metals. Brandt called it a new "semi-metal".[65][66] He showed that compounds of cobalt metal were the source of the blue color in glass, which previously had been attributed to the bismuth found with cobalt. Cobalt became the first metal to be discovered since the pre-historical period. All previously known metals (iron, copper, silver, gold, zinc, mercury, tin, lead and bismuth) had no recorded discoverers.[67]
During the 19th century, a significant part of the world's production of cobalt blue (a pigment made with cobalt compounds and alumina) and smalt (cobalt glass powdered for use for pigment purposes in ceramics and painting) was carried out at the Norwegian Blaafarveværket.[68][69] The first mines for the production of smalt in the 16th century were located in Norway, Sweden, Saxony and Hungary. With the discovery of cobalt ore in New Caledonia in 1864, the mining of cobalt in Europe declined. With the discovery of ore deposits in Ontario, Canada, in 1904 and the discovery of even larger deposits in the Katanga Province in the Congo in 1914, mining operations shifted again.[63] When the Shaba conflict started in 1978, the copper mines of Katanga Province nearly stopped production.[70][71] The impact on the world cobalt economy from this conflict was smaller than expected: cobalt is a rare metal, the pigment is highly toxic, and the industry had already established effective ways for recycling cobalt materials. In some cases, industry was able to change to cobalt-free alternatives.[70][71]
In 1938, John Livingood and Glenn T. Seaborg discovered the radioisotope cobalt-60.[72] This isotope was famously used at Columbia University in the 1950s to establish parity violation in radioactive beta decay.[73][74]
After World War II, the US wanted to guarantee the supply of cobalt ore for military uses (as the Germans had been doing) and prospected for cobalt within the US. High purity cobalt was highly sought after for its use in jet engines and gas turbines.[75] An adequate supply of the ore was found in Idaho near Blackbird canyon. Calera Mining Company started production at the site.[76]
Cobalt demand has further accelerated in the 21st century as an essential constituent of materials used in rechargeable batteries, superalloys, and catalysts.[75] It has been argued that cobalt will be one of the main objects of geopolitical competition in a world running on renewable energy and dependent on batteries, but this perspective has also been criticised for underestimating the power of economic incentives for expanded production.[77]
Occurrence
[edit]The stable form of cobalt is produced in supernovae through the r-process.[78] It comprises 0.0029% of the Earth's crust. Except as recently delivered in meteoric iron, free cobalt (the native metal) is not found on Earth's surface because of its tendency to react with oxygen in the atmosphere. Small amounts of cobalt compounds are found in most rocks, soils, plants, and animals.[79] In the ocean cobalt typically reacts with chlorine.
In nature, cobalt is frequently associated with nickel. Both are characteristic components of meteoric iron, though cobalt is much less abundant in iron meteorites than nickel. As with nickel, cobalt in meteoric iron alloys may have been well enough protected from oxygen and moisture to remain as the free (but alloyed) metal.[80]
Cobalt in compound form occurs in copper and nickel minerals. It is the major metallic component that combines with sulfur and arsenic in the sulfidic cobaltite (CoAsS), safflorite (CoAs2), glaucodot ((Co,Fe)AsS), and skutterudite (CoAs3) minerals.[16] The mineral cattierite is similar to pyrite and occurs together with vaesite in the copper deposits of Katanga Province.[81] When it reaches the atmosphere, weathering occurs; the sulfide minerals oxidize and form pink erythrite ("cobalt glance": Co3(AsO4)2·8H2O) and spherocobaltite (CoCO3).[82][83]
Cobalt is also a constituent of tobacco smoke.[84] The tobacco plant readily absorbs and accumulates heavy metals like cobalt from the surrounding soil in its leaves. These are subsequently inhaled during tobacco smoking.[85]
Production
[edit]
| Country | Production | Reserves |
|---|---|---|
| 130,000 | 4,000,000 | |
| 10,000 | 600,000 | |
| 8,900 | 250,000 | |
| 5,900 | 1,500,000 | |
| 3,900 | 220,000 | |
| 3,800 | 500,000 | |
| 3,800 | 260,000 | |
| 3,000 | 100,000 | |
| 3,000 | 47,000 | |
| 2,700 | 36,000 | |
| 2,300 | 13,000 | |
| 2,200 | 140,000 | |
| 800 | 69,000 | |
| Other countries | 5,200 | 610,000 |
| World total | 190,000 | 8,300,000 |
The main ores of cobalt are cobaltite, erythrite, glaucodot and skutterudite (see above), but most cobalt is obtained by reducing the cobalt by-products of nickel and copper mining and smelting.[87][88]
Since cobalt is generally produced as a by-product, the supply of cobalt depends to a great extent on the economic feasibility of copper and nickel mining in a given market. Demand for cobalt was projected to grow 6% in 2017.[89]
Primary cobalt deposits are rare, such as those occurring in hydrothermal deposits, associated with ultramafic rocks, typified by the Bou-Azzer district of Morocco. At such locations, cobalt ores are mined exclusively, albeit at a lower concentration, and thus require more downstream processing for cobalt extraction.[90][91]
Several methods exist to separate cobalt from copper and nickel, depending on the concentration of cobalt and the exact composition of the used ore. One method is froth flotation, in which surfactants bind to ore components, leading to an enrichment of cobalt ores. Subsequent roasting converts the ores to cobalt sulfate, and the copper and the iron are oxidized to the oxide. Leaching with water extracts the sulfate together with the arsenates. The residues are further leached with sulfuric acid, yielding a solution of copper sulfate. Cobalt can also be leached from the slag of copper smelting.[92]
The products of the above-mentioned processes are transformed into the cobalt oxide (Co3O4). This oxide is reduced to metal by the aluminothermic reaction or reduction with carbon in a blast furnace.[16]

Extraction
[edit]
The United States Geological Survey estimates world reserves of cobalt at 7,100,000 metric tons.[93] The Democratic Republic of the Congo (DRC) currently produces 63% of the world's cobalt. This market share may reach 73% by 2025 if planned expansions by mining producers like Glencore Plc take place as expected. Bloomberg New Energy Finance has estimated that by 2030, global demand for cobalt could be 47 times more than it was in 2017.[94]
Changes that Congo made to mining laws in 2002 attracted new investments in Congolese copper and cobalt projects. Glencore's Mutanda Mine shipped 24,500 tons of cobalt in 2016, 40% of Congo DRC's output and nearly a quarter of global production. After oversupply, Glencore closed Mutanda for two years in late 2019.[95][96] Glencore's Katanga Mining project is resuming as well and should produce 300,000 tons of copper and 20,000 tons of cobalt by 2019, according to Glencore.[89]
Democratic Republic of the Congo
[edit]
In 2005, the top producer of cobalt was the copper deposits in the Democratic Republic of the Congo's Katanga Province. Formerly Shaba province, the area had almost 40% of global reserves, reported the British Geological Survey in 2009.[97]
Artisanal mining supplied 17% to 40% of the DRC production.[98] Some 100,000 cobalt miners in Congo DRC use hand tools to dig hundreds of feet, with little planning and fewer safety measures, say workers and government and NGO officials, as well as The Washington Post reporters' observations on visits to isolated mines. The lack of safety precautions frequently causes injuries or death.[99] Mining pollutes the vicinity and exposes local wildlife and indigenous communities to toxic metals thought to cause birth defects and breathing difficulties, according to health officials.[100]
Child labor is used in mining cobalt from African artisanal mines.[98][101] Human rights activists have highlighted this and investigative journalism reporting has confirmed it.[102][103] This revelation prompted cell phone maker Apple Inc., on March 3, 2017, to stop buying ore from suppliers such as Zhejiang Huayou Cobalt who source from artisanal mines in the DRC, and begin using only suppliers that are verified to meet its workplace standards.[104][105]
There is a push globally by the EU and major car manufacturers (OEM) for global production of cobalt to be sourced and –produced sustainably, responsibly and traceability of the supply chain. Mining companies are adopting and practising ESG initiatives in line with OECD Guidance and putting in place evidence of zero to low carbon footprint activities in the supply chain production of lithium-ion batteries. These initiatives are already taking place with major mining companies, artisanal and small-scale mining companies (ASM). Car manufacturers and battery manufacturer supply chains: Tesla, VW, BMW, BASF and Glencore are participating in several initiatives, such as the Responsible Cobalt Initiative and Cobalt for Development study. In 2018 BMW Group in partnership with BASF, Samsung SDI and Samsung Electronics have launched a pilot project in the DRC over one pilot mine, to improve conditions and address challenges for artisanal miners and the surrounding communities.
The political and ethnic dynamics of the region have in the past caused outbreaks of violence and years of armed conflict and displaced populations. This instability affected the price of cobalt and also created perverse incentives for the combatants in the First and Second Congo Wars to prolong the fighting, since access to diamond mines and other valuable resources helped to finance their military goals—which frequently amounted to genocide—and also enriched the fighters themselves. While DR Congo has in the 2010s not recently been invaded by neighboring military forces, some of the richest mineral deposits adjoin areas where Tutsis and Hutus still frequently clash, unrest continues although on a smaller scale and refugees still flee outbreaks of violence.[106]
Cobalt extracted from small Congolese artisanal mining endeavors in 2007 supplied a single Chinese company, Congo DongFang International Mining. A subsidiary of Zhejiang Huayou Cobalt, one of the world's largest cobalt producers, Congo DongFang supplied cobalt to some of the world's largest battery manufacturers, who produced batteries for ubiquitous products like the Apple iPhones. Because of accused labour violations and environmental concerns, LG Chem subsequently audited Congo DongFang in accordance with OECD guidelines. LG Chem, which also produces battery materials for car companies, imposed a code of conduct on all suppliers that it inspects.[107]
The Mukondo Mountain project, operated by the Central African Mining and Exploration Company (CAMEC) in Katanga Province, may be the richest cobalt reserve in the world. It produced an estimated one-third of the total global cobalt production in 2008.[108] In July 2009, CAMEC announced a long-term agreement to deliver its entire annual production of cobalt concentrate from Mukondo Mountain to Zhejiang Galico Cobalt & Nickel Materials of China.[109]
In 2016, Chinese ownership of cobalt production in the Congo was estimated at over 10% of global cobalt supply, forming a key input to the Chinese cobalt refining industry and granting China substantial influence over the global cobalt supply chain.[110] Chinese control of Congolese cobalt has raised concern in Western nations which have sought to reduce supply chain reliance upon China and have expressed concern regarding labor and human rights violations in cobalt mines in the DRC.[111][112]
In February 2018, global asset management firm AllianceBernstein defined the DRC as economically "the Saudi Arabia of the electric vehicle age", due to its cobalt resources, as essential to the lithium-ion batteries that drive electric vehicles.[113]
9 марта 2018 года президент Джозеф Кабила обновил кодекс добычи 2002 года, увеличил обвинения в роялти и объявив Кобальта и Колтана . «Стрателс -металлы» [ 114 ] [ 115 ] Кодекс добычи 2002 года был эффективно обновлен 4 декабря 2018 года. [ 116 ]
В декабре 2019 года международные защитники прав, неправительственная организация по правам человека, подала знаменательный иск против Apple, Tesla , Dell , Microsoft и Google Company Alphabet для «сознательной выгоды от и помощи и подстрекательства к жестокому и жестокому использованию маленьких детей» в горнодобывающей коблте. Полем [ 117 ] Рассматриваемые компании отказали в их участии в детском труде . [ 118 ] Полем В 2024 году суд постановил, что поставщики облегчают Force Labour, но американские технологические компании не несут ответственности, потому что они не действуют как общее предприятие с поставщиками и что «предполагаемые травмы не справедливо отслеживаются» для любого из поведения обвиняемых Полем [ 119 ]
Канада
[ редактировать ]В 2017 году некоторые разведывательные компании планировали обследовать старые серебряные и кобальтовые шахты в районе Кобальта, Онтарио , где, как полагают, лежат значительные месторождения. [ 120 ]
Куба
[ редактировать ]Канадская международные процессы Sherritt обрабатывают кобальтовые руды в никелевых месторождениях с шахт MOA на Кубе , а на острове есть несколько других шахт в Mayarí , Camagüey и Pinar Del Río . Продолжающиеся инвестиции Sherritt International в кубинское никелевое и кобальтовое производство, приобретая права на добычу полезных ископаемых в течение 17–20 лет, сделало коммунистическую страну третьей для резервов кобальта в 2019 году до самой Канады. [ 121 ]
Индонезия
[ редактировать ]Начиная с меньших количеств в 2021 году, Индонезия начала производить кобальт как побочный продукт производства никеля . К 2022 году страна стала вторым по величине производителем кобальта в мире, а эталонный продюсец минеральной разведки прогнозировал индонезийское производство, которое к 2030 году составила 20 процентов глобального производства. [ 122 ]
Приложения
[ редактировать ]В 2016 году было использовано 116 000 тонн (128 000 коротких тонн) кобальта. [ 8 ] Кобальт использовался в производстве высокопроизводительных сплавов. [ 87 ] [ 88 ] Он также используется в некоторых аккумуляторах.
Сплавы
[ редактировать ]На основе кобальта суперсплавы исторически потребляли большую часть производимого кобальта. [ 87 ] [ 88 ] Температурная стабильность этих сплавов делает их подходящими для лопастей турбин для газовых турбин и самолетных двигателей сплавы на основе никеля , хотя однокристаллические превосходят их в производительности. [ 123 ] Сплавы на основе кобальта также являются коррозионными и износостойкими, что делает их, например, титан полезным для изготовления ортопедических имплантатов , которые не изнашиваются с течением времени. Развитие износостойких сплавов кобальта началось в первом десятилетии 20-го века с звездными сплавами, содержащими хром с различными количествами вольфрама и углерода. Сплавы с хромами и карбидами вольфрама очень твердые и устойчивы к износу. [ 124 ] Специальные кобальт-хромий- молибдена сплавы , такие как Vitallium, используются для протезных частей (замены тазобедренного сустава и колена). [ 125 ] Кобальтовые сплавы также используются для зубных протезирования в качестве полезного замены никеля, которая может быть аллергенной. [ 126 ] Некоторые высокоскоростные стали также содержат кобальт для повышения тепла и износостойкости. Специальные сплавы алюминия, никеля, кобальта и железа, известных как альнико , а также самария и кобальта ( магнит самария -кобальта ) используются в постоянных магнитах . [ 127 ] Он также спланирован с 95% платиной для ювелирных изделий, что дает сплав, подходящий для тонкого литья, который также слегка магнитный. [ 128 ]
Батареи
[ редактировать ]Литий-оксид кобальта (LICOO 2 ) широко используется в катодах литий-ионной батареи . Материал состоит из слоев оксида кобальта с литиевым интеркалированным . Во время выписки ( т. Е. Когда не активно обвиняется), литий выпускается в виде литий -ионов. [ 129 ] Никель -кадмий [ 130 ] (NICD) и никелевый металл гидрид [ 131 ] (NIMH) Батареи также включают кобальт для улучшения окисления никеля в аккумуляторе. [ 130 ] Исследование рынка прозрачности оценило мировой рынок литий-ионных аккумуляторов в 2015 году в 30 миллиардов долларов и прогнозировал увеличение до 75 миллиардов долларов США к 2024 году. [ 132 ]
Хотя в 2018 году большинство кобальта в батареях использовалось в мобильном устройстве, [ 133 ] Более позднее применение кобальта - аккумуляторные батареи для электромобилей. Эта отрасль увеличила в пять раз в своем спросе на кобальт, что заставляет находить новое сырье в более стабильных областях мира. [ 134 ] Ожидается, что спрос будет продолжаться или увеличиваться по мере увеличения распространенности электромобилей. [ 135 ] Исследование в 2016–2017 годах включало область вокруг Кобальта, Онтарио, район, где многие серебряные шахты прекратили операцию десятилетия назад. [ 134 ] Кобальт для электромобилей увеличился на 81% с первой половины 2018 года до 7200 тонн в первой половине 2019 года, за счет батареи 46,3 ГВт. [ 136 ] [ 137 ]
Поскольку детские и рабские труды неоднократно сообщались в добыче кобальта, в первую очередь в кустарных шахтах доктора Конго, технологические компании, ищущие цепочки этических поставок, столкнулись с нехваткой этого сырья и [ 138 ] В октябре 2017 года цена на кобальтовый металл достигла девятилетнего максимума, более 30 долларов США за фунт, против 10 долларов США в конце 2015 года. [ 139 ] После избыточного положения цена упала до более нормальных 15 долларов в 2019 году. [ 140 ] [ 141 ] Как реакция на проблемы с горнодобыванием кустарного кобальта в докторе Конго. в докторе Конго. Члены FCA включают Чжэцзян Хуаю Кобальт , Sono Motors , «Ответственная инициатива по кобальту», Fairphone , Glencore and Tesla, Inc. [ 142 ] [ 143 ]
Исследования проводится Европейским союзом в возможность исключения требований кобальта в производстве литий-ионных аккумуляторов. [ 144 ] [ 145 ] По состоянию на август 2020 года производители аккумуляторов постепенно сокращали содержание катодного кобальта с 1/3 ( NMC 111) до 1/5 (NMC 442) до 1/10 (NMC 811) и также ввели в катод литий -фосфата без кобальта в Аккумуляторы электромобилей, таких как Tesla Model 3 . [ 146 ] [ 147 ] В сентябре 2020 года Tesla обрисовал в общих чертах свои планы по созданию собственных, без кобальта батареи. [ 148 ]
Литий -железо фосфатные батареи официально превзошли тройные кобальтовые батареи в 2021 году с 52% установленной емкости. По оценкам аналитиков, доля его рынка превысит 60% в 2024 году. [ 149 ]
Катализаторы
[ редактировать ]Несколько кобальтовых соединений являются катализаторами окисления . Ацетат кобальта используется для преобразования ксилола в терефталевую кислоту , предшественник объемного полиметилентерефталата полиэтилена . Типичными катализаторами являются кобальтовые карбоксилаты (известные как кобальтовое мыло). Они также используются в красках, лаках и чернилах в качестве «сушильных агентов» посредством окисления сушильных масел . [ 150 ] [ 129 ] Тем не менее, их использование вытекает из -за проблем с токсичностью. [ 151 ] Те же самые карбоксилаты используются для улучшения адгезии между сталью и резиной в стальных радиальных шинах. Кроме того, они используются в качестве акселераторов в полиэфирных системах. [ 152 ] [ 153 ] [ 154 ]
Катализаторы на основе кобальта используются в реакциях, включающих угарный газ . Кобальт также является катализатором в процессе Фишера -Тропша для гидрирования угарного газа в жидкое топливо. [ 155 ] Гидроформилирование алкенов кобальт часто использует -октакарбонил в качестве катализатора. [ 156 ] Гидродсульфуризация молибдена нефти . использует катализатор, полученный из кобальта и Этот процесс помогает очистить нефть примесей серы, которые мешают переработке жидкого топлива. [ 129 ]
Пигменты и окраска
[ редактировать ]

До 19 -го века кобальт был преимущественно использован в качестве пигмента. Со времени средневековья он использовался, чтобы сделать Smalt , голубого стекла. Смальт производится путем таяния смесь жареного минерального смальтита , кварца и карбоната калия , которая дает темно -сильное силикатное стекло, которое тонко заземляется после производства. [ 157 ] Смальт широко использовался для окрашивания стекла и в качестве пигмента для картин. [ 158 ] В 1780 году Свен Ринман обнаружил кобальта Грин , а в 1802 году Луи Жак Тенар обнаружил кобальт синий . [ 159 ] такие как кобальтовый синий (кобальтовый алюминат), церулеанский stannate), зеленого оттенки (кобальт ( ii кобальта ) различные синий Кобальтовые пигменты , Пигменты художника из -за их превосходной хроматической стабильности. [ 160 ] [ 161 ]
Радиоизотопы
[ редактировать ]Кобальт-60 (CO-60 или 60 CO) полезен в качестве источника гамма-излучения, потому что он может быть произведен в предсказуемых количествах с высокой активностью путем бомбардировки кобальта с нейтронами . Он производит гамма -лучи с энергией 1,17 и 1,33 МэВ . [ 29 ] [ 162 ]
Кобальт используется во внешней лучевой терапии , стерилизации медикаментов и медицинских отходов, радиационной обработке пищевых продуктов для стерилизации (холодная пастеризация ), [ 163 ] Промышленная рентгенография (например, рентгенограмма целостности сварки), измерения плотности (например, измерения плотности бетонной плотности) и выключатели высоты заполнения резервуара. Металл обладает неудачным свойством производства тонкой пыли, вызывая проблемы с радиационной защитой . Кобальт из радиотерапевтических машин был серьезной опасностью, когда он не выброшен должным образом, и в 1984 году произошла одна из худших несчастных случаев загрязнения радиационного загрязнения в Северной Америке, когда в Хуаресе, Мексику, была ошибочно разобрана в свалке в Хуаресе, в Мексике. [ 164 ] [ 165 ]
Cobalt-60 имеет радиоактивный период полураспада 5,27 года. Потеря активности требует периодической замены источника в лучевой терапии и является одной из причин, почему кобальтовые машины были в значительной степени заменены линейными ускорителями при современной лучевой терапии. [ 166 ] Кобальт-57 (Co-57 или 57 CO) является радиоизотопом кобальта, чаще всего используется в медицинских тестах, в качестве радиоактивной, для поглощения витамина B 12 , и для теста на Шиллинг . Cobalt-57 используется в качестве источника в спектроскопии Mössbauer и является одним из нескольких возможных источников в рентгеновских флуоресцентных устройствах. [ 167 ] [ 168 ]
Проекты ядерного оружия могут намеренно включить 59 CO, некоторые из которых будут активированы в ядерном взрыве для получения 60 Ко 60 Ко, рассеянный как ядерные последствия , иногда называют кобальтовой бомбой . [ 169 ] [ 170 ]
Магнитные материалы
[ редактировать ]Из -за ферромагнитных свойств кобальта он используется в производстве различных магнитных материалов. [ 171 ] Он используется в создании постоянных магнитов, таких как магниты Alnico , известные своими сильными магнитными свойствами, используемыми в электродвигателях , датчиках и МРТ . машинах [ 172 ] [ 173 ] Он также используется в производстве магнитных сплавов, таких как кобальтовая сталь , широко используемая в магнитной записи , таких как жесткие диски и ленты . [ 174 ]
Способность Кобальта поддерживать магнитные свойства при высоких температурах делает его ценной в приложениях магнитной записи, обеспечивая надежные устройства хранения данных . [ 175 ] Кобальт также вносит свой вклад в специализированные магниты, такие как самарий-кобальт и неодим-железный бор , которые жизненно важны в электронике для таких компонентов, как датчики и приводы . [ 176 ]
Другое использование
[ редактировать ]- Кобальт используется в гальванинге для его привлекательного внешнего вида, твердости и устойчивости к окислению. [ 177 ]
- Он также используется в качестве базового грунтовки для фарфоровых эмали . [ 178 ]
Биологическая роль
[ редактировать ]Кобальт необходим для метаболизма всех животных. Он является ключевой компонентом кобаламина , также известного как витамин B 12 , основной биологический резервуар кобальта в качестве ультратратного элемента . [ 179 ] [ 180 ] Бактерии в желудках животных жвачных животных превращают соли кобальта в витамин B 12 , соединение, которое может быть получено только бактериями или археей . Поэтому минимальное присутствие кобальта в почвах заметно улучшает здоровье пастбищных животных, и рекомендуется поглощение 0,20 мг/кг в день, поскольку у них нет другого источника витамина B 12 . [ 181 ]
Белки на основе использования кобаламина Corrin для удержания кобальта. Коэнзим B 12 имеет реактивную связь C-CO, которая участвует в реакциях. [ 182 ] У людей B 12 имеет два типа алкил -лиганда : метил и аденозил. MEB 12 способствует переводам группы метил (-ч 3 ). Аденозильная версия B 12 катализирует перестройки, в которых атом водорода непосредственно переносится между двумя соседними атомами с сопутствующим обменом второго заместителя, x, который может быть атом углерода с заместителями, атомом кислорода или амином. Метилмалонил-коэнзимент A Мутаза (MUT) превращает MML-COA в SU-COA , важный этап в экстракции энергии из белков и жиров. [ 183 ]
Хотя гораздо реже, чем другие металлопротеины (например, цинк и железо), другие кобальтопротеины известны помимо B 12 . Эти белки включают метиониновую аминопептидазу 2 , фермент, который встречается у людей и других млекопитающих, который не использует корриновое кольцо B 12 , но напрямую связывает кобальт. Другим некорриринным кобальтом является нитрилратаза , фермент бактерий, который метаболизирует нитрилы . [ 184 ]
Дефицит кобальта
[ редактировать ]У людей потребление кобальта-содержащего витамин B 12 удовлетворяет все потребности в кобальте. Для крупного рогатого скота и овец, которые удовлетворяют потребностям витамина B 12 путем синтеза резидентными бактериями в рубце, существует функция для неорганического кобальта. В начале 20 -го века, во время развития сельского хозяйства на вулканическом плато Северного острова в Новой Зеландии, крупный рогатый скот страдал от того, что называлось «Болезнь кустарника». Было обнаружено, что в вулканическим почвам не хватало солей кобальта, необходимых для пищевой цепи скота. [ 185 ] [ 186 ] Было обнаружено , что «болезнь побережья» в девяносто мильной пустыне к юго -востоку от Южной Австралии в 1930 -х годах возникает в недостатках питания следовых элементов кобальта и меди. Дефицит кобальта был преодолен путем разработки «кобальтовых пуль», плотных гранул оксида кобальта, смешанных с глиной, данной перорально для проживания в рубце животного . [ нужно разъяснения ] [ 187 ] [ 186 ] [ 188 ]
-
Кобальт-дефицитный овец
Проблемы со здоровьем
[ редактировать ]| Опасности | |
|---|---|
| GHS Маркировка : [ 189 ] | |
 
| |
| Опасность | |
| H302 , H317 , H319 , H334 , H341 , H350 , H360F , H412 | |
| P273 , P280 , P301+P312 , P302+P352 , P305+P351+P338 , P308+P313 | |
| NFPA 704 (Огненная бриллиант) | |
Значение LD для растворимых солей кобальта 50 было оценивается от 150 до 500 мг/кг. [ 190 ] В США Управление по безопасности и гигиене труда (OSHA) определило допустимый предел воздействия (PEL) на рабочем месте в качестве среднего по времени (TWA) 0,1 мг/м 3 Полем Национальный институт безопасности и гигиены труда (NIOSH) установил рекомендуемый предел воздействия (REL) 0,05 мг/м. 3 , взвешенное время в среднем. ( Значение IDLH сразу же опасно для жизни и здоровья) составляет 20 мг/м 3 . [ 191 ]
Тем не менее, хроническое проглатывание кобальта вызвало серьезные проблемы со здоровьем в дозах гораздо меньше, чем смертельная доза. В 1966 году добавление кобальтовых соединений для стабилизации пива в Канаде привело к особой форме кардиомиопатии , вызванной токсином , которая стала известна как кардиомиопатия пива . [ 192 ] [ 193 ]
Кроме того, кобальтовый металл подозревается в причинении рака (то есть, возможно, канцерогенной , IARC Group 2B ) в соответствии с Международным агентством по исследованиям рака (IARC). [ 194 ]
Это вызывает респираторные проблемы при вдыхании. [ 195 ] Это также вызывает проблемы с кожей при прикосновении; После никеля и хрома кобальт является основной причиной контактного дерматита . [ 196 ]
Примечания
[ редактировать ]- ^ расширение кобальта анизотропным : коэффициенты кристаллического для является каждой Тепловое оси −6 /K, α C = 17,9 × 10 −6 /K и α среднее = α v /3 = 12,9 × 10 −6 /K.
- ^ Словарь Гримма, более конкретно, называет его «спектральным горным маникен» ( Gespenstisches Bergmännchen) , в других местах («Kobold» ii) это ноты, которые Кобол также относится к Берггейсте в Бергманнеше (майнеры).
- ^ Гримм получен и кобол из греческого кобало , как вышеупомянутый; OED согласился с тем, что Коболд , Кобельт (руда), Кобель (мой дух) был тем же словом.
Ссылки
[ редактировать ]- ^ "Кобальт". Оксфордский английский словарь (2 -е изд.). Издательство Оксфордского университета . 1989.
- ^ «Стандартные атомные веса: кобальт» . Ciaaw . 2017.
- ^ Прохаска, Томас; Irrgeher, Johanna; Благосостояние, Жаклин; Böhlke, John K.; Чессон, Лесли А.; Коплен, Тайлер Б.; Ding, наконечник; Данн, Филипп Дж.Х.; Грёнинг, Манфред; Холден, Норман Э.; Meijer, Harro AJ (4 мая 2022 г.). «Стандартные атомные веса элементов 2021 (технический отчет IUPAC)» . Чистая и прикладная химия . doi : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ^ Jump up to: а беременный Arblaster, John W. (2018). Выбранные значения кристаллографических свойств элементов . Материал Парк, штат Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ Jump up to: а беременный в дюймовый Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2 -е изд.). Баттерворт-Хейнеманн . С. 1117–1119. ISBN 978-0-08-037941-8 .
- ^ Kondev, FG; Ван, М.; Хуан, WJ; Naimi, S.; Audi, G. (2021). «Оценка ядерных свойств Nubase2020» (PDF) . Китайская физика c . 45 (3): 030001. DOI : 10.1088/1674-1137/Abddae .
- ^ "Кобальт". Оксфордский английский словарь (2 -е изд.). Издательство Оксфордского университета . 1989.
- ^ Jump up to: а беременный Даниэль Бочов (1 ноября 2017 г.). «Электромобиль Future Spurs Cobalt Rush: спрос на опухоль на продукт дышит новой жизнью в маленький город Онтарио» . Ванкувер Солнце . Блумберг. Архивировано из оригинала 28 июля 2019 года.
- ^ "Катализаторы" . Институт кобальта . Архивировано из оригинала 16 августа 2023 года . Получено 15 августа 2023 года .
- ^ Enghag, per (2004). "Кобальт" . Энциклопедия элементов: технические данные, история, обработка, приложения . Уайли. п. 667. ISBN 978-3-527-30666-4 .
- ^ Мурти, против Р. (2003). «Магнитные свойства материалов» . Структура и свойства инженерных материалов . McGraw-Hill Education (Индия) Pvt Limited. п. 381. ISBN 978-0-07-048287-6 .
- ^ Селоцци, Сальваторе; Аранео, Родольфо; Ловат, Джампиеро (1 мая 2008 г.). Электромагнитное экранирование . Уайли. п. 27. ISBN 978-0-470-05536-6 .
- ^ Ли, Б.; Alsenz, R.; Ignatiev, A.; Ван Хоув, М.; Ван Хоув, Массачусетс (1978). «Поверхностные структуры двух аллотропных фаз кобальта». Физический обзор б . 17 (4): 1510–1520. BIBCODE : 1978 PHRVB..17.1510L . doi : 10.1103/physrevb.17.1510 .
- ^ «Свойства и факты для кобальта» . Американские элементы . Архивировано из оригинала 2 октября 2008 года . Получено 19 сентября 2008 года .
- ^ Кобальт Брюссель: информационный центр кобальта. 1966. П. 45
- ^ Jump up to: а беременный в дюймовый и Холмен, AF; Wiberg, E.; Wiberg, N. (2007). "Кобальт". Учебник неорганической химии (на немецком языке) (102 -е изд.). де Грюйтер. С. ISBN 978-3-11-017770-1 .
- ^ Housecroft, CE; Sharpe, AG (2008). Неорганическая химия (3 -е изд.). Прентис Холл. п. 722. ISBN 978-0-13-175553-6 .
- ^ Ритли, Фрэнк (6 декабря 2012 г.). Элементы минералогии Ратли . Springer Science & Business Media. п. 40. ISBN 978-94-011-9769-4 .
- ^ Кребс, Роберт Э. (2006). История и использование химических элементов нашей Земли: справочное руководство (2 -е изд.). Greenwood Publishing Group. п. 107. ISBN 0-313-33438-2 .
- ^ Петито, Сара С.; Марш, Эрин М.; Карсон, Грегори А.; Ланджелл, Марджори А. (2008). «Химия поверхности оксида кобальта: взаимодействие COO (100), CO3O4 (110) и CO3O4 (111) с кислородом и водой» . Журнал молекулярного катализа A: Химический . 281 (1–2): 49–58. doi : 10.1016/j.molcata.2007.08.023 . S2CID 28393408 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2 -е изд.). Баттерворт-Хейнеманн . С. 1119–1120. ISBN 978-0-08-037941-8 .
- ^ Вернер А. (1912). «Знать асимметричную кобальтатому. V» . Химические отчеты . 45 : 121–130. Doi : 10.1002/cber.19120450116 .
- ^ Гисперт, Джоан Рибас (2008). «Ранние теории координационной химии» . Координационная химия . Уайли. С. 31–33. ISBN 978-3-527-31802-5 Полем Архивировано из оригинала 5 мая 2016 года . Получено 27 июня 2015 года .
- ^ Дом, Джеймс Э. (2008). Неорганическая химия . Академическая пресса. С. 767 -. ISBN 978-0-12-356786-4 Полем Получено 16 мая 2011 года .
- ^ Старкс, Чарльз М.; Лиотта, Чарльз Леонард; Halpern, Marc (1994). Катализ переноса фазы: основы, применение и промышленные перспективы . Спрингер. С. 600–. ISBN 978-0-412-04071-9 Полем Получено 16 мая 2011 года .
- ^ Сигел, Астрид; Сигел, Гельмут; Sigel, Roland, eds. (2010). Органометаллики в окружающей среде и токсикологии (ионы металлов в науках о жизни) . Кембридж , Великобритания : Королевское общество химии издательство . п. 75. ISBN 978-1-84755-177-1 .
- ^ Бирн, Эрин К.; Ричсон, Даррин С.; Теопольд, Клаус Х. (1 января 1986 г.). «Tetrakis (1-Norbornyl) кобальт, низко спиновой тетраэдрический комплекс переходного металла первого ряда». Журнал химического общества, химическая связь (19): 1491. doi : 10.1039/c39860001491 . ISSN 0022-4936 .
- ^ Бирн, Эрин К.; Теопольд, Клаус Х. (1 февраля 1987 г.). «Окислительно-восстановительная химия тетракиса (1-норборн) кобальта. Синтез и характеристика кобальта (V) алкильного и самообменного скорости пары CO (III)/CO (IV)». Журнал Американского химического общества . 109 (4): 1282–1283. doi : 10.1021/ja00238a066 . ISSN 0002-7863 .
- ^ Jump up to: а беременный в Audi, Жорж; Берсильон, Оливье; Блахто, Джин; Wapstra, Aaldert Hendrik (2003), «Оценка n Ubase ядерных и распадных свойств» , Ядерная физика A , 729 : 3–128, Bibcode : 2003nupha.729 .... 3a , doi : 10.1016/j.nuclphysa.2003.11 .001
- ^ Jump up to: а беременный в Ball, Philip (2003). Яркая земля: искусство и изобретение цвета . Университет Чикагской Прессы. С. 118–119. ISBN 9780226036281 .
- ^ Jump up to: а беременный в Гриммс ; Хильдебранд, Рудольф (1868). Немецкий словарь , том 5, SV " Кобальт "
- ^ Jump up to: а беременный в дюймовый и фон Wothers, Peter (2019). Сурьма, золото и волк Юпитера: как были названы элементы . Издательство Оксфордского университета. С. 47–49. ISBN 9780192569905 .
- ^ Агрикола, Джордж (1546) [1530]. «Берманн, или диалог Metallica » . Восстание Джорджа Фермера и причины для субтрожной либера. 5. Природа тех вещей, которые вытекают с земли. 4. Природа ископаемого либера. 10. Старые и новые металлы. 2. Берманн, или Dialogus Metallica Lib.1. Интерпретация немецких голосов вопроса о металлике, добавив индекс избиения . Базель: Пробук. стр. 441-442.
Кобальт, наш призыв, греческий кэдми
; Ср. Индекс под " кобальтом ". - ^ Агрикола, Джорджиус (1912). Георгиус Агрикола де ре -Metallica: tr. От 1 -го латинского изд. 1556 (книги I - viii) . Перевод Гувера, Герберта Кларка и Лу Генри Гувера . Лондон: Mining Magazine. С. 112–113. Описывает (и табулирует) немецкую форму kobelt ; В двух томах: вторая часть , книги IX -XII, смежная страничная страница.
- ^ Агрикола, Джордж (1614) [1549]. "37" . В Джоне Сигфридусе (ред.). Джордж Агрикола Живого подполья . Виттенберг: напечатано Meisnerianis. стр. 78-79.
- ^ Jump up to: а беременный Агрикола Джордж (1657) [1530]. «Имена животных английский, Грега, Q'ue German, их автор в книге подземных умов» . Джордж Агрикола Кемпниценсис Врачи и философ Кларисс. На Metallica 12.: Какие услуги, инструменты, задачи и все, наконец, для зрелищного металла, не только слегка описанного; Однако по изображениям их места ... так что глаза расположены как можно более ясными . Базель: EX & Printed Emmanuel Konig. п. [762].
ДЕСМОН : Dærus Artery , Bergterufel; Мягкий бергменлейн / кобель / guttel
- ^ Этот отрывок из отдельной работы De animantibus переводится в сноску Agricola & Hoovers Trr. (1912) , с. 217, N26 : «Немцы, а также греки называют кобалос ».
- ^ Agricola & Hoovers Trr. (1912) , с. 214, N21.
- ^ Проповедь лютеранского реформистского богослова Йоханнеса Мэтьесия (1652) на неприятности Кобальт руда считал, что демон, известный массам как Кобель . Цитируется на английском языке [ 38 ] Выдержка Wothers. [ 32 ]
- ^ Иоганн Бекманн (Eng. Tr. 1797), который явно прокомментировал вывод слова «кобальт» руды, сформированной из Кобеля Agricola ( Cobalus ), был процитирован химиком Питером Уэтерсом по этой теме. [ 32 ]
- ^ «Новый и полный словарь немецкого языка для англичан" SV " Das Whiter ": «4. Воздух и пары, сыры, пары ... среди шахтеров», Küttner, Carl Gottlob; Николсон, Уильям, Эдд. (1813), вып. 3
- ^ Jump up to: а беременный Гриммс ; Хильдебранд, Рудольф (1868). Немецкий словарь , том 5, SV " KOBOLD " в "III. 3) боковые формы"
- ^ Словарь Гриммс утверждает, что Кобальт и Коболд являются «тем же словом в своем первоначальном источнике ( Урспрюнлих )». [ 31 ] Итак, вход Гримма в «Kobold», iii. Происхождение, боковые формы, 3) а) перечисляет Кобель как миниатюрное вторичное имя . [ 42 ]
- ^ На самом деле, среди «гномов и гоблинов». [ 30 ] [ 32 ]
- ^ Lecouteux, Claude (2016). «Ограбление ( Роггмалс, Роббелн, плотный Кламдлан, воротник, Хульбин; Груврир в щедрости)» . Энциклопедия норвежского и германского фольклора, мифологии и магии . Саймон и Шустеры. ISBN 9781620554814 Полем , ср. (По -французски) Lecpapux (2014), « Drggments », Trintaniy Heartaniqually , pp. 1995-1996.
- ^ Верди, Донато (2023). Аристотелизм и магия в ранней современной Европе: философы, экспериментаторы и чудесные работники . Bloomsbury Publishing. п. 85. ISBN 9781350357174 .
- ^ Кобел Бергманлейн был ака «Бергменлин» (мод. Стандартное правописание , Бергманнхен ) в соответствии с глянком Агриколы. [ 36 ] Словарь Гриммса также говорит, что руды вызваны спрайтами Бергманхена , но он думает, что шахтеры называют это «Кооболд», а не отличим от «Кобель». Принимая во внимание, что словарь Lecouteux определяет «Bergmännchen» как «мой дух» и признает «Kobel», но не «Kobld» в качестве синонима. [ 45 ] Совсем недавно обнаружена литература, которая без колебаний называет Bergmännchen « гномом». [ 46 ]
- ^ "Кобальт" . Оксфордский английский словарь (онлайн изд.). Издательство Оксфордского университета . или (Требуется членство в учреждении участие .) ; Мюррей, Джеймс Ах Эд. (1908) Новый англ. Диктат II , SV " Кобальт "
- ^ Jump up to: а беременный Müller-Freureuth, Karl (1906). "Глава 14" . Слова саксонских людей: вклад в суждение . Дрезден: Вильгельм Баенш. С. ISBN 978-3-95770-329-3 .
- ^ Glasenapp, Carl Friedrich [на немецком языке] (1911). "III. Коболд" . Зигфрид Вагнер и его искусство: собрали эссе о драматической работе Зигфрида Вагнера от «Bärenhädern» до «Banadietrich» . Иллюстрируется Францем Стассеном . Лейпциг: Breitkopf & Härtel. п. 134.
- ^ Кречмер, Пол (1928). «Подробнее о предыстории индейцев» . Журнал сравнительных языковых исследований в области индо -европейских языков . 55 п. 89 и р. 87, n2.
- ^ Jump up to: а беременный Клуге, Фридрих ; Seebold, Elmar , Eds. (2012) [1899]. "Кобальт" . Этимологический словарь немецкого языка (25 изд.). Walter de Gruyter Gmbh & Co Kg. п. 510. ISBN 9783110223651 .
- ^ Jump up to: а беременный в Mellor, JW (1935) Кобальт Комплексный трактат о неорганической и теоретической химии Vol. Xiv, p. 420.
- ^ Agricola (1546) p. 481 : Latin : modulus = German : Kobel
- ^ Лидделл и Скотт (1940). Грек -английский лексикон . SV " KWBA/QIA ". Пересмотрен и дополнен сэром Генри Стюартом Джонсом с помощью Родерика Маккензи. Оксфорд: Clarendon Press. ISBN 0-19-864226-1 . Онлайн -версия получена 29 августа 2024 года.
- ^ Мерк, Эмануэль (1902). "Кобальм металл" . Airy Nothings: воображение потустороннего мира от средневековья до эпохи разума: очерки в честь Аласдейра А. Макдональда (2 изд.). Дармштадт: Э. Мерк. п. 75
- ^ Тейлор, младший (1977). «Происхождение и использование кобальтовых соединений в качестве синего» . Наука и археология . 19 : 6.
- ^ "J. Berenedes" Recto Берендес, Дж. (8 февраля 1899 г.). «Имена элементов» . Chemiker-Zeitung . 23 (11): 103.
- ^ Кобальт , Энциклопедия Британская онлайн.
- ^ Пулак, Cemal (1998). «Корабли с Uluburun: обзор». Международный журнал морской археологии . 27 (3): 188–224. doi : 10.1111/j.1095-9270.1998.tb00803.x .
- ^ Хендерсон, Джулиан (2000). "Стекло". Наука и археология материалов: исследование неорганических материалов . Routledge. п. 60. ISBN 978-0-415-19933-9 .
- ^ Rehren, Thilo (2003). «Аспекты производства кобальтового стекла в Египте». Археометрия . 43 (4): 483–489. doi : 10.1111/1475-4754.00031 .
- ^ Jump up to: а беременный Деннис, В. Х (2010). "Кобальт" . Металлургия: 1863–1963 . AldineTransaction. С. 254–256. ISBN 978-0-202-36361-5 .
- ^ «Информационные обследования тарифов по статьям в пункте 1- Закона о тарифах 1913 года ... и связанных статей в других параграфах» . 17 августа 2023 года.
- ^ Georg Brandt впервые показал, что Cobalt является новым металлом в: G. Brandt (1735) «de semimetallis» (диссертация по полуметалам), Журнал литературы и наук (журнал шведской литературы и наук), том. 4, страницы 1-10.
См. Также: (1) Г. Брандт (1746) «Рен Ох Анмаркингар Ангаенде и замечания, касающиеся необычайного пигмента, Компл. С. Королевской шведской академии науки), вып. 7, с. 119–130; (2) Г. Брандт (1748) «Кобальти -нова -экзаменационные экзамены и описание» (Cobalt, новый элемент, изученный и описанный), Acta Regiae Societates Scientarum upsalensis (Журнал Королевского научного общества Уппсала, 1st Seres, vol. 3, с. 33–41; (3) Джеймс Л. Маршалл и Вирджиния Р. Маршалл (весна 2003 г.) «RideScovery of the Elements: Ridarhyttan, Швеция » Гексагон (Официальный журнал «Альфа -чи -сигма братства химиков»), Vol. 94, № 1, страницы 3–8 - ^ Ван, Шиджи (2006). «Кобальт - его восстановление, утилизация и применение». Журнал Общества минералов, металлов и материалов . 58 (10): 47–50. Bibcode : 2006Jom .... 58J..47W . doi : 10.1007/s11837-006-0201-y . S2CID 137613322 .
- ^ Недели, Мэри Эльвира (1932). «Обнаружение элементов. III. Примерно около металлов восемнадцатого века». Журнал химического образования . 9 (1): 22. Bibcode : 1932jched ... 9 ... 22w . doi : 10.1021/ed009p22 .
- ^ Рэмберг, Ивар Б. (2008). Создание земли: геология Норвегии . Геологическое общество. С. 98–. ISBN 978-82-92394-42-7 Полем Получено 30 апреля 2011 года .
- ^ C. Tomlinson, ed. (1852). "Кобальт " Циклопдия обычных искусств и менеджеров стр. 400–403.
- ^ Jump up to: а беременный Уэлмер, Фридрих-Уилгельм; Беккер-Платенс, Дженс Дитер. «Глобальные нефтяные минеральные ресурсы и устойчивость» . Геологическая служба США.
- ^ Jump up to: а беременный Вестин, Артур Х; Стокгольмский Международный институт исследования мира (1986). "Кобальт" . Глобальные ресурсы и международный конфликт: факторы окружающей среды в стратегической политике и действиях . Издательство Оксфордского университета. С. 75–78. ISBN 978-0-19-829104-6 .
- ^ Livingood, J.; Сиборг, Гленн Т. (1938). «Долгоживущие радиокобальтовые изотопы». Физический обзор . 53 (10): 847–848. Bibcode : 1938 Phrv ... 53..847L . doi : 10.1103/physrev.53.847 .
- ^ Wu, CS (1957). «Экспериментальный тест сохранения паритета в бета -распаде» . Физический обзор . 105 (4): 1413–1415. Bibcode : 1957 phrv..105.1413w . doi : 10.1103/physrev.105.1413 .
- ^ Wróblewski, AK (2008). «Падение паритета - революция, которая произошла пятьдесят лет назад». Acta Physica Polonica б . 39 (2): 251. Bibcode : 2008acpbb..39..251w . S2CID 34854662 .
- ^ Jump up to: а беременный Робертс, Стивен; Ганн, Гас (6 января 2014 г.), Ганн, Гас (ред.), «Кобальт» , Справочник по критическим металлам (1 изд.), Wiley, стр. 122–149, doi : 10.1002/9781118755341.ch6 , ISBN 978-0-470-67171-9 , Получено 1 декабря 2023 г.
- ^ «Самая богатая дыра в горе» . Популярная механика : 65–69. 1952.
- ^ Overland, Индра (1 марта 2019 г.). «Геополитика возобновляемой энергии: разоблачение четырех новых мифов» . Энергетические исследования и социальные науки . 49 : 36–40. Bibcode : 2019erss ... 49 ... 36o . doi : 10.1016/j.ers.2018.10.018 . HDL : 11250/2579292 . ISSN 2214-6296 .
- ^ Ptitsyn, da; Chechetkin, VM (1980). «Создание элементов железной группы в взрыве сверхновой». Советские астрономические письма . 6 : 61–64. Bibcode : 1980sval .... 6 ... 61p .
- ^ Доминго, Хосе Л. (1989), «Кобальт в окружающей среде и его токсикологические последствия» , в Ware, Джордж В. (ред.), Обзоры загрязнения окружающей среды и токсикологии , вып. 108, Нью-Йорк: Springer, pp. 105–132, doi : 10.1007/978-1-4613-8850-0_3 , ISBN 978-1-4613-8850-0 , PMID 2646660 , получен 30 ноября 2023 г.
- ^ Nuccio, Pasquale Mario; Валенца, Мариано (1979). «Определение металлического железа, никеля и кобальта в метеоритах» (PDF) . Итальянские общества сообщения о минералогии и петрографии . 35 (1): 355–360.
- ^ Керр, Пол Ф. (1945). «Cattierite и Vaesite: новые минералы с бельгийскими конго» (PDF) . Американский минералогист . 30 : 83–492.
- ^ Бакли, Ан (1987). «Поверхностное окисление кобальта». Австралийский журнал химии . 40 (2): 231. doi : 10.1071/ch9870231 .
- ^ Янг Р. (1957). «Геохимия кобальта». Geochimica et Cosmochimica Acta . 13 (1): 28–41. Bibcode : 1957gecoa..13 ... 28y . doi : 10.1016/0016-7037 (57) 90056-x .
- ^ Талвуд, Рейнск; Шульц, Томас; Флор, Эва; Из Бентема, Ян; Западный, Пит; Обзоры, Антонон (2011). «Опасные соединения в табачном дыме» . Международный журнал или экологические исследования и общественное здравоохранение . 8 (12): 613–628. doi : 10 3390/Jerph8020613 . ISSN 1660-4601 . PMC 308482 . PMID 2156207 .
- ^ Pourkhabbaz, a; Pourkhabbaz, H (2012). «Исследование токсичных металлов в табаке различных иранских брендов сигарет и связанных с ними проблем со здоровьем» . Иранский журнал базовых медицинских наук . 15 (1): 636–644. PMC 3586865 . PMID 23493960 .
- ^ Статистика и информация о кобальте (PDF) , Геологическая служба США, 2023
- ^ Jump up to: а беременный в Шедд, Ким Б. "Минеральный ежегодник 2006: кобальт" (PDF) . Геологическая служба США . Получено 26 октября 2008 года .
- ^ Jump up to: а беременный в Шедд, Ким Б. "Товарный отчет 2008: кобальт" (PDF) . Геологическая служба США . Получено 26 октября 2008 года .
- ^ Jump up to: а беременный Генри Сандерсон (14 марта 2017 г.). «Метеорический рост Кобальта рискует Катанга Конго» . Финансовые времена.
- ^ Мюррей В. Хитцман, Артур А. Букстрем, Джон Ф. Слэк и Майкл Л. Зиентек (2017). «Кобальт - настилы депозитов и поиск первичных месторождений» . USGS . Получено 17 апреля 2021 года.
- ^ "Кобальт цена: BMW избегает загадки Конго - пока" . Mining.com . Получено 17 апреля 2021 года.
- ^ Дэвис, Джозеф Р. (2000). Специальное руководство ASM: никель, кобальт и их сплавы . ASM International. п. 347. ISBN 0-87170-685-7 .
- ^ «Кобальт» (PDF) . Геологическая служба Соединенных Штатов, Резюме минеральных товаров. Январь 2016 года. С. 52–53.
- ^ Уилсон, Томас (26 октября 2017 г.). «Мы все будем полагаться на Конго для питания наших электромобилей» . Блумберг . Получено 25 марта 2023 года .
- ^ «Кобальтовый акции Glencore содержит цены, несмотря на подвеску на шахте» . Рейтер . 8 августа 2019 года.
- ^ «Glencore закрывает шахту Mutanda, 20% глобального поставки кобальта остается в автономном режиме» . Эталонная минеральная разведка . 28 ноября 2019 года.
Шахта будет поставлена на уход и техническое обслуживание в течение не менее двух лет.
- ^ «Африканское производство минералов» (PDF) . Британская геологическая служба . Получено 6 июня 2009 г.
- ^ Jump up to: а беременный Франкель, Тодд С. (30 сентября 2016 г.). «Кобальтовая добыча для литий -ионных батарей имеет высокую стоимость человека» . The Washington Post . Получено 18 октября 2016 года .
- ^ Муда, Лена; Садоф, Карли Домб; Франкель, Тодд С. (28 февраля 2018 г.). «Перспектива - скрытые затраты на добычу кобальта» . The Washington Post . ISSN 0190-8286 . Получено 7 марта 2018 года .
- ^ Франкель, Тодд С. (30 сентября 2016 г.). «Трубопровод кобальта: отслеживание пути от смертоносных ручных шахт в Конго до телефонов потребителей и ноутбуков» . The Washington Post .
- ^ Детский труд за смартфоном и электромобилями . Amnesty International (2016-01-19). Получено на 2018-01-07.
- ^ Кроуфорд, Алекс. Познакомьтесь с Дорсеном, 8 лет, который маначит Cobalt, чтобы заставить ваш смартфон работать . Sky News UK . Получено на 2018-01-07.
- ^ Вы сейчас держите продукт детского труда? (Видео) . Sky News UK (2017-02-28). Получено на 2018-01-07.
- ^ Рейсингер, Дон. (2017-03-03) Откровение для детей, побуждает Apple внести изменение политики поставщиков . Удача . Получено на 2018-01-07.
- ^ Франкель, Тодд С. (3 марта 2017 г.) Яблоко раскалывается дальше на поставщика кобальта в Конго, поскольку детский труд сохраняется . The Washington Post . Получено на 2018-01-07.
- ^ Уэлмер, Фридрих-Уилгельм; Беккер-Платенс, Дженс Дитер. «Глобальные нефтяные минеральные ресурсы и устойчивость» . Получено 16 мая 2009 г.
- ^ Аудиторский отчет о Конго Донгфанг международной горнодобывающей промышленности Сарл . DNV-GL получил 18 апреля 2021 года.
- ^ «CAMEC - чемпион по кобальту» (PDF) . Международная добыча. Июль 2008 . Получено 18 ноября 2011 года .
- ^ Эми Уизерден (6 июля 2009 г.). «Ежедневный подкаст - 6 июля 2009 г.» . Добыча еженедельно . Получено 15 ноября 2011 года .
- ^ Гулли, Эндрю; МакКаллоу, Эрин; Шедд, Ким (август 2019). «Внутреннее и иностранное влияние Китая в глобальной цепочке поставок кобальта» . Политика ресурсов . 62 : 317–323. Bibcode : 2019Repol..62..317g . doi : 10.1016/j.resourpol.2019.03.015 .
- ^ «От кобальта до автомобилей: как Китай эксплуатирует ребенка и принудительный труд в Комиссии Конго Конгресса по Китаю» . www.cecc.gov . 14 ноября 2023 года.
- ^ Дом, Энди (19 февраля 2024 г.). «Запад бросает вызов критическим минералам Китая на Африке» . Рейтер .
- ^ Mining Journal «Инвесторы [Ivanhoe] ждали», Aspermont Ltd., Лондон, Великобритания, 22 февраля 2018 года. Получено 21 ноября 2018 года.
- ^ Шабалала, Занди «Кобальт будет объявлен стратегическим минералом в Конго», Reuters, 14 марта 2018 года. Получено 3 октября 2018 года.]
- ^ Reuters , « Конго Кабила, знакомство с новым кодексом горнодобывающей промышленности », 14 марта 2018 года. Получено 3 октября 2018 года.
- ^ «DRC объявляет кобальт« стратегический » » , Mining Journal , 4 декабря 2018 года. Получено 7 октября 2020 года.
- ^ «Американский иск о кобальте освещает« устойчивую »технологию» . Время устойчивости . 17 декабря 2019 года . Получено 16 сентября 2020 года .
- ^ «Apple, Google Fight Final за детские труды в кобальтовых шахтах - Law360» . www.law360.com . Получено 16 сентября 2020 года .
- ^ «Покупка кобальта не заставляет нас фирмы ответственными за злоупотребления в докторе Конго» . 6 марта 2024 года.
- ^ Канадский город -призрак, который Тесла возвращает к жизни . Bloomberg (2017-10-31). Получено на 2018-01-07.
- ^ «Производство никеля на Кубе превышает 50000 метрических тонн ». Куба бизнес -отчет. Получено 18 апреля 2021 года.
- ^ «Самым большим источником кобальта за пределами Африки теперь является Индонезия» . Bloomberg News . 8 февраля 2023 года . Получено 10 мая 2023 года .
- ^ Доначи, Мэтью Дж. (2002). Суперсплавы: техническое руководство . ASM International. ISBN 978-0-87170-749-9 .
- ^ Кэмпбелл, Флейк С (30 июня 2008 г.). «Кобальт и кобальтовые сплавы» . Элементы металлургии и инженерных сплавов . ASM International. С. 557–558. ISBN 978-0-87170-867-0 .
- ^ Мишель, Р.; Nolte, M.; Рейх М.; Löer, F. (1991). «Системные эффекты имплантированных протезов, изготовленных из сплавов кобальт-хромий». Архив ортопедической хирургии и травмы . 110 (2): 61–74. doi : 10.1007/bf00393876 . PMID 2015136 . S2CID 28903564 .
- ^ Disegi, John A. (1999). Кобальтовые алои для биомедицинских применений . ASTM International. п. 34. ISBN 0-8031-2608-5 .
- ^ Люборский, Fe; Мендельсон, Ли; Пейн, к (1957). «Воспроизведение свойств постоянных магнитных сплавов Alnico с удлиненными частицами кобальтового железа с одним доменом». Журнал прикладной физики . 28 (344): 344. Bibcode : 1957jap .... 28..344L . doi : 10.1063/1,1722744 .
- ^ Биггс, Т.; Тейлор, SS; Ван дер Линген, Э. (2005). «Утверждение платиновых сплавов для потенциального применения ювелирных изделий» . Платиновые металлы обзор . 49 : 2–15. doi : 10.1595/147106705x24409 .
- ^ Jump up to: а беременный в Хокинс М. (2001). «Зачем нам нужен кобальт». Прикладная наука о Земле . 110 (2): 66–71. Bibcode : 2001apeas.110 ... 66h . doi : 10.1179/aes.2001.110.2.66 . S2CID 137529349 .
- ^ Jump up to: а беременный Армстронг, Rd; Бриггс, GWD; Чарльз, EA (1988). «Некоторые эффекты добавления кобальта к гидроксидному электроду никеля». Журнал прикладной электрохимии . 18 (2): 215–219. doi : 10.1007/bf01009266 . S2CID 97073898 .
- ^ Чжан, П.; Йокояма, Тоширо; Итабаши, Осаму; Вакуи, Йошито; Suzuki, Toshishige M.; Иноуэ, Кацутоши (1999). «Восстановление значений металлов из отработанных никель -металла -гидридных аккумуляторов». Журнал источников питания . 77 (2): 116–122. Bibcode : 1999jps .... 77..116z . doi : 10.1016/s0378-7753 (98) 00182-7 .
- ^ Запад, Карл (29 июля 2017 г.). «Электрические мечты автопроизводителей зависят от поставки редких минералов» . Хранитель . EISSN 1756-3224 . ISSN 0261-3077 . OCLC 60623878 . Архивировано из оригинала 6 июня 2022 года . Получено 29 июня 2022 года .
- ^ Кастеллано, Роберт (13 октября 2017 г.). «Как минимизировать риск цепочки поставок кобальта Tesla» . Ищу альфа . Архивировано из оригинала 4 апреля 2022 года . Получено 29 июня 2022 года .
- ^ Jump up to: а беременный «По мере того, как подтягивается подача кобальта, Lico Energy Metals объявляет о двух новых кобальтовых шахтах» . cleantechnica.com . 28 ноября 2017 года . Получено 7 января 2018 года .
- ^ Шиллинг, Эрик (31 октября 2017 г.). «У нас может быть недостаточно минералов, чтобы даже удовлетворить спрос на электромобиль» . Ялопник . Архивировано из оригинала 1 апреля 2022 года . Получено 29 июня 2022 года .
- ^ «Состояние заряда: электромобили, батареи и батареи (бесплатный отчет @AdamasIntel)» . Адамас Интеллект . 20 сентября 2019 года. Архивировано с оригинала 20 октября 2019 года . Получено 20 октября 2019 года .
- ^ «Muskmobiles, бегущие соперники с дороги» . Mining.com . 26 сентября 2019 года. Архивировано с оригинала 30 сентября 2019 года.
- ^ Гермес, Дженнифер. (2017-05-31) Tesla & GE сталкиваются с серьезным нехваткой кобальта с этически источниками . Environmentaleader.com. Получено на 2018-01-07.
- ^ Электромобили еще не превращают рынок кобальта в золотой рудник - Nornickel . Mining.com (2017-10-30). Получено на 2018-01-07.
- ^ «Почему цены на кобальт разбились» . Международный банкир . 31 июля 2019 года. Архивировано с оригинала 30 ноября 2019 года.
- ^ «Цены на кобальт и графики цен на кобальт - инвестиционная мин» . www.infomine.com .
- ^ «Тесла присоединяется к« Fair Cobalt Alliance », чтобы улучшить горнодобывающую промышленность ДРК» . Mining-technology.com . 8 сентября 2020 года . Получено 26 сентября 2020 года .
- ^ Клендер, Джои (8 сентября 2020 года). «Тесла присоединяется к Fair Cobalt Alliance в поддержку моральных усилий по добыче полезных ископаемых» . teslarati.com . Получено 26 сентября 2020 года .
- ^ Без кобальта батареи для будущего веб-сайта автомобильных приложений
- ^ Проект COBRA в Европейском Союзе
- ^ Yoo-Chul, Kim (14 августа 2020 г.). «Стратегия батареи Теслы, последствия для LG и Samsung» . Корейские времена . Получено 26 сентября 2020 года .
- ^ Шахан, Захари (31 августа 2020 г.). "Литий и никель и Тесла, о боже!" Полем cleantechnica.com . Получено 26 сентября 2020 года .
- ^ Кальма, Джастин (22 сентября 2020 г.). «Тесла сделать катоды с батареей EV без кобальта» . Theverge.com . Получено 26 сентября 2020 года .
- ^ «Э.В. литий -литий -фосфатный аккумулятор борьбы» . EnergyTrend.com . 25 мая 2022 года.
- ^ "Кобальт сушилка для красок | Cobalt Cem-All®" . Борчерс . Архивировано из оригинала 9 июля 2023 года . Получено 15 мая 2021 года .
- ^ Холстед, Джошуа (апрель 2023 г.). «Расширенные применения и повышенная долговечность алкидных покрытий с использованием высокопроизводительных катализаторов» . Coatingstech . 20 (3): 45–55 - через Американскую ассоциацию покрытий.
- ^ Weatherhead, RG (1980), Weatherhead, Rg (ed.), «Катализаторы, ускорители и ингибиторы для ненасыщенных полиэфирных смол», Технология FRP: системы усиленных волокнами , Dordrecht: Springer Netherlands, стр. 204–239, DOI : 10.1007/ 978-94-009-8721-0_10 , ISBN 978-94-009-8721-0
- ^ «Селектор продукта | AOC» . Aocresins.com . Получено 15 мая 2021 года .
- ^ «Comar Chemicals - полиэфирное ускорение» . www.comarchemicals.com . Архивировано из оригинала 15 мая 2021 года . Получено 15 мая 2021 года .
- ^ Ходаков, Андрей Й. Ходаков; Chu, Wei & Fongarland, Pascal (2007). «Достижения в разработке новых катализаторов Fischer-Tropsch для синтеза длинноцепочечных углеводородов и чистого топлива». Химические обзоры . 107 (5): 1692–1744. doi : 10.1021/cr050972v . PMID 17488058 .
- ^ Hebrard, Frédéric & Kalck, Philippe (2009). «Катализируемое кобальтом гидроформилирование алкенов: генерация и утилизация карбонильных видов и каталитический цикл». Химические обзоры . 109 (9): 4272–4282. doi : 10.1021/cr8002533 . PMID 19572688 .
- ^ Оверман, Фредерик (1852). Трактат по металлургии . D. Appleton & Company. С. 631 –637.
- ^ Muhlethaler, Bruno; Thissen, Джин (1969). "Smalt". Исследования по сохранению . 14 (2): 47–61. doi : 10.2307/1505347 . JSTOR 1505347 .
- ^ Гелен, AF (1803). «О приготовлении синего цвета, сделанного из кобальта, который так же красив, как ультрамарин. От гражданина тогда» . Новый общий журнал химии, том 2 . Х. Фрёлих. (Немецкий перевод из LJ Thénard ; Journal des Mines; Brumaire 12 1802; P 128–136)
- ^ Witteveen, HJ; Фарнау, EF (1921). «Цвета, разработанные оксидами кобальта» . Промышленная и инженерная химия . 13 (11): 1061–1066. doi : 10.1021/IE50143A048 .
- ^ Венецкий, С. (1970). «Обвинение оружия мира». Металлург . 14 (5): 334–336. doi : 10.1007/bf00739447 . S2CID 137225608 .
- ^ Мандевилл, C.; Фулбрайт, Х. (1943). "Энергии γ-лучей из SB 122 , CD 115 , И 192 , Мн 54 , Zn 65 и co 60 ". Физический обзор . 64 (9–10): 265–267. Bibcode : 1943phrv ... 64..265m . Doi : 10.1103/physrev.64.265 .
- ^ Уилкинсон, виртуальная машина; Гулд Г. (1998). Пищевое облучение: справочное руководство . Вудхед. п. 53. ISBN 978-1-85573-359-6 .
- ^ Блейксли, Сандра (1 мая 1984 г.). «Авария Хуареса» . New York Times . Получено 6 июня 2009 г.
- ^ «Распространение источника сирота Сьюдада Хуареса, 1983» . Wm. Роберт Джонстон. 23 ноября 2005 г. Получено 24 октября 2009 года .
- ^ Национальный исследовательский совет (США). Комитет по использованию и замене источника радиации; Национальный исследовательский совет (США). Совет по ядерным и радиационным исследованиям (январь 2008 г.). Использование источника радиации: сокращенная версия . Национальная академическая пресса. С. 35–. ISBN 978-0-309-11014-3 Полем Получено 29 апреля 2011 года .
- ^ Мейер, Тереза (30 ноября 2001 г.). Исследование физиотерапевта . Slack Incorporated. п. 368. ISBN 978-1-55642-588-2 .
- ^ Калникки, Д.; Сингхви Р. (2001). «Полевой портативный XRF -анализ образцов окружающей среды» . Журнал опасных материалов . 83 (1–2): 93–122. Bibcode : 2001jhzm ... 83 ... 93K . doi : 10.1016/s0304-3894 (00) 00330-7 . PMID 11267748 .
- ^ Пейн, Л.Р. (1977). «Опасности кобальта». Профессиональная медицина . 27 (1): 20–25. doi : 10.1093/occmed/27.1.20 . PMID 834025 .
- ^ Puri-Mirza, Amna (2020). «Марокко производство кобальта» . Статистика .
- ^ Тренто, Чин (14 апреля 2024 г.). «Что такое кобальт в повседневной жизни» . Стэнфордские передовые материалы . Получено 24 июня 2024 года .
- ^ Хорват, Джон; Ормерод, Джон, ред. (2022). «Глава 11: Постоянные магнитные покрытия и процедуры тестирования» . Современные постоянные магниты . Woodhead Publishing Series в электронных и оптических материалах. Woodhead Publishing. С. 371–402. doi : 10.1016/b978-0-323-88658-1.00011-x . ISBN 9780323886581 Полем Получено 24 июня 2024 года .
- ^ «Альнико магниты: более внимательный взгляд на их историю, свойства и приложения» . Радиальный магнит . 15 февраля 2024 года . Получено 24 июня 2024 года .
- ^ Мохапатра, Jeotikanta; Син, Мейинг (2020). «Твердые и полу-хрустящие магнитные материалы на основе кобальта и кобальтовых сплавов». Журнал сплавов и соединений . 824 . doi : 10.1016/j.jallcom.2020.153874 .
- ^ Yousuf, реабилитация; Махмуд, Наглаа (2021). «Электрические и магнитные свойства кобальтовых, медных и никелевых органометаллических комплексов для молекулярных проводов» . Ain Shams Engineering Journal . 12 (2): 2135–2144. doi : 10.1016/j.asej.2020.12.002 .
- ^ «Самарий кобальт против неодимских магнитов» . Идеальные магнитные решения . 15 мая 2019 года . Получено 24 июня 2024 года .
- ^ Дэвис, Джозеф Р; Комитет по справочнику, ASM International (1 мая 2000 г.). "Кобальт" . Никель, кобальт и их сплавы . ASM International. п. 354. ISBN 978-0-87170-685-0 .
- ^ Комитет по технологическим альтернативам сохранения кобальта, Национальный исследовательский совет (США); Национальный консультативный совет по материалам, Национальный исследовательский совет (США) (1983). «Земля -коат фритт» . Сохранение кобальта через технологические альтернативы . п. 129
- ^ Ямада, Казухиро (2013). «Глава 9. Кобальт: его роль в здоровье и болезнях». В Сигеле, Астрид; Сигел, Гельмут; Сигел, Роланд Ко (ред.). Взаимосвязи между важными ионами металлов и заболеваниями человека . Металлические ионы в науках о жизни. Тол. 13. Springer. С. 295–320. doi : 10.1007/978-94-007-7500-8_9 . ISBN 978-94-007-7499-5 Полем PMID 24470095 .
- ^ Кракан, Валентин; Banerjee, Ruma (2013). «Глава 10 КОБАЛТ И КРИНОИД ТРАНСПОРТ И БИОХИМИЯ». В Банси, Люсия (ред.). Металломика и клетка . Металлические ионы в науках о жизни. Тол. 12. Springer. С. 333–374. doi : 10.1007/978-94-007-5561-1_10 . ISBN 978-94-007-5560-4 Полем PMID 23595677 . электронная книга ISBN 978-94-007-5561-1 ISSN 1559-0836 Электронный ISSN 1868-0402 .
- ^ Шварц, FJ; Kirchgessner, M.; Stangl, GI (2000). «Потребность в кобальте для мясного скота - потребление корма и рост на разных уровнях снабжения кобальта». Журнал физиологии животных и питания животных . 83 (3): 121–131. doi : 10.1046/j.1439-0396.2000.00258.x .
- ^ Голос, Джудит Г.; Voet, Donald (1995). Биохимия Нью -Йорк: J. Wiley & Sounds. п. 675 . ISBN 0-471-58651-X Полем OCLC 31819701 .
- ^ Смит, Дэвид М.; Голдинг, Бернард Т.; Радом, Лео (1999). «Понимание механизма B12-зависимой метилмалонил-коа-мутазы: частичный перенос протона в действии». Журнал Американского химического общества . 121 (40): 9388–9399. doi : 10.1021/ja991649a .
- ^ Кобаяши, Мичихико; Shimizu, Sakayu (1999). «Кобальтовые белки». Европейский журнал биохимии . 261 (1): 1–9. doi : 10.1046/j.1432-1327.1999.00186.x . PMID 10103026 .
- ^ «Почвы» . Университет Вайкато. Архивировано с оригинала 25 января 2012 года . Получено 16 января 2012 года .
- ^ Jump up to: а беременный McDowell, Lee Russell (2008). Витамины в питании животных и человека (2 -е изд.). Хобокен: Джон Уайли и сыновья. п. 525. ISBN 978-0-470-37668-3 .
- ^ Австралийская академия науки> Покойные стипендиаты> Хедли Ральф Марстон 1900–1965 гг. По состоянию на 12 мая 2013 года.
- ^ Снук, Лоуренс С. (1962). «Кобальт: его использование для борьбы с потерей болезни» . Журнал Министерства сельского хозяйства, Западная Австралия . 4. 3 (11): 844–852.
- ^ "Кобальт 356891" . Сигма-Альдрич . 14 октября 2021 года . Получено 22 декабря 2021 года .
- ^ Дональдсон, Джон Д. и Бейерсманн, Детмар (2005) «Кобальтовые и кобальтские соединения» в энциклопедии промышленной химии Уллмана , Wiley-VCH, Вайнхайм. Два : 10.1002/14356007.a07_281.pub2
- ^ Niosh Pocket Guide к химическим опасностям. "#0146" . Национальный институт безопасности и гигиены труда (NIOSH).
- ^ Морин Y; Tětu a; Mercier G (1969). «Квебекская кардиомиопатия: клинические и гемодинамические аспекты». Анналы нью -йоркской академии наук . 156 (1): 566–576. Bibcode : 1969nyasa.156..566m . doi : 10.1111/j.1749-6632.1969.tb16751.x . PMID 5291148 . S2CID 7422045 .
- ^ Барсело, Дональд Г. и Барсело, Дональд (1999). "Кобальт". Клиническая токсикология . 37 (2): 201–216. doi : 10.1081/clt-100102420 . PMID 10382556 .
- ^ [PDF]
- ^ Эльбагар, Нима; Ван Херден, Доминик; Макинтош, Элиза (май 2018 г.). "Грязная энергия" . CNN . Получено 30 мая 2018 года .
- ^ BACTERTER, David A.; Анджелини, Джанни; Ингбер, Ари; Керн, Петра С.; Menné, Torkil (2003). «Никель, хром и кобальт в потребительских продуктах: пересмотр безопасных уровней в новом тысячелетии» . Контактный дерматит . 49 (1): 1–7. doi : 10.1111/j.0105-1873.2003.00149.x . PMID 14641113 . S2CID 24562378 .
Дальнейшее чтение
[ редактировать ]
- Харпер, Эм; Кавлак, Г.; Graedel, TE (2012). «Отслеживание металла гоблинов: цикл использования кобальта». Экологическая наука и технология . 46 (2): 1079–86. Bibcode : 2012enst ... 46.1079h . doi : 10.1021/es201874e . PMID 22142288 . S2CID 206948482 .
- Narendrula, R.; Нконголо, KK; Беккет, П. (2012). «Сравнительный анализ почвенных металлов в Садбери (Онтарио, Канада) и Лубумбаши (Катанга, доктор-Конго)». Бюллетень загрязнения окружающей среды и токсикологии . 88 (2): 187–92. Bibcode : 2012buect..88..187n . doi : 10.1007/s00128-011-0485-7 . PMID 22139330 . S2CID 34070357 .
- Pauwels, H.; Pettenati, M.; Greffié, C. (2010). «Совокупное влияние заброшенных шахт и сельского хозяйства на химию подземных вод». Журнал гидрологии загрязняющих веществ . 115 (1–4): 64–78. BIBCODE : 2010JCHYD.115 ... 64P . doi : 10.1016/j.jconhyd.2010.04.003 . PMID 20466452 .
- Булут, Г. (2006). «Восстановление меди и кобальта из древнего шлака». Управление отходами и исследования . 24 (2): 118–24. Bibcode : 2006wmr .... 24..118b . doi : 10.1177/0734242x06063350 . PMID 16634226 . S2CID 24931095 .
- Джефферсон, JA; Escudero, E.; Уртадо, я; Пандо, Дж.; Tapia, R.; Свенсон, эр; Prchal, J.; Schreiner, GF; Schoene, RB; Hurtado, A.; Джонсон, RJ (2002). «Чрезмерный эритроцитоз, хроническая горная болезнь и уровень кобальта в сыворотке». Лансет . 359 (9304): 407–8. doi : 10.1016/s0140-6736 (02) 07594-3 . PMID 11844517 . S2CID 12319751 .
- Løvold, телевизор; Haugsbø, L. (1999). «Кобальтовая фабрика-диагностики 1822-32». Журнал Ассоциации Норвежской лиги . 119 (30): 4544–6. PMID 10827501 .
- Птица, GA; Hesslein, RH; Mills, KH; Шварц, WJ; Тернер, Массачусетс (1998). «Биоаккумуляция радионуклидов в оплодотворенных канадских бассейнах озера». Наука общей среды . 218 (1): 67–83. Bibcode : 1998 Scen.218 ... 67b . doi : 10.1016/s0048-9697 (98) 00179-x . PMID 9718743 .
- Nemery, B. (1990). «Токсичность металла и дыхательные пути» . Европейский респираторный журнал . 3 (2): 202–19. doi : 10.1183/09031936.93.03020202 . PMID 2178966 .
- Казанцис, Г. (1981). «Роль кобальта, железа, свинца, марганца, ртути, платины, селена и титана в канцерогенезе» . Перспективы здоровья окружающей среды . 40 : 143–61. doi : 10.1289/ehp.8140143 . PMC 1568837 . PMID 7023929 .
- Kerfoot, EJ; Фредрик, WG; Domeier, E. (1975). «Исследования ингаляции кобальтовых металлов на миниатюрном свинье». Американская промышленная гигиеновая ассоциация журнала . 36 (1): 17–25. doi : 10.1080/00028889758507202 . PMID 1111264 .
Внешние ссылки
[ редактировать ]- " Британская Тол. VI (9 -е изд.). 1878. стр. 81–83.
- Кобальт за периодической таблицей видео (Университет Ноттингема)
- Центры по заболеваниям и профилактике - кобальт
- Кобальт
- Химические элементы
- Переходные металлы
- Диетические минералы
- Ферромагнитные материалы
- Канцерогены IARC группы 2B
- Детский труд
- Добыча кобальта
- Неформальная экономика в Африке
- Ресурсная экономика
- Горнодобывающие сообщества в Африке
- Инициатива прозрачности добычи отраслей
- Химические элементы с шестиугольной конструкцией с закрытыми
- Нативные элементы минералы